Содержание
Вода в жизни организмов
Содержание
Из всех известных нам веществ только вода может находиться в жидком состоянии при относительно низкой температуре, преобладающей на поверхности Земли. По этой и другим причинам вода в жизни организмов всегда играла важнейшую роль . Когда жизнь только зарождалась, вода обеспечила ей среду, в которой молекулы могли двигаться и взаимодействовать.
Организмы эволюционировали в воде за 2 млрд. лет до распространения на суше. И сегодня по-прежнему жизнь полностью зависит от воды. Около 2/3 тела любого живого организма составляет это неорганическое вещество, его содержимое колеблется от 10 до 98%, в зависимости от типа клетки. Чем выше интенсивность обмена веществ в клетке, тем выше содержание в ней воды:
- в молодом организме человека или животного 80% воды (у медузы 98%) от массы тела;
- в клетках старого организма – 60%;
- в головном мозге – 85%;
- в клетках эмали зубов – 10-15%.
Сцифомедуза базинга рики (Bazinga rieki)
Автор: Dr Lisa-Ann Gershwin, CC0
Вода в жизни организмов обеспечивает:
- доставку питательных веществ и кислорода ко всем клеткам тела,
- буферизацию (поддержание кислотности) внутренней среды,
- регуляцию температуры тела,
- преобразование пищи в энергию,
- усвоение питательных веществ клетками,
- вывод шлаков и отходов, появившиеся в процессе жизнедеятельности и целый ряд других функций.

Не случайно тропические леса, где дожди идут регулярно, изобилуют жизнью, тогда как пустыни кажутся совсем безжизненными.
Тропические жители
В организмах вода находится в свободном и связанном состояниях.
- Свободная вода присутствует в межклеточном пространстве, в сосудах, вакуолях, в полостях органов и организма. Она служит для переноса веществ в клетку и обратно.
- Связанная вода входит в состав некоторых клеточных структур.
Большую часть плазмы крови составляет вода
Вода в жизни организмов: водородная связь – результат особой структуры атома водорода
Вода в жизни организмов играет роль растворителя. Она имеет простую молекулярную структуру, состоящую из атома кислорода, связанного с двумя атомами водорода. В результате этого молекула является стабильной, она удовлетворяет правилу октета – не имеет непарных электронов и не несёт чистой энергии. Электроотрицательность кислорода намного больше, чем водорода, поэтому связи между этими атомами сильно полярны. Полярность молекулы воды лежит в основе её химических свойств, важных для всего живого.
Полярность молекулы воды лежит в основе её химических свойств, важных для всего живого.
Самым выдающимся свойством воды является её способность образовывать слабые химические связи, называемые водородными. Они формируются между частично отрицательным атомом кислорода и двумя частично положительными атомами водорода. Эти связи обладают всего 5-10% силы ковалентных скреплений. Но в большом количестве они играют важную роль в построении структур белков, а значит, несут ответственность за химическую организацию живых систем.
Строение молекулы воды
Если рассмотреть молекулу воды, то можно увидеть, что её две ковалентных связи несут частичный заряд на каждом полюсе. Полюс кислорода частично отрицателен (δ –), полюсы водорода частично положительны (δ +). В общей сложности молекула воды несёт 2 отрицательных и 2 положительных заряда. Атом кислорода лежит в центре «пирамиды», атомы водорода занимают две вершины, а частично отрицательные заряды занимают две другие вершины.
Благодаря особому строению молекулы воды, снежинки бывают только шестилучевыми, а не такими как на этом рисунке
Между атомом кислорода одной молекулы воды и атомом водорода другой молекулы возникает электростатическое притяжение. Каждая молекула воды, подобно маленькому магниту, притягивает к себе еще четыре молекулы и соединяется с ними водородными связями.
Из-за большого количества водородных соединений вода, несмотря на её малую молекулярную массу, при температурах от 0°С до 100°С может сохранять жидкое агрегатное состояние, тогда как подобные ей водородные соединения (например, H2S, NH3 ,HF) являются газами.
Строение молекулы воды
Автор: Booyabazooka, CC BY-SA 3.0
Сцепление жидкой воды отвечает и за её поверхностное натяжение. Поэтому мелкие насекомые могут ходить по воде, а вода поднимается по капиллярам почвы и по сосудам растений.
Примеры поверхностного натяжения воды
Подобные комплексы молекул существенно повышают температуры кипения и таяния воды (по сравнению с похожими молекулами) и увеличивают ее теплоемкость. Они же делают воду очень хорошим растворителем и благоприятной средой для протекания целого ряда реакций.
Они же делают воду очень хорошим растворителем и благоприятной средой для протекания целого ряда реакций.
Взаимодействие молекулы воды с полярными молекулами и ионными соединениями
Полярность воды заставляет её притягиваться к другим полярным молекулам или ионным решёткам. Притяжение других полярных веществ называется адгезией. Вода соединяется с любым веществом, с которым она может образовать водородные связи. Полярные молекулы и ионные соединения растворяются в воде, неполярные (например, масла) нет.
Притяжение воды к веществам, имеющим электрические заряды на поверхности, отвечает за капиллярное действие. Если стеклянную трубку с узким диаметром опустить в стакан с водой, уровень жидкости в трубке поднимется выше, чем в стакане, из-за адгезии воды со стеклянной поверхностью. Чем уже будет трубка, тем сильнее электрические силы между водой и стаканом и тем выше она поднимется. Так капиллярная сила воды помогает ей преодолевать силу притяжения Земли.
Капиллярность воды и ртути
Автор: MesserWoland, CC BY-SA 3.0
Таблица 1. Некоторые свойства воды
| Свойство | Объяснение | Примеры пользы для жизни |
| Сцепление | Водородные связи удерживают молекулы воды вместе | Листья притягивают воду вверх от корней; семена набухают и прорастают. |
| Высокая удельная теплоёмкость и теплопроводность | Когда водородные связи разрываются, они поглощают тепло, а когда образуются – выделяют. Так они минимизируют температуру изменения. | Вода поддерживает постоянство температуры организмов относительно окружающей среды. Благодаря высокой теплопроводности температура равномерно распределяется в теле организма. |
| Высокая удельная температура парообразования и конденсации | Чтобы вода испарилась, должно быть разорвано много водородных связей, поэтому этот процесс происходит с затратой большого количества энергии. | Испарение воды с кожи, за счёт траты энергии, охлаждает поверхность тела. |
| Более низкая плотность льда | Благодаря водородным связям в кристалле льда молекулы воды расположены относительно далеко друг от друга. Плотность жидкой воды – 0,9982 г/см2. Плотность льда – 0,917 г/см2. | Зимой лёд закрывает водоёмы, поэтому основная их часть не замерзает и обитатели озёр, рек и т. д. не погибают. |
| Растворимость | Молекула воды притягивается к полярным соединениям, разрушая их решётки и молекулы, и превращая атомы в ионы. | Многие растворённые молекулы могут свободно перемещаться внутрь клетки, что способствует химическим реакциям. |
Высокая удельная теплоёмкость воды помогает ей поддерживать температуру
Температура каждого вещества является показателем того, насколько быстро движутся его отдельные молекулы. В случае с водой для разрыва большого количества её водородных связей требуется много внешней энергии, это удерживает её молекулы от движения. Следовательно, вода имеет высокую теплоёмкость, определяющуюся как количество теплоты, нужное для изменения температуры 1г вещества на 1°С.
Следовательно, вода имеет высокую теплоёмкость, определяющуюся как количество теплоты, нужное для изменения температуры 1г вещества на 1°С.
Удельная теплоёмкость измеряет степень, в которой вещество сопротивляется изменению своей температуры. Чем полярнее молекулы вещества, тем выше их удельная теплоёмкость. Теплоёмкость воды равна 4,1806 кДж, она в два раза выше, чем у большинства углеродных соединений и в 9 раз выше железа. Только аммиак, обладающий большей полярностью, чем вода и формирующий сильные водородные связи, имеет более высокую удельную теплоёмкость. Тем не менее, только 20% водородных связей разрушается при нагревании воды от 0° до 100°С.
Из-за высокой теплоёмкости вода нагревается медленнее, чем любая другая смесь и сохраняет тепло дольше. Из-за высокого содержания воды в организмах они могут длительное время поддерживать постоянство своей внутренней температуры. Этому способствует не только высокая теплоёмкость воды, но и её высокая теплопроводность, равномерно распределяющая тепло по телу. Тепло, выделяющееся при химических реакциях внутри клетки, разрушает её, если в ней нет воды, поглощающей это тепло. Вода в жизни организма — играет ведущую роль.
Тепло, выделяющееся при химических реакциях внутри клетки, разрушает её, если в ней нет воды, поглощающей это тепло. Вода в жизни организма — играет ведущую роль.
Вода в жизни организмов: высокая температура испарения способствует охлаждению
Удельная температура испарения определяется как количество энергии, требуемое для превращения 1г жидкости в газ. Чтобы произвести такие изменения с водой, нужно 586 Ккал энергии. Испарение воды с какой-либо поверхности охлаждает эту поверхность.
Способ терморегуляции животных
Многие организмы используют это свойство воды для предупреждения перегрева, например, у животных и человека лишнее тепло уходит через потоотделение, многие животные в жару высовывают влажный язык, чтобы с него испарялась вода, облизывают кожу для охлаждения.
Вода в жизни организмов: меньшая плотность твёрдой воды, чем жидкой
При охлаждении вода сначала сжимается. Но происходит это только до температуры 4°С, достигнув самой большой своей возможной плотности, с дальнейшим понижением температуры, вода начинает расширяться. При низких температурах молекулы воды запираются в кристаллическую форму, образуя решётки водородных связей. Так получается лёд.
При низких температурах молекулы воды запираются в кристаллическую форму, образуя решётки водородных связей. Так получается лёд.
Кристаллическая решётка льда
Автор: NIMSoffice
Лёд менее плотный, чем жидкость, благодаря тому, что водородные связи в кристаллах располагают атомы относительно далеко друг от друга. Такая необычная особенность позволяет айсбергам плавать. Если бы у воды не было такой способности, почти все водоёмы замерзали бы до дна и их обитатели в них не смогли бы выживать. В этом случае вода в жизни организмов выполняет защитную роль.
Раз при замерзании вода расширяется, то при этом она может разорвать ткани и клетки организмов. Это причина того, почему деревья на зиму прекращают сокодвижение и сбрасывают листья.
Айсберг
Полярные молекулы и ионы растворимы в воде
Молекулы воды собираются вокруг любого вещества, несущего электрический заряд, это могут быть как ионы, так и полярные молекулы. Например, сахароза (столовый сахар) состоит из молекул, содержащих гидроксильные (OH) полярные группы.
Кристаллы сахара легко растворяются, потому что молекулы воды могут образовывать водородные связи с гидроксильными группами молекул сахарозы. Поэтому сахароза считается растворимой в воде. При этом воду называют растворителем, а сахар растворённым веществом.
Растворение
Когда молекула сахарозы отламывается от кристалла, молекулы воды окружают её облаком, образующим гидратационную оболочку, которая препятствует её связыванию с другими молекулами сахарозы. Гидратные оболочки образуют ионы, такие как Na + и Cl –.
Насыщение воды ионами неорганических веществ и их коллоидами называется минерализацией.
К числу выдающихся в физиологическом отношении свойств воды относится её способность растворять газы (O2, CO2 и др.). Это очень важно для тех организмов, которые живут в воде, а также для процессов всех живых клеток.
Вода в жизни организмов является также источником кислорода и водорода, выделяемых при фотолизе в световую фазу фотосинтеза.
Так как вода в жидком состоянии не имеет жесткой внутренней структуры, тепловое движение молекул приводит к постоянному перемешиванию молекул водного раствора. Это явление называют диффузией. Вследствие диффузии концентрации растворенных веществ в разных частях раствора выравниваются.
Диффузия воды — осмос
Автор: Квазар Ярош
Наличие в живых организмах биологических мембран и растворённых в воде ионов приводит к появлению явления осмоса. Вследствие того что биологические мембраны является полупроницаемыми, через них не могут проходить крупные органические молекулы, но могут проходить молекулы воды. В случае, когда концентрация крупных молекул по разные стороны мембраны различна, молекулы воды начинают интенсивно перемещаться на ту сторону, где концентрация растворенных веществ выше. Вследствие этого и возникает избыток веществ по одну сторону мембраны, что можно наблюдать в виде осмотического давления.
Осмотическое давление и несжимаемость воды – важные свойства для живых организмов.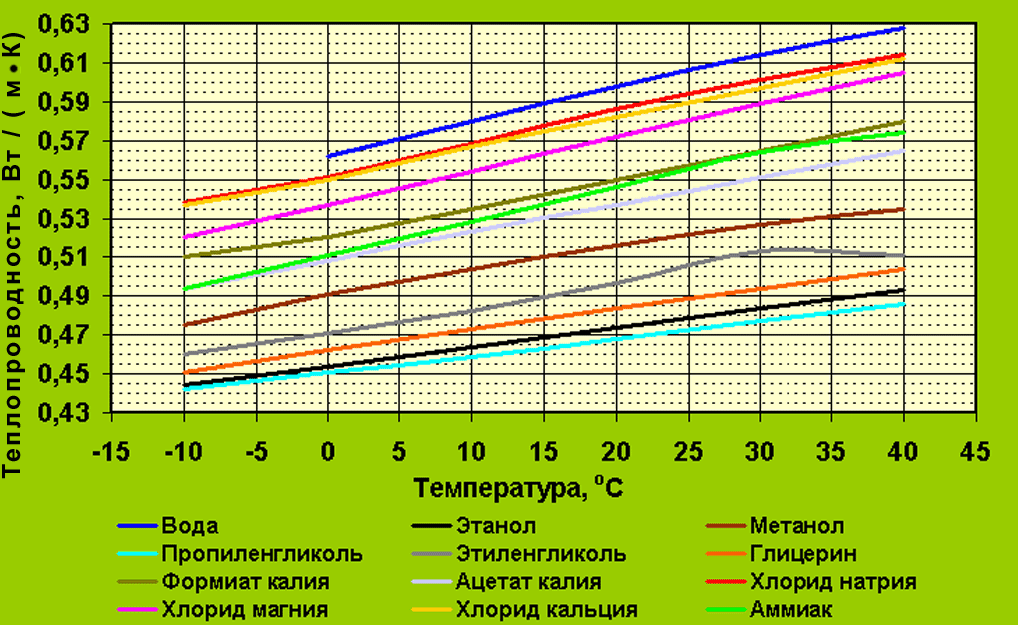 Благодаря им сохраняется объём клеток, напряжённое состояние плазматической мембраны (тургор) и происходит перемещение веществ внутри цитоплазмы. Тургорное давление воды поддерживает листья и стебли растений в упругом состоянии, определяет форму тела медуз, круглых червей. Плазмолиз – выход воды из клеток, что обусловливается содержанием ионов вне и внутри клетки. Если солей больше снаружи, тогда вода покидает клетку.
Благодаря им сохраняется объём клеток, напряжённое состояние плазматической мембраны (тургор) и происходит перемещение веществ внутри цитоплазмы. Тургорное давление воды поддерживает листья и стебли растений в упругом состоянии, определяет форму тела медуз, круглых червей. Плазмолиз – выход воды из клеток, что обусловливается содержанием ионов вне и внутри клетки. Если солей больше снаружи, тогда вода покидает клетку.
Плазмолиз — изотония — тургор
Автор: LadyofHats
Вода организует неполярные молекулы
Молекулы воды всегда стремятся сформировать максимальное число возможных водородных связей. Когда неполярные молекулы, такие как масла, не формирующие водородных связей, попадают в воду, молекулы воды стараются их удалить.
При этом неполярные молекулы агрегируются (слипаются вместе), чтобы свести к минимуму их разрушение водой. Они сжимаются от контакта с водой, по этой причине их называют гидрофобными (греч. гидрос, «вода» и фобос, «страх»). Гидрофобны высшие карбоновые кислоты, жиры и некоторые другие вещества.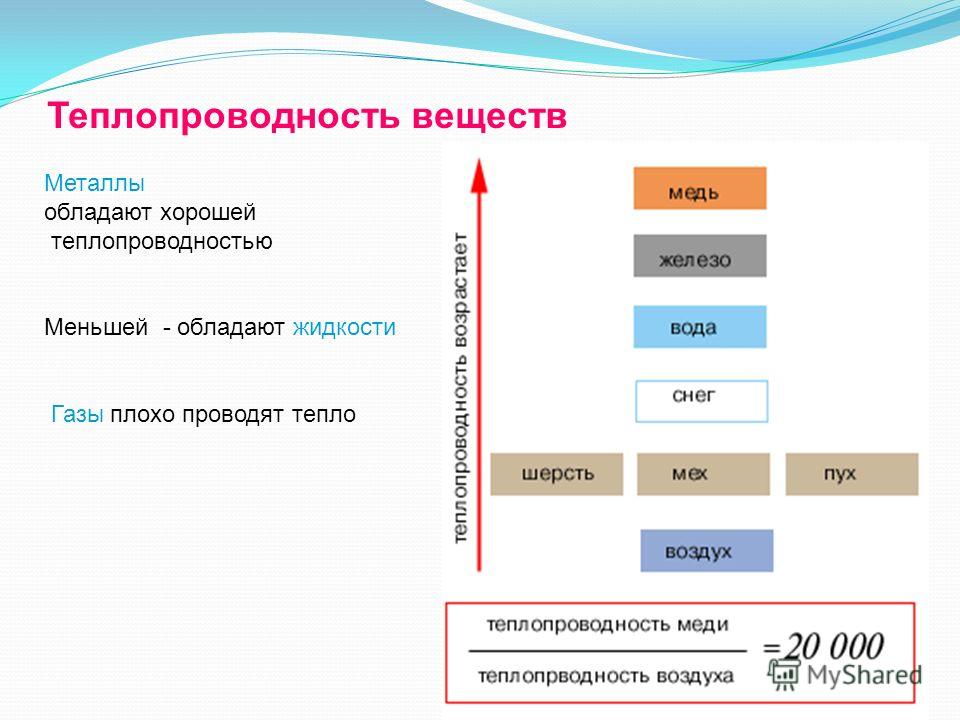
Капли масла в воде
Напротив, полярные молекулы, легко образующие связи с водой, называют гидрофильными («водолюбивыми»). Гидрофильными веществами являются моно- и дисахариды, многие минеральные соли и кислоты, низшие спирты, низшие карбоновые кислоты и др.
Тенденция неполярных молекул к агрегации в воде называется гидрофобным исключением. Путём принуждения гидрофобных молекул к агрегации, вода заставляет их принять определённую форму. Это свойство влияет на структуру белков, ДНК и биологических мембран, оно не позволяет им слипаться. По этой причине взаимодействие неполярных молекул и воды имеет решающее значение для живых систем.
Вода способна распадаться на ионы
Вода сама может участвовать в химических реакциях – фотосинтез, гидролиз и др. Ковалентные связи молекулы воды иногда разрываются спонтанно. В чистой воде при 25°C только в одной из 550 миллионов молекул происходит подобный процесс. При этом ядро атома водорода диссоциирует от молекулы. Его положительный заряд больше не нарушается и он становится ионом водорода H +.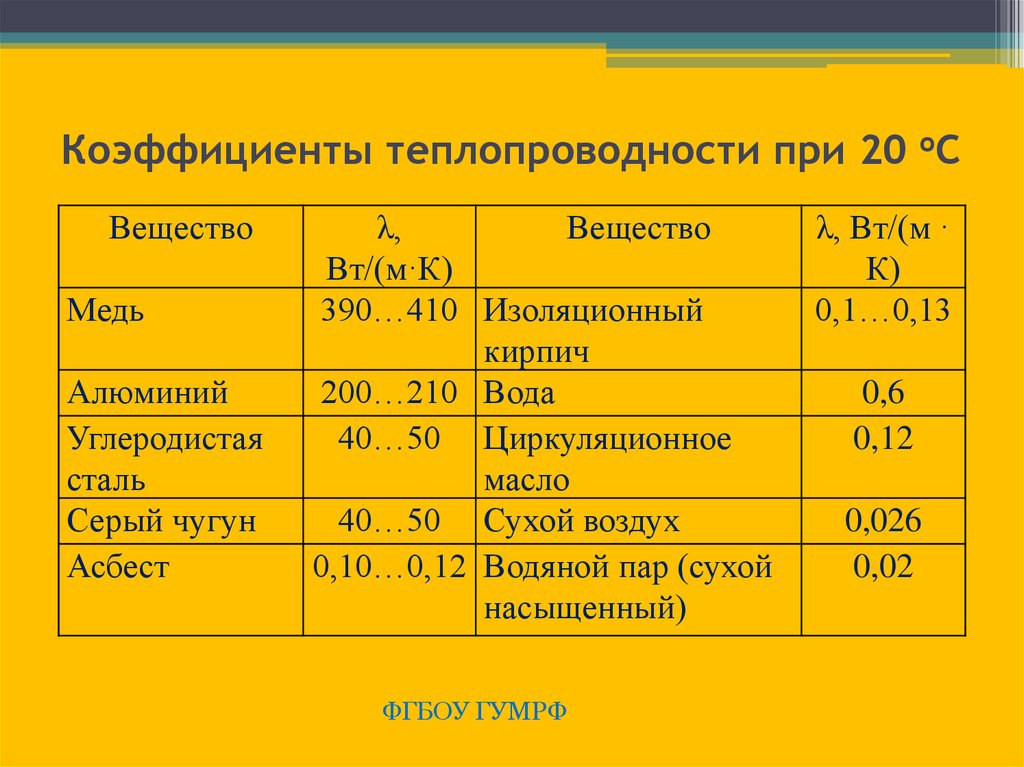 Остальная часть диссоциированной молекулы воды, сохранившая общий электрон и ковалентную связь становится отрицательно заряженной и образует гидроксид-ион ОH-. Этот процесс спонтанного образования ионов называется ионизацией:
Остальная часть диссоциированной молекулы воды, сохранившая общий электрон и ковалентную связь становится отрицательно заряженной и образует гидроксид-ион ОH-. Этот процесс спонтанного образования ионов называется ионизацией:
H2O → OH – + H +
При 25°C 1 литр воды содержит одну десятимиллионную (или 10 -7) моль ионов Н +. Моль – это вес вещества в граммах, он соответствует атомной массе всех атомов в молекуле этого вещества. В случае с H +, атомная масса иона равна 1, а моль ионов весит 1 г.
Ион водорода участвуют в определении кислотности среды (внутренней среды организма, почвы и др.), он же нужен в качестве переносчика энергии в процессе фотосинтеза.
Один моль любого вещества всегда содержит 6.02 × 10 23 молекул вещества. Поэтому молярная концентрация ионов водорода в чистой воде, представляется как [H +], 10 -7 моль /л. В действительности, H + обычно связывается с другой молекулой воды, чтобы сформировать ион гидроксония (H3O +).
Строение воды, ее аномалии и важнейшие физические свойства
Химически чистая вода состоит по весу из 11,19% водорода и 88,81% кислорода. Изучение структуры воды тесно связано с изучением трех агрегатных состояний, в которых она встречается на Земле. Строение воды определяется расположением ядер водорода относительно ядра кислорода. Исследования молекулы воды показали, что атомы кислорода и водорода располагаются по углам равнобедренного треугольника, на вершине которого находится атом кислорода (рис. 1 а). Угол при вершине равен примерно 106°, а стороны треугольника имеют длину 0,96 А (ангстрема), т. е. 10-10 м; расстояние между ядрами водорода НН==1,50 А. Треугольник НОН находится внутри сферы, по которой движутся электроны. Центр инерции сферы С не совпадает с центром атома кислорода О и находится от него на расстоянии 0,13 А.[ …]
Изучение структуры воды тесно связано с изучением трех агрегатных состояний, в которых она встречается на Земле. Строение воды определяется расположением ядер водорода относительно ядра кислорода. Исследования молекулы воды показали, что атомы кислорода и водорода располагаются по углам равнобедренного треугольника, на вершине которого находится атом кислорода (рис. 1 а). Угол при вершине равен примерно 106°, а стороны треугольника имеют длину 0,96 А (ангстрема), т. е. 10-10 м; расстояние между ядрами водорода НН==1,50 А. Треугольник НОН находится внутри сферы, по которой движутся электроны. Центр инерции сферы С не совпадает с центром атома кислорода О и находится от него на расстоянии 0,13 А.[ …]
При охлаждении воды количество ассоциированных молекул возрастает, но так как при понижении температуры решетка воды непрерывно деформируется, приближаясь к решетке льда, то к моменту замерзания полная перестройка молекул завершается увеличением объема. Для большинства тел при переходе из жидкой фазы в твердую характерно уменьшение удельного объема и увеличение плотности.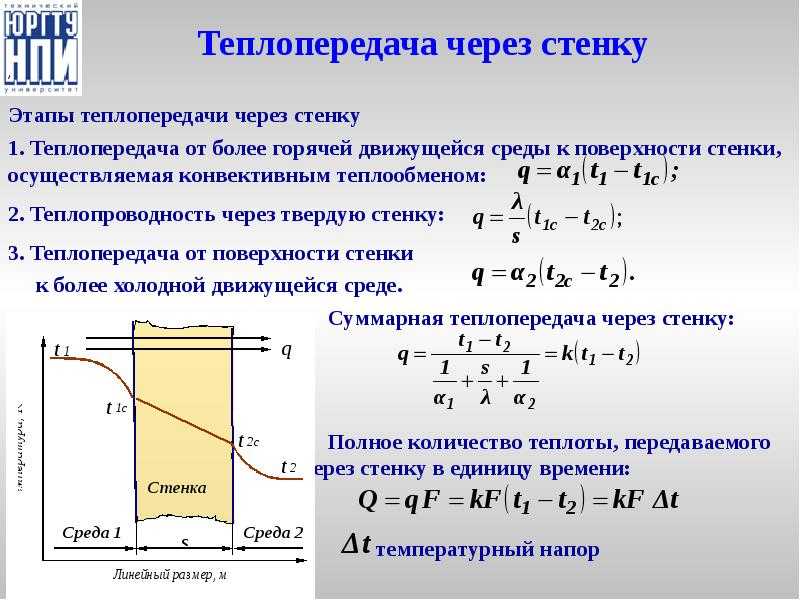 При замерзании воды удельный объем увеличивается примерно на 10%. Плотность чистого льда при температуре 0° С равна 0,9167 • 103 кг/м3, т. е. меньше, чем воды. Поэтому лед держится на поверхности, предохраняя водоемы от промерзания до дна. Образующийся внутриводный и донный лед (стр. 84, 301) всплывает к поверхности. Сложной структурой молекул воды и перестройкой их решеток можно объяснить увеличение плотности воды с повышением температуры от 0 до 4° С, аномальное изменение ее удельной теплоемкости с изменением температуры, высокую теплоту плавления, парообразования, диэлектрическую постоянную и некоторые другие особенности.[ …]
При замерзании воды удельный объем увеличивается примерно на 10%. Плотность чистого льда при температуре 0° С равна 0,9167 • 103 кг/м3, т. е. меньше, чем воды. Поэтому лед держится на поверхности, предохраняя водоемы от промерзания до дна. Образующийся внутриводный и донный лед (стр. 84, 301) всплывает к поверхности. Сложной структурой молекул воды и перестройкой их решеток можно объяснить увеличение плотности воды с повышением температуры от 0 до 4° С, аномальное изменение ее удельной теплоемкости с изменением температуры, высокую теплоту плавления, парообразования, диэлектрическую постоянную и некоторые другие особенности.[ …]
Согласно кинетической теории газов и жидкости, удельный объем всех тел при повышении температуры увеличивается, т. е. уменьшается плотность. Вода отличается от других тел и в этом отношении: в интервале от 0 до +4° С ее плотность увеличивается в связи с частичным разрушением тетраэдральной структуры, а при дальнейшем повышении температуры плотность уменьшается (удельный объем увеличивается) вследствие увеличения расстояния между молекулами. У морской воды температура наибольшей плотности зависит и от солености. С повышением температуры и понижением солености плотность уменьшается, а с понижением температуры и увеличением солености увеличивается.[ …]
У морской воды температура наибольшей плотности зависит и от солености. С повышением температуры и понижением солености плотность уменьшается, а с понижением температуры и увеличением солености увеличивается.[ …]
Вода, лед и воздух плохо проводят тепло, поэтому в естественных водоемах передача тепла в глубины происходит чрезвычайно медленно. Обогревание же глубинных вод связано с процессами вертикального перемешивания. Для Мирового океана важную роль играет теплопроводность, связанная с турбулентностью, коэффициент которой в тысячи раз превосходит коэффициент молекул лярной теплопроводности. Для оценки скорости переноса тепла определяют температуропроводность. Она равна отношению коэффициента теплопроводности воды к ее плотности и теплоемкости при постоянном давлении. Весьма малая теплопроводность воды, льда и снега и высокая теплоемкость благоприятны для развития жизни в водоемах.[ …]
Скрытая теплота испарения и льдообразования. При переходе воды из жидкой фазы в парообразное состояние процесс испарения происходит медленно, а с повышением температуры более интенсивно. Когда упругость водяных паров становится равной внешнему давлению, вода закипает. Температура кипения химически чистой воды при нормальном давлении 1013 мб (760 мм) соответствует 100° С, при давлении 970 мб — 98,8° С, а при 1020 мб 100,2° С. При испарении и при конденсации 1 кг воды затрачивается и выделяется определенное количество тепла, называемое скрытой удельной теплотой парообразования (испарения), величина которой при 273 К равна 2,5-10® Дж/кг (597 кал/г). С повышением температуры она понижается и при 373 К равна 2,26-10е Дж/кг, т. е. 539 кал/г при 100° С. Скрытая теплота парообразования чистого льда или снега при 273 К больше, чем воды, на величину теплоты плавления 3,35 • 105 Дж/кг (677 кал/г).[ …]
Когда упругость водяных паров становится равной внешнему давлению, вода закипает. Температура кипения химически чистой воды при нормальном давлении 1013 мб (760 мм) соответствует 100° С, при давлении 970 мб — 98,8° С, а при 1020 мб 100,2° С. При испарении и при конденсации 1 кг воды затрачивается и выделяется определенное количество тепла, называемое скрытой удельной теплотой парообразования (испарения), величина которой при 273 К равна 2,5-10® Дж/кг (597 кал/г). С повышением температуры она понижается и при 373 К равна 2,26-10е Дж/кг, т. е. 539 кал/г при 100° С. Скрытая теплота парообразования чистого льда или снега при 273 К больше, чем воды, на величину теплоты плавления 3,35 • 105 Дж/кг (677 кал/г).[ …]
Высокая теплота испарения воды и плавления льда имеет важное значение для теплового баланса Земли.[ …]
Диэлектрическая постоянная воды (е) весьма высока — она равна 81. У большинства тел она находится в пределах 2—8. Высокий дипольный момент при незначительном молекулярном объеме воды обусловливает высокое значение е.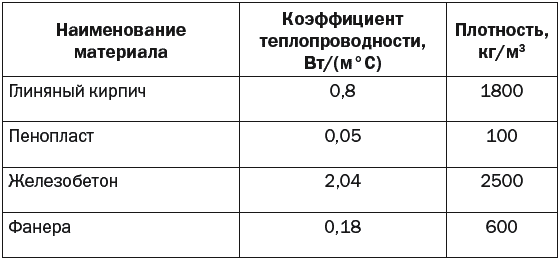 Только немногие соединения обладают высокой диэлектрической постоянной (нитробензол 36, спирты метиловый 33, этиловый 26 и рутил 170). Вследствие большой диэлектрической постоянной вода отличается большой ионизирующей способностью (способностью расщеплять молекулы растворенных веществ на ионы) и высокой растворимостью различных элементов, входящих в состав почв и горных пород.[ …]
Только немногие соединения обладают высокой диэлектрической постоянной (нитробензол 36, спирты метиловый 33, этиловый 26 и рутил 170). Вследствие большой диэлектрической постоянной вода отличается большой ионизирующей способностью (способностью расщеплять молекулы растворенных веществ на ионы) и высокой растворимостью различных элементов, входящих в состав почв и горных пород.[ …]
Поверхностное натяжение. Внутримолекулярные силы проявляются внутри воды в виде сил сцепления, а на свободной поверхности— в виде сил прилипания. Первые обусловливают вязкость, вторые — поверхностное натяжение. На свободной поверхности межмолекулярные силы стремятся втянуть все молекулы во внутрь жидкости и уменьшить свободную поверхность. В результате этого возникает сила поверхностного натяжения, направленная нормально к поверхности воды. Коэффициент поверхностного натяжения изменяется от 7,13-10 2 до 7,65- 10-2 Н/м (от 71,32 до 76,52 дин/см) в зависимости от температуры и солености. С ним связано образование первичных капиллярных волн на поверхности озер, морей и океанов. [ …]
[ …]
Для ламинарных движений с малыми скоростями, когда слои воды, не смешиваясь, как бы скользят друг по другу, характерна молекулярная вязкость. Коэффициент молекулярной вязкости чистой воды при 0° С равен 0,01795 • 10 5 кг • м/с.[ …]
Вода отличается большой подвижностью. Под влиянием различных внешних и внутренних сил воды естественных водоемов приходят в движение. Наряду с такими крупномасштабными движениями, как приливы, сейсмические волны, течения, а также волнение, колебания уровня, вертикальное перемешивание, движение воды может происходить под влиянием молекулярных сил. Силы взаимного притяжения и отталкивания между частицами воды и веществ, с которыми они взаимодействуют, определяют движение воды в капиллярах почв и грунтов. Исследования физических свойств воды показывают, что у пресной воды эти силы зависят главным образом от изменений температуры и давления, а у морской, кроме того, и от солености. Так, например, морская вода, представляя собой высокоионизированный раствор различных солей, хорошо проводит электрический ток. [ …]
[ …]
Рисунки к данной главе:
| Строение молекул воды (а) и тетраэдральное расположение молекул (6). |
Вернуться к оглавлению
ПОКАЗАТЕЛИ ТЕПЛОПРОВОДНОСТИ
Свойство материала, обозначаемое λ и определяемое законом Фурье , которое для одномерной проводимости в изотропной среде имеет вид:
Значение λ зависит от температуры и обычно определяется экспериментально методами, основанными на законе Фурье, т.е.
где, например,
измеряется для заданного значения dT/dx. Подробная информация о методах, используемых для определения λ для твердых тел, жидкостей и газов, дана Тайем (19).69) и Маглик, Чезаирлиян и Пелецкий (1984, 1992). Значения λ каталогизированы Тулукианом и Хо (с 1970 по 1977 г.), обширным банком данных, составленным Центром исследования теплофизических свойств Университета Пердью и постоянно расширяемым и обновляемым CINDAS в том же университете.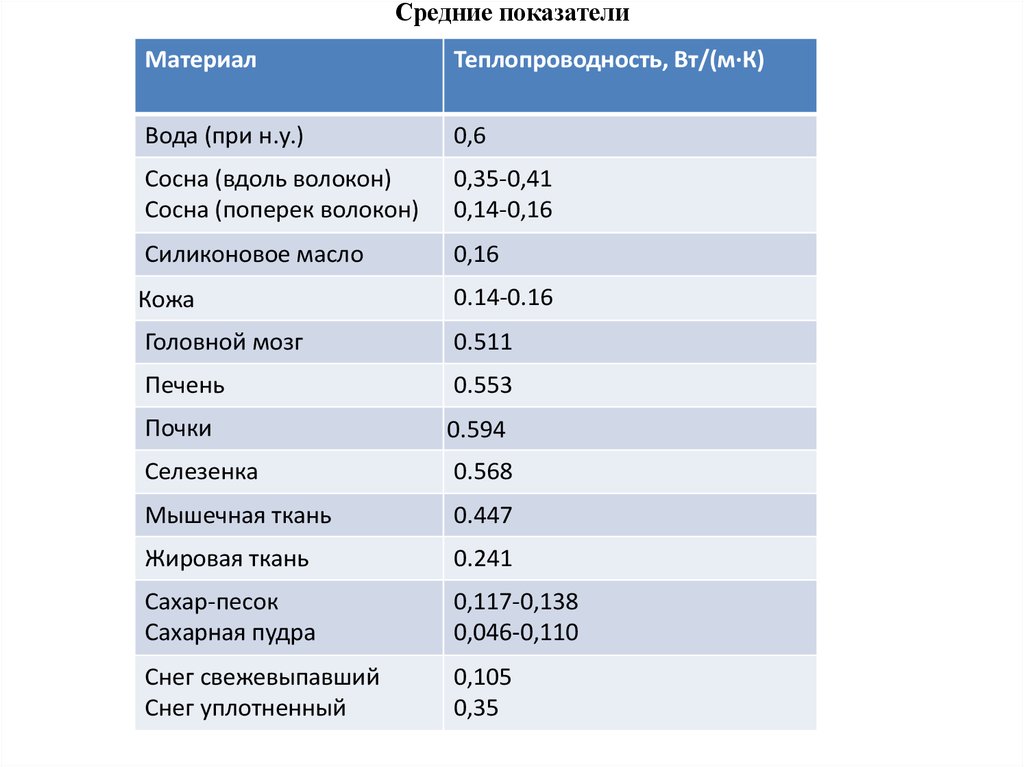 Другими доступными справочниками данных являются справочники Кэя и Лаби (1986) и Перри и Грина (1984).
Другими доступными справочниками данных являются справочники Кэя и Лаби (1986) и Перри и Грина (1984).
На рисунке 1 показан очень широкий диапазон значений λ для твердых тел, жидкостей и газов при нормальных температурах и давлениях.
Рисунок 1. Разброс значений λ для трех состояний вещества.
Температурная зависимость значений λ для трех состояний вещества показана на рисунках 2 и 3.
Рисунок 2. Изменение теплопроводности некоторых металлов в зависимости от температуры.
Рисунок 3. Изменение теплопроводности некоторых жидкостей в зависимости от температуры.
Теплопроводность металла обычно можно соотнести с температурой в ограниченном диапазоне, используя такое выражение, как:
λ = λ 0 (а + bθ + cθ 2 )
где θ = T – T ref и λ 0 – теплопроводность при эталонной температуре T ref .
Теплопроводность неоднородного твердого тела обычно зависит от кажущейся объемной плотности и, как правило, увеличивается с повышением температуры и увеличением объемной плотности.
На рис. 3 показана температурная зависимость λ для некоторых насыщенных жидкостей и паров и газов, имеющих инженерное значение. λ для большинства жидкостей уменьшается с повышением температуры. Исключением является вода, для которой наблюдается увеличение λ примерно до 150°C и уменьшение λ после этого. Вода обладает наибольшей теплопроводностью из всех жидкостей, кроме жидких металлов.
Теплопроводность газов увеличивается с повышением температуры, но практически не зависит от давления при давлениях, близких к атмосферному. Значения λ для пара сильно зависят от давления.
Методы оценки значений λ вне диапазона опубликованных значений и значений λ смесей жидкости и газа описаны Reid et al. (1987).
ССЫЛКИ
CINDAS, Центр анализа и синтеза информации и числовых данных, Университет Пердью, 2595 Yeager Road, West Lafayette, IN 47906, США.
Kaye, G.W.C. and Laby, TH (1986) Таблицы физических и химических констант , 15-е изд., Longmans Scientific and Technical, Harlow, UK.
Маглич К.Д., Чезаирлиян А.Д. и Пелецкий В.Е. (1984, 1992) Сборник методов измерения теплофизических свойств , Vols. 1 (1984) и 2 (1992), Plenum Press, Нью-Йорк.
Perry, R. H. and Green, D. W. (1984) Perry’s Handbook Engineers’ Engineering , 6-е изд., McGraw-Hill.
Reid, R.C., Prausnitz, J.M., и Poling, B.E. (1987) The Properties of Gases and Liquids , 4th edn., McGraw-Hill, New York.
Тулукиан, Ю. С. и Хо, С. Ю. 1970–1977. Теплофизические свойства вещества, Серия данных TPRC (13 томов), Plenum Press, Нью-Йорк.
Tye, R.P. (1969) Измерение теплопроводности , Vols. 1 и 2, Академическая пресса.
Каталожные номера
- CINDAS, Центр информации и анализа и синтеза числовых данных, Университет Пердью, 2595 Yeager Road, West Lafayette, IN 47906, США.
- Kaye, GWC и Laby, TH (1986) Tables of Physical and Chemical Constants , 15-е изд., Longmans Scientific and Technical, Harlow, UK.

- Маглик, К.Д., Чезаирлиан, А.Д. и Пелецкий, В.Е. (1984, 1992) Сборник методов измерения теплофизических свойств , Vols. 1 (1984) и 2 (1992), Plenum Press, Нью-Йорк.
- Перри, Р. Х. и Грин, Д. В. (1984) Справочник инженеров-химиков Перри , 6-е изд., McGraw-Hill.
- Рейд Р.С., Праусниц Дж.М. и Полинг Б.Е. (1987) Свойства газов и жидкостей , 4-е изд., McGraw-Hill, Нью-Йорк.
- Тулукиан, Ю.С. и Хо, С.Ю., 1970–1977. Теплофизические свойства вещества, . Серия данных TPRC (13 томов), Plenum Press, Нью-Йорк.
- Tye, RP (1969) Измерение теплопроводности , Том. 1 и 2, Академическая пресса.
Теплопроводность – Энергетическое образование
Энергетическое образование
Меню навигации
ИСТОЧНИКИ ЭНЕРГИИ
ЭНЕРГЕТИЧЕСКОЕ ИСПОЛЬЗОВАНИЕ
ЭНЕРГЕТИЧЕСКОЕ ВОЗДЕЙСТВИЕ
ИНДЕКС
Поиск
Теплопроводность , часто обозначаемая как [math]\kappa[/math], представляет собой свойство, связывающее скорость потери тепла на единицу площади материала со скоростью изменения его температуры. 9{\ circ} F} \ справа) [/ математика]. [3] Материалы с более высокой теплопроводностью являются хорошими проводниками тепловой энергии.
9{\ circ} F} \ справа) [/ математика]. [3] Материалы с более высокой теплопроводностью являются хорошими проводниками тепловой энергии.
Поскольку передача тепла путем теплопроводности предполагает передачу энергии без движения материала, логично, что скорость передачи тепла будет зависеть только от разницы температур между двумя точками и теплопроводности материала.
Дополнительные сведения о теплопроводности см. в разделе Гиперфизика.
Значения для обычных материалов
| Материал | Электропроводность при 25 o C |
|---|---|
| Акрил | 0,2 |
| Воздух | 0,024 |
| Алюминий | 205 |
| Битум | 0,17 |
| Латунь | 109 |
| Цемент | 1,73 |
| Медь | 401 |
| Алмаз | 1000 |
| Войлочная изоляция | 0,04 |
| Стекло | 1,05 |
| Железо | 80 |
| Кислород | 0,024 |
| Бумага | 0,05 |
| Аэрогель кремнезема | 0,02 |
| Вакуум | 0 |
| Вода | 0,58 |
Из таблицы справа видно, что большинство материалов, обычно ассоциируемых с хорошими проводниками, обладают высокой теплопроводностью.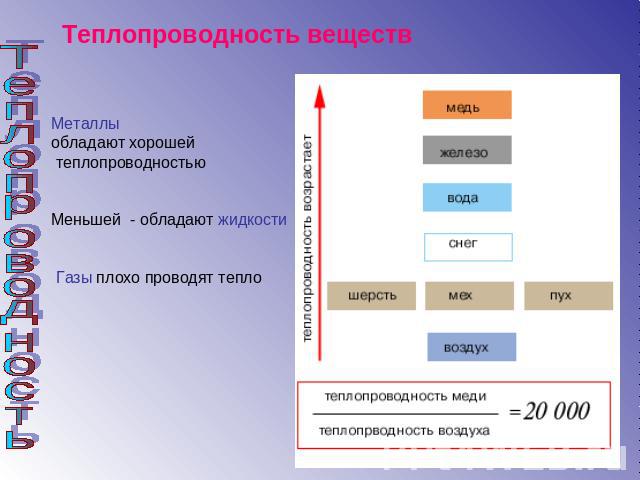 В основном металлы обладают очень высокой теплопроводностью, которая хорошо сравнима с тем, что известно о металлах. Кроме того, изоляционные материалы, такие как аэрогель и изоляция, используемые в домах, имеют низкую теплопроводность, что указывает на то, что они не пропускают тепло через себя. Таким образом, низкая теплопроводность указывает на хороший изоляционный материал.
В основном металлы обладают очень высокой теплопроводностью, которая хорошо сравнима с тем, что известно о металлах. Кроме того, изоляционные материалы, такие как аэрогель и изоляция, используемые в домах, имеют низкую теплопроводность, что указывает на то, что они не пропускают тепло через себя. Таким образом, низкая теплопроводность указывает на хороший изоляционный материал.
Промежуточные материалы не обладают ни значительными изолирующими, ни проводящими свойствами. Цемент и стекло не проводят очень большое количество тепла и не обеспечивают очень хорошую изоляцию.
Идея о том, что теплопроводность некоторых материалов связана с тем, насколько хорошо они изолируют, обеспечивает связь между теплопроводностью и значениями R/U. Поскольку значения U и R выражают, насколько хорошо определенный материал сопротивляется потоку тепла, теплопроводность играет роль в формировании этих значений. Однако значения U и R также зависят от толщины материала, тогда как теплопроводность этого не учитывает.


