Содержание
Исследование свойств воды при кристаллизации
Внимание! Администрация сайта rosuchebnik.ru не несет ответственности за содержание методических разработок, а также за соответствие разработки ФГОС.
- Участник:Ковалёв Павел Алексеевич
- Руководитель:Шик Галина Яковлевна
Цель работы: провести опыты по кристаллизации воды и подготовить предложения по их проведению.
Вступление
Вода является не только одним из самых необходимых, но и самых удивительных явлений на нашей планете. Исключительно важна роль воды в возникновении и поддержании жизни на Земле, в химическом строении живых организмов, в формировании климата и погоды. Вода является важнейшим веществом для всех живых существ на Земле.
Введение
Большая часть поверхности Земли покрыта водой (океаны, моря, озёра, реки, льды). На Земле примерно 96,5 % воды приходится на океаны, 1,7 % мировых запасов составляют грунтовые воды, ещё 1,7 % – ледники и ледяные шапки Антарктиды и Гренландии, небольшая часть находится в реках, озёрах и болотах, и 0,001 % в облаках, которые образуются из взвешенных в воздухе частиц льда и жидкой воды.
Вода при нормальных условиях находится в жидком состоянии, однако при температуре в 0 °C она переходит в твердое состояние – лед и кипит (превращается в водяной пар) при температуре 100 °C.
Значения 0 °C и 100 °C были выбраны как соответствующие температурам таяния льда и кипения воды при создании температурной шкалы «по Цельсию».
Лёд встречается в природе в виде собственно льда (материкового, плавающего, подземного), а также в виде снега, инея, изморози. Под действием собственного веса лёд приобретает пластические свойства и текучесть.
Природный лёд обычно значительно чище, чем вода, так как при кристаллизации воды в первую очередь в решётку встают молекулы воды.
Общие запасы льда на Земле около 30 млн. км³. Основные запасы льда сосредоточены в полярных шапках (главным образом, в Антарктиде, где толщина слоя льда достигает 4 км).
В мировом океане вода солёная и это препятствует образованию льда, поэтому лёд образуется только в полярных и субполярных широтах, где зима долгая и очень холодная. Замерзают некоторые неглубокие моря, расположенные в умеренном поясе.
Замерзают некоторые неглубокие моря, расположенные в умеренном поясе.
Кроме того, имеются данные о наличии льда на планетах Солнечной системы (например, на Марсе), их спутниках, на карликовых планетах и в ядрах комет.
Исследование свойств воды необходимо для человечества.
При этом процесс кристаллизации воды можно изучать в домашних условиях, а также на уроках в средней школе.
Актуальность работы использование на уроках физики, для знакомства учащихся со свойствами воды при кристаллизации.
Объектом исследования является кристаллизация воды.
Предмет исследования – изучения свойств воды при кристаллизации.
Цель работы провести опыты по кристаллизации воды и подготовить предложения по их проведению.
Главной задачей является изучение свойств воды при кристаллизации.
Для решения главной задачи необходимо:
- Повести анализ основных свойств воды.

- Изучить значение кристаллизации воды для флоры и фауны Земли.
- Определить основные опыты для проведения исследования.
- Провести опыты и описать основные результаты.
- Подготовить предложения по проведению опытов на уроках в средней школе.
Теоретическая значимость работы заключается в систематизации основных свойств воды и значения кристаллизации воды для флоры и фауны Земли.
Практическая значимость работы – изучение процесса кристаллизации воды во время проведение опытов, а также подготовка предложений по проведению опытов на уроках в средней школе.
1. Подготовка к исследованию
1.1 Анализ основных свойств воды
Вода является одним из самых удивительных веществ на планете Земля. Встретить воду можно практически везде в естественных условиях как на поверхности планеты, так и в ее недрах в трех возможных физических состояниях для веществ: жидкое, твердое, газообразное (то есть вода, лед, водяной пар).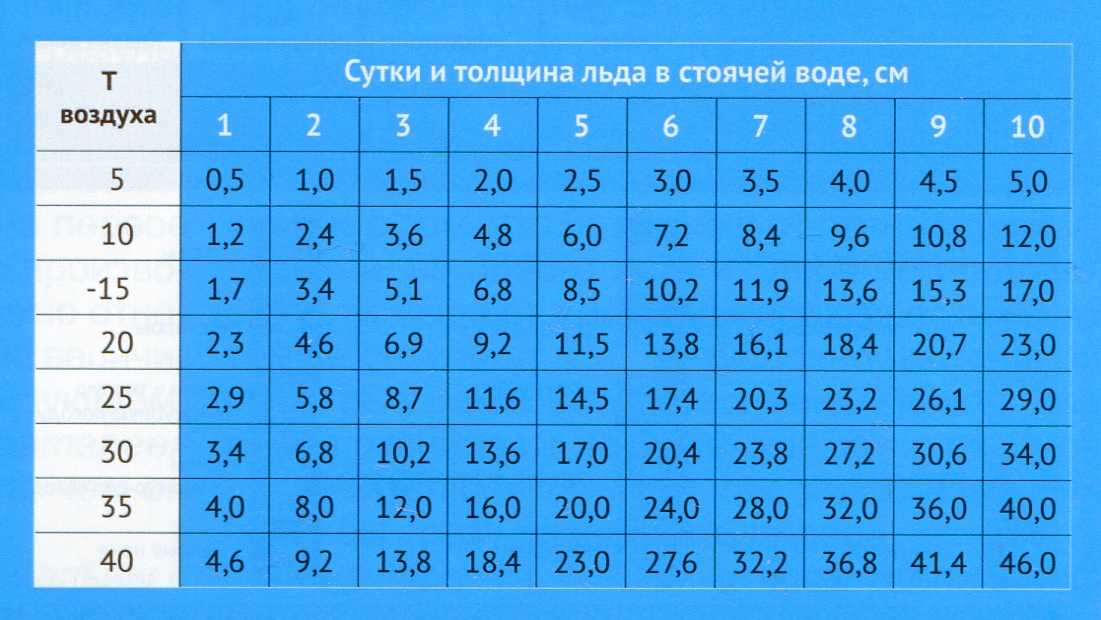
Конечно, существуют вещества, которые можно получить в виде жидкости, твердого тела или газа. Однако, не существует подобного химического вещества, которое именно в естественных условиях встречается в указанных выше трех физических состояниях.
Свойства воды:
- Вода является веществом, которое не имеет ни цвета, ни запаха, ни вкуса.
- Вода является единственным на планете Земля известным науке веществом, встречающимся в природных условиях в трех физических состояниях: твердое тело, жидкость, газ.
- Вода является универсальным растворителем, имея возможность растворять большее количество солей, а также других веществ, чем какие-либо другие вещества.
- Вода с большим трудом поддается окислению. Вода — достаточно химически устойчива, то есть разложить ее на составные части или сжечь достаточно проблематично.
- Окислению водой поддаются практически все естественные металлы, так же под ее воздействием разрушаются особо твердые горные породы.

- При замерзании вода обладает уникальными свойствами расширения. Благодаря таким свойствам лед на воде, которая находится в виде жидкости, плавает.
- Вода, как физическое вещество, характеризуется большим сродством сама с собой. Такое сродство у воды является самым большим среди всех жидкостей. Вследствие этого вода на поверхности размещается в виде капель сферической формы, поскольку сфера обладает наименьшей при заданном объеме поверхностью.
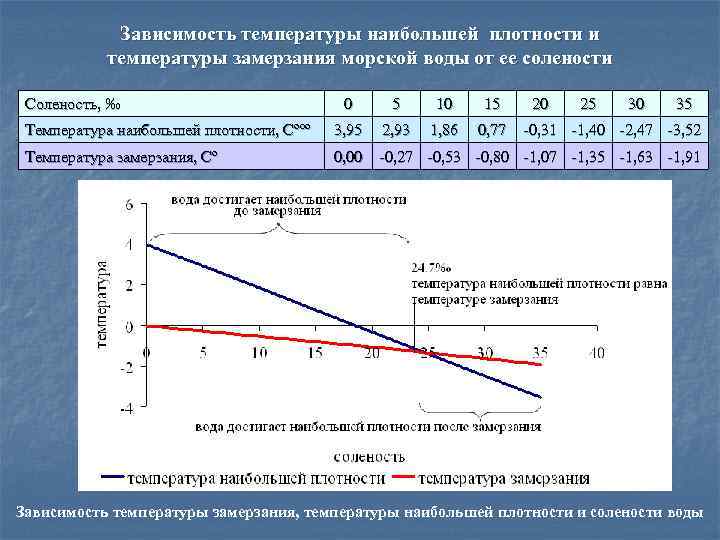
- Замерзание воды происходит не при температурных условиях ее наибольшей плотности (при 4 градусах Цельсия), а при нуле градусов Цельсия. Это свойства пресной воды. Однако, замерзание морской воды происходит при более низких температурах: минус 1,9 градусов Цельсия, при солености 35%.
- Вода обладает очень высокой теплоемкостью, относительно мало нагреваясь при этом. Также вода обладает достаточно высокой скрытой теплотой плавления (порядка 80 кал/г), а также испарения ( порядка 540 кал/г). Вода способна поглощать значительные объемы дополнительного тепла.
 Температура же в процессе замерзания или при кипении остается неизменной.
Температура же в процессе замерзания или при кипении остается неизменной. - Дистиллированная вода практически не проводит электрический ток, однако наличие в воде даже небольшого количества солей значительно увеличивает ее токопроводящие свойства.
Свойства снега:
- При смешивании соли со снегом наблюдается два процесса: разрушение кристаллической структуры соли, которое происходит с поглощением тепла, и гидрация ионов. Последний процесс происходит с выделением тепла в окружающую среду. Для поваренной соли и хлористого кальция первый процесс превалирует над вторым. Поэтому при смешивании снега с этими солями происходит активный отбор тепла из окружающей среды. Ещё одна особенность соляных растворов состоит в том, что их точка замерзания ниже 0 градусов. Чтобы снег на тротуарах таял при температуре ниже 0 градусов, его посыпают этими солями.
- Снег обладает удивительным свойством – памятью. Он сохраняет следы. По следам можно, например, изучать физику.
 Чем крупнее животное, тем глубже от него след, следовательно, тем большее давление оно оказывает на снег. Следы собаки более глубокие, чем следы её щенков. Мыши, ласки оставляет неглубокие чёрточки. Природа снабдила копытных животных способностью раздвигать копыта и увеличивать площадь опоры. Это помогает им зимой при передвижение по заснеженному лесу и полям не так глубоко погружаться в снег.
Чем крупнее животное, тем глубже от него след, следовательно, тем большее давление оно оказывает на снег. Следы собаки более глубокие, чем следы её щенков. Мыши, ласки оставляет неглубокие чёрточки. Природа снабдила копытных животных способностью раздвигать копыта и увеличивать площадь опоры. Это помогает им зимой при передвижение по заснеженному лесу и полям не так глубоко погружаться в снег.
1.2 Значение кристаллизации воды для флоры и фауны
Мы любим снег не только за то, что он дарит нам великолепные зимние пейзажи. У нашей любви к снегу немало рациональных причин. «Снег на полях — хлеб в закромах», «Зима без снега – лето без хлеба», – справедливо утверждают старинные русские пословицы. Снежный покров — это огромный запас влаги, столь необходимый полям, в то же время это своеобразное гигантское одеяло, защищающее поверхность земли от холодных ветров. Академик Б. И. Вернадский подчеркивал, что снежный покров — «не просто теплая покрышка озимых, это живительная покрышка», весной он дает талые воды, насыщенные кислородом. Известно, что количество азотистых соединений летом в почве пропорционально высоте сошедшего снежного покрова. Недаром снежная мелиорация рассматривается сегодня как одно из важнейших условий получения высоких и устойчивых урожаев.
Известно, что количество азотистых соединений летом в почве пропорционально высоте сошедшего снежного покрова. Недаром снежная мелиорация рассматривается сегодня как одно из важнейших условий получения высоких и устойчивых урожаев.
Запасы снега существенно влияют на уровень воды в реках, определяют изменения климата на больших территориях.
Кроме того, снег является хорошим строительным материалом для различных построек на севере — от иглу (жилищ эскимосов) до больших складских помещений. Существует самая большая в мире гостиница, полностью сделанная изо льда и снега, находится она в шведской Лапландии в 200 километрах от Северного полярного круга.
Он служит основой зимних дорог и даже аэродромов.
Благодаря снегу мы каждый год любуемся сказочными зимними пейзажами, играем в снежки, строим снежные городки, крепости, катаемся на лыжах, санках, в снежном уборе приходит к нам прекрасный новогодний праздник.
Значение льда трудно недооценить. Лёд оказывает большое влияние на условия обитания и жизнедеятельности растений и животных, на разные виды хозяйственной деятельности человека. Покрывая воду сверху, лед играет в природе роль своего рода плавучего экрана, защищающего реки и водоемы от дальнейшего замерзания и сохраняющего жизнь подводному миру. Если бы плотность воды увеличивалась при замерзании, лед оказался бы тяжелее воды и начал тонуть, что привело бы к гибели всех живых существ в реках, озерах и океанах, которые замерзли бы целиком, превратившись в глыбы льда, а Земля стала ледяной пустыней, что неизбежно привело бы к гибели всего живого.
Лёд оказывает большое влияние на условия обитания и жизнедеятельности растений и животных, на разные виды хозяйственной деятельности человека. Покрывая воду сверху, лед играет в природе роль своего рода плавучего экрана, защищающего реки и водоемы от дальнейшего замерзания и сохраняющего жизнь подводному миру. Если бы плотность воды увеличивалась при замерзании, лед оказался бы тяжелее воды и начал тонуть, что привело бы к гибели всех живых существ в реках, озерах и океанах, которые замерзли бы целиком, превратившись в глыбы льда, а Земля стала ледяной пустыней, что неизбежно привело бы к гибели всего живого.
Лёд может вызывать ряд стихийных бедствий с вредными и разрушительными последствиями – обледенение летательных аппаратов, судов, сооружений, дорожного полотна и почвы, град, метели и снежные заносы, речные заторы с наводнениями, ледяные обвалы и др. Природный лёд используется для хранения и охлаждения пищевых продуктов, биологических и медицинских препаратов, для чего он специально производится и заготавливается.
1.3 Выбор и обоснование опытов для проведения исследования
Для проведения опытов с водой необходимо выбрать те, которые наиболее полно характеризуют и подтверждают свойства воды.
Проведенный анализ показал, что лучше всего это будет реализовано при выполнении следующих опытов:
- Замерзание соленой воды.
- Расширение воды при замерзании.
- Замерзание жидкости при внешнем воздействии снега.
- Замерзание мыльных пузырей.
- Срастание сосульки.
- Скрип сухого снега.
- Примерзание к поверхности.
2. Проведение исследования
2.1 Подготовка материальной части
Для проведения опытов были взяты:
- предметы – кастрюля, стеклянная бутылка, пластиковая бутылка, одноразовые стаканы, тонкая медная проволока, трубочка;
- вещества – снег, сосулька, соль, вода, мыльный раствор, сок.
2.
 2 Проведение опытов с описанием основных результатов
2 Проведение опытов с описанием основных результатов
1. Замерзание соленой воды.
Налейте в две формочки воду – чистую и очень солёную. Вынесите формочки на мороз или поставьте в морозильную камеру. Вы заметите, что чистая пресная вода превратилась в лёд, а солёная замёрзнет при очень сильном морозе.
Замерзание воды происходит не при температурных условиях ее наибольшей плотности (при 4 градусах Цельсия), а при нуле градусов Цельсия. Это свойства пресной воды.
При этом, морской лед отличается от пресноводного в ряде отношений. У соленой воды температура замерзания понижается по мере увеличения солености. В диапазоне солености от 30 до 35 промилле точка замерзания меняется от -1.6 до -1.9 град. Образование морского льда можно рассматривать как замерзание пресной воды с вытеснением солей в ячейки морской воды внутри толщи льда. Когда температура достигает точки замерзания, образуются ледяные кристаллы, которые «окружают» не замерзшую воду.
2. Расширение воды при замерзании.
Наполните водой пластиковый стакан, пластиковую бутылку и стеклянную бутылку. Выставьте их на мороз. Замерзая, вода увеличивается в объёме, «вылезает» из стакана, стеклянную бутылку разрывает даже в том случае, когда она заполнена наполовину. Пластиковая бутылка остаётся без видимых изменений.
При замерзании вода обладает уникальными свойствами расширения. Благодаря таким свойствам лед на воде, которая находится в виде жидкости, плавает.
Зимой из-за этого свойства воды происходят аварии на водопроводах. В сильные морозы основная причина таких аварий – замерзание текучей воды. Происходит ее расширение, так что образующийся лед легко разрывает трубы, так как плотность льда – 917 кг/м3, а плотность воды – 1000 кг/м3, то есть объем увеличивается в 1,1 раза, что довольно существенно.
3. Замерзание жидкости при внешнем воздействии снега.
Налейте в пластиковый стакан (пробирку) сок и поставьте его в кастрюлю с солёным снегом. Сок замёрзнет, и очень скоро вы будете лакомиться фруктовым льдом.
Сок замёрзнет, и очень скоро вы будете лакомиться фруктовым льдом.
При смешивании соли со снегом наблюдается разрушение кристаллической структуры соли, которое происходит с поглощением тепла. Поэтому при смешивании снега с солью происходит активный отбор тепла из сока и сок превращается в лед.
4. Замерзание мыльных пузырей.
Приготовьте мыльный раствор. Раствор на морозе держите в рукавице, чтобы он не замёрз. Выдувайте пузыри трубочкой для сока. Из-за разности температур изнутри пузыря и снаружи возникает большая подъёмная сила, мгновенно уносящая пузыри вверх. Тонкая мыльная плёнка на морозе быстро замерзает, превращая пузыри в ледяные шарики.
Таким образом, тончайшая пленка мыльного пузыря замерзает за считанные секунды.
5. Срастание сосульки.
Возьмите сосульку. Перекиньте через неё тонкую проволоку, концы которой утяжелите грузиками. Наблюдайте, как проволока растапливает лёд, проникает всё глубже в сосульку. Вода над сосулькой вновь замерзает.
Вода над сосулькой вновь замерзает.
Это подтверждает свойство поглощения тепла большей массой льда.
Лед нарастает снизу, сразу над проволокой, так как стекающая вниз талая вода замерзает при соприкосновении с холодными стенками сосульки.
6. Скрип сухого снега.
Насыпьте в тарелку сахарный песок горкой и начните давить его ложкой. Вы услышите характерный скрип. Намочите песок и вновь разотрите. Скрип исчез. В морозные дни звук распространяется на большие расстояния.
Снег скрипит только в мороз (ниже -5°C), и звук скрипа меняется в зависимости от температуры воздуха – чем крепче мороз, тем выше тон скрипа. При достаточном опыте можно оценивать температуру воздуха по звуку, который издает скрипящий снег. Скрип образуется из-за того, что при давлении разрушаются мельчайшие кристаллики снега. Причем каждый из них по отдельности очень мал, чтобы издавать звук, доступный уху человека, но вместе они ломаются довольно громко. Усиление морозов делает ледяные кристаллики более твердыми и хрупкими. При каждом шаге ледяные иглы ломаются. При температуре воздуха ниже -50°C скрип снега становится таким сильным, что его можно слышать через тройные стекла (этому способствует также большая плотность морозного воздуха).
Усиление морозов делает ледяные кристаллики более твердыми и хрупкими. При каждом шаге ледяные иглы ломаются. При температуре воздуха ниже -50°C скрип снега становится таким сильным, что его можно слышать через тройные стекла (этому способствует также большая плотность морозного воздуха).
7. Примерзание к поверхности.
Добавьте в кастрюлю со снегом поваренную соль в соотношении примерно 1 к 6. Тщательно размешайте смесь. Если теперь вы захотите переставить кастрюлю, то её придётся поднять вместе с табуретом.
Это также подтверждает поглощение тепла из окружающей среды.
При смешивании соли со снегом происходит образование раствора, сопровождающееся сильным охлаждением вследствие большого поглощения теплоты льдом при его плавлении и солью при ее растворении. Так, например, температура смеси из 29 грамм соли и 100 грамм льда понижается до – 21°С. А если взять 143 грамма соли и 100 грамм льда, то температура может быть понижена до – 55°С.
2.3 Предложения по проведению опытов
Опыты по изучению свойств воды целесообразно проводить на уроках в средней и начальной школе.
При этом для детей начальной школы рекомендуется проведение опытов № 1 и 2 в домашних условиях под присмотром родителей.
Для учеников средней школы возможно проведение опытов № 3, 6 и 7 на уроках под руководством учителя, а опыты № 4 и 5 – факультативно или самостоятельно в домашних условиях.
Заключение
Таким образом, исследование свойств воды необходимо для человечества.
Процесс кристаллизации воды можно изучать в домашних условиях, а также на уроках в средней и начальной школе.
В работе удалось решить следующие задачи:
- Повести анализ основных свойств воды.
- Изучить значение кристаллизации воды для флоры и фауны Земли.
- Определить основные опыты для проведения исследования.

- Провести опыты и описать основные результаты.
- Подготовить предложения по проведению опытов на уроках в средней школе.
Значимость работы по систематизации основных свойств воды и значения кристаллизации воды для флоры и фауны Земли подтвердилась.
Цель достигнута.
Вода, которая никогда не замерзает
Сделать кубики льда очень просто: берем обычный
пластиковый лоток для кубиков льда, наполняем его водой и ставим
в морозильник. Вскоре вода кристаллизуется и превращается в
лед. Если проанализировать структуру кристаллов льда, мы
увидим, что молекулы воды расположены в виде правильных
решетчатых структур. В воде же, напротив, молекулы расположены не
в строгом порядке, хоть и близко друг к другу: иначе вода не
могла бы течь.
А что, если бы вода никогда не превращалась в лед? И
возможно ли это?
«Стеклянная» вода
Группа физиков и химиков из Швейцарской высшей технической школы
Цюриха (ETH Zurich) и Цюрихского университета во главе с
профессорами Раффаэле Мецценга (Raffaele Mezzenga) и Эхудом
Ландау (Ehud Landau) нашла необычный способ, который мешает воде
кристаллизоваться, сообщается на сайте
ETH. При экстремальных минусовых температурах – даже при -263
При экстремальных минусовых температурах – даже при -263
градусах по Цельсию – вода сохраняет характеристики жидкости.
По порядку – о поиске нового метода. На первом этапе
исследователи разработали и синтезировали новый класс липидов
(молекул жира) для создания новой формы «мягкой» биологической
субстанции, известной как липидная мезофаза. Мезофазой называется
агрегатное состояние вещества, промежуточное между жидкостью и
твердым телом. Самый известный пример мезофазы – желатин. В этом
материале липиды самопроизвольно собираются и объединяются,
образуя мембраны, которые ведут себя так же, как молекулы
натурального жира. Эти мембраны затем формируют сети соединенных
каналов диаметром менее одного нанометра. Температура и
количество воды, а также новая структура разработанных липидных
молекул определяют структуру, которую принимает липидная
мезофаза.
Затем воду смешали с липидной мезофазой. Используя жидкий гелий,
исследователи смогли охладить липидную мезофазу, состоящую из
химически модифицированного моноацилглицерина, до температуры
-263 градуса по Цельсию (что всего на 10 градусов выше
абсолютного «нуля»), и кристаллы льда не образовались. При этой
При этой
температуре вода стала «стеклообразной», что исследователи смогли
продемонстрировать и подтвердить при моделировании. В отличие от
пластикового лотка для кубиков льда с крупными «лунками», в узких
каналах липидной мезофазы нет места для образования кристаллов
льда, поэтому вода остается беспорядочной даже при экстремальных
минусовых температурах. Липиды тоже не замерзают. Результаты
исследования этого необычного поведения воды, когда она заключена
в липидную мезофазу, были описаны в статье, опубликованной в
журнале Nature Nanotechnology.
«Ключевым фактором является соотношение липидов и воды», –
объясняет профессор Раффаэле Мецценга из Лаборатории пищевых и
мягких материалов в ETH Zurich. Соответственно, именно содержание
воды в смеси определяет температуру, при которой изменяется
геометрия мезофазы. Если, например, смесь содержит 12% воды,
структура мезофазы будет переходить при температуре около -15
градусов Цельсия из кубической решетки в пластинчатую структуру.
Естественный «антифриз» для бактерий
«Что делает разработку этих липидов настолько сложной, так это их
синтез и очистка», – говорит Эхуд Ландау, профессор химии в
Цюрихском университете. Так происходит потому, что молекулы
липидов состоят из двух частей: одна является гидрофобной
(отталкивает воду), а другая – гидрофильной (наоборот,
притягивает воду). С ними чрезвычайно сложно работать, отмечает
ученый.
Мягкий биоматериал, образованный из липидных мембран и воды,
имеет сложную структуру, которая сводит к минимуму контакт воды с
гидрофобными частями и максимизирует ее взаимодействие с
гидрофильными частями.
Исследователи смоделировали новый класс липидов на мембранах
определенных бактерий. Эти бактерии также вырабатывают особый
класс самоорганизующихся липидов, которые могут естественным
образом ограничивать количество воды в их внутреннем
пространстве, позволяя микроорганизмам выживать в очень холодных
условиях.
У нового класса тоже есть свой хитрый механизм. Новизна этих
липидов заключается в том, что молекулы гидрофобных частей
липидов образуют маленькие кольца, которые создают необходимую
«кривизну» для образования крошечных водяных каналов и
предотвращают кристаллизацию липидов.
Мягкая материя для исследований
Для чего понадобятся липидные мезофазы, которые не дают воде
замерзнуть? Главным образом, они будут служить инструментом для
других исследователей. Например, для биологов, которые изучают
структуру и функции крупных биомолекул, таких как белки или
крупные молекулярные комплексы. Обычно такие образцы помещают в
быстро охлажденную воду, чтобы сохранить их и в дальнейшем
изучить. Но как только они превращаются в ледяные кристаллы,
разрушаются их мембраны и важные составляющие молекул.
Существует метод витрификации – «стеклования» живых клеток. В
криобиологии этот термин используют для обозначения метода
сверхбыстрого замораживания живых образцов. Криопротекторный
Криопротекторный
раствор, в котором находятся живые объекты, не кристаллизуется
при охлаждении, а переходит в стекловидное состояние. Этот метод
активно используют при криоэлектронной микроскопии, которая
помогает изучить структуры биомеолекул в растворах. Новый
способ, который использует липидные мезофазы, может стать
альтернативой при подобных исследованиях.
«Наше исследование прокладывает путь для будущих проектов, чтобы
определить, как белки могут сохраняться в своей первоначальной
форме и взаимодействовать с липидными мембранами при очень низких
температурах», – говорит профессор Швейцарской высшей технической
школы Цюриха.
[Фото: Peter Rüegg / ETH Zurich]
Замерзает ли соленая вода? | Вандополис
НАУКА — Физические науки
Задумывались ли вы когда-нибудь…
- Замерзает ли соленая вода?
- При какой температуре замерзает вода в океане?
- Является ли полярный лед пресной или соленой водой?
Теги:
См. все теги
все теги
- Цельсия,
- по Фаренгейту,
- заморозить,
- пресная вода,
- замороженный,
- лед,
- ,
- Северный полюс,
- океан,
- Океаны,
- соль,
- наука,
- Южный полюс,
- температура,
- вода,
- Наука,
- Старик Зима,
- Крик,
- Озеро,
- Пруд,
- Река,
- Зима,
- Полярный,
- Ледяная шапка,
- Замораживание,
- Точка,
- Обычный,
- Водород,
- Кислород,
- Бонд,
- Частица,
- Ставка,
- Ледяной,
- Дорога,
- Движение,
- Волна,
- Тепло,
- Алкоголь
молекула
Сегодняшнее чудо дня было вдохновлено Друзиллой. Друзилла Чудеса , « замораживает ли соленая вода » Спасибо, что ДУЗИЛЬНО размышляете вместе с нами, Друзилла!
Друзилла Чудеса , « замораживает ли соленая вода » Спасибо, что ДУЗИЛЬНО размышляете вместе с нами, Друзилла!
Разве лед не ЧУДЕСНЫЙ? В жаркий день ничто так не помогает, как лимонад, налитый на стакан, полный кубиков льда. На самом деле, лед делает так много вещей лучше. Например, мы любим использовать лед для приготовления домашнего мороженого!
Когда приходит Старик Зима, понижение температуры может превратить ручьи, озера, пруды и даже реки в замерзшие катки, на которых можно кататься на коньках. Но как же океан? Если вы когда-нибудь были у океана зимой, вы, наверное, замечали, что он не замерзает, как маленький пруд.
Так замерзает ли когда-нибудь океан? Если вы видели фотографии Северного полюса или Южного полюса, вы знаете, что в этих местах есть полярные ледяные шапки. Если океан замерзает в этих местах, почему остальная часть океана не замерзает зимой?
Температура замерзания пресной воды составляет 0° по Цельсию или 32° по Фаренгейту. Однако присутствие соли в воде снижает температуру замерзания воды. Чем больше соли в воде, тем ниже будет температура замерзания.
Однако присутствие соли в воде снижает температуру замерзания воды. Чем больше соли в воде, тем ниже будет температура замерзания.
Когда пресная вода замерзает, молекулы водорода и кислорода соединяются вместе в кристаллическую структуру льда. Присутствие соли затрудняет связывание молекул воды со структурой льда, потому что лед естественным образом отталкивает молекулы соли. Так что в некотором смысле соль мешает молекулам воды, не давая им соединиться со льдом. Соль также натыкается на лед, выбивая молекулы воды из структуры — вот как соль плавит лед.
Когда молекулы соли вытесняют молекулы воды, скорость замерзания замедляется. Вот почему на обледенелых дорогах часто используют соль, чтобы замедлить замерзание и сделать движение по ним более безопасным.
Хотя соленость морской воды бывает разной, часто в океанской воде содержится около 35 граммов соли на каждую 1000 единиц воды. Это снижает точку замерзания океанской воды примерно до -1,8 ° C или 28,8 ° F. Таким образом, океанская вода замерзает. Просто нужно достичь более низкой температуры.
Просто нужно достичь более низкой температуры.
Еще одним фактором, влияющим на замерзание океанской воды, является ее движение. В отличие от прудов, океанские волны постоянно движутся. Это помогает океанской воде сохранять тепло. В результате только действительно холодные районы, такие как Северный полюс или Южный полюс, обычно становятся достаточно холодными, чтобы вода в океане замерзла.
Однако при замерзании океанской воды замерзает только водная часть. Молекулы соли проталкиваются ниже поверхности льда. В результате полярный лед превращается в пресноводный лед, который можно растопить для получения питьевой воды!
Около 15% океана содержит морской лед, по крайней мере, часть года. Может показаться, что это немного, но это примерно 10 миллионов квадратных миль морского льда!
Интересно, что дальше?
Держись за зонтик! Завтра мы будем исследовать дикий мир погоды в Вандерополисе.
Попробуй
Хочешь поплавать? Обязательно проверьте следующие действия с другом или членом семьи:
- Готовы лично убедиться, как соль влияет на температуру замерзания воды? Пригласите друга или члена семьи и проведите этот простой научный эксперимент дома.
 Вам понадобится всего несколько простых принадлежностей: две пустые пластиковые бутылки (бутылки с чистой водой отлично подойдут!), соль, вода и морозильник. Наполните обе пластиковые бутылки водой. Добавьте две столовые ложки соли в одну бутылку. Обязательно пометьте бутылки «простая вода» и «соленая вода». Когда вы закончите маркировку бутылок, положите их в морозильную камеру. Через час или два проверьте свои бутылки. Является ли бутылка с простой водой более прочной, чем бутылка с соленой водой? Точно так же океанской воде требуется больше времени и более низкие температуры, чтобы замерзнуть. Как это круто?
Вам понадобится всего несколько простых принадлежностей: две пустые пластиковые бутылки (бутылки с чистой водой отлично подойдут!), соль, вода и морозильник. Наполните обе пластиковые бутылки водой. Добавьте две столовые ложки соли в одну бутылку. Обязательно пометьте бутылки «простая вода» и «соленая вода». Когда вы закончите маркировку бутылок, положите их в морозильную камеру. Через час или два проверьте свои бутылки. Является ли бутылка с простой водой более прочной, чем бутылка с соленой водой? Точно так же океанской воде требуется больше времени и более низкие температуры, чтобы замерзнуть. Как это круто? - Если вы хотите увидеть, как волны влияют на замерзающую океанскую воду, вы можете повторить свой эксперимент. Только на этот раз налейте в обе емкости простую воду. Установите таймер и медленно встряхивайте один из контейнеров каждые пять минут или около того. Это будет до некоторой степени имитировать эффект океанских волн. Примерно через час вы заметили разницу в прочности двух контейнеров? Замедлило ли действие волны процесс замерзания? Если нет, то почему вы думаете, что не увидели никакого эффекта? Вам нужно более постоянное движение, чтобы увидеть изменения? Поэкспериментируйте с различными типами волновых движений и более частым таймингом, если вам интересно узнать больше!
- О чем вы думаете, когда слышите слова «соль» и «вода»? Некоторым на ум приходит сладкое, липкое вещество, известное как ириски с соленой водой.
 Если вы настроены на сладкое удовольствие, зайдите в Интернет, чтобы проверить домашнюю ириску с соленой водой за один час. Получайте удовольствие, готовя вкусное угощение, которое обязательно понравится всем!
Если вы настроены на сладкое удовольствие, зайдите в Интернет, чтобы проверить домашнюю ириску с соленой водой за один час. Получайте удовольствие, готовя вкусное угощение, которое обязательно понравится всем!
Wonder Sources
- http://oceanservice.noaa.gov/facts/oceanfreeze.html
- http://www.ehow.com/facts_5300647_salt-water-freeze.html
- http://www.waynesthisandthat.com/saltice.html
- http://en.wikipedia.org/wiki/Sea_ice
Вы поняли?
Проверьте свои знания
Wonder Contributors
Благодарим:
Anne
за ответы на вопросы по сегодняшней теме Wonder!
Продолжайте удивляться вместе с нами!
Что вас интересует?
Wonder Words
- температура
- пресноводный
- водород
- кислород
- молекула
- соль
- вода
- пруд
- заморозить
- лед
- полярный
- ручей
- река
- кристаллический
- движение
- волна
- океан
- частица
Примите участие в конкурсе Wonder Word
Оцените это чудо
Поделись этим чудом
×
ПОЛУЧАЙТЕ СВОЕ ЧУДО ЕЖЕДНЕВНО
Подпишитесь на Wonderopolis и получайте
Чудо дня® по электронной почте или SMS
Присоединяйтесь к Buzz
Не пропустите наши специальные предложения, подарки и рекламные акции. Узнай первым!
Узнай первым!
Поделитесь со всем миром
Расскажите всем о Вандополисе и его чудесах.
Поделиться Wonderopolis
Wonderopolis Widget
Хотите делиться информацией о Wonderopolis® каждый день? Хотите добавить немного чуда на свой сайт? Помогите распространить чудо семейного обучения вместе.
Добавить виджет
Ты понял!
Продолжить
Не совсем!
Попробуйте еще раз
льда | Национальное географическое общество
Лед — это вода в замерзшей твердой форме. Лед часто образуется на озерах, реках и в океане в холодную погоду. Он может быть очень толстым или очень тонким. Проявляется в виде мороза, снега, мокрого снега и града.
Вода замерзает при температуре ноль градусов по Цельсию (32 градуса по Фаренгейту). Как только вода приближается к точке замерзания, молекулы воды начинают расширяться. В небольшом пространстве эти расширяющиеся молекулы могут создавать большое давление. Вот почему ледяная вода зимой может лопнуть даже самые тяжелые металлические трубы. Это также причина, по которой ваш лоток для льда дома может выглядеть так, будто он переполнен льдом, даже если вы наполнили его водой только наполовину. Если вода замерзнет в трещине в скале, лед может в конечном итоге разбить скалу на части. Из-за этих мощных свойств лед играет очень важную роль в процессах выветривания, когда камни разбиваются на более мелкие части, и эрозии, когда камни и земля вымываются или перемещаются в другие места.
В небольшом пространстве эти расширяющиеся молекулы могут создавать большое давление. Вот почему ледяная вода зимой может лопнуть даже самые тяжелые металлические трубы. Это также причина, по которой ваш лоток для льда дома может выглядеть так, будто он переполнен льдом, даже если вы наполнили его водой только наполовину. Если вода замерзнет в трещине в скале, лед может в конечном итоге разбить скалу на части. Из-за этих мощных свойств лед играет очень важную роль в процессах выветривания, когда камни разбиваются на более мелкие части, и эрозии, когда камни и земля вымываются или перемещаются в другие места.
Расширенные молекулы делают лед намного легче жидкой воды, поэтому лед плавает. Айсберг весом в несколько тонн все еще может легко плавать в океане, точно так же, как кусок льда легко плавает в вашей чашке с водой или содовой.
Вода покрывает более 70 процентов поверхности Земли. Чуть более двух процентов воды Земли замерзло в лед; почти весь этот лед находится в ледниках, представляющих собой огромные массы льда. Сегодня ледники встречаются во многих горных районах и в полярных районах Земли.
Сегодня ледники встречаются во многих горных районах и в полярных районах Земли.
Ледяные щиты
Ледники, покрывающие более 50 000 квадратных километров суши, называются ледяными щитами. Северный и Южный полюса Земли покрыты ледяными щитами. На самом деле почти весь континент Антарктиды покрыт льдом. Антарктический ледяной щит размером примерно с Соединенные Штаты и Мексику вместе взятые. Ледяной щит Гренландии у Северного полюса в три раза больше Техаса. В прошлые ледниковые периоды континентальные ледяные щиты, подобные тем, что на полюсах, покрывали огромные части Северной Америки и Европы.
Крупные площади, покрытые льдом, площадью менее 50 000 квадратных километров называются ледяными полями.
Морской лед
Замерзшую океанскую воду называют морским льдом. В то время как айсберги образуются на суше, а затем откалываются в море, в океане образуется морской лед. Лед, переживший один сезон таяния, называется старым льдом. Каждую осень большие участки северо-восточной Канады в Гудзоновом заливе замерзают. Белые медведи охотятся на тюленей под покровом старого морского льда Гудзонова залива. Весной, когда лед тает, белые медведи возвращаются на сушу. Они едят очень мало, пока осенью океан снова не замерзнет.
Каждую осень большие участки северо-восточной Канады в Гудзоновом заливе замерзают. Белые медведи охотятся на тюленей под покровом старого морского льда Гудзонова залива. Весной, когда лед тает, белые медведи возвращаются на сушу. Они едят очень мало, пока осенью океан снова не замерзнет.
Подвижный морской лед, свободно плавающий в океане, не связанный с какой-либо береговой линией, называется дрейфующим льдом. Существует множество различных видов дрейфующего льда. Совокупность айсбергов и льда шириной не более 2 метров (6,5 футов), например, называется битым льдом.
Мелкий лед представляет собой тонкий слой кристаллов пресной воды, образующийся при взаимодействии льда с поверхностью океана. Frazil также образуется через холодные, быстро текущие ручьи.
Жирный лед представляет собой тонкое скопление мелкой крошки. Жирный лед толще мелкозернистого, но недостаточно прочный, чтобы быть настоящим айсбергом или льдиной. Жирный лед делает океан чем-то похожим на нефтяное пятно. Тонкий застывший слой жирного льда называется ледяной коркой. Слякоть, губчатое скопление жирного льда называется шугой.
Тонкий застывший слой жирного льда называется ледяной коркой. Слякоть, губчатое скопление жирного льда называется шугой.
Измельченный и жирный лед создают новый лед нилас, который обычно прозрачен. Иногда лед нилас и старый лед разного возраста смерзаются вместе, образуя лед брекчии.
В отличие от дрейфующего льда, припай прикрепляется к берегу или морскому дну и не двигается под действием ветра или течений. Большая площадь скопившегося дрейфующего льда называется паковым льдом. Льдина — это плавучий кусок льда шириной менее 10 километров.
Черный лед
Когда вода попадает на холодную дорогу и быстро замерзает, образуется тонкий прозрачный слой льда, называемый черным льдом. Его называют черным льдом, потому что в отличие от снега, который белый, черный лед прозрачен, открывая черную дорогу под ним.
Якорный лед
В чрезвычайно турбулентных условиях вода может упасть ниже точки замерзания, не замерзнув. В этих условиях образуются крошечные отдельные кристаллы льда, образующие вязкую смесь. Эти слякотные куски льда могут накапливаться и прилипать ко дну рек или океанов, становясь якорным льдом.
В этих условиях образуются крошечные отдельные кристаллы льда, образующие вязкую смесь. Эти слякотные куски льда могут накапливаться и прилипать ко дну рек или океанов, становясь якорным льдом.
Сухой лед
Замороженный диоксид углерода, называемый сухим льдом, уникален тем, что он плавится непосредственно в газообразное состояние, минуя жидкую стадию. При температуре более 100 градусов ниже нуля (по Фаренгейту) сухой лед очень эффективно охлаждает вещи, но также может представлять опасность. Прикосновение к сухому льду может вызвать обморожение.
Краткий факт
Конденсат Бозе-Эйнштейна
Лед холодный, но не в самом холодном состоянии. Существует странное четвертое состояние материи (добавленное к известному списку жидкостей, твердых и газообразных), называемое конденсатом Бозе-Эйнштейна, которое возникает, когда атомы приближаются к абсолютному нулю, температуре, при которой прекращается всякое движение атомов. Когда это происходит, атомы теряют свои индивидуальные свойства и сливаются в единый «суператом».


 Температура же в процессе замерзания или при кипении остается неизменной.
Температура же в процессе замерзания или при кипении остается неизменной. Чем крупнее животное, тем глубже от него след, следовательно, тем большее давление оно оказывает на снег. Следы собаки более глубокие, чем следы её щенков. Мыши, ласки оставляет неглубокие чёрточки. Природа снабдила копытных животных способностью раздвигать копыта и увеличивать площадь опоры. Это помогает им зимой при передвижение по заснеженному лесу и полям не так глубоко погружаться в снег.
Чем крупнее животное, тем глубже от него след, следовательно, тем большее давление оно оказывает на снег. Следы собаки более глубокие, чем следы её щенков. Мыши, ласки оставляет неглубокие чёрточки. Природа снабдила копытных животных способностью раздвигать копыта и увеличивать площадь опоры. Это помогает им зимой при передвижение по заснеженному лесу и полям не так глубоко погружаться в снег.