Содержание
Формула воды — интернет энциклопедия для студентов
ОПРЕДЕЛЕНИЕ
Вода (оксид водорода) представляет собой бинарное неорганическое соединение.
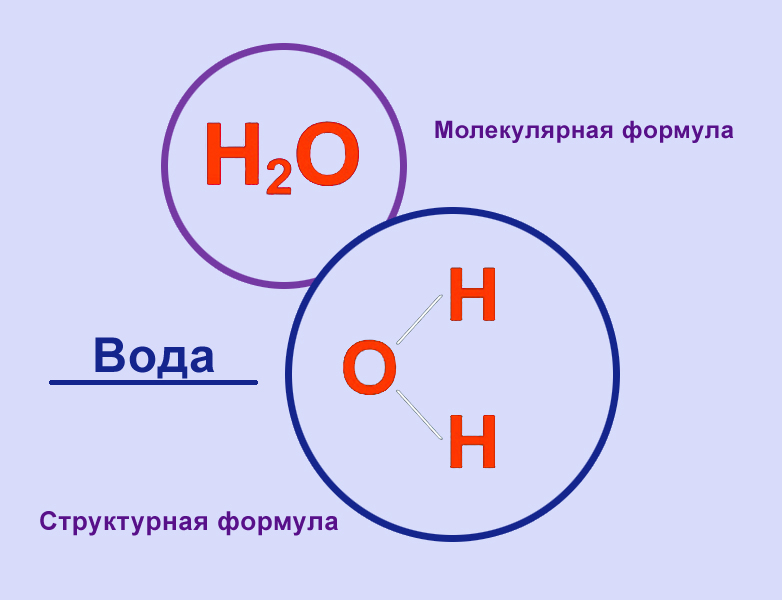
Химическая и структурная формула воды
Структурная формула:
Химическая и структурная формула воды
Молярная масса: 18,01528 г / моль.
Альтернативные названия: оксид водорода, гидроокись водорода, гидроксикислота, двуокись водорода, оксидан, оксид дигидромона.
Атом кислорода в молекуле воды находится в состоянии sp3-гибридизации, поскольку в образовании гибридных орбиталей участвует не только валентные электроны, но и одиночные электронные пары. Гибридные орбитали направлены на вершины тетраэдра:
Из-за большой разницы в электроотрицательности кислорода и водорода связи в молекуле сильно поляризованы, а электронная плотность сдвигается к кислороду. Молекула воды имеет большой дипольный момент, поскольку полярные связи асимметричны.
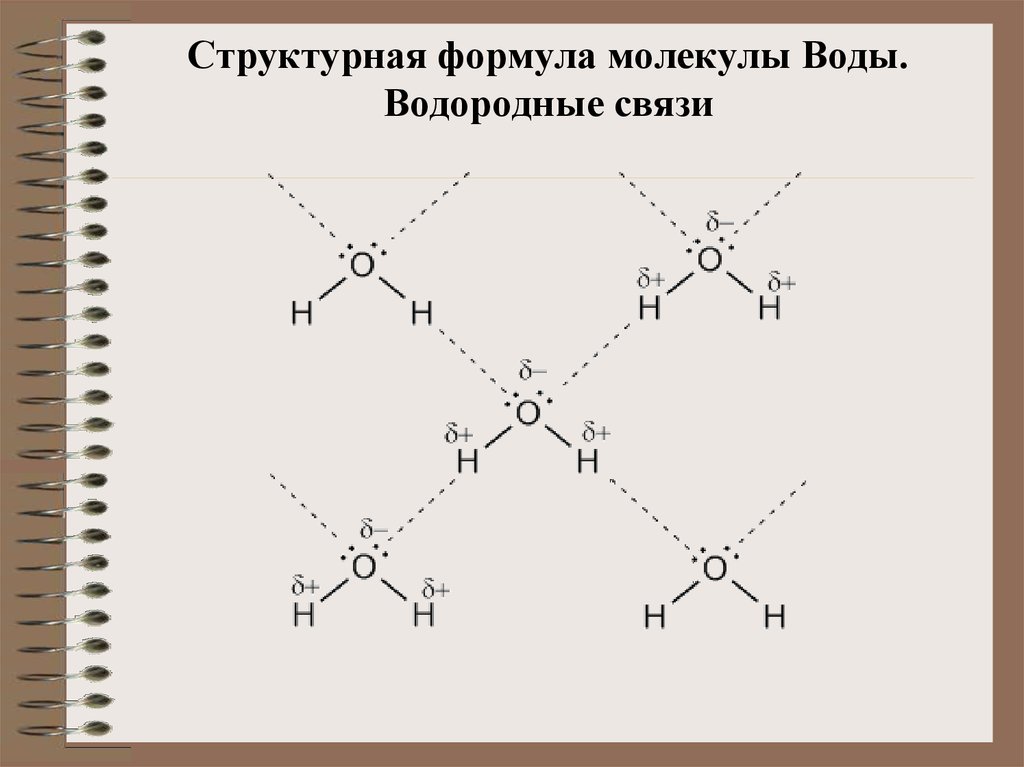
Образование водородных связей между молекулами воды связано с сильной поляризацией O-H-связи. Каждая молекула воды может образовывать до четырех водородных связей — два из них образуют атом кислорода, а еще два — атомы водорода:
Каждая молекула воды может образовывать до четырех водородных связей — два из них образуют атом кислорода, а еще два — атомы водорода:
Образование водородных связей определяет более высокую температуру кипения, вязкость и поверхностное натяжение воды по сравнению с гидридами аналогов (селен и серу теллура).
Изотопная модификация воды
В зависимости от типа изотопов водорода, которые составляют молекулу, выделяются следующие изотопные модификации воды:
\(\
\begin{array}{|c|c|}
\hline
Название&Формула\\ \hline
Легкая вода (основной компонент природной воды)& \mathrm{H}_{2} \mathrm{O}\\ \hline
Тяжёлая вода (дейтериевая)& \mathrm{D}_{2} \mathrm{O}\\ \hline
Сверхтяжёлая вода (тритиевая)& \mathrm{T}_{2} \mathrm{O}\\ \hline
Тритий-дейтериевая вода&\mathrm{TDO}\\ \hline
Тритий-протиевая вода&\mathrm{THO}\\ \hline
Дейтерий-протиевая вода&\mathrm{DHO}\\ \hline
\end{array}
\)
Учитывая тот факт, что кислород имеет три стабильных изотопа \(\
^{16} \mathrm{O},^{17} \mathrm{O} и n^{18} \mathrm{O}
\) , можно сделать 18 формул молекул воды, отличающихся изотопным составом. Как правило, природная вода содержит все эти типы молекул.
Как правило, природная вода содержит все эти типы молекул.
Примеры решения проблем по «водной формуле»
ПРИМЕР 1
9 литров воды выливали в радиатор автомобиля и добавляли 2 литра метилового спирта с плотностью 0,8 г / мл. При какой минимальной температуре вы можете оставить автомобиль на открытом воздухе, не опасаясь, что вода в радиаторе замерзнет (криоскопическая постоянная воды составляет 1,86 K • кг / моль)?
Согласно закону Рауля понижение температуры кристаллизации разбавленных растворов неэлектролитов равно:
\(\
\Delta t_{c r}=K_{c r} \cdot C_{m}=\frac{K_{c r} \cdot m_{B} \cdot 1000}{m_{A} \cdot M_{B}}
\) где: \(\
\Delta t_{c r}
\) — понижение температуры замерзания раствора; \(\
\mathrm{KCR}
\) — константа криоскопического растворителя; \(\
\mathrm{Cm}
\) — мольная концентрация раствора; \(\
\mathrm{mB}
\) — масса растворенного вещества; \(\
mA
\) — масса растворителя; МБ — это молярная масса растворенного вещества. {\circ} C
{\circ} C
\)
\(\
Tzam=0-\Delta t=-10,3
\)
Автомобиль можно оставить на улице при температуре выше -10,3 ° C
ПРИМЕР 2
Сколько грамм \(\
\mathrm{Na} 2 \mathrm{SO} 4
\) • \(\
10 \mathrm{H} 20
\) следует растворить в 250 г воды, чтобы получить раствор, содержащий 5% безводную соль?
Молярная масса \(\
\mathrm{Na} 2504
\) равна:
\(\
M\left(N a_{2} S O_{4}\right)=142
\) г / моль
Молярная кристаллическая гидратная масса:
\(\
M\left(N a_{2} S O_{4} \cdot 10 H_{2} O\right)=322
\) г / моль
Обозначим количество (моль) растворенной соли в виде х.
Тогда масса решения будет равна:
\(\
m(p-p a)=m\left(N a_{2} S O_{4} \cdot 10 H_{2} O\right)+m\left(H_{2} O\right)=x \cdot 322+250
\)
Масса безводной соли в готовом растворе будет равна:
\(\
m\left(N a_{2} S O_{4}\right)=x \cdot 142
\)
Массовая доля сульфата натрия в растворе:
\(\
\omega=\frac{m\left(N a_{2} S O_{4}\right)}{m(\mathrm{p}-\mathrm{pa})}=\frac{142 \cdot \mathrm{x}}{322 \cdot \mathrm{x}+250} \cdot 100=5
\)
Отсюда \(\
\mathbf{x}
\) будет равен:
\(\
14200 x=5 \cdot(322 x+250)
\)
\(\
12590 x=1250
\)
\(\
x=0,0993
\) моль
Масса кристаллического гидрата будет равна:
\(\
m\left(N a_{2} S O_{4} \cdot 10 H_{2} O\right)=0,0993 \cdot 322=31,97=31. 97 г.
97 г.
\)
Масса \(\
\mathrm{Na}_{2} \mathrm{SO}_{4} \cdot 10 \mathrm{H}_{2} \mathrm{O}
\) будет равна 31,97 г.
Физика
166
Реклама и PR
31
Педагогика
80
Психология
72
Социология
7
Астрономия
9
Биология
30
Культурология
86
Экология
8
Право и юриспруденция
36
Политология
13
Экономика
49
Финансы
9
История
16
Философия
8
Информатика
20
Право
35
Информационные технологии
6
Экономическая теория
7
Менеджент
719
Математика
338
Химия
20
Микро- и макроэкономика
1
Медицина
5
Государственное и муниципальное управление
2
География
542
Информационная безопасность
2
Аудит
11
Безопасность жизнедеятельности
3
Архитектура и строительство
1
Банковское дело
1
Рынок ценных бумаг
6
Менеджмент организации
2
Маркетинг
238
Кредит
3
Инвестиции
2
Журналистика
1
Конфликтология
15
Этика
9
Хлорирование метана Формула алканов Формула соляной кислоты Макс Боденштейн, немецкий химик
Узнать цену работы
Узнай цену
своей работы
Имя
Выбрать тип работыЧасть дипломаДипломнаяКурсоваяКонтрольнаяРешение задачРефератНаучно — исследовательскаяОтчет по практикеОтветы на билетыТест/экзамен onlineМонографияЭссеДокладКомпьютерный набор текстаКомпьютерный чертежРецензияПереводРепетиторБизнес-планКонспектыПроверка качестваЭкзамен на сайтеАспирантский рефератМагистерскаяНаучная статьяНаучный трудТехническая редакция текстаЧертеж от рукиДиаграммы, таблицыПрезентация к защитеТезисный планРечь к дипломуДоработка заказа клиентаОтзыв на дипломПубликация в ВАКПубликация в ScopusДиплом MBAПовышение оригинальностиКопирайтингДругое
Принимаю Политику
конфиденциальности
Подпишись на рассылку,
чтобы не пропустить информацию об акциях
Структура воды и ее свойства
Рубрики
Поиск
Популярные
Насколько вода необходима живым существам, известно, пожалуй, каждому. Она служит основным элементом организма человека, обеспечивающим нормальное функционирование всех органов и терморегуляцию, участвует в большинстве химических реакций, происходящих в клетках, является транспортером питательных веществ, кислорода, помогает усваивать питательные вещества и выполняет ряд других полезных функций.
Она служит основным элементом организма человека, обеспечивающим нормальное функционирование всех органов и терморегуляцию, участвует в большинстве химических реакций, происходящих в клетках, является транспортером питательных веществ, кислорода, помогает усваивать питательные вещества и выполняет ряд других полезных функций.
Наука не дает точных рекомендаций по поводу того, сколько воды необходимо выпивать человеку в сутки, однако бесспорным является тот факт, что употреблять можно исключительно очищенный питьевой ресурс, не несущий вреда организму. Чтобы разобраться в том, что такое чистая вода, следует изучить структурную формулу и ее основные свойства.
Структурная формула молекулы воды
С точки зрения химии, молекула воды довольно проста: состоит она из двух атомов водорода и одного атома кислорода, соответственно, структурная формула записывается как h3O. Каждый из атомов водорода соединяется с кислородом одной ковалентной связью, поэтому формулу еще можно отобразить как H-O-H.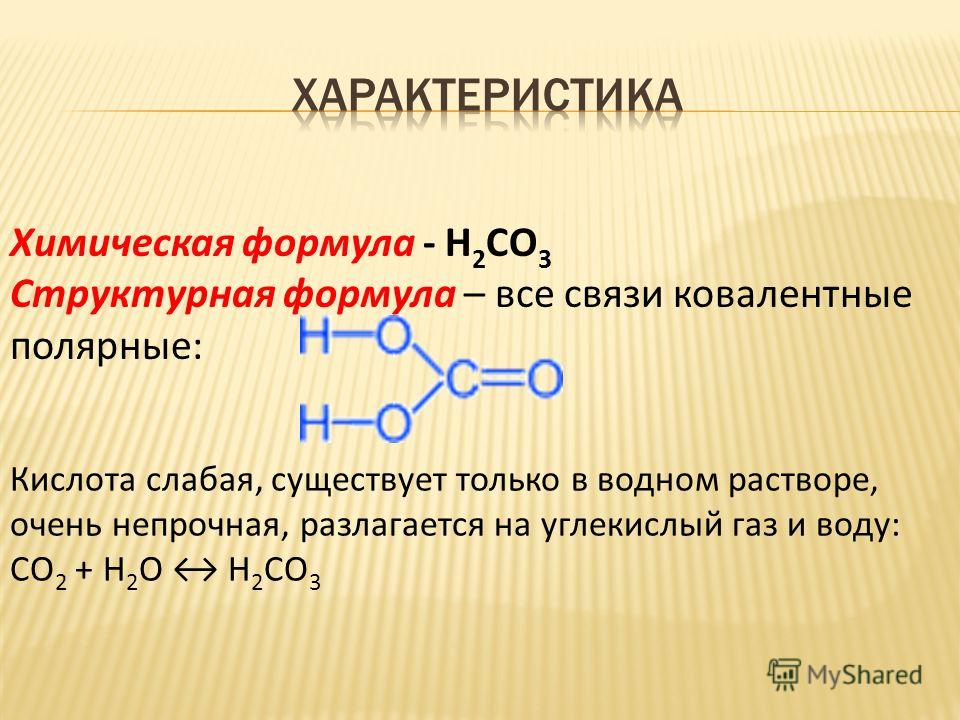 Структура Н2О представляет собой особую взаимозависимость молекул с высокой диэлектрической проницаемостью, с которой может соревноваться лишь ряд кислот цианистого водорода. Для примера, показатель проницаемости Н2О — 81, в то время, как у большинства других тел этот показатель колеблется в пределах 2-3. Эта химическая субстанция способна лучшим образом растворять другие вещества, окислять практически любые горные породы и оказывать разрушительное воздействие на металл.
Структура Н2О представляет собой особую взаимозависимость молекул с высокой диэлектрической проницаемостью, с которой может соревноваться лишь ряд кислот цианистого водорода. Для примера, показатель проницаемости Н2О — 81, в то время, как у большинства других тел этот показатель колеблется в пределах 2-3. Эта химическая субстанция способна лучшим образом растворять другие вещества, окислять практически любые горные породы и оказывать разрушительное воздействие на металл.
Вода уникальна своими свойствами, молекулы обладают способностью хорошо «слипаться» друг с другом, что является объяснением многих ее характеристик. Например, одним из важных свойств является высокая теплопроводность и температура кипения. Чтобы испарить один литр Н2О, потребуется намного больше времени, чем на испарение многих других жидких составов.
Свойства структуры воды
В естественном состоянии Н2О представляет собой прозрачную субстанцию без запаха, цвета и вкуса. Причем благодаря водородной связи она остается жидкой в широком диапазоне температур. В твердом состоянии она преобразуется в лед, а в газообразном становится паром. Структурная функция воды может быть следующих видов:
В твердом состоянии она преобразуется в лед, а в газообразном становится паром. Структурная функция воды может быть следующих видов:
- наполняющая — Н2О наполняет все клетки организма человека влагой. От уровня ее нехватки в организме могут наблюдаться такие явления, как сильное чувство жажды, сморщивание кожных покровов, пересушивание слизистых оболочек. При глобальном обезвоживании у человека могут наступить расстройства психики, галлюцинации и даже смертельный исход;
- растворяющая — чтобы обеспечить доставку питательных веществ в клетки организма, вода растворяет их в себе. Также она способствует выведению продуктов жизнедеятельности из организма естественным путем, обеспечивает правильный обмен веществ;
- транспортная — благодаря свойству высокого натяжения Н2О может проникать в самые тонкие капилляры, обеспечивая питание организму;
- в качестве терморегулятора — поддерживает нормальную температуру тела, обладая свойствами испарения и теплоемкости.

Все вышеприведенные функции в полной мере проявляются в чистом ресурсе, поэтому крайне важно следить за качеством потребляемой жидкости, периодически проводить лабораторные исследования и в случае обнаружения плохих показателей использовать дополнительные фильтры. А вы уже успели заказать фильтрующую установку? Не стоит откладывать это решение на потом, о здоровье своем и близких нужно позаботиться уже сегодня!
Вода — молекула, формула, структура, свойства
Что такое молекула воды?
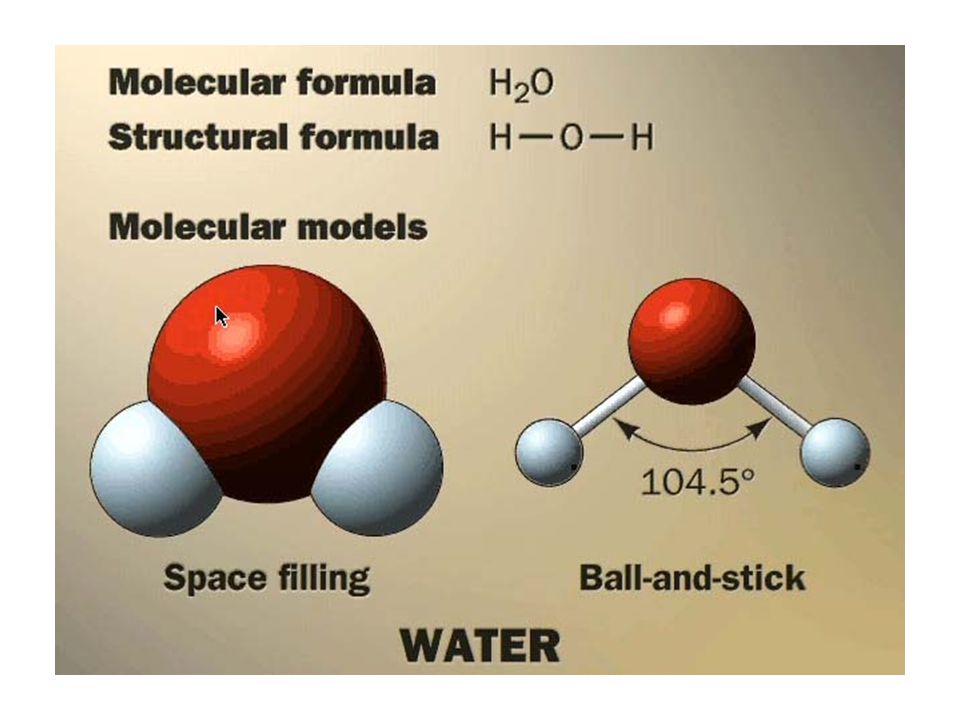
Молекула воды , химическая формула H 2 O , состоящая из атомов кислорода и водорода, существующая в нашей земной среде в виде кристаллического твердого, жидкого или газообразного состояния. Это бесцветная жидкость без вкуса, имеющая V-образную структуру.
Вода – необходимая жидкость, способная растворять многие неорганические и органические соединения или химические элементы. Жидкое и твердое состояния воды возникают благодаря существованию водородных связей.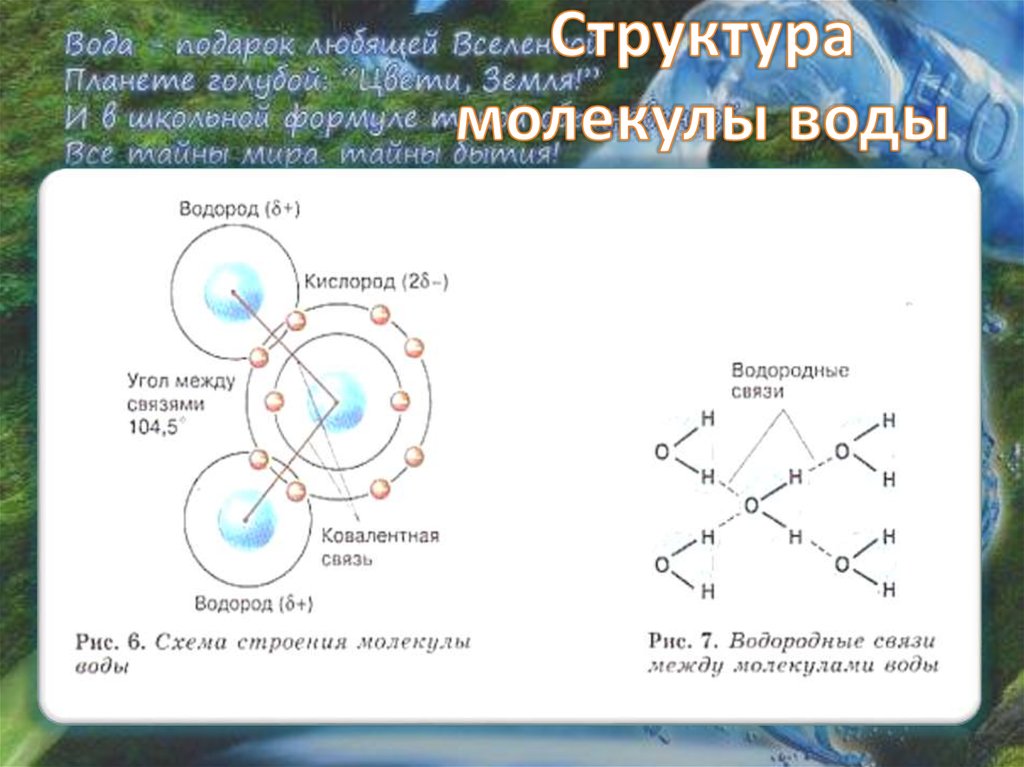
Молекулярная масса H 2 O составляет 18 г·моль −1 с температурой плавления 0 °C и температурой кипения 100 °C. Вода имеет амфипротонное вещество и обладает свойствами действовать как кислота или основание.
Значение воды в жизни человека
- Вода очень важна для жизни человека или живого организма.
- Он составляет большую часть нашего тела.
- Это связано с основной биологической функцией нашего тела.
- Каждая часть нашего тела использует воду для регулирования температуры тела.
- Помогает выводить отходы из нашего организма и контролировать работу человеческого мозга.
Наличие гигиенически безопасной и чистой питьевой воды для бытовых нужд является большой проблемой во всем мире. Поэтому мы использовали много методов для его сохранения.
Удаление сточных вод, промышленные отходы, серная кислота, азотная кислота, удобрения, инсектициды и моющие средства являются основными загрязнителями, вызывающими загрязнение воды в окружающей среде
Структура молекулы воды
Электронная конфигурация валентной оболочки центрального атома кислорода в молекуле воды: 2s 2 2p x 2 2p y 1 2p
8 1
8 z Все эти четыре атомные орбитали гибридизуются, образуя четыре эквивалентные sp 3 тетраэдрические гибридные орбитали.
Две из этих четырех гибридизованных орбиталей содержат однократно занятые электроны. Эти две орбитали перекрываются с двумя 1s-орбиталями атома водорода, образуя две ковалентные связи. Остальные две орбитали содержат по две электронные пары.
Из-за наличия пар электронов на центральном атоме H 2 O представляет собой молекулу v-образной формы с валентным углом H-O-H, равным 105,5°.
Свойства воды
- H 2 Молекулы O полярны.
- Универсальный растворитель. Он растворяет большинство полярных и ионных веществ.
- Теплоёмкость воды очень велика. Для повышения температуры на один градус требуется большое количество энергии.
- Жидкость H 2 Молекулы O плотнее льда, потому что кристаллы льда содержат огромное пустое пространство.
- Обладает когезионными и адгезивными свойствами. Когезионные свойства воды, ответственные за поверхностное натяжение.
Физические свойства
Небольшое количество воды кажется бесцветным. Большое количество молекул представляет собой жидкость синего цвета из-за поглощения атомами красного света.
Большое количество молекул представляет собой жидкость синего цвета из-за поглощения атомами красного света.
Появляется в двух формах: твердой и мягкой. В настоящее время жесткость или мягкость и уровень pH воды изменяются из-за образования кислотных дождей и растворения материалов. Это вредное воздействие на биологические системы растений и животных.
| Молекулярная формула | Н 2 О | |
| Молярная масса | 18 г моль −1 | |
| Температура плавления | 0,00 °C или 32,00 °F или 273,15 K | |
| Точка кипения | 99,98 °C или 211,96 °F или 373,13 K | |
| Плотность (г/мл) | Жидкость | Твердый |
| При 0 °C: 0,9998396 При 0 °C: 0,9970474 | При 0 °C: 0,9167 | |
| Конъюгированная кислотно-щелочная пара | Кислота | База |
| ион гидроксония (H 3 O + ) | ион гидроксида (OH − ) | |
| Теплоемкость | 75,385±0,05 Дж моль -1 К -1 | |
| Кристаллическая структура | шестигранник | |
| Дипольный момент | 1,8546 Д | |
Полярность H
2 Молекула O
Электроотрицательность и сродство к электрону кислорода намного выше, чем у водорода.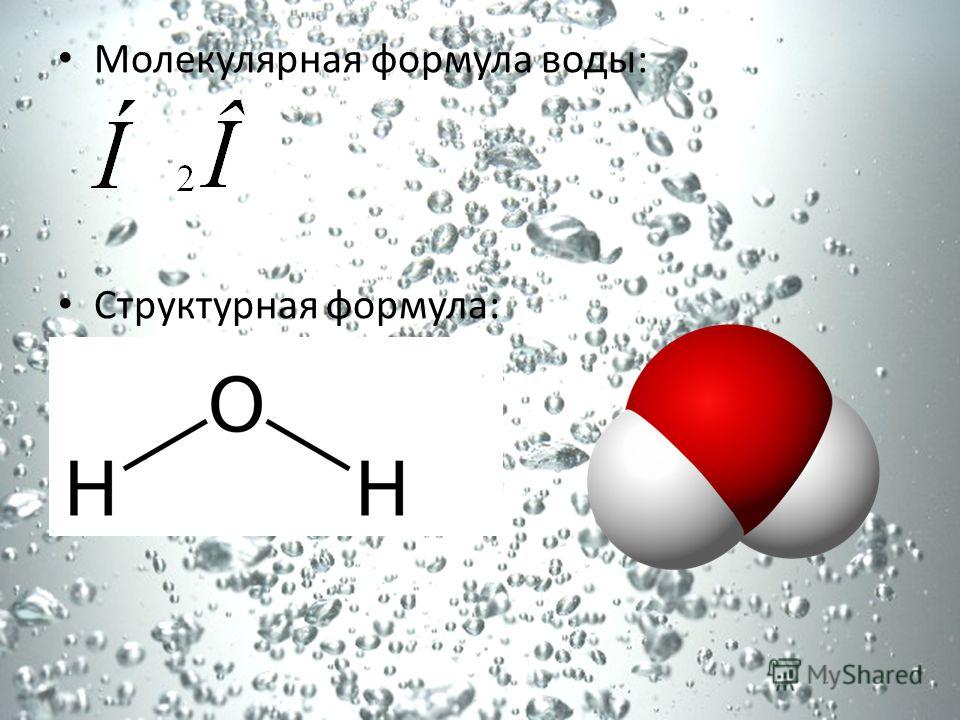 Следовательно, электрическая поляризация возникает за счет приобретения частичного положительного заряда на водороде и частичного отрицательного заряда на атоме кислорода.
Следовательно, электрическая поляризация возникает за счет приобретения частичного положительного заряда на водороде и частичного отрицательного заряда на атоме кислорода.
Полярность молекулы H 2 O обусловлена двумя фактами:
- Дипольный момент из-за различий в электроотрицательности кислорода и водорода.
- Наличие двухэлектронных пар у центрального атома кислорода с v-образной структурой.
Проводимость чистой воды
Чистый раствор не является хорошим проводником электричества. Он слегка диссоциирует и ведет себя как слабый электролит. Удельная электропроводность чистой воды при 25 °C составляет 0,58 × 10 -7 Ом -1 см -1 .
Структура льда
Кристаллическая структура льда представляет различные типы сложных структур в химии. Молекула льда сформировала девять сложных кристаллических решеток, установленных в соответствии с различными диапазонами температуры и давления.
В обычных формах замерзает при 0°C и давлении 1 атм, имеет гофрированную гексагональную структуру. В этой структуре каждое звено H 2 O окружено тетраэдрически атомами кислорода четырех других молекул H 2 O посредством водородных связей, протянувшихся по всей структуре.
Что происходит, когда лед превращается в воду?
В ледяных кристаллах есть огромные пустые пространства. У каждого атома кислорода есть два ближних и два дальних соседа.
- При очень низкой плотности и очень низкой температуре около -120 °C наблюдается кубическая кристаллическая решетка льда. Экспериментальная нулевая энтропия льда составляет 3,4 Дж·моль 9 .0017 −1 .
- Когда количество молекул H 2 O объединяется, положительный конец одного диполя атакует отрицательный конец другого диполя. Следовательно, молекулы H 2 O связаны вместе, образуя кластер (H 2 O) n ,
- В газовой фазе молекулы воды такой водородной связи или ассоциации не обнаружено.

Кислота и основание в H
2 Раствор O
Протоны объединяются с молекулой воды с образованием H 3 O + или ионы гидроксония. Процесс кислотно-щелочной нейтрализации в воде включает диффузию протона к основанию.
Реакция химического равновесия H 2 O,
H 2 O → H + + OH −
Ионный продукт,
k w 9 O 0 = 0 [0] [H + ] [OH − ]
Ионное произведение постоянно равно 10 −14 . Концентрация ионов водорода и гидроксила в H 2 O раствор обратно пропорциональны друг другу.
- Действует как кислота в присутствии более сильного основания. Например,
NH 3 + H 2 O → NH 4 + + OH − - В присутствии кислот ведет себя как основание, присоединяя протон. Например,
HSO 4 − + H 2 O → H 3 O + + SO 4 −2
Жесткая и мягкая вода
Универсальная вода-растворитель подразделяется на два типа: жесткая и мягкая, в зависимости от растворенных минералов.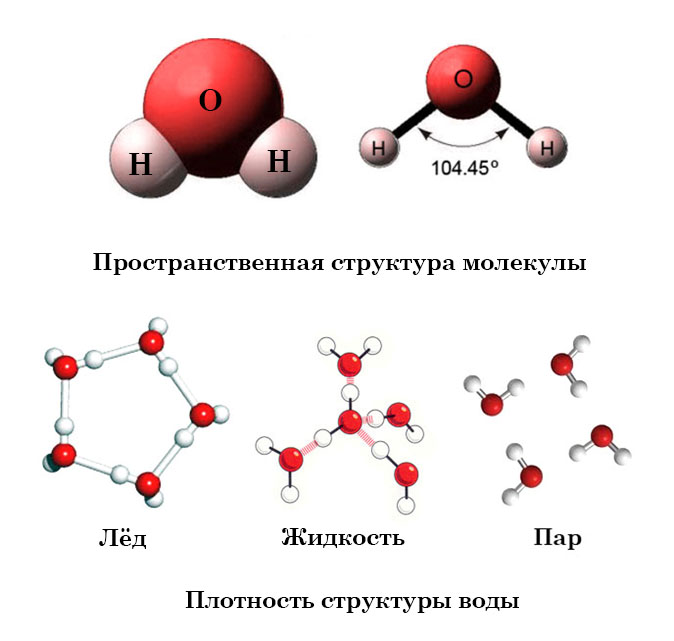 Некоторые из этих минералов полезны для нашего здоровья.
Некоторые из этих минералов полезны для нашего здоровья.
Что такое жесткая вода?
Содержит поваренную соль кальция и магния. Эти ионы образуют нерастворимые осадки с фабричным материалом. Такие типы растворов называются жесткой водой. Бикарбонат кальция и натрия временно делает раствор жестким.
Если растворы содержат растворимые сульфаты кальция или магния, которые не выпадают в осадок при кипячении, вода называется постоянной жесткостью.
Что такое мягкая вода?
При кипячении можно удалить временную жесткость воды, но постоянную жесткость нельзя удалить простым способом.
- Твердые растворы размягчаются путем пропускания их через слои нерастворимых алюмосиликатов натрия или ионообменных смол (цеолитов).
- Полезный реагент, такой как ЭДТА, этилендиаминтетрауксусная кислота или калгон (гексаметафосфат натрия), используется для устранения жесткости воды для приготовления мягкого раствора.
Темы химии
Вода, что такое вода? О науке, химии и структуре
Вода имеет химическую формулу h3O, состоящую из двух атомов водорода и одного атома кислорода.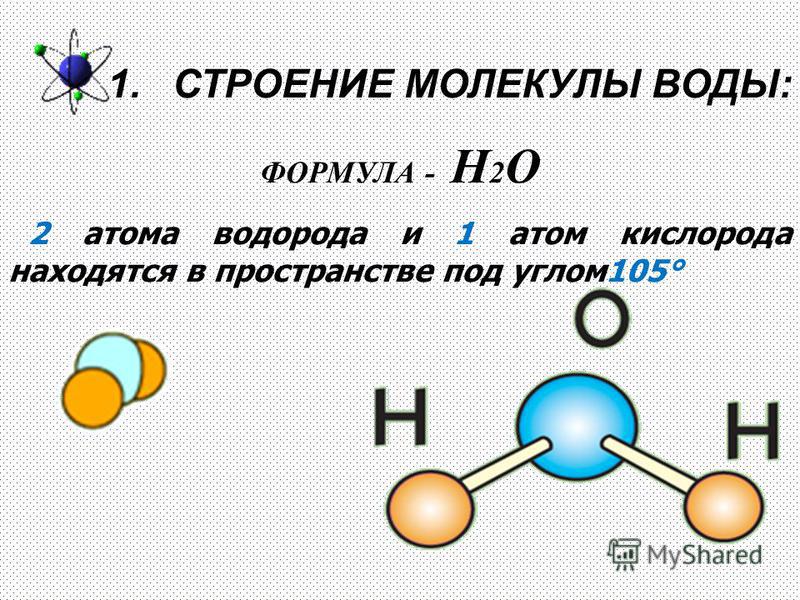 В науке его часто называют универсальным растворителем. Вода — единственное чистое вещество, встречающееся в природе во всех трех агрегатных состояниях: твердом; жидкость и газ. Вода может принимать разные формы; твердое состояние воды обычно называют льдом или аморфной твердой водой; газообразное состояние известно как водяной пар или пар; а общую жидкую фазу обычно называют просто водой.
В науке его часто называют универсальным растворителем. Вода — единственное чистое вещество, встречающееся в природе во всех трех агрегатных состояниях: твердом; жидкость и газ. Вода может принимать разные формы; твердое состояние воды обычно называют льдом или аморфной твердой водой; газообразное состояние известно как водяной пар или пар; а общую жидкую фазу обычно называют просто водой.
Важной особенностью воды является ее полярная природа. Молекула воды образует угол с атомами водорода на концах и кислородом в вершине. Поскольку кислород имеет более высокую электроотрицательность, чем водород, сторона молекулы с атомом кислорода имеет частичный отрицательный заряд. Молекула с такой разностью зарядов называется диполем. Различия зарядов заставляют молекулы воды притягиваться друг к другу (относительно положительные области притягиваются к относительно отрицательным областям) и к другим полярным молекулам. Это притяжение известно как водородная связь и объясняет многие свойства воды. Хотя водородная связь представляет собой относительно слабое притяжение по сравнению с ковалентными связями внутри самой молекулы воды, она отвечает за ряд физических свойств воды. Одним из таких свойств является относительно высокая температура плавления и кипения; требуется больше тепловой энергии, чтобы разорвать водородные связи между молекулами. Водородная связь также придает воде необычное поведение при замерзании. При охлаждении почти до точки замерзания наличие водородных связей означает, что молекулы, перестраиваясь для минимизации своей энергии, образуют гексагональную кристаллическую структуру льда, которая на самом деле имеет более низкую плотность: следовательно, твердая форма, лед, будет плавать в воде. . Другими словами, вода расширяется при замерзании, тогда как практически все другие материалы сжимаются при затвердевании.
Хотя водородная связь представляет собой относительно слабое притяжение по сравнению с ковалентными связями внутри самой молекулы воды, она отвечает за ряд физических свойств воды. Одним из таких свойств является относительно высокая температура плавления и кипения; требуется больше тепловой энергии, чтобы разорвать водородные связи между молекулами. Водородная связь также придает воде необычное поведение при замерзании. При охлаждении почти до точки замерзания наличие водородных связей означает, что молекулы, перестраиваясь для минимизации своей энергии, образуют гексагональную кристаллическую структуру льда, которая на самом деле имеет более низкую плотность: следовательно, твердая форма, лед, будет плавать в воде. . Другими словами, вода расширяется при замерзании, тогда как практически все другие материалы сжимаются при затвердевании.
Вода также является хорошим растворителем благодаря своей полярности. Когда ионное или полярное соединение входит в воду, оно окружено молекулами воды.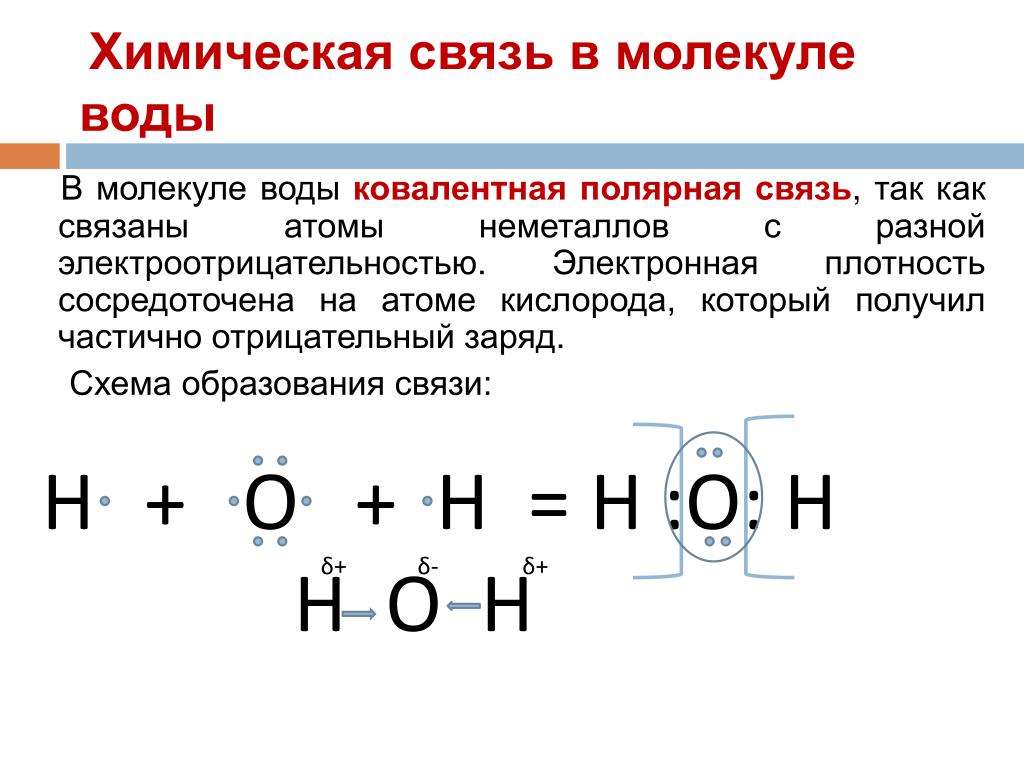 Относительно небольшой размер молекул воды обычно позволяет многим молекулам воды окружать одну молекулу растворенного вещества. Частично отрицательные дипольные концы воды притягиваются к положительно заряженным компонентам растворенного вещества, и наоборот, к положительным дипольным концам.
Относительно небольшой размер молекул воды обычно позволяет многим молекулам воды окружать одну молекулу растворенного вещества. Частично отрицательные дипольные концы воды притягиваются к положительно заряженным компонентам растворенного вещества, и наоборот, к положительным дипольным концам.
Обычно ионные и полярные вещества, такие как кислоты, спирты и соли, относительно растворимы в воде, а неполярные вещества, такие как жиры и масла, — нет. Неполярные молекулы остаются вместе в воде, потому что молекулам воды энергетически выгоднее связываться водородными связями друг с другом, чем участвовать в ван-дер-ваальсовых взаимодействиях с неполярными молекулами.
Примером ионного растворенного вещества является поваренная соль; хлорид натрия, NaCl, разделяется на катионы Na+ и анионы Cl-, каждый из которых окружен молекулами воды. Затем ионы легко переходят из своей кристаллической решетки в раствор. Примером неионогенного растворенного вещества является столовый сахар. Диполи воды образуют водородные связи с полярными областями молекулы сахара (ОН-группами) и позволяют ему уноситься в раствор.