Содержание
ВОДА | Энциклопедия Кругосвет
ВОДА – оксид водорода H2O.
В течение многих столетий вода считалась простым веществом. Лишь в 1783 французский химик Антуан Лоран Лавуазье (1743–1794) сумел разложить ее. Он показал, что вода состоит из водорода и кислорода, а в 1789 дал первую оценку ее количественного состава: 15% водорода и 85% кислорода. В дальнейшем количественный анализ воды проводили многие ученые. Долгое время образцовыми считались результаты французского химика и физика Жозефа Луи Гей-Люссака (1778–1850), полученные около 1808: 13,27% водорода и 86,73% кислорода. Только в 1821 шведский химик Йенс Якоб Берцелиус (1779–1848) и французский физик и химик Пьер Луи Дюлонг (1785–1838) сделали более правильный анализ воды и нашли, что она содержит 11,1% водорода и 88,9% кислорода, что очень близко к современным значениям (11,19% водорода и 88,81% кислорода).
Изучая объемные отношения реагирующих газов, Гей-Люссак показал, что один объем кислорода и два объема водорода при взаимодействии дают два объема водяного пара (при температуре выше 100° С). На основании этих результатов с учетом закона Авогадро был сделан вывод, что две частицы водяного пара образуются из одной частицы кислорода и двух частиц водорода. Таким образом была выведена формула воды H2O.
На основании этих результатов с учетом закона Авогадро был сделан вывод, что две частицы водяного пара образуются из одной частицы кислорода и двух частиц водорода. Таким образом была выведена формула воды H2O.
На нашей планете вода играет очень важную роль. В природе она совершает непрерывный круговорот. Под влиянием солнечной энергии жидкая вода (главным образом, в теплых морях и океанах) превращается в пар, который поднимается в верхние слои атмосферы. Это происходит благодаря тому, что водяной пар легче воздуха. Так происходит образование облаков, которые ветрами переносятся в другие части планеты, где в виде дождя и других осадков вода попадает на поверхность земли. Здесь она образует ручьи и реки, которые возвращают испаренную воду в океаны (рис. 1).
Чистой воды в природе нет. Даже наиболее чистая дождевая вода при падении через атмосферу растворяет газы и захватывает пыль. При ее испарении всегда остается небольшой остаток – около 0,03 г на литр. На поверхности земли вода дополнительно растворяет многие твердые вещества. Часть ее впитывается в почву. В глубине земли продолжается растворение различных веществ, так что при выходе на поверхность вода иногда образует минеральные источники. Ключевая и колодезная вода от растворенных в ней солей часто бывает жесткой.
Часть ее впитывается в почву. В глубине земли продолжается растворение различных веществ, так что при выходе на поверхность вода иногда образует минеральные источники. Ключевая и колодезная вода от растворенных в ней солей часто бывает жесткой.
Речная (пресная) вода содержит до 0,5 г растворенных солей в одном литре. В конце концов, все это попадает в море. Таким образом, море, испаряя чистую воду, получает взамен воду с растворенными в ней веществами. Количество солей, поставляемое реками в моря и океаны, огромно. Так, река Дон ежегодно вносит в Азовское море около 16 млн. т солей, Дунай в Черное море – 9 млн. т.
В океанской воде содержится около 35 г солей в литре. Столько же имеется в водах большинства морей. Однако для закрытых морей встречаются отклонения от средней солености, связанные с числом впадающих рек, средней температурой и другими факторами. Балтийское море содержит лишь 3–8 г солей на литр, а Красное – до 45 г. В соленых озерах содержание солей может быть намного больше: в Мертвом море – 228 г в одном литре, в оз. Эльтон – 270 г. В морской воде растворен, в основном, хлорид натрия; кроме того, имеются и другие соли натрия, магния, кальция.
Эльтон – 270 г. В морской воде растворен, в основном, хлорид натрия; кроме того, имеются и другие соли натрия, магния, кальция.
Для научной работы, а также для фармацевтических и других целей, воду перегоняют (рис. 2). Для этого ее превращают в пар, который затем охлаждают, получая чистую дистиллированную воду. Примеси остаются в перегонном сосуде.
Молекула воды имеет угловое строение с длиной связи О–Н 96 пм и валентным углом Н-О-Н 104,5°. Молекула воды полярна, ее дипольный момент равен 1,86 Д.(Д –дебай, 1 Д = 3,34·10-30 Кулон·м).
Природная вода содержит следы «тяжелой» воды (оксида дейтерия) D2O. Физические свойства H2O и D2O заметно различаются.
| H2O | D2O | |
| t плав.,°С | 0,0 | 3,8 |
| t кип., °С | 100,0 | 101,4 |
Свойства воды служат точкой отсчета для многих физических величин. Так, температуры замерзания и кипения воды лежат в основе шкалы Цельсия. Один литр – это объем 1 кг чистой воды, взвешенной при +4 °С (при этой температуре вода имеет максимальную плотность).
Так, температуры замерзания и кипения воды лежат в основе шкалы Цельсия. Один литр – это объем 1 кг чистой воды, взвешенной при +4 °С (при этой температуре вода имеет максимальную плотность).
Многие физические свойства воды аномальны по сравнению с другими жидкостями. Одной из причин этого служат малые размеры молекул воды – минимальные среди всех жидких веществ при обычных условиях. Однако наиболее важным свойством воды является ее способность образовывать прочные водородные связи.
В водяном паре при температуре кипения и атмосферном давлении присутствует около 1% димеров, в которых молекулы воды объединены в пары водородными связями. В жидком и твердом состоянии каждая молекула воды образует четыре водородные связи: две как донор протонов и две – как акцептор протонов. Водородные связи молекулы воды направлены приблизительно к вершинам правильного тетраэдра (рис. 3.).
Если бы водородных связей не было, то температуры плавления и кипения воды были бы существенно ниже, как это наблюдается у других водородных соединений неметаллов.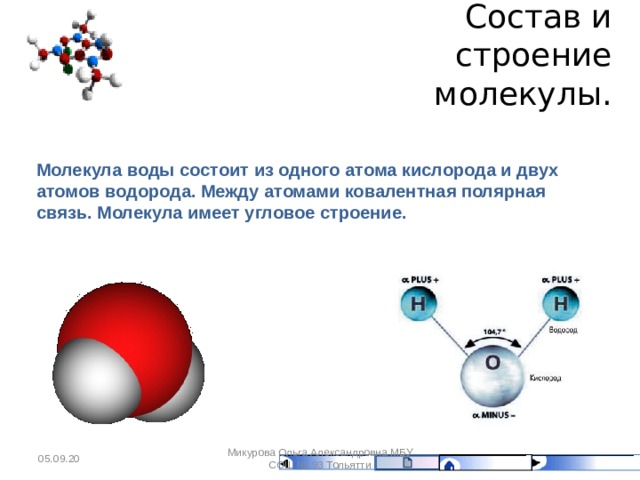 Водородные связи являются причиной и другого уникального свойства воды – при плавлении ее плотность возрастает. При 0°С плотность льда (0,9168 г/см3) меньше, чем плотности жидкой воды (0,9998 г/см3), поэтому лед плавает на поверхности воды. Если бы у льда была более высокая плотность, по мере замерзания он опускался бы на дно, что сделало бы жизнь в водоемах зимой невозможной.
Водородные связи являются причиной и другого уникального свойства воды – при плавлении ее плотность возрастает. При 0°С плотность льда (0,9168 г/см3) меньше, чем плотности жидкой воды (0,9998 г/см3), поэтому лед плавает на поверхности воды. Если бы у льда была более высокая плотность, по мере замерзания он опускался бы на дно, что сделало бы жизнь в водоемах зимой невозможной.
Чтобы превратить воду в пар, надо затратить много энергии – около 44 кДж/моль. При обратном переходе пара в жидкую воду выделяется то же количество теплоты.
Вода устойчива при нагревании вплоть до 1000°С. При более высоких температурах она частично разлагается на водород и кислород. Эти же продукты образуются при электролизе воды.
Разложение воды искрами электрической машины заметили еще в 1789, а годом позже воду разложили с помощью гальванического электричества. В России это впервые было сделано профессором С.-Петербургской Медико-Хирургической Академии В.В. Петровым летом 1802 посредством огромной «гальвани-вольтовой батареи», состоявшей из 4200 медных и цинковых кружков. Электролиз чистой воды идет очень медленно. Для более быстрого разложения воды электрическим током в нее добавляют какую-либо кислоту, щелочь или соль. Этот процесс иногда используют для получения чистого водорода и кислорода (рис. 4).
Электролиз чистой воды идет очень медленно. Для более быстрого разложения воды электрическим током в нее добавляют какую-либо кислоту, щелочь или соль. Этот процесс иногда используют для получения чистого водорода и кислорода (рис. 4).
Под действием УФ-излучения вода распадается на ионы Н+ и ОН–, а под действием ионизирующего излучения радиоактивных веществ – образует Н2, Н2О2 и свободные радикалы Н*, ОН*, НО2*.
Вода вступает в химическое взаимодействие со многими простыми веществами. Большинство таких реакций протекает при высокой температуре. Только наиболее активные металлы (щелочные и щелочноземельные) и неметаллы (галогены) реагируют с водой при комнатной температуре. Однако при одновременном воздействии воды и окислителей даже при обычной температуре происходит разрушение металлов средней активности (таких как железо) в результате коррозии.
Очень сильными восстановителями вода восстанавливается до водорода, очень сильными окислителями – окисляется до кислорода.
Вода взаимодействует со многими основными оксидами с образованием гидроксидов. В реакциях воды с большинством кислотных оксидов образуются кислоты.
РЕАКЦИИ ВОДЫ
| С простыми веществами: | |
| металлами | неметаллами |
| 2Na + 2H2O = 2NaOH + H2 | Cl2 + H2O⇋ HCl + HClO |
| 2Fe + 3H2O = Fe2O3 + 3H2 (600 °C) | H2O + C ⇋ CO + H2 (800–1000 °C) |
| С оксидами: | |
| основными | кислотными |
| CaO + H2O = Ca(OH)2 | SO3 + H2O = H2SO4 |
| Na2O + H2O = 2NaOH | N2O5 +H2O = 2HNO3 |
| Термическое разложение: 2Н2О⇋ 2Н2 + О2 | |
Некоторые сложные вещества полностью разлагаются водой – подвергаются необратимому гидролизу:
Al2S3 + 6H2O = 2Al(OH)3↓ + 3H2S↑
Вода может служить катализатором. Например, щелочные металлы и водород реагируют с хлором только в присутствии следов воды. Иногда вода является каталитическим ядом, например, для железного катализатора при синтезе аммиака.
Например, щелочные металлы и водород реагируют с хлором только в присутствии следов воды. Иногда вода является каталитическим ядом, например, для железного катализатора при синтезе аммиака.
В результате образования водородных связей твердая вода (лед) имеет рыхлую структуру с обширными замкнутыми полостями двух типов: больших и малых. В этих полостях могут размещаться молекулы других веществ, имеющие соответствующие размеры. Они удерживаются в них ван-дер-ваальсовыми силами. Так образуются газовые гидраты – клатраты, соединения типа «гость-хозяин», в которых «гостями» являются молекулы газов или легкокипящих жидкостей (благородные газы, галогены, углеводороды и др.), а «хозяевами» – молекулы воды, образующие кристаллический каркас. По внешнему виду газовые гидраты напоминают снег или рыхлый лед, но могут существовать только при повышенном давлении и отрицательной (по Цельсию) температуре. Наиболее важным на сегодняшний день газовым гидратом является гидрат природного газа метана, колоссальные скопления которого обнаружены в недрах земли, в особенности на шельфе морей и океанов.
Газовые гидраты относятся к соединениям переменного состава. Если диаметр молекулы газа менее 0,52 нм (Ar, CH4, H2S), то в предельном случае могут заполниться и большие и малы полости кристаллической решетки. При полном заполнении всех полостей число молекул воды, приходящихся на одну молекулу «гостя», составляет 5,75 (например, 4Ar . 23H2O). Молекулы «гостей» с диаметром от 0,52 до 0,59 нм (Br2, CH3SH, COS) могут заполнять лишь большие полости. В этом случае минимальной число молекул воды, приходящееся на одну молекулу «гостя», равно 7,66 (например, 3Br2 . 23H2O). Гидраты газов с диаметром молекул от 0,59 до 0,69 нм (C3H8, изо-C4H10, CHCl3) имеют другую структуру и состав, например C3H8 . 17H2O.
Вода хорошо растворяет многие вещества, имеющие ионное строение (соли, щелочи), а также вещества, молекулы которых полярны. Наличие в жидкой воде ассоциатов (элементов кристаллической структуры) наряду с большим дипольным моментом молекул приводит к высокой диэлектрической проницаемости воды (ε = 78,3 при 25 °С). Это вызывает заметное ослабление кулоновского притяжения в водной среде, а, следовательно, способствует электролитической диссоциации ионных и полярных ковалентных соединений. При этом полярные молекулы воды участвуют в процессе гидратации за счет притяжения соответствующих полюсов полярных молекул воды к образующимся катионам и анионам. В ряде случаев образующиеся связи являются настолько прочными, что можно говорить о возникновении аквакомплексов. Аквакомплексы обнаружены не только в водных растворах, но и во многих кристаллических структурах.
Наличие в жидкой воде ассоциатов (элементов кристаллической структуры) наряду с большим дипольным моментом молекул приводит к высокой диэлектрической проницаемости воды (ε = 78,3 при 25 °С). Это вызывает заметное ослабление кулоновского притяжения в водной среде, а, следовательно, способствует электролитической диссоциации ионных и полярных ковалентных соединений. При этом полярные молекулы воды участвуют в процессе гидратации за счет притяжения соответствующих полюсов полярных молекул воды к образующимся катионам и анионам. В ряде случаев образующиеся связи являются настолько прочными, что можно говорить о возникновении аквакомплексов. Аквакомплексы обнаружены не только в водных растворах, но и во многих кристаллических структурах.
Твердые вещества, как правило, лучше растворяются при нагревании. При этом вещества с очень прочной кристаллической решеткой мало растворимы в воде. К ним относятся хлориды, бромиды и иодиды серебра и свинца, сульфаты щелочноземельных металлов и свинца, большинство гидроксидов, сульфидов, ортофосфатов и карбонатов металлов.
Газы обычно плохо растворяются в воде. Исключение составляют газообразные вещества, взаимодействующие с водой, например аммиак, хлороводород или диоксид серы. Растворимость всех газов возрастает при увеличении давления и, как правило, понижается при нагревании.
В жидкой воде одна из каждых 10 миллионов молекул диссоциирует, образуя ионы: катионы водорода Н+ и гидроксид-ионы ОН–:
Н2О ⇋ Н+ + ОН–
Чистая вода содержит одинаковую молярную концентрацию катионов водорода Н+ и гидроксид-ионов ОН–, и среда ее нейтральна. Однако при растворении многих веществ в воде концентрации ионов Н+ и ОН– изменяются. Если увеличивается концентрация катионов водорода, среда становится кислотной. При увеличении концентрации гидроксид-ионов среда становится щелочной. Определить характер среды можно с помощью индикаторов.
| Индикатор | Кислотная среда | Нейтральная среда | Щелочная среда |
| Лакмус | Красный | Фиолетовый | Синий |
| Фенолфталеин | Бесцветный | Бесцветный | Малиновый |
| Метиловый оранжевый | Розовый | Оранжевый | Желтый |
Основания диссоциируют в водном растворе с образованием гидроксид-ионов, создавая щелочную среду:
NaOH = Na+ + OH– (сильное основание)
NH3 . h3O ⇋ NH4+ + OH– (слабое основание)
h3O ⇋ NH4+ + OH– (слабое основание)
При диссоциации кислот в растворе образуются катионы водорода, и среда становится кислотной.
H2SO4 = 2H+ + SO42– (сильная кислота)
h3CO3 ⇋ H+ + HCO3– (слабая кислота)
| Вещества | Сильные | Слабые |
| Основания | NaOH, KOH, Ca(OH)2, Ba(OH)2 | Nh4 |
| Кислоты | HCl, HBr, HI, H2SO4, HNO3 | H3PO4, H2CO3, H2S |
Соли при растворении в воде диссоциируют на катионы металла и анионы кислоты. Растворы многих солей имеют кислотную или щелочную среду за счет обратимого гидролиза по катиону или по аниону (см. ГИДРАТАЦИЯ, ГИДРАТЫ, ГИДРОЛИЗ).
ГИДРАТАЦИЯ, ГИДРАТЫ, ГИДРОЛИЗ).
| СОЛЬ | ГИДРОЛИЗ | СРЕДА РАСТВОРА | рН | |
| Катион | Анион | |||
| сильного основания | сильной кислоты | — | нейтральная | 7 |
| сильного основания | слабой кислоты | по аниону | щелочная | > 7 |
| слабого или малорастворимого основания | сильной кислоты | По катиону | кислотная | < 7 |
| слабого или малорастворимого основания | слабой кислоты | По катиону и аниону | Нейтральная кислотная или щелочная | 7 > 7 < 7 |
Несмотря на свое название, многие кислые соли (например, гидрокарбонат натрия) создают в водном растворе щелочную среду:
NaHCO3 = Na+ + HCO3–
HCO3– + H2O ⇋ H2CO3 + OH–
Вода используется во многих технологических процессах главным образом как охлаждающая жидкость, транспортирующая среда для сыпучих материалов (например, золы), важнейший растворитель, реагент. Тяжелую воду применяют в качестве эффективного замедлителя нейтронов. Обычная вода не токсична, однако тяжелая вода опасна для млекопитающих.
Тяжелую воду применяют в качестве эффективного замедлителя нейтронов. Обычная вода не токсична, однако тяжелая вода опасна для млекопитающих.
Вода является жизненно важным веществом. Она является обязательным компонентом всех живых существ. Организм взрослого человека массой 65 кг содержит до 40 кг воды. Вода является растворителем, составной частью клеток, участником биохимических реакций. Она играет важную роль в терморегуляции. У взрослого человека суточная потребность в воде составляет примерно 2,4 кг. Сюда включается вода, поступающая в организм с твердой и жидкой пищей, в виде напитков, а также вода, образующаяся в результате дыхательных процессов (около 300 г).
Человек чрезвычайно остро ощущает изменения содержания воды в организме и может прожить без воды лишь несколько суток. Потеря 10–20% воды опасна для жизни. В то же время избыток воды приводит к перегрузке сердечно-сосудистой системы, потере солей.
Очень важен минеральный состав питьевой воды. Человек употребляет для питья воду, содержащую от 0,02 до 2 г минеральных веществ на 1 л. Большое значение имеют вещества, находящиеся в малых концентрациях, но играющие важную роль в физиологических процессах организма. Например, длительное употребление питьевой воды, содержащей фтора менее 0,6 мг/л, ведет к кариесу зубов, а потребление воды с концентрацией фтора более 1 мг/л вызывает флюороз.
Большое значение имеют вещества, находящиеся в малых концентрациях, но играющие важную роль в физиологических процессах организма. Например, длительное употребление питьевой воды, содержащей фтора менее 0,6 мг/л, ведет к кариесу зубов, а потребление воды с концентрацией фтора более 1 мг/л вызывает флюороз.
Если в питьевую воду попадают возбудители инфекционных заболеваний, она может явиться фактором их распространения. Многие возбудители кишечных инфекций сохраняют свою жизнеспособность в воде в течение нескольких месяцев.
При определении качества питьевой воды немаловажное значение имеют свойства, воспринимаемые органами чувств (органолептические свойства): температура, прозрачность, цвет, запах, вкус, жесткость. Питьевая вода должна быть безопасной в эпидемиологическом отношении, безвредной по химическому составу, благоприятной по органолептическим свойствам. Чтобы использовать для питья природную воду, ее обычно очищают. С этой целью применяют как физические (фильтрование, отстаивание), так и химические (хлорирование, озонирование) методы.
В 1 мл питьевой воды должно быть не более 100 микроорганизмов (число бактерий группы кишечных палочек – не более 3). Не менее жесткие ограничения накладываются на содержание химических веществ.
| Алюминий 0,5 | Полифосфаты 3,5 |
| Бериллий 0,002 | Свинец 0,03 |
| Железо 0,3 | Селен 0,001 |
| Марганец 0,1 | Стронций 7,0 |
| Медь 1,0 | Сульфаты 500,0 |
| Молибден 0,25 | Фтор 0,7–1,5 (для различных климатических районов) |
| Мышьяк 0,05 | Хлориды 350,0 |
| Нитраты 45,0 | Цинк 5,0 |
| Полиакриламид 2,0 |
Общая жесткость питьевой воды должна быть не выше 7,0 ммоль/л, а сухой остаток – 1000 мг/л. Значения рН не должны выходить за пределы 6,0–9,0.
Ресурсы питьевой воды не безграничны. Проблема обеспечения питьевой водой растущего народонаселения является одной из наиболее острых экологических проблем современности. На возобновляемые водные ресурсы – речной сток воды – оказывает влияние не только растущее загрязнение окружающей среды, но и глобальное потепление климата Земли. Хотя в ряде районов России увеличение количества атмосферных осадков и повышение температуры воздуха в холодное время года благоприятно отражаются на стоке воды рек, на северо-западе и юге нашей страны наметилась тенденция к уменьшению количества ежегодно возобновляющихся водных ресурсов.
Для предотвращения водного кризиса, помимо усиления административных мер по охране природных ресурсов, необходимо экологическое образование население. Это должно помочь правильному восприятию взаимосвязей между всеми сферами Земли, включая ее водную оболочку.
Елена Савинкина
Влияние воды и растворенных в ней веществ на организм
Роль воды в организме человека
Человек состоит из воды на 70-80%; мозг человека — на 85%; эмбрион — на 95%; меньше всего воды в костях — 30%. Вода — основной растворитель в человеческом организме, в ней переносятся все вещества — соли, кислород, ферменты, гормоны. Поэтому все вещества, вырабатываемые нашим организмом, водорастворимы.
Вода — основной растворитель в человеческом организме, в ней переносятся все вещества — соли, кислород, ферменты, гормоны. Поэтому все вещества, вырабатываемые нашим организмом, водорастворимы.
При растворении веществ очень важен химический состав воды, ведь чем больше посторонних примесей в воде, тем хуже она растворяет вещества. (Например, водопроводная вода на 1/5 часть уже занята посторонними примесями и человеку остается только 4/5 от выпитого объема).
Содержащиеся в воде органические соединения и их воздействие на организм человека
Все органические соединения, находящиеся в воде, можно условно разделить на мелкие (размер молекулы — меньше 100 килодальтон) и крупные (размер молекулы — от 100 килодальтон). Наиболее опасны для человека крупные органические соединения, которые на 90% являются канцерогенами или мутагенами. Наиболее опасны хлорорганические соединения, образующиеся при кипячении хлорированной воды, т.к. они являются сильными канцерогенами, мутагенами и токсинами. Остальные 10% крупной органики в лучшем случае нейтральны в отношении организма. Полезных для человека крупных органических соединений, растворенных в воде, всего 2-3 (это ферменты, необходимые в очень малых дозах).
Остальные 10% крупной органики в лучшем случае нейтральны в отношении организма. Полезных для человека крупных органических соединений, растворенных в воде, всего 2-3 (это ферменты, необходимые в очень малых дозах).
Воздействие органики начинается непосредственно после питья. В зависимости от дозы это может быть 18-20 дней или, если доза большая, 8-12 месяцев.
Содержащиеся в воде ионы тяжелых металлов и их воздействие на организм человека
Тяжелые металлы, попадая в наш организм, остаются там навсегда, вывести их можно только с помощью белков молока и белых грибов. Достигая определенной концентрации в организме, они начинают свое губительное воздействие — вызывают отравления, мутации. Кроме того, что сами они отравляют организм человека, они еще и чисто механически засоряют его — ионы тяжелых металлов оседают на стенках тончайших систем организма и засоряют почечные каналы, каналы печени, таким образом снижая фильтрационную способность этих органов. Соответственно, это приводит к накоплению токсинов и продуктов жизнедеятельности клеток нашего организма, т. е. самоотравление организма, т.к. именно печень отвечает за переработку ядовитых веществ, попадающих в наш организм, и продуктов жизнедеятельности организма, а почки — за их выведение наружу.
е. самоотравление организма, т.к. именно печень отвечает за переработку ядовитых веществ, попадающих в наш организм, и продуктов жизнедеятельности организма, а почки — за их выведение наружу.
К тяжелым металлам относятся Pb (свинец), Al (алюминий), Mn (марганец), Si (кремний), Fe (железо), Se (селен), Zn (цинк), Hg (ртуть), Cd (кадмий).
Марганец забивает канальцы нервных клеток. Снижается проводимость нервного импульса, как следствие повышается утомляемость, сонливость, снижается быстрота реакции, работоспособность, появляются головокружение, депрессивные, подавленные состояния. Особенно опасны отравления марганцем у детей и эмбрионов (когда женщина беременна) — приводит к идиотии. Из 100 детей, матери которых во время беременности подверглись отравлению марганцем, 96-98 рождаются идиотами. Есть также теория, что токсикозы на ранних и поздних сроках беременности вызываются марганцем. В водопроводной воде — избыток марганца. Кроме воды марганец содержится в воздухе из-за производственных выбросов. В природе марганец затем накапливается в грибах и растениях, попадая таким образом в пищу. Марганец почти невозможно вывести из организма; очень тяжело диагностировать отравление марганцем, т.к. симптомы очень общие и присущи многим заболеваниям, чаще же всего человек просто не обращает на них внимания.
В природе марганец затем накапливается в грибах и растениях, попадая таким образом в пищу. Марганец почти невозможно вывести из организма; очень тяжело диагностировать отравление марганцем, т.к. симптомы очень общие и присущи многим заболеваниям, чаще же всего человек просто не обращает на них внимания.
Алюминий так же оказывает общее отравляющее и засоряющее действие на организм человека. В водопроводной воде его избыток связан с тем, что излишки железа на водозаборе удаляют сульфатом алюминия. Реагируя с ионами железа, сульфат алюминия дает нерастворимый осадок, в который выпадает, в принципе и железо, и алюминий, но в реальности в воде остается и железо, и алюминий.
Селен не содержится в природной воде Новосибирска. Селен необходим человеку в очень малых дозах, при малейшем превышении дозы он превращается в канцероген, мутаген и токсин. Человеку можно безопасно восполнить недостаток селена с помощью специальных минеральных комплексов; селен также содержится в морской капусте.
Железо бывает в природе в трех состояниях — молекулярное железо F0(когда оно куском), Fe2+ — необходимо в организме человека как переносчик кислорода (в молекуле гемоглобина 4 иона F2+) и F3+ — вредное для человека — оно и есть ржавчина. Железо необходимо организму человека, но только в определенной пропорции и в виде иона F2+. В водопроводной воде большой избыток железа, т.к. в природной воде Новосибирска его много, плюс ржавые трубы, по которым течет вода к потребителям.
Кальций необходим в организме человека для строения костной ткани (зубы, кости), мышечной ткани (мышцы, мышца сердца), поддержания проводящей функции нервной ткани. При избытке кальций нейтрален по отношению к организму человека, однако, это снижает качество воды — соли кальция образуют накипь и мутность воды.
Магний необходим для нормальной деятельности нервных клеток. Однако, его количество в воде должно быть ограниченно, т.к. при избытке он действует на подобие марганца — засоряет канальцы нервных клеток, только он менее активен и проще выводится из организма.
Калий также необходим для нормальной жизнедеятельности организма, т.к. является компонентом калий-натриевого насоса. Калий-натриевый насос — это структура на мембране каждой клетки, благодаря которой в клетку проникают вещества из межклеточной жидкости, а из клетки выводятся продукты ее жизнедеятельности. Кроме того, особенно важен калий для сердечно-сосудистой деятельности, т.к. он нормализует давление крови и работу сердца.
Отчасти наличие тех или иных металлов в воде обусловлено ее кислотснотью. Провести качественное определение кислотности и измерить общее количество растворенных веществ воде Вам помогут сделать карманные приборы TDS Meter — TDS Meter EZ
Если Вы уже приобрели систему очистки питьевой воды, то для Вас мы предлагаем электронные устройства он-лайн контроля качества — минерализации воды Clean Tap Monitor, Dual Monitor 1 и Dual Monitor 2.
Источник: Компания Чистая Вода
любопытных детей: как делается вода?
Любопытные дети — серия для детей. Отправьте свой вопрос на любопытный[email protected]. Вам также может понравиться подкаст Imagine This, созданный совместно ABC KIDS listen и The Conversation на основе Curious Kids.
Отправьте свой вопрос на любопытный[email protected]. Вам также может понравиться подкаст Imagine This, созданный совместно ABC KIDS listen и The Conversation на основе Curious Kids.
Как производится вода? – Клара, 8 лет, Канберра.
Привет, Клара. Это действительно отличный вопрос. Если бы мы могли производить большое количество воды дешево, чисто и безопасно, это решило бы множество мировых проблем. К сожалению, это не так просто.
Читать далее:
Любознательные дети: откуда берутся облака и почему они имеют разную форму?
Что такое вода и откуда она взялась?
Вода состоит из двух атомов водорода, связанных с атомом кислорода.
Шаттерсток
Вы, наверное, слышали об атомах, мельчайших строительных блоках всей материи во Вселенной. Мы все состоим из атомов, слипшихся (или, как сказали бы ученые, «связанных»). Атомы, связанные вместе, образуют молекулы.
Атомы, связанные вместе, образуют молекулы.
Молекула чистой воды состоит из двух атомов водорода, связанных с атомом кислорода. Как объяснялось в предыдущей статье Curious Kids, ученые считают, что вода на Земле могла появиться в результате таяния богатых водой минералов во время формирования планеты и ледяных комет, которые миллиарды лет назад врезались в Землю и растаяли.
Ученые считают, что вода могла попасть к нам из горных пород, плавящихся при формировании Земли, и ледяных комет.
Flickr/barnyz Подписаться, CC BY
Почему мы не можем просто сделать больше?
Приготовление небольших объемов чистой воды в лаборатории возможно, но нецелесообразно «создавать» большие объемы воды путем смешивания водорода и кислорода. Реакция дорогая, высвобождает много энергии и может вызвать действительно мощные взрывы.
В то время как общий объем воды на Земле остается примерно одинаковым, вода постоянно меняет свое местоположение и состояние. Это означает, что иногда это жидкость (например, вода, которую мы пьем), твердое тело (лед) или газ (водяной пар, например пар).
Это означает, что иногда это жидкость (например, вода, которую мы пьем), твердое тело (лед) или газ (водяной пар, например пар).
Ученые называют этот процесс изменения гидрологическим (водным) циклом, при котором вода постоянно перемещается по миру, перемещаясь между воздухом, землей и океаном.
По кругу
Цикл начинается, когда вода испаряется из океана (или озер, рек и водно-болотных угодий) и попадает в атмосферу (окружающий нас воздух) в виде водяного пара (газа).
По мере того, как теплый, насыщенный водой воздух поднимается вверх, он охлаждается и может удерживать меньше воды.
В результате образуются облака. В конце концов, водяной пар снова превращается в жидкую воду и выпадает на Землю в виде дождя. Дождь, который не сразу испаряется обратно в атмосферу, либо стекает в океан в виде стока, либо поглощается землей и становится грунтовыми водами — водой, хранящейся под землей в крошечных пространствах внутри скал.
Растения могут всасывать грунтовые воды своими корнями и выталкивать воду через крошечные отверстия в листьях (это называется транспирацией).
Грунтовые воды медленно текут через землю в океан, и цикл начинается снова.
Это круговорот воды.
Шаттерсток
Гидрологический цикл чувствителен к изменениям температуры и давления. Например, если жарко и ветрено, происходит большее испарение. Таким образом, изменение климата влияет на гидрологический цикл. Области, которые когда-то были влажными, могут стать сухими (и наоборот), потому что облака роняют свой дождь в океан, а не на землю, где его можно собрать и использовать.
Две крошечные капли питьевой воды
Мы пьем пресную воду, но большая часть воды на Земле соленая. И подавляющее большинство доступной пресной воды на Земле на самом деле скрыто под землей в виде подземных вод.
На самом деле, если представить, что вся вода на Земле может поместиться в литровый пакет из-под молока, то это будет океанская вода, за исключением двух столовых ложек пресной воды.
Из двух столовых ложек пресной воды немногим менее трех четвертей замерзнет и превратится в лед, а большая часть оставшейся части будет подземной водой.
Пресная вода, которую мы видим и используем в реках, болотах и озерах, составляет менее двух капель воды в мире.
Поэтому защита крупных источников пресной воды, таких как грунтовые воды, очень важна, поскольку удаление соли из океанской воды может стоить больших денег и энергии.
Большая часть воды соленая и находится в океане.
Flickr/beana_cheese, CC BY
Атмосфера, Земля и океан взаимосвязаны, и то, что мы делаем в одном месте, может повлиять на качество воды в других местах.
Химикаты, вылитые в раковину или выброшенные в атмосферу, могут в конечном итоге оказаться в грунтовых водах, что означает, что пресной воды для нас станет меньше.
Хотя мы не можем «создать» больше воды, мы можем максимально использовать имеющуюся воду, сохраняя и защищая ее.
Читать далее:
Любознательные дети: Как образовался океан? Откуда взялась вся вода?
Привет, любознательные малыши! У вас есть вопрос, на который вы хотели бы получить ответ от эксперта? Попросите взрослого отправить нам свой вопрос. Вы можете:
Вы можете:
* Отправьте свой вопрос по адресу [email protected]
* Расскажите нам в Твиттере, отметив @ConversationEDU хэштегом #curiouskids, или
* Расскажите нам на Facebook
CC BY-ND
Пожалуйста, сообщите нам ваше имя, возраст и город, в котором вы живете. При желании вы также можете отправить аудиозапись вашего вопроса. Присылайте столько вопросов, сколько хотите! Мы не сможем ответить на все вопросы, но постараемся.
Из чего состоит вода
Опубликовано
Соленая вода, очевидно, содержит соль, но может содержать и много других микроэлементов. Пресная вода из разных источников будет содержать разные элементы и минералы. Они поступают из горных пород, которые омывает вода, а также из загрязняющих веществ с ферм и промышленности. Вода, которую вы пьете, будет содержать несколько добавок, используемых для очистки, а также фторид, который добавляется для нашего здоровья. Дождевая вода будет иметь любое количество загрязняющих веществ, накопившихся в атмосфере.
Пресная вода из разных источников будет содержать разные элементы и минералы. Они поступают из горных пород, которые омывает вода, а также из загрязняющих веществ с ферм и промышленности. Вода, которую вы пьете, будет содержать несколько добавок, используемых для очистки, а также фторид, который добавляется для нашего здоровья. Дождевая вода будет иметь любое количество загрязняющих веществ, накопившихся в атмосфере.
Ученые считают, что при высоких температурах и давлениях, таких как внутри планет-гигантов, вода существует в виде ионной воды, в которой молекулы распадаются на ионы водорода и кислорода, а при еще более высоких давлениях — в виде суперионной воды, в которой кислород кристаллизуется, но ионы водорода свободно плавают в кислородной решетке.
Есть много интересных фактов о воде. Вода – жидкость без вкуса и запаха. Естественный цвет воды и льда слегка голубой, хотя в небольших количествах вода кажется бесцветной. Лед также кажется бесцветным, а водяной пар практически невидим как газ. Поскольку молекула воды не является линейной, а атом кислорода имеет более высокую электроотрицательность, чем атомы водорода, вода несет небольшой отрицательный заряд. В результате вода имеет электрический дипольный момент. Вода может образовывать большое количество межмолекулярных водородных связей (четыре). Эти факторы приводят к высокому поверхностному натяжению воды и капиллярным силам. Воду часто называют универсальным растворителем. Все основные клеточные компоненты растворены в воде. Вода имеет максимальную плотность 3,98°С. Как ни странно, он становится менее плотным, когда охлаждается до твердой формы, льда. В этом твердом состоянии он расширяется и занимает на 9% больше объема, что объясняет факт плавания льда в жидкой воде.
Поскольку молекула воды не является линейной, а атом кислорода имеет более высокую электроотрицательность, чем атомы водорода, вода несет небольшой отрицательный заряд. В результате вода имеет электрический дипольный момент. Вода может образовывать большое количество межмолекулярных водородных связей (четыре). Эти факторы приводят к высокому поверхностному натяжению воды и капиллярным силам. Воду часто называют универсальным растворителем. Все основные клеточные компоненты растворены в воде. Вода имеет максимальную плотность 3,98°С. Как ни странно, он становится менее плотным, когда охлаждается до твердой формы, льда. В этом твердом состоянии он расширяется и занимает на 9% больше объема, что объясняет факт плавания льда в жидкой воде.
Вода покрывает большую часть нашей планеты, и ее можно найти в той или иной форме по всей известной Вселенной. Независимо от того, где вы находитесь на Земле, вода каждый день так или иначе влияет на вас.
Мы написали много статей о воде для Universe Today.
