Содержание
Вода — растворитель. Растворы — презентация, доклад, проект
Вы можете изучить и скачать доклад-презентацию на
тему Вода — растворитель. Растворы.
Презентация на заданную тему содержит 20 слайдов. Для просмотра воспользуйтесь
проигрывателем,
если материал оказался полезным для Вас — поделитесь им с друзьями с
помощью социальных кнопок и добавьте наш сайт презентаций в закладки!
Презентации»
Химия»
Презентация Вода — растворитель. Растворы
Слайды и текст этой презентации
Слайд 1
Описание слайда:
Вода- растворитель. Растворы
Учитель химии
Затомская Анна Витальевна
БОУ г. Омска «СОШ №80»
Слайд 2
Описание слайда:
Слайд 3
Описание слайда:
Слайд 4
Описание слайда:
Слайд 5
Описание слайда:
Слайд 6
Описание слайда:
Слайд 7
Описание слайда:
Слайд 8
Описание слайда:
Слайд 9
Описание слайда:
Слайд 10
Описание слайда:
Слайд 11
Описание слайда:
Слайд 12
Описание слайда:
Слайд 13
Описание слайда:
Эмульсия
Слайд 14
Описание слайда:
Суспензия
Слайд 15
Описание слайда:
Слайд 16
Описание слайда:
Слайд 17
Описание слайда:
Слайд 18
Описание слайда:
Слайд 19
Описание слайда:
Источники
Слайд 20
Описание слайда:
Источники
Tags
Вода — растворитель. Растворы
Растворы
Похожие презентации
Презентация успешно отправлена!
Ошибка! Введите корректный Email!
Вода — растворитель. Значение воды. | Презентация к уроку по химии (8 класс):
Слайд 1
« Вода –растворитель. Растворы. Значение воды».
Слайд 2
Вода …..Тебя невозможно описать, Тобой наслаждаются, Не ведая, что ты такое! Мало сказать, что Ты необходима для жизни: Ты – сама жизнь ! Антуан де Сент-Экзюпери
Слайд 3
А, что мы знаем о воде……? 1. Формула воды – Н2О. 2. Относительная молекулярная масса воды равна 16 3. Большое поверхностное натяжение 4. Вода может существовать в трех агрегатных состояниях 5. Соль можно выделить из раствора фильтрованием. 6. Вода – хороший растворитель. 7. Чтобы выделить соль из раствора, его необходимо выпарить. 8. Вода – летучая жидкость 9. Вода имеет вкус и запах. 10. Вода не имеет вкуса и запаха.
Слайд 4
А, что мы знаем о воде……? 1. Формула воды – Н2О. 2. Относительная молекулярная масса воды равна 16 3. Большое поверхностное натяжение 4. Вода может существовать в трех агрегатных состояниях 5. Соль можно выделить из раствора фильтрованием. 6. Вода – хороший растворитель. 7. Чтобы выделить соль из раствора, его необходимо выпарить. 8. Вода – летучая жидкость 9. Вода имеет вкус и запах. 10. Вода не имеет вкуса и запаха.
Слайд 5
Вода Химическая формула: H 2 O Агрегатные состояния: Жидкость Газ Твёрдое вещество Поверхностное натяжение
Слайд 6
Вы когда -нибудь сдавали кровь на анализ? А знаете ли вы, что наша кровь по составу очень похожа на океанскую воду? О чём вам это говорит ? Жизнь зародилась в воде…….
Слайд 7
Р оль воды в жизни животных человека 15:23:17 — в организмах животных – воды 60 — 90% — состав плазмы крови очень близок к составу воды морей и океанов, — 6-недельный эмбрион – 97,6 % воды, — новорожденный организм – 70 – 83 % — взрослый организм – 75% — кровь – 81% — плотные ткани (мышцы) – 75% — кости – 20% Ежесуточно выделяется в виде: — слюны — 1500мл — желудочного сока – 2500мл — сок поджелудочной железы – 700мл — кишечные соки – 3000мл
Слайд 8
Роль воды в жизни растений растения на 50-90% состоят из воды минеральные вещества поступают в растение только в растворенном виде вода участвует в фотосинтезе обеспечивает объем и упругость клетки 15:23:18
Слайд 9
15:23:18 Роль воды в природе и жизни человека Составьте схему, отражающую роль воды в природе и жизни человека (можете дополнить) Внутренняя среда организмов Фотосинтез Растворител ь Среда обитания Почвенное питание растений Подумай…?
Слайд 10
Что такое раствор? Лабораторные опыты Оборудование и реактивы: пробирки, стеклянные палочки, вода (Н2О), мел (СаСО3), масло, хлорид натрия ( NaCl ) Цель работы : получить раствор вещества, описать внешний вид раствора Техника безопасности: Аккуратно работать со стеклянной посудой!!!
Слайд 11
Ход работы: Лабораторные опыты 1) В три пробирки налейте по 1/3 воды 2) В первую пробирку добавьте 2 ложки мела, перемешайте палочкой. Что наблюдаете? 3) Во вторую пробирку добавьте 5 капель масла, перемешайте палочкой. Что наблюдаете? 4) В третью пробирку добавьте 2 ложки соли, перемешайте. Что наблюдаете? что делал что наблюдал Смешал 1) вода+мел 2) вода+масло 3) вода+соль Мел не растворился в воде Масло не растворилось в воде Соль растворилась Отчет:
Что наблюдаете? 3) Во вторую пробирку добавьте 5 капель масла, перемешайте палочкой. Что наблюдаете? 4) В третью пробирку добавьте 2 ложки соли, перемешайте. Что наблюдаете? что делал что наблюдал Смешал 1) вода+мел 2) вода+масло 3) вода+соль Мел не растворился в воде Масло не растворилось в воде Соль растворилась Отчет:
Слайд 12
Раствор — это однородная система, состоящая из молекул растворителя и частиц растворенного вещества, между которыми происходят физические и химические взаимодействия.
Слайд 13
Взвесь — это жидкость или газ, в которых относительно равномерно распределены мелкие частицы твердого вещества или капли другой жидкости. Взвеси Эмульсия Суспензия Это взвесь, в которой мелкие частицы твердого вещества равномерно распределены между молекулами жидкости Это взвесь, в которой мелкие капельки какой-либо жидкости равномерно распределены между молекулами другой жидкости
Слайд 14
Виды растворов Насыщенный раствор – раствор, в котором при данной температуре вещество больше не растворяется. Ненасыщенный раствор – раствор , в котором при данной температуре находится меньше растворяемого вещества, чем в его насыщенном растворе Пересыщенный раствор – раствор , в котором при данной температуре находится в растворенном состоянии больше вещества, чем в его насыщенном растворе при тех же условиях .
Ненасыщенный раствор – раствор , в котором при данной температуре находится меньше растворяемого вещества, чем в его насыщенном растворе Пересыщенный раствор – раствор , в котором при данной температуре находится в растворенном состоянии больше вещества, чем в его насыщенном растворе при тех же условиях .
Слайд 15
Растворимость зависит от : — природы реагирующих веществ; — температуры; — вида растворителя .
Слайд 16
Подведём итоги…. Что такое раствор? Из чего он состоит? Дайте определение растворимости. Перечислите признаки химического взаимодействия происходящие в растворе. Какие факторы влияют на растворимость? Как называется раствор если: при данной t ° вещество больше не растворяется, при данной t ° вещество ещё растворяется, раствор содержит избыток растворённого вещества.
PPT – Вода: Презентация PowerPoint «Универсальный растворитель» | скачать бесплатно
Об этой презентации
Стенограмма и примечания докладчика
Название: Вода: универсальный растворитель
1
Вода универсальный растворитель
2
Вода – это химическое вещество! h3OOОдна
молекула воды состоит из 2 атомов
водорода и одного атома кислорода, связанных вместе.
Связи, удерживающие водород и кислород
вместе называются ковалентными связями — они
очень прочные.
3
Вода как растворитель
- Вода играет важную роль как химическое
вещество. Его многочисленные важные функции включают в себя
, являющийся хорошим растворителем для растворения многих твердых веществ,
, служащий отличным охлаждающим агентом как механически,
, так и биологически, и выступающий в качестве реагента
во многих химических реакциях. - Кровь, пот и слезы… все растворы воды.
4
Форма воды делает ее полярной
- Вода сильно полярна — две стороны воды
имеют очень разный заряд.
5
Вода образует водородные связи
- Поскольку вода имеет слегка отрицательный конец и
слегка положительный конец, она может взаимодействовать с самим
, ПРИЛИПАЯ друг к другу.
- Положительный водородный конец одной молекулы может
притягивать отрицательную неподеленную пару другой воды
молекула. Это взаимодействие называется «связывание водорода
». - Тип слабого электростатического притяжения
(положительное к отрицательному). Поскольку каждая
одна из молекул воды может образовать четыре
Водородных Связи, образуется сложная сеть молекул.
6
Какая связь является водородной связью?___ Какая связь
является ковалентной связью? ___ Какая связь крепка?
___ Какая связь слабая? ___
А
Б
Б
A
A
B
7
Адгезия и сцепление
- Вода притягивается к другой воде. Это
называется сплоченностью. Вода также может притягиваться к
другим материалам. Это называется адгезией. Оба этих свойства
обусловлены водородной связью! - Напишите свой пример из реальной жизни
- сплоченности ________________
- Напишите свой пример из реальной жизни
- сплоченности ________________
8
Вода существует в трех формах
- Вода может существовать на нашей планете в трех физических
состояниях. Вода может быть жидкостью, газом или твердым телом.
Вода может быть жидкостью, газом или твердым телом. - Твердые? Плащение жидкости
- Газ? Жидкая конденсация
- Жидкость? Твердое замораживание
- Жидкость? Испарение газа
Высокая тепло
- . Специфическое тепло. набрано или потеряно) для изменения температуры
1 грамм вещества 1 градус Цельсия. - Килокалория или большая C равна 1000 маленьких
калорий. Чтобы поднять 1000
граммов воды на 1 градус Цельсия, требуется 1000 калорий. еще один. - Молекулы на поверхности жидкой воды имеют на
меньше соседей и, как следствие, имеют большее
притяжение к нескольким молекулам воды, которые
находятся поблизости. Это делает поверхность жидкости
немного более трудной для пробивания, чем внутреннюю часть
.
11
Поверхностное натяжение
- Когда небольшой объект, который обычно
тонет в воде, осторожно помещают на поверхность, он может
оставаться подвешенным на поверхности из-за поверхностного
натяжения.
- Поверхностное натяжение связано с когезионными
свойствами воды. - Напишите свой собственный реальный пример поверхностного
натяжения_______
12
Вода как растворитель
- Частичный заряд, возникающий на молекуле воды
, делает ее отличным растворителем. - Вода растворяет многие вещества, окружая
заряженных частиц и «втягивая» их в раствор
. - Например, поваренная поваренная соль, хлорид натрия,
представляет собой ионное вещество, содержащее чередующиеся
ионов натрия и хлора.
13
(No Transcript)
14
- Write your own example of water dissolving a
polar or ionic substance _________________________
_____
15
Water as a Solvent
- In a Подобным образом любое вещество, которое несет
суммарный электрический заряд, включая как ионные
соединения, так и полярные ковалентные молекулы, может
растворяться в воде.
- Эта идея также объясняет, почему некоторые вещества
НЕ растворяются в воде. - Масло, например, представляет собой неполярную молекулу.
Поскольку молекула масла
не несет электрического заряда, она не притягивается к молекулам воды
и, следовательно, не растворяется в
воде.
16
Неполярный
НЕ РАСТВОРИВАЕТСЯ
Полярный
17
Капиллярный
- Поверхностное натяжение связано с когезивным
свойства воды. - Однако капиллярное действие связано с
адгезионными свойствами воды
18
Капиллярное действие
- Как капиллярное действие приносит пользу
растениям?____________________________
9
О PowerShow.com
2.15: Вода – свойства растворителя воды
- Последнее обновление
- Сохранить как PDF
- Код страницы
- 12672
- Безграничный
- Безграничный
Цели обучения
- Объясните, почему некоторые молекулы не растворяются в воде.

Свойства растворителя воды
Вода, которая не только растворяет многие соединения, но и растворяет больше веществ, чем любая другая жидкость, считается универсальным растворителем. Полярная молекула с частично положительным и отрицательным зарядом легко растворяет ионы и полярные молекулы. Поэтому воду называют растворителем: веществом, способным растворять другие полярные молекулы и ионные соединения. Заряды, связанные с этими молекулами, образуют водородные связи с водой, окружая частицу с молекулами воды. Это называется сферой гидратации или гидратной оболочкой и служит для разделения или диспергирования частиц в воде.
При добавлении к воде ионных соединений отдельные ионы взаимодействуют с полярными областями молекул воды в процессе диссоциации, нарушая их ионные связи. Диссоциация происходит, когда атомы или группы атомов отрываются от молекул и образуют ионы. Рассмотрим поваренную соль (NaCl, или хлорид натрия): при добавлении кристаллов NaCl в воду молекулы NaCl диссоциируют на ионы Na + и Cl – , вокруг которых образуются сферы гидратации. Положительно заряженный ион натрия окружен частично отрицательным зарядом кислорода молекулы воды; отрицательно заряженный ион хлорида окружен частично положительным зарядом водорода в молекуле воды.
Положительно заряженный ион натрия окружен частично отрицательным зарядом кислорода молекулы воды; отрицательно заряженный ион хлорида окружен частично положительным зарядом водорода в молекуле воды.
Рисунок \(\PageIndex{1}\): Диссоциация NaCl в воде: Когда поваренная соль (NaCl) смешивается с водой, вокруг ионов образуются сферы гидратации.
Поскольку многие биомолекулы либо полярны, либо заряжены, вода легко растворяет эти гидрофильные соединения. Однако вода является плохим растворителем для гидрофобных молекул, таких как липиды. Неполярные молекулы вступают в гидрофобные взаимодействия в воде: вода меняет свои схемы водородных связей вокруг гидрофобных молекул, образуя клеточную структуру, называемую клатратом. Это изменение характера водородных связей водного растворителя приводит к значительному снижению общей энтропии системы, поскольку молекулы становятся более упорядоченными, чем в жидкой воде. Термодинамически такое большое уменьшение энтропии не является самопроизвольным, и гидрофобная молекула не растворится.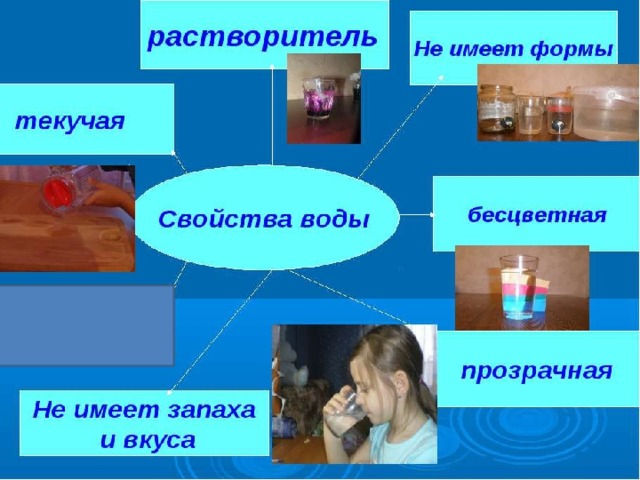


 Вода может быть жидкостью, газом или твердым телом.
Вода может быть жидкостью, газом или твердым телом.

