Содержание
Химические свойства основных оксидов | CHEMEGE.RU
Подробно про оксиды, их классификацию и способы получения можно прочитать здесь.
1. Взаимодействие с водой. С водой способны реагировать только основные оксиды, которым соответствуют растворимые гидроксиды (щелочи). Щелочи образуют щелочные металлы (литий, натрий, калий, рубидий и цезий) и щелочно-земельные (кальций, стронций, барий). Оксиды остальных металлов с водой химически не реагируют. Оксид магния реагирует с водой при кипячении.
CaO + H2O → Ca(OH)2
CuO + H2O ≠ (реакция не идет, т.к. Cu(OH)2 — нерастворимый гидроксид)
2. Взаимодействие с кислотными оксидами и кислотами. При взаимодействии основным оксидов с кислотами образуется соль этой кислоты и вода. При взаимодействии основного оксида и кислотного образуется соль:
основный оксид + кислота = соль + вода
основный оксид + кислотный оксид = соль
При взаимодействии основных оксидов с кислотами и их оксидами работает правило:
Хотя бы одному из реагентов должен соответствовать сильный гидроксид (щелочь или сильная кислота).
Иными словами, основные оксиды, которым соответствуют щелочи, реагируют со всеми кислотными оксидами и их кислотами. Основные оксиды, которым соответствуют нерастворимые гидроксиды, реагируют только с сильными кислотами и их оксидами (N2O5, NO2, SO3 и т.д.).
| Основные оксиды, которым соответствуют щелочи | Основные оксиды, которым соответствуют нерастворимые основания |
| Реагируют со всеми кислотами и их оксидами | Реагируют только с сильными кислотами и их оксидами |
| Na2O + SO2 → Na2SO3 | CuO + N2O5 → Cu(NO3)2 |
3. Взаимодействие с амфотерными оксидами и гидроксидами.
При взаимодействии основных оксидов с амфотерными образуются соли:
основный оксид + амфотерный оксид = соль
С амфотерными оксидами при сплавлении взаимодействуют только основные оксиды, которым соответствуют щелочи. При этом образуется соль. Металл в соли берется из более основного оксида, кислотный остаток — из более кислотного. В данном случае амфотерный оксид образует кислотный остаток.
При этом образуется соль. Металл в соли берется из более основного оксида, кислотный остаток — из более кислотного. В данном случае амфотерный оксид образует кислотный остаток.
K2O + Al2O3 → 2KAlO2
CuO + Al2O3 ≠ (реакция не идет, т.к. Cu(OH)2 — нерастворимый гидроксид)
(чтобы определить кислотный остаток, к формуле амфотерного или кислотного оксида добавляем молекулу воды: Al2O3 + H2O = H2Al2O4 и делим получившиеся индексы пополам, если степень окисления элемента нечетная: HAlO2. Получается алюминат-ион AlO2—. Заряд иона легко определить по числу присоединенных атомов водорода — если атом водорода 1, то заряд аниона будет -1, если 2 водорода, то -2 и т.д.).
Амфотерные гидроксиды при нагревании разлагаются, поэтому реагировать с основными оксидами фактически не могут.
4. Взаимодействие оксидов металлов с восстановителями.
При оценке окислительно-восстановительной активности металлов и их ионов можно использовать электрохимический ряд напряжений металлов:
Восстановительные свойства (способность отдавать электроны) у простых веществ-металлов здесь увеличиваются справа налево, окислительные свойства ионов металлов — увеличиваются наоборот, слева направо. При этом некоторые ионы металлов в промежуточных степенях окисления могут проявлять также восстановительные свойства (например ион Fe2+ можно окислить до иона Fe3+).
Более подробно про окислительно-восстановительные реакции можно прочитать здесь.
Таким образом, ионы некоторых металлов — окислители (чем правее в ряду напряжений, тем сильнее). При взаимодействии с восстановителями металлы переходят в степень окисления 0.
4.1. Восстановление углем или угарным газом.
Углерод (уголь) восстанавливает из оксидов до простых веществ только металлы, расположенные в ряду активности после алюминия. Реакция протекает только при нагревании.
Реакция протекает только при нагревании.
FeO + C = Fe + CO
Активные металлы, расположенные в ряду активности левее алюминия, активно взаимодействуют с углеродом, поэтому при взаимодействии их оксидов с углеродом образуются карбиды и угарный газ:
CaO + 3C = CaC2 + CO
Угарный газ также восстанавливает из оксидов только металлы, расположенные после алюминия в электрохимическом ряду:
Fe2O3 + CO = Al2O3 + CO2
CuO + CO = Cu + CO2
4.2. Восстановление водородом.
Водород восстанавливает из оксидов только металлы, расположенные в ряду активности правее алюминия. Реакция с водородом протекает только в жестких условиях – под давлением и при нагревании.
CuO + H2 = Cu + H2O
youtube.com/embed/a-7TTaROUVw» frameborder=»0″ allowfullscreen=»allowfullscreen»>
4.3. Восстановление более активными металлами (в расплаве или растворе, в зависимости от металла)
При этом более активные металлы вытесняют менее активные. То есть добавляемый к оксиду металл должен быть расположен левее в ряду активности, чем металл из оксида. Реакции, как правило, протекают при нагревании.
Например, оксид цинка взаимодействует с алюминием:
3ZnO + 2Al = Al2O3 + 3Zn
но не взаимодействует с медью:
ZnO + Cu ≠
Восстановление металлов из оксидов с помощью других металлов — это очень распространенный процесс. Часто для восстановления металлов применяют алюминий и магний. А вот щелочные металлы для этого не очень подходят – они слишком химически активны, что создает сложности при работе с ними.
Например, цезий взрывается на воздухе.
Алюмотермия – это восстановление металлов из оксидов алюминием.
Например: алюминий восстанавливает оксид меди (II) из оксида:
3CuO + 2Al = Al2O3 + 3Cu
Магниетермия – это восстановление металлов из оксидов магнием.
CuO + Mg = Cu + MgO
Железо можно вытеснить из оксида с помощью алюминия:
2Fe2O3 + 4Al → 4Fe + 2Al2O3
При алюмотермии образуется очень чистый, свободный от примесей углерода металл.
4.4. Восстановление аммиаком.
Аммиаком можно восстанавливать только оксиды неактивных металлов. Реакция протекает только при высокой температуре.
Например, аммиак восстанавливает оксид меди (II):
3CuO + 2NH3 = 3Cu + 3H2O + N2
5. Взаимодействие оксидов металлов с окислителями.
Взаимодействие оксидов металлов с окислителями.
Под действием окислителей некоторые основные оксиды (в которых металлы могут повышать степень окисления, например Fe2+, Cr2+, Mn2+ и др.) могут выступать в качестве восстановителей.
Например, оксид железа (II) можно окислить кислородом до оксида железа (III):
4FeO + O2 = 2Fe2O3
Понравилось это:
Нравится Загрузка…
Оксиды — что это такое? Химические свойства и классификация
Бесплатный вводный урок по химии
Записаться
Знакомство с оксидами обычно начинается на уроках химии в 8 классе. Из этой статьи вы узнаете, что такое оксиды в химии, их классификацию и свойства, а также способы получения.
Определение оксидов
Оксиды — это сложные вещества, состоящие из двух химических элементов (т. е. бинарные соединения), один из которых — кислород в степени окисления −2.
е. бинарные соединения), один из которых — кислород в степени окисления −2.
Общая формула оксидов: ЭxOy, где Э – химический элемент, а x и y — индексы, определяемые степенью окисления химических элементов.
Практикующий детский психолог Екатерина Мурашова
Бесплатный курс для современных мам и пап от Екатерины Мурашовой. Запишитесь и участвуйте в розыгрыше 8 уроков
Виды оксидов
Все оксиды делятся на солеобразующие и несолеобразующие.
Несолеобразующие оксиды — это оксиды, которые не взаимодействуют с кислотами и щелочами, то есть не способны образовать соли.
К несолеобразующим оксидам относят: CO, SiO, N2O, NO.
Солеобразующие оксиды — это оксиды, которые взаимодействуют с кислотами и щелочами с образованием солей.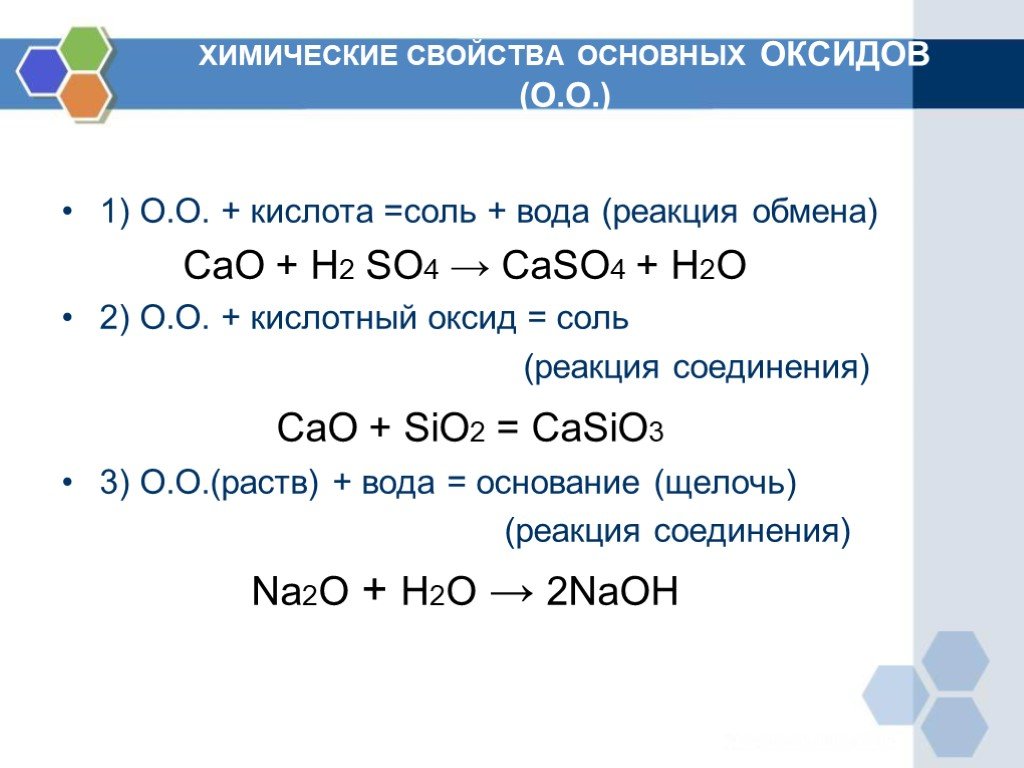
Солеобразующие оксиды делятся на три группы:
Основные оксиды — это оксиды, образованные металлами со степенью окисления +1 или +2.
Примеры основных оксидов: Na+12O, Ca+2O, Ba+2O.
Амфотерные оксиды — оксиды, образованные металлами со степенью окисления +3 или +4.
К амфотерным оксидам относят также: ZnO, BeO, PbO, SnO.
Несмотря на то, что эти металлы проявляют степень окисления +2 в данных соединениях, их оксиды проявляют амфотерные свойства.
Примеры амфотерных оксидов: Al+32O3, Fe2+3O3.
Кислотные оксиды — оксиды, образованные металлами с валентностью V и более или неметаллами с любой валентностью (за исключением несолеобразующих оксидов, то есть CO, SiO, N2O, NO).

Примеры кислотных оксидов: S+6O3, N2+5O5, Mn2+7O7.
Если один и тот же химический элемент образовывает несколько оксидов, то с увеличением степени окисления основные свойства оксидов ослабевают и усиливаются кислотные.
Например:
CrO (оксид хрома (II)) — проявляет основные свойства;
Cr2O3 (оксид хрома (III)) — проявляет амфотерные свойства;
CrO3 (оксид хрома (VI)) — проявляет кислотные свойства.
Закрепим знания о типах оксидов, изучив схему:
Номенклатура оксидов
Названия оксидов строятся по систематической номенклатуре следующим образом:
Пишем слово «оксид».

Указываем название второго химического элемента в родительном падеже.
Если этот элемент имеет переменную валентность, то указываем валентность элемента в этом соединении в скобках римской цифрой.
Примеры названий оксидов:
Fe2O3 — оксид железа (III). Читается: феррум два о три.
Na2O — оксид натрия. Читается: натрия два о.
SO3 — оксид серы (VI). Читается: эс о три.
До появления систематической номенклатуры вещества называли по присущим им специфическим свойства (цвету, запаху и т. д.). Такой способ названия веществ — тривиальная номенклатура. Некоторые названия используются и сейчас.
Названия некоторых оксидов: таблица
Химическая формула оксида | Бытовое (тривиальное название) | Возможное научное название |
|---|---|---|
| H2O | Вода | Оксид водорода |
| CO2 | Углекислый газ | Оксид углерода (IV), диоксид углерода |
| CO | Угарный газ | Оксид углерода (II), монооксид углерода |
| SO3 | Серный газ | Оксид серы (VI), триоксид серы |
| SO2 | Сернистый газ | Оксиды серы (IV), диоксид серы |
| SiO2 | Кварц, горный хрусталь, песок кварцевый, речной и морской | Оксид кремния |
| Al2O3 | Глинозем | Оксид алюминия |
| Fe2O3 | Гематит (крокус) | Оксид железа (III) |
| CaO | Негашеная известь | Оксид кальция |
Химические свойства основных оксидов
1.
 Взаимодействие с водой
Взаимодействие с водой
С водой способны реагировать оксиды тех металлов, которым соответствуют растворимые гидроксиды. То есть с водой реагируют только оксиды щелочных и щелочноземельных металлов.
Основный оксид + вода = основание Например: Na2O + H2O = 2NaOH |
|---|
Оксид магния взаимодействует с водой только при нагревании.
2. Взаимодействие с кислотными оксидами и кислотами
Основные оксиды, соответствующие щелочам, взаимодействуют со всеми кислотными оксидами и кислотами. Оксиды неактивных металлов взаимодействуют только с кислотными оксидами, соответствующими сильным кислотам, или с сильными кислотами.
Основный оксид + кислотный оксид = соль Например: BaO + SO3 = BaSO4 Основный оксид + кислота = соль + вода Например: Mg(OH)2 + 2HNO3 = Mg(NO3)2 + 2H2O |
|---|
3.
 Взаимодействие с амфотерными оксидами
Взаимодействие с амфотерными оксидами
В эту реакцию могут вступать только основные оксиды щелочных или щелочноземельных металлов. При сплавлении двух оксидов образуется соль.
Основный оксид + амфотерный оксид = соль Например: Na2O + Al2O3 = NaAlO2 |
|---|
Как составлять такие соли: металл в этой соли берем из основного оксида, а кислотный остаток из амфотерного оксида (они проявляют более кислотные свойства).
Химические свойства кислотных оксидов
1. Взаимодействие с водой
Кислотные оксиды взаимодействуют с водой с образованием соответствующих кислот. За исключением SiO2, которому соответствует нерастворимая кремниевая кислота.
Кислотный оксид + вода = кислота Например: SO3 + H2O = H2SO4 |
|---|
2.
 Взаимодействие с основными оксидами и щелочами
Взаимодействие с основными оксидами и щелочами
Кислотные оксиды сильных кислот способны взаимодействовать с любыми основными оксидами или основаниями.
Кислотный оксид + основный оксид = соль Например: SO3 + CuO = CuSO4 Кислотный оксид + основание = соль + вода Например: N2O5 + 2NaOH = 2NaNO3 + H2O |
|---|
Кислотные оксиды, соответствующие слабым кислотам (такие как CO2, SO2), способны взаимодействовать с основными оксидами, соответствующим щелочам, а также с щелочами.
3. Взаимодействие с амфотерными оксидами и гидроксидами
С амфотерными оксидами в реакцию вступают кислотные оксиды — как правило, сильных кислот.
Кислотный оксид + амфотерный оксид = соль Например: SO3 + Al2O3 = Al2(SO4)3 Кислотный оксид + амфотерный оксид = соль + вода Например: SO3 + Al(OH)3 = Al2(SO4)3 + H2O |
|---|
Химические свойства амфотерных оксидов
1. Взаимодействие с водой
Амфотерные оксиды не взаимодействуют с водой — даже при нагревании!
Амфотерный оксид + вода ≠ |
|---|
2. Взаимодействие с кислотными оксидами и кислотой
Амфотерные оксиды взаимодействуют только с сильными и средними кислотами и их оксидами.
Амфотерный оксид + кислотный оксид = соль Например: Al2O3 + N2O5 = 2Al(NO3)3 Амфотерный оксид + кислота = соль + вода Например: Al2O3 + 6HCl = 2AlCl3 + 3H2O |
|---|
3. Взаимодействие с основными оксидами
Амфотерные оксиды взаимодействуют только с теми оксидами, которые соответствуют щелочам. Реакция протекает только в расплаве, так как в растворе такие оксиды взаимодействуют преимущественно с водой с образованием щелочей.
Амфотерный оксид + основный оксид (расплав) = соль Например: Al2O3 + Na2O = 2NaAlO2 |
|---|
4.
 Взаимодействие со щелочами
Взаимодействие со щелочами
Продукты взаимодействия амфотерных оксидов со щелочами зависят от условий проведения реакции. В растворе образуются комплексные соли, а при сплавлении – средние соли.
Амфотерный оксид + щелочь (раствор) + вода = комплексная соль Например: Al2O3 + 2NaOH + 3H2O = 2Na[Al(OH)4] Амфотерный оксид + щелочь (расплав) = средняя соль + вода Например: ZnO + 2KOH = K2ZnO2 + H2O |
|---|
Получение оксидов
1. Окисление металлов
Почти все металлы окисляются кислородом до устойчивых степеней окисления.
Например: 4Al + 3O2 = 2Al2O3
Исключение
Не взаимодействуют с кислородом: платина, золото и палладий.
Металлы с переменной степенью окисления, как правило, образуют соединения в степени окисления +3:
4Cr + 3O2 = 2Cr2O3
При взаимодействии щелочных металлов (элемента IA группы) образуются пероксиды Me2O2 или надпероксиды MeO2, где Ме — щелочной металл.
2. Окисление простых веществ — неметаллов
При окислении неметаллов в избытке кислорода, как правило, образуются высшие оксиды (это оксиды, в которых неметалл проявляют высшую степень окисления):
4P + 5O2 (избыток) = 2P2O5
При недостаточном количестве кислорода образуются оксиды неметаллов в промежуточной степени окисления:
4P + 3O2 (недостаток) = 2P2O3
Существуют и исключения. Например, сера окисляется лишь до оксида серы (IV) даже в избытке кислорода:
S + O2 = SO2
Или азот, который взаимодействует с кислородом только при температуре 2 000̊С или под действием электрического разряда с образованием оксида азота (II):
N2 + O2 = 2NO
Запомнить
Галогены (элементы VIIA группы) вовсе не взаимодействуют с кислородом, так же как и инертные газы (элементы VIIIA группы).
3. Разложение гидроксидов
Некоторые кислоты и гидроксиды неустойчивы и самопроизвольно разлагаются по схеме:
Гидроксид (кислота) = оксид + вода
Например:
H2SO3 = SO2↑ + H2O
H2CO3 = CO2↑ + H2O
Ag(OH) = Ag2O + H2O
NH4OH = NH3↑ + H2O
Оксиды тяжелых металлов (нерастворимые гидроксиды) и кремниевая кислота разлагаются при нагревании по той же самой схеме.
Например:
4. Окисление сложных веществ
Сложные бинарные (состоящие из двух химических элементов) соединения окисляются с образованием двух оксидов этих элементов в устойчивых степенях окисления.
Например:
2H2S + 3O2 = 2SO2 + 2H2O
4NH3 + 5O2 = 4NO + 6H2O
Также оксиды получают разложением солей, например, карбонатов, нитратов сульфатов и т. д.
д.
Например, Li2CO3 = Li2O + CO2↑
Мы узнали, какие вещества в химии называют оксидами, какие бывают оксиды, а также разобрали свойства каждого вида. Осталось подкрепить теорию практикой — а сделать это можно на курсах по химии в онлайн-школе Skysmart!
Татьяна Сосновцева
К предыдущей статье
Ковалентные неполярные и полярные связи
К следующей статье
Химические свойства металлов
Важность оксидов и реакций оксид-вода | Водная химия оксидов
Фильтр поиска панели навигации
Oxford AcademicThe Water Chemistry of OxidesInorganic ChemistryBooksJournals
Термин поиска мобильного микросайта
Закрыть
Фильтр поиска панели навигации
Oxford AcademicThe Water Chemistry of OxidesInorganic ChemistryBooksJournals
Термин поиска на микросайте
Расширенный поиск
Иконка Цитировать
ЦитироватьРазрешения
Делиться
- Твиттер
- Подробнее
CITE
Bunker, Bruce C и William H Casey,
‘Важность оксидов и реакций оксидов’
,
Водная химия оксидов
(
, Нью-Йорк,
2016;
онлайн-издание,
Oxford Academic
, 12 ноября 2020 г.
), https://doi.org/10.1093/oso/9780199384259.003.0005,
, по состоянию на 13 ноября 2022 г.
Выберите формат
Выберите format.ris (Mendeley, Papers, Zotero).enw (EndNote).bibtex (BibTex).txt (Medlars, RefWorks)
Закрыть
Фильтр поиска панели навигации
Oxford AcademicThe Water Chemistry of OxidesInorganic ChemistryBooksJournals
Термин поиска мобильного микросайта
Закрыть
Фильтр поиска панели навигации
Oxford AcademicThe Water Chemistry of OxidesInorganic ChemistryBooksJournals
Термин поиска на микросайте
Advanced Search
Abstract
Земля состоит в основном из оксидов (рис. 1.1, табл. 1, табл. 1.1). Внутренняя часть представляет собой железоникелевое ядро, составляющее 35% массы планеты. Ядро заключено в пластичную зону, называемую мантией. Поверх мантии плавает, как шлак поверх доменной печи, тонкая оболочка, называемая коркой. И мантия, и кора (65% массы планеты) состоят в основном из оксидов. Хотя земная кора тонкая (толщина 8–13 км под океаническими бассейнами и до 70 км под континентами), она все же представляет собой огромное количество вещества, соответствующее 7 млрд км3, с весом 2,5·1019.метрических тонн. Из этой массы 46% связано с относительно легким элементом кислородом, преимущественно с оксидами, содержащими кремний, алюминий и железо. Почти каждый материал, с которым мы, люди, сталкиваемся или используем, получен из оксидных строительных блоков, составляющих земную кору. Вода на сегодняшний день является самой распространенной жидкостью на планете. На самом деле может быть трудно понять, сколько воды содержится на Земле. Большая часть нашей жидкой воды находится в океанах, которые покрывают общую площадь поверхности 361 млн км2 (70% поверхности Земли) при средней глубине почти 4 км (табл.
1, табл. 1.1). Внутренняя часть представляет собой железоникелевое ядро, составляющее 35% массы планеты. Ядро заключено в пластичную зону, называемую мантией. Поверх мантии плавает, как шлак поверх доменной печи, тонкая оболочка, называемая коркой. И мантия, и кора (65% массы планеты) состоят в основном из оксидов. Хотя земная кора тонкая (толщина 8–13 км под океаническими бассейнами и до 70 км под континентами), она все же представляет собой огромное количество вещества, соответствующее 7 млрд км3, с весом 2,5·1019.метрических тонн. Из этой массы 46% связано с относительно легким элементом кислородом, преимущественно с оксидами, содержащими кремний, алюминий и железо. Почти каждый материал, с которым мы, люди, сталкиваемся или используем, получен из оксидных строительных блоков, составляющих земную кору. Вода на сегодняшний день является самой распространенной жидкостью на планете. На самом деле может быть трудно понять, сколько воды содержится на Земле. Большая часть нашей жидкой воды находится в океанах, которые покрывают общую площадь поверхности 361 млн км2 (70% поверхности Земли) при средней глубине почти 4 км (табл. 1). Объем воды в океанах составляет 1,4 млрд км3, что составляет пятую часть объема всей земной коры. Общая масса гидросферы составляет 1,7·1018 т. Однако общее содержание воды на планете оценивается в 100 раз больше, чем жидкость, которую мы видим; большая часть воды на Земле (2,1020 мт) связана с гидрооксидными минералами в недрах Земли. Все мы знаем, что жизнь на Земле не могла бы существовать без воды. Однако для сравнения: общая масса всех живых существ на Земле составляет 3,6·1011 мт, что в 5 миллионов раз меньше массы жидкой воды на нашей планете.
1). Объем воды в океанах составляет 1,4 млрд км3, что составляет пятую часть объема всей земной коры. Общая масса гидросферы составляет 1,7·1018 т. Однако общее содержание воды на планете оценивается в 100 раз больше, чем жидкость, которую мы видим; большая часть воды на Земле (2,1020 мт) связана с гидрооксидными минералами в недрах Земли. Все мы знаем, что жизнь на Земле не могла бы существовать без воды. Однако для сравнения: общая масса всех живых существ на Земле составляет 3,6·1011 мт, что в 5 миллионов раз меньше массы жидкой воды на нашей планете.
Ключевые слова:
кислотно-основная химия, скорости растворения, коэффициенты экстинкции, гидросфера, ионный обмен, оптоэлектроника, показатель преломления, сверхпроводящие оксиды, предел прочности при растяжении
Предмет
Неорганическая химия
В настоящее время у вас нет доступа к этой главе.
Войти
Получить помощь с доступом
Получить помощь с доступом
Доступ для учреждений
Доступ к контенту в Oxford Academic часто предоставляется посредством институциональных подписок и покупок. Если вы являетесь членом учреждения с активной учетной записью, вы можете получить доступ к контенту одним из следующих способов:
Если вы являетесь членом учреждения с активной учетной записью, вы можете получить доступ к контенту одним из следующих способов:
Доступ на основе IP
Как правило, доступ предоставляется через институциональную сеть к диапазону IP-адресов. Эта аутентификация происходит автоматически, и невозможно выйти из учетной записи с IP-аутентификацией.
Войдите через свое учреждение
Выберите этот вариант, чтобы получить удаленный доступ за пределами вашего учреждения. Технология Shibboleth/Open Athens используется для обеспечения единого входа между веб-сайтом вашего учебного заведения и Oxford Academic.
- Нажмите Войти через свое учреждение.
- Выберите свое учреждение из предоставленного списка, после чего вы перейдете на веб-сайт вашего учреждения для входа.
- При посещении сайта учреждения используйте учетные данные, предоставленные вашим учреждением.
 Не используйте личную учетную запись Oxford Academic.
Не используйте личную учетную запись Oxford Academic. - После успешного входа вы вернетесь в Oxford Academic.
Если вашего учреждения нет в списке или вы не можете войти на веб-сайт своего учреждения, обратитесь к своему библиотекарю или администратору.
Войти с помощью читательского билета
Введите номер своего читательского билета, чтобы войти в систему. Если вы не можете войти в систему, обратитесь к своему библиотекарю.
Члены общества
Доступ члена общества к журналу достигается одним из следующих способов:
Войти через сайт сообщества
Многие общества предлагают единый вход между веб-сайтом общества и Oxford Academic. Если вы видите «Войти через сайт сообщества» на панели входа в журнале:
- Щелкните Войти через сайт сообщества.
- При посещении сайта общества используйте учетные данные, предоставленные этим обществом.
 Не используйте личную учетную запись Oxford Academic.
Не используйте личную учетную запись Oxford Academic. - После успешного входа вы вернетесь в Oxford Academic.
Если у вас нет учетной записи сообщества или вы забыли свое имя пользователя или пароль, обратитесь в свое общество.
Войти с помощью личного кабинета
Некоторые общества используют личные аккаунты Oxford Academic для предоставления доступа своим членам. Смотри ниже.
Личный кабинет
Личную учетную запись можно использовать для получения оповещений по электронной почте, сохранения результатов поиска, покупки контента и активации подписок.
Некоторые общества используют личные аккаунты Oxford Academic для предоставления доступа своим членам.
Просмотр учетных записей, вошедших в систему
Щелкните значок учетной записи в правом верхнем углу, чтобы:
- Просмотр вашей личной учетной записи и доступ к функциям управления учетной записью.

- Просмотр институциональных учетных записей, предоставляющих доступ.
Выполнен вход, но нет доступа к содержимому
Oxford Academic предлагает широкий ассортимент продукции. Подписка учреждения может не распространяться на контент, к которому вы пытаетесь получить доступ. Если вы считаете, что у вас должен быть доступ к этому контенту, обратитесь к своему библиотекарю.
Ведение счетов организаций
Для библиотекарей и администраторов ваша личная учетная запись также предоставляет доступ к управлению институциональной учетной записью. Здесь вы найдете параметры для просмотра и активации подписок, управления институциональными настройками и параметрами доступа, доступа к статистике использования и т. д.
Покупка
Наши книги можно приобрести по подписке или приобрести в библиотеках и учреждениях.
Информация о покупке
Водная химия оксидов
Иконка Цитировать
ЦитироватьРазрешения
Делиться
- Твиттер
- Подробнее
CITE
Bunker, Bruce C и William H Casey,
The Aveyous Hemistry of Oxides
(
, Нью -Йорк,
2016;
Online Edn,
Oxford Academic
, 12 ноября.
), https://doi.org/10.1093/oso/9780199384259.001.0001,
, по состоянию на 13 ноября 2022 г.
Выберите формат
Выберите format.ris (Mendeley, Papers, Zotero).enw (EndNote).bibtex (BibTex).txt (Medlars, RefWorks)
Закрыть
Фильтр поиска панели навигации
Oxford AcademicThe Water Chemistry of OxidesInorganic ChemistryBooksJournals
Термин поиска мобильного микросайта
Закрыть
Фильтр поиска панели навигации
Oxford AcademicThe Water Chemistry of OxidesInorganic ChemistryBooksJournals
Термин поиска на микросайте
Расширенный поиск
Abstract
Водная химия оксидов представляет собой однотомный текст, в котором собраны все критические вопросы, связанные с взаимодействием оксидных материалов с водными растворами. Он служит основным справочником для ученых, работающих с оксидами в контексте геологии, различных типов неорганической химии и материаловедения. Текст также полезен для специалистов, работающих с промышленными приложениями, в которых оксиды либо получают, либо должны работать в водной среде. Том состоит из пяти ключевых разделов. Первая часть состоит из двух вводных глав, предназначенных для ознакомления инженеров, химиков, геологов и ученых-промышленников с общими интересами к физическим и химическим свойствам оксидных материалов. Во второй части представлены основные и фундаментальные принципы, которые имеют решающее значение для понимания большинства основных реакций между водой и оксидами. Часть третья посвящена синтезу оксидных материалов в водной среде. Четвертая часть посвящена реакциям оксид-вода и их экологическим и технологическим последствиям, а пятая часть посвящена другим типам соответствующих реакций. «Водная химия оксидов» — первая книга, в которой в одном томе содержится исчерпывающий обзор всех критических реакций между оксидами и водой.
Он служит основным справочником для ученых, работающих с оксидами в контексте геологии, различных типов неорганической химии и материаловедения. Текст также полезен для специалистов, работающих с промышленными приложениями, в которых оксиды либо получают, либо должны работать в водной среде. Том состоит из пяти ключевых разделов. Первая часть состоит из двух вводных глав, предназначенных для ознакомления инженеров, химиков, геологов и ученых-промышленников с общими интересами к физическим и химическим свойствам оксидных материалов. Во второй части представлены основные и фундаментальные принципы, которые имеют решающее значение для понимания большинства основных реакций между водой и оксидами. Часть третья посвящена синтезу оксидных материалов в водной среде. Четвертая часть посвящена реакциям оксид-вода и их экологическим и технологическим последствиям, а пятая часть посвящена другим типам соответствующих реакций. «Водная химия оксидов» — первая книга, в которой в одном томе содержится исчерпывающий обзор всех критических реакций между оксидами и водой. Таким образом, он объединяет широкий спектр существующих книг и литературы в центральное место, которое обеспечивает ключевую ссылку для понимания и доступа к широкому кругу более специализированных тем. Книга содержит более 300 рисунков и таблиц.
Таким образом, он объединяет широкий спектр существующих книг и литературы в центральное место, которое обеспечивает ключевую ссылку для понимания и доступа к широкому кругу более специализированных тем. Книга содержит более 300 рисунков и таблиц.
Предмет
Неорганическая химия
Содержание
Передний вопрос
Титульные страницы
Преданность
Подписи к рисункам на обложке
12Часть первая
Введение в оксиды
Расширять
31
Важность оксидов и реакций оксид-вода
Расширять
222
Обзор оксидных структур и составов
49Часть вторая
Основные реакции оксидов в водных растворах513
Структура и свойства воды
Расширять
614
Растворенные ионы в воде
Расширять
875
Продукты гидролиза: растворимые мультикатионные кластеры
Расширять
1326
Химия протяженных оксидных поверхностей
165Часть третья
Водный синтез и обработка оксидов
Расширять
1677
Зарождение и рост твердых оксидных и гидроксидных фаз
Расширять
1918
Коллоидная химия оксидов
Расширять
2319
Биоинспирированный синтез оксидных наноструктур
267Часть четвертая
Технологически важные оксидные реакции
Расширять
26826910
Ионообменное поведение оксидов
Расширять
30611
Электрохимия оксидов
Расширять
33712
Оксидные пленки при коррозии металлов: химия оксидных дефектов
Расширять
37113
Фотохимия и реакции в возбужденном состоянии оксидов
403Часть пятая
Реакции с участием тетраэдрических оксидов
Расширять
40514
Водная полимеризация силикатов и алюмосиликатов
Расширять
44415
Растворение и выщелачивание стекла
Расширять
48116
Коррозионное растрескивание под напряжением: химически активируемая наномеханика
509Часть шестая
Экологическая геохимия оксидов
Расширять
51117
Выветривание оксидов
Расширять
53718
Влияние оксидов на химию окружающей среды
Конец Материи
Индекс
Войти
Получить помощь с доступом
Получить помощь с доступом
Институциональный доступ
Доступ к контенту в Oxford Academic часто предоставляется посредством институциональных подписок и покупок. Если вы являетесь членом учреждения с активной учетной записью, вы можете получить доступ к контенту одним из следующих способов:
Если вы являетесь членом учреждения с активной учетной записью, вы можете получить доступ к контенту одним из следующих способов:
Доступ на основе IP
Как правило, доступ предоставляется через институциональную сеть к диапазону IP-адресов. Эта аутентификация происходит автоматически, и невозможно выйти из учетной записи с IP-аутентификацией.
Войдите через свое учреждение
Выберите этот вариант, чтобы получить удаленный доступ за пределами вашего учреждения. Технология Shibboleth/Open Athens используется для обеспечения единого входа между веб-сайтом вашего учебного заведения и Oxford Academic.
- Щелкните Войти через свое учреждение.
- Выберите свое учреждение из предоставленного списка, после чего вы перейдете на веб-сайт вашего учреждения для входа.
- Находясь на сайте учреждения, используйте учетные данные, предоставленные вашим учреждением.
 Не используйте личную учетную запись Oxford Academic.
Не используйте личную учетную запись Oxford Academic. - После успешного входа вы вернетесь в Oxford Academic.
Если вашего учреждения нет в списке или вы не можете войти на веб-сайт своего учреждения, обратитесь к своему библиотекарю или администратору.
Войти с помощью читательского билета
Введите номер своего читательского билета, чтобы войти в систему. Если вы не можете войти в систему, обратитесь к своему библиотекарю.
Члены общества
Доступ члена общества к журналу достигается одним из следующих способов:
Войти через сайт сообщества
Многие общества предлагают единый вход между веб-сайтом общества и Oxford Academic. Если вы видите «Войти через сайт сообщества» на панели входа в журнале:
- Щелкните Войти через сайт сообщества.
- При посещении сайта общества используйте учетные данные, предоставленные этим обществом.
 Не используйте личную учетную запись Oxford Academic.
Не используйте личную учетную запись Oxford Academic. - После успешного входа вы вернетесь в Oxford Academic.
Если у вас нет учетной записи сообщества или вы забыли свое имя пользователя или пароль, обратитесь в свое общество.
Вход через личный кабинет
Некоторые общества используют личные аккаунты Oxford Academic для предоставления доступа своим членам. Смотри ниже.
Личный кабинет
Личную учетную запись можно использовать для получения оповещений по электронной почте, сохранения результатов поиска, покупки контента и активации подписок.
Некоторые общества используют личные аккаунты Oxford Academic для предоставления доступа своим членам.
Просмотр учетных записей, вошедших в систему
Щелкните значок учетной записи в правом верхнем углу, чтобы:
- Просмотр вашей личной учетной записи и доступ к функциям управления учетной записью.




 Не используйте личную учетную запись Oxford Academic.
Не используйте личную учетную запись Oxford Academic. Не используйте личную учетную запись Oxford Academic.
Не используйте личную учетную запись Oxford Academic.
 Не используйте личную учетную запись Oxford Academic.
Не используйте личную учетную запись Oxford Academic. Не используйте личную учетную запись Oxford Academic.
Не используйте личную учетную запись Oxford Academic.