Содержание
Опыты по химии. Непредельные углеводороды
Чтобы поделиться, нажимайте
Постановка опытов и текст – к.п.н. Павел Беспалов.
Взаимодействие ацетилена с хлором
В цилиндр насыпаем небольшое количество кристаллов перманганата калия и бросаем кусочек карбида кальция. Затем приливаем в цилиндр соляную кислоту. В сосуде наблюдаются вспышки, стенки цилиндра покрываются сажей. При взаимодействии соляной кислоты с перманганатом калия выделяется газ хлор
16 HCI + 2KMnO4 = 5CI2 + 2 KCI + 2 MnCI2 + 8H2O
С соляной кислотой карбид кальция дает ацетилен
СаС2 + 2 HCI = С2Н2 + СаCI2
Хлор с ацетиленом взаимодействуют, образуя хлороводород и уголь
С2Н2 + CI2 = 2С + 2 НCI
Оборудование: цилиндр, шпатель.
Техника безопасности. Соблюдать правила работы с горючими газами. Опыт проводить только под тягой. После проведения опыта цилиндр залить водой.
Взаимодействие этилена с бромной водой
Получаем этилен нагреванием смеси этилового спирта с концентрированной серной кислотой. Выделяющийся этилен пропустим через раствор брома в воде, который называют бромной водой. Бромная вода очень быстро обесцвечивается. Бром присоединяется к этилену по месту двойной связи. При этом образуется 1,2-дибромэтан.
СН2=СН2 + Br2 = CH2Br — CH2Br
Реакция обесцвечивания водного раствора брома служит качественной реакцией на непредельность органических соединений.
Оборудование: колба Вюрца, капельная воронка, промывалка, газоотводная трубка, стакан или пробирка, штатив.
Техника безопасности. Соблюдать правила работы с горючими газами, концентрированными кислотами и огнеопасными жидкостями.
Взаимодействие ацетилена с бромной водой
Ацетилен получаем действием воды на карбид кальция. Пропустим выделяющийся ацетилен через бромную воду. Наблюдаем обесцвечивание бромной воды. Бром присоединяется к ацетилену по месту тройной связи. При этом образуется соединение с четырьмя атомами брома в молекуле — 1,1,2,2-тетрабромэтан.
СН ≡ СН + 2Br2 = CHBr2 — CHBr2
Обесцвечивание бромной воды доказывает непредельность ацетилена.
Оборудование: колба Вюрца, делительная воронка, газоотводная трубка, стакан или пробирка, штатив.
Техника безопасности. Опыт следует проводить под тягой. Соблюдать правила работы с горючими газами.
Соблюдать правила работы с горючими газами.
Взаимодействие ацетилена с раствором перманганата калия
Ацетилен получаем действием воды на карбид кальция. При пропускании ацетилена через подкисленный раствор перманганата калия наблюдаем быстрое обесцвечивание раствора. Происходит окисление ацетилена по месту разрыва тройной связи с образованием продукта окисления – щавелевой кислоты. В избытке перманганата калия щавелевая кислота окисляется до углекислого газа и воды.
Обесцвечивание раствора перманганата калия служит доказательством непредельности ацетилена.
Оборудование: колба Вюрца, делительная воронка, газоотводная трубка, стакан, штатив.
Техника безопасности. Соблюдать правила работы с горючими газами.
Взаимодействие этилена с раствором перманганата калия.
Получаем этилен нагреванием смеси этилового спирта с концентрированной серной кислотой. Опустим газоотводную трубку с выделяющимся этиленом в подкисленный раствор перманганата калия. Раствор быстро обесцвечивается. При этом этилен окисляется в двухатомный спирт этиленгликоль.
Раствор быстро обесцвечивается. При этом этилен окисляется в двухатомный спирт этиленгликоль.
СН2=СН2 + [О] + Н-ОН = CH2ОН — CH2ОН
Эта реакция является качественной реакцией на двойную связь.
Оборудование: колба Вюрца, капельная воронка, промывалка, газоотводная трубка, стакан или пробирка, штатив.
Техника безопасности.
Соблюдать правила работы с горючими газами, концентрированными кислотами и огнеопасными жидкостями.
Взрыв смеси ацетилена с кислородом
Смесь ацетилена с кислородом при поджигании взрывается с большой силой. Поэтому безопасно экспериментировать только небольшими объемами смеси — в этом нам поможет раствор мыла. В фарфоровую ступку с водой и раствором мыла добавим немного пероксида водорода. К полученному раствору прибавим катализатор — диоксид марганца.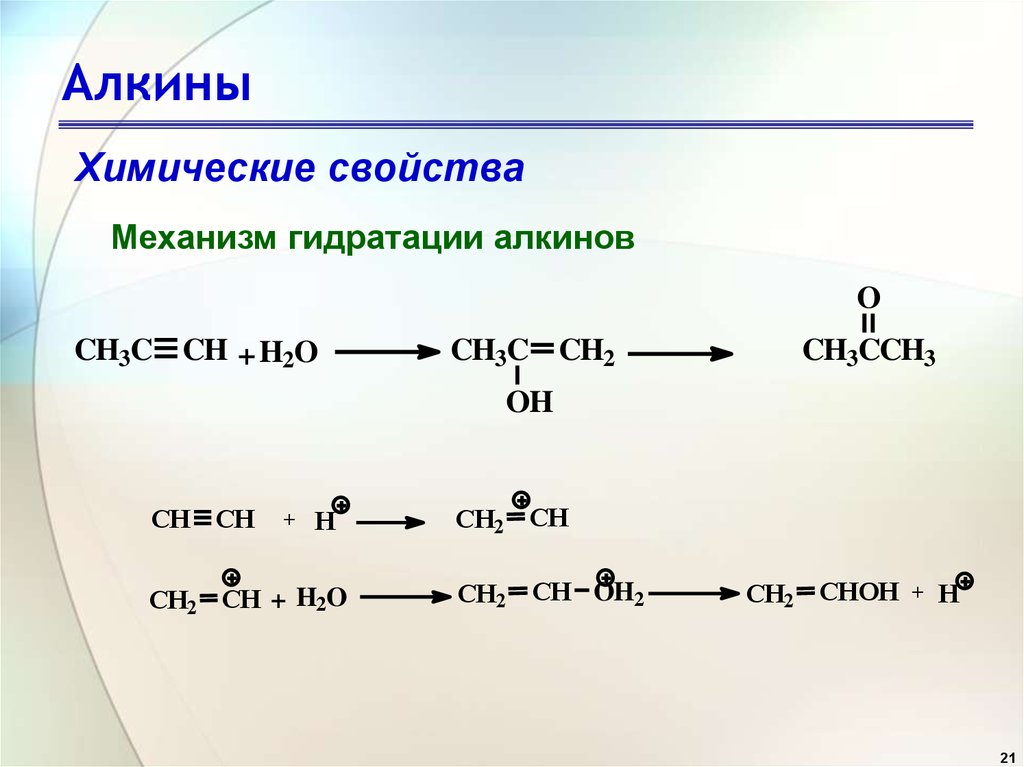 Сразу же начинается выделение кислорода.
Сразу же начинается выделение кислорода.
2Н2О2 = 2Н2О + О2
В эту смесь опустим небольшой кусочек карбида кальция. При взаимодействии с водой он дает ацетилен.
СаС2 + 2 Н2О = С2Н2 + Са(ОН)2
На поверхности раствора, благодаря присутствию мыла, образуются пузыри, заполненные смесью ацетилена с кислородом. При поджигании пузырей происходят сильные взрывы смеси ацетилена с кислородом.
Оборудование: фарфоровая ступка, лучина.
Техника безопасности. Соблюдать правила работы с горючими газами. Поджигать можно только небольшой объем смеси.
Горение ацетилена
Получим ацетилен из карбида кальция и воды. Закроем колбу пробкой с газоотводной трубкой. В конец газоотводной трубки вставлена игла для инъекций. Через некоторое время, когда ацетилен полностью вытеснит воздух из колбы, подожжем выделяющейся газ. Ацетилен горит белым ярким пламенем. При горении ацетилена образуется углекислый газ и вода.
Ацетилен горит белым ярким пламенем. При горении ацетилена образуется углекислый газ и вода.
2СН ≡ СН + 5О2 → 4СО2 + 2Н2О
Внесем пробирку в пламя горящего ацетилена. На пробирке оседает сажа. При недостатке кислорода ацетилен не успевает полностью сгорать и выделяет углерод в виде сажи. Светимость пламени объясняется большим процентным содержанием углерода в ацетилене и высокой температурой его пламени, в котором раскаляются несгоревшие частицы углерода.
Оборудование: круглодонная колба, пробка с иглой от медицинского шприца, штатив.
Техника безопасности. Соблюдать правила работы с горючими газами. Поджигать ацетилен можно только после отбора пробы на чистоту.
Горение этилена
Получаем этилен нагреванием смеси этилового спирта с концентрированной серной кислотой. Смесь готовят из одной части спирта и трех частей серной кислоты. Серная кислота играет роль водоотнимающего средства. При нагревании смеси выделяется этилен.
При нагревании смеси выделяется этилен.
С2Н5ОН = С2Н4 + Н2О
Собираем этилен в цилиндр способом вытеснения воды. Этилен – бесцветный газ, малорастворимый в воде. Этилен сгорает на воздухе с образованием углекислого газа и воды.
С2Н4 + 3О2 = 2СО2 + 2Н2О
Оборудование: колба Вюрца, делительная воронка, промывалка, газоотводная трубка, штатив, цилиндр.
Техника безопасности. Соблюдать правила работы с горючими газами, концентрированными кислотами и огнеопасными жидкостями.
Получение ацетиленида меди
Ацетилен получаем действием воды на карбид кальция. Атомы водорода в молекуле ацетилена обладают большой подвижностью. Поэтому они легко могут быть замещены металлами. Пропустим через аммиачный раствор хлорида меди (I) ацетилен. Выпадает красный осадок ацетиленида меди (I) .
СН ≡ СН + 2CuCI → CuC ≡ CCu ↓ + 2HCI
Оборудование: колба Вюрца, делительная воронка, газоотводная трубка, стакан или пробирка, полипропиленовая воронка, фильтровальная бумага, штатив.
Техника безопасности. Соблюдать правила работы с горючими газами. Получать только небольшие количества ацетиленида меди. Высушеный ацетиленид меди — очень опасное взрывчатое вещество. Его уничтожают обработкой концентрированной соляной кислотой.
Получение ацетиленида серебра
Ацетилен получаем действием воды на карбид кальция. Атомы водорода в молекуле ацетилена обладают большой подвижностью. Поэтому они легко могут быть замещены металлами. Пропустим через аммиачный раствор оксида серебра ацетилен. Выпадает осадок ацетиленида серебра.
СН ≡ СН + Аg2O → AgC ≡ CAg ↓ + H2O
Оборудование: колба Вюрца, делительная воронка, газоотводная трубка, стакан или пробирка, полипропиленовая воронка, фильтровальная бумага, штатив.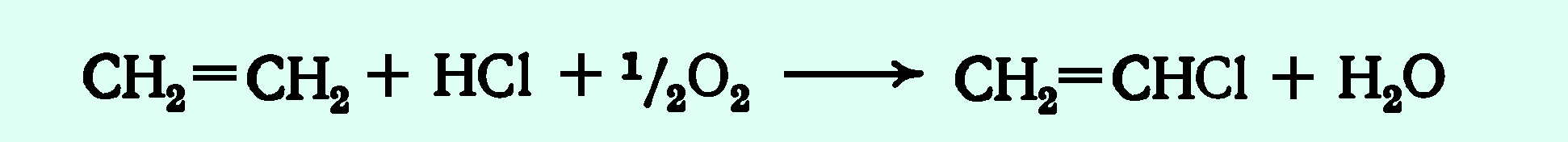
Техника безопасности. Соблюдать правила работы с горючими газами. Получать только небольшие количества ацетиленида серебра. Высушенный ацетиленид серебра — очень опасное взрывчатое вещество. Его уничтожают обработкой концентрированной соляной кислотой.
Непрочность ацетиленидов металлов
Ацетилениды металлов — неустойчивые соединения. Во влажном состоянии ацетиленид серебра устойчив, высушенный он легко взрывается. Поднесем к сухому ацетилениду серебра тлеющую лучинку — он взрывается. Проведем аналогичный эксперимент с ацетиленидом меди (I). Так же как и ацетиленид серебра, ацетиленид меди (I) во влажном состоянии устойчив, но легко разлагается, если его высушить. Горящая лучинка, поднесенная к сухому ацетилениду меди (I), приводит к взрыву. При этом появляется пламя, окрашенное в зеленый цвет.
Оборудование: огнезащитная прокладка, лучина.
Техника безопасности. Получать и разлагать можно только небольшие количества ацетиленида серебра и меди. Высушеные ацетилениды серебра и меди — опасные взрывчатые вещества. Ацетилениды уничтожают обработкой концентрированной соляной кислотой.
Высушеные ацетилениды серебра и меди — опасные взрывчатые вещества. Ацетилениды уничтожают обработкой концентрированной соляной кислотой.
Огонь из воды и спаянные трубы
Можно ли получить огонь из воды? Как создать инструмент, который сделал бы промышленную обработку металлов дешевле и экологически безопаснее? Об этом – в очередном выпуске программы “Футурис”!
Европейские учёные и инженеры разработали портативное устройство, способное превращать воду в огонь. Теперь пайка, сварка и другие операции с металлом не требуют баллонов со сжатым газом – горючее производится на месте по мере потребностей.
По словам технолога Эндрю Эллиса из ITM Power, “это устройство для электролиза – в нём используется обычный ток из розетки и вода. Вода расщепляется на газообразные водород и кислород, которые подаются в горелку. Получившееся пламя можно использовать для пайки или других промышленных нужд. Одним словом, мы превращаем воду в огонь”.
До сих пор использование электролиза было ограничено высокой стоимостью этой технологии, в которой применяются дорогостоящие мембраны и катализаторы на основе платины и других драгметаллов. Учёным удалось сделать электролиз экономичнее.
Учёным удалось сделать электролиз экономичнее.
“У нас здесь целая команда химиков работает над новой формулой для мембраны – с ней эффективность электролиза увеличивается, – говорит Эндрю. – Кроме того, мы проводим масштабные исследования катализаторов, чтобы снизить потребность в платине и заменить её гораздо менее дорогими материалами. Эти исследования позволили значительно снизить стоимость электролизного оборудования”.
Водород и кислород, полученные из воды, вновь смешиваются у кончика горелки. Температура этого пламени ниже, чем у пропанового или ацетиленового, и с ним проще обходиться.
“Как вы видите, это пламя намного мягче окси-ацетиленового, – говорит сварщик Рори Олни. – В нём нет раскалённого ядра, так что оно не так режет глаза. Как вы видите, я работаю в прозрачных очках, без сварочной маски”.
Ацетиленовые баллоны взрывоопасны и неудобны в хранении и транспортировке. Во многих ситуациях их запрещено использовать по соображениям безопасности. Кроме того, горячим ацетиленовым пламенем легко испортить заготовки из лёгкого металла – например, алюминия.
Как утверждает специалист по свойствам материалов Стивен Бэйнс,
“у ацетилена высокая температура и скорость пламени, так что им можно очень быстро расплавить заготовку – это один из основных недостатков”.
Водородное пламя гораздо мягче и чище: вместо дыма при его горении получается вода.
“Если сравнивать с ацетиленом, – говорит инженер Ник Ладфорд, – газ из этого электролизного прибора будет обходиться как минимум в 20 раз дешевле – это если учитывать стоимость хранения ацетиленовых баллонов, страховку и так далее, плюс цену собственно газа”.
Малые и средние предприятия смогут оценить преимущества этой технологии в скором будущем, когда она, как ожидается, выйдет на рынок.
Пока же прототип электролизной системы испытывают профессиональные сварщики в Великобритании.
“Одно из главным преимуществ этой системы – в том, что горелка всегда остаётся холодной, – доволен сварщик Рори. – Пламя горит только снаружи факела, так что он сам не нагревается и остаётся прохладным на ощупь. И когда гасишь пламя по окончании пайки, холодную горелку можно просто положить на стол, не опасаясь что-то сжечь”.
И когда гасишь пламя по окончании пайки, холодную горелку можно просто положить на стол, не опасаясь что-то сжечь”.
www.safeflameproject.eu
Также по теме
Защита морей и океанов: подводная реставрация спасёт экосистемы?
Европейским строителям помогут роботы
В ЕС наградили ученых за новую терапию рака
ВЕЛИКОБРИТАНИЯ
ВОДНЫЕ РЕСУРСЫ
ИССЛЕДОВАНИЯ
НАУКА
НОВЫЕ ТЕХНОЛОГИИ
11.9: Добавление воды — Химия LibreTexts
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 30481
Реакция: гидратация алкинов
Как и в случае с алкенами, гидратация (присоединение воды) к алкинам требует сильной кислоты, обычно серной кислоты, и ей способствует сульфат ртути. Однако, в отличие от присоединения к двойным связям, которые дают спиртовые продукты, присоединение воды к алкинам дает кетоновые продукты (за исключением ацетилена, который дает ацетальдегид). Объяснение этому отклонению кроется в енол-кето таутомеризация , иллюстрируемая следующим уравнением. Исходным продуктом присоединения воды к алкину является енол (соединение, имеющее гидроксильный заместитель, присоединенный к двойной связи), и он немедленно перестраивается в более стабильный кето-таутомер.
Однако, в отличие от присоединения к двойным связям, которые дают спиртовые продукты, присоединение воды к алкинам дает кетоновые продукты (за исключением ацетилена, который дает ацетальдегид). Объяснение этому отклонению кроется в енол-кето таутомеризация , иллюстрируемая следующим уравнением. Исходным продуктом присоединения воды к алкину является енол (соединение, имеющее гидроксильный заместитель, присоединенный к двойной связи), и он немедленно перестраивается в более стабильный кето-таутомер.
Таутомеры определяются как быстро взаимопревращающиеся структурные изомеры, обычно отличающиеся другим расположением связи для лабильного атома водорода (здесь окрашены красным) и другим расположением двойной связи. Равновесие между таутомерами не только быстро наступает в нормальных условиях, но часто сильно благоприятствует одному из изомеров (ацетон, например, 99,999% кето-таутомер). Даже в таких односторонних равновесиях свидетельство присутствия второстепенного таутомера исходит из химического поведения соединения. Таутомерные равновесия катализируются следами кислот или оснований, которые обычно присутствуют в большинстве химических образцов. Три приведенных ниже примера иллюстрируют эти реакции для различных замещений тройной связи. Стадия таутомеризации указана красной стрелкой. Для терминальных алкинов добавление воды следует правилу Марковникова, как и во втором примере ниже, и конечным продуктом является метилкетон (за исключением ацетилена, показанного в первом примере). Для внутренних алкинов (тройная связь находится внутри более длинной цепи) добавление воды не является региоселективным. Если тройная связь расположена несимметрично (т. е. если R и R’ в третьем уравнении не совпадают), будут образованы два изомерных кетона.
Таутомерные равновесия катализируются следами кислот или оснований, которые обычно присутствуют в большинстве химических образцов. Три приведенных ниже примера иллюстрируют эти реакции для различных замещений тройной связи. Стадия таутомеризации указана красной стрелкой. Для терминальных алкинов добавление воды следует правилу Марковникова, как и во втором примере ниже, и конечным продуктом является метилкетон (за исключением ацетилена, показанного в первом примере). Для внутренних алкинов (тройная связь находится внутри более длинной цепи) добавление воды не является региоселективным. Если тройная связь расположена несимметрично (т. е. если R и R’ в третьем уравнении не совпадают), будут образованы два изомерных кетона.
| HC≡CH + H 2 O + HGSO 4 & H 2 SO 4 — > [H 2 C = CHOH] — > [H 2 C = CHOH] — > . C-CH=O |
| RC≡CH + H 2 O + HgSO 4 & H 2 SO 4 —— > [ — > RC(=O)CH 3 |
| RC≡CR’ + H 2 O + HgSO 4 & H 2 SO 4 —— > [ RHC=C(OH)R’ + RC(OH)=CHR’ ] —— > RCH 2 -C (=O)R’ + RC(=O)-CH 2 R’ |
При добавлении воды алкины могут гидратироваться с образованием енолов, которые спонтанно таутомеризуются в кетоны. Реакция катализируется ионами ртути. Следует правилу Марковникова: концевые алкины дают метилкетоны
Реакция катализируется ионами ртути. Следует правилу Марковникова: концевые алкины дают метилкетоны
- Первая стадия представляет собой кислотно-основную реакцию, в которой π-электроны тройной связи действуют как основание Льюиса и атакуют протон, тем самым протинируя углерод с наибольшим количеством водородных заместителей.
- Второй этап представляет собой атаку нуклеофильной молекулы воды на электрофильный карбокатион, в результате чего образуется ион оксония.
- Затем вы депротонируете основание, образуя спирт, называемый енолом, который затем таутомеризуется в кетон.
- Таутомерия представляет собой одновременный сдвиг протона и двойной связи, который переходит из енольной формы в кетоизомерную форму, как показано выше на рисунке 7.
Теперь давайте рассмотрим некоторые реакции гидратации.
Гидратация терминального алкина дает метилкетоны
Как показано на рисунке 7, π-электроны будут атаковать протон, образуя карбокатион, который затем подвергается атаке нуклеофильных молекул воды. После депротинирования мы получаем енол, который затем таутомеризуется в показанную кетоновую форму.
После депротинирования мы получаем енол, который затем таутомеризуется в показанную кетоновую форму.
Гидратация алкина
Как вы можете видеть здесь, π-электроны тройной связи атакуют протон, который образует ковалентную связь на углероде с наибольшим количеством водородных заместителей. Как только водород связан, у вас есть карбокатион, который подвергается атаке молекулой воды. Теперь у вас есть положительный заряд кислорода, что приводит к проникновению основания и депротинированию молекулы. После депротинирования получается енол, который затем таутомеризуется.
Здесь показана таутомерия, когда протон атакуют π-электроны двойной связи, образуя ковалентную связь между углеродом и водородом на менее замещенном углероде. Электроны от кислорода в конечном итоге перемещаются к углероду, образуя двойную связь с углеродом и придавая себе положительный заряд, который затем подвергается атаке со стороны основания. Основание депротинирует кислород, что приводит к более стабильному конечному продукту в состоянии равновесия, который представляет собой кетон.
Авторы
11.9: Addition of Water распространяется по незадекларированной лицензии, автором, ремиксом и/или куратором является LibreTexts.
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Показать страницу TOC
- № на стр.
- Теги
Реакционная способность алкинов
Реакции алкинов |
|---|
Тройная углерод-углеродная связь может быть расположена в любом неразветвленном месте внутри углеродной цепи или на конце цепи, и в этом случае она называется терминал . Из-за своей линейной конфигурации (угол связи sp-гибридизованного углерода составляет 180º) десятичленное углеродное кольцо является наименьшим, которое может выполнять эту функцию без чрезмерного напряжения. Поскольку наиболее распространенным химическим превращением двойной углерод-углеродной связи является реакция присоединения, можно ожидать, что то же самое верно и для тройных углерод-углеродных связей. Действительно, большинство реакций присоединения алкенов, обсуждавшихся ранее, также протекают с алкинами и с аналогичной регио- и стереоселективностью.
Из-за своей линейной конфигурации (угол связи sp-гибридизованного углерода составляет 180º) десятичленное углеродное кольцо является наименьшим, которое может выполнять эту функцию без чрезмерного напряжения. Поскольку наиболее распространенным химическим превращением двойной углерод-углеродной связи является реакция присоединения, можно ожидать, что то же самое верно и для тройных углерод-углеродных связей. Действительно, большинство реакций присоединения алкенов, обсуждавшихся ранее, также протекают с алкинами и с аналогичной регио- и стереоселективностью.
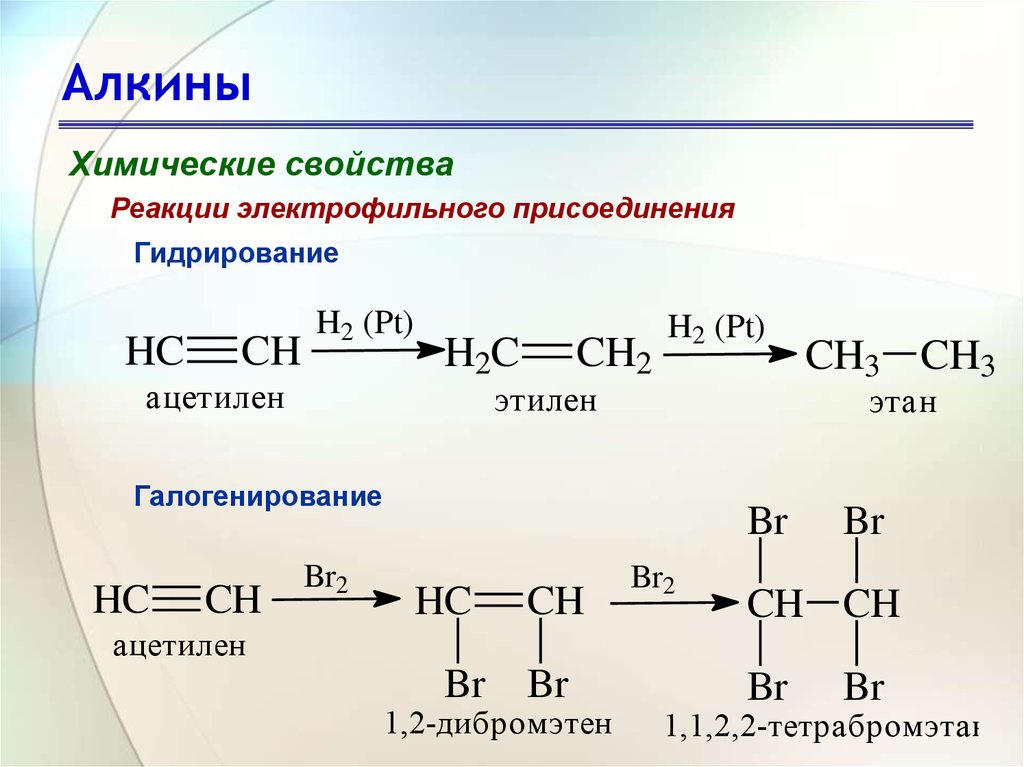
1. Каталитическое гидрирование
Каталитическое присоединение водорода к 2-бутину не только служит примером такой реакции присоединения, но также предоставляет данные о теплоте реакции, которые отражают относительную термодинамическую стабильность этих углеводородов, как показано на диаграмме справа. Из теплоты гидрирования, показанной синим цветом в единицах ккал/моль, видно, что алкины термодинамически менее стабильны, чем алкены, в большей степени, чем алкены менее стабильны, чем алканы. Стандартные энергии связи для углерод-углеродных связей подтверждают этот вывод. Таким образом, двойная связь прочнее одинарной связи, но не в два раза прочнее. Разность (63 ккал/моль) можно рассматривать как силу компонента π-связи. Точно так же тройная связь прочнее двойной связи, но не на 50% прочнее. Здесь разницу (54 ккал/моль) можно принять за силу второй π-связи. 9ккал/моль Ослабление этой второй π-связи отражается в числах теплоты гидрирования (36,7 — 28,3 = 8,4).
Стандартные энергии связи для углерод-углеродных связей подтверждают этот вывод. Таким образом, двойная связь прочнее одинарной связи, но не в два раза прочнее. Разность (63 ккал/моль) можно рассматривать как силу компонента π-связи. Точно так же тройная связь прочнее двойной связи, но не на 50% прочнее. Здесь разницу (54 ккал/моль) можно принять за силу второй π-связи. 9ккал/моль Ослабление этой второй π-связи отражается в числах теплоты гидрирования (36,7 — 28,3 = 8,4).
Поскольку алкины термодинамически менее стабильны, чем алкены, можно ожидать, что реакции присоединения первых будут более экзотермическими и относительно более быстрыми, чем эквивалентные реакции последних. В случае каталитического гидрирования обычные катализаторы гидрирования Pt и Pd настолько эффективны в промотировании присоединения водорода как к двойным, так и к тройным углерод-углеродным связям, что алкеновое промежуточное соединение, образованное присоединением водорода к алкину, не может быть выделено. Менее эффективный катализатор, Катализатор Линдлара , приготовленный дезактивацией (или отравлением) обычного палладиевого катализатора путем обработки его ацетатом свинца и хинолином, позволяет превращать алкины в алкены без дальнейшего восстановления в алкан. Добавление водорода является стереоселективным сином (например, 2-бутин дает цис-2-бутен). Дополнительное стереоселективное восстановление в антимоде может быть осуществлено раствором натрия в жидком аммиаке. Эта реакция будет обсуждаться далее в этом разделе.
Менее эффективный катализатор, Катализатор Линдлара , приготовленный дезактивацией (или отравлением) обычного палладиевого катализатора путем обработки его ацетатом свинца и хинолином, позволяет превращать алкины в алкены без дальнейшего восстановления в алкан. Добавление водорода является стереоселективным сином (например, 2-бутин дает цис-2-бутен). Дополнительное стереоселективное восстановление в антимоде может быть осуществлено раствором натрия в жидком аммиаке. Эта реакция будет обсуждаться далее в этом разделе.
| R-C≡C-R + H 2 & Lindlar Catalyst-> CIS R-CH = CH-R |
| R-C≡C-R + 2 NA в NH 3 (LIQ) — 4444444444444444444444444444444444444 > транс R-CH=CH-R + 2 NaNH 2 |
Алкены и алкины обнаруживают любопытную разницу в поведении при каталитическом гидрировании. Независимые исследования скорости гидрирования для каждого класса показывают, что алкены реагируют быстрее, чем алкины. Однако осторожное гидрирование алкина происходит исключительно до алкена до тех пор, пока первый не будет израсходован, после чего алкен продукта очень быстро гидрируется до алкана. Такое поведение хорошо объясняется различиями в стадиях реакции гидрирования. Прежде чем водород сможет присоединиться к кратной связи, алкен или алкин должны быть адсорбированы на поверхности катализатора. В связи с этим ранее было описано образование устойчивых комплексов платины (и палладия) с алкенами. Поскольку алкины сильнее адсорбируются на таких каталитических поверхностях, чем алкены, они предпочтительно занимают реакционные центры на катализаторе. Последующий перенос водорода к адсорбированному алкину протекает медленно по сравнению с соответствующим переносом водорода к адсорбированной молекуле алкена. Следовательно, восстановление тройных связей происходит избирательно с умеренной скоростью с последующим быстрым присоединением водорода к алкеновому продукту. Катализатор Линдлара позволяет адсорбировать и восстанавливать алкины, но не адсорбирует алкены в достаточной степени для их восстановления.
Однако осторожное гидрирование алкина происходит исключительно до алкена до тех пор, пока первый не будет израсходован, после чего алкен продукта очень быстро гидрируется до алкана. Такое поведение хорошо объясняется различиями в стадиях реакции гидрирования. Прежде чем водород сможет присоединиться к кратной связи, алкен или алкин должны быть адсорбированы на поверхности катализатора. В связи с этим ранее было описано образование устойчивых комплексов платины (и палладия) с алкенами. Поскольку алкины сильнее адсорбируются на таких каталитических поверхностях, чем алкены, они предпочтительно занимают реакционные центры на катализаторе. Последующий перенос водорода к адсорбированному алкину протекает медленно по сравнению с соответствующим переносом водорода к адсорбированной молекуле алкена. Следовательно, восстановление тройных связей происходит избирательно с умеренной скоростью с последующим быстрым присоединением водорода к алкеновому продукту. Катализатор Линдлара позволяет адсорбировать и восстанавливать алкины, но не адсорбирует алкены в достаточной степени для их восстановления.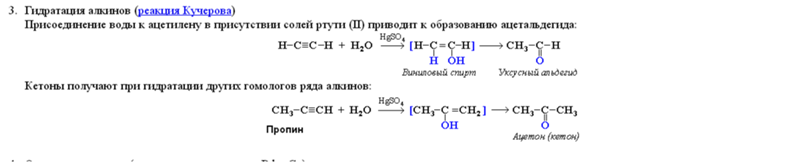
2. Добавление электрофильными реагентами
При изучении реакций присоединения электрофильных реагентов, таких как сильные кислоты Бренстеда и галогены, к алкинам обнаруживается любопытный парадокс. Реакции даже более экзотермичны, чем присоединения к алкенам, и все же скорость присоединения к алкинам в 100–1000 раз медленнее, чем присоединение к эквивалентно замещенным алкенам. Реакция одного эквивалента брома с 1-пентен-4-ином, например, дает в качестве основного продукта 4,5-дибром-1-пентин.
Хотя эти электрофильные присоединения к алкинам медленны, они происходят и обычно проявляют региоселективность по правилу Марковникова и антистереоселективность. Одной из проблем, конечно, является то, что продукты этих присоединений сами по себе являются замещенными алкенами и поэтому могут подвергаться дальнейшему присоединению.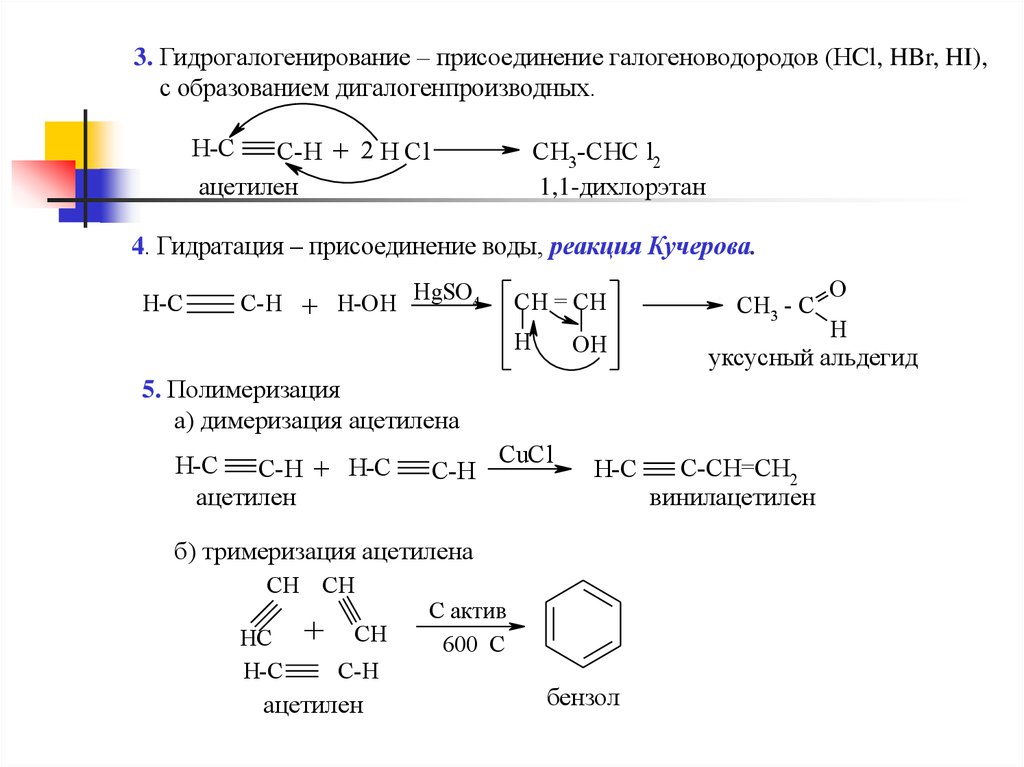 Из-за своей высокой электроотрицательности галогеновые заместители на двойной связи снижают ее нуклеофильность и тем самым снижают скорость реакций электрофильного присоединения. Следовательно, существует тонкий баланс относительно того, будет ли продукт первоначального присоединения к алкину подвергаться дальнейшему присоединению к насыщенному продукту. Хотя исходные алкеновые продукты часто можно выделить и идентифицировать, они обычно присутствуют в смесях продуктов и не могут быть получены с высоким выходом. Следующие реакции иллюстрируют многие из этих особенностей. В последнем примере 1,2-диодэтен не подвергается дальнейшему присоединению, поскольку вицинальные дийодалканы относительно нестабильны.
Из-за своей высокой электроотрицательности галогеновые заместители на двойной связи снижают ее нуклеофильность и тем самым снижают скорость реакций электрофильного присоединения. Следовательно, существует тонкий баланс относительно того, будет ли продукт первоначального присоединения к алкину подвергаться дальнейшему присоединению к насыщенному продукту. Хотя исходные алкеновые продукты часто можно выделить и идентифицировать, они обычно присутствуют в смесях продуктов и не могут быть получены с высоким выходом. Следующие реакции иллюстрируют многие из этих особенностей. В последнем примере 1,2-диодэтен не подвергается дальнейшему присоединению, поскольку вицинальные дийодалканы относительно нестабильны.
Реакции электрофильного присоединения к алкенам и алкинам, как правило, протекают с начальным образованием пи-комплекса , в котором электрофил принимает электроны от кратной связи и слабо связывается с ней. Такие комплексы образуются обратимо и затем могут реорганизоваться в реакционноспособный промежуточный продукт на более медленной, определяющей скорость стадии.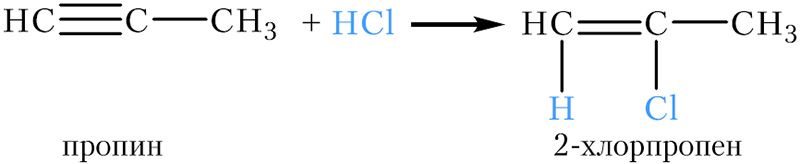 Реакции с алкинами более чувствительны к смене растворителя и каталитическим воздействиям, чем реакции с эквивалентными алкенами. Для примеров и обсуждения механизмов нажмите здесь.
Реакции с алкинами более чувствительны к смене растворителя и каталитическим воздействиям, чем реакции с эквивалентными алкенами. Для примеров и обсуждения механизмов нажмите здесь.
Почему реакции алкинов с электрофильными реагентами протекают более вяло, чем соответствующие реакции алкенов? В конце концов, реакции присоединения к алкинам, как правило, более экзотермичны, чем присоединения к алкенам, и кажется, что плотность π-электронов вокруг тройной связи выше (две π-связи против одной). Два фактора важны для объяснения этого кажущегося парадокса. Во-первых, хотя с тройной связью связано больше π-электронов, sp-гибридизованные атомы углерода оказывают сильное притяжение к этим π-электронам, которые, следовательно, более прочно связаны с функциональной группой, чем π-электроны двойной связи. . Это видно по потенциалам ионизации этилена и ацетилена.
| Ацетилен | HC≡CH + Energy —— > [HC≡CH • (+) + e (–) | ΔH = +264 kcal/mole | |
|---|---|---|---|
| Ethylene | H 2 C=CH 2 + Энергия —— > [H 2 C=CH 2 ] • (+) 5 5 8 (–) 902 902| ΔH = +244 ккал/моль | | |
| Этан | H 3 C–CH 3 + Энергия —— > [H 3 C–CH 3 ] • (+) 5 5 (–) 9026| ΔH = +296 ккал/моль | |
Как определено предыдущими уравнениями, потенциал ионизации представляет собой минимальную энергию, необходимую для отрыва электрона от молекулы соединения. Поскольку пи-электроны удерживаются менее прочно, чем сигма-электроны, мы ожидаем, что потенциалы ионизации этилена и ацетилена будут ниже, чем у этана, как и в случае. Сродство к протону в газовой фазе имеет тот же порядок: этилен более основный, чем ацетилен, а этан менее основный, чем любой из них. Поскольку начальным взаимодействием между электрофилом и алкеном или алкином является образование пи-комплекса, в котором электрофил принимает электроны от кратной связи и становится слабо связанным с кратной связью, становится понятным относительно более медленные реакции алкинов.
Поскольку пи-электроны удерживаются менее прочно, чем сигма-электроны, мы ожидаем, что потенциалы ионизации этилена и ацетилена будут ниже, чем у этана, как и в случае. Сродство к протону в газовой фазе имеет тот же порядок: этилен более основный, чем ацетилен, а этан менее основный, чем любой из них. Поскольку начальным взаимодействием между электрофилом и алкеном или алкином является образование пи-комплекса, в котором электрофил принимает электроны от кратной связи и становится слабо связанным с кратной связью, становится понятным относительно более медленные реакции алкинов.
Предполагается, что вторым фактором является стабильность промежуточного соединения карбокатиона, образованного сигма-связью протона или другого электрофила с одним из атомов углерода тройной связи. Положительный заряд этого интермедиата локализован на ненасыщенном углероде, и такие 90–194 винильные катионы 90–195 менее стабильны, чем их насыщенные аналоги. Действительно, мы можем модифицировать наш предыдущий порядок устойчивости карбокатионов, включив в него эти виниловые катионы, как показано ниже. Возможно, что виниловые катионы, стабилизированные сопряжением с арильным заместителем, являются интермедиатами присоединения НХ к алкинам типа Ar-C≡C-R, но такие интермедиаты образуются не во всех реакциях присоединения алкинов.
Возможно, что виниловые катионы, стабилизированные сопряжением с арильным заместителем, являются интермедиатами присоединения НХ к алкинам типа Ar-C≡C-R, но такие интермедиаты образуются не во всех реакциях присоединения алкинов.
|
Применение постулата Хаммонда указывает на то, что энергия активации для образования промежуточного соединения винилового катиона будет выше, чем для образования промежуточного соединения с более низкой энергией. Это показано для алкенов по сравнению с алкинами на следующих энергетических диаграммах.
Это показано для алкенов по сравнению с алкинами на следующих энергетических диаграммах.
Несмотря на эти различия, электрофильные присоединения к алкинам оказались исключительно полезными синтетическими трансформациями. Например, добавление HCl, уксусной кислоты и синильной кислоты к ацетилену дает соответственно полезные мономеры винилхлорид, винилацетат и акрилонитрил, как показано в следующих уравнениях. Обратите внимание, что в этих и многих других подобных реакциях переходные металлы, такие как соли меди и ртути, являются эффективными катализаторами.
| HC≡CH + HCL + HGCL 2 (на углероде) — > H 2 C = CHCL VinylChlid —> H 2 C = CCLCH 2 CL 2,3-дихлорпропен | ||||||||||||
HC≡CH + CH 3 CO 2 38 HC≡CH + CH 3 CO 2 4038 HC≡CH + CH 3 CO 2 38 HC≡CH + CH 3 CO 2| HC≡CH + CH 3 . |  H 2 C=CHOCOCH 3 Винилацетат H 2 C=CHOCOCH 3 Винилацетат | |||||||||||
| HC≡CH + HCN + CU 2 CL 2 — > H 2 C = CHCN > H 2 C = CHCN > H 2 C = CHCN . переходные металлы отличаются от простых пи-комплексов, отмеченных выше. Здесь синергетический процесс, включающий донорство электронов с заполненной π-орбитали органического лиганда на пустую d-орбиталь металла вместе с обратным донорством электронов с другой d-орбитали металла на пустую π*-разрыхляющую орбиталь лиганда. Модель комплекса Pt(II) с ацетиленом можно посмотреть, нажав здесь 3. Гидратация алкинов и таутомерия Как и в случае с алкенами, для присоединения воды к алкинам требуется сильная кислота, обычно серная кислота, и этому способствует сульфат ртути. Однако, в отличие от присоединения к двойным связям, которые дают спиртовые продукты, присоединение воды к алкинам дает кетоновые продукты (за исключением ацетилена, который дает ацетальдегид). Таутомеры определяются как быстро взаимопревращающиеся конституциональные изомеры, обычно отличающиеся другим расположением связи для лабильного атома водорода (здесь окрашены красным) и другим расположением двойной связи. Равновесие между таутомерами не только быстрое в нормальных условиях, но часто сильно благоприятствует одному из изомеров (например, ацетон на 99,999% состоит из кето-таутомера). Даже в таких односторонних равновесиях свидетельство присутствия второстепенного таутомера исходит из химического поведения соединения. Таутомерные равновесия катализируются следами кислот или оснований, которые обычно присутствуют в большинстве химических образцов.
Два фактора оказывают важное влияние на описанную здесь енол-кето-таутомеризацию. Скорость, с которой происходит енол-кето-таутомеризация, свидетельствует о низкой энергии активации этого процесса. Мы отметили, что перегруппировка катализируется кислотой и основанием, и очень тщательные эксперименты показали, что взаимное превращение таутомеров происходит намного медленнее, если такие катализаторы отсутствуют. H 2 C=CH-O-CH 3 –X– > CH 3 -CH 2 -CH=O Изменение потенциальной энергии для этой перегруппировки даже более выгодно, чем для енол-кето-таутомерии, и оценивается более чем в 25 ккал/моль от изменения энергии связи. Несмотря на эту термодинамическую движущую силу, описанный выше эфир енола полностью устойчив к обработке основанием и подвергается быстрому кислотно-катализируемому гидролизу с потерей метанола, а не перегруппировке. Определяющим отличием в этом случае должна быть непозволительно высокая энергия активации для описанной перегруппировки в сочетании с альтернативными путями реакции с более низкой энергией. 4. Реакции гидроборирования Диборан легко реагирует с алкинами, но образование замещенных алкеновых продуктов оставляет открытой возможность второй реакции присоединения. Умный метод предотвращения этого события использует тот факт, что алкины обычно не страдают от стерических затруднений вблизи тройной связи (конфигурация этой функциональной группы линейна). Следовательно, большие или громоздкие электрофильные реагенты легко присоединяются к тройной связи, но образующийся алкен обязательно более скучен или стерически затруднен и сопротивляется дальнейшему присоединению. Объемный реагент гидроборирования, необходимый для этой стратегии, получают реакцией диборана с 2-метил-2-бутеном, сильно разветвленным алкеном. Из-за алкильного разветвления только два алкена присоединяются к BH 3 фрагмент (снова стерические затруднения), оставляя одну ковалентную связь BH доступной для реакции с алкином, как показано ниже. Полученный диалкилборан называется дисиамилбораном, сокращением от ди-вторичного изоамилборана (амил — это старое название пентила). Важным применением дисиамилборана является его реакция присоединения к концевым алкинам. Как и в случае с алкенами, группа реагентов BH добавляется явно антимарковниковским образом из-за того, что электрофилом является бор, а не водород. Дальнейшее присоединение к образующемуся борзамещенному алкену не происходит, и обычное окислительное удаление бора щелочной перекисью водорода дает енол, который быстро перегруппировывается в альдегидный таутомер. Таким образом, при правильном выборе реагентов терминальные алкины могут быть превращены либо в метилкетоны (гидратация, катализируемая ионами ртути), либо в альдегиды (гидроборирование с последующим окислением). Rc≡CH + (C 5 H 11 ) 2 B-H-—-> [RCH = CH-B (C 5 H 11 ) 2 ] + H 2 O ) 2 & NaOH — — > [RCH=CH-OH] —— > RCH 2 -CH=O Гидроборирование внутренних алкинов не является особенно полезной процедурой, поскольку часто будет получена смесь продуктов, если тройная связь не замещена симметрично. Аналогичные результаты дает гидратация, катализируемая ионами ртути. 5. ОкисленияРеакции алкинов с окислителями, такими как перманганат калия и озон, обычно приводят к расщеплению тройной связи с образованием продуктов карбоновой кислоты. Общее уравнение для такого рода преобразования следует. Символ [O] часто используется в общем для обозначения окисления.
Реакции нуклеофильного присоединения и восстановление sp-гибридные атомы углерода тройной связи делают алкины более электрофильными, чем аналогично замещенные алкены. HC≡ CH + HCN + NaCN (каталитический) —— > H 2 C=CH-CN Самым маленьким и наиболее реакционноспособным нуклеофильным веществом, вероятно, является электрон. Присоединение электрона к функциональной группе по определению является восстановлением, и мы отмечали ранее, что алкины восстанавливаются растворами натрия в жидком аммиаке до транс-алкенов. Чтобы понять, как происходит это восстановление, нам сначала нужно идентифицировать две различные реакции натрия с жидким аммиаком (температура кипения -78 ºC).
Кислотность терминальных алкинов Алканы, несомненно, являются самыми слабыми кислотами Бренстеда, обычно встречающимися в органической химии. Трудно измерить такие слабые кислоты, но по оценкам pK a этана составляет около 48. Гибридизация углерода для увеличения s-характера C-H увеличивает кислотность, при этом наибольшее изменение происходит для sp- Группы C-H обнаружены в терминальных алкинах. Таким образом, рК a этена оценивается в 44, а pK a этина (ацетилена) равно 25, что делает его кислотой в 10 23 раз более сильной, чем этан. Это увеличение кислотности позволяет выделить нерастворимые соли серебра и меди таких соединений. Несмотря на резкое увеличение кислотности терминальных алкинов по сравнению с другими углеводородами, они по-прежнему являются очень слабыми кислотами, особенно по сравнению с водой, которая примерно в миллиард раз более кислая. Если мы хотим получить нуклеофильные соли терминальных алкинов для использования в синтезе, поэтому необходимо будет использовать гораздо более сильное основание, чем гидроксидный (или этоксидный) анион. Таким основанием является амид натрия (NaNH 2 ), обсуждавшийся выше, и его реакции с концевыми алкинами можно проводить в жидком аммиаке или эфире в качестве растворителей. Продуктами этой кислотно-щелочной реакции являются аммиак и соль ацетилида натрия. Поскольку ацетилид-анион является мощным нуклеофилом, он может вытеснять ионы галогенидов из 1º-алкилгалогенидов с образованием более сильно замещенного алкина в качестве продукта (S N 2 реакции).
Поскольку RC≡C: (–) Na (+) является очень сильным основанием (примерно в миллиард раз сильнее, чем NaOH), его использование в качестве нуклеофила в реакциях S N 2 ограничено 1º-алкилгалогенидами; 2º и 3º-алкилгалогениды отщепляются по механизму Е2. Повышенная кислотность концевых алкинов по сравнению с алканами также приводит к реакциям металлообмена при обработке этих соединений литийорганическими реактивами или реактивами Гриньяра. Этот обмен, показанный ниже в уравнении 1, можно интерпретировать как кислотно-основную реакцию, которая, как и ожидалось, протекает в направлении более слабой кислоты и более слабого основания. Этот фактор явно ограничивает применимость реагентов Гриньяра или литиевых реагентов, когда присутствует концевая тройная связь, как в уравнении 2.
Кислотность терминальных алкинов также играет роль в определении продукта, когда вицинальные (или геминальные) дигалогениды подвергаются реакциям бис-элиминирования, индуцированным основанием. В случае неконцевых алкинов амиды натрия и калия и родственные им сильные основания из 1º-аминов способны отрывать протоны от атомов углерода, соседних с тройной связью. Образующиеся алленовые карбанионы подвергаются быстрому равновесию с переносом протона, что приводит к относительно стабильному конъюгированному основанию терминального алкина. |

 Объяснение этого отклонения лежит в енол-кето-таутомеризации , иллюстрируемой следующим уравнением. Исходным продуктом присоединения воды к алкину является енол (соединение, имеющее гидроксильный заместитель, присоединенный к двойной связи), и он немедленно перестраивается в более стабильный кето-таутомер.
Объяснение этого отклонения лежит в енол-кето-таутомеризации , иллюстрируемой следующим уравнением. Исходным продуктом присоединения воды к алкину является енол (соединение, имеющее гидроксильный заместитель, присоединенный к двойной связи), и он немедленно перестраивается в более стабильный кето-таутомер.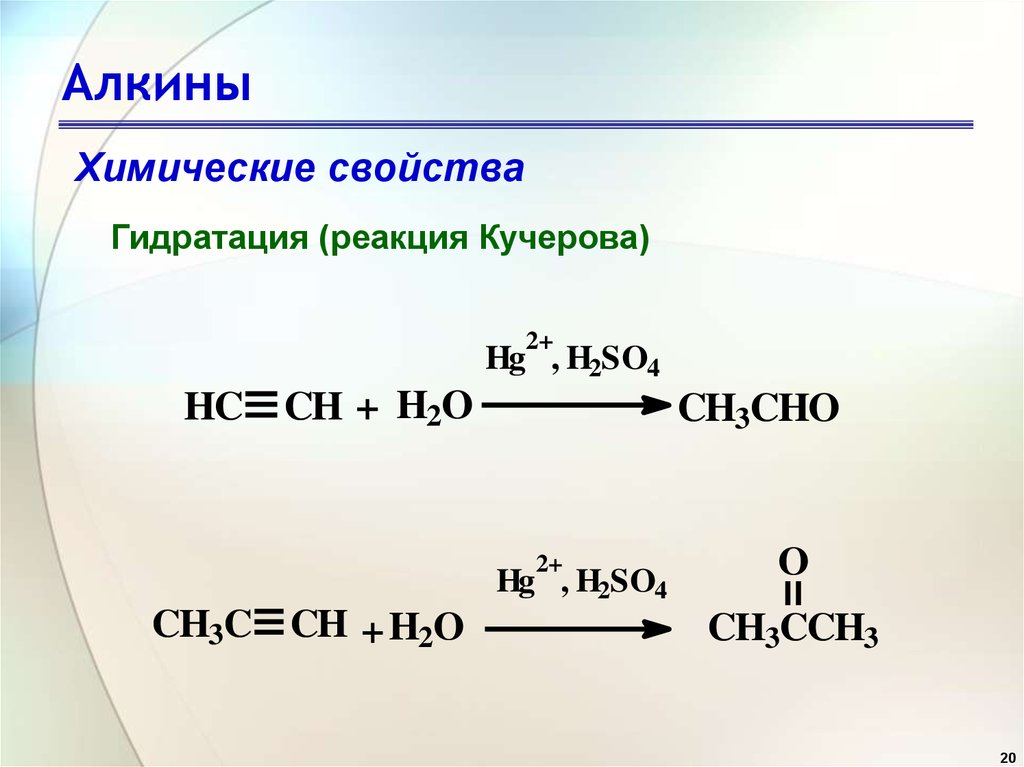 Три приведенных ниже примера иллюстрируют эти реакции для различных замещений тройной связи. Стадия таутомеризации указана красной стрелкой. Для терминальных алкинов добавление воды следует правилу Марковникова, как и во втором примере ниже, и конечным продуктом является метилкетон (за исключением ацетилена, показанного в первом примере). Для внутренних алкинов (тройная связь находится внутри более длинной цепи) добавление воды не является региоселективным. Если тройная связь расположена несимметрично (т. е. если R и R’ в третьем уравнении не совпадают), будут образованы два изомерных кетона.
Три приведенных ниже примера иллюстрируют эти реакции для различных замещений тройной связи. Стадия таутомеризации указана красной стрелкой. Для терминальных алкинов добавление воды следует правилу Марковникова, как и во втором примере ниже, и конечным продуктом является метилкетон (за исключением ацетилена, показанного в первом примере). Для внутренних алкинов (тройная связь находится внутри более длинной цепи) добавление воды не является региоселективным. Если тройная связь расположена несимметрично (т. е. если R и R’ в третьем уравнении не совпадают), будут образованы два изомерных кетона. Во-первых, это разность потенциальных энергий между таутомерными изомерами. Этот фактор определяет положение равновесного состояния . Второй фактор — это энергия активации взаимного превращения одного таутомера в другой. Этот фактор определяет скорость перегруппировки . Поскольку потенциальная энергия или стабильность соединения в значительной степени зависит от энергии его ковалентной связи, мы можем оценить относительную энергию кето- и енольных таутомеров, рассматривая связи, которые изменяются при перегруппировке. Из следующей диаграммы мы видим, что происходят только три значительных изменения, и стандартные энергии связи для этих изменений приведены справа от уравнения. Кето-таутомер имеет преимущество в энергии связи на 17,5 ккал/моль, поэтому ожидается его преобладание в равновесии.
Во-первых, это разность потенциальных энергий между таутомерными изомерами. Этот фактор определяет положение равновесного состояния . Второй фактор — это энергия активации взаимного превращения одного таутомера в другой. Этот фактор определяет скорость перегруппировки . Поскольку потенциальная энергия или стабильность соединения в значительной степени зависит от энергии его ковалентной связи, мы можем оценить относительную энергию кето- и енольных таутомеров, рассматривая связи, которые изменяются при перегруппировке. Из следующей диаграммы мы видим, что происходят только три значительных изменения, и стандартные энергии связи для этих изменений приведены справа от уравнения. Кето-таутомер имеет преимущество в энергии связи на 17,5 ккал/моль, поэтому ожидается его преобладание в равновесии. Ярким примером влияния энергии активации на такие превращения может служить следующая гипотетическая перегруппировка. Здесь мы заменили метильную группу (окрашенную темно-бордовым цветом) на протон обычной таутомерии, и метил переходит от кислорода к углероду точно так же, как протон переходит от енола к кетону.
Ярким примером влияния энергии активации на такие превращения может служить следующая гипотетическая перегруппировка. Здесь мы заменили метильную группу (окрашенную темно-бордовым цветом) на протон обычной таутомерии, и метил переходит от кислорода к углероду точно так же, как протон переходит от енола к кетону.

 В результате алкины иногда вступают в реакции присоединения, инициированные связыванием с нуклеофилом. Этот способ реакции, показанный ниже, обычно не проявляется для алкенов, если только двойная связь не активируется электроотрицательными заместителями, напр. F 2 C=CF 2 или путем сопряжения с электроноакцепторной группой.
В результате алкины иногда вступают в реакции присоединения, инициированные связыванием с нуклеофилом. Этот способ реакции, показанный ниже, обычно не проявляется для алкенов, если только двойная связь не активируется электроотрицательными заместителями, напр. F 2 C=CF 2 или путем сопряжения с электроноакцепторной группой.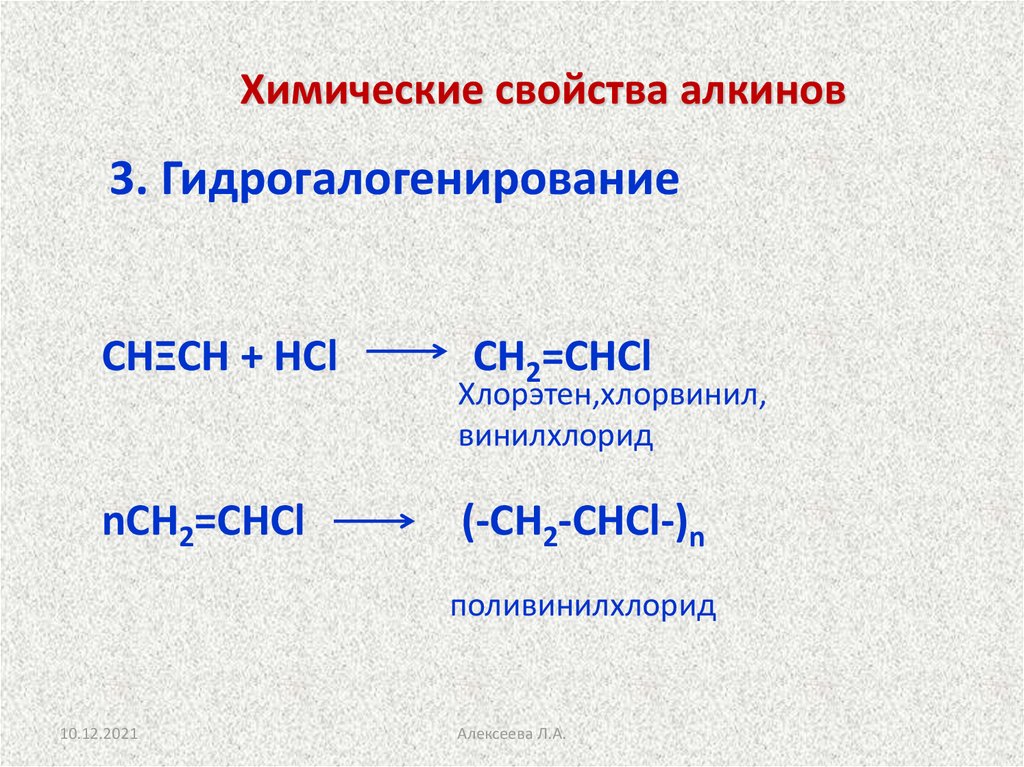 В первом случае натрий растворяется в чистой жидкости с образованием темно-синего раствора, состоящего из очень подвижных и слабо связанных электронов вместе с сольватированными катионами натрия (первое уравнение ниже). В практических целях мы можем рассматривать такие растворы как источник «свободных электронов», которые можно использовать в качестве мощных восстановителей. Во втором случае соли трехвалентного железа катализируют реакцию натрия с аммиаком с выделением водорода и образованием бесцветной соли амида натрия (второе уравнение). Это аналогично реакции натрия с водой с образованием гидроксида натрия, но поскольку аммиак 10 18 раз слабее кислоты, чем вода, реакция менее бурная. Полезность этой реакции заключается в том, что амид натрия, NaNH 2 , является чрезвычайно сильным основанием (на 18 порядков сильнее, чем гидроксид натрия), которое можно использовать для превращения очень слабых кислот в сопряженные с ними основания.
В первом случае натрий растворяется в чистой жидкости с образованием темно-синего раствора, состоящего из очень подвижных и слабо связанных электронов вместе с сольватированными катионами натрия (первое уравнение ниже). В практических целях мы можем рассматривать такие растворы как источник «свободных электронов», которые можно использовать в качестве мощных восстановителей. Во втором случае соли трехвалентного железа катализируют реакцию натрия с аммиаком с выделением водорода и образованием бесцветной соли амида натрия (второе уравнение). Это аналогично реакции натрия с водой с образованием гидроксида натрия, но поскольку аммиак 10 18 раз слабее кислоты, чем вода, реакция менее бурная. Полезность этой реакции заключается в том, что амид натрия, NaNH 2 , является чрезвычайно сильным основанием (на 18 порядков сильнее, чем гидроксид натрия), которое можно использовать для превращения очень слабых кислот в сопряженные с ними основания. Изолированные двойные связи углерода не восстанавливаются натрием в жидком аммиаке, что подтверждает разницу в электроотрицательности между sp и sp 2 гибридизированный углерод.
Изолированные двойные связи углерода не восстанавливаются натрием в жидком аммиаке, что подтверждает разницу в электроотрицательности между sp и sp 2 гибридизированный углерод.
 Это приложение синтеза описано в следующих уравнениях. Первые два уравнения показывают, как ацетилен можно превратить в пропин; последние два уравнения представляют собой синтез 2-пентина из пропина.
Это приложение синтеза описано в следующих уравнениях. Первые два уравнения показывают, как ацетилен можно превратить в пропин; последние два уравнения представляют собой синтез 2-пентина из пропина.
 Следующий пример иллюстрирует отщепление такого типа, исходя из 1,2-дибромпентана, полученного из 1-пентена добавлением брома. Первоначальное отщепление предположительно приводит к образованию 1-бром-1-пентена, поскольку следует отдавать предпочтение атаке основания на более кислый и менее затрудненный 1º-углерод. Затем второе удаление дает 1-пентин. Если используется очень сильное основание амид натрия, концевой алкин улавливается в виде его натриевой соли, из которой он может быть высвобожден при обработке слабой кислотой. Однако, если для элиминации используется более слабое основание KOH, концевая алкиновая соль не образуется или образуется обратимо, а первоначально образовавшийся 1-пентин перегруппировывается в более стабильный 2-пентин через промежуточное соединение аллена.
Следующий пример иллюстрирует отщепление такого типа, исходя из 1,2-дибромпентана, полученного из 1-пентена добавлением брома. Первоначальное отщепление предположительно приводит к образованию 1-бром-1-пентена, поскольку следует отдавать предпочтение атаке основания на более кислый и менее затрудненный 1º-углерод. Затем второе удаление дает 1-пентин. Если используется очень сильное основание амид натрия, концевой алкин улавливается в виде его натриевой соли, из которой он может быть высвобожден при обработке слабой кислотой. Однако, если для элиминации используется более слабое основание KOH, концевая алкиновая соль не образуется или образуется обратимо, а первоначально образовавшийся 1-пентин перегруппировывается в более стабильный 2-пентин через промежуточное соединение аллена.