Справочник химика 21. Вода основание
Соль вода основание кислота — МегаЛекции
где М – металл, А – остаток кислоты (анион).
Соли, образованные сильными кислотами и сильными основаниями (например, NaCl, KNO3 и др.), гидролизу не подвергаются. Гидролиз характерен для солей, образованных: 1) слабой кислотой и сильным основанием, 2) сильной кислотой и слабым основанием, 3) слабой кислотой и слабым основанием. Приведем примеры.
Пример 1. Составьте ионно-молекулярные и молекулярные уравнения гидролиза солей: а) KCN; б) Na2CO3; в) ZnSO4. Определите реакцию среды растворов этих солей.
Решение. а) Цианид калия KCN – соль слабой одноосновной кислоты HCN и сильного основания KOH. При растворении в воде молекулы KCN полностью диссоциируют на катионы K+ и анионы CN 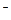 . Катионы K+ не будут связывать ионы OH
. Катионы K+ не будут связывать ионы OH 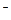 воды, так как KOH – сильный электролит, анионы же CN
воды, так как KOH – сильный электролит, анионы же CN 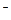 связывают ионы H+ воды, образуя молекулы слабого электролита HCN. Соль гидролизуется, как говорят, по аниону. Ионно-молекулярное уравнение гидролиза
связывают ионы H+ воды, образуя молекулы слабого электролита HCN. Соль гидролизуется, как говорят, по аниону. Ионно-молекулярное уравнение гидролиза
CN 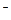 + h3O ⇄ HCN + OH
+ h3O ⇄ HCN + OH 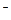
или в молекулярной форме
KCN + h3O ⇄ HCN + KOH
В результате гидролиза в растворе появляется некоторый избыток ионов OH 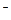 , поэтому раствор KCN имеет щелочную реакцию (pH>7).
, поэтому раствор KCN имеет щелочную реакцию (pH>7).
б) Карбонат натрия Na2CO3 – соль слабой многоосновной кислоты h3CO3 и сильного основания NaOH. В этом случае анионы соли CO 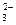 , связывая водородные ионы воды, образуют анионы кислой соли HCO
, связывая водородные ионы воды, образуют анионы кислой соли HCO 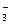 , а не молекулы h3CO3. В обычных условиях гидролиз идет по первой ступени. Соль гидролизуется по аниону. Ионно-молекулярное уравнение гидролиза
, а не молекулы h3CO3. В обычных условиях гидролиз идет по первой ступени. Соль гидролизуется по аниону. Ионно-молекулярное уравнение гидролиза
CO 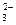 + h3O ⇄ HCO
+ h3O ⇄ HCO 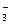 + OH
+ OH 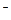
или в молекулярной форме
Na2CO3 + h3O ⇄ NaHCO3 + NaOH
В растворе появляется избыток ионов OH 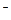 , поэтому раствор Na2CO3 имеет щелочную реакцию (pH>7).
, поэтому раствор Na2CO3 имеет щелочную реакцию (pH>7).
в) Сульфат цинка ZnSO4 – соль слабого многокислотного основания Zn(OH)2 и сильной кислоты h3SO4. В этом случае катионы Zn2+ связывают гидроксильные ионы воды, образуя катионы основной соли ZnOH+. Образование молекул Zn(OH)2 не происходит, так как ионы ZnOH+ диссоциируют гораздо труднее, чем молекулы Zn(OH)2. В обычных условиях гидролиз идет по первой ступени. Соль гидролизуется по катиону. Ионно-молекулярное уравнение гидролиза
Zn2+ + h3O  ⇄ ZnOH+ + H+
⇄ ZnOH+ + H+
или в молекулярной форме
2ZnSO4 + 2h3O ⇄ (ZnOH)2SO4 + h3SO4
В растворе появляется избыток ионов водорода, поэтому раствор ZnSO4 имеет кислую реакцию (pH< 7).
Пример 2. Какие продукты образуются при смешивании растворов Al(NO3)3 и K2CO3? Составьте ионно-молекулярное и молекулярное уравнение реакции.
Решение. Соль Al(NO3)3 гидролизуется по катиону, а K2CO3 – по аниону:
Al3+ + h3O ⇄ AlOh3+ + H+
CO 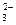 + h3O ⇄ HCO
+ h3O ⇄ HCO 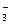 + OH
+ OH 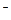
Если растворы этих солей находятся в одном сосуде, то идет взаимное усиление гидролиза каждой из них, ибо ионы H+ и OH 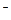 образуют молекулу слабого электролита h3O. При этом гидролитическое равновесие сдвигается вправо и гидролиз каждой из взятых солей идет до конца с образованием Al(OH)3 и CO2 (h3CO3). Ионно-молекулярное уравнение:
образуют молекулу слабого электролита h3O. При этом гидролитическое равновесие сдвигается вправо и гидролиз каждой из взятых солей идет до конца с образованием Al(OH)3 и CO2 (h3CO3). Ионно-молекулярное уравнение:
2 Al3+ + 3 CO 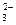 + 3h3O = 2Al(OH)3 + 3CO2
+ 3h3O = 2Al(OH)3 + 3CO2
молекулярное уравнение:
2 Al(NO3)3 + 3K2CO3 +3h3O = 2Al(OH)3 + 3CO2 + 6KNO3
Контрольные вопросы:
| 161.Составьте ионно-молекулярное и молекулярное уравнения гидролиза соли, раствор которой имеет: а) щелочную реакцию; б) кислую реакцию. | |||
| 162.Kакое значение рН(>7<) имеют растворы следующих солей: Na3РО4, Cu(NO3)2, MnSO4? Cоставьте ионно-молекулярные и молекулярные уравнения гидролиза этих солей. | |||
| 163.Какие из солей Na2SiO3, CdCl2, NaNO3, CoCl2 подвергаются гидролизу? Составьте ионно-молекулярные и молекулярные уравнения гидролиза соответствующих солей. Какое значение рН(>7<) имеют растворы этих солей? | |||
| 164. При смешивании растворов FeCl3 и K2CO3 каждая из взятых солей гидролизуется необратимо до конца с образованием соответствующих основания и кислоты. Выразите этот совместный гидролиз ионно-молекулярным и молекулярным уравнениями. | |||
| 165. Какая из двух солей при равных условиях в большей степени подвергается гидролизу: Na2SO3 или Na2S, CdCl2 или ZnCl2? Почему? Составьте ионно-молекулярные и молекулярные уравнения гидролиза этих солей. | |||
| 166. Какое значение рН(>7<) имеют растворы солей NaNO2, CuCl2, MnSO4? Cоставьте ионно-молекулярные и молекулярные уравнения гидролиза этих солей. | |||
| 167. Составьте ионно-молекулярные и молекулярные уравнения гидролиза солей Cu(NO3)2, Na2S, SnSO4 . Какое значение рН(>7<) имеют растворы этих солей? | |||
| 168. Составьте ионно-молекулярные и молекулярные уравнения гидролиза солей СН3СООNa, K3PO4, Fe(NO3)3. Какое значение рН(>7<) имеют растворы этих солей? | |||
| 169. При смешивании растворов Cr2(SO4)3 и Na2СО3 каждая из взятых солей гидролизуется необратимо до конца с образованием соответствующих основания и кислоты. Составьте ионно-молекулярное и молекулярное уравнения происходящего совместного гидролиза. | |||
170. Подберите по два уравнения в молекулярном виде к каждому из молекулярно-ионных уравнений:
Fe3+ + 2h3O ⇄ [(Fe(OH)2]+ +2H+
CO 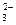 + h3O ⇄ HCO + h3O ⇄ HCO 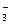 + OH- + OH- | |||
| 171. Какие из солей LiCl, Сr(NO3)3, Na2CO3, NiSO4 подвергаются гидролизу? Составьте ионно-молекулярные и молекулярные уравнения гидролиза соответствующих солей. Какое значение рН(>7<) имеют растворы этих солей? | |||
| 172. К раствору AlCl3 добавили следующие вещества: а) НNO3; б) NaОН; в) Na2SiO3; г) Pb(NO3)2. В каких случаях гидролиз сульфата алюминия усилится? Почему? Составьте ионно-молекулярные уравнения гидролиза соответствующих солей. | |||
| 173. Какая из двух солей при равных условиях в большей степени подвергается гидролизу: Na2CO3 или Na3PO4; FeСl3 или AlCl3? Почему? Составьте ионно-молекулярные и молекулярные уравнения гидролиза этих солей. | |||
| 174. Какое значение рН(>7<) имеют растворы солей K2SO3, Pb(NO3)2, СuCl2? Составьте ионно-молекулярные и молекулярные уравнения гидролиза этих солей. | |||
175.Подберите по два уравнения в молекулярном виде к каждому из молекулярно-ионных уравнений:
 Al3+ + h3O ⇄ (AlOH)2+ + H+
S2- + h3O ⇄ HS- + OH- Al3+ + h3O ⇄ (AlOH)2+ + H+
S2- + h3O ⇄ HS- + OH- | |||
| 176. К раствору Na2S добавили следующие вещества: а) Н2SO4; б) KOH; в) Zn(NO3)2; г) К2CO3. В каких случаях гидролиз сульфида натрия усилится? Почему? Составьте ионно-молекулярные уравнения гидролиза соответствующих солей. | |||
| 177. Cоставьте ионно-молекулярное и молекулярное уравнения совместного гидролиза, происходящего при смешивании растворов Na2S и ZnСl2. Каждая из взятых солей гидролизуется необратимо до конца с образованием соответствующих основания и кислоты. | |||
| 178. К раствору NiSO4 добавили следующие вещества: а) НNO3; б) NaОН; в) FeCl2; г) Na2S. В каких случаях гидролиз cульфата никеля усилится? Почему? Составьте ионно-молекулярные уравнения гидролиза соответствующих солей. | |||
| 179. Какие из солей NiCl2, Na2CO3, ZnSO4, КСl подвергаются гидролизу? Составьте ионно-молекулярные и молекулярные уравнения гидролиза соответствующих солей. Какое значение рН (>7<) имеют растворы этих солей? | |||
| 180. При смешивании растворов CrCl3 и K2SiO3 каждая из взятых солей гидролизуется необратимо до конца с образованием соответствующих основания и кислоты. Выразите этот совместный гидролиз ионно-молекулярным и молекулярным уравнениями. | |||
megalektsii.ru
Вода как основание - Справочник химика 21
Ион гидроксония следует рассматривать как кислоту (так как он способен отдавать протон), а воду — как основание. В общем виде подобные реакции можно представить следующим уравнением [c.201]Побочная реакция — взаимодействие воды как основания с кислотой [c.425]
При растворении потенциальных электролитов в воде они гидратируются и вступают в протолитическое взаимодействие с водой как основанием, сопряженным с кислотой — ионом оксония Н3О+ [c.413]
Ион ОН- играет роль основания, сопряженного с водой как кислотой, а ион Н3О+ —это кислота, сопряженная с водой как основанием. Протолитической реакции (X.13) отвечает константа равновесия [c.593]Строение основного центра молекул аминов и ионов карбоновых кислот значительно отличается от строения основного центра молекул воды и гидроксильных ионов. Поэтому предсказание каталитических констант воды и гидроксильных ионов путем экстраполяции зависимостей, найденных для катализа растворенными основаниями, не особенно надежны. По этой же причине ненадежны каталитические константы молекул воды и ионов гидроксония, предсказываемые для случая кислотного катализа. Как отметил Белл [15], другой сложностью является необходимость экстраполировать по крайней мере на шесть порядков. Рассмотрев известные данные по катализу в водных растворах молекулами воды как основаниями, Белл пришел к выводу, что каталитические константы, даваемые уравнением (14) и полученные путем экстраполяции, все-таки согласуются в пределах одного [c.415]
Кислоты Бренстеда. Для слабых электролитов кислотность количественно оценивается константой равновесия (К) реакции, заключающейся в переносе протона от кислоты к воде как основанию (протолитическая реакция). [c.101]
Основной реакцией является взаимодействие титруемого основания с кислотой В + Н+ побочной реакцией — взаимодействие воды как основания с кислотой Н20 + Н+ч Нз0+. [c.223]
Соли сильных кислот и сильных оснований имеют нейтральную реакцию среды (см. раздел IV.2).С другой стороны, в разделе V.4 было показано, что раствор соли слабой кислоты и сильного основания имеет щелочную реакцию, так как анион слабой кислоты реагирует с водой как основание (см. раздел IV.2). Аналогично соль слабого основания и сильной кислоты дает кислую реакцию. [c.146]
Примером того, какое влияние на поведение растворенного вещества оказывает относительное сродство к протону, служит ацетамид, который ведет себя в воде как основание, а в жидком аммиаке как кислота [c.53]
Протолитические реакции происходят на границе раздела органической и водной фаз между протонированными формами рабочего вещества и водой как основанием, сопряженным с ионом оксония Н 0+. Гидрофобный катион Т+ удерживателя препятствует переходу образующихся анионов в водную фазу. Например, для формы НбК рабочего вещества в окисленном состоянии [c.215]
Основные свойства воды вследствие небольшой сплы воды как основания были обнаружены сравнительно поздно. При концентрировании раствора бромистого водорода в жидком аммиаке остается твердый бромистый аммоний, так как равновесие [c.124]
Одна из основных трудностей при расшифровке механизмов каталитических процессов состоит в том, что кинетические уравнения часто оказываются одинаковыми для реакций, протекающих различным образом.Так, например, если промежуточный активный катион вступает во взаимодействие с водой как основанием [c.15]
Жидкий аммиак, как и вода, — сильный ионизирующий растворитель. При этом производные Nh5 в жидком аммиаке (подобно производным ОНз в воде) ведут себя как кислоты аммонокислоты), а производные NH (подобно производным ОН" в воде) — как основания (аммонооснования). Например, сильными кислотами в жидком аммиаке являются NH l, Nh5NO3, а основаниями — KNHj, Ba(Nh3)2- Дигидронлтриды Zn(NHa)2, A1(NH.2)3 ведут себя как амфотерные соединения. Производные NHa" называются также амидами, а производные NH " — имидами. [c.348]
Мерой силы кислоты Брёнстеда является константа ее диссоциации К , определяемая по отношению к воде как основанию, или соответствующее значение рА . [c.91]
Быстрое присоединение молекулы воды к карбкатиону приводит к катиону /ирет-бутилгидроксония, который затем с участием воды как основания отщепляет протон с образованием спирта. Этой схеме механизма соответствует энергетическая диаграмма, показанная на рис. 13.3. [c.599]
Фосфат-ионы реагируют с водой как основания. Поэтому реакция водного раствора laH PO —кислая, Na.HPOi—щелочная, NaaPOi—сильно щелочная. [c.372]
Это означает, что ортофосфорная кислота электролитически диссоциирует по типу кислоты—реакция ее водного раствора сильнокислая. Образующиеся в процессе электролитической диссоциации фосфорной кислоты дигидро- и гидрофосфат-ионы способны реагировать как по типу кислот, таки по типу оснований фосфат-ионы реагируют с водой как основания. Поэтому реакция водного раствора NaH POi—кислая, NajHPO —щелочная и NagP04—сильнощелочная. [c.511]
Энергия активации депротопизации (для воды как основания) составляет приблизительно 20—23 ккал/моль [57, 119]. При этом наблюдается относительно большая отрицательная энтропия активации (от —19 до —24 энтр. ед) [c.272]
Из литературы известны лишь данные по скоростям диссоциации 1-хлор-1-нитро8тава (ХНЭ) под действием воды как основания [2,3] при 35°. Отрывочность имеющейся информации не позволяет сделать каких-либо обобщений относительно протолитической реакционной способности данного соединения. [c.367]
chem21.info
Основание (химия) - это... Что такое Основание (химия)?
У этого термина существуют и другие значения, см. Основание.Основа́ния — класс химических соединений.
В статье смысл термина «основание» раскрывается в первом, наиболее широко используемом значении — осно́вные гидрокси́ды.
Получение




Классификация
Основания классифицируются по ряду признаков.
- По растворимости в воде.
- Растворимые основания (щёлочи): гидроксид натрия NaOH, гидроксид калия KOH, гидроксид бария Ba(OH)2, гидроксид стронция Sr(OH)2, гидроксид цезия CsOH, гидроксид рубидия RbOH.
- Практически нерастворимые основания: Mg(OH)2, Ca(OH)2, Zn(OH)2, Cu(OH)2, Al(OH)3, Fe(OH)3, Be(OH)2.
- Другие основания: Nh4·h3O
Деление на растворимые и нерастворимые основания практически полностью совпадает с делением на сильные и слабые основания, или гидроксиды металлов и переходных элементов
- По летучести.
- Летучие: Nh4, Ch4-Nh3
- Нелетучие: щёлочи, нерастворимые основания.
- По стабильности.
- По наличию кислорода.
- По типу соединения:
- Неорганические основания: содержат одну или несколько групп -OH.
- Органические основания: органические соединения, являющиеся акцепторами протонов: амины, амидины и другие соединения.
Номенклатура
По номенклатуре IUPAC неорганические соединения, содержащие группы -OH, называются гидроксидами. Примеры систематических названий гидроксидов:
- NaOH — гидроксид натрия
- TlOH — гидроксид таллия(I)
- Fe(OH)2 — гидроксид железа(II)
Если в соединении есть оксидные и гидроксидные анионы одновременно, то в названиях используются числовые приставки:
- TiO(OH)2 — дигидроксид-оксид титана
- MoO(OH)3 — тригидроксид-оксид молибдена
Для соединений, содержащих группу O(OH), используют традиционные названия с приставкой мета-:
- AlO(OH) — метагидроксид алюминия
- CrO(OH) — метагидроксид хрома
Для оксидов, гидратированных неопределённым числом молекул воды, например Tl2O3•n h3O, недопустимо писать формулы типа Tl(OH)3. Называть такие соединениями гидроксидами также не рекомендуется. Примеры названий:
- Tl2O3•n h3O — полигидрат оксида таллия(III)
- MnO2•n h3O — полигидрат оксида марганца(IV)
Особо следует именовать соединение Nh4•h3O, которое раньше записывали как Nh5OH и которое в водных растворах проявляет свойства основания. Это и подобные соединения следует именовать как гидрат:
Химические свойства
- В водных растворах основания диссоциируют, что изменяет ионное равновесие:
 это изменение проявляется в цветах некоторых кислотно-основных индикаторов:
это изменение проявляется в цветах некоторых кислотно-основных индикаторов: - При взаимодействии с кислотой происходит реакция нейтрализации и образуется соль и вода:
 Примечание: реакция не идёт, если и кислота и основание слабые.
Примечание: реакция не идёт, если и кислота и основание слабые. - При избытке кислоты или основания реакция нейтрализации идёт не до конца и образуются кислые или осно́вные соли, соответственно:


- Амфотерные основания могут реагировать с щелочами с образованием гидроксокомплексов:
![\mathsf{Zn(OH)_2 + 2KOH \ \xrightarrow{}\ K_2[Zn(OH)_4] }](/800/600/http/dic.academic.ru5c6283a60c1359ecd48eda1fc41a9eb2.png)
- Основания реагируют с кислотными или амфотерными оксидами с образованием солей:


- Основания вступают в обменные реакции (реагируют с растворами солей):

- Слабые и нерастворимые основания при нагреве разлагаются на оксид и воду:
 Некоторые основания (Cu(I), Ag, Au(I)) разлагаются уже при комнатной температуре.
Некоторые основания (Cu(I), Ag, Au(I)) разлагаются уже при комнатной температуре. См. также
Литература
- Химическая энциклопедия / Редкол.: Кнунянц И.Л. и др.. — М.: Советская энциклопедия, 1988. — Т. 1. — 623 с.
- Химическая энциклопедия / Редкол.: Кнунянц И.Л. и др.. — М.: Советская энциклопедия, 1992. — Т. 3. — 639 с. — ISBN 5-82270-039-8
- Лидин Р.А. и др. Номенклатура неорганических веществ. — М.: КолосС, 2006. — 95 с. — ISBN 5-9532-0446-9
dic.academic.ru





















