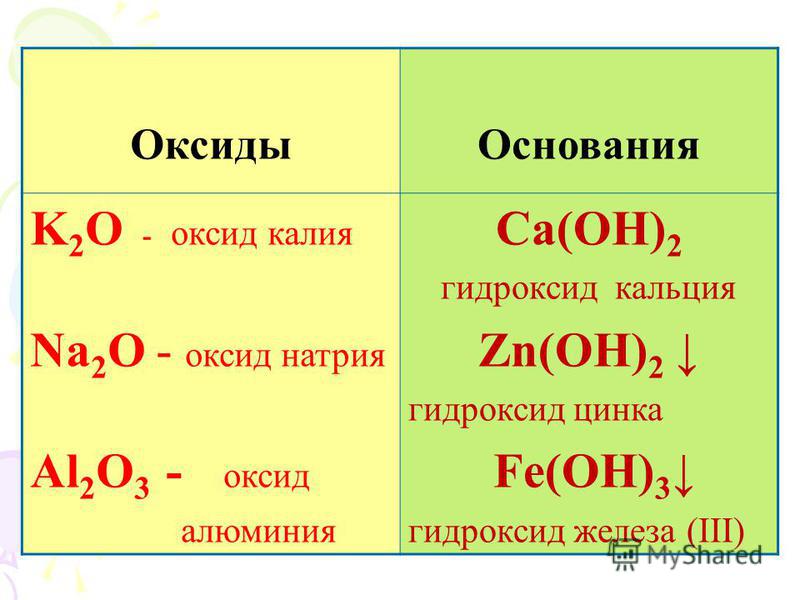
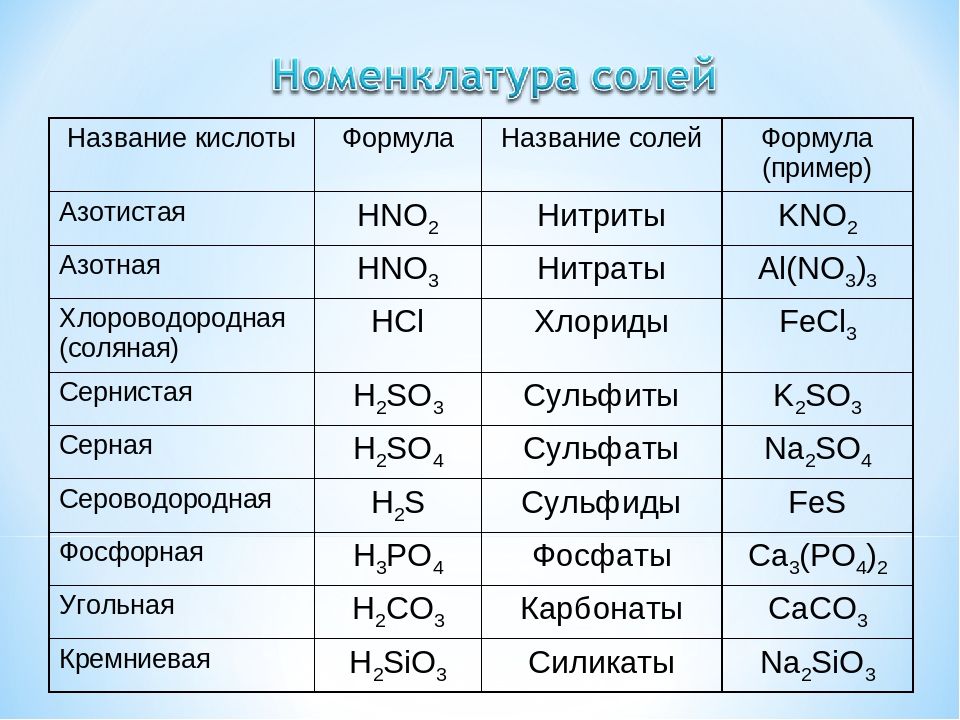
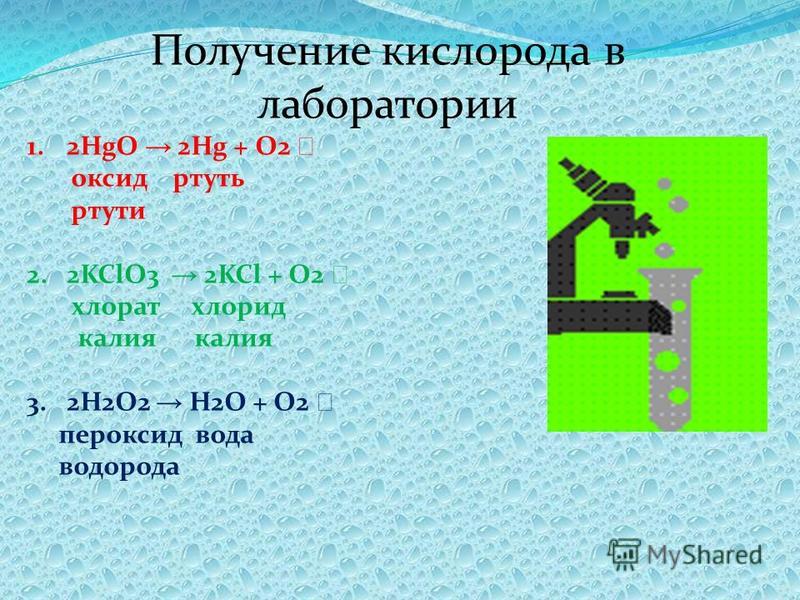
Содержание
Итоговая работа по теме V
Вариант 1
1. Даны вещества: фосфор, оксид бария, раствор серной кислоты, гидроксид калия, оксид серы (IV), вода. Какие з них будут взаимодействовать между собой? Напишите уравнения реакций и назовите образующиеся вещества.
2. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
3. Чем сходны и чем различаются по составу основание и соль? Ответ поясните примерами.
4. Рассчитайте количество вещества (моль) и массу каждого продукта, образующегося при проведении следующих превращений: гидроксид железа (III) → оксид железа (III) → сульфат железа (III) →, если было взято 214 г гидроксида железа (III).
Вариант 2
1. Даны вещества: кальций, соляная кислота, вода, оксид кальция, медь, гидроксид натрия. Какие из них будут взаимодействовать между собой? Напишите уравнения реакций и назовите образующиеся вещества.
2. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
3. С веществами каких классов взаимодействуют: а) основные оксиды; б) кислотные оксиды? Напишите уравнения соответствующих реакций.
4. Рассчитайте количество вещества (моль) и массу каждого продукта, образующегося при проведении следующих превращений: кальций → оксид кальция → гидроксид кальция → хлорид кальция, если было взято 80 г кальция.
Вариант 3
1. Даны вещества: цинк, раствор серной кислоты, оксид меди (II), вода, гидроксид кальция, оксид углерода (IV). Какие из них будут взаимодействовать между собой? Напишите уравнения и назовите образующиеся вещества.
2. Напишите уравнения реакций, позволяющих осуществить следующие превращения:
3. Чем сходны и чем различаются по составу кислоты и соль? Ответ поясните примерами.
Кислота и соль включают в себя кислотный остаток. Но в состав соли входит еще катион металла, а в состав кислоты – протон: HCl – NaCl.
4. Рассчитайте количество вещества (моль) и массу каждого продукта, образующегося при проведении следующих превращений: сера → оксид серы (IV) → сернистая кислота → сульфат бария, если было взято 16 г серы.
Вариант 4
1. Даны вещества: вода, соляная кислота, магний, гидроксид бария, оксид натрия, гидроксид меди (II). Какие из них будут взаимодействовать между собой? Напишите уравнения реакций и назовите образующиеся вещества.
2. Напишите уравнения реакций, позволяющих осуществить следующие превращения:
3. Чем сходны и чес различаются по составу и свойствам основные и кислотные оксиды? Ответ поясните примерами.
4. Рассчитайте количество вещества (моль) и массу каждого продукта, образующегося при проведении следующих превращений: гидроксид меди (II) → оксид меди → хлорид меди (II), если было взято 49 г гидроксида меди (II).
Оксид калия — frwiki.wiki
Оксид калия представляет собой химическое соединение с молекулярной формулой K 2 O. Он имеет форму бледно-желтого кристаллизованного ионного твердого вещества, которое очень реактивно и поэтому очень редко встречается в естественной среде. Калийный состав некоторых коммерческих веществ, таких как удобрения или цементы, иногда выражается в эквивалентах K 2 O..
Резюме
- 1 Синтез
- 2 Структура и свойства
- 3 Оксид калия в удобрениях
- 4 Примечания и ссылки
Синтез
Оксид калия образуется в результате реакции кислорода с калием, в результате чего образуется пероксид калия K 2 O 2., который необходимо обработать калием, чтобы получить оксид K 2 O :
- К 2 О 2+ 2 К → 2 К 2 O.

Новое и более прямое приготовление осуществляется путем нагревания нитрата калия KNO 3.с металлическим калием :
- 2 KNO 3+ 10 К → 6 К 2 O+ N 2.
С другой стороны, невозможно получить оксид калия дегидратацией гидроксида калия КОН.
Структура и свойства
Кристаллическая структура оксида калия K 2 Oявляется обратным флюориту CaF 2при этом катионы калия координируются с четырьмя анионами кислорода, каждый из которых координируется с восемью катионами калия.
К 2 Опредставляет собой основной оксид, который бурно реагирует с водой с образованием гидроксида калия КОН, очень едкого соединения. Его гигроскопичность делает его расплывающимся за счет поглощения атмосферной влажности, вызывая бурную реакцию K 2 O. с водой.
Оксид калия в удобрениях
Сырая формула K 2 Oиспользуется для выражения содержания калия в удобрениях NPK ( азот — фосфор — калий ), хотя на самом деле калий присутствует не в виде оксида, а в виде хлорида калия KCl, сульфата калия K 2 SO 4или карбонат калия K 2 CO 3.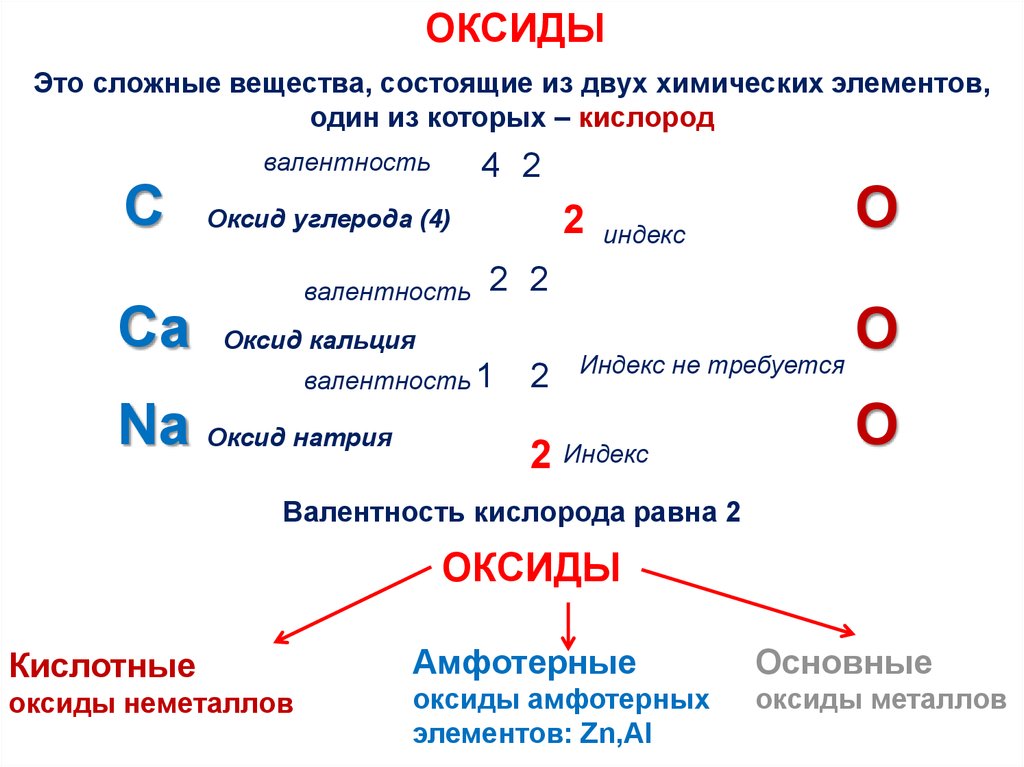 Процент K 2 Oна этикетках указано количество оксида калия, эквивалентное количеству калия, присутствующего в удобрении, зная, что по массе K 2 Oсодержит 83% калия, против 52,5% для KCl, 44,9% для K 2 SO 4, и 56,6% для K 2 CO 3 : удобрение, содержащее 30% по весу KCl, будет, таким образом, титровать 19% K 2 O.
Процент K 2 Oна этикетках указано количество оксида калия, эквивалентное количеству калия, присутствующего в удобрении, зная, что по массе K 2 Oсодержит 83% калия, против 52,5% для KCl, 44,9% для K 2 SO 4, и 56,6% для K 2 CO 3 : удобрение, содержащее 30% по весу KCl, будет, таким образом, титровать 19% K 2 O.
Примечания и ссылки
- ↑ рассчитывается молекулярная масса от « атомных весов элементов 2007 » на www.chem.qmul.ac.uk .
- ↑ (in) AF Holleman, E.
 Wiberg, » Неорганическая химия » Academic Press, Сан-Диего, США, 2001 ( ISBN 0-12-352651-5 )
Wiberg, » Неорганическая химия » Academic Press, Сан-Диего, США, 2001 ( ISBN 0-12-352651-5 )
- ↑ (де) Э. Зинтл, А. Хардер, Б. Даут « Гиттерструктура оксида, сульфида, селенида и теллурида лития, натрия и калия » в Z. Elektrochem. Энгью. Phys. Chem. 40, 588–593, 1934.
- ↑ (in) А.Ф. Уэллс « Структурная неорганическая химия » Clarendon Press, Oxford, 1984. ( ISBN 0-19-855370-6 )
Соединения калия | |
|---|---|
| KBr · KBrO 3 · KCN · KCNO · KCl · KClO 3 · KClO 4 · KF · KH · KHCO 2 · KHCO 3 · KHF 2 · KHSO 3 · KHSO 4 · KHSO 5 · KH 2 AsO 4 · KI · KIO 3 · KIO 4 · KMnO 4 · KNO 2 · KNO 3 · KOCN · KOH · KO 2 · KPF 6 · KSCN · K 2 CO 3 · K 2 CrO 4 · K 2 Cr 2 O 7 · K 2 FeO 4 · K 2 HPO 4 · K 2 MnO 4 · K 2 O · K 2 O 2 · K 2 PtCl 4 · K 2 PtCl 6 · K 2 S · K 2 SO 3 · K 2 SO 4 · KH 2 PO 3 · KH 2 PO 4 · K 2 S 2 O 5 · K 2 S 2 O 7 · K 2 S 2 O 8 · K 2 SiO 3 · K 3 [Fe (CN) 6 ] · K 3 [Fe (C 2 O 4 ) 3 ] · K 3 MnO 4 · K 3 PO 4 · K 4 [Fe (CN) 6 ] · K 4 MnO 4 · K 4 Mo 2 Cl 8 |
Оксиды | |
|---|---|
| Различные состояния | Четырехокись сурьмы ( Sb 2 O 4 ) · Оксид серебра (I, III) ( Ag O) · Оксид кобальта (II, III) ( Co 3 O 4 ) · Оксид железа (II, III) ( Fe 3 O 4 ) Трехводородный монооксид (H 3 O) · Оксид марганца (II, III) ( Mn 3 O 4 ) · Оксид свинца (II, IV) ( Pb 3 O 4 ) |
| Степень окисления +1 | Оксид серебра ( Ag 2 O) · оксид дикарбона ( C 2 O) · оксид меди (I) ( Cu 2 O) · оксид хлора ( Cl 2 O) · оксид лития ( Li 2 O) · оксид калия ( K 2 O) · Оксид натрия ( Na 2 O) · оксид рубидия ( Rb 2 O) · оксид таллия (I) ( Tl 2 O) · вода ( H 2 O) и другие оксиды водорода |
| Степень окисления +2 | Оксид алюминия (II) ( Al O) · оксид бария ( Ba O) · оксид бериллия ( Be O) · оксид кадмия ( Cd O) · оксид кальция ( Ca O) · оксид углерода ( C O) · оксиды кобальта (II ) ( Co O) · оксиды хрома (II) ( Cr O) · оксид меди (II) ( Cu O) · оксид германия ( Ge O) · оксид железа (II) ( Fe O) · оксид иридия ( Ir O) · Оксид магния ( Mg O) · оксид ртути (II) ( Hg O) · оксид никеля (II) ( Ni O) · оксид азота ( N O) · оксид палладия (II) ( Pd O) · оксид свинца (II) ( Pb O) · оксид стронция ( Sr O) · оксид серы ( S O) · диоксид серы ( S 2 O 2 ) · оксид олова (II) ( Sn O) · оксид титана (II) ( Ti O) · ванадий ( II) оксид ( V O) · оксид цинка ( Zn O) · оксид циркония ( Zr O) |
| Степень окисления +3 | Полуторный оксид актиния ( Ac 2 O 3 ) · оксид алюминия ( Al 2 O 3 ) · триоксид сурьмы ( Sb 2 O 3 ) · триоксид мышьяка ( As 2 O 3 ) · оксид висмута (III) ( Bi 2 O 3 ) · триоксид бора ( B 2 O 3 ) · оксид хрома (III) ( Cr 2 O 3 ) · оксиды кюрия (III) (Cm 2 O 3)) · Триоксид диазота ( N 2 O 3 ) · оксид эрбия (III) ( Er 2 O 3 ) · Оксиды европия (III) ( Eu 2 O 3 ) · оксид железа (III) ( Fe 2 O 3 ) · оксид гадолиния (III) ( Gd 2 O 3 ) · оксид галлия (III) ( Ga 2 O 3 ) · оксид, гольмий (III) ( Ho 2 O 3 ) · оксид индия (III) ( в 2 O 3 ) · оксид иридий (III) ( Ir 2 O 3 ) · оксид лантана ( La 2 O 3 ) · оксиды лютеция (III) ( Lu 2 O 3 ) · оксид неодима (III) ( Nd 2 O 3 ) · оксид никеля (III) ( Ni 2 O 3 ) · триоксид фосфора ( P 4 O 6 ) · оксид прометия (III) ( Pm 2 O 3 ) · оксид празеодима (III) ( Pr 2 O 3 ) · оксид родия (III) ( Rh 2 O 3 ) · Оксиды самария (III) ( Sm 2 O 3 ) · Оксид скандия ( Sc 2 O 3 ) · Оксид тербия (III) ( Tb 2 O 3 ) · Оксид таллия (III) ( Tl 2 O 3 ) · Оксид тулия (III) ( Tm 2 O 3 ) · оксид титана (III) ( Ti 2 O 3 ) · оксид вольфрама (III) ( W 2 O 3 ) · оксид ванадия (III) ( V 2 O 3 ) · Оксид иттербия (III) ( Yb 2 O 3 ) · оксиды иттрия (III) ( Y 2 O 3 ) |
| Степень окисления +4 | Диоксид углерода ( C O 2 ) · триоксид углерода ( C O 3 ) · оксид церия (IV) ( это O 2 ) · диоксид хлора ( Cl O 2 ) · диоксид хрома ( Cr O 2 ) · оксид кюрия (IV) (CmO 2) · Пероксид азота ( N 2 O 4 ) · диоксид германия ( Ge O 2 ) · оксид гафния (IV) ( Hf O 2 ) · оксид иридия (IV) ( Ir O 2 ) · диоксид свинца ( Pb O 2 ) · марганец диоксид ( Mn O 2 ) · диоксид азота ( N O 2 ) · оксиды нептуния (IV) ( Np O 2 ) · оксиды протактиния (IV) ( Pa O 2 ) · диоксид плутония ( Pu O 2 ) · оксид рения (IV) ( Re O 2 ) · оксид родия (IV) ( Rh O 2 ) · диоксид рутения ( Ru O 2 ) · диоксид селена ( If O 2 ) · диоксид кремния ( If O 2 ) · диоксид серы ( S O 2 ) · Диоксид олова ( Sn O 2 ) · диоксид теллура ( Te O 2 ) · диоксид тория ( Th O 2 ) · диоксид титана ( Ti O 2 ) · оксид вольфрама (IV) ( W O 2 ) · диоксид урана ( U O 2 ) · оксид ванадия (IV) ( V O 2 ) · диоксид циркония ( Zr O 2 ) |
| Степень окисления +5 | Пятиокись сурьмы ( Sb 2 O 5 ) · пятиокись мышьяка ( As 2 O 5 ) · пятиокись азота ( N 2 O 5 ) · пятиокись ниобия ( Nb 2 O 5 ) · пятиокись фосфора ( P 2 O 5 ) · Оксиды протактиния (V ) ( Pa 2 O 5 ) · оксид тантала (V) ( Ta 2 O 5 ) · оксид ванадия (V) ( V 2 O 5 ) |
| Степень окисления +6 | Триоксид хрома ( Cr O 3 ) · триоксид иридия ( Ir O 3 ) · триоксид молибдена ( Mo O 3 ) · триоксид рения ( Re O 3 ) · триоксид селена ( As O 3 ) · триоксид серы ( S O 3 ) · теллур триоксид ( Te O 3 ) · триоксид вольфрама ( W O 3 ) · триоксид урана ( U O 3 ) · триоксид ксенона ( Xe O 3 ) |
| Степень окисления +7 | Гептоксид хлора ( Cl 2 O 7 ) · гептоксид марганца ( Mn 2 O 7 ) · оксид рения (VII) ( Re 2 O 7 ) · оксиды технеция (VII) ( Tc 2 O 7 ) |
| Степень окисления +8 | Четырехокись осмия ( Os O 4 ) · четырехокись рутения ( Ru O 4 ) · четырехокись ксенона ( Xe O 4 ) · оксид иридия (VIII) ( Ir O 4 ) · четырехокись гассия ( Hs O 4 ) |
| похожие темы | Окись углерода · Двуокись хлора · Оксид · оксокислота · озонид |
<img src=»https://fr. wikipedia.org/wiki/Special:CentralAutoLogin/start?type=1×1″ alt=»» title=»»>
wikipedia.org/wiki/Special:CentralAutoLogin/start?type=1×1″ alt=»» title=»»>
ICSC 0769 — ОКСИД КАЛИЯ
ICSC 0769 — ОКСИД КАЛИЯ
| КАЛИЯ ОКСИД | ICSC: 0769 (октябрь 2006 г.) |
| Калия моноксид Дикалий оксид | |
| Номер CAS: 12136-45-7 |
| № ООН: 2033 |
| Номер ЕС: 235-227-6 |
| ОСТРЫЕ ОПАСНОСТИ | ПРЕДУПРЕЖДЕНИЕ | ПОЖАРОТУШЕНИЕ | |
|---|---|---|---|
| ПОЖАР И ВЗРЫВ | Не горючий. | Использовать порошок, двуокись углерода. НЕТ водосодержащих агентов. |
| ПРЕДОТВРАТИТЬ РАССЕЯНИЕ ПЫЛИ! ИЗБЕГАЙТЕ ВСЕХ КОНТАКТОВ! ВО ВСЕХ СЛУЧАЯХ ОБРАЩАЙТЕСЬ К ВРАЧУ! | |||
|---|---|---|---|
| СИМПТОМЫ | ПРЕДУПРЕЖДЕНИЕ | ПЕРВАЯ ПОМОЩЬ | |
| Вдыхание | Боль в горле. Кашель. Обжигающее ощущение. Затрудненное дыхание. Сбивчивое дыхание. | Используйте местную вытяжку. Используйте защиту органов дыхания. | Свежий воздух, отдых. Полупрямое положение. Может потребоваться искусственное дыхание. Немедленно обратитесь за медицинской помощью. |
| Кожа | Покраснение. Боль. Серьезные ожоги кожи. | Защитные перчатки. Защитная одежда. | Снять загрязненную одежду. Промойте кожу большим количеством воды или примите душ. Немедленно обратитесь за медицинской помощью. Немедленно обратитесь за медицинской помощью. |
| Глаза | Покраснение. Боль. Бернс. | Носите защитную маску или защиту для глаз в сочетании с защитой органов дыхания. | Промыть большим количеством воды в течение нескольких минут (снять контактные линзы, если это возможно). Немедленно обратитесь за медицинской помощью. |
| Проглатывание | Боль в горле. Ощущение жжения в горле и груди. Шок или коллапс. | Не ешьте, не пейте и не курите во время работы. | Прополоскать рот. Не вызывает рвоту. Немедленно обратитесь за медицинской помощью. |
| ЛИКВИДАЦИЯ УТЕЧЕК | КЛАССИФИКАЦИЯ И МАРКИРОВКА |
|---|---|
Средства индивидуальной защиты: костюм химической защиты, включая автономный дыхательный аппарат. Смести просыпанное вещество в закрытые сухие пластиковые контейнеры. Смойте остатки большим количеством воды. Смести просыпанное вещество в закрытые сухие пластиковые контейнеры. Смойте остатки большим количеством воды. | В соответствии с критериями СГС ООН ОПАСНОСТЬ Вызывает серьезные ожоги кожи и повреждение глаз Транспортировка |
| ХРАНЕНИЕ | |
| Отдельно от сильных кислот, пищевых продуктов и кормов. Сухой. | |
| УПАКОВКА | |
| Герметичный. Не перевозить с пищевыми продуктами и кормами. |
| КАЛИЯ ОКСИД | КМГС: 0769 |
| ФИЗИЧЕСКАЯ И ХИМИЧЕСКАЯ ИНФОРМАЦИЯ | |
|---|---|
Физическое состояние; Внешний вид Физические опасности Химическая опасность | Формула: К 2 О |
| ВОЗДЕЙСТВИЕ И ВЛИЯНИЕ НА ЗДОРОВЬЕ | |
|---|---|
Пути воздействия Последствия кратковременного воздействия | Опасность при вдыхании Последствия длительного или многократного воздействия |
| ПРЕДЕЛЫ ВОЗДЕЙСТВИЯ НА РАБОЧЕМ МЕСТЕ |
|---|
| ОКРУЖАЮЩАЯ СРЕДА |
|---|
| ПРИМЕЧАНИЯ |
|---|
| Бурно реагирует с такими средствами пожаротушения, как вода. Симптомы отека легких часто проявляются только через несколько часов и усиливаются при физической нагрузке. Поэтому необходимы покой и медицинское наблюдение. Следует рассмотреть вопрос о немедленном проведении соответствующей ингаляционной терапии врачом или уполномоченным лицом.  См. ICSC 0357. |
| ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ |
|---|
Классификация ЕС |
| Все права защищены. Опубликованный материал распространяется без каких-либо явных или подразумеваемых гарантий. Ни МОТ, ни ВОЗ, ни Европейская комиссия не несут ответственности за интерпретацию и использование информации, содержащейся в этом материале. | |
Смотрите также:
Токсикологические сокращения
Калий (произносится как /pəˈtæsiəm/) — химический элемент. Он имеет условное обозначение K 9.0008 ( арабский : al qalja → латинский : kalium ) и атомный номер 19. Название «калий» происходит от слова «калий», поскольку калий был впервые выделен из калия. Калий представляет собой мягкий серебристо-белый металлический щелочной металл, который естественным образом связан с другими элементами в морской воде и многих минералах. Он быстро окисляется на воздухе и очень реактивен, особенно по отношению к воде. Во многих отношениях калий и натрий химически сходны, хотя организмы вообще и животные клетки в частности относятся к ним весьма по-разному. Дополнительные рекомендуемые знания
Возникновение Калий составляет около 1,5% веса земной коры и является седьмым по распространенности элементом. Поскольку он очень электроположителен, металлический калий трудно получить из его минералов. Он никогда не встречается в природе в свободном виде, так как бурно реагирует с водой. Калий можно выделить путем электролиза его гидроксида в процессе, который мало изменился со времен Дэви. При производстве калия применяют также термические методы с использованием хлористого калия. См. также минералы калия. Изотопы
Известно 24 изотопа калия. В природе встречаются три изотопа: 39 К (93,3%), 40 К (0,0117%) и 41 К (6,7%). Встречающийся в природе 40 K распадается до стабильного 40 Ar (11,2%) за счет электронного захвата и эмиссии позитронов и распадается до стабильного 40 Ca (88,8%) за счет бета-распада; 40 K имеет период полураспада 1,250×10 9 лет. Помимо датирования, изотопы калия широко использовались в качестве индикаторов при изучении выветривания. Они также использовались для изучения круговорота питательных веществ, поскольку калий является макроэлементом, необходимым для жизни. 40 K содержится в природном калии (и, следовательно, в некоторых коммерческих заменителях соли) в количестве, достаточном для того, чтобы большие пакеты этих заменителей можно было использовать в качестве радиоактивного источника для демонстраций в классе. У здоровых животных и людей 40 К представляет собой самый большой источник радиоактивности, даже больший, чем 14 К. В человеческом теле массой 70 кг распадается около 4400 ядер 40 К в секунду. [1] Активность природного калия 31 Бк/г. СвойстваФизические свойства Калий — второй наименее плотный металл; только литий менее плотный. Это мягкое легкоплавкое твердое вещество, которое легко режется ножом. Калий и его соединения излучают в пламени фиолетовую окраску. Этот факт лежит в основе пламенного теста на наличие калия в образце. Концентрацию калия в растворе обычно определяют пламенной фотометрией, атомно-абсорбционной спектрофотометрией, индуктивно-связанной плазмой или ионселективными электродами. Химические свойстваКалий должен быть защищен от воздуха при хранении, чтобы предотвратить разрушение металла от оксидной и гидроксидной коррозии. Часто образцы выдерживают в восстановительной среде, такой как керосин. Как и другие щелочные металлы, калий бурно реагирует с водой с образованием водорода. Реакция заметно более бурная, чем реакция лития или натрия с водой, и достаточно экзотермична, чтобы воспламенился выделяющийся газообразный водород.
Поскольку калий быстро реагирует даже со следами воды, а продукты его реакции нелетучи, его иногда используют отдельно или в виде NaK (сплав с натрием, который является жидким при комнатной температуре) для осушения растворителей перед перегонкой. Гидроксид калия сильно реагирует с диоксидом углерода с образованием карбоната калия и используется для удаления следов CO 2 с воздуха. Соединения калия обычно обладают отличной растворимостью в воде благодаря высокой энергии гидратации иона K + . Ион калия бесцветен в воде. Методы выделения калия путем осаждения, иногда используемые для гравиметрического анализа, включают использование тетрафенилбора натрия, гексагидрата гексахлорплатината (IV) дигидрогена и кобальтинитрита натрия. Калий в организмеБиохимическая функцияКалий важен для нервной функции и влияет на осмотический баланс между клетками и интерстициальной жидкостью. [2] Калий можно определить по вкусу, поскольку он активирует три из пяти типов вкусовых рецепторов в зависимости от концентрации. Разбавленные растворы ионов калия имеют сладкий вкус (при умеренной концентрации в молоке и соках), в то время как более высокие концентрации становятся все более горькими/щелочными и, наконец, также солеными на вкус. Мембранная поляризацияКалий также важен для сокращения мышц и передачи всех нервных импульсов у животных через потенциалы действия. Из-за взаимодействия заряда иона калия и окружающих его молекул воды ионы K + больше, чем ионы Na + , а ионные каналы и насосы в клеточных мембранах могут легко различать два типа ионов, активно перекачивая или пассивно пропуская один из двух ионов, блокируя при этом другой. Недостаток калия в жидкостях организма может вызвать потенциально смертельное состояние, известное как гипокалиемия, обычно возникающее в результате диареи, повышенного диуреза и рвоты. Симптомы дефицита включают мышечную слабость, паралитическую кишечную непроходимость, аномалии ЭКГ, снижение рефлекторной реакции и в тяжелых случаях паралич дыхания, алкалоз и сердечную аритмию. Фильтрация и выделение Калий является важным минеральным макроэлементом в питании человека; это основной катион (положительный ион) внутри клеток животных, и поэтому он важен для поддержания баланса жидкости и электролитов в организме. Натрий составляет большую часть катионов плазмы крови в количестве около 145 миллиэквивалентов на литр (3345 миллиграммов), а калий составляет большую часть катионов клеточной жидкости в количестве около 150 миллиэквивалентов на литр (4800 миллиграммов). Плазма фильтруется через клубочки почек в огромных количествах, около 180 литров в сутки. [3] Таким образом, каждый день фильтруется 602 000 миллиграммов натрия и 33 000 миллиграммов калия. Все, кроме 1000-10000 миллиграммов натрия и 1000-4000 миллиграммов калия, которые могут быть в рационе, должны реабсорбироваться. Натрий должен реабсорбироваться таким образом, чтобы поддерживать правильный объем крови и правильное осмотическое давление; калий должен реабсорбироваться таким образом, чтобы поддерживать его концентрацию в сыворотке как можно ближе к 4,8 миллиэквивалентам (около 190 миллиграммов) на литр. Калий пассивно перемещается через поры в клеточной стенке. Когда ионы движутся через насосы, в насосах есть ворота по обе стороны от клеточной стенки, и только один из них может быть открыт одновременно. В результате за секунду проходит 100 ионов. Поры имеют только одни ворота, и только один тип ионов может проходить через них со скоростью от 10 до 100 миллионов ионов в секунду. [10] Поры требуют кальция, чтобы открыть [11] , хотя считается, что кальций работает в обратном направлении, блокируя по крайней мере одну из пор. [12] Карбонильные группы внутри поры аминокислот имитируют гидратацию воды, происходящую в водном растворе [13] по природе электростатических зарядов на четырех карбонильных группах внутри поры. Калий в рационеАдекватное потребление, как правило, может быть обеспечено за счет употребления в пищу разнообразных продуктов, содержащих калий, и его дефицит редко встречается у здоровых людей, придерживающихся сбалансированной диеты. Продукты с высоким содержанием калия включают в себя в порядке убывания авокадо, картофель, бананы, брокколи, апельсиновый сок, соевые бобы и абрикосы, хотя он также распространен в большинстве фруктов, овощей и мяса. Диета с высоким содержанием калия может снизить риск гипертонии, а дефицит калия в сочетании с адекватным потреблением тиамина вызывает у крыс сердечные заболевания. [15] В рекомендациях Института медицины от 2004 года указано, что DRI составляет 4000 мг калия, хотя большинство американцев потребляют только половину этого количества в день. [16] Точно так же в Европейском союзе, особенно в Германии и Италии, довольно часто встречается недостаточное потребление калия. [17] Добавки калия в медицине наиболее широко используются в сочетании с петлевыми диуретиками и тиазидами, классами диуретиков, которые выводят из организма натрий и воду, но имеют побочный эффект, вызывая потерю калия с мочой. Лица, страдающие заболеваниями почек, могут испытывать неблагоприятные последствия для здоровья при употреблении большого количества калия с пищей. Пациенты с терминальной стадией почечной недостаточности, получающие терапию почечным диализом, должны соблюдать строгие диетические ограничения по потреблению калия, поскольку почки контролируют экскрецию калия, и повышение концентрации калия в крови может вызвать фатальную сердечную аритмию. Острую гиперкалиемию можно уменьшить, употребляя в пищу пищевую соду 9.0359 [21] или глюкоза, [22] [23] гипервентиляция [24] и потливость. приложенийСельское хозяйство и здравоохранение
Промышленный
Многие соли калия очень важны и включают: бромид калия, карбонат калия, хлорат калия, хлорид калия, хромат калия, цианид калия, дихромат калия, йодид калия, нитрат калия, сульфат калия. История Калий был открыт в Лондоне сэром Хамфри Дэви. Калий не был известен во времена Римской империи, и его названия не классическая латынь, а скорее нео-латынь.
Меры предосторожности Твердый калий бурно реагирует с водой, поэтому его следует хранить под минеральным маслом, например керосином, и обращаться с ним осторожно. Однако, в отличие от лития и натрия, калий не может храниться под маслом бесконечно долго. При хранении от 6 месяцев до года на металле и под крышкой контейнера могут образовываться опасные ударочувствительные пероксиды, которые могут детонировать при открывании. Чрезвычайно щелочной гидроксид калия (КОН) на поверхности калия, подвергшегося воздействию влаги, представляет собой едкую опасность. Как и в случае с металлическим натрием, «мыльное» ощущение металлического калия на коже возникает из-за едкого распада жиров в коже на неочищенное мягкое калиевое мыло и представляет собой начало щелочного ожога. Очевидно, что с калием следует обращаться осторожно, с полной защитой кожи и глаз. Калийные пожары усугубляются водой, и только несколько сухих химикатов эффективны для них. См. также
| Эта статья находится под лицензией GNU Free Documentation License. | 
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||


 Wiberg, » Неорганическая химия » Academic Press, Сан-Диего, США, 2001 ( ISBN 0-12-352651-5 )
Wiberg, » Неорганическая химия » Academic Press, Сан-Диего, США, 2001 ( ISBN 0-12-352651-5 )

 0983(1) g·mol −1
0983(1) g·mol −1  )
)
 1 Физические свойства
1 Физические свойства Основной источник калия, поташ, добывается в Саскачеване, Калифорнии, Германии, Нью-Мексико, Юте и других местах по всему миру. Казахстан – ведущий мировой экспортер калия [ ссылка необходима ] . На три тысячи футов ниже поверхности Саскачевана находятся крупные месторождения калия, которые являются важными источниками этого элемента и его солей, при этом несколько крупных рудников работают с 1960-х годов. Саскачеван первым применил замораживание влажных песков (формация Блэрмор) для проходки через них шахтных стволов. Основной горнодобывающей компанией является Potash Corporation of Saskatchewan. Океаны являются еще одним источником калия, но количество, присутствующее в данном объеме морской воды, относительно мало по сравнению с натрием.
Основной источник калия, поташ, добывается в Саскачеване, Калифорнии, Германии, Нью-Мексико, Юте и других местах по всему миру. Казахстан – ведущий мировой экспортер калия [ ссылка необходима ] . На три тысячи футов ниже поверхности Саскачевана находятся крупные месторождения калия, которые являются важными источниками этого элемента и его солей, при этом несколько крупных рудников работают с 1960-х годов. Саскачеван первым применил замораживание влажных песков (формация Блэрмор) для проходки через них шахтных стволов. Основной горнодобывающей компанией является Potash Corporation of Saskatchewan. Океаны являются еще одним источником калия, но количество, присутствующее в данном объеме морской воды, относительно мало по сравнению с натрием.

 Свежесрезанный калий имеет серебристый вид, но на воздухе он сразу же начинает тускнеть до серого цвета.
Свежесрезанный калий имеет серебристый вид, но на воздухе он сразу же начинает тускнеть до серого цвета. В этой роли он служит мощным осушителем.
В этой роли он служит мощным осушителем. Комбинированная горечь и соленость растворов с высоким содержанием калия затрудняет вкусовые качества добавок с высокими дозами калия в жидких напитках. [ ссылка необходима ]
Комбинированная горечь и соленость растворов с высоким содержанием калия затрудняет вкусовые качества добавок с высокими дозами калия в жидких напитках. [ ссылка необходима ] 
 [4] Натриевые насосы всегда должны работать для сохранения натрия. Калий иногда также необходимо сохранять, но поскольку количество калия в плазме крови очень мало, а запас калия в клетках примерно в 30 раз больше, для калия ситуация не столь критична. Поскольку калий перемещается пассивно [5] [6] в противотоке натрию в ответ на кажущееся (но не фактическое) равновесие Доннана, [7] моча никогда не может опуститься ниже концентрации калия в сыворотке за исключением иногда активного выделения воды в конце обработки. Калий дважды секретируется и трижды реабсорбируется, прежде чем моча достигает собирательных трубочек. [8] В этот момент концентрация калия обычно примерно такая же, как в плазме. Если бы калий был убран из рациона, минимальная обязательная экскреция почками оставалась бы около 200 мг в день, когда уровень сыворотки снижается до 3,0-3,5 миллиэквивалентов на литр примерно через одну неделю, [9] и никогда не может быть полностью устранен.
[4] Натриевые насосы всегда должны работать для сохранения натрия. Калий иногда также необходимо сохранять, но поскольку количество калия в плазме крови очень мало, а запас калия в клетках примерно в 30 раз больше, для калия ситуация не столь критична. Поскольку калий перемещается пассивно [5] [6] в противотоке натрию в ответ на кажущееся (но не фактическое) равновесие Доннана, [7] моча никогда не может опуститься ниже концентрации калия в сыворотке за исключением иногда активного выделения воды в конце обработки. Калий дважды секретируется и трижды реабсорбируется, прежде чем моча достигает собирательных трубочек. [8] В этот момент концентрация калия обычно примерно такая же, как в плазме. Если бы калий был убран из рациона, минимальная обязательная экскреция почками оставалась бы около 200 мг в день, когда уровень сыворотки снижается до 3,0-3,5 миллиэквивалентов на литр примерно через одну неделю, [9] и никогда не может быть полностью устранен. . Поскольку его невозможно полностью отключить, смерть наступит, когда содержание калия в организме упадет примерно до половины полной емкости. В конце обработки калий выделяется еще раз, если его уровень в сыворотке слишком высок.
. Поскольку его невозможно полностью отключить, смерть наступит, когда содержание калия в организме упадет примерно до половины полной емкости. В конце обработки калий выделяется еще раз, если его уровень в сыворотке слишком высок. [14]
[14]  Доступны различные медицинские добавки. Если используются добавки калия, такие как разрыхлитель без натрия и поваренная соль без натрия, недостаточное количество тиамина может вызвать авитаминоз. [18] [19] Дефицит витамина В-1 возможен при употреблении пищи, содержащей сульфит или диоксид серы, или алкогольного напитка, ферментированного диоксидом серы, во время еды, так как сульфит разрушает витамин В-1 в организме. кишечник. [20]
Доступны различные медицинские добавки. Если используются добавки калия, такие как разрыхлитель без натрия и поваренная соль без натрия, недостаточное количество тиамина может вызвать авитаминоз. [18] [19] Дефицит витамина В-1 возможен при употреблении пищи, содержащей сульфит или диоксид серы, или алкогольного напитка, ферментированного диоксидом серы, во время еды, так как сульфит разрушает витамин В-1 в организме. кишечник. [20]  [25]
[25] 
 В 1807 году он получил его из едкого кали (KOH). Калий был первым металлом, который был выделен электролизом.
В 1807 году он получил его из едкого кали (KOH). Калий был первым металлом, который был выделен электролизом. Рекомендуется хранить калий, рубидий или цезий не более трех месяцев, если они не хранятся в инертной (бескислородной) атмосфере или под вакуумом. [26]
Рекомендуется хранить калий, рубидий или цезий не более трех месяцев, если они не хранятся в инертной (бескислородной) атмосфере или под вакуумом. [26]