Специфические свойства | |
1. Ортофосфорная кислота диссоциирует ступенчато: H3PO4 ↔ H+ + H2PO4—(дигидроортофосфат-ион) H2PO4— ↔ H+ + HPO42-(гидроортофосфат-ион) HPO42- ↔ H+ + PO43-(ортофосфат-ион) 2. Взаимодействует с металлами в ряду активности до (Н2): металл+ H3PO4=соль+Н2↑ 3. Взаимодействует с основными оксидами: оксид металла + H3PO4 = соль + Н2О 4. основание + H3PO4 = соль + Н2О если кислота в избытке, то образуется кислая соль: H3PO4(изб) + NaOH = NaH2PO4+ H2O или H3PO4(изб) + 2NaOH =Na2HPO4 + 2H2O 5. Реагирует с аммиаком (по донорно-акцепторному механизму), если в избытке кислота, образуются кислые соли: H3PO4 + NH3 = NH3H2PO4 H3PO4 + 2NH3 = (NH3)2HPO4 H3PO4 + 3NH3 = (NH3)3PO4 6. 2H3PO4+3Na2CO3 = 2Na3PO4 + 3H2O + 3CO2↑ | 1. При нагревании ортофосфорная кислота постепенно превращается в метафосфорную кислоту: 2H3PO4 (t˚C) → H2O + H4P2O7 H4P2O7 (t˚C)→ H2O + 2HPO3 2. Качественная реакция наPO43- — фосфат ион. Отличительной реакцией ортофосфорной кислоты от других фосфорных кислот является реакция с нитратом серебра — образуетсяжёлтый осадок: Н3РО4 + 3AgNO3 = Ag3PO4↓+ 3HNO3 3.
|
Оксид фосфора (V): получение и свойства
| Оксиды азота | Цвет | Фаза | Характер оксида |
| P2O3 Оксид фосфора (III), фосфористый ангидрид | белый | твердый | кислотный |
| P2O5 Оксид фосфора(V), фосфорный ангидрид | белый | твердый | кислотный |
Оксид фосфора (V) – это кислотный оксид. В нормальных условиях образует белые кристаллы. В парах состоит из молекул P4О10. Очень гигроскопичен (используется как осушитель газов и жидкостей).
В нормальных условиях образует белые кристаллы. В парах состоит из молекул P4О10. Очень гигроскопичен (используется как осушитель газов и жидкостей).
Способы получения. Оксид фосфора (V) получают сжиганием фосфора в избытке кислорода.
4P + 5O2 → 2P2O5
1. Оксид фосфора (V) – очень гигроскопичное вещество, которое используется для осушения газов. Обладая высоким сродством к воде, оксид фосфора (V) дегидратирует до ангидридов неорганические и органические кислоты.
Например, оксид фосфора (V) дегидратирует серную, азотную и уксусную кислоты:
P2O5 + H2SO4 → 2HPO3 + SO3
P2O5 + 2HNO3 → 2HPO3 + N2O5
P2O5 + 2CH3COOH → 2HPO3 + (CH3CO)2O
2. Фосфорный ангидрид является типичным кислотным оксидом, взаимодействует с водой с образованием фосфорных кислот:
Фосфорный ангидрид является типичным кислотным оксидом, взаимодействует с водой с образованием фосфорных кислот:
P2O5 + 3H2O → 2H3PO4
В зависимости от количества воды и от других условий образуются мета-фосфорная, орто-фосфорная или пиро-фосфорная кислота:
P2O5 + 2H2O → 2H4P2O7
P2O5 + H2O → HPO3
Видеоопыт взаимодействия оксида фосфора с водой можно посмотреть здесь.
3. Как кислотный оксид, оксид фосфора (V) взаимодействует с основными оксидами и основаниями.
Например, оксид фосфора (V) взаимодействует с гидроксидом натрия. При этом образуются средние или кислые соли:
При этом образуются средние или кислые соли:
P2O5 + 6NaOH → 2Na3PO4 + 3H2O
P2O5 + 2NaOH + H2O → 2NaH2PO4
P2O5 + 4NaOH → 2Na2HPO4 + H2O
Еще пример: оксид фосфора взаимодействует с оксидом бария (при сплавлении):
P2O5 + 3BaO → Ba3(PO4)2
Понравилось это:
Нравится Загрузка…
оксид | химическое соединение | Британика
оксид железа
Посмотреть все СМИ
- Ключевые люди:
- Джозеф Пристли
- Похожие темы:
- вода
оксид серы
глинозем
диоксид титана
оксидный минерал
Просмотреть весь соответствующий контент →
Резюме
Прочтите краткий обзор этой темы
оксид , любое из большого и важного класса химических соединений, в которых кислород связан с другим элементом. За исключением более легких инертных газов (гелия [He], неона [Ne], аргона [Ar] и криптона [Kr]), кислород (O) образует по крайней мере один бинарный оксид с каждым из элементов.
За исключением более легких инертных газов (гелия [He], неона [Ne], аргона [Ar] и криптона [Kr]), кислород (O) образует по крайней мере один бинарный оксид с каждым из элементов.
И металлы, и неметаллы могут достигать наивысших степеней окисления (т. е. отдавать максимальное количество доступных валентных электронов) в соединениях с кислородом. Щелочные и щелочноземельные металлы, а также переходные и постпереходные металлы (в их низших степенях окисления) образуют ионные оксиды, т. е. соединения, содержащие О 2- анион. Металлы с высокими степенями окисления образуют оксиды, связи которых имеют более ковалентный характер. Неметаллы также образуют ковалентные оксиды, которые обычно имеют молекулярный характер. Плавное изменение типа связи в оксидах от ионных к ковалентным наблюдается по мере того, как периодическая таблица перемещается от металлов слева к неметаллам справа. Такая же вариация наблюдается в реакции оксидов с водой и обусловленном этим кислотно-основном характере продуктов. Ионные оксиды металлов реагируют с водой с образованием гидроксидов (соединений, содержащих OH − ion) и образующиеся в результате основные растворы, в то время как большинство оксидов неметаллов реагируют с водой с образованием кислот и образующихся кислотных растворов ( см. в таблице).
Ионные оксиды металлов реагируют с водой с образованием гидроксидов (соединений, содержащих OH − ion) и образующиеся в результате основные растворы, в то время как большинство оксидов неметаллов реагируют с водой с образованием кислот и образующихся кислотных растворов ( см. в таблице).
| группа 1 | группа 2 | группа 13 | группа 14 | группа 15 | группа 16 | группа 17 | |
|---|---|---|---|---|---|---|---|
Источник: Из W. Robinson, J. Odom, and H. Holtzclaw, Jr., Chemistry: Concepts and Models, DC Heath and Co. , 1992. , 1992. | |||||||
| реакция оксидов с водой и кислотно-щелочной характер гидроксидов | Na 2 O дает NaOH (сильное основание) | MgO дает Mg(OH) 2 (слабое основание) | Al 2 O 3 нереагирующий | SiO 2 нереагирующий | P 4 O 10 дает H 3 PO 4 (слабая кислота) | SO 3 дает H 2 SO 4 (сильная кислота) | Кл 2 O 7 дает HClO 4 (сильная кислота) |
| связывание в оксидах | Na 2 O ионный | ионный MgO | Al 2 O 3 ионный | SiO 2 ковалентная | P 4 O 10 ковалентная | СО 3 ковалентный | Cl 2 O 7 ковалентная |
Некоторые органические соединения реагируют с кислородом или другими окислителями с образованием веществ, называемых оксидами. Так, амины, фосфины и сульфиды образуют аминооксиды, фосфиноксиды и сульфоксиды соответственно, в которых атом кислорода ковалентно связан с атомом азота, фосфора или серы. Так называемые оксиды олефинов представляют собой циклические эфиры.
Так, амины, фосфины и сульфиды образуют аминооксиды, фосфиноксиды и сульфоксиды соответственно, в которых атом кислорода ковалентно связан с атомом азота, фосфора или серы. Так называемые оксиды олефинов представляют собой циклические эфиры.
Оксиды металлов представляют собой твердые кристаллические вещества, содержащие катион металла и анион оксида. Обычно они реагируют с водой с образованием оснований или с кислотами с образованием солей.
Щелочные металлы и щелочноземельные металлы образуют три различных типа бинарных соединений кислорода: (1) оксиды, содержащие оксид-ионы, O 2– , (2) пероксиды, содержащие пероксид-ионы, O 2 2– , которые содержат ковалентные одинарные связи кислород-кислород, и (3) супероксиды, содержащие ионы супероксида, O 2 − , которые также имеют ковалентные связи кислород-кислород, но имеют на один отрицательный заряд меньше, чем ионы перекиси. Щелочные металлы (имеющие степень окисления +1) образуют оксиды M 2 O, пероксиды M 2 O 2 и супероксиды MO 2 . (M представляет собой атом металла.) Щелочноземельные металлы (со степенью окисления +2) образуют только оксиды, MO, и пероксиды, MO 2 . Все оксиды щелочных металлов могут быть получены нагреванием соответствующего нитрата металла с элементарным металлом.
(M представляет собой атом металла.) Щелочноземельные металлы (со степенью окисления +2) образуют только оксиды, MO, и пероксиды, MO 2 . Все оксиды щелочных металлов могут быть получены нагреванием соответствующего нитрата металла с элементарным металлом.
2МНО 3 + 10M + тепло → 6M 2 O + N 2
Общее получение оксидов щелочноземельных металлов включает нагревание карбонатов металлов.
MCO 3 + тепло → MO + CO 2
Как оксиды щелочных металлов, так и оксиды щелочноземельных металлов являются ионными и реагируют с водой с образованием основных растворов гидроксида металла.
M 2 O + H 2 O → 2MOH (где M = металл группы 1)
MO + H 2 O → M(OH) 2 (где M = металл группы 2)
Поэтому эти соединения часто называют основными оксидами. В соответствии со своим основным поведением они реагируют с кислотами в типичных кислотно-щелочных реакциях с образованием солей и воды; Например,
М 2 O + 2HCl → 2MCl + H 2 O (где M = металл группы 1).
Эти реакции также часто называют реакциями нейтрализации. Наиболее важными основными оксидами являются оксид магния (MgO), хороший проводник тепла и электрический изолятор, который используется в огнеупорном кирпиче и теплоизоляции, и оксид кальция (CaO), также называемый негашеной известью или известью, широко используемый в сталелитейной промышленности и в воде. очищение.
Тщательно изучены периодические тренды оксидов. В любой данный период связь в оксидах прогрессирует от ионной к ковалентной, а их кислотно-основной характер меняется от сильно основного к слабоосновному, амфотерному, слабокислому и, наконец, сильнокислому. Как правило, основность увеличивается вниз по группе (например, в оксидах щелочноземельных металлов BeO < MgO < CaO < SrO < BaO). Кислотность увеличивается с увеличением степени окисления элемента. Например, из пяти оксидов марганца MnO (в котором марганец имеет степень окисления +2) является наименее кислотным, а Mn 2 O 7 (содержащий Mn 7+ ) наиболее кислый. Оксиды переходных металлов со степенями окисления +1, +2 и +3 представляют собой ионные соединения, состоящие из ионов металлов и ионов оксидов. Эти оксиды переходных металлов со степенями окисления +4, +5, +6 и +7 ведут себя как ковалентные соединения, содержащие ковалентные связи металл-кислород. Как правило, ионные оксиды переходных металлов являются основными. То есть они будут реагировать с водными кислотами с образованием растворов солей и воды; Например,
Оксиды переходных металлов со степенями окисления +1, +2 и +3 представляют собой ионные соединения, состоящие из ионов металлов и ионов оксидов. Эти оксиды переходных металлов со степенями окисления +4, +5, +6 и +7 ведут себя как ковалентные соединения, содержащие ковалентные связи металл-кислород. Как правило, ионные оксиды переходных металлов являются основными. То есть они будут реагировать с водными кислотами с образованием растворов солей и воды; Например,
СоО + 2Н 3 О + → Co 2+ + 3H 2 О.
Оксиды со степенями окисления +5, +6 и +7 являются кислыми и реагируют с растворами гидроксида с образованием солей и воды; Например,
CrO 3 + 2OH — → CrO 4 2− + H 2 O.
Оксиды со степенью окисления +4 обычно являются амфотерными (от греческого amphoteros, «в обоих направлениях»), что означает, что эти соединения могут вести себя либо как кислоты, либо как основания. Амфотерные оксиды растворяются не только в кислых, но и в основных растворах. Например, оксид ванадия (VO 2 ) представляет собой амфотерный оксид, растворяющийся в кислоте с образованием синего иона ванадила, [VO] 2+ , и в основании с образованием желто-коричневого гипованадат-иона, [V 4 O 9 ] 2− . Амфотеризм среди оксидов основной группы в первую очередь обнаруживается у металлоидных элементов или их близких соседей.
Например, оксид ванадия (VO 2 ) представляет собой амфотерный оксид, растворяющийся в кислоте с образованием синего иона ванадила, [VO] 2+ , и в основании с образованием желто-коричневого гипованадат-иона, [V 4 O 9 ] 2− . Амфотеризм среди оксидов основной группы в первую очередь обнаруживается у металлоидных элементов или их близких соседей.
Оформите подписку Britannica Premium и получите доступ к эксклюзивному контенту.
Подписаться сейчас
КИСЛОТНО-ОСНОВНОЕ ПОВЕДЕНИЕ ПЕРИОДА 3 ОКСИДА На этой странице рассматриваются реакции оксидов элементов 3-го периода (натрия в хлор) с водой и, где это уместно, с кислотами или основаниями. Очевидно, что аргон не используется, поскольку он не образует оксид. Краткое описание тенденции Оксиды Оксиды, которые мы рассмотрим:
| |||||||||||||||
Примечание: Если вы еще не были там, возможно, вам будет интересно просмотреть страницу о структурах и физических свойствах оксидов периода 3 в качестве полезного введения, прежде чем двигаться дальше. Используйте кнопку НАЗАД в браузере, чтобы быстро вернуться на эту страницу позже, если вы решите перейти по этой ссылке. | |||||||||||||||
Тенденция кислотно-щелочного поведения Тенденция кислотно-щелочного поведения проявляется в различных реакциях, но в виде простого обобщения: Для этой простой тенденции вы должны смотреть только на самые высокие оксиды отдельных элементов. Это те, которые находятся в верхнем ряду выше, и именно здесь элемент находится в максимально возможной степени окисления. Схема не так проста, если вы включите и другие оксиды. Для оксидов неметаллов их кислотность обычно рассматривается с точки зрения кислых растворов, образующихся при их реакции с водой, например, триоксид серы реагирует с образованием серной кислоты. Однако все они будут реагировать с основаниями, такими как гидроксид натрия, с образованием солей, таких как сульфат натрия. Все эти реакции подробно описаны на оставшейся части этой страницы. | |||||||||||||||
Предупреждение: Остальная часть этой страницы содержит довольно много подробностей о различных оксидах. Не упускайте из виду общую тенденцию периода в отношении высших оксидов, когда смотрите на все эти детали. Очень важно знать, что говорится в вашей программе по этой теме, а также изучить прошлые работы и схемы оценок, иначе вы в конечном итоге увязнете в массе деталей, о которых вам на самом деле не нужно знать. Если вы готовитесь к экзамену в Великобритании (уровень A или его эквивалент) и у вас нет ни одной из этих вещей, перейдите по этой ссылке, прежде чем идти дальше, чтобы узнать, как их получить. | |||||||||||||||
Химия индивидуальных оксидов Оксид натрия Оксид натрия — простой сильноосновный оксид. Он является основным, поскольку содержит ион оксида O 2-, который является очень сильным основанием с высокой склонностью к соединению с ионами водорода. Реакция с водой Оксид натрия экзотермически реагирует с холодной водой с образованием раствора гидроксида натрия. В зависимости от его концентрации pH будет около 14.
Реакция с кислотами Как сильное основание, оксид натрия также реагирует с кислотами. Например, он будет реагировать с разбавленной соляной кислотой с образованием раствора хлорида натрия.
Оксид магния Оксид магния также является простым основным оксидом, поскольку он также содержит оксидные ионы. Однако он не так сильно щелочен, как оксид натрия, потому что ионы оксида не так свободны. В случае оксида натрия твердое тело удерживается вместе за счет притяжения между ионами 1+ и 2-. В случае оксида магния притяжение находится между 2+ и 2-. Даже с учетом других факторов (таких как энергия, высвобождаемая, когда положительные ионы образуют притяжение с водой в образующемся растворе), чистый эффект этого заключается в том, что реакции с участием оксида магния всегда будут менее экзотермическими, чем реакции с оксидом натрия. Реакция с водой Если взболтать немного белого порошка оксида магния с водой, кажется, что ничего не происходит — не похоже, что он реагирует. Однако, если вы проверите рН жидкости, вы обнаружите, что он где-то около рН 9, что свидетельствует о слабощелочной реакции. Должно быть, произошла небольшая реакция с водой, в результате которой в растворе образовались гидроксид-ионы. В ходе реакции образуется некоторое количество гидроксида магния, но он почти нерастворим, поэтому не так много гидроксид-ионов попадает в раствор.
Реакция с кислотами Оксид магния реагирует с кислотами так же, как и любой простой оксид металла.
Оксид алюминия Описание свойств оксида алюминия может привести к путанице, поскольку он существует в различных формах. Одна из этих форм очень нереактивна. Он химически известен как альфа-Al 9.0070 2 O 3 и производится при высоких температурах. Далее мы примем одну из наиболее реактивных форм. Оксид алюминия амфотерный . Он вступает в реакцию как с основанием, так и с кислотой. Реакция с водой Оксид алюминия не реагирует простым образом с водой в том смысле, в каком это делают оксид натрия и оксид магния, и не растворяется в ней. Хотя он все еще содержит ионы оксида, они слишком прочно удерживаются в твердой решетке, чтобы вступать в реакцию с водой. | |||||||||||||||
Примечание: Однако некоторые формы оксида алюминия очень эффективно поглощают воду. | |||||||||||||||
Реакция с кислотами Оксид алюминия содержит оксид-ионы и поэтому реагирует с кислотами так же, как оксиды натрия или магния. Это означает, например, что оксид алюминия будет реагировать с горячей разбавленной соляной кислотой с образованием раствора хлорида алюминия.
В этой (и подобных реакциях с другими кислотами) оксид алюминия проявляет основную сторону своей амфотерной природы. Реакция с основаниями Оксид алюминия также имеет кислую сторону по своей природе, и это проявляется в реакции с основаниями, такими как раствор гидроксида натрия. Образуются различные алюминаты — соединения, в которых алюминий находится в отрицательном ионе. Это возможно, потому что алюминий обладает способностью образовывать ковалентные связи с кислородом. В случае с натрием существует слишком большая разница в электроотрицательности между натрием и кислородом, чтобы образовать что-либо, кроме ионной связи. Но электроотрицательность увеличивается по мере прохождения периода, и разница электроотрицательностей между алюминием и кислородом меньше. Это позволяет образовывать ковалентные связи между ними. | |||||||||||||||
Примечание: Если вас не устраивает электроотрицательность, вы найдете объяснение, если перейдете по этой ссылке. Используйте кнопку НАЗАД в браузере, чтобы быстро вернуться на эту страницу позже. | |||||||||||||||
С горячим концентрированным раствором гидроксида натрия оксид алюминия реагирует с образованием бесцветного раствора тетрагидроксоалюмината натрия.
| |||||||||||||||
Примечание: Вы можете найти всевозможные другие формулы, данные для продукта этой реакции. Они варьируются от NaAlO 2 (который представляет собой обезвоженную форму соединения в уравнении) до Na 3 Al(OH) 6 (это совершенно другой продукт). То, что вы на самом деле получите, будет зависеть от таких вещей, как температура и концентрация раствора гидроксида натрия. В любом случае, истина почти наверняка намного сложнее любой из них. Это тот случай, когда полезно выяснить, что ваши экзаменаторы цитируют в своих вспомогательных материалах или схемах выставления оценок, и придерживаться этого. При необходимости получите такую информацию от своих экзаменаторов (если вы проходите курс в Великобритании), следуя ссылкам на странице учебных программ. | |||||||||||||||
Диоксид кремния (оксид кремния(IV)) К тому времени, когда вы дойдете до кремния по мере прохождения периода, электроотрицательность увеличится настолько, что уже не будет достаточно разницы электроотрицательностей между кремнием и кислородом для образования ионных связей. Диоксид кремния не имеет основных свойств — не содержит ионов оксида и не реагирует с кислотами. Вместо этого он очень слабокислотный и реагирует с сильными основаниями. Реакция с водой Диоксид кремния не реагирует с водой из-за сложности разрушения гигантской ковалентной структуры. Реакция с основаниями Диоксид кремния реагирует с раствором гидроксида натрия, но только если он горячий и концентрированный. Образуется бесцветный раствор силиката натрия.
Вы также можете быть знакомы с одной из реакций, происходящих в доменной печи для извлечения железа, в которой оксид кальция (из известняка, который является одним из сырьевых материалов) реагирует с диоксидом кремния с образованием жидкого шлака, силиката кальция. Это также пример реакции кислого диоксида кремния с основанием.
Важно! Для остальных оксидов мы в основном будем рассматривать результаты их взаимодействия с водой с получением растворов различных кислот. Когда мы говорим об увеличении кислотности оксидов по мере перехода, скажем, от оксида фосфора(V) к триоксиду серы и оксиду хлора(VII), мы обычно говорим о возрастающей силе кислот, образующихся при их реакции. с водой. Оксиды фосфора Мы рассмотрим два оксида фосфора, оксид фосфора (III), P 4 O 6 , и оксид фосфора (V), P 4 O 10 . Оксид фосфора(III) Оксид фосфора (III) реагирует с холодной водой с образованием раствора слабой кислоты, H 3 PO 3 , известной как фосфористая кислота, ортофосфористая кислота или фосфоновая кислота. Его реакция с горячей водой гораздо сложнее.
| |||||||||||||||
Примечание. Обратите внимание на окончание «-ous» в первых двух именах. Это не орфографическая ошибка — это правда! Он используется, чтобы отличить его от фосфорной кислоты, которая сильно отличается (см. Ниже). Названия фосфорсодержащих кислот просто кошмар! (На самом деле, насколько я понимаю, фосфорные кислоты вообще всегда были и продолжают быть полным кошмаром!) Не слишком беспокойтесь об этих названиях на этом уровне. Просто убедитесь, что вы можете написать формулы, если вам это нужно, и будьте благодарны, что вам не нужно знать о них так много! | |||||||||||||||
Чистая неионизированная кислота имеет структуру: Водороды не высвобождаются в виде ионов, пока вы не добавите воду к кислоте, и даже тогда высвобождается не так много, потому что фосфористая кислота является слабой кислотой. Фосфористая кислота имеет pK a 2,00, что делает ее сильнее, чем обычные органические кислоты, такие как этановая кислота (pK a = 4,76). | |||||||||||||||
Примечание: Если вы знаете о pK a , но не очень уверены, вы можете перейти по этой ссылке, но это, вероятно, займет у вас много времени. Все, что вам действительно нужно знать по этой теме, это то, что чем ниже значение pK a , тем сильнее кислота. | |||||||||||||||
Очень маловероятно, что вы когда-либо будете реагировать непосредственно на оксид фосфора (III) с основанием, но вам может понадобиться знать, что происходит, если вы взаимодействуете с образовавшейся фосфористой кислотой с основанием. В фосфористой кислоте два атома водорода в группах -ОН являются кислыми, а другой — нет. Это означает, что вы можете получить две возможные реакции, например, с раствором гидроксида натрия, в зависимости от используемых пропорций.
| |||||||||||||||
Примечание: Проверьте свою программу, прошлые работы и схемы оценок, прежде чем вы слишком увязнете в этом! Перейдите по этой ссылке, чтобы узнать, как получить их, если вы их еще не получили (только учебные программы для Великобритании). | |||||||||||||||
Оксид фосфора(V) Оксид фосфора(V) бурно реагирует с водой с образованием раствора, содержащего смесь кислот, природа которых зависит от условий. Обычно мы рассматриваем только одну из них, фосфорную (V) кислоту, H 3 PO 4 , также известную как фосфорная кислота или ортофосфорная кислота.
На этот раз чистая неионизированная кислота имеет структуру: Фосфорная (V) кислота также является слабой кислотой с pK a 2,15. Это делает его на 90 387 слабее фосфористой кислоты на 90 388. Растворы обеих этих кислот с концентрацией около 1 моль дм -3 будут иметь рН около 1. Опять же, вы вряд ли когда-либо будете реагировать на этот оксид с основанием, но вполне вероятно, что вы знаете, как фосфорная (V) кислота реагирует с чем-то вроде раствора гидроксида натрия. Если вы посмотрите на структуру, то увидите, что она имеет три группы -ОН, и каждая из них имеет кислый атом водорода. Вы можете получить реакцию с гидроксидом натрия в три стадии, при этом один за другим эти атомы водорода реагируют с ионами гидроксида.
Опять же, если бы вы реагировали оксидом фосфора (V) непосредственно с раствором гидроксида натрия, а не сначала получали кислоту, вы бы получили такие же возможные соли. Это становится смешно, поэтому я приведу только один пример из возможных уравнений:
| |||||||||||||||
Примечание: Если на экзамене вы получите вопрос, в котором вам просто нужно написать уравнение реакции гидроксида натрия с фосфорной (V) кислотой, какое уравнение вы должны написать? Это не должно иметь большого значения — все они совершенно действительны. Если вы действительно хотите быть уверенным, проверьте прошлые бумаги и отметьте схемы. Я нашел один вопрос о реакции между оксидом натрия и фосфорной (V) кислотой, где схема меток принимала любое из возможных уравнений — чего я и ожидал. (Я знаю, что не дал вам этот конкретный набор уравнений, но их нетрудно вычислить, если вы понимаете принцип, и я не могу дать каждое отдельное кислотно-щелочное уравнение. Это уже давно страница будет продолжаться вечно, и все в отчаянии сдадутся задолго до конца!.. Вот почему вы пытаетесь понять химию, а не учить ее по-попугайски.) Пожалуйста не теряйте время выучите уравнения — или по крайней мере пока не узнаете и не поймете всю остальную химию, которую вам нужно знать и понимать! У любого уравнения очень мало шансов попасть на экзамен, даже если оно есть в вашей программе. Жизнь слишком коротка, чтобы тратить время на изучение уравнений. | |||||||||||||||
Оксиды серы Мы рассмотрим диоксид серы, SO 2 , и триоксид серы, SO 3 . Диоксид серы Двуокись серы хорошо растворяется в воде, реагируя с ней с образованием раствора, известного как сернистая кислота и традиционно имеющего формулу H 2 SO 3 . Однако основным веществом в растворе является просто гидратированный диоксид серы — SO 2 .xH 2 O. Вопрос о существовании H 2 SO 3 как такового в растворе остается спорным. Сернистая кислота также является слабой кислотой с pK a около 1,8, что немного сильнее, чем у двух вышеперечисленных фосфорсодержащих кислот. Достаточно концентрированный раствор сернистой кислоты снова будет иметь рН около 1, . | |||||||||||||||
Примечание: Значение pK a , указанное для сернистой кислоты в различных источниках, может варьироваться от 1,77 до 1,9. Ионизация «сернистой кислоты» включает ионизацию гидратированного комплекса, и вам не нужно об этом беспокоиться на этом уровне. | |||||||||||||||
Диоксид серы также будет реагировать непосредственно с такими основаниями, как раствор гидроксида натрия. Если диоксид серы барботируют через раствор гидроксида натрия, сначала образуется раствор сульфита натрия, а затем раствор гидросульфита натрия, когда диоксид серы избыток.
| |||||||||||||||
Примечание: Сульфит натрия также называют сульфатом натрия(IV). Гидросульфит натрия также является гидросульфатом натрия (IV) или бисульфитом натрия. Обратите внимание, что уравнения для этих реакций отличаются от примеров с фосфором. | |||||||||||||||
Другая важная реакция диоксида серы с основным оксидом кальция с образованием сульфита кальция (сульфата кальция (IV)). Это лежит в основе одного из методов удаления диоксида серы из дымовых газов на электростанциях.
Триоксид серы Триоксид серы бурно реагирует с водой с образованием тумана из капель концентрированной серной кислоты.
| |||||||||||||||
Примечание: Если вы знаете о контактном процессе производства серной кислоты, вы знаете, что триоксид серы всегда превращается в серную кислоту окольным путем, чтобы избежать проблемы тумана серной кислоты. Если вам интересно, вы найдете подробную информацию о контактном процессе в другом месте на этом сайте, но это не имеет отношения к текущей теме. | |||||||||||||||
Чистая неионизированная серная кислота имеет структуру: Серная кислота является сильной кислотой, и растворы обычно имеют pH около 0. Кислота реагирует с водой, образуя ион гидроксония (ион водорода в растворе, если хотите) и ион гидросульфата. Эта реакция завершена практически на 100%. H 2 SO 4 (водн.) + H 2 O(ж) H 3 O + (водн.) + HSO 4 — 90 90 90 — 90 Второй водород удалить труднее. На самом деле ион гидросульфата является относительно слабой кислотой, аналогичной по силе кислотам, которые мы уже обсуждали на этой странице. На этот раз вы получаете равновесие: HSO 4 — (водн.) + H 2 O(л) H 3 O + (водн. Серная кислота, конечно же, имеет все реакции сильной кислоты, с которыми вы знакомы из вводных курсов химии. Например, нормальная реакция с раствором гидроксида натрия заключается в образовании раствора сульфата натрия, в котором оба кислых атома водорода реагируют с ионами гидроксида.
В принципе, вы также можете получить раствор гидросульфата натрия, используя вдвое меньше гидроксида натрия и просто реагируя с одним из двух кислотных атомов водорода в кислоте. На практике лично я никогда этого не делал — не вижу особого смысла! Триоксид серы сам по себе также будет реагировать непосредственно с основаниями с образованием сульфатов. Например, он будет реагировать с оксидом кальция с образованием сульфата кальция. Это точно так же, как реакция с диоксидом серы, описанная выше.
Оксиды хлора Хлор образует несколько оксидов, но единственные два, упомянутые в любой из программ уровня A Великобритании, — это оксид хлора (VII), Cl 2 O 7 , и оксид хлора (I), Cl 2 O. Хлор ( Оксид VII) также известен как гептоксид дихлора, а оксид хлора (I) — как монооксид дихлора. Оксид хлора(VII) Оксид хлора (VII) является высшим оксидом хлора — хлор находится в максимальной степени окисления +7. Он продолжает тенденцию высших оксидов элементов периода 3 к тому, чтобы быть более сильными кислотами. Оксид хлора (VII) реагирует с водой с образованием очень сильной кислоты, хлорной (VII) кислоты, также известной как хлорная кислота. pH типичных растворов, как и серной кислоты, будет около 0, .
Неионизированная хлорная (VII) кислота имеет структуру: Вам, вероятно, это не понадобится для целей уровня UK A (или его эквивалентов), но это полезно, если вы понимаете, почему хлорная (VII) кислота является более сильной кислотой, чем хлорная (I) кислота (см. Когда ион хлората (VII) (перхлорат-ион) образуется в результате потери иона водорода (например, когда он реагирует с водой), заряд может быть делокализован по каждому атому кислорода в ионе. Это делает его очень стабильным и означает, что хлорная (VII) кислота очень сильная. | |||||||||||||||
Примечание: Это точно так же, как делокализация, которая происходит в ионе этаноата, образующемся, когда этановая кислота ведет себя как слабая кислота. Вы найдете это подробно описано на странице об органических кислотах. Используйте кнопку НАЗАД в браузере, если вы решили перейти по этой ссылке. | |||||||||||||||
Хлорная(VII) кислота реагирует с раствором гидроксида натрия с образованием раствора хлората натрия(VII).
Сам оксид хлора (VII) также реагирует с раствором гидроксида натрия с образованием того же продукта.
Оксид хлора(I) Оксид хлора(I) гораздо менее кислый, чем оксид хлора(VII). Он в некоторой степени реагирует с водой с образованием хлорноватистой (I) кислоты, HOCl, также известной как хлорноватистая кислота.
| |||||||||||||||
Примечание: Вы также можете найти хлорную (I) кислоту, записанную как HClO. Форма, которую я использовал, более точно отражает способ соединения атомов. | |||||||||||||||
Структура хлорной (I) кислоты точно соответствует ее формуле HOCl. В нем нет кислорода с двойными связями и нет способа делокализации заряда отрицательного иона, образованного в результате потери водорода. Это означает, что образовавшийся отрицательный ион не очень стабилен и легко восстанавливает свой водород, чтобы вернуться в кислоту. | |||||||||||||||

 Применяется как осушитель газов и жидкостей.
Применяется как осушитель газов и жидкостей.
 Водный раствор кислоты изменяет окраску индикаторов на красный:
Водный раствор кислоты изменяет окраску индикаторов на красный: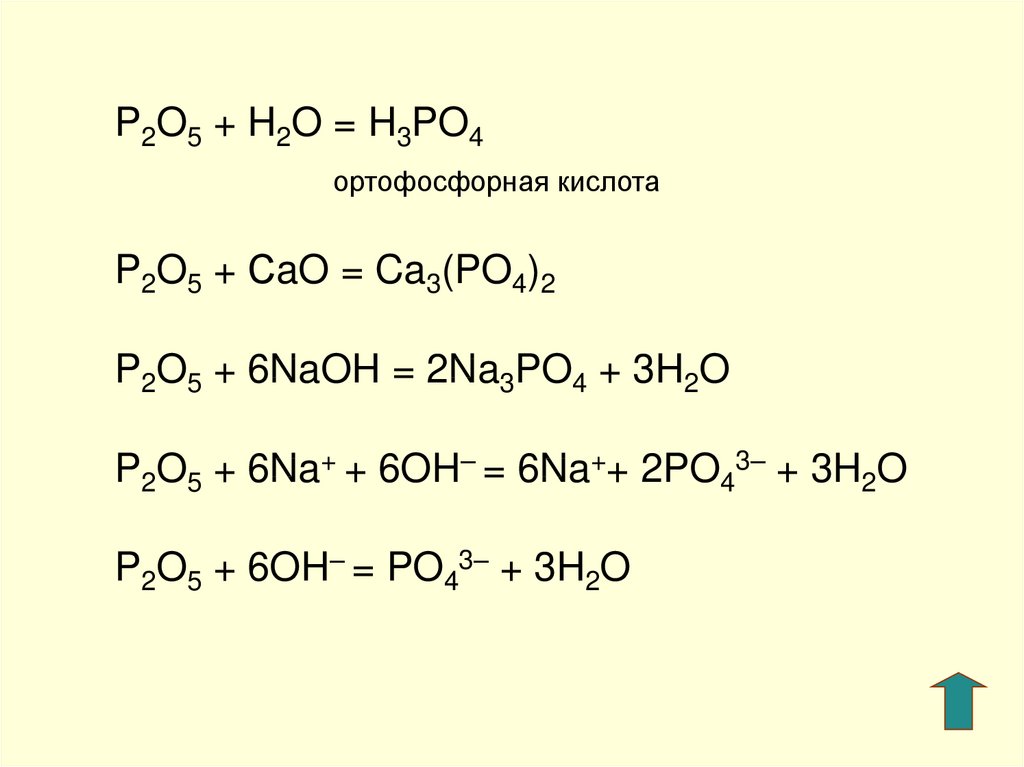 Взаимодействует с основаниями Ме(ОН)n:
Взаимодействует с основаниями Ме(ОН)n: Реагирует с солями слабых кислот:
Реагирует с солями слабых кислот: Играет большую роль в жизнедеятельности животных и растений. Её остатки входят в состав АТФ. При разложении АТФ выделяется большое количество энергии, что очень важно для живых организмов.
Играет большую роль в жизнедеятельности животных и растений. Её остатки входят в состав АТФ. При разложении АТФ выделяется большое количество энергии, что очень важно для живых организмов. калием
калием


 Чтобы сломать их, требуется больше энергии.
Чтобы сломать их, требуется больше энергии.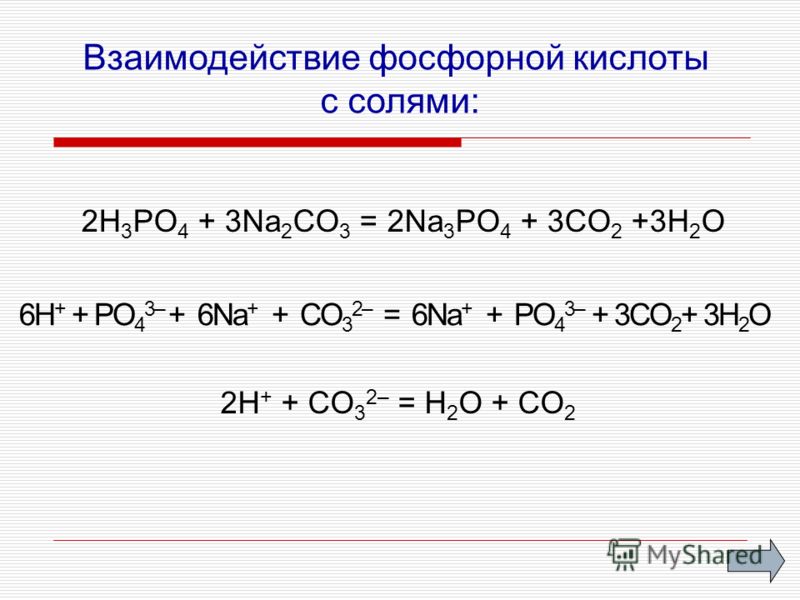 Например, он реагирует с теплой разбавленной соляной кислотой с образованием раствора хлорида магния.
Например, он реагирует с теплой разбавленной соляной кислотой с образованием раствора хлорида магния. Я не смог установить, включает ли это поглощение только такие вещи, как водородные связи, или же происходит реальная химическая реакция с образованием какого-то гидроксида. Если у вас есть какая-либо твердая информация по этому поводу, не могли бы вы связаться со мной по адресу, указанному на странице об этом сайте.
Я не смог установить, включает ли это поглощение только такие вещи, как водородные связи, или же происходит реальная химическая реакция с образованием какого-то гидроксида. Если у вас есть какая-либо твердая информация по этому поводу, не могли бы вы связаться со мной по адресу, указанному на странице об этом сайте.







 В каждом случае это просто зависит от пропорций двух используемых реагентов.
В каждом случае это просто зависит от пропорций двух используемых реагентов. Знайте, как работать с ними, если вам нужно.
Знайте, как работать с ними, если вам нужно. 2. У меня нет возможности узнать, какой из них правильный.
2. У меня нет возможности узнать, какой из них правильный.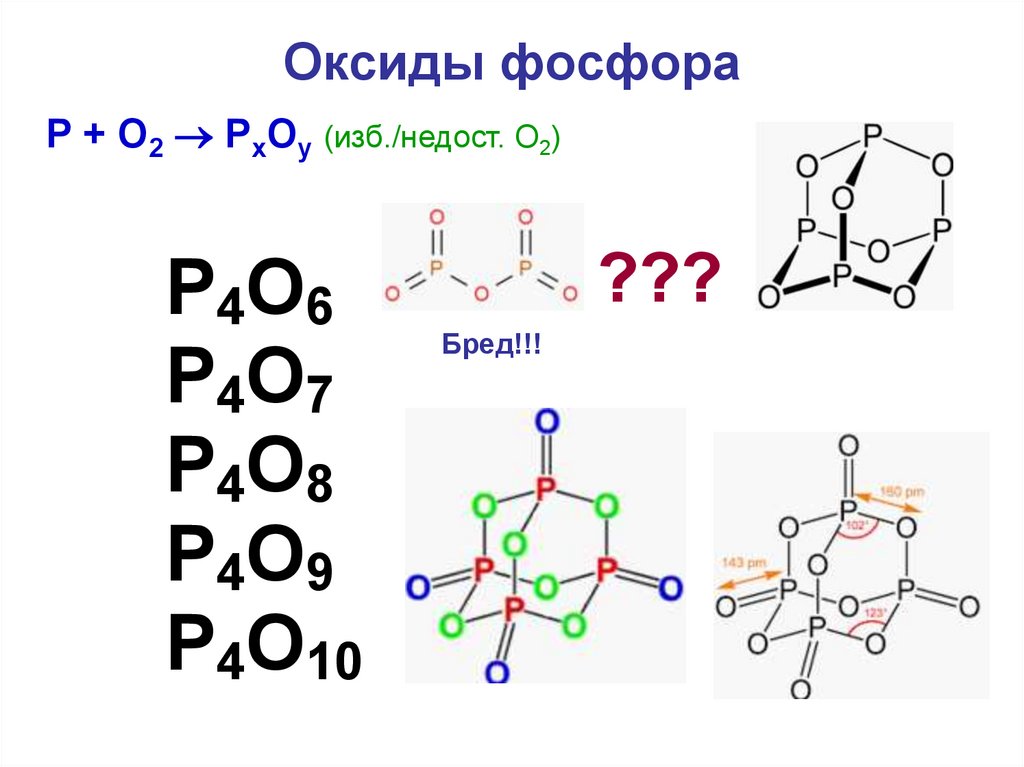 В данном случае мы реагируем с оксидом напрямую с гидроксидом натрия, потому что именно так мы, скорее всего, и поступим.
В данном случае мы реагируем с оксидом напрямую с гидроксидом натрия, потому что именно так мы, скорее всего, и поступим.
 ) + SO 4 2- (водн.)
) + SO 4 2- (водн.)
 ниже) . Вы можете применить те же рассуждения и к другим кислотам на этой странице.
ниже) . Вы можете применить те же рассуждения и к другим кислотам на этой странице.
