Содержание
Молярная масса — что это? Как рассчитать? Формулы и примеры
Что такое моль
Прежде чем говорить о том, как найти молярную массу вещества, определимся с понятием «моль». Его ввели как искусственную величину для упрощения расчетов. Это количество вещества, в котором содержится столько же мельчайших частиц, сколько в 12 г одного из изотопов углерода — C12.
Для всех химических веществ это количество одинаково и представляет собой число Авогадро 6,02 · 1023. Постоянная Авогадро обозначается NA, а измеряется в моль-1.
Число Авогадро — это количество молекул, ионов или других мельчайших частиц в 1 моле вещества.
NA = 6,02 · 1023 моль-1.
Историческая справка
В 1811 году химик Амедео Авогадро предположил, что если взять два равных объема газов в равных значимых условиях (при одинаковой температуре и давлении), то количество молекул в этих объемах тоже будет одинаковым. Опираясь на свою гипотезу, он определил атомные и молекулярные массы многих веществ, а также рассчитал количество атомов в молекулах воды, оксидов азота и т. д. Однако в научных кругах гипотеза Авогадро долго не находила понимания. Общепринятой она стала только в 1860 году.
Опираясь на свою гипотезу, он определил атомные и молекулярные массы многих веществ, а также рассчитал количество атомов в молекулах воды, оксидов азота и т. д. Однако в научных кругах гипотеза Авогадро долго не находила понимания. Общепринятой она стала только в 1860 году.
Практикующий детский психолог Екатерина Мурашова
Бесплатный курс для современных мам и пап от Екатерины Мурашовой. Запишитесь и участвуйте в розыгрыше 8 уроков
Что такое молярная масса
Молярная масса — это масса одного моля вещества, она измеряется в граммах деленных на моль (г/моль). Данная величина представляет собой отношение массы вещества к его количеству, которое измеряется в молях.
Как обозначается молярная масса: М.
, где — это масса вещества, а — количество вещества.
Единица измерения молярной массы: г/моль.
Запоминаем!
Правильно говорить именно молярная, а не мольная масса.
Несмотря на то, что в 1 моле любого химического вещества содержится одинаковое количество молекул (и оно равно числу Авогадро), молярные массы разных веществ отличаются. Все потому, что отличаются атомы, которые входят в состав этих молекул. В частности, разница между ними заключается в относительной атомной массе (Ar) — например, Ar(Mg) = 24, а Ar(Hg) = 200. Сейчас станет ясно, какое это имеет значение.
Как определить молярную массу
Данная величина тесно связана с такими понятиями, как относительные атомная и молекулярная массы. Именно относительные, потому что абсолютную массу молекулы или атома вещества в химии не используют для решения задач — это слишком малые величины.
Относительная атомная масса вещества (Ar) показывает, во сколько раз его атом больше 1/12 атома углерода. Это значение для каждого химического элемента можно увидеть в таблице Менделеева.
Относительная молекулярная масса (Mr) складывается из Ar каждого атома в молекуле вещества с учетом индексов. Она показывает, на сколько масса молекулы больше 1/12 атома углерода.
, где — это количество атомов.
Разберемся на примерах.
В молекуле хлорида натрия NaCl есть 1 атом натрия и 1 атом хлора, при этом Ar(Na) = 23, Ar (Cl) = 35,5.
Mr(NaCl) = 23 + 35,5 = 58,5.
В молекуле NaNO2 есть 1 атом натрия, 1 атом азота и 2 атома кислорода.
Ar(Na) = 23, Ar(N) = 14, Ar(O) = 16.
Mr(NaNO2) = 23 + 14 + 16 · 2 = 69.
Собственно, для вычисления молярной массы больше ничего и не требуется.
Важно
Молярная масса вещества численно равна относительной молекулярной массе. Но путать эти два понятия не стоит — у них разный физический смысл. Молярная масса характеризует 1 моль, а относительная молекулярная — 1 молекулу.
Но путать эти два понятия не стоит — у них разный физический смысл. Молярная масса характеризует 1 моль, а относительная молекулярная — 1 молекулу.
Бесплатные занятия по английскому с носителем
Занимайтесь по 15 минут в день. Осваивайте английскую грамматику и лексику. Сделайте язык частью жизни.
Количество вещества
Из предыдущих формул понятно, что молярная масса и количество вещества тесно связаны. Рассмотрим эту связь подробнее. Начнем с того, что количество вещества может обозначаться как латинской буквой , так и греческой буквой (ню). Международное обозначение — , но не стоит удивляться, встретив в формулах любую из этих букв.
В формуле нахождения молярной массы мы обозначили количество вещества через :
, следовательно .
Пользуясь этим, можно найти количество вещества (в молях), если нам известны его абсолютная и молярная масса.
Пример 1
Как определить, какое количество вещества включают 350 г сульфата бария BaSO4?
Воспользуемся формулой .
Мы помним, что M = Mr (значение молярной массы равно значению относительной молекулярной).
Mr(BaSO4) = Ar(Ba) + Ar(S) + Ar(O) · 4 = 137 + 32 + 16 · 4 = 233.
М(BaSO4) = Mr(BaSO4) = 233 г/моль.
Подставим значение молярной массы в формулу:
моль.
Есть и еще одна формула количества вещества, которая позволяет найти его, если известно число молекул или других структурных единиц.
, где — число структурных единиц, — число Авогадро.
Пример 2
Допустим, некий объем CaCO3 содержит 3,01 · 1023 молекул. Как найти количество вещества, соответствующее данному объему?
Воспользуемся формулой моль.
Молярный объем
Выше мы находили количество вещества через молярную массу, но для газов это можно сделать и через молярный объем. Согласно закону Авогадро количество любого газа, равное 1 моль, будет занимать один и тот же объем, если газы рассматриваются при одинаковой температуре и давлении.
Согласно закону Авогадро количество любого газа, равное 1 моль, будет занимать один и тот же объем, если газы рассматриваются при одинаковой температуре и давлении.
При стандартных физических условиях — температуре 0°С и давлении 1 атм или 760 мм ртутного столба, 1 моль газа занимает объем 22,4 л.
Молярный объем — это объем газа, взятого в количестве 1 моль. Он обозначается Vm.
При нормальных условиях Vm = 22,4 л/моль.
Значения молярного и фактического объема газа помогают найти количество вещества.
, где — фактический объем газа, а — молярный объем.
Пример 1
Сколько молей содержится в 120 литрах газа при нормальных условиях?
Рассчитаем по формуле моль.
Ответ: 120 литров любого газа при стандартных условиях содержат 5,36 моль.
Относительная плотность одного газа по другому
Иногда для решения задачи нужно знать, как найти молярную массу газа, о котором сообщается лишь его плотность по воздуху или по другому газу. Это возможно, если знать формулу относительной плотности, которая обозначается буквой D.
Это возможно, если знать формулу относительной плотности, которая обозначается буквой D.
, где и — некие газы.
Пример 1
Как определить, во сколько раз угарный газ плотнее водорода?
Для начала найдем молярную массу CO и H2:
М(CO) = Mr(CO) = Ar(C) + Ar(O) = 12 + 16 = 28.
М(H) = Mr(H2) = 2 · Ar(H) = 2 · 1 = 2.
.
Ответ: угарный газ в 14 раз плотнее водорода.
Пример 2
Как посчитать молярную массу газа х, о котором известно, что он в 10 раз плотнее углекислого газа CO2?
Подсчитаем для начала молярную массу углекислого газа:
M(CO2) = Mr(CO2) = 12 + 2 · 16 = 44.
Ориентируясь на формулу относительной плотности, произведем расчет молярной массы искомого газа х.
М(х) = D(х/CO2) · M(CO2) = 10 · 44 = 440 г/моль.
Ответ: у данного газа молярная масса 440 г/моль.
Примеры задач
Итак, мы разобрались, как находить молярную массу жидкости, газа или твердого тела и как это понятие связано с количеством вещества, а также с относительной плотностью одного газа по другому. Чтобы закрепить знания, посмотрите, как эти сведения применяются в решении задач.
Задача 1
Известно, что 300 г неустановленного вещества содержат 12,04 · 1023 молекул. Чему равна молярная масса данного вещества?
Дано:
N(х) = 12,04 · 1023.
m(х) = 300 г.
M(х) = ?
Решение:
Найдем количество вещества моль.
Подставим количество вещества в формулу :
г/моль.
Ответ: молярная масса данного вещества 150 г/моль.
Задача 2
Какой объем займет водород в количестве 0,7 моль?
Дано:
моль.
Решение:
По формуле мы можем найти объем .
Зная, что молярный объем при обычных условиях составляет 22,4 л/моль, вычислим фактический объем водорода:
л.
Ответ: объем водорода составляет 15,68 литров.
Задача 3
В порции оксида серы SO3 содержится 8,356 · 1023 атомов кислорода. Какова масса этой порции?
Дано:
N(O) = 8,356 · 1023.
m(SO3) = ?
Решение:
Для решения задачи нам подходит формула , т. е. . Но для начала нужно найти количество вещества.
Мы знаем, что в одной молекуле SO3 есть 3 атома кислорода, исходя из этого можно вычислить количество молекул в порции оксида:
, следовательно .
Зная количество молекул, рассчитаем количество вещества:
моль.
Теперь можно узнать молярную массу SO3:
M(SO3) = 32 + 16 · 3 = 80 г/моль.
Рассчитаем фактическую массу через молярную массу:
г.
Ответ: абсолютная масса порции оксида серы 36,8 грамм.
Задача 4
Как рассчитать молярную массу простого вещества, о котором известно, что в порции 100 г содержится 15,05 · 1023 молекул? Назовите это вещество.
Дано:
m(x) = 100 г.
N(x) = 15,05 · 1023.
М(х) = ?
Решение:
В данном случае поможет вычислить молярную массу NA, с помощью которого мы сначала узнаем количество вещества:
моль.
Исходя из этого, рассчитаем молярную массу:
г/моль.
Ответ: согласно таблице Менделеева можно предположить, что это кальций Ca.
Задача 5
Определите, насколько сероводород H2S плотнее водорода H2?
Решение:
Нам требуется вычислить относительную плотность сероводорода по водороду:
.
Для этого вычислим молярные массы H2S и H2:
М(H2S) = 1 · 2 + 32 = 34 г/моль.
М(H2) = 1 · 2 = 2 г/моль.
Подставим значения в формулу:
.
Ответ: сероводород в 17 раз плотнее водорода.
Вопросы для самопроверки
Что такое число Авогадро и чему оно равно?
В чем измеряется молярная масса?
Напишите формулу молярной массы вещества.

Какая формула связывает количество вещества и его объем?
Как узнать количество вещества, если известно число молекул в порции?
Физика Масса молекул. Количество вещества
Материалы к уроку
Конспект урока
Рассмотрим основные понятия молекулярно-кинетической теории: относительная молекулярная масса, количество вещества, постоянная АвогАдро, молярная масса.
Так как массы молекул очень малы, удобно использовать в расчетах не абсолютные значения масс, а относительные. По международному соглашению массы всех атомов и молекул сравниваются с 1/12 массы атома углерода. Массу частицы, измеренную в а.е.м. (атомная единица массы), принято называть относительной атомной (или молекулярной) массой. Значения относительных атомных масс приведены в периодической системе химических элементов Дмитрия Ивановича Менделеева. Относительная молекулярная масса молекулы вещества равна сумме относительных атомных масс атомов, составляющих данную молекулу. Относительные атомные массы всех химических элементов точно измерены. Относительная молекулярная масса (Mr) – отношение массы молекулы данного вещества к 1/12 массы атома углерода (m0c).
Относительная молекулярная масса молекулы вещества равна сумме относительных атомных масс атомов, составляющих данную молекулу. Относительные атомные массы всех химических элементов точно измерены. Относительная молекулярная масса (Mr) – отношение массы молекулы данного вещества к 1/12 массы атома углерода (m0c).
Складывая относительные массы элементов, входящих в состав молекулы вещества, можно вычислить относительную молекулярную массу вещества. Например, относительная молекулярная масса углекислого газа СО2 приблизительно равна 44, так как относительная атомная масса углерода точно равна 12, а кислорода примерно 16: к 12+2*16=44
Количество вещества – это физическая величина, характеризующая число структурных единиц в теле (атомов в атомарном веществе, молекул – в молекулярном).
Единицей количества вещества в СИ является моль. Один моль равен количеству вещества, в котором содержится столько же атомов или молекул, сколько атомов содержится в чистом углероде массой 0,012 кг. Такое число атомов называется числом Авогадро в честь итальянского ученого.
Такое число атомов называется числом Авогадро в честь итальянского ученого.
Для определения постоянной Авогадро надо найти массу одного атома углерода. Постоянную Авогадро можно определить, если разделить массу углерода, взятого в количестве одного моля на массу атома углерода:
Количество вещества равно отношению числа частиц в теле (атомов – в атомарном веществе, молекул – в молекулярном) к числу молекул в одном моле вещества, т.е. к числу Авогадро.
Если два разных тела состоят из одного и того же числа частиц (хотя и разных), то эти тела содержат одинаковое количество вещества (при этом массы тел могут не совпадать). Слева атомы углерода, справа атомы водорода.
Молярная масса M равна массе вещества, взятого в количестве один моль. Единица молярной массы – кг/моль.
Молярные массы веществ, молекулы которых состоят из одного атома, приведены в Периодической системе Д.И.Менделеева.
Например, информация в клетке с углеродом, помимо порядкового номера 6 углерода в Периодической системе, задает его молярную массу в г/моль 12,011. Молярная масса углерода в СИ равна 0,012 кг/моль. Для веществ, молекулы которых состоят из двух атомов (например, О2), молярная масса составит удвоенную цифру, взятую из Периодической системы.
Молярная масса углерода в СИ равна 0,012 кг/моль. Для веществ, молекулы которых состоят из двух атомов (например, О2), молярная масса составит удвоенную цифру, взятую из Периодической системы.
Для молекул более сложного состава при расчете учитывается число атомов всех химических элементов в молекуле.
Если массу одной молекулы вещества обозначить через m0 (эм нулевое), то молярную массу можно трактовать как массу постоянной Авогадро (Nа) молекул. Масса любого количества вещества равна произведению массы одной молекулы на число молекул в теле. Заменив постоянное Авогадро и число молекул в теле их выражениями, получим, что количество вещества равно отношению массы вещества к его молярной массе.
Масса молекулы может быть рассчитана на основе молярной массы и числа Авогадро.
Масса одного атома водорода, например, составляет 1,67·10-27 кг, молекулы водорода Н2 в 2 раза больше, масса атома углерода в 12 раз, а молекулы кислорода в 32 раза больше массы атома водорода.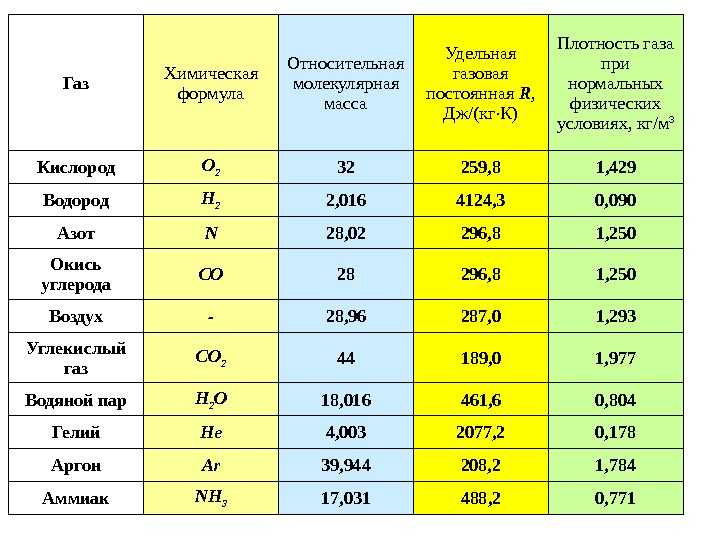
Размер молекулы a может быть оценен как размер кубика, в котором содержится одна молекула, исходя из плотности твердых или жидких веществ и массы одной молекулы.
Для воды диаметр а = 3·10-10 м. Для газов, в которых молекулы разделены друг от друга зазором, как показано на рисунке, такая оценка дает среднее расстояние между молекулами.
Часто при решении той или иной задачи важнее знать не число частиц вещества, а их концентрацию. Концентрация (n) показывает, сколько частиц содержится в единице объема (чаще всего — в одном кубическом метре) данного вещества.
Рассмотрим задачи.
Определим молярную массу воды.
Решение. В молекуле воды Н2О 2 атома водорода и 1 атом кислорода. Атомная масса водорода = 1, а кислорода – 16. Следовательно молекулярная масса воды равна 2* 1 + 16 = 18 атомных единиц массы, а молярная масса воды =0,018 кг/моль.
Какое количество вещества содержится в воде массой 200 г?
Для решения задачи переведем массу в систему СИ. Запишем формулу для определения количества вещества.
Запишем формулу для определения количества вещества.
Чтобы иметь возможность воспользоваться ей, надо найти молярную массу воды.
Теперь подставим наши результаты в исходную формулу и получим ответ.
В воде массой 200 г содержится 11,1 моль вещества.
Остались вопросы по теме? Наши репетиторы готовы помочь!
Подготовим к ЕГЭ, ОГЭ и другим экзаменам
Найдём слабые места по предмету и разберём ошибки
Повысим успеваемость по школьным предметам
Поможем подготовиться к поступлению в любой ВУЗ
Выбрать репетитора
Молекулярная масса вещества
Молекулярная масса вещества, также называемая молярной массой , M, представляет собой массу 1 моля этого вещества, выраженную в M граммах.
В системе СИ единицей измерения М является [кг/кмоль], в английской системе единицей измерения является [фунт/фунтмоль], а в системе СГ единицей измерения М является [г/моль]. Молекулярная масса представлена одним и тем же числом во всех системах единиц независимо от используемой системы. По этой причине во многих случаях единица молекулярной массы не упоминается; однако следует понимать, что это не безразмерный параметр.
Молекулярная масса представлена одним и тем же числом во всех системах единиц независимо от используемой системы. По этой причине во многих случаях единица молекулярной массы не упоминается; однако следует понимать, что это не безразмерный параметр.
Молекулярная масса чистого соединения определяется по его химической формуле и атомным массам его элементов. Атомные массы элементов, обнаруженных в органических веществах: C = 12,011, H = 1,008, S = 32,065, O = 15,999 и N = 14,007.
Пример: Молекулярная масса этанола (C 2 H 5 OH)
Для расчета молекулярной массы этанола суммируется молекулярная масса каждого атома в молекуле:
M этанол = 2*12,011[кг/кмоль] + 6*1,008[кг/кмоль] + 1*15,999 [кг/кмоль] = 46,069 [кг/кмоль]
См. также Физические данные для углеводородов, Физические данные для спиртов и карбоновых кислот кислоты, Физические данные для органических соединений азота и Физические данные для органических соединений серы
 038
0380 9003
050 286
286
9180031
2.
050
 178
178 189
1891 0031
 097
097Средняя масса одной молекулы
ChemTeam: средняя масса одной молекулы
Преобразование молей
Расчет средней массы одной молекулы
При расчете средней массы одной молекулы выполните следующие действия:
- Рассчитать молярную массу вещества
- Разделите на число Авогадро
Кстати, методика расчета средней массы одного атома элемента точно такая же, как и для расчета средней массы одной молекулы соединения.
Также обратите внимание, что я продолжаю использовать слово «средний». Поскольку каждый элемент в соединении имеет несколько изотопов, моль соединения (скажем, H 2 O) состоит из молекул немного разного веса. Например, водород имеет два стабильных изотопа, а кислород — три. Это приводит к девяти различным возможным комбинациям изотопов.
Поскольку нет практического способа отделить все разные веса, мы в конечном итоге измеряем средний вес одной молекулы, а это означает, что вес ни одной отдельной молекулы не рассчитан. (Этот конкретный факт часто подвергается проверке.)
Пример №1: Какова средняя масса одной молекулы H 2 O?
1) Рассчитайте молярную массу.
Молярная масса воды 18,015 г/моль. Это было рассчитано путем умножения атомного веса водорода (1,008) на два и добавления результата к весу одного кислорода (15,999).
Пожалуйста, помните, что вам сначала нужна молярная масса, когда вы пытаетесь найти среднюю массу одной молекулы.
2) Разделить молярную массу вещества на число Авогадро.
18,015 г/моль ––––––––––––––– = 2,992 x 10¯ 23 г 6,022 x 10 23 моль¯ 1
3) Обратите внимание, что окончательный ответ был округлен до четырех значащих цифр (от 2,9915 — обратите внимание на округление по правилу пяти). Также обратите внимание, что единица моль отменяется.
Пример #2: Рассчитайте среднюю массу (в граммах) одной молекулы CH 3 COOH (молярная масса = 60,0516 г/моль)
молярная масса —> 60,0516 г/моль ––––––––––––––– = 9,972 x 10¯ 23 г Номер Авогадро —> 6,022 x 10 23 моль¯ 1
Пример №3: Определите среднюю массу в граммах одного атома золота (молярная масса = 196,666 г/моль).
196,666 г/моль ––––––––––––––– = 3,266 x 10¯ 23 г 6,022 x 10 23 моль¯ 1 Кстати, более старое название молярной массы элемента — грамм-атомный вес. Э-э, это тот, который Химическая Группа выучила еще тогда, когда он был всего лишь ростком.
Пример №4: Определите массу (в граммах) атома золота-198.
Обратите внимание, что этот вопрос касается одного конкретного изотопа. Для этого мы должны найти грамм-атомный вес для этого одного изотопа (часто называемый изотопной массой), а не молярную массу (также называемую средней атомной массой) золота (значение, которое мы использовали в примере № 3).
В Википедии есть таблица с массами всех изотопов золота.
Значение золота-198 составляет 197,968 г/моль. Поставлена проблема:
197,968 г/моль ––––––––––––––– = 3,287 x 10¯ 23 г 6,022 x 10 23 моль¯ 1 Обратите внимание, что это не среднее значение. Это фактическая масса каждого атома золота-198.
Пример №5: Рассчитайте массу одного атома серебра:
Серебро имеет два стабильных изотопа, поэтому его молярная масса представляет собой средневзвешенное значение этих двух значений. Это означает, что то, что рассчитывается в видео, на самом деле является средней массой одного атома серебра.
Это означает, что то, что рассчитывается в видео, на самом деле является средней массой одного атома серебра.
Вы должны знать об этом, потому что у вас может быть инструктор, который акцентирует внимание на среднем аспекте вычислений, в то время как другие могут полностью его игнорировать.
Пример #6: Определите массу 125 атомов палладия.
Решение:
Выполнено в стиле размерного анализа.
106,42 г 1 моль 125 атомов ––––––– х ––––––––––––––– х –––––––– = 2,21 x 10¯ 20 г 1 моль 6,022 x 10 23 атомов 1
Пример №7: Определите массу одной молекулы U 235 F 6
.
Решение:
1) Обратите внимание, что требуется масса конкретного изотопа. Для этого идем в интернет и ищем:
235,0439 г/моль
2) Есть еще один необычный аспект этой проблемы:
В природе присутствует только один стабильный изотоп фтора. Другими словами, 100% всех атомов фтора в природе весят одинаково:
18,9984 г/моль
Кстати, у самого долгоживущего нестабильного изотопа фтора период полураспада чуть меньше 110 минут. В химическом смысле его нет в природе!
3) Рассчитайте молярную массу U 235 F 6 :
349,0343 г/моль
4) Рассчитайте фактическую массу одной молекулы U 235 F 6 :
349,0343 г/моль / 6,022 x 10 23 молекул/моль = 5,796 x 10¯ 22
5) Почему я должен говорить фактическую массу, а не среднюю массу? Это связано с тем, что фтор в природе имеет только один изотоп, а уран (который в природе имеет два изотопа) ограничен только одним конкретным изотопа.
Пример #8: Можете ли вы плавать в миллиарде миллиардов (1,00 x 10 18 ) молекул воды?
Решение:
Лучший способ определить, сможете ли вы плавать в таком количестве воды, — это определить массу присутствующей воды. Я сделаю это в стиле размерного анализа.
1 моль 18,015 г 1,00 x 10 18 молекул х ––––––––––––––––––– х –––––––– = 0,0000299 г 6,022 x 10 23 молекул 1 моль Нет, в таком количестве воды нельзя плавать.



 В Википедии есть таблица с массами всех изотопов золота.
В Википедии есть таблица с массами всех изотопов золота.