Содержание
Оксид графена поможет опреснять воду солнечным светом
Ученые из Китая создали эффективное масштабируемое устройство для опреснения морской воды на основе оксида графена, работающее от солнечной энергии. О своем изобретении исследователи сообщают в журнале Proceedings of the National Academy of Sciences.
Опреснение за счет солнечной энергии без дополнительных затрат могло бы решить проблему дефицита питьевой воды в регионах с плохо развитой инфраструктурой. Однако до сих пор не было изготовлено прототипов, которые можно было бы превратить в опреснитель, способный с достаточной эффективностью без дополнительной поддержки производить питьевую воду из морской.
Для создания такого устройства необходимо, чтобы, с одной стороны, эффективно поглощалась энергия, а с другой стороны, нагрев был локализован и испарение происходило без дополнительного теплоотвода и потерь. Несмотря на большие успехи в области разработки поглотителей солнечного излучения, во всех существовавших ранее решениях поглотители контактировали с объемом воды. При такой конфигурации поглощенное тепло передавалось всему ее объему и расходовалось неэффективно. Устранить этот недостаток можно было только за счет ограничения объема воды, что делало все решения не применимыми в реальных условиях.
При такой конфигурации поглощенное тепло передавалось всему ее объему и расходовалось неэффективно. Устранить этот недостаток можно было только за счет ограничения объема воды, что делало все решения не применимыми в реальных условиях.
Авторы нового исследования разработали конструкцию, которая представляет собой таблетку теплоизолятора (пенополистерола), обернутую целлюлозой и накрытую пластинкой оксида графена. За счет капиллярных сил вода втягивается в целлюлозу и подается к поглотителю солнечной энергии (пластинке оксида графена). Из-за того, что сам нагреватель отделен от общего объема воды теплоизолятором, потери тепла минимизируются. Исследователи проверяли различные характеристики устройства, такие как распределение температуры в процессе работы, эффективность нагрева и «потери массы» (испарение), и провели опреснение контрольных образцов морской воды.
В результате КПД нового устройства держится на уровне примерно 80 процентов даже при увеличении объема воды, температура воды в объеме повышается незначительно, и нагрев преимущественно локализован на поверхности оксида графена. Даже при долгом облучении такой опреснитель обеспечивает линейную зависимость количества произведенного пара от времени. Во всех случаях после использования устройства соленость опресненной воды оказывалась ниже стандарта, принятого для питьевой воды (200 миллиграмм на литр).
Даже при долгом облучении такой опреснитель обеспечивает линейную зависимость количества произведенного пара от времени. Во всех случаях после использования устройства соленость опресненной воды оказывалась ниже стандарта, принятого для питьевой воды (200 миллиграмм на литр).
Оксид графена был выбран в качестве поглощающего материала не случайно.
Он недорогой, легко масштабируемый, эффективно поглощает солнечную
энергию во всем спектре. Пористая структура обеспечивает эффективную
подачу воды и отвод пара. К тому же материал легко складывается и
раскладывается много раз, что важно, например, при транспортировке
устройства. Таким образом, предложенное авторами исследования устройство может
обеспечивать необходимый выход пресной воды при адекватных затратах на
производство и транспортировку.
Ученые активно исследуют необычные свойства оксида графена: выяснилось, например, что на оксидных пленках можно рисовать токопроводящие схемы, а с помощью инфракрасного света листы оксида графена можно научить шагать.
Екатерина Жданова
Нашли опечатку? Выделите фрагмент и нажмите Ctrl+Enter.
Оксид водорода – вода. 9-й класс
Оксид водорода – вода. 9-й класс
- Илларионова Алла Алексеевна
Разделы:
Химия, Конкурс «Презентация к уроку»
Класс:
9
Презентация к уроку
Загрузить презентацию (2 МБ)
(Слайд 1)
Цели:
- рассмотреть нахождение воды в природе, её роль;
- повторить, углубить знания учащихся о составе,
физических и химических
(окислительно-восстановительных) свойствах воды; - сформировать умения предсказывать
окислительно-восстановительные свойства
вещества, опираясь на его состав.
Оборудование: модель молекулы воды,
мультимедийная презентация, реактивы,
химическая посуда.
ХОД УРОКА
Учитель:
1. Казалось бы, что может быть проще, чем вода?
Оказывается, всем нам известная вода имеет такие
необычные свойства, что её с полным правом можно
назвать чудом природы В конце урока вы должны
объяснить смысл слов академика Карпинского,
которые взяты эпиграфом. (Слайд 1)
2. Художники запечатлили это вещесто на своих
полотнах, поэты воспели в стихах. (Слайд 2) А мы
посмотрим на это вещество глазами химика.
3. Общее содержание воды на Земле составляет 1500
млн. куб. км. Всё живое и неживое содержит воду. В
организме человека 60-70% воды от массы тела. За 60
лет жизни человек перекачивает через себя более
50 т воды. (Слайд 3)
4. После обсуждения вопроса о роли воды на Земле,
учащиеся записывают в тетради тезисы. (Слайд 4)
(Слайд 4)
5. Учитель просит учащихся охарактеризовать
качественный и количественный состав молекулы
воды, тип связи. Затем рассказывает учащимся о
пространственном строениимолекулы воды. (Слайд 5)
6. Среди необозримого множества веществ вода
занимает совершенно особое место. Благодаря
строению её молекулы, почти все физико-
химические свойства воды являются аномальными.
(Слайд 6)
7. Учитель рассказывает об окислительных
свойствах воды (Слайд 7), демонстрирует
взаимодействие натрия с водой, один из учащихся
записывает реакцию на доске, составляет
электронный баланс.
8. Рассматриваются восстановительные свойства
воды. (Слайд 8)
9. Учитель задаёт вопрос классу: «С какими
оксидами реагирует вода?» После обсуждения,
учитель демонстрирует взаимодействие воды с
оксидом кальция. Учащиеся записывают уравнения
реакций соединения. (Слайд 9)
10. Учащиеся дают ответ на вопрос, поставленный в
начале урока. Если позволит время,проводится
Если позволит время,проводится
закрепление. (Слайд 10)
Реакция воды с оксидами металлов открывает двери для исследователей
8 августа 2014 г.
Скотт Гордон
Многопрофильная группа ученых решила давно остававшийся без ответа вопрос о том, как взаимодействуют два самых распространенных вещества в мире.
В статье, недавно опубликованной в журнале Nature Communications, Манос Маврикакис, профессор химической и биологической инженерии Университета Висконсин-Мэдисон, и его сотрудники сообщают о фундаментальных открытиях о том, как вода реагирует с оксидами металлов. Документ открывает двери для более глубокого понимания и управления химическими реакциями в различных областях, от катализа до геохимии и химии атмосферы.
Манос Маврикакис
«Эти оксиды металлов повсюду, и вода повсюду», — говорит Маврикакис. «Было бы неплохо увидеть, как нечто столь распространенное, как вода, взаимодействует с материалами, которые ускоряют химические реакции».
«Было бы неплохо увидеть, как нечто столь распространенное, как вода, взаимодействует с материалами, которые ускоряют химические реакции».
Эти реакции играют огромную роль в катализируемом создании общих химических платформ, таких как метанол, который производится порядка 10 миллионов тонн в год в качестве сырья для производства химикатов и для использования в качестве топлива. «Девяносто процентов всех каталитических процессов используют оксиды металлов в качестве носителя», — говорит Маврикакис. «Поэтому на все реакции, включая воду в качестве примеси, реагента или продукта, будут влиять полученные знания».
Химики понимают, как вода взаимодействует со многими неоксидными металлами, которые очень гомогенны. С оксидами металлов дело обстоит сложнее: иногда отсутствует атом кислорода, что вызывает то, что Маврикакис называет «кислородными дефектами». Когда вода встречается с одним из этих дефектов, она образует два соседних гидроксила — стабильное соединение, состоящее из одного атома кислорода и одного атома водорода.
Маврикакис, научный сотрудник Говэн Пэн и доктор философии. Студентка Кэрри Фарбероу вместе с исследователями из Орхусского университета в Дании и Лундского университета в Швеции исследовала, как гидроксилы влияют на молекулы воды вокруг них и чем это отличается от молекул воды, контактирующих с нетронутой поверхностью оксида металла.
Исследователи из Орхуса получили данные о реакциях с помощью сканирующей туннельной микроскопии (СТМ). Затем исследователи из Висконсина подвергли изображения СТМ квантово-механическому анализу, который расшифровал полученные химические структуры и определил, какой атом есть какой. «Если у вас нет того компонента работы, который мы предоставили, вы не сможете сказать только с помощью СТМ, какова атомная структура воды при поглощении ее различными поверхностями», — говорит Маврикакис.
Следующий шаг Маврикакиса — изучить, как эти различные структуры реагируют с другими молекулами, и использовать результаты исследования для улучшения катализа. Он видит много возможностей за пределами своей области.
Он видит много возможностей за пределами своей области.
В ходе проекта были получены две совершенно разные картины реакций оксидов воды и металлов.
«На гладкой поверхности образуются аморфные сети молекул воды, тогда как на гидроксилированной поверхности есть гораздо более структурированные, хорошо упорядоченные домены молекул воды», — говорит Маврикакис.
В последнем случае исследователи поняли, что гидроксил ведет себя как своего рода якорь, устанавливая шаблон для аккуратного гексамерного кольца молекул воды, притягивающихся к поверхности металла.
Следующим шагом Маврикакиса является изучение того, как эти разные структуры реагируют с другими молекулами, и использование результатов исследования для улучшения катализа. Он видит много возможностей за пределами своей области.
«Возможно, другие вдохновятся и рассмотрят последствия геохимии или химии атмосферы, например, как эти кластерные структуры воды на наночастицах атмосферной пыли могут влиять на образование облаков, дождь и кислотный дождь», — говорит Маврикакис.
Другие исследователи могли бы также изучить, проявляют ли другие молекулы подобное поведение, когда они вступают в контакт с оксидами металлов, добавляет он.
«Это достижения в методах, которые позволяют рождать эту новую информацию».
Манос Маврикакис
«Это открывает двери для использования водородных связей для придания поверхностям гидрофильности или притяжения к воде, а также для (шаблона) этих поверхностей для избирательного поглощения других молекул, обладающих фундаментальным сходством с водой», — говорит Маврикакис. «Поскольку катализ лежит в основе инженерных химических реакций, он также очень важен для инженерных химических реакций атомного масштаба».
Хотя исследования составляют часть фундамента химии, они также во многом обязаны современным исследовательским технологиям.
«Масштаб и характер вычислений, которые нам приходилось делать, вероятно, были невозможны до четырех или пяти лет назад, а пространственное и временное разрешение сканирующей туннельной микроскопии отсутствовало», — говорит Маврикакис.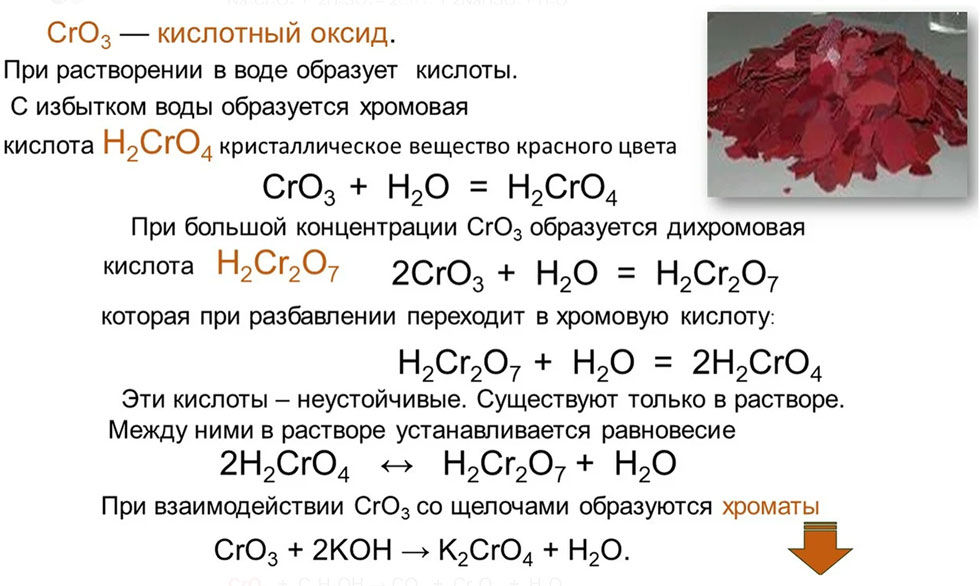 «Таким образом, именно достижения в методах позволяют рождать эту новую информацию».
«Таким образом, именно достижения в методах позволяют рождать эту новую информацию».
Финансирование Министерства энергетики США, Управления фундаментальных энергетических наук и Управления научных исследований ВВС США поддержало исследование UW. Соавторами статьи являются Линдсей Р. Мерте из Орхуса и Лунда, а также исследователи из Орхуса Ральф Бехштейн, Феликс Райбольдт, Хелен Цойтен, Ян Кнудсен, Эрик Лаэгсгаард, Стефан Вендт и Флемминг Безенбахер.
Читайте больше новостей от Инженерного колледжа
Реакции элементов периода 3 и их оксидов
Содержание
Третий период периодической таблицы представляет интересную химию в форме элементов и их оксидов, которые подвергаются множеству реакций. Давайте узнаем больше о реакциях элементов периода 3 и их оксидов!
Период 3 Периодической таблицы
Таблица — 1
Группа 1 | Группа 2 | Группа 3-12 | Группа 13 | Группа 14 | Группа 15 | Группа 16 | Группа 17 | Группа 18 | |
| Период 3 | 11 На 22,99 | 12 Мг 24. | 13 Ал 26,98 | 14 Си 28.09 | 15 Р 30,97 | 16 С 32.07 | 17 Кл 35,45 | 18 Ар 39,95 | |
| Электроотрицательность: | 0,9 | 1,2 | 1,5 | 1,8 | 2.1 | 2,5 | 3,0 | / | |
| Разница в электроотрицательности | 2,6 | 2,3 | 2,0 | 1,7 | 1,4 | 1,0 | 0,5 | / |
Тенденция электроотрицательности → → → → → высокий Тип связи в оксидах можно определить, оценив разницу в электроотрицательности между кислородом и элементом. Электроотрицательность кислорода 3,5. Электроотрицательность элементов периода 3 (с использованием шкалы электроотрицательности атомов Полинга) и различия в электроотрицательности каждого элемента и кислорода показаны в таблице 1.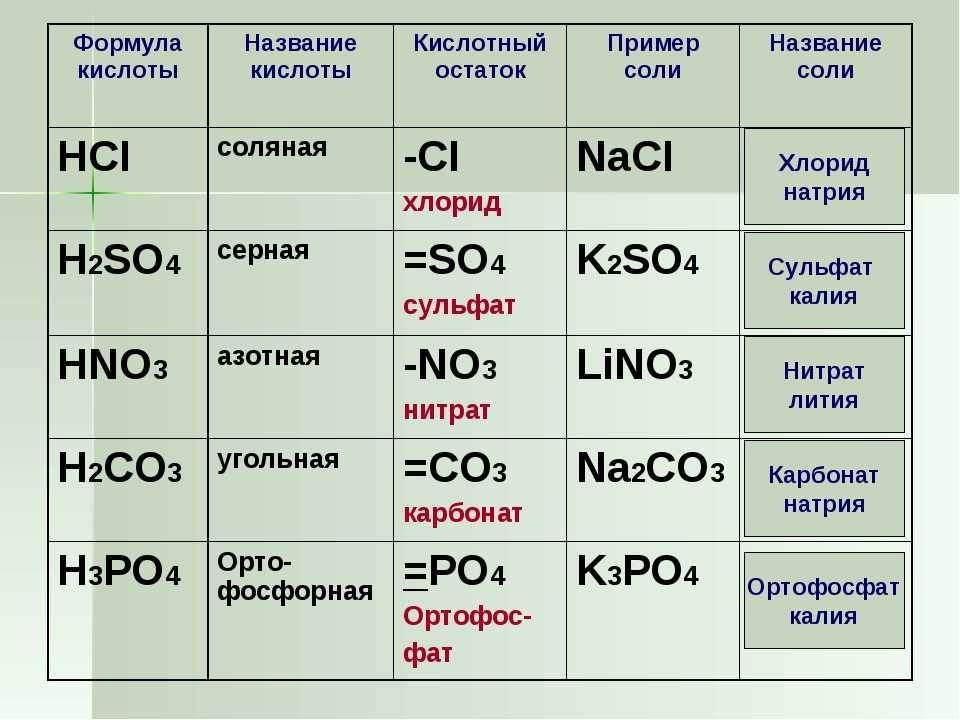
В течение периода, когда мы идем слева направо, то есть от Na к Ar, электроотрицательность увеличивается из-за увеличения количества зарядов на ядре.
В оксидах кислород притягивает к себе электроны гораздо сильнее, чем металлы (Na, Mg и Al), поэтому атом кислорода оттягивает электроны от атома металла, в результате чего образуются два иона: анион кислорода, O 2- ; катион металла, Na + , Mg 2+ , Al 3+ и ионные связи. Это твердые оксиды, и силы электростатического притяжения удерживают ионы кислорода и металлов в организованных трехмерных структурах, решетках.
Оксиды металлов состоят из гигантских структур с сильным притяжением между ионами. Для разрушения этих притяжений требуется много тепловой энергии, поэтому эти оксиды твердые и имеют высокие температуры плавления.
Другие элементы 3-го периода: Si, P, S и Cl больше похожи на кислород по электроотрицательности, поэтому электроны, образующие связь между атомами, больше разделяются, чем притягиваются одним из них. Таким образом, эти элементы образуют ковалентный тип связи в своих оксидах.
Таким образом, эти элементы образуют ковалентный тип связи в своих оксидах.
SiO 2 образует твердую трехмерную сеть, называемую кремнеземом, подобную по структуре алмазу. Кремнезем очень твердый при комнатной температуре с высокой температурой плавления.
Оксиды фосфора P 4 O 10 a сера SO 2 и SO 3 и хлор представляют собой небольшие дискретные ковалентные молекулы. Некоторые из этих молекул являются индивидуальными, а некоторые являются полимерными. Между этими молекулами действуют межмолекулярные силы типа Ван-дер-Ваальсовых дисперсионных сил или диполь-дипольных взаимодействий, и они определяют низкую температуру плавления такого рода оксидов, значительно более низкую, чем у оксидов металлов.
При взаимодействии элементов с кислородом образуются продукты – оксиды.
Оксиды всех элементов периода 3, кроме Cl и Ar, могут быть получены одним и тем же методом: сжиганием элемента в воздухе в реакции горения, когда элемент будет реагировать с кислородом воздуха с образованием оксида элемента. Ar является благородным газом и не образует оксидов, а Cl образует оксиды (Cl 2 O, ClO 2 , Cl 2 O 7 ), которые нестабильны и не могут быть получены таким способом.
Ar является благородным газом и не образует оксидов, а Cl образует оксиды (Cl 2 O, ClO 2 , Cl 2 O 7 ), которые нестабильны и не могут быть получены таким способом.
Рассматривая Период 3 Периодической таблицы слева направо, мы можем прийти к некоторым выводам:
- Характер связи в оксидах элементов Периода 3 меняется с ионной на ковалентную связь.
- Оксиды образуют ионную решетку от ковалентной сети до ковалентных молекул.
- Оксиды элементов периода 3 от основных до амфотерных и кислых.
Вода хотя и очень слабый окислитель, очень легко и быстро окисляет натрий. Полученный раствор сильно щелочной и имеет рН 14:9.0003
2Na (s) + 2H 2 O → 2Na + + 2OH — + H 2(g)
Магний медленно и экзотермически реагирует с горячей водой с холодной водой, но очень экзотермически Дается оксид:
мг (S) + H 2 O (G) → MGO (S) + H 2 (G)
Реакции из Oxidation Art: 8958995559
. Реакции Oxidation: 898955999559
Реакции Oxidation: 898955999559
. Натрий 4Na + O 2 → 2Na 2 O 6 Reaction of Periodic 3 oxides with water will be following: Гидроксиды этого металла: NaOH и Mg(OH) 2 — обе базы. P 4 O 10(s) + 6 H 2 O (l) → 4H 3 PO4 (l) SO 2 (G) + H 2 O (L) → H 2 SO 3 (L) SO 3 3 (S) + H 9023 2 2 2 2 2 2 2  ) + 2OH — (водн.)
) + 2OH — (водн.)4
3 3 (S) + H 333 2 2 2 2
2 3 3 3 (S) 2 2 2 2323 23 2 2 2
3 3 (S) ) → H 2 SO 4(l)
Таким образом, растворы оксидов металлов в воде проявляют свойства оснований, а водные растворы оксидов неметаллов проявляют свойства кислот.
Реакция оксидов 3-го периода с кислотами и основаниями и их основные, амфотерные и кислотные свойства
Общая тенденция изменения кислотности в оксидах элементов 3-го периода по периоду слева направо (группа 1) справа (группа 17):
основные оксиды (группа 1, 2) → амфотерный оксид (Al 2 O 3 ) → кислые оксиды (оксикислоты)
Такая же тенденция наблюдается в каждом периоде Периодической таблица и имеем:
Основания реагируют с кислотами, такими как HCl:
- Оксид натрия реагирует с разбавленной соляной кислотой с образованием соли и воды:
NA 2 O (S) + 2HCl (AQ) → 2NACL (AQ) + H 2 O (L) 2 O (L) 2 O (L) 9000 3
- 949494949494949494949494949494949494949494949494949494949494949494949494949н. и вода.
MgO (т) + 2HCl (водн. ) → MgCl 2 (водн.) + H 2 O (l)
) → MgCl 2 (водн.) + H 2 O (l)
- Реакция взаимодействия оксида алюминия и горячей разбавленной соляной кислоты с образованием хлорида алюминия и воды.
Al 2 O 3 + 6HCl (водн.) → 2AlCl 3 + 3H 2 O (l)
9000s также реагирует с оксидами алюминия. При добавлении концентрированного раствора гидроксида натрия к оксиду алюминия образуются комплексные ионы, такие как ион тетрагидроксоалюмината:
Al 2 O 3(s) + 2NaOH(водн.) +3H 2 O (ж) →2NaAl(OH) 4(водн.)
В этой реакции Al 2 O 3 действует как кислота.
Заключение: Al 2 O 3 имеет амфотерный характер.
- Диоксид кремния, оксид металлоида химически очень инертен и слабокислотный. Он реагирует с горячим концентрированным гидроксидом натрия с образованием силиката натрия и воды.

SiO 2(т) + 2NaOH (л) → Na 2 SiO 3(ж) + H 2 O (ж)
водный раствор гидроксида натрия в качестве основания. Оксиды фосфора реагируют с водой с образованием кислот, как мы видели, и эти кислоты могут реагировать с гидроксидом натрия в реакции нейтрализации.
- Тогда имеем:
H 3 PO 3(водн.) + 3NaOH (водн.) →Na 3 PO 3 (AQ) + 3H 2 O (L)
H 3 PO 4 (AQ) + 3NAOH (AQ) 4244 (AQ) + 3NAOH (AQ) 2424424424242222223.922223.
233223 292223 2
223 2
223 2
2223 (AQ) + 3NAOH (AQ) 4242424242223.12223 2
4 + 3NAOH (AQ . ) + 3H 2 O (l)
- Диоксид серы реагирует с водным раствором гидроксида натрия с образованием соли (натрия
сульфит) и вода. Триоксид серы бурно реагирует с водой с образованием серной кислоты, которая вступает в реакцию с гидроксидом натрия с образованием соли.
Триоксид серы бурно реагирует с водой с образованием серной кислоты, которая вступает в реакцию с гидроксидом натрия с образованием соли.
SO 2(g) + 2NaOH (aq) →Na 2 SO 3(aq) + H 2 O (l)
H 2 SO 4(aq ) + 2NAOH (aq) → NA 2 SO4 (AQ) + H 2 O (L)
Запрошенные вопросы о атомальных символах — Современный период
. Сколько элементов содержится в третьем периоде периодической таблицы?
В третьем периоде периодической таблицы восемь элементов. Его называют нормальным или коротким периодом. Эти элементы включают в себя; натрий, магний, алюминий, кремний, фосфор, хлор и аргон (благородный газ).
Что такое электроотрицательность?
Электроотрицательность — это сила элемента, с которой он может притягивать общую пару электронов в ковалентной связи. Электроотрицательность уменьшается сверху вниз в группе и увеличивается слева направо в периоде.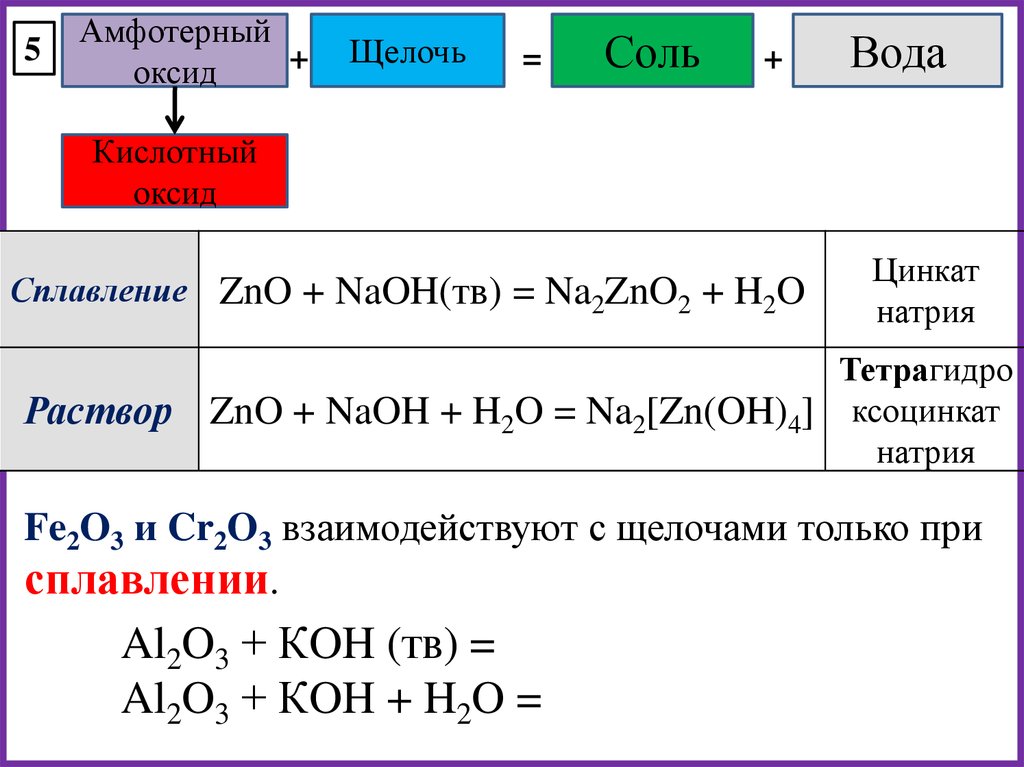


 31
31