Содержание
Элементы жизни. Вода — Рамблер/новости
Из чего состоят живые тела и при чем тут углерод? Что такое генетический код, кто такие вирусы, как устроено эволюционное древо и почему произошел кембрийский взрыв? Книга Сергея Ястребова «От атомов к древу: Введение в современную науку о жизни», вышедшая в издательстве «Альпина нон-фикшн» дает актуальные ответы на эти и многие другие вопросы. Публикуем главу из книги.
Фото: ИндикаторИндикатор
Что такое вода?
Видео дня
Вода — одно из самых распространенных веществ на планете Земля. Она покрывает две трети земной поверхности,и ее очень много в живых организмах — гораздо больше, чем любого другого вещества. Подавляющее большинство биохимических реакций, то есть превращений жизненно важных молекул друг в друга, идет в растворах, где вода является растворителем. Воды много и в космосе — например, в кометах, в недрах Урана и Нептуна или в межзвездных туманностях. В целом можно сказать, что вода — это одно из самых распространенных веществ не только на Земле, но и вообще во Вселенной. Иное дело, что далеко не на всех планетах она встречается в жидком виде (Земля — единственная планета Солнечной системы, на поверхности которой есть постоянно существующие водоемы). Так или иначе, неудивительно, что именно вода послужила средой для всем нам знакомой жизни.
Иное дело, что далеко не на всех планетах она встречается в жидком виде (Земля — единственная планета Солнечной системы, на поверхности которой есть постоянно существующие водоемы). Так или иначе, неудивительно, что именно вода послужила средой для всем нам знакомой жизни.
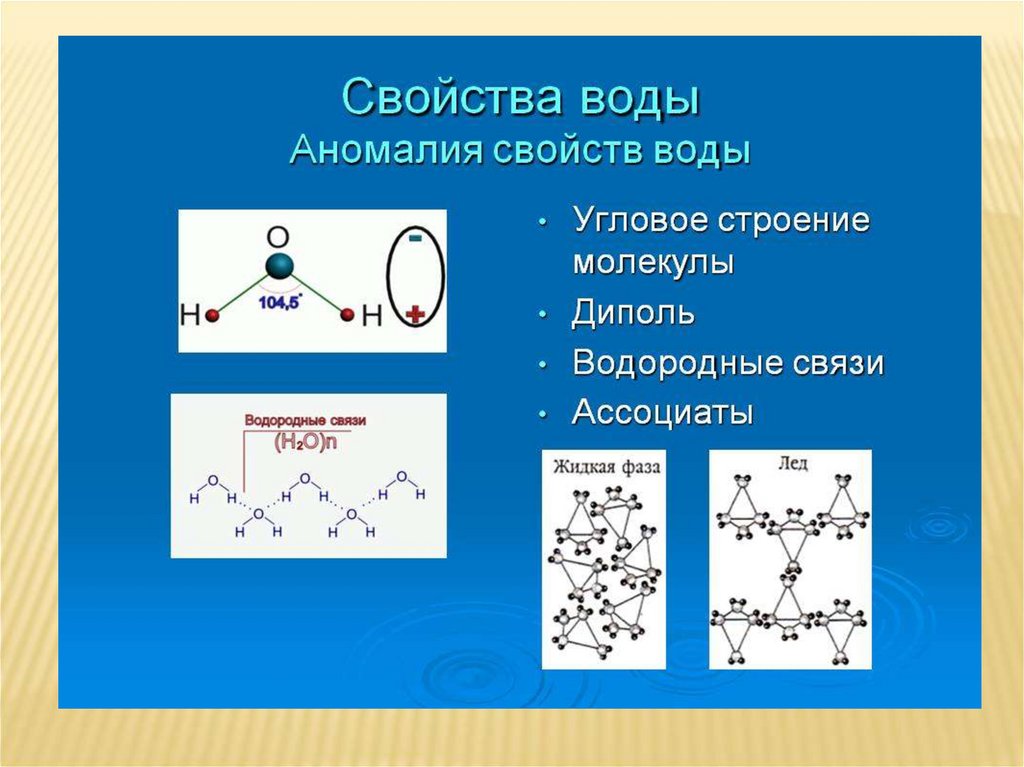
Что же такое вода с точки зрения химии? Это весьма простая молекула, состоящая всего лишь из двух атомов водорода (H) и одного атома кислорода (O). Соответственно, химическая формула воды — h3O. Каждый атом водорода соединен с атомом кислорода одной ковалентной связью, в полном соответствии с валентностью кислорода, которая (как мы помним) равна двум. Формулу воды можно записать и так: H–O–H. Это эквивалентно формуле 2 которую обычно приводят в книгах.
Многие свойства воды объясняются тем, что ее молекулы исключительно хорошо «слипаются» друг с другом. Например, на поверхности водоема они образуют пленку, по которой клопы-водомерки, отнюдь не микроскопические существа, бегают как посуху. Другие особенности воды как вещества — прекрасная теплопроводность и высокая температура кипения (на испарение литра воды надо потратить больше энергии, чем на испарение того же объема чуть ли не любой другой жидкости). Чтобы понять, почему вода именно такова, надо присмотреться к ее молекулам повнимательнее.
Чтобы понять, почему вода именно такова, надо присмотреться к ее молекулам повнимательнее.
Водородная связь
Начнем вот с чего. В общей химии часто встречается понятие «электроотрицательность», введенное когда-то Лайнусом Полингом. Электроотрицательность — это сила, с которой атом в составе молекулы оттягивает на себя общие с другим атомом электроны, образующие ковалентную связь. Самый электроотрицательный элемент — фтор (F), а сразу за ним на шкале электроотрицательности следует кислород (O). Иначе говоря, кислород превосходит по электроотрицательности все другие атомы, за исключением фтора, который в живой природе встречается очень редко. Запомним этот факт, он нам пригодится.
Электроотрицательность одинаковых атомов по определению равна. Если между двумя одинаковыми атомами есть ковалентная связь, то образующая ее пара электронов никуда не смещается. Грубо говоря, эти электроны располагаются между атомами точно посредине. Такая ковалентная связь называется неполярной. Само собой разумеется, что любая ковалентная связь между одинаковыми атомами будет неполярна (например, связь в молекуле водорода H–H или углерод-углеродная связь C–C).
Само собой разумеется, что любая ковалентная связь между одинаковыми атомами будет неполярна (например, связь в молекуле водорода H–H или углерод-углеродная связь C–C).
Если же ковалентную связь образуют два разных атома, то общие электроны смещаются к тому из них, у которого электроотрицательность выше. Такая связь называется полярной (см. рис. 1 и 2). При очень большой разнице в электроотрицательности связь может даже превратиться в ионную — это случится, если один атом полностью «отберет» общую пару электронов у другого. В молекулах, из которых состоят живые существа, ионные связи встречаются относительно редко, зато ковалентные полярные — очень часто. Например, это широко распространенные в органических веществах связи C–O и H–O.
Связь между водородом и кислородом в молекуле воды — это типичная ковалентная полярная связь. Электроотрицательность кислорода намного выше, поэтому общие лектроны смещены к нему. В результате на атоме кислорода образуется маленький отрицательный заряд, а на атомах одорода — маленькие положительные заряды.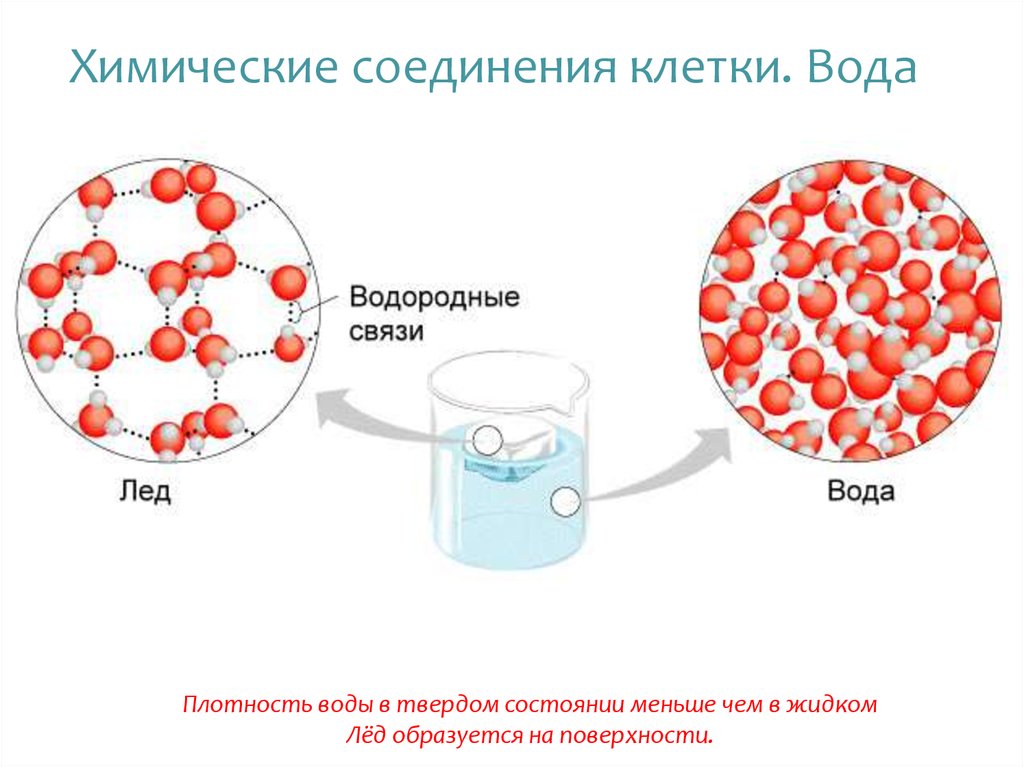 На графических формулах эти маленькие заряды, величина которых начительно меньше единицы, принято обозначать буквой «дельта» с добавлением соответствующего знака. Как мы еперь знаем, связи кислорода с водородом или углеродом ообще всегда полярные. Молекулы, в которых много таких связей, несут многочисленные частичные заряды, отрицательные на кислороде и положительные на водороде или углероде.
На графических формулах эти маленькие заряды, величина которых начительно меньше единицы, принято обозначать буквой «дельта» с добавлением соответствующего знака. Как мы еперь знаем, связи кислорода с водородом или углеродом ообще всегда полярные. Молекулы, в которых много таких связей, несут многочисленные частичные заряды, отрицательные на кислороде и положительные на водороде или углероде.
А вот связь между углеродом и водородом (C–H) считается неполярной, хоть атомы и разные. И это тоже очень важно. Между атомами углерода и водорода разница в электроотрицательности настолько мала, что смещение электронов там незаметно. Например, молекулы углеводородов, состоящие только из атомов C и H, в силу этого полностью неполярны, никаких частичных зарядов, которые хоть на что-то влияли бы, в них нет.
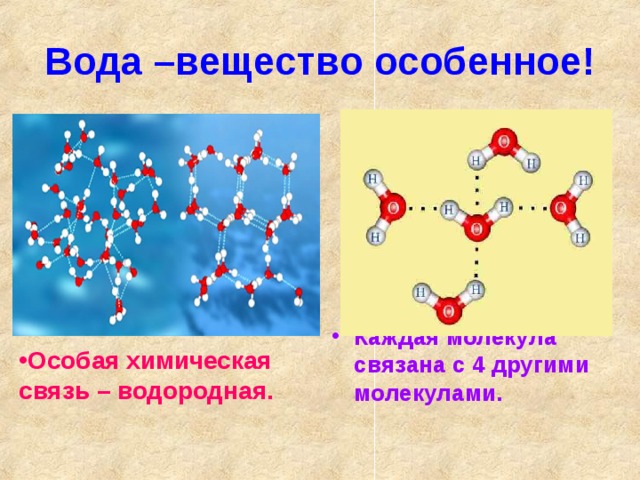
Теперь вспомним, что положительные и отрицательные электрические заряды согласно закону Кулона притягиваются друг к другу. Например, частично отрицательный атом кислорода одной молекулы воды притягивается частично положительными атомами водорода других молекул воды. В результате между водородом и кислородом возникают нековалентные связи, основанные на электростатическом притяжении, — они называются водородными
В результате между водородом и кислородом возникают нековалентные связи, основанные на электростатическом притяжении, — они называются водородными
Это очень слабые связи, в жидкой воде они легко образуются и так же легко рвутся при движениях молекул. Но, несмотря на то что водородные связи гораздо слабее ковалентных, они дают сильный эффект, если их много.
А в воде их очень много. Например, именно из-за колоссального количества водородных связей у воды исключительно высокая теплоемкость — ее трудно нагреть и трудно остудить. Большинство особенностей воды так или иначе связано с тем, что ее молекулы очень хорошо образуют водородные связи.
«Водородная связь чем-то напоминает любовь втроем», — писал в своем известном университетском учебнике американский биохимик Люберт Страйер. Он имел в виду, что в водородной связи атом водорода связан сразу с двумя атомами кислорода: с одним ковалентно (и прочно), а с другим электростатически (и слабо). Чтобы образовать водородную связь, атом водорода обязательно должен уже состоять в ковалентной связи с другим атомом, причем значительно отличающимся от него по электроотрицательности.
Водородные связи важны не только с точки зрения свойств воды. Они много где встречаются. Например, в главе 9 мы увидим, что без водородных связей невозможно представить себе структуру молекулы ДНК, от которой зависит хранение наследственной информации.
Любовь и ненависть воды
Любое вещество, растворенное в воде, так или иначе взаимодействует с ней, и способ этого взаимодействия зависит, прежде всего, от электрических свойств молекул. Например, если растворить в воде поваренную соль (NaCl), она распадется на положительно заряженные ионы натрия (Na+) и отрицательно заряженные ионы хлора (Cl–). При этом к ионам натрия молекулы воды “прилипнут» своими атомами кислорода (несущими маленький отрицательный заряд δ–), а к ионам хлора — атомами водорода (несущими маленький положительный заряд δ+). В результате и те и другие ионы получат оболочку, состоящую из молекул воды (см. рис. 3). Образование таких оболочек называется гидратацией. Ионы натрия и хлора находятся в воде в гидратированном состоянии. Гидратация — процесс, сопутствующий растворению в воде любого вещества (если оно вообще в ней растворимо, конечно).
Гидратация — процесс, сопутствующий растворению в воде любого вещества (если оно вообще в ней растворимо, конечно).
Молекулы, в которых много ковалентных полярных связей, тоже прекрасно взаимодействуют с водой — в первую очередь потому, что образуют с ней водородные связи, «цепляясь» за молекулы воды своими частичными зарядами. Такие вещества хорошо растворяются в воде и называются гидрофильными («любящими воду»). К гидрофильным веществам относятся, например, спирты и углеводы (см. главу 1). Каждый знает, что столовый сахар (а это типичный углевод) растворяется в воде очень хорошо. То же самое можно сказать и о спиртах, например об этиловом спирте — основе алкогольных напитков. Именно растворам спирта в воде была посвящена знаменитая диссертация Дмитрия Ивановича Менделеева.
Правда,рецепта водки Менделеев, вопреки распространенной легенде, не разрабатывал. Его интересовало происходящее при растворении взаимодействие молекул спирта и воды — тот самый процесс, который мы только что назвали гидратацией.
Менделеев убедительно показал, что растворение — это не физическое явление (простое смешивание), а химическое (включающее образование новых межмолекулярных связей). Тогда получается, что раствор — это, по сути, новое вещество.
Как правило, любое наугад взятое органическое соединение будет растворяться в воде тем лучше, чем больше в нем атомов кислорода. Это понятно: именно вокруг атомов кисло- рода обычно образуются водородные связи. Например, молекула глюкозы (C6h22O6, шесть атомов кислорода!) в этом отношении просто идеальна. Как раз поэтому сахара, и глюкозу в том числе, очень удобно использовать в роли быстро усваивающихся питательных веществ.
Молекулы, в которых все связи неполярные, взаимодействуют с водой гораздо слабее, чем друг с другом. Вещества, состоящие из таких молекул, плохо растворяются в воде и называются гидрофобными («боящимися воды»). Типичные гидрофобные соединения — углеводороды. Как мы знаем, они по определению состоят только из углерода и водорода, связи между которыми неполярны.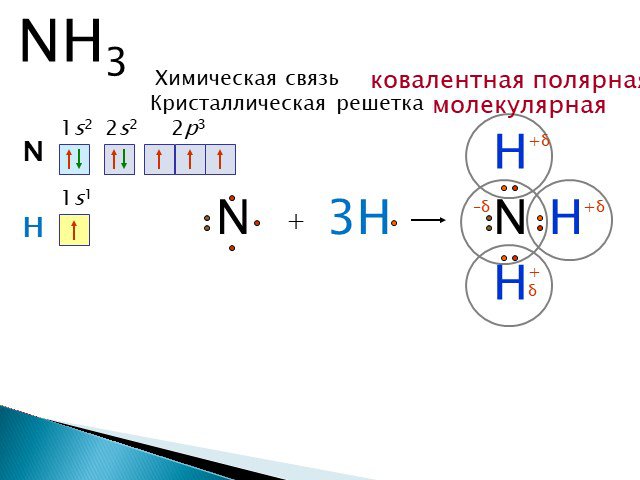 Если бросить в воду парафин (смесь твердых углеводородов, из которой делают свечи), он и не подумает там растворяться — ни при каких условиях.
Если бросить в воду парафин (смесь твердых углеводородов, из которой делают свечи), он и не подумает там растворяться — ни при каких условиях.
А если налить в воду бензин (смесь жидких углеводородов, которая служит моторным топливом), то он, скорее всего, отслоится от нее, образовав четкую поверхность раздела. Вода как бы «выталкивает» эти вещества.
Если в формуле органического соединения есть кислород, то оно, скорее всего, гидрофильное, разве что там присутствует какая-нибудь совсем уж огромная углеводородная цепочка.
Гидрофильными бывают и некоторые бескислородные органические вещества — например, амины. В биохимии значение различий между гидрофильными и гидрофобными веществами без преувеличения грандиозно (см. главы 3, 5, 6). Многие детали устройства клеток без учета этих различий просто невозможно понять. А все потому, что земная жизнь — водная.
Талассогены
А могут ли подойти для жизни какие-нибудь другие растворители, кроме воды? Ответ — да. Например, углекислота (ее формула O=C=O, или просто CO2) знакома людям, прежде всего, в виде углекислого газа, который мы выдыхаем. Но она может и замерзать, образуя так называемый сухой лед. Проблема в том, что при нагревании в условиях, характерных для Земли, сухой лед сразу испаряется в газ, минуя жидкую фазу. Потому мы и не видим в быту жидкой углекислоты. Однако при более высоких давлениях, чем наше атмосферное, углекислота может становиться жидкостью. И тогда она представляет собой хороший гидрофильный растворитель, аналогичный по свойствам воде (и легко смешивающийся с ней), в котором успешно идут многие биохимические реакции.
Но она может и замерзать, образуя так называемый сухой лед. Проблема в том, что при нагревании в условиях, характерных для Земли, сухой лед сразу испаряется в газ, минуя жидкую фазу. Потому мы и не видим в быту жидкой углекислоты. Однако при более высоких давлениях, чем наше атмосферное, углекислота может становиться жидкостью. И тогда она представляет собой хороший гидрофильный растворитель, аналогичный по свойствам воде (и легко смешивающийся с ней), в котором успешно идут многие биохимические реакции.
В этом растворителе могут жить даже земные микробы: например, на дне Окинавского желоба в Восточно-Китайском море исследователи-океанологи нашли целое озеро жидкой углекислоты, в котором постоянно живут довольно разнообразные бактерии.
Некоторые исследователи считают, что океаны жидкой углекислоты могут существовать на так называемых «суперземлях» — планетах с массой, в несколько раз превосходящей массу Земли. Суперземли — довольно многочисленная категория экзопланет, и возможность жизни на них сейчас активно обсуждается.
Другой перспективный кандидат на роль вмещающей среды для жизни — аммиак (Nh4). Это гидрофильный растворитель, образующий много водородных связей, в данном случае между водородом и азотом (их разница в электроотрицательности для этого вполне достаточна, см. рис. 2). Неудивительно, что по своим физико-химическим свойствам аммиак напоминает воду. На более холодных планетах, чем Земля, он находится в жидком состоянии и вполне может быть основой жизни. Теоретически возможно существование холодных землеподобных планет с аммиачными океанами. Есть ли там жизнь, никто не знает. Но почему бы и нет? Если насчет альтернатив углеродной жизни есть серьезные сомнения (см. главу 1), то углеродную жизнь, использующую не воду, а какой-нибудь другой растворитель, представить себе гораздо легче. Никакие фундаментальные законы не запрещают ей существовать.
Просто так уж сложилось, что на нашей планете из всех растворителей преобладает вода — ну а от добра добра не ищут, и земной жизни осталось лишь развиваться в этих относительно благоприятных условиях.
Еще один гидрофильный растворитель, в котором теоретически допускают возможность жизни, — метиловый спирт,или метанол (Ch4OH). Для человека это страшный яд, но тут все зависит от настройки биохимических систем: вообще-то никакие законы природы не мешают «сконструировать» живой организм, для которого метанол будет совершенно безобиден, а то и полезен. Метанол — одно из самых простых органических веществ, и неудивительно, что образуется он очень легко. Его много в космосе, причем не только на планетах, но и в межзвездных газопылевых облаках. Некоторые ученые осмеливаются предполагать, что именно синтез метанола был ключевым химическим звеном на пути к возникновению земной жизни. Метанол очень гидрофилен и прекрасно образует водородные связи, примерно такие же, как в воде. Собственно, это и делает его хорошим гидрофильным растворителем. Как и аммиак, метанол замерзает при гораздо более низкой температуре, чем вода, и в принципе может быть средой для жизни на более холодных планетах, чем Зем- ля.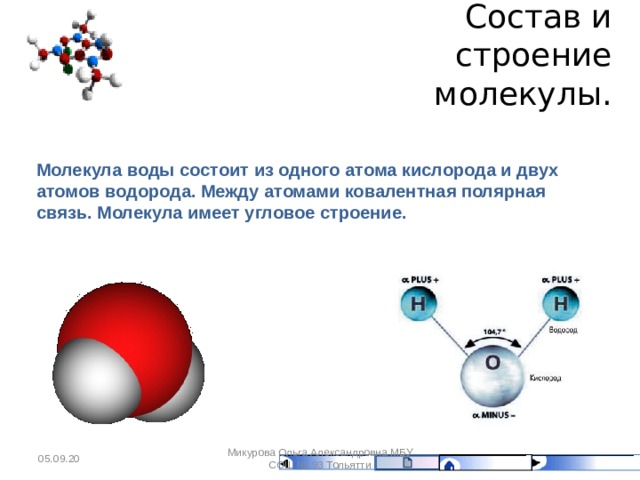 В Солнечной системе метанола хватает, например на Тритоне, крупнейшем спутнике Нептуна.
В Солнечной системе метанола хватает, например на Тритоне, крупнейшем спутнике Нептуна.
Наконец, еще один кандидат на роль подходящего для жизни гидрофильного растворителя — сероводород, соединение водорода и серы с формулой h3S (она же H–S–H). Молекула сероводорода очень похожа на молекулу воды. Правда, водородные связи она образует несколько хуже. В Солнечной системе сероводорода много на Ио — спутнике Юпитера, который отличается невероятной геологической активностью. Поверхность Ио покрыта вулканами, выбрасывающими фонтаны лавы, а состоит эта лава в основном из разнообразных соединений серы, которые текут и застывают, ибо в системе Юпитера очень холодно. Ио — это настоящий «мир льда и пламени”.
Если бы на Ио была жизнь, она вполне могла бы быть основана на сероводороде, точно так же, как земная жизнь — на воде.
А может ли среда для жизни оказаться не гидрофильной, а гидрофобной? Исключить такое в принципе нельзя. Например, на крупнейшем спутнике Сатурна — Титане — есть угле- водородные озера и даже моря, состоящие из метана (Ch5),этана (C2H6) и пропана (C3H8). Это настоящий гидрофобный растворитель, в котором некоторые ученые допускают существование жизни, хотя прямых подтверждений этому пока что нет. Жидкой воды на поверхности Титана не бывает, там слишком холодно.
Это настоящий гидрофобный растворитель, в котором некоторые ученые допускают существование жизни, хотя прямых подтверждений этому пока что нет. Жидкой воды на поверхности Титана не бывает, там слишком холодно.
В целом, однако, сейчас кажется более вероятным, что главный растворитель для внеземной жизни окажется гидрофильным (но не обязательно водой). Во-первых, гидрофильных растворителей в природе просто больше. А во-вторых, все известные биохимические механизмы слишком уж сильно «заточены» под гидрофильную среду. Биохимию на гидрофобной основе вообразить гораздо труднее.
Из совсем уж экзотических альтернатив воде можно назвать, к примеру, фтороводород (HF, «аш-фтор»). Водный раствор фтороводорода — очень агрессивное вещество, которое называется плавиковой кислотой (в сериале «Во все тяжкие», главный герой которого — химик, ставший преступником, этой кислотой растворяют трупы). Однако многие органические молекулы, например углеводороды, в ней совершенно стабильны. К тому же фтороводород прекрасно образует водородные связи, а это, как мы уже знаем, очень важное для растворителя свойство. Возможность фтороводородной жизни допускали некоторые ученые, например астроном Карл Саган. А в фантастической повести Ивана Ефремова «Сердце Змеи” описана планета с фтороводородным океаном и дышащими фтором разумными жителями, с которыми земляне вступают в контакт. «Люди Земли увидели лиловые волны океана из фтористого водорода, омывавшие берега черных песков, красных утесов и склонов иззубренных гор, светящихся голубым лунным сиянием…»
Возможность фтороводородной жизни допускали некоторые ученые, например астроном Карл Саган. А в фантастической повести Ивана Ефремова «Сердце Змеи” описана планета с фтороводородным океаном и дышащими фтором разумными жителями, с которыми земляне вступают в контакт. «Люди Земли увидели лиловые волны океана из фтористого водорода, омывавшие берега черных песков, красных утесов и склонов иззубренных гор, светящихся голубым лунным сиянием…»
Великий популяризатор науки Айзек Азимов — кстати говоря, биохимик по научной специальности — не раз задумывался над тем, из каких веществ могли бы образоваться океаны на других планетах. Он назвал такие вещества термином «талассогены», что буквально значит «производящие море». По определению Азимова, талассоген — это вещество, способное сформировать планетарный океан. В замечательной книге «Асимметрия жизни» Азимов подробно разбирает проблему океанов, приходя к выводу, что самые вероятные талассогены — это вода, аммиак и метан. При этом для планет, расположенных примерно на таком расстоянии от звезд, как Земля, вода имеет преимущество, потому что она остается жидкой при более высокой температуре. «Вы можете представить метановые океаны на такой планете, как Нептун, или аммиачные океаны на планете типа Юпитера, однако вода, и только вода может создать океан на внутренней планете вроде Земли». Это выглядит логичным, но тут есть по меньшей мере один важный нюанс. Азимов писал эту книгу больше 40 лет назад, когда о планетах других звездных систем не было известно совершенно ничего. Не было даже уверенности, что они вообще существуют. А сейчас астрономам известны тысячи экзопланет, и уже ясно, что, мягко говоря, далеко не все звездные системы похожи на Солнечную. Сочетания условий там могут быть совершенно другими. Поэтому от расширения списка возможных вариантов вреда, скорее всего, не будет.
«Вы можете представить метановые океаны на такой планете, как Нептун, или аммиачные океаны на планете типа Юпитера, однако вода, и только вода может создать океан на внутренней планете вроде Земли». Это выглядит логичным, но тут есть по меньшей мере один важный нюанс. Азимов писал эту книгу больше 40 лет назад, когда о планетах других звездных систем не было известно совершенно ничего. Не было даже уверенности, что они вообще существуют. А сейчас астрономам известны тысячи экзопланет, и уже ясно, что, мягко говоря, далеко не все звездные системы похожи на Солнечную. Сочетания условий там могут быть совершенно другими. Поэтому от расширения списка возможных вариантов вреда, скорее всего, не будет.
Возвращаясь к земной (а вернее, водной) биохимии, будем иметь в виду, что она — не единственная теоретически возможная. Изучая природу, всегда полезно помнить люби- мую мысль Станислава Лема: «Среди звезд нас ждет Неизвестное».
Понравился материал? Добавьте Indicator.Ru в «Мои источники» Яндекс. Новостей и читайте нас чаще.
Новостей и читайте нас чаще.
Подписывайтесь на Indicator.Ru в соцсетях: Facebook, ВКонтакте, Twitter, Telegram, Одноклассники.
Водородная связь | CHEMEGE.RU
Рассмотрим взаимодействия, возникающие между отдельными молекулами в веществе — межмолекулярные взаимодействия. Межмолекулярные взаимодействия — это такой вид взаимодействия между нейтральными атомами, при котором не образуются новые ковалентные связи. Силы взаимодействия между молекулами обнаружены Ван-дер Ваальсом в 1869 году, и названы в честь него Ван-дар-Ваальсовыми силами. Силы Ван-дер-Ваальса делятся на ориентационные, индукционные и дисперсионные. Энергия межмолекулярных взаимодействий намного меньше энергии химической связи.
Ориентационные силы притяжения возникают между полярными молекулами (диполь-диполь взаимодействие). Эти силы возникают между полярными молекулами. Индукционные взаимодействия — это взаимодействие между полярной молекулой и неполярной.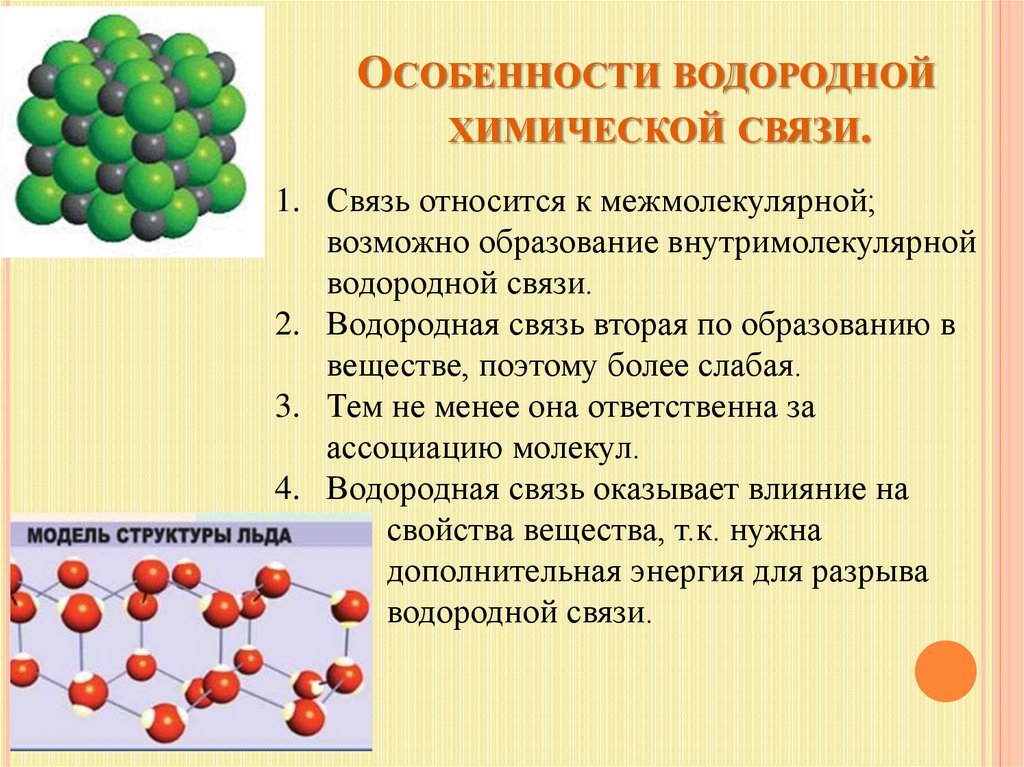 Неполярная молекула поляризуется из-за действия полярной, что и порождает дополнительное электростатическое притяжение.
Неполярная молекула поляризуется из-за действия полярной, что и порождает дополнительное электростатическое притяжение.
Особый вид межмолекулярного взаимодействия — водородные связи.
Водородные связи — это межмолекулярные (или внутримолекулярные) химические связи, возникающие между молекулами, в которых есть сильно полярные ковалентные связи — H-F, H-O или H-N. Если в молекуле есть такие связи, то между молекулами будут возникать дополнительные силы притяжения.
Механизм образования водородной связи частично электростатический, а частично — донорно–акцепторный. При этом донором электронной пары выступают атом сильно электроотрицательного элемента (F, O, N), а акцептором — атомы водорода, соединенные с этими атомами. Для водородной связи характерны направленность в пространстве и насыщаемость.
Водородную связь можно обозначать точками: Н ··· O.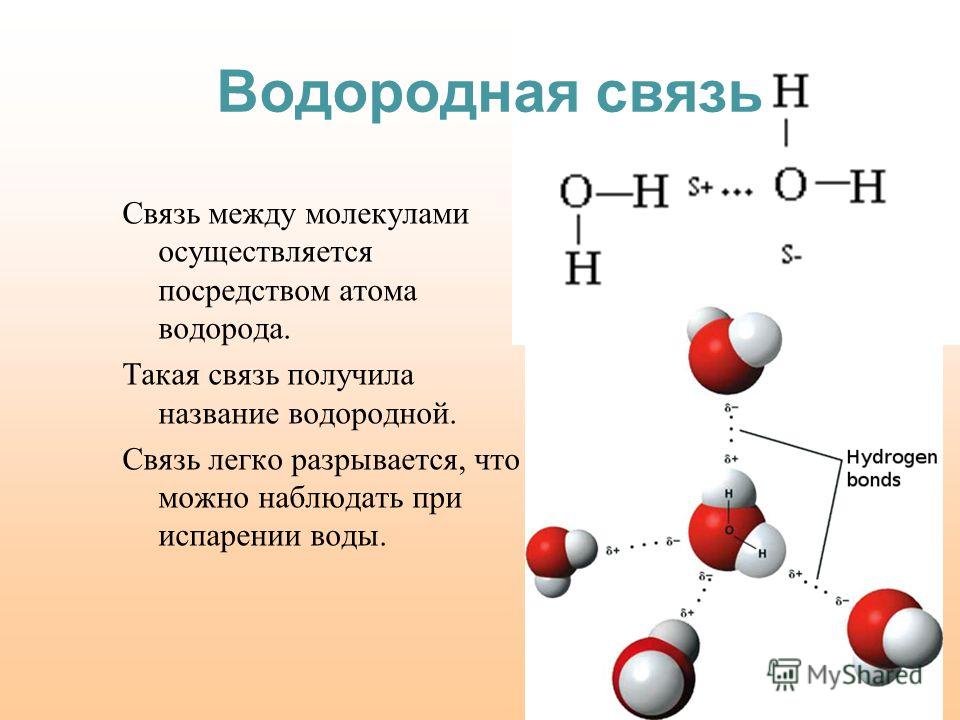 Чем больше электроотрицательность атома, соединенного с водородом, и чем меньше его размеры, тем крепче водородная связь. Она характерна прежде всего для соединений фтора с водородом, а также кислорода с водородом, в меньшей степени азота с водородом.
Чем больше электроотрицательность атома, соединенного с водородом, и чем меньше его размеры, тем крепче водородная связь. Она характерна прежде всего для соединений фтора с водородом, а также кислорода с водородом, в меньшей степени азота с водородом.
Водородные связи возникают между следующими веществами:
- фтороводород HF (газ, раствор фтороводорода в воде — плавиковая кислота),
- вода H2O (пар, лед, жидкая вода):
- раствор аммиака и органических аминов — между молекулами аммиака и воды;
- органические соединения, в которых есть связи O-H или N-H: спирты, карбоновые кислоты, амины, аминокислоты, фенолы, анилин и его производные, белки, растворы углеводов — моносахаридов и дисахаридов.
Водородная связь оказывает влияние на физические и химические свойства веществ. Так, дополнительное притяжение между молекулами затрудняет кипение веществ. У веществ с водородными связями наблюдается аномальное повышение тепературы кипения.
Так, дополнительное притяжение между молекулами затрудняет кипение веществ. У веществ с водородными связями наблюдается аномальное повышение тепературы кипения.
Например, как правило, при повышении молекулярной массы наблюдается повышение температуры кипения веществ. Однако в ряду веществ H2O-H2S-H2Se-H2Te мы не наблюдаем линейное изменение температур кипения.
А именно, у воды температура кипения аномально высокая — не меньше -61оС, как показывает нам прямая линия, а намного больше, +100 оС. Эта аномалия объясняется наличием водородных связей между молекулами воды. Следовательно, при обычных условиях (0-20оС) вода является жидкостью.
Понравилось это:
Нравится Загрузка…
Понимание решающей связи между водой и энергией
Энергия, вода
Ряд выдающихся ученых-водников и активистов, в том числе Питер Глейк из Тихоокеанского института и Упману Лалл из Колумбийского водного центра, уже некоторое время обращали внимание на решающую связь между глобальными водными и энергетическими проблемами.
Но в то время как осведомленность о взаимосвязи воды и энергии растет, во многих частях мира политика, касающаяся как энергии, так и воды, в лучшем случае остается недальновидной, а в худшем — опасно контрпродуктивной.
Вот некоторые из множества способов тесной взаимосвязи использования воды и энергии, что это означает для глобального движения за устойчивое развитие и что можно сделать.
То, как мы используем воду, требует энергии.
В Соединенных Штатах около 4 процентов производства электроэнергии используется для водоснабжения и очистки, согласно отчету Sandia National Laboratories Конгрессу; на нагрев горячей воды для бытовых нужд приходится около 9 процентов бытового потребления энергии.
Однако количество энергии, которое идет на использование воды, значительно варьируется от региона к региону. В Калифорнии, например, на перемещение, очистку и подогрев воды приходится 19 процентов потребления электроэнергии в штате и 30 процентов природного газа. Южная Калифорния, в частности, перекачивает значительное количество воды с больших расстояний, чтобы удовлетворить местные потребности в воде.
Южная Калифорния, в частности, перекачивает значительное количество воды с больших расстояний, чтобы удовлетворить местные потребности в воде.
Учитывая как возникающие ограничения на глобальное производство энергии, так и климатический стресс, вызванный сжиганием ископаемого топлива, имеет смысл экономить воду и делать все возможное, чтобы снизить интенсивность использования воды.
Протестующие у австралийского завода по опреснению воды. Источник: Takver на Flickr.
К сожалению, многие предлагаемые решения острого дефицита воды по всему миру на самом деле гораздо более энергоемки, чем то, что мы делаем в настоящее время. Например, правительства от Калифорнии до Израиля и Саудовской Аравии обращаются к масштабным проектам по опреснению воды как к святому Граалю для решения постоянных проблем с водой. Но, как указывалось в отчете Калифорнийской комиссии по коммунальным предприятиям за 2007 год, «производство пресной воды из морской воды путем опреснения является очень энергоемким процессом, и его следует использовать только тогда, когда нет других экономичных источников воды».
По данным комиссии, остров Каталина, расположенный у побережья Южной Калифорнии, производит 25 процентов своей пресной воды за счет опреснения, но на это же самое опреснение приходится почти почти 70 процентов энергопотребления острова.
Другие высокоэнергетические решения включают откачку воды из отдаленных мест. Управление водоснабжения Южной Невады, например, планирует построить трубопровод протяженностью 285 миль, чтобы перекачивать воду в выжженный Лас-Вегас, город в пустыне, страдающий от засухи, который получает большую часть воды из быстро тонущих резервуаров, питаемых рекой Колорадо. Перекачка воды на большие расстояния чрезвычайно энергозатратна.
Традиционное производство энергии в решающей степени зависит от обильных запасов пресной воды.
Термоэлектрическое использование воды — по сути, кипячение воды для вращения турбин для выработки электроэнергии или использование воды для охлаждения энергетического оборудования — составляет ошеломляющую половину общего водозабора в Соединенных Штатах.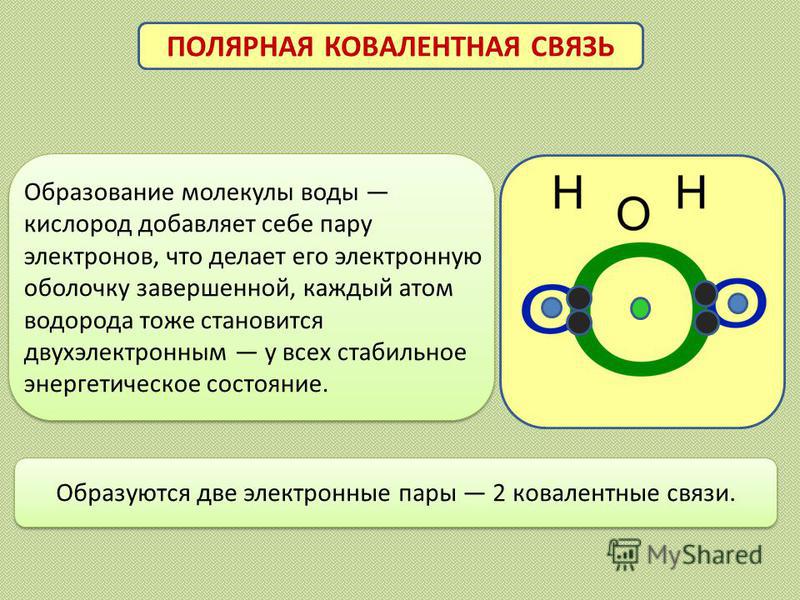 Подавляющее большинство выработки электроэнергии происходит от этих паровых турбин, независимо от того, используют ли они уголь, природный газ, нефть или ядерное топливо для нагрева воды.
Подавляющее большинство выработки электроэнергии происходит от этих паровых турбин, независимо от того, используют ли они уголь, природный газ, нефть или ядерное топливо для нагрева воды.
После использования электростанции выпускают всю воду, которая не была потеряна в результате испарения, обратно в окружающую среду — при гораздо более высокой температуре, практика, которая может нанести серьезный ущерб экосистемам водных путей.
Атомная теплоэлектростанция. Источник: Викимедиа.
Но это не единственная проблема. Оказывается, чрезвычайная водоемкость термоэлектрического производства означает, что потребность в воде может легко столкнуться с потребностью в энергии в ближайшие годы. В 2009 годуВ статье для Колумбийского журнала экологического права Бенджамин К. Совакул и Келли Э. Совакул сделали доводы в пользу того, что конвергенция роста населения, повышения спроса на электроэнергию и засухи в некоторых районах «может угрожать вызвать массовую нехватку воды, в то время как вынужденная отключения могут произойти из-за нехватки воды в других».
Тем не менее, «несмотря на серьезность проблем с водой, связанных с потреблением электроэнергии, большинство электроэнергетических компаний продолжают предлагать водоемкие электростанции как лучший способ удовлетворить прогнозы спроса».
Другим крупным источником электроэнергии, которому угрожает нехватка воды, является гидроэнергетика. Около 20 процентов электроэнергии в мире вырабатывается крупными плотинами гидроэлектростанций — плотинами, которые требуют постоянного, большого потока воды.
Но поскольку мировой климат и круговорот воды нарушены, энергия крупных гидроэлектростанций находится под угрозой. Приведу лишь один пример: низкий уровень воды в озере Мид угрожает отключением электроэнергии на плотине Гувера, основном источнике электроэнергии для Лас-Вегаса и Южной Калифорнии.
Плотина Гувера ночью. Источник: Алессандро Альба на Flickr.
Риск для электричества из-за уменьшения количества воды является глобальной проблемой. На Филиппинах этим летом из-за засухи Национальная электросетевая корпорация сократила подачу электроэнергии наполовину в некоторых районах, поскольку уровень воды в водохранилищах упал до беспрецедентно низкого уровня.
Между тем, исследование, проведенное в Швейцарии, предсказывает, что таяние альпийских ледников может привести к резкому сокращению производства гидроэлектроэнергии — с почти 60 процентов в настоящее время до 47 процентов в 2035 году.
Индия и другие страны, которые получают значительную энергию от питаемых ледниками рек Гималаев, также находятся в опасности.
Поиски новых источников дешевой, богатой энергии угрожают существующим источникам воды.
Нам уже давно известно, что безрассудная добыча угля загрязняет грунтовые и поверхностные воды. Однако все мы знаем, что уголь — грязное топливо; а как насчет «чистого сжигания» природного газа? Недавние достижения в технологии гидроразрыва пласта (гидроразрыва пласта) создали для промышленности потенциал для разработки огромных, ранее неиспользованных запасов природного газа в Соединенных Штатах и во всем мире.
Но, как показал недавний документальный фильм Gasland , гидроразрыв представляет серьезную опасность для воды, так как миллионы галлонов воды, песка и токсичных химикатов, необходимых для гидроразрыва скважины, просачиваются на поверхность, отравляя грунт и поверхностные воды окружающих сообщества.
Тем временем в Канаде добыча нефтеносных песков стала основным источником «нетрадиционной» сырой нефти, рекламируемой как способ компенсировать снижение добычи традиционной нефти. Но в дополнение к другим проблемам, добыча нефтеносных песков требует огромного количества воды, в основном отводимой из реки Атабаска.
Горючий сланец, который часто рекламируют как еще один обширный нетрадиционный нефтяной ресурс будущего, также потребует для производства ошеломляющего количества воды. Учитывая, что большая часть горючих сланцев в США находится в регионах, уже испытывающих нехватку воды, и будет зависеть от интенсивного забора воды из уже пересыхающей реки Колорадо, трудно понять, как здесь можно избежать коллизии между потребностями в воде и энергии, поскольку хорошо.
Наконец, кажущийся бесконечным каскад разливов нефти, больших и малых, угрожает как пресноводным, так и морским ресурсам — от Ньютаун-Крик в центре Нью-Йорка, отравленного разливом нефти объемом 17–30 миллионов галлонов 57 лет назад, до Deepwater Horizon. , к недавнему разливу в Мичигане.
, к недавнему разливу в Мичигане.
Однако не только ископаемое топливо угрожает воде. Даже такой, казалось бы, безобидный продукт, как этанол на основе кукурузы, требует огромного количества воды для выращивания, что не является устойчивым решением для тех частей страны, которые зависят от орошения из ископаемых водоносных горизонтов, таких как Огаллала на Великих равнинах.
Использование ископаемой энергии приводит к потеплению климата, что нарушает круговорот воды и угрожает водным и энергетическим ресурсам.
В той мере, в какой климат можно описать в значительной степени как форму и движение воды по земле, изменение климата также можно рассматривать в основном как водную проблему, проявляющуюся в сильных штормах, увеличении засухи и повышении уровня моря (все гидрологические проблемы).
Таким образом, изменение климата, вероятно, создаст дополнительную нагрузку как на водные, так и на энергетические ресурсы.
Что делать?
Из всех источников энергии фотоэлектрическая солнечная энергия и ветровая генерация в наименьшей степени зависят от потребления воды для производства; по данным Американской ассоциации ветроэнергетики, энергия ветра использует 1/500 th того же количества воды, что и уголь, на единицу произведенной электроэнергии.
Но более важным, чем переключение источников энергии, является сокращение и сохранение потребления как энергии, так и воды. Учитывая связь между водой и энергией, из этого следует, что снижение нашего общего углеродного следа и невозобновляемых источников энергии является одним из лучших способов защиты водных ресурсов; Точно так же сокращение потребления воды является ключевым способом сокращения нашего углеродного и энергетического следа.
Такие решения зависят не только от действий отдельных лиц, их также легко рассматривать как функции политики.
Например, в штате Гуджарат, Индия, электричество для фермеров субсидируется до такой степени, что потребление воды и энергии практически бесплатно, что является серьезной проблемой для страны, которая, по общему мнению, столкнется с острой нехваткой воды в ближайшие годы.
Один из ключевых проектов Центра водных ресурсов включает в себя изучение структуры субсидий на электроэнергию штата, чтобы выяснить, можно ли в сочетании с водосберегающей технологией и выбором сельскохозяйственных культур изменить субсидию, чтобы дать фермерам стимулы для экономии воды и энергии.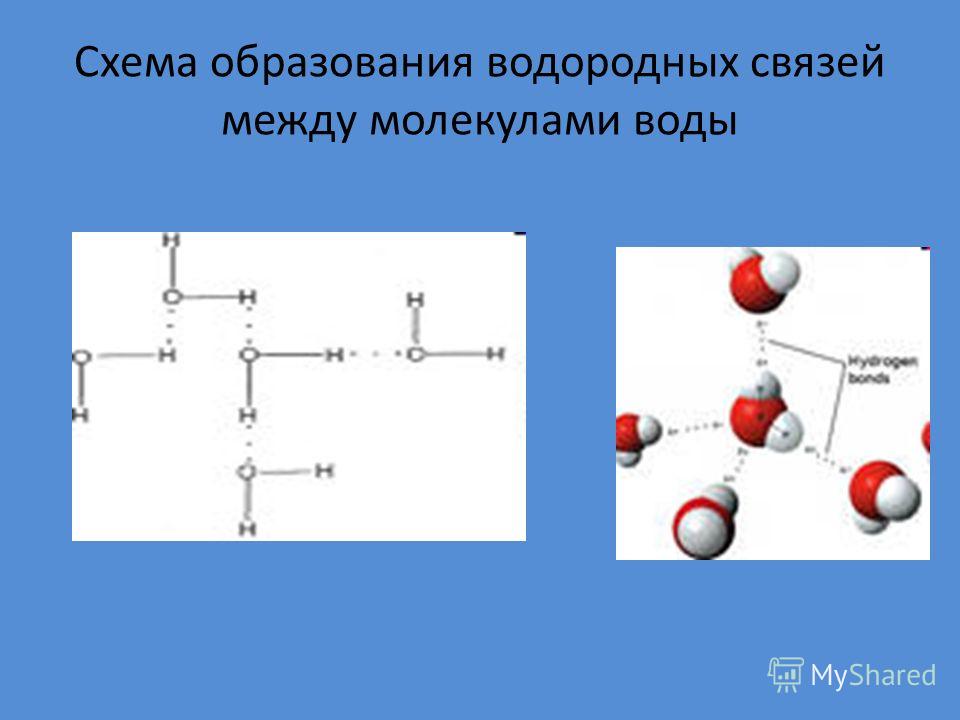
Но Индия — не единственное место, которое может извлечь выгоду из двойной стратегии экономии энергии и воды. Эрика Гис из New York Times сообщает, что с 1993 по 2006 год водный район долины Санта-Клара «сэкономил примерно 1,42 миллиарда киловатт-часов энергии, что эквивалентно годовой мощности, потребляемой 207 000 домохозяйств, благодаря финансовым стимулам, консультационным программам и инвестиции в инфраструктуру, которые сокращают потребление воды».
Тогда может показаться, что самый важный шаг — это просто шаг к осознанию — признать, что связь между энергией и водой всегда присутствует, и разработать водные и энергетические решения с учетом всей системы.
Сегодня День действий блога, и проблема в воде.
—
Подписывайтесь на Columbia Water Center в Facebook и Twitter
Теги:
ЭнергетикаВодные вопросыЦены на водуДефицит воды
Соединение водопровода малого диаметра
Соединение водопровода малого диаметра дома
Оповещения
Просмотреть все оповещения рабочей зоны
Просмотр карты предупреждений
Подпишитесь на оповещения DC Water Alerts
DC Water возобновил отключение услуг в июле 2022 года.

Мы здесь, чтобы помочь! Нажмите dcwater.com/cares, чтобы узнать о наших различных программах помощи и о том, как подать заявку. Позвоните нам сегодня по телефону 202 354-3600, чтобы договориться об оплате.
Аварийное отключение воды
DC Водопроводные бригады/подрядчики в настоящее время ремонтируют сломанный 8-дюймовый водопровод, расположенный на 18-й улице между D St и Massachusetts Ave SE
Подробнее
Аварийное отключение воды
D St между 53-й и 54-й улицами SE
Подробнее
| Что это значит? | Если вы строите новое здание, добавляете пристройку, ремонтируете существующее здание или сносите существующее здание, имеющее водопровод и канализацию, подключенные к общественной системе, вам потребуется разрешение DC Water для получения разрешения на строительство. Как правило, DC Water делит проекты на две категории:
Если ваш проект не предусматривает подключение к водопроводу, и вы не уверены, требуется ли вам разрешение от DC Water, позвоните в отдел DC Water Permit Operations по телефону 202-646-8600. |
|---|---|
| Касается ли это меня? | DC Water должен рассмотреть и утвердить планы:
|
| Когда подавать заявление? | Применяйте по крайней мере за два месяца до получения разрешения DC Water. Это предполагает, что планы будут рассмотрены, вопросы/комментарии будут подготовлены, а планы будут изменены и повторно представлены на утверждение. Нередко этот цикл повторяется два или три раза, прежде чем планы становятся достаточными для утверждения. |
| Что мне нужно предоставить? | Пожалуйста, отправьте следующую информацию в DC Water:
. |