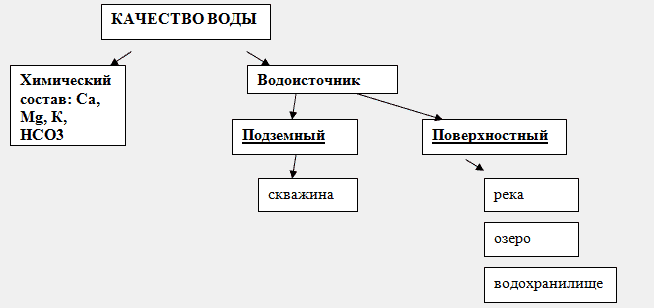
52. Диссоциация воды. Ионное производство воды. Водный показатель. Вода ионная
9_Ионное произведение воды

ЛЕКЦИЯ 9
ИОННОЕ ПРОИЗВЕДЕНИЕ ВОДЫ. ВОДОРОДНЫЙ ПОКАЗАТЕЛЬ
ПЛАН ЛЕКЦИИ
 Электролитическая диссоциация воды.
Электролитическая диссоциация воды.
 Ионное произведение воды.
Ионное произведение воды.
 Водородный показатель (рН).
Водородный показатель (рН).
 Определение рН водных растворов.
Определение рН водных растворов.
 Буферные растворы.
Буферные растворы.
ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ ВОДЫ
Вода обладает незначительной электрической проводимостью, является
слабым электролитом. Удельная электрическая проводимость воды при 298 К
составляет 6,2 10-8 Ом1  см1 . Полярные молекулы воды подвергаются самоионизации в результате переноса протонов с одной молекулы на другую
см1 . Полярные молекулы воды подвергаются самоионизации в результате переноса протонов с одной молекулы на другую
2h3O h4O+ + OH .
h4O+ + OH .
Такой процесс называют автопротолизом. Упрощенная форма записи уравнения диссоциации воды:
h3O H+ + OH .
H+ + OH .
Константа диссоциации воды может быть вычислена по уравнению
K | a H | aOH | , | |
| a H | O | ||
|
|
| ||
|
| 2 |
|
|
где aH , aOH
, aOH , ah3O - активности ионов Н+, ОН и молекул воды.
, ah3O - активности ионов Н+, ОН и молекул воды.
Исполнитель: |
| Дата: |
|
|
|
|
|
|
|
|
|
| Мероприятие № | 4 | 2 | 7 | 1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|

При комнатной температуре самоионизации подвергается незначительная часть молекул воды (приблизительно одна из 108 молекул), поэтому в выражении константы диссоциации воды активности заменяют концентрациями
K | [H | ][OH ] | 1,8 10 | 16 | при 298 К. |
|
|
| |
|
|
|
|
|
| ||||
| [h3O] |
|
|
|
| ||||
|
|
|
|
|
|
|
| ||
|
|
|
|
|
|
| 0 |
| кДж |
Диссоциация воды - обратимый эндотермический процесс: | h398 | 55,76 | моль . | ||||||
Повышение температуры ведет к смещению равновесия в сторону прямой реакции и возрастанию концентраций ионов Н+ и ОН:
T, K | 273 | 293 | 298 | 323 | 353 | 373 |
|
|
|
|
|
|
|
([H ] [OH- ]) 107 ,моль | 0,34 | 0,78 | 1,05 | 2,44 | 5,02 | 7,40 |
л |
|
|
|
|
|
|
|
|
|
|
|
|
|
ИОННОЕ ПРОИЗВЕДЕНИЕ ВОДЫ
Произведение равновесных концентраций ионов H+ и OH− называютионным произведением воды (K w )
Kw [H ][OH ].
Как следует из выражения константы диссоциации воды,
K w K[h3O].
Равновесную концентрацию молекул [H 2O]можно принять равной общему количеству вещества воды в одном литре, т.е.
| [h3O] CH O |
|
| m | 1000 | 55,56 моль/л . | ||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
| |||||||||||
|
| MV | 18 1 | |||||||||||||||||||
|
| 2 |
|
|
|
|
|
|
|
|
| |||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| ||
| Kw | 1,8 10 16 55,56 |
|
| 10 14 при 298К (250С). | |||||||||||||||||
Исполнитель: |
|
| Дата: |
|
|
|
|
|
|
|
|
|
|
|
|
|
| Мероприятие № | 4 | 2 | 7 | 1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|

При данной температуре ионное произведение воды является постоянной величиной для любых разбавленных водных растворов.
Значение ионного произведения воды возрастает при повышении температуры:
t,0C | 25 | 50 | 70 | 100 |
|
|
|
|
|
K w 1014 | 1,0 | 5,5 | 15,8 | 55,0 |
|
|
|
|
|
Пример.
Вычислите концентрации ионов H+ и OH в 0,01М растворе гидроксида натрия.
в 0,01М растворе гидроксида натрия.
Решение. NaOH - щелочь, сильный электролит, в водном растворе полностью распадается на ионы: NaOH = Na+ + OH . Молярная концентрация ионов OH равна молярной концентрации NaOH:
равна молярной концентрации NaOH:
[OH ] CNaOH 10-2 моль/л .
Концентрация ионов водорода:
[H ] | Kw |
| 10 | 14 | 10 | 12 | моль/л . | |
|
|
|
|
|
| |||
[OH ] | 10 2 |
| ||||||
|
|
|
| |||||
ВОДОРОДНЫЙ ПОКАЗАТЕЛЬ(pН)
Поскольку степенные выражения неудобны в количественных расчетах, их заменяют логарифмическими функциями, имеющими специальные обозначения и названия:
|
|
| lg[H | ] |
| pH, | ||||||||||||
|
| lg[OH | ] |
| pOH, | |||||||||||||
|
|
| lgK w |
| pK w . | |||||||||||||
Исполнитель: |
| Дата: |
|
|
|
|
|
|
|
|
|
|
| Мероприятие № |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| 4 | 2 | 7 | 1 | |||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|

Символ рН называют водородным показателемpH lg[H ] .
Логарифмируя ионное произведение воды, получим
lg[H | ] | lg[OH | ] lg Kw , |
pH | pOH | pK w , | |
pH | pOH 14 (при 298К). | ||
Пример 1. Вычислите рН 0,01 M раствора соляной кислоты. | |||
Решение. Водородный | показатель | pH lg[H ] . Соляная кислота | |
является сильным электролитом, т.е. в водном растворе полностью распадается на ионы:
HCl = H+ + Cl .
Молярная концентрация ионов водорода в данном случае равна молярной концентрации кислоты:
[H ] CHCl 102 моль/л ; pH lg102 2.
lg102 2.
Пример 2. Рассчитайте рН 0,1 M раствора гидроксида калия.
Решение. KOH - щелочь, сильный электролит, в водном растворе полностью распадается на ионы:
KOH = K+ + OH .
Молярная концентрация ионов OH равна молярной концентрации KOH:
равна молярной концентрации KOH:
|
| [OH ] | CKOH 10-1 моль/л , | ||||||||||||||
|
| pOH = -lg[OH−]= 1, | |||||||||||||||
|
| pH 14 - pOH = 14 – 1 = 13, | |||||||||||||||
|
|
|
| рН = 13. | |||||||||||||
Исполнитель: |
| Дата: |
|
|
|
|
|
|
|
|
|
| Мероприятие № |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| 4 | 2 | 7 | 1 | |||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|

Пример 3. Рассчитайте рН 0,01 M раствора бромноватистой кислоты.
Решение. Бромноватистая кислота – слабый электролит. Уравнение диссоциации:
HBrO H+ + BrO−, | K | [H ][BrO | ] | 2,2 10 | 9 (при 298 K). |
|
| ||||
[HBrO] |
| ||||
|
|
|
|
|
Согласно уравнению диссоциации, [H+] = [BrO−] , т.е.
| [H ]2 |
|
|
K | [HBrO] , | [H ] | K [HBrO] . |
Степень диссоциации слабого электролита мала, [HBrO] ≈ СHBrO.
Концентрация ионов водорода и значение рН:
|
| 2,2 10 9 0,01 | 4,7 10 5 моль/л. |
[H ] K CHBrO | |||
| pH | lg( 4,7 10 5 ) | 4,3. |
Пример 4. Рассчитайте рН 0,01 M водного раствора аммиака.
Решение. В водном растворе аммиака существует равновесие:
NH | 3 | H | O | NH | OH , | K | [Nh5 ] [OH ] | 1,8 10 | 5 | (при 298 K), | ||||
|
|
|
| |||||||||||
| 2 |
|
| 4 |
|
| [Nh4 | h3O] |
|
|
|
| ||
|
|
|
|
|
|
|
|
|
|
|
| |||
т.е. гидрат | аммиака | NH 3 | H 2O | проявляет | свойства | слабого электролита. | ||||||||
Диссоциация слабого электролита протекает в малой степени, можно считать,
что [Nh4 h3O] |
| СNh4 h3 O . Согласно уравнению диссоциации [Nh5 ] | [OH ], | ||||||||||||||||||||||||||||
следовательно K |
| [OH ]2 |
|
| . |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| |||||||
| CNH |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| |||||
|
|
|
| 3 | H | O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| |||||||
|
|
|
|
|
| 2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| ||
Концентрация ионов ОН−: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| |||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| ||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| 5 10 | 2 4,2 104 моль/л . |
|
|
|
| |||||||
[OH ] | K C | NH |
|
| H |
| O | 1,8 10 |
|
|
|
| |||||||||||||||||||
|
|
|
|
| 3 |
| 2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| ||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| ||
|
|
|
|
| pOH lg[OH ] | lg(4,2 | 10 4 ) 3,4 . |
|
|
|
| ||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| |
Исполнитель: |
|
|
|
|
|
|
|
|
| Дата: |
|
|
|
|
|
|
|
|
|
|
|
|
| Мероприятие № | 4 | 2 | 7 | 1 | |||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|

Значение рН:
pH = 14 – рОН- = 14 - 3,4 = 10,6.
Значения концентраций ионов H+ или OH , а также показатель рН являются количественной характеристикой среды раствора (кислой,
нейтральной, щелочной).
В нейтральной среде
[H ] [OH ]  Kw ,
Kw ,
[H ] 10 14 107 моль/л , pH | lg[H ] lg10 7 7 . |
В кислой среде
[H ] 10 7 моль/л , lg[H ] lg107 , lg[H ] 7 , т.е.pH 7 .
В щелочной среде
[H ] 10 7 моль/л , lg[H ] lg107 , lg[H ] 7 , т.е.pH 7 .
КОЛИЧЕСТВЕННЫЕ ХАРАКТЕРИСТИКИ РЕАКЦИИ СРЕДЫ
| Концентрация ионов, моль/л |
| ||
Среда |
|
| рН | |
[H+] | [OH ] | |||
|
| |||
|
|
|
| |
нейтральная | 10 7 | 10 7 | 7 | |
|
|
|
| |
кислая | >10 7 | <10 7 | < 7 | |
|
|
|
| |
щелочная | <10 7 | >10 7 | > 7 | |
|
|
|
| |
ОПРЕДЕЛЕНИЕ РН ВОДНЫХ РАСТВОРОВ
Измерение рН растворов (рН-метрия)используется довольно широко.
Контроль значений pH крови и других биологических растворов позволяет диагностировать патологические процессы в организмах. Значение рН
Исполнитель: |
| Дата: |
|
|
|
|
|
|
|
|
|
| Мероприятие № | 4 | 2 | 7 | 1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|

природных вод является важнейшим гидрохимическим, гидрогеологическим и экологическим показателем. В сельском хозяйстве по значению рН контролируют кислотность почв. Величина рН используется для контроля и автоматического регулирования производства, в технологии которого используются растворы.
Точное измерение рН осуществляют с помощью приборов – потенциометров
(pH-метров),в которых используется система со стеклянными и вспомогательными электродами. Потенциал стеклянного электрода зависит от концентрации ионов H+ в растворе. Принцип действияpH-метровоснован на измерении разности потенциалов электродов, помещенных в анализируемый раствор. Диапазон измеряемых значений рН 0 14, точность измерения - 0,01 единицы pH.
Измерение рН раствора на рН-метретипа«Эксперт-рН»показано на рисунке.
Для грубой оценки рН используют кислотно - основные индикаторы – органические вещества, окраска которых зависит от рН среды. Широко применяемыми индикаторами являются лакмус, фенолфталеин, метиловый оранжевый и другие слабые органические кислоты и основания.
Исполнитель: |
| Дата: |
|
|
|
|
|
|
|
|
|
| Мероприятие № | 4 | 2 | 7 | 1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|

Например, индикатор метиловый оранжевый (н –
диметиламиназобензолсульфат натрия) может существовать в молекулярной
(HInd) и ионной (Ind ) формах, имеющих соответственно красную и желтую окраску. В интервале значений рН 3,1-4,4в результате смещения ионного
равновесия |
|
HInd | H+ + Ind |
происходит постепенное изменение окраски: от красной к желтой при повышении рН и от желтой к красной при понижении рН.
Индикатор фенолфталеин - слабая органическая кислота, при значениях рН ниже 8,2 находится преимущественно в молекулярной (бесцветной) форме.
Добавление щелочи приводит к смещению равновесия в сторону ионной формы, раствор приобретает малиновую окраску.
Изменение окраски кислотно - основных индикаторов происходит в некотором интервале, соответствующем 1-2единицы рН.
ОБЛАСТИ ПЕРЕХОДА ХАРАКТЕРНОЙ ОКРАСКИ НЕКОТОРЫХ ИНДИКАТОРОВ
Индикатор | Область перехода pH | Переход окраски при | |
повышении рН | |||
|
| ||
|
|
| |
метиловый оранжевый | 3,1 - 4,4 | красная → желтая | |
метиловый красный | 4,2 - 6,3 | красная → желтая | |
лакмус | 6,0 – 8,0 | красная → синяя | |
феноловый красный | 6,8 – 8,4 | желтая→ красная | |
фенолфталеин | 8,2 – 10,0 | бесцветная→ малиновая | |
|
|
|
Для определения рН раствора в более широком диапазоне часто применяют универсальный индикатор, представляющий собой смесь индикаторов.
Исполнитель: |
| Дата: |
|
|
|
|
|
|
|
|
|
| Мероприятие № | 4 | 2 | 7 | 1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|

ХАРАКТЕРНАЯ ОКРАСКА УНИВЕРСАЛЬНОГО ИНДИКАТОРА
Интервал рН | Окраска индикатора |
|
|
0,0 - 3,4 | красная |
3,4 - 4,7 | оранжевая |
4,7 - 6,2 | жѐлтая |
6,2 - 7,2 | зелѐная |
7,2 - 8,5 | синяя |
8,5 - 13,0 | фиолетовая |
|
|
БУФЕРНЫЕ РАСТВОРЫ
Многие аналитические реакции проводят при строго определенном значении pH, которое должно сохраниться в течение всего времени проведения реакции. Концентрация водородных ионов (соответственно, и pH) может изменяться в ходе некоторых реакций, а также под действием СО2 воздуха,
стекла посуды, различных примесей, присутствующих в дистиллированной воде. Для сохранения постоянного значения рН в заданном диапазоне применяют буферные растворы. Чаще всего в качестве буферных растворов используют смеси слабых кислот (или слабых оснований) и одноименных солей.
Например, ацетатный буферный раствор содержит уксусную кислоту и ацетат натрия, диссоциации которых соответствуют уравнения:
СН3СООН СН3СОО− + Н+
СН3СОО− + Н+
СН3СООNa = СН3СОО− + Na+
Концентрация водородных ионов в растворе уксусной кислоты может быть найдена из выражения константы диссоциации
Исполнитель: |
| Дата: |
|
|
|
|
|
|
|
|
|
| Мероприятие № | 4 | 2 | 7 | 1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|

К | [Ch4COO ][H ] | 1,8 10 | 5 | , [H ] | K [Ch4COOH] | . | ||
[Ch4COOH] |
|
| [Ch4COO- ] |
| ||||
|
|
|
|
| ||||
Присутствие в растворе одноименной соли подавляет диссоциацию уксусной кислоты. В результате концентрация недиссоциированных молекул кислоты становится почти равной концентрации кислоты, а концентрация ацетатных ионов – концентрации соли
К | Ссоли [H ] | , | [H ] | K Cкислоты | , |
|
| ||||
| Скислоты |
| Ссоли | ||
где Скислоты – концентрация кислоты, Ссоли – концентрация соли.
Концентрация ионов водорода в таком растворе определяется только соотношением концентраций кислоты и одноименной соли и не зависит от абсолютных значений концентраций. При разбавлении раствора значение рН практически не изменяется. Добавление небольшого количества сильной кислоты или щелочи также не приводит к заметному изменению рН таких растворов. Добавленные в раствор ионы H+ связываютсяацетат-ионами:
Ch4COO- + H+ = Ch4COOH,
ионы OH- - недиссоциированными молекулами уксусной кислоты CН3COOH:
OH- + Ch4COOH = h3O +Ch4COO-.
Аммиачный буферный раствор приготовляют смешением водного раствора аммиака и соли аммония.
NH 3  h3O
h3O Nh5 OH ,
Nh5 OH ,
Nh5Cl Nh5 Cl
Концентрацию ионов ОН− в растворе можно определить из уравнения:
Исполнитель: |
| Дата: |
|
|
|
|
|
|
|
|
|
| Мероприятие № | 4 | 2 | 7 | 1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
studfiles.net
Диссоциация воды. Ионное произведение воды. Водородный показатель, рН.
До сих пор мы предполагали и рассматривали процесс диссоциации растворенного вещества под действием молекул растворителя. Но возможен процесс и самодиссоциации растворителя. То есть взаимодействие между собственными молекулами растворителя настолько значительно, что может привести к разрыву связей внутри молекул с образованием новых заряженных частиц – ионов. Например, вода диссоциирует на ионы водорода и гидроксила
Н2Ожид. ↔ Н+раствор + ОН-раствор, и как следствие – чистая вода обладает электропроводностью (правда, незначительной). Следует отметить, что в воде протон сольватирован и существует в виде иона гидроксония (гидрония) Н3О+. С учетом этого уравнение процесса диссоциации воды (автопротолиз воды) можно записать:
2Н2О ↔ Н3О+ + ОН- . На практике, однако, чаще используют форму записи Н+, чем Н3О+. В условиях равновесия процесс самодиссоциации воды можно охарактеризовать константой диссоциации Кн2о: Кд(н2о)=[ H+]⋅[OH−]/[ h3O]
Ее величина очень мала и при 22 оС составляет значение равное 1,8 ⋅10-16. Из этого следует, что в воде образуется очень незначительное количество ионов водорода Н+ и гидроксила ОН- (числитель выражения), а следовательно, и распадается незначительная часть молекул воды. Поэтому можно без большой ошибки считать равновесную концентрацию нераспавшихся молекул воды
[h3O] в приведенном выражении равной концентрации исходной воды (до диссоциации), которая для одного литра воды, принимая во внимание плотность воды и ее молярную массу, равна [h3O] = 55,56 моль/л, где 1000 г – масса одного литра воды, 18 – молярная масса воды. Если подставить величину концентрации воды в выражение константы диссоциации, то получим: 1,8⋅10-16 = [H+][OH−]/55,56 или [H+][OH-]=Кводы=1,8.10-16/55,56 = 1⋅10-14.
Последнее выражение ─ произведение концентраций ионов водорода и гидроксила ─ называют ионным произведением воды. Величина эта постоянная при данной температуре и характеризует соотношение концентраций ионов водо-
рода и гидроксила чистой воды. Из ионного произведения воды видно, что концентрации ионов водорода и гидроксила равны между собой и в чистой воде составляют величину, равную: [H+] = [OH-] = 1⋅10-7 моль/л.
Это и понятно, так как каждая распавшаяся молекула воды поставляет одновременно один ион водорода Н+ и один ион гидроксила ОН-. Если вспомнить, что ион водорода Н+ является носителем кислотных свойств, а ион гидроксила ОН- ─ основных, то при равенстве их концентраций
[H+] = [OH-] = 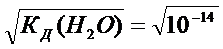 =10-7 моль/л вода является нейтральным электролитом: ни кислым, ни основным. Вода выступает в роли амфолита. Если же концентрация ионов водорода [H+] в водном растворе будет в силу каких-то причин больше концентрации ионов гидроксила [OH-] (например, при добавлении молекул кислоты, распадающихся на ионы водорода и кислотного остатка), то раствор будет кислым. Если же, наоборот, концентрация ионов гидроксила будет больше, чем ионов водорода, то раствор окажется основным. Например, если в растворе концентрация ионов водорода [H+] = 10-4 моль/л, а концентрация ионов гидроксила соответственно равна [OH-] =10-10 моль/л (их произведение должно равняться [H+][OH-]= 10-14), то концентрация ионов водорода больше концентрации ионов гидроксила [H+] > [OH-], и раствор окажется кислым (говорят: среда кислая).
=10-7 моль/л вода является нейтральным электролитом: ни кислым, ни основным. Вода выступает в роли амфолита. Если же концентрация ионов водорода [H+] в водном растворе будет в силу каких-то причин больше концентрации ионов гидроксила [OH-] (например, при добавлении молекул кислоты, распадающихся на ионы водорода и кислотного остатка), то раствор будет кислым. Если же, наоборот, концентрация ионов гидроксила будет больше, чем ионов водорода, то раствор окажется основным. Например, если в растворе концентрация ионов водорода [H+] = 10-4 моль/л, а концентрация ионов гидроксила соответственно равна [OH-] =10-10 моль/л (их произведение должно равняться [H+][OH-]= 10-14), то концентрация ионов водорода больше концентрации ионов гидроксила [H+] > [OH-], и раствор окажется кислым (говорят: среда кислая).
В практической работе принято выражать концентрацию ионов водорода через так называемый водородный показатель рН, который представляет собой просто один только показатель степени концентрации ионов водорода
без отрицательного знака. С математической точки зрения рН ─ это отрицательный десятичный логарифм молярной концентрации ионов водорода: рН = - lg[H+].
Если, например, [H+] = 10-4 моль/л, то рН = - lg[10-4]= 4 (среда кислая). При равных концентрациях ионов водорода и гидроксила [H+] = [OH-] = 10-7моль/л раствор будет нейтральным и его рН = - lg [10-7] = 7 (среда нейтральная). Если рН <7, то среда кислая; если рН > 7, то среда щелочная
Иногда применяют не показатель рН, а показатель ионов гидроксила рОН (по аналогии с рН), равный рОН = -lg[OH-].
Сумма показателей ионов водорода и гидроксила для данного раствора должна быть равной 14, т.е. рН + рОН = 14, так как логарифмирование ионного произведения воды дает следующее соотношение lg ([H+]⋅[OH-]) = lg 10-14 , или lg[H+] + lg[OH-] = -14, а отсюда, принимая во внимание, что рН = -lg[H+] и pOH = - lg[OH-], получим рН + рОН = 14.
Следует отметить, что при расчете рН и рОН концентрациями [H+] и [OH-] можно пользоваться лишь в растворах, ионная сила которых близка к нулю, коэффициенты активности единице, а значит активности равны концентрациям. В противном случае ионное произведение воды равно произведению активностей протонов и гидроксид-ионов: Кводы = а (Н+) ∙ а (ОН-).
Так, для растворов с высокой концентрацией электролитов водородный показатель обозначается раН и равен отрицательному логарифму активной (эффективной) концентрации (активности) ионов водорода: : раН = -lg([H+] .fH+ ) = -lg[H+] - lg fH+ = pH - lg fH+, раОН = -lg([ОH-] .fHО- ) = -lg[ОH-] - lg fОH- = pОH - lg fОH-, где fH+― коэффициент активности протонов в данном растворе.
Гидролиз солей. Механизм гидролиза. Типичные случаи гидролиза в зависимости от силы кислот и оснований, образующих соль. Ступенчатый гидролиз, образование кислых и основных солей.
Гидролиз соли – взаимодействие ионов соли с водой, в результате которого образуются слабые электролиты.
Вода, как известно, имеет нейтральную среду (рН = 7). Но при растворении в ней некоторых солей (например, Na2CO3, CuSO4), не содержащих в своем составе ни ионов водорода Н+, ни ионов гидроксила ОН-, водородный показатель рН раствора оказывается отличным от нейтрального рН=7. Так, например, раствор соды Na2CO3 в воде имеет щелочную реакцию (рН>7), а сульфата меди CuSO4 – кислую (рН<7). То есть при растворении этих солей в воде изменяется
соотношение между концентрациями ионов водорода и гидроксила: [H+] ≠ [OH-]. Чистая вода диссоциирует с образованием в равных количествах ионов водорода и гидроксила в силу того, что каждая распадающаяся молекула воды дает один ион водорода и один ион гидроксила: Н2О ↔ Н+ + ОН-.
Растворившиеся молекулы соли в воде распадаются на собственные ионы: катионы и анионы, которые сразу же окружаются молекулами воды – гидратируются. Дальнейшее их взаимодействие с водой осуществляется через собственную гидратную оболочку. Если, например, катион какой-то соли (пусть это будет ион меди Сu2+) взаимодействует с ближайшими гидроксилами ОН-
молекул воды, образуя довольно прочную, а, следовательно, и недиссоциирующую частицу (в нашем случае это ион [Cu(OH)]+ ), то концентрация равновесных ионов гидроксила в воде окажется меньше, поскольку часть из них
прочно связана. А равновесная концентрация ионов водорода окажется, естественно, больше. И, как результат, ─ среда кислая (рН < 7). Образование прочных, недиссоциирующих частиц типа: [Cu(OH)]+, [Fe(OH) ]2+, [Fe(OH)2]+, [Zn(OH)]+, [Ni(OH)]+, [Al(OH)]2+ и других не удивительно. Катионы Сu2+, Fe2+, Fe3+, Zn2+ , Ni2+, Al3+ и другие, имея свободные орбитали, могут образовывать ковалентные связи с молекулами воды, кислород которой имеет свободные электронные пары, по донорно-акцепторному механизму: катионы выступают в роли акцепторов, а кислород воды ─ в роли доноров.
Чем больше заряд катиона и меньше его радиус, а значит и больше его поляризующее действие, тем более ковалентный характер взаимодействия его с гидроксилом воды. И тем самым ослабляется связь иона водорода с собственным гидроксилом молекулы воды и ему легче его покинуть. Схематически можно изобразить этот процесс с участием иона меди таким образом:
Cu2+ + [:O:H]- H+ → [Cu : O:H]+ + H+, где Сu2+ ─ ион меди с валентной свободной орбиталью; [:O:H]- H+─ молекула
воды в виде ионов гидроксила и водорода с валентными свободными парами электронов кислорода. В данном случае уменьшение концентрации ионов гидроксила (увеличение концентрации ионов водорода) обусловлено образованием
относительно прочной частицы [Cu(OH)]+, которые диссоциирует в меньшей степени, чем сами молекулы воды.
Очевидно, чем слабее основание (прочнее связаны ионы гидроксила с катионами соли), тем выше равновесная концентрация ионов водорода и тем более кислая среда.
Возможен и другой – противоположный случай, когда связываются в малодиссоциирующие частицы ионы водорода с анионами соли. Анионы соли (например, СО32-, S2-, PO43-, SO32-, Ch4COO-, SiO32- и др.) в воде так же гидратированы и осуществляют свою связь с окружающими их молекулами воды посредством ионов водорода этих молекул. Эта связь носит название водородной связи. Она частично имеет электростатический характер (взаимодействие противоположно заряженных частиц: в нашем случае – анион соли и положительный ион водорода) и частично – донорно-акцепторный: ион водорода Н+, имея пустую орбиталь, выступает в роли акцептора, а анионы соли,
имея свободные пары электронов, являются донорами.
Если анионы соли связываются довольно прочно с ионами водорода воды (увеличивается доля ковалентного характера связи между ними), то можно считать, что ион водорода в большей степени принадлежит уже аниону соли, чем молекуле воды. Степень диссоциации образовавшейся новой частицы будет меньше, чем степень диссоциации самой воды. Следовательно, и концентрация равновесных ионов водорода окажется меньше, а концентрация равновесных ионов гидроксила будет больше. И, как результат, среда становится щелочной.
Таким образом, в зависимости от степени и характера взаимодействия катионов и анионов соли с ионами воды будут и разные результаты: среда раствора может оказаться и кислой, и щелочной или остаться нейтральной. Сам
процесс взаимодействия ионов соли с ионами воды, в результате которого изменяется рН раствора, называется гидролизом.
Если катионы и анионы соли имеют небольшие заряды и довольно большие радиусы, то их влияние на молекулы воды невелико, и гидролиза практически не происходит. Это относится к таким катионам, как K+, Ca2+, Rb+, Ba2+, и
анионам: Cl-, NO3-, SO42-. То есть соли, составленные из этих ионов (сильных кислот и сильных оснований), гидролизу подвергаться не будут, и рН этих растворов будет равно или близко к семи (рН ≈ 7). Различают еще три возможных
варианта взаимодействия воды с солями, если:
1─ соль образована сильным основанием и слабой кислотой;
2 – соль образована сильной кислотой и слабым основанием;
3 – соль образована слабой кислотой и слабым основанием.
В первом случае катионы соли обладают малой акцепторной активностью в сравнении с анионами, которые выступают с явно выраженными донорными свойствами по отношению к воде. Примером может служить процесс взаимодействия нитрита калия KNO2 с водой, который можно представить следующим молекулярным уравнением, которое соответствует реакции обратной реакции нейтрализации:
KNO2 + HOН ↔ KOH + HNO2.
Или в ионно-молекулярной форме:
K+ + NO2- + HOН ↔ K+ + OH- + HNO2.
После сокращения получим:
NO2- + HOH ↔ OH- + HNO2.
Из сокращенного ионного уравнения явно видно, что ионы водорода воды связываются в малодиссоциирующие молекулы азотистой кислоты HNO2, и в растворе преобладают ионы гидроксила. Следовательно, раствор этой соли в воде имеет щелочную реакцию (рН > 7).
Напомним, что при написании реакций в ионной форме слабые электролиты или малодиссоциирующие вещества изображают в недиссоциированном виде.
Если в воде растворяются соли многоосновных кислот (например, К2СО3), то гидролиз протекает ступенчато. Вначале анионы соли (в частности, карбонат –анион СО32-) присоединяют по одному иону водорода, образуя слабодиссоциирующие кислые анионы:
первая ступень СО32- + НOН ↔ OH- + HCO3-.
Или в молекулярной форме:
К2СО3 + НОН ↔ КОН + КНСО3.
Затем образовавшаяся кислая соль КНСО3 может далее гидролизоваться, присоединяя к кислому аниону еще один ион водорода, что в молекулярноионной форме выразится уравнением второй ступени:
вторая ступень НСО3- + НOH ↔ OH- + h3CO3.
Или в молекулярной форме:
KHCO3 + HOН ↔ KOH + h3CO3.
Если гидролиз протекает ступенчато, то идет он в основном по первой ступени. В меньшей мере по второй и ещё в меньшей степени по третьей ступени, если таковая имеется. В приведенном примере гидролиза карбоната калия
в растворе в основном будут присутствовать ионы НСО3- (наряду с ионами К+ и ОН- ), образующиеся по первой ступени гидролиза, и практически будет мало молекул угольной кислоты Н2СО3, как продукта второй ступени. Но если продукты гидролиза каким-нибудь образом удаляются из системы (например, улетучиваются), то растворенная соль подвергается гидролизу полностью. Так, например,
при растворении сульфида калия в воде вследствие образования легколетучего сероводорода h3S по второй ступени и удаления его из раствора, гидролиз соли
протекает практически до конца:
K2S + 2HOH ↔ 2KOH + h3S↑
или в ионно-молекулярной форме:
S2- + 2HOH ↔ 2OH- + h3S↑
Рассмотрим второй случай гидролиза, когда катионы соли взаимодействуют с водой с образованием малодиссоциирующих частиц, а анионы не образуют прочных соединений с ионами водорода. Примером может служить гидролиз хлорида меди CuCl2 (соль образована слабым основанием Cu(OH)2 и сильной кислотой HCl). Хлорид меди гидролизуется ступенчато, последовательно
присоединяя одну гидроксильную группу ОН- по первой ступени и затем вторую группу ОН- – по второй. Ионные уравнения соответствующих ступеней следующие:
первая ступень Cu2+ + HOH ↔ [CuOH]+ + H+,
вторая ступень [CuOH]+ + HOH ↔ Cu(OH)2 + H+.
Молекулярные уравнения этих ступеней:
первая ступень CuCl2 + HOН ↔ CuOHCl + HCl,
вторая ступень CuOHCl + HOН ↔ Cu(OH)2 + HCl.
Как явно видно из ионных уравнений, в результате взаимодействия ионов соли с ионами воды связываются ионы гидроксила (следовательно, их концентрация становится меньше), а концентрация ионов водорода соответственно
увеличивается. А это означает, что раствор становится кислым ( рН < 7). При гидролизе таких солей обычно образуется основная соль и сильная кислота.
В случае гидролиза солей, образованных слабыми основаниями и слабыми кислотами (третий случай), ионы воды относительно прочно связываются и с катионами, и с анионами соли. В качестве примера рассмотрим гидролиз ацетата аммония Nh5Ch4COO (соль образована слабой уксусной кислотой СН3СООН и слабым основанием Nh5OH):
Nh5Ch4COO + HOН → Nh5OH + Ch4COOH,
или в ионной форме:
Nh5+ + Ch4COO- + HOН → Nh5OH + Ch4COOH.
Реакция среды таких растворов (рН) зависит от соотношения констант диссоциации продуктов гидролиза. Если более сильной кислотой образована соль, то среда будет кислой (рН < 7), если более сильным основанием ― основной (рН > 7). Если константы диссоциации основания и кислоты, образующих соль близки, то растворы солей этого типа имеют или слабокислую, или слабощелочную реакции, т.е. их рН близок к нейтральному значению (рН ≈7). В частности, раствор ацетата аммония имеет рН =7, так как константы диссоциации гидроксида аммония и уксусной кислоты равны.
cyberpedia.su
52. Диссоциация воды. Ионное производство воды. Водный показатель.
Чистая вода очень плохо проводит электрический ток, но все же обладает измеримой электропроводностью, которая объясняется небольшой диссоциацией воды на ионы водорода и гидроксид-ионы: h3O H++OH-. По величине электропроводности чистой воды можно вычислить концентрацию ионов водорода и гидроксид-ионов в воде. При 25 °С она равна 10~7 моль/л. Напишем это уравнение следующим образом [H+] [OH-] = [h3O] K Поскольку степень диссоциации воды очень мала, то концентрация недиссоциированных молекул Н20 в воде практически равна общей концентрации воды, т. е. 55,55 моль/л {1 л содержит 1000 г. воды, т. е. 100:18,02 = 55,55 молей), В разбавленных водных растворах концентрацию воды можно считать такой же. Поэтому, заменив в последнем уравнении произведение [Н2О] К. новой константой Кн2о, будем иметь: [H+][OH-]=Kh3O. Полученное уравнение показывает, что для воды и разбавленных водных, растворов при неизменной температуре произведение концентраций ионов водорода и гидроксид-ионов есть величина постоянная. Эта постоянная величина называется ионным произведением воды. Численное значение ее нетрудно получить, подставив в последнее уравнение концентрации ионов водорода и гидроксид-ионов. В чистой воде при 25 °С [Н+] = [ОН~] = 1 • 10~7 моль/л. Растворы, в которых концентрации ионов водорода и гидроксид-ионов одинаковы, называются нейтральными растворами. В кислых растворах больше концентрация ионов водорода, в щелочных — концентрация гидроксид-ионов. Но какова бы ни была реакция раствора, произведение концентраций ионов водорода я гидроксид-ионов остается постоянным. Если например, к чистой воде добавить столько кислоты, чтобы концентрация ионов водорода повысилась до 10~3 моль.-л, то концентрация гидроксид-ионов понизится так, что произведение [Н+][ОН~] останется равным 10-14. Как степень кислотности, так и степень щелочности раствора можно количественно охарактеризовать концентрацией ионов водорода: нейтральный раствор Н+=10-7, кислый Н+>10-7, щелочной Н+<10-7. Кислотность или щелочность раствора можно выразить другим, более удобным способом: вместо концентрации ионов водорода указывают ее десятичный логарифм, взятый с обратным знаком. Последняя величина называется водородным показателем и обозначается через рН: pH= - lg [H+].
53. Интервалы значения pH для различных жидкостей человеческого организма.
Постоянство концентрации водородных ионов является одной из существенных констант внутренней среды организмов. Так, рН крови человека составляет 7,36. Активность разнообразных биологических катализаторов (ферментов), а нередко и специфика происходящих в тканях биохимических процессов связаны с ограниченными зонами значеня рН. Например, пепсин желудочного сока активен при рН 1,5 — 2,1 каталаза крови — при рН 7,0; тканевые катепсины при реакции среды, близкой к нейтральной, катализируют синтез белка, а pH кислой реакции его расщепляют. Смещение реакции среды в животном организме в кислую сторону называется ацидозом, а в щелочную — алкалозом. Изменение реакции крови на несколько десятых долей рН приводит к серьёзным нарушениям жизнедеятельности. Определение концентрации водородных ионов в ряде случаев помогает судить о характере протекающих в организме физиологических и патологических процессов. В связи с этим приходится определять рН в различных биологических жидкостях, что иногда (например, при определении рН крови) представляет довольно сложную задачу. Определение реакции среды и знание концентрации водородных ионов в биологических объектах часто является необходимым в лабораторной практике. Эти определения бывают нужны, в частности, при создании желаемой реакции среды, необходимой для оптимальной жизнедеятельности микроорганизмов. При проведении многих биологических опытов in vitro, например, при работе с культурами тканей, при определении ферментативной активности препаратов и т. п. одним из основных условий является создание соответствующей реакции среды.
studfiles.net