Содержание
Карбид кальция: формула, реакция с водой (гидролиз), получение и хранение
Карбид кальция имеет резкий чесночный запах и сильно поглощает воду. Его плотность повышается с увеличением количества примесей и изменяется в пределах 2,22-2,8 г/см3. Молекулярная масса — 64,102. Технический карбид кальция выпускают по ГОСТ 1460.
Содержание
- История получения
- Получение
- Гидролиз
- Количество воды необходимое для реакции
- Параметры влияющие на скорость реакции
- Карбид кальция плюс азот
- Карбид кальция плюс водород
- Хранение
- Карбид кальция
- химическое соединение кальция с углеродом, в чистом виде представляющее собой белое кристаллическое вещество. Химическая формула — СаС2
- Технический карбид кальция
- твердый кускообразный материал, цвет излома которого меняется в зависимости от содержания карбида кальция.
 При содержании 60-75% СаС2 — имеет излом серого цвета, переходящий в фиолетовый при более высоком содержании CaC2. Высокопроцентный (80% СаС2 и выше) — имеет окраску от светло-коричневого до голубовато-черного.
При содержании 60-75% СаС2 — имеет излом серого цвета, переходящий в фиолетовый при более высоком содержании CaC2. Высокопроцентный (80% СаС2 и выше) — имеет окраску от светло-коричневого до голубовато-черного.
История получения карбида кальция
Карбид кальция был получен случайно в 1862 г. Немецкий химик Фридрих Вёлер (Friedrich W?hler) при попытке выделения металлического кальция из извести (карбоната кальция СаСО3) путем длительного прокаливания смеси, состоящей из извести и угля, получил массу сероватого цвета, в которой не обнаружил признаков металла. Как результат неудавшегося эксперимента он выбросил эту массу на свалку во дворе. Во время дождя лаборант заметил выделение какого-то газа из выброшенной массы. Это заинтересовало Фридриха Вёлера, он провел анализ газа и установил, что это ацетилен (С2Н2), ранее открытый Эдмундом Дэви (Edmund Davy), в 1836 г.
Однако имя этому газу присвоил французский химик Пьер Эжен Марселен Бертло (Marcellin Berthelot) после того, как в 1863 году получил ацетилен, пропуская водород над раскалёнными электрической дугой графитовыми электродами.
Томас Уилсон (Thomas Leopold «Carbide» Willson) в 1888 году и Фердинанд Фредерик Анри Муассан (Ferdinand Frederic Henri Moissan) в 1892 независимо друг от друга открыли метод получения карбида кальция в дуговой электропечи, что послужило толчком для дальнейшего развития промышленного получения технического карбида кальция.
В России первые заводы по изготовлению карбида кальция были построены акционерным обществом «Перун» в 1908 г. в Земковицах, а в 1910 г. в Петербурге. В 1914 г. на этом заводе работали две карбидные печи мощностью по 500 кВт и две печи по 900 кВт.
В 1917 г. при Макеевском металлургическом заводе была построена установка с электропечью мощностью 1800 кВт. Почти одновременно на заводе в Баку для нужд нефтепромышленности и на Аллавердском медеплавильном заводе также были пущены карбидные печи.
В 1930 г. был построен и пущен первый большой карбидный завод в Растяпино (ныне г. Дзержинск Нижегородской области). На этом заводе карбид кальция впервые стал выпускаться не только как товарный продукт, но и для получения цианамида кальция.
Получение карбида кальция
Технический карбид кальция получают в результате взаимодействия обожженной извести (СаО) с коксом (3С) или антрацитом в электрических печах при температуре 1900-2300°С. Шихту, состоящую из смеси кокса или антрацита и извести в определенной пропорции, загружают в электропечь, шихта расплавляется, при этом происходит эндотермическая химическая реакция (с поглощением тепла) по формуле:
СаО+3С = СаС2+СО -108 ккал/моль
Таким образом, для получения 1 т карбида кальция требуется:
- 4000 кг извести
- 600 кг кокса
- 1965 кВт·ч электроэнергии
Однако вследствие значительных потерь энергии в карбидных печах практически для получения 1 т технического карбида кальция расходуется от 2800 до 3700 кВт·ч в зависимости от мощности печи. Если мощность печи меньше 1000 кВт, то расход электроэнергии может достичь 4000 кВт·ч/т и более.
Расплавленный карбид кальция сливают из печи в специальные изложницы, в которых он остывает и затвердевает. После затвердевания его дробят в щековых дробилках и сортируют в решетчатых барабанах на куски различной величины от 2 до 80 мм.
После затвердевания его дробят в щековых дробилках и сортируют в решетчатых барабанах на куски различной величины от 2 до 80 мм.
Выход кусков различных размеров при дроблении приведен ниже:
| Грануляция, мм | 25-80 | 15-25 | 8-15 | 2-8 | до 2 |
|---|---|---|---|---|---|
| Выход, % | 66-80 | 8-10 | 6-14 | 4,5-6,5 | 1,5-3,0 |
Товарным карбидом кальция считается грануляцией от 2 до 100 мм. Карбидная пыль, получающаяся при дроблении, непригодна для нормальных ацетиленовых генераторов из-за слишком энергической реакции с водой, перегрева и опасности взрыва.
Зависимость удельного веса технического карбида кальция от содержания в нем СаС2, приведена в таблице ниже:
| Содержание СаС2 в техническом карбиде, % | 80 | 75 | 70 | 65 | 60 | 55 |
|---|---|---|---|---|---|---|
| Удельный вес технического карбида | 2,32 | 2,37 | 2,41 | 2. 45 45 | 2,49 | 2,53 |
Технический карбид кальция, получаемый в электропечах, содержит ряд примесей, попадающих в него из исходных материалов, которыми пользуются при его производстве. Средний химический состав применяемого для сварки:
| Компонент | Содержание, % (по массе) |
|---|---|
| Карбид кальция (СаС2) | 72,5 |
| Известь (СаО) | 17,3 |
| Окись магния (MgO) | 0,4 |
| Окись железа (Fe2O3) и окись алюминия (Al2O3) | 2,5 |
| Окись кремния (SiO2) | 2,0 |
| Сера (S) | 0,3 |
| Углерод (С) | 1,0 |
| Другие примеси | 4,0 |
Как видно из приведенного состава, основной примесью является известь.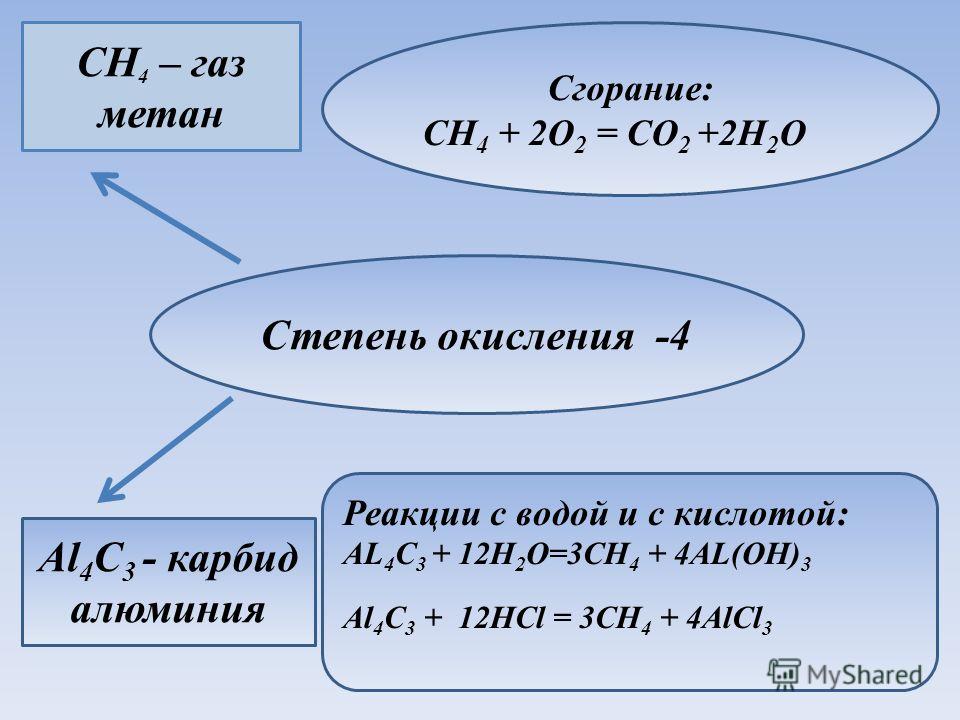
Примеси, содержащиеся в исходных материалах, применяемых для производства, ухудшают его качество. Особенно вредными примесями являются фосфор и сера, которые переходят в карбид кальция в виде фосфористых и сернистых соединений кальция, а при разложении карбида попадают в ацетилен в виде фосфористого водорода и сероводорода.
Гидролиз или карбид кальция плюс вода
При взаимодействии карбида кальция и воды происходит реакция, которая называется гидролиз. Когда-то гидролиз карбида кальция был основным промышленным способом для получения ацетилена — горючего газа, применяемого при газовой сварке и газовой резке. Еще об одном способе получения можно узнать из статьи о получении ацетилена.
При взаимодействии карбида кальция (CaC2) с водой (H2O) получается газ — ацетилен (C2H2) и гашеная известь (Ca(OH)2), являющаяся отходом. Химическая активность карбида кальция по отношению к воде столь велика, что он разлагается даже кристаллизационной водой, содержащейся в солях.
Экзотермическая реакция (т.е. с выделением тепла) взаимодействия карбида кальция с водой протекает бурно по уравнению:
CaC2+2H2O=C2H2+Ca(OH)2 +30,4 ккал/моль
Тепловой эффект реакции слагается из тепла, выделяемого при взаимодействии с водой карбида кальция и негашеной извести. Взаимодействие извести с водой протекает по уравнению:
СаО+H2O = Ca(OH)2 +15,2 ккал/моль
- Выход ацетилена
- объем ацетилена в литрах, выделяемый при разложении 1 кг карбида, приведенный к 20° и 760 мм рт. ст.
Для разложения 1 кг химически чистого карбида кальция теоретически необходимо 0,562 кг воды, при этом получается 0,406 кг ацетилена (285 л) и 1,156 кг гашеной извести.
Значительный тепловой эффект реакции карбида кальция и опасность перегрева ацетилена заставляют вести процесс с большим избытком воды для охлаждения. Это делает процесс более безопасным. Температура выходящего из генератора ацетилена при этом превышает температуру окружающей среды всего на 10-15°С.
Количество воды необходимое для реакции с карбидом кальция
Минимальное количество воды, необходимое для охлаждения при реакции 1 кг карбида кальция, может быть рассчитано следующим образом.
При разложении 1 кг 70%-го карбида кальция образуется 0,284 кг ацетилена и 1,127 кг гидрата окиси кальция т.е. гашеной извести (принимая содержание окиси кальция в карбиде кальция равным 24%).
Принимаем, что начальная температура воды равна 15° С, а температура в генераторе во время работы равна 60° С. Уравнение теплового баланса для 1 кг карбида кальция выражается следующим образом:
q=q1+q2+q3+q4+q5
где q — количество тепла, выделяющееся при разложении 1 кг 70%-го карбида кальция, равное 397 ккал/кг
q1 — количество тепла, затрачиваемое на нагревание получаемой гашеной извести с 15 до 60°С:
q1= 1,127?(60-15)-0,23= 11,7 ккал
0,23 — средняя теплоемкость гидрата окиси кальция в ккал/кг
q2 — количество тепла, затрачиваемое на нагревание получаемого ацетилена с 15 до 60° С:
q2=0,284?(60-15)-0,336 = 4,3 ккал
0,336 — средняя теплоемкость 1 кг ацетилена в ккал в указанном интервале температур
q3 — тепло, затрачиваемое на испарение воды в количестве 0,034 кг (при 60° С содержание водяных паров, насыщающих ацетилен, полученный из 1 кг карбида кальция, равно 34 г) скрытая теплота парообразования воды — 539 ккал/кг
q3 = 0,034?539+0,034?1?(60-15) -19,9 ккал
q4 — потеря тепла в окружающую среду и на нагревание стенок генератора, она составляет примерно 7% от общего количества выделяющегося тепла:
q4=397?7/100=27,8 ккал
q5 — количество тепла, расходуемое на нагревание воды до температуры 60° С:
q5=q?(q1+q2+q3+q4)=397?(11,7+4,3+19,9+27,8) = 336,3 ккал
Искомый минимальный безопасный объем воды равен:
V=q5/(60-15)?1=336,3/45?7,5 л
Так как 1 м3 ацетилена при абсолютном давлении 1 кгс/мм2 и 20°С весит 1,09 кг, следовательно, из 1 кг химически чистого карбида кальция теоретически можно получить 0,406/1,09 = 0,3725 м3, или 372,5 л ацетилена.
Как уже говорилось выше, технический карбид кальция обычно содержит не более 70-80% CaC2. Поэтому из 1 кг технического карбида кальция можно получить от 230 до 280 л ацетилена.
Если учесть потери ацетилена на растворение в воде и продувку ацетиленового генератора, то для получения 1 м3 (1000 дм3) ацетилена практически приходится расходовать 4,3-4,5 кг карбида кальция. Более точные данные о фактическом выходе ацетилена в зависимости от количества примесей (сорта) и размеров «кусков» (грануляции) указаны в ГОСТ 1460.
Параметры влияющие на скорость реакции с водой
Чем меньше размеры кусков, тем быстрее происходит реакция карбида кальция с водой.
Карбид кальция размером 50?80 мм разлагается полностью в течение 13 мин, а размером 8?15 мм — в течение 6,5 мин.
При величине кусков менее 2 мм карбид кальция считается отходом и называется карбидной пылью. Карбидная пыль разлагается практически мгновенно. При взаимодействии с водой реакция карбидной пыли происходит на поверхности воды и выделяемое тепло не может быть быстро отведено. Это приводит к повышению температуры в зоне реакции и перегреву частиц карбида и выделяющегося ацетилена. При этом особенно опасно присутствие воздуха, так как быстро достигается температура воспламенения ацетилено-воздушной смеси. Поэтому карбидную пыль нельзя применять в обычных ацетиленовых генераторах, рассчитанных для работы на кусковом карбиде кальция, так как это может вызвать взрыв ацетилена в генераторе. Для разложения карбидной пыли применяют генераторы специальной конструкции.
Это приводит к повышению температуры в зоне реакции и перегреву частиц карбида и выделяющегося ацетилена. При этом особенно опасно присутствие воздуха, так как быстро достигается температура воспламенения ацетилено-воздушной смеси. Поэтому карбидную пыль нельзя применять в обычных ацетиленовых генераторах, рассчитанных для работы на кусковом карбиде кальция, так как это может вызвать взрыв ацетилена в генераторе. Для разложения карбидной пыли применяют генераторы специальной конструкции.
Чем выше температура воды, тем быстрее идет реакция карбида кальция. Если вода сильно загрязнена гашеной известью, образующейся при реакции карбида кальция, то реакция замедляется.
При разложении неподвижного карбида кальция в недостаточном количестве воды куски его могут покрываться коркой гашеной извести и сильно перегреваться, при этом может иметь место реакция:
СаС2+Ca(ОН)2 = C2H2+2СаО
В этом случае реакция карбида кальция происходит за счет отнятия влаги, содержащейся в гашеной извести. В результате повышается плотность корки, что приводит к еще большему перегреву. Поэтому непрерывное удаление извести из зоны реакции имеет большое значение, так как перегрев может привести к взрыву ацетилено-воздушной смеси или вызвать взрывчатый распад ацетилена.
В результате повышается плотность корки, что приводит к еще большему перегреву. Поэтому непрерывное удаление извести из зоны реакции имеет большое значение, так как перегрев может привести к взрыву ацетилено-воздушной смеси или вызвать взрывчатый распад ацетилена.
Если производить разложение одинаковых количеств карбида кальция различными постепенно уменьшающимися количествами воды, то температура получаемой смеси ацетилен — водяной пар будет соответственно повышаться. При температуре около 90°С почти все тепло (за исключением тепла, затрачиваемого на нагревание ацетилена и карбидного ила) расходуется на образование водяного пара. Эти условия реакции соответствуют процессу, при котором получается сухой гидрат окиси кальция, поскольку вся вводимая в реакцию вода расходуется на разложение карбида и образование водяного пара.
При погружении карбида кальция в воду процесс разложения протекает также весьма неравномерно: вначале реакция идет очень активно с бурным выделением ацетилена, а затем скорость реакции уменьшается. Это объясняется уменьшением поверхности кусков и тем, что они покрываются коркой извести, препятствующей свободному доступу воды.
Это объясняется уменьшением поверхности кусков и тем, что они покрываются коркой извести, препятствующей свободному доступу воды.
При перемешивании воды с находящимся в ней карбидом кальция реакция происходит быстрее и равномернее.
Скорость реакции карбида кальция в воде зависит от чистоты карбида кальция и поверхности соприкосновения кусков карбида кальция с водой.
Скорость реакции карбида кальция в воде является весьма важным элементом, характеризующим качество карбида кальция. Для практических целей пользуются понятием продолжительности разложения.
Продолжительностью разложения считают время, в течение которого выделяется 98% от всего количества ацетилена, который может быть выделенным из карбида кальция, так как остаток разлагается очень медленно и не характеризует процесс разложения применительно к условиям работы ацетиленовых генераторов.
В таблице ниже приведены экспериментальные данные о продолжительности разложения карбида кальция в зависимости от размеров его кусков.
| Размеры кусков, мм | Пыль | 2/4 | 5/8 | 8/15 | 15/25 | 25/50 | 50/80 |
|---|---|---|---|---|---|---|---|
| Продолжительность разложения, мин. | Несколько секунд | 1,17 | 1,65 | 1,82 | 4,23 | 13,5 | 16,6 |
Следует, оговорить, что данные таблицы характеризуют лишь те образцы карбида кальция, с которыми были проведены опыты. Практически могут иметь место значительные отклонения, главным образом в сторону уменьшения скорости реакции.
Скорость разложения в значительной степени зависит от выхода ацетилена из карбида кальция. Чем ниже выход, тем меньше скорость реакции.
На диаграмме ниже показаны изменения в скорости разложения карбида кальция двух сортов с одинаковыми размерами кусков (25/50).
При разложении 1 кг карбида кальция с выходом ацетилена 263 л/кг за первые 3 минуты выделяется 220 л ацетилена, а соответственно при выходе 226 л/кг — только 150 л.
Карбид кальция плюс азот
При температуре 1000°С карбид кальция, взаимодействуя с азотом, образует цианамид кальция. Уравнение реакции имеет следующий вид:
CaC2+N2=CaCN2+C
Эта реакция используется для промышленного производства цианамида кальция. Цианамид кальция применяется в качестве удобрения и как исходный продукт для получения цианидов.
Карбид кальция плюс водород
С водородом карбид кальция вступает в реакцию при температуре выше 2200°С с образованием ацетилена и металлического кальция. При высокой температуре карбид кальция восстанавливает большинство окислов металлов.
Хранение карбида кальция
После того как был получен карбид кальция хранение его допускается в специальных герметичных барабанах и специально оборудованных помещениях, но все это уже рассмотрено в статье о том, где и как хранить карбид кальция.
Что такое карбид кальция и какой газ он выделяет?
Карбид кальция – соединение кальция с углеродом, представляющее собой твердое кристаллическое вещество. Его получают путем сплавления оксида кальция с коксом в электрических печах (при температурах 1900-1950°С) и последующего затвердевания в специальных формах (изложницах), дробления и сортирования на куски определенных размеров (мелкого, среднего и крупного).
Его получают путем сплавления оксида кальция с коксом в электрических печах (при температурах 1900-1950°С) и последующего затвердевания в специальных формах (изложницах), дробления и сортирования на куски определенных размеров (мелкого, среднего и крупного).
Таким образом происходит образования технического продукта с грязной темно-серой или коричневой окраской из-за 20-25 % содержания примесей (угля и других красящих веществ). Кроме того, в его составе присутствуют сульфид и фосфид кальция, из-за которых материал имеет неприятный запах.
Хорошо поглощает воду и при взаимодействии с ней даже при низких температурах разлагается и бурно выделяет газ ацетилен (acetylene gas) с большим количеством тепла. Разложение вещества может спровоцировать даже атмосферная влага.
Область применения
Карбид кальция (Calcium carbide) используется для получения цианамида кальция (методом реакции с азотом), из которого синтезируют цианистые соединения и удобрения, производства карбидно-карбамидных регуляторов роста растений и карбидного порошкового реагента.
Без этого вещества не обходится и проведение автогенных работ и освещения, изготовление ацетиленовой сажи и других материалов: синтетического каучука, алконитрила, стирола, винилхлорида, уксусной кислоты, хлорпроизводных ацетилена, искусственных смол, этилена, ацетона и др. Также оно применяется в процессе газосварки, производстве карбидных ламп.
Из специальной фракции calcium carbide (прошедшей переработку с применением отходов и некондиционного сырья) путем реакции с водой получают газ ацетилен и побочный продукт – гашеную известь. Эта процедура сопровождается выделением значительного количества тепла. Объем получаемого газа зависит от чистоты карбида кальция (чем чище материал, тем больше выйдет ацетилена) и варьируется в пределах 235-285 л от 1 кг карбида.
Теоретически для разложения 1 кг calcium carbide требуется 0,56 л воды, но на практике используют от 5 до 26 л жидкости, чтобы лучше охладить ацетилен и обеспечить безопасность процесса. Быстрота разложения будет зависеть от грануляции и чистоты исходного материала, а также от температуры и чистоты воды (чем чище и меньше размер, больше температура, тем выше скорость реакции).
Можно ли тушить водой карбид кальция?
Calcium carbide является негорючим продуктом, но выделяющийся при его разложении ацетилен взрыво- и пожароопасен. Он легко воспламеняется даже при кратковременном контакте с воздухом и обладает способностью самовоспламеняться даже в чистом виде. Он также легко вступает в реакцию с солями меди, серебра и ртути с образованием нестойких взрывчатых ацетеленидов. Обладает наркотическим действием, обусловленным фосфористым водородом в его составе.
Реагент ни в коем случае не разрешается тушить водой! При попадании жидкости в емкости с веществом возможны взрывы. Для тушения следует применять сухие порошковые огнетушители, сухой песок, углекислоту, асбестовое полотно.
Ацетилен легче воздуха, поэтому возможно его накопление в высших точках слабовентилируемых помещений.
Меры безопасности и хранение
Calcium carbide относится к 1 классу опасности по степени воздействия на организм. Его пыль раздражающе действует на кожные покровы, слизистые оболочки и дыхательные пути. Реагент очень опасен при вдыхании (симптомы: прерывистое дыхание, кашель, насморк, чувство удушья, отек легких), попадании на кожные покровы (получение ожогов, язв) и в глаза (резь, слезотечение, отек век).
Реагент очень опасен при вдыхании (симптомы: прерывистое дыхание, кашель, насморк, чувство удушья, отек легких), попадании на кожные покровы (получение ожогов, язв) и в глаза (резь, слезотечение, отек век).
При применении материала необходимо использовать специальную защитную одежду, противогаз, перчатки и специальную обувь. Работать только в хорошо проветриваемых помещениях. В случае попадания на кожу промыть пораженное место большим количеством воды, смазать жирным кремом и вызвать врача.
Хранить в герметичных тарах в вертикальном положении (не более, чем в 3 ряда) в несгораемых, хорошо вентилируемых складах или на открытых площадках под навесом, защищающих от воздействия влаги. Не допускается совместное хранение с другими веществами. Срок годности – 6 месяцев с даты производства.
Где купить?
Мы предлагаем высококачественные химпрепараты по самой выгодной стоимости. Чтобы заказать такие товары у нас, просто нажмите на соответствующую кнопку возле изображения продукта и введите ваши контакты. Мы свяжемся с вами в ближайшее время.
Мы свяжемся с вами в ближайшее время.
Химические характеристики карбида кальция и его реакция с водой
Похоже, вы зашли на наш сайт из
Германия .
Пожалуйста, перейдите на наш региональный сайт для получения более актуальных цен, сведений о продуктах и специальных предложениях.
Выбрать другую страну
Почему так бодро?
[Депозитные фотографии]
Карбид кальция представляет собой химическое соединение кальция и углерода и в чистом виде представляет собой белое кристаллическое вещество. Его получают по реакции
Ca + 2C → CaC₂
Карбид кальция
[Викимедиа]
Карбид кальция имеет большое практическое значение. Он также известен как ацетилид кальция.
Он также известен как ацетилид кальция.
Химические характеристики карбида кальция
Карбид кальция не летуч и не растворим ни в одном известном растворителе и реагирует с водой с образованием газообразного ацетилена и гидроксида кальция. Его плотность составляет 2,22 г/см³. Температура плавления 2160°С, температура кипения 2300°С. Поскольку ацетилен, образующийся при контакте с водой, легко воспламеняется, вещество отнесено к классу опасности 4.3.
Ацетилид кальция был впервые получен немецким химиком Фридрихом Вёлером в 1862 году при нагревании сплава цинка и кальция с углем. Ученый описал реакцию карбида кальция с водой. Карбид кальция энергично реагирует даже со следами Н₂O, выделяя большое количество тепла. При недостаточном количестве воды образующийся ацетилид самопроизвольно воспламеняется. Ацетилид кальция бурно реагирует с водными растворами щелочей и разбавленными неорганическими кислотами. Эти реакции высвобождают ацетилид. Благодаря своим сильным восстановительным свойствам CaC₂ восстанавливает все оксиды металлов до чистых металлов или превращает их в карбиды.
Легче получить карбид кальция из его оксида, чем из самого кальция, так как оксид восстанавливается при температуре выше 2000 °C. Соединение металла и углерода:
CaO + 3C → CO↑ + CaC₂
Реакция происходит в электродуговой печи, где нагревается смесь негашеной извести и кокса или антрацита. Технический продукт имеет серый цвет из-за наличия свободного углерода, оксида кальция, фосфида, сульфида и других химических соединений. CaC₂ составляет 80-85% продукта по массе.
Использование карбида кальция
В прошлом карбид кальция использовался в карбидных лампах, где он служил источником ацетиленового пламени. В настоящее время эти лампы все еще используются для питания маяков и маяков, а также при исследовании пещер. CaC₂ также служит сырьем для разработки химических технологий, прежде всего синтетического каучука. Карбид кальция также используется для производства винилхлорида, ацетиленовой сажи, акрилонитрила, уксусной кислоты, ацетона, этилена, стирола и синтетических смол.
Старая шахтерская карбидная лампа
[Депозитные фотографии]
В металлургии карбид кальция применяют для раскисления металлов и снижения содержания в них кислорода и серы (десульфурация). Карбид кальция используется для производства порошкообразного карбида, регулятора роста растений. Для получения одной тонны CaC₂ требуется 3000 кВт/ч электроэнергии. По этой причине производство вещества рентабельно только при низких затратах на электроэнергию. В то же время производство карбида кальция во всем мире постоянно увеличивается.
Карбид кальция – реакция с водой
При реакции карбида кальция с водой выделяется ацетилен:
2H₂O + CaC₂ → C₂H₂↑ + Ca(OH)₂
Ацетилен – промышленное вещество с неприятным запахом содержащимися в нем примесями (NH₃, H₂S, PH₃ и др.). В чистом виде ацетилен представляет собой бесцветный газ с характерным слабым запахом, растворяется в воде.
Сварщик с ацетиленовой горелкой
[Депозитные фотографии]
Чтобы продемонстрировать реакцию карбида кальция с водой, можно использовать простой опыт: налить воду в бутыль объемом 1,5 л, быстро добавить несколько кусочков карбида кальция и закрыть бутыль пробкой. В результате последующей реакции между карбидом кальция и водой ацетилен накапливается в бутылке по мере роста давления. Как только реакция прекратится, поместите в бутылку горящую бумажку – это должно вызвать взрыв, сопровождаемый огненным облаком. Поскольку в результате реакции стенки бутылки могут лопнуть, этот эксперимент опасен и должен проводиться только при строгом соблюдении техники безопасности.
Внимание! Не пытайтесь проводить эти эксперименты без профессионального присмотра! Посмотрите здесь эксперименты с пламенем, которые вы можете безопасно проводить дома
Чтобы продемонстрировать реакцию карбида кальция с водой, эксперимент можно повторить в модифицированном виде – с шестилитровой бутылью. При этом компоненты необходимо взвешивать с точностью, ведь чем больше радиус бутылки, тем меньше емкость выдерживает высокое давление (при условии одинакового материала и толщины стенок). Бутылка большой емкости имеет большой радиус, но стенки у нее примерно такие же — соответственно, она менее устойчива к давлению. Чтобы он не взорвался, необходимо заранее рассчитать количество карбида кальция. Молярная масса кальция составляет 40 г/моль, а углерода — 12 г/моль, поэтому молярная масса карбида кальция составляет около 64 г/моль. Соответственно, из 64 г карбида получится 22,4 л ацетилена. Объем баллона 6 л, а давление поднялось примерно на 4 атмосферы.
При этом компоненты необходимо взвешивать с точностью, ведь чем больше радиус бутылки, тем меньше емкость выдерживает высокое давление (при условии одинакового материала и толщины стенок). Бутылка большой емкости имеет большой радиус, но стенки у нее примерно такие же — соответственно, она менее устойчива к давлению. Чтобы он не взорвался, необходимо заранее рассчитать количество карбида кальция. Молярная масса кальция составляет 40 г/моль, а углерода — 12 г/моль, поэтому молярная масса карбида кальция составляет около 64 г/моль. Соответственно, из 64 г карбида получится 22,4 л ацетилена. Объем баллона 6 л, а давление поднялось примерно на 4 атмосферы.
Бутылка должна выдерживать пять атмосфер: для проведения эксперимента берем около 64 г карбида кальция и около 0,5 л воды. Поместите кусок карбида в небольшой пакет. Вставьте пакет в бутылку, затем быстро закройте бутылку пробкой. Реакция карбида кальция с водой продолжается несколько минут, бутылка вздувается и процесс сопровождается громкими хлопками, но бутылка должна это выдержать.
Шариковая модель молекулы ундекана
[Викимедиа]
После завершения выпуска ацетилена положите горячую тряпку, смоченную гендеканом, на пробку бутылки, затем отойдите на максимально безопасное расстояние. Вскоре вы увидите яркую желтую вспышку, а из бутылки поднимется фонтан пламени высотой до 4 метров. Это сожжет пробку и деформирует бутылку, но бутылка должна остаться целой. Этот эксперимент необходимо проводить на открытом воздухе, вдали от легковоспламеняющихся и взрывоопасных предметов. Обязательно соблюдайте все соответствующие меры предосторожности.
У нас есть для вас еще статьи по химии:
- Поддельный химический разрез
Как сделать искусственную кровь - Как подводная лодка поднимается и тонет
Как работает подводная лодка?
Вы можете провести десятки химических опытов дома!
Почему такой синий?
Учить больше
Попытайся
К взаимодействию карбида кальция с водой при газохроматографическом определении следовых количеств влаги в аммиаке сверхвысокой чистоты
. 2018 27 июля; 1560: 71-77.
2018 27 июля; 1560: 71-77.
doi: 10.1016/j.chroma.2018.05.028.
Эпаб 2018 16 мая.
Трубянов Максим М
1
, Георгий М Мочалов
2
, Сергей Суворов
3
, Егор С Пузанов
2
, Петухов Антон Н
2
, Илья В Воротынцев
2
, Воротынцев Владимир Михайлович
2
Принадлежности
- 1 Лаборатория мембранных и каталитических процессов, кафедра нанотехнологий и биотехнологий, Нижегородский государственный технический университет им. Р.Э. Алексеев, ул. Минина, 24, 603950, Нижний Новгород, Российская Федерация.
 Электронный адрес: [email protected].
Электронный адрес: [email protected]. - 2 Лаборатория мембранных и каталитических процессов, кафедра нанотехнологий и биотехнологий, Нижегородский государственный технический университет им. Р.Э. Алексеев, ул. Минина, 24, 603950, Нижний Новгород, Российская Федерация.
- 3 Фирма ХОРСТ ООО, 117534, г. Москва, ул. Академика Янгеля, 14-2-257.
PMID:
29778446
DOI:
10.1016/j.chroma.2018.05.028
Максим М. Трубянов и др.
Ж Хроматогр А.
.
. 2018 27 июля; 1560: 71-77.
2018 27 июля; 1560: 71-77.
doi: 10.1016/j.chroma.2018.05.028.
Эпаб 2018 16 мая.
Авторы
Трубянов Максим М
1
, Георгий М Мочалов
2
, Сергей Суворов
3
, Егор С Пузанов
2
, Антон Петухов
2
, Илья В Воротынцев
2
, Воротынцев Владимир Михайлович
2
Принадлежности
- 1 Лаборатория мембранных и каталитических процессов, кафедра нанотехнологий и биотехнологий, Нижегородский государственный технический университет им. Р.
 Э. Алексеев, ул. Минина, 24, 603950, Нижний Новгород, Российская Федерация. Электронный адрес: [email protected].
Э. Алексеев, ул. Минина, 24, 603950, Нижний Новгород, Российская Федерация. Электронный адрес: [email protected]. - 2 Лаборатория мембранных и каталитических процессов, кафедра нанотехнологий и биотехнологий, Нижегородский государственный технический университет им. Р.Э. Алексеев, ул. Минина, 24, 603950, Нижний Новгород, Российская Федерация.
- 3 Фирма ХОРСТ ООО, 117534, г. Москва, ул. Академика Янгеля, 14-2-257.
PMID:
29778446
DOI:
10.1016/j.chroma.2018.05.028
Абстрактный
Текущее исследование сосредоточено на процессах, происходящих во время проточной конверсии воды в ацетилен в реакционной ячейке с карбидом кальция для анализа следовых количеств влаги в аммиаке с помощью реакционной газовой хроматографии. Предложены и обсуждены факторы, негативно влияющие на воспроизводимость и точность измерений. Было обнаружено, что внутримолекулярная реакция промежуточного продукта HOCaCCH является побочной реакцией с образованием фонового ацетилена во время контакта влажного газообразного аммиака с карбидом кальция. Присутствие промежуточного продукта HOCaCCH среди продуктов реакции подтверждается ИК-Фурье-спектральным исследованием порошка карбида кальция, подвергнутого воздействию влажного газа. Кинетика побочных реакций оценивается экспериментально и обсуждается ее влияние на результаты газохроматографических измерений в связи с определением оптимальных рабочих параметров анализа аммиака. Метод реакционной газовой хроматографии для измерения следовых количеств влаги в матрице аммиака был экспериментально сравнен с методом ИК-Фурье-спектрометра с газовой ячейкой с длинным оптическим путем для оценки ограничений точности и ресурсоемкости.
Предложены и обсуждены факторы, негативно влияющие на воспроизводимость и точность измерений. Было обнаружено, что внутримолекулярная реакция промежуточного продукта HOCaCCH является побочной реакцией с образованием фонового ацетилена во время контакта влажного газообразного аммиака с карбидом кальция. Присутствие промежуточного продукта HOCaCCH среди продуктов реакции подтверждается ИК-Фурье-спектральным исследованием порошка карбида кальция, подвергнутого воздействию влажного газа. Кинетика побочных реакций оценивается экспериментально и обсуждается ее влияние на результаты газохроматографических измерений в связи с определением оптимальных рабочих параметров анализа аммиака. Метод реакционной газовой хроматографии для измерения следовых количеств влаги в матрице аммиака был экспериментально сравнен с методом ИК-Фурье-спектрометра с газовой ячейкой с длинным оптическим путем для оценки ограничений точности и ресурсоемкости.
Ключевые слова:
аммиак; карбид кальция; ИК-Фурье-спектрометрия; Газовая хроматография; кинетика реакции; След воды.
Copyright © 2018 Elsevier B.V. Все права защищены.
Похожие статьи
Усовершенствованный метод газовой хроматографии с обратной продувкой для определения следов постоянных газов и диоксида углерода в аммиаке сверхвысокой чистоты.
Трубянов М.М., Мочалов Г.М., Воротынцев И.В., Воротынцев А.В., Суворов С.С., Смирнов К.Ю., Воротынцев В.М.
Трубянов М.М. и соавт.
J Хроматогр А. 2016 20 мая; 1447: 129-34. doi: 10.1016/j.chroma.2016.04.020. Epub 2016 8 апр.
Ж Хроматогр А. 2016.PMID: 27083259
[Карбид кальция различной формы кристаллов, синтезированный остатком карбида кальция].
Лу З.И., Кан М., Цзян Ч.Р., Ту М.Дж.
Лу Зи и др.
Хуан Цзин Кэ Сюэ. 2006 апр; 27 (4): 775-8.
Хуан Цзин Кэ Сюэ. 2006.
2006.PMID: 16768005
Китайский язык.
Применение пентагидрата сульфата меди в качестве реагента для удаления аммиака для определения следовых примесей в аммиаке методом газовой хроматографии.
Аомура Ю., Кобаяши Ю., Миядзава Ю., Симидзу Х.
Аомура Ю. и др.
J Chromatogr A. 12 марта 2010 г .; 1217 (11): 1838–44. doi: 10.1016/j.chroma.2010.01.039. Epub 2010 20 января.
Дж Хроматогр А. 2010.PMID: 20132934
Аммиак как газ-носитель для кислотно-основной хроматографии.
Березкин В.Г., Алишоев В.Р., Королев А.А., Малюкова И.В.
Березкин В.Г., и соавт.
J Chromatogr A. 2000 Dec;903(1-2):173-81. doi: 10.1016/s0021-9673(00)00885-2.
Дж Хроматогр А. 2000.PMID: 11153939
Карбид кальция: уникальный реагент для органического синтеза и нанотехнологий.



 Электронный адрес:
Электронный адрес:  Э. Алексеев, ул. Минина, 24, 603950, Нижний Новгород, Российская Федерация. Электронный адрес:
Э. Алексеев, ул. Минина, 24, 603950, Нижний Новгород, Российская Федерация. Электронный адрес:  2006.
2006.