Содержание
как получить в домашних условиях?
Существует несколько водородных соединений азота. Наиболее известным и важным является аммиак — NH3. Это бинарное соединение азота с водородом, при нормальных условиях представляющее собой бесцветный газ со специфическим запахом.
Растворяется в воде и спиртах. 18-20%-ный раствор NH3 в воде называют аммиачной водой или водным аммиаком. Это бесцветная или желтоватая прозрачная жидкость с характерным резким запахом, без каких-либо механических примесей.
Известен также другой раствор NH3, с содержанием основного вещества 10 %, именуемый нашатырным спиртом. Очень часто его отождествляют с аммиачной водой, но на самом деле это разные субстанции, отличающиеся концентрацией аммиака и сферой применения.
Получать водный аммиак возможно благодаря тому, что молекула этого газа является высокополярной. Это обусловливает его отличную растворимость в воде (1 объем воды растворяет 700-1200 объемов аммиака), а также сравнительную простоту перехода в твердое и жидкое состояния. Но главным образом получение раствора этого вещества осуществляется только в промышленных условиях.
Но главным образом получение раствора этого вещества осуществляется только в промышленных условиях.
Получение аммиачной воды и нашатырного спирта
Водный аммиак получают при взаимодействии сырого коксового газа с водой, конденсирующейся из-за охлаждения газа или специально добавляющейся в него для вымывания NH3. В обоих вариантах получается слабая (скрубберная) аммиачная вода. Ее дистиллируют с водяным паром и последующими конденсацией и дефлегмацией, в результате чего получается концентрированная аммиачная вода с содержанием NH3 18-20 %. Ее применяют для производства азотных удобрений, полимеров, кальцинированной соды, взрывчатых веществ, в качестве хладагента, растворителя, противоморозной добавки, в животноводстве и др.
Из водного аммиака можно получить нашатырный спирт, широко известный в качестве антисептика и возбуждающего средства при обмороках. Для этого доводят концентрацию основного вещества до 10 % путем разбавления водой. Но существует и более короткий и простой метод, применяемый, к примеру, мастерами-холодильщиками.
Они пропускают первый этап и получают нашатырный спирт прямо из аммиака. Для этого шланг с газом помещают в ведро с водой и ждут определенного сигнала – так называемых щелчков, означающих, что реакция завершилась и газ можно перекрывать. Полученный таким образом нашатырный спирт не подходит для использования в химической промышленности и медицине, но может применяться в качестве хладагента.
Существует еще одна разновидность растворов NH3 – аммиак водный ЧДА (чистый для анализа). Он не содержит никаких посторонних примесей и производится с максимально четким соблюдением технологии. Вещество используется в качестве реактива в аналитической химии и медицине. Оно позволяет синтезировать химически чистые вещества в химической отрасли.
Безопасность и хранение
Реагент является трудногорючим, токсичным веществом. По степени воздействия на организм человека относится к 4-му классу опасности. При работе с ним следует использовать защитные перчатки, очки, маску и прорезиненную спецодежду. Работу выполнять только в хорошо вентилируемых помещениях.
Работу выполнять только в хорошо вентилируемых помещениях.
В случае попадания реактива на кожные покровы и слизистые оболочки следует промыть пораженные области большим количеством воды и обратиться к врачу.
Хранить реагент нужно в закрытой упаковке в сухих складских помещениях. Срок годности – 1 год с даты изготовления.
Где приобрести?
Компания «АКВАХИМ» реализуем высококачественную химпродукцию от ведущих производителей России и зарубежья. Заказать у нас просто: нажмите на соответствующую кнопку возле фотографии товара и введите ваше имя, номер телефона и e-mail. Мы свяжемся с вами в рабочее время для обсуждения деталей.
Мария Бурганова
,
25.04.2017 г.
10300
Мониторинг аммиака и аммония в воде 💧
Аммиак используется в качестве реагента и маркерного параметра при контроле качества очистки воды и сточных вод. Узнайте больше про аммиак и аммоний, а также о решениях для их мониторинга.
Узнайте больше про аммиак и аммоний, а также о решениях для их мониторинга.
Что такое аммиак?
Аммиак — это бесцветное, едкое газообразное соединение водорода и азота (один атом азота и три атома водорода, NH3), которое хорошо растворяется в воде.
Аммиак образуется естественным образом как продукт микробиологического разложения азотистых органических веществ (животных и растительных белков). Он также производится для использования в удобрениях в сельскохозяйственном сегменте или для использования в производстве пластмасс, фармацевтических препаратов и прочих химикатов.
Аммиак в грунтовых водах — это нормальное явление ввиду микробиологических процессов. Однако присутствие аммиачного азота в поверхностных водах обычно указывает на бытовое загрязнение. Избыток аммиака наносит вред растительности и невероятно токсичен для водных организмов, особенно при повышенных уровнях pH и температуры.
Аммиачная вода (водный аммиак)
Для различных применений аммиак растворяют в воде для получения «водного аммиака». Водные растворы аммиака (водный аммиак) довольно нестабильны — концентрация аммиака может снизиться во время транспортировки или во время хранения.
Водные растворы аммиака (водный аммиак) довольно нестабильны — концентрация аммиака может снизиться во время транспортировки или во время хранения.
Что такое аммоний?
Аммоний — это соединение, содержащее один атом азота и четыре атома водорода (NH4+). В то время как аммиак представляет собой нейтральную не ионизированную молекулу (слабощелочная), аммоний — это ион, несущий положительный заряд. Кроме того, аммиак издает резкий характерный запах, а вот аммоний совсем не пахнет.
Основным фактором, определяющим соотношение аммиака к аммонию в воде, является водородный показатель pH. На активность аммиака также влияют ионная сила и температура раствора. Важно помнить, что, хотя аммиак вреден для водных организмов, ион аммония в основном безвреден. В водном хозяйстве очень важно знать концентрации связанного с водородом азота. Поэтому термины аммиак и аммоний используются взаимозаменяемо, обозначаются как NH3—N или NH4—N соответственно и обычно выражаются в мг/л или ppm N.
Химическое уравнение, определяющее отношение между аммиаком и аммонием:
NH3 + H2O ↔ NH4+ + ОН—
Когда уровень pH низкий, равновесие смещается вправо, а когда высокий, равновесие смещается влево. Как правило, при комнатной температуре с pH менее 6 доля аммиака-N в виде NH3 очень мала, и почти весь аммиачный азот присутствует в виде NH4+.
При pH около 8 доля NH3 составляет 10 процентов или меньше, а при pH немного выше 9 — около 50 процентов. Как только pH становится > 11, все ионы аммония в растворе будут преобразованы в молекулярную форму аммиака. Активность водного аммиака намного ниже при низких температурах.
Важность контроля аммиака
Аммиак используется и как реагент, и как один из основных параметров при контроле качества очистки воды и сточных вод.
- Контроль концентрации аммиака природного происхождения в исходной воде.

- В процессе дезинфекции хлорамином аммиак соединяется с хлором для очистки питьевой воды и поддержания более длительного остатка в распределительных системах.
- Иногда аммиак используется для контроля pH, например, в фармацевтической промышленности.
- Аммиак особо тщательно контролируется в процессах нитрификации и денитрификации сточных вод.
Хотя в целом аммиак безвреден при низких концентрациях, высокие концентрации могут причинить вред и представлять опасность для здоровья. Следовательно, уровень аммиака необходимо надлежащим образом контролировать и поддерживать в рамках установленных законодательством.
Приборы и реагенты Hach для мониторинга аммиака и аммония в воде
В ассортименте Hach вы найдете испытательное промышленное и лабораторное оборудование, реагенты и программное обеспечение, необходимое для точного контроля и управления уровнями аммиака в любом технологическом процессе.
- Спектрофотометры — компания Hach предлагает ведущие спектрофотометры на рынке анализа воды.

- Колориметры — Простые в использовании, прочные, портативные инструменты Hach созданы для того, чтобы выдерживать уникальные нагрузки, с которыми можно столкнуться в полевых условиях.
- Лабораторный многопараметрический измеритель HQD с ионоселективным электродом для аммиака или аммония. Измерители HQD подключаются к интеллектуальным электродам IntelliCAL, которые автоматически распознают параметр тестирования.
- Портативные измерители HQ — Серия HQ предназначена для электрохимического анализа в полевых и лабораторных условиях.
- Промышленный анализатор аммония Amtax sc — Онлайн-анализатор Hach Amtax sc с газочувствительным электродом разработан для высокоточного определения концентрации аммония непосредственно в процессе обработки (установка вне помещений). Подробнее про анализатор ->
- Анализатор монохлорамина аммиака 5500sc — обеспечивает непрерывный мониторинг, предоставляя вам информацию, необходимую для контроля процесса хлорирования.

- Анализаторы аммония серии EZ — Промышленные онлайн-анализаторы серии EZ предлагают несколько методов для контроля содержания аммония в воде.
- Датчик A-ISE sc — Цифровой ионоселективный датчик A-ISE sc от Hach разработан для определения концентрации аммония непосредственно в среде.
- Датчик AN-ISE sc — погружной датчик Hach AN-ISE sc для аммония и нитратов выполняет непрерывные прямые измерения используя технологию точного ионоселективного электрода.
- Реагенты для определения свободного и общего аммиака — Компания Hach предлагает высококачественные реагенты для рутинного и комплексного анализа ключевых параметров воды.
Компания АкваАналитикс® 💧 является официальными представителем Hach Lange на территории России и стран СНГ. Для получения консультации или подбора лабораторного / промышленного оборудования для контроля аммиака на вашем предприятии или в лаборатории, свяжитесь с нами удобным для вас способом.
Представительство в России: +7 (495) 201-53-02 [email protected]
Представительство в Узбекистане: +998 (90) 174-57-84 [email protected]
Предыдущая статья
Следующая статья
Последние новости
Статьи
Особенности и различия спектрофотометров серии DR
Читать далее
Статьи
Выбор фильтровальной ткани для фильтр-пресса
Читать далее
Статьи
Использование спектрофотометра для анализа ХПК
Читать далее
Статьи
Контроль качества воды в прудах для разведения рыбы
Читать далее
Статьи
Органолептические показатели питьевой воды
Читать далее
Статьи
Аудит кислорода на пивоваренных производствах
Читать далее
Статьи
Окислительно восстановительный потенциал воды
Читать далее
Статьи
Методы определения концентрации железа в воде
Читать далее
Статьи
Как интерпретировать результаты тест-полосок на хлор
Читать далее
Статьи
Что такое титрование и для чего оно используется?
Читать далее
Статьи
Методы определения концентрации хлора в воде
Читать далее
Роль и опасность аммиака в поверхностных водах Подземные воды
Азот является важным питательным веществом, которое требуется всем растениям и животным для формирования
аминокислот. В своей молекулярной форме (N 2 ) азот не может использоваться большинством водных организмов.
В своей молекулярной форме (N 2 ) азот не может использоваться большинством водных организмов.
растений, поэтому его необходимо преобразовать в другую форму, прежде чем его можно будет использовать. Одна такая форма
представляет собой аммиак (NH 3 ). Аммиак может поглощаться растениями или окисляться бактериями до нитратов.
(№ 3 – ) или нитрит (№ 2 – ).
Аммиак (NH 3 ) представляет собой бесцветный газ с сильным резким запахом. Аммиак реагирует с
вода с образованием слабого основания (NH 4 OH —> NH 4 + + OH — ).
термин аммиак относится к двум формам азота, которые находятся в равновесии в воде, неионизированный
аммиак (NH 3 ) и ионизированный ион аммония (NH 4 + ). Тесты для
аммиака обычно измеряют общее количество аммиака (NH 3 плюс NH 4 + ) содержание.
Токсичность аммиака в первую очередь связана с неионизированной формой (NH 3 ), т. к.
к.
в отличие от ионизированной формы (NH 4 + ). В общем, больше NH 3 и
большая токсичность существует при более высоких значениях pH.
При растворении в воде обычный аммиак (Nh4) вступает в реакцию с образованием ионизированных соединений, называемых аммонием.
(NH 4 + ):
NH 3 + H 2 O ↔ NH 4 + + OH –
Это сокращенный способ сказать, что одна молекула аммиака реагирует с одной молекулой воды с образованием одного иона аммония и одного гидроксильного иона. По двунаправленной стрелке мы можем сказать, что реакция может идти в любом направлении, и ионы гидроксила и ионы аммония могут объединяться с образованием аммиака и воды. Именно это и происходит при увеличении pH воды, то есть вода становится более щелочной. Вы можете вспомнить, что щелочность вызвана увеличением гидроксильных ионов. Увеличение гидроксильных ионов (или щелочности) сдвигает равновесие влево и образуется больше неионизированного аммиака.
В любой момент времени будут присутствовать как молекулы аммиака, так и ионы аммония. Количество каждого вида зависит как от pH, так и от температуры.
Резюме: Аммиак существует в воде в двух формах:
NH 3 (это называется неионизированным аммиаком)
NH 4
9 )
Вместе эти две формы аммиака называются TAN, что означает общий аммиачный азот.
NH 3 является основной формой токсичного аммиака. Сообщается, что он токсичен для пресной воды.
организмов в концентрациях от 0,53 до 22,8 мг/л. Токсичными уровнями являются как pH, так и
зависит от температуры. Токсичность увеличивается по мере увеличения pH и температуры. Растения более
устойчивы к аммиаку, чем животные, а беспозвоночные более устойчивы, чем рыбы. Вылупление и
темпы роста рыб могут быть затронуты. Во время структурного развития воздействие аммиака может
изменяют или изменяют нормальное развитие тканей в жабрах, печени и почках. Токсичные концентрации
Токсичные концентрации
аммиак у человека может вызвать потерю равновесия, судороги, кому и смерть.
Уровни аммиака, превышающие рекомендуемые пределы, могут нанести вред водным обитателям. Токсичность аммиака считается одной из основных причин необъяснимых потерь в рыбоводных хозяйствах. Хотя молекула аммиака является питательным веществом, необходимым для жизни, избыток аммиака может накапливаться в организме и вызывать изменение метаболизма или повышение pH тела. Разные виды рыб могут переносить разные уровни аммиака, но в любом случае чем меньше, тем лучше. Мальки радужной форели могут выдерживать концентрацию до 0,2 мг/л, в то время как гибридный полосатый окунь может выдерживать концентрацию до 1,2 мг/л.
Рыбы могут страдать от потери равновесия, повышенной возбудимости, повышенной дыхательной активности и потребления кислорода, а также учащенного сердцебиения. При экстремальном уровне аммиака у рыб могут возникнуть судороги, кома и смерть. Опыты показали, что смертельная концентрация для различных видов рыб колеблется от 0,2 до 2,0 мг/л. Форель кажется наиболее восприимчивой к этой рыбе, а карп наименее восприимчивой.
Форель кажется наиболее восприимчивой к этой рыбе, а карп наименее восприимчивой.
При более высоких уровнях (> 0,1 мг/л NH 3 ) даже относительно короткое воздействие может привести к
поражение кожи, глаз и жабр. Слегка повышенный уровень аммиака, попадающий в допустимый диапазон
может негативно повлиять на водную жизнь. Рыба может столкнуться со снижением успешности вылупления, снижением
скорости роста и морфологического развития, а также повреждения жаберной ткани (т. е. гиперплазия), печени,
и почки. Гиперплазия – жаберные лепестки набухают и слипаются, что снижает
способность «дышать».
Повышенный уровень также может привести к отравлению аммиаком из-за подавления нормального выделения аммиака из жабр. Если рыба не может выделять этот продукт обмена веществ, уровень аммиака в крови повышается, что приводит к повреждению внутренних органов. Реакция рыб на токсичные уровни аммиака будет вялостью, потерей аппетита, лежанием на дне пруда с прижатыми плавниками или задыханием у поверхности воды, если поражены жабры. К сожалению, эта реакция аналогична реакции на плохое качество воды, заражение паразитами и другие заболевания.
К сожалению, эта реакция аналогична реакции на плохое качество воды, заражение паразитами и другие заболевания.
Эксперименты показали, что воздействие неионизированного аммиака в концентрации всего 0,002 мг/л в течение шести недель вызывает гиперплазию жаберной оболочки у мальков лосося и может привести к бактериальному заболеванию жабр.
Новости комплексного управления растениеводством | Комплексное управление растениеводством
You are here
Home » Интегрированное управление растениеводством » Интегрированное управление растениеводством Новости
1 мая 2008 г.
Марк Ханна, Департамент сельскохозяйственной и биосистемной инженерии
Многие операторы сеялок в Айове этой весной столкнулись с влажной почвой. Операторы захотят дождаться подходящих условий, чтобы избежать «засорения» урожая значительными затратами на семена, удобрения, технику и время.
29 апреля 2008 г.
Боб Харцлер, Департамент агрономии
2,4-Д обычно добавляют к глифосату для сжигания существующей растительности на полях с нулевой обработкой почвы. К преимуществам включения 2,4-Д относятся:
К преимуществам включения 2,4-Д относятся:
29 апреля 2008 г.
Стивен К. Барнхарт, Департамент агрономии
Весенний посев сена и пастбищ обычно проводится в Айове с конца февраля до конца апреля. Затянувшийся период дождливой погоды в 2008 году заставил многих производителей все еще ждать начала посевных работ.
Могут ли они по-прежнему успешно сажать кормовые культуры?
29 апреля 2008 г.
Стивен К. Барнхарт, профессор кафедры агрономии
В настоящее время в Айове очевидны значительные площади вымерзшей люцерны. Худшие районы находятся вдоль коридора шоссе 20 на востоке и северо-востоке Айовы, с заметными потерями до границы с Миннесотой в Айове, а также в случайных полях в других частях штата. Замерзшая ткань кроны люцерны и верхнего стержневого корня не способна восстановиться. Доказательства травмы были задержаны, потому что некоторые растения начали зеленеть, а затем погибли.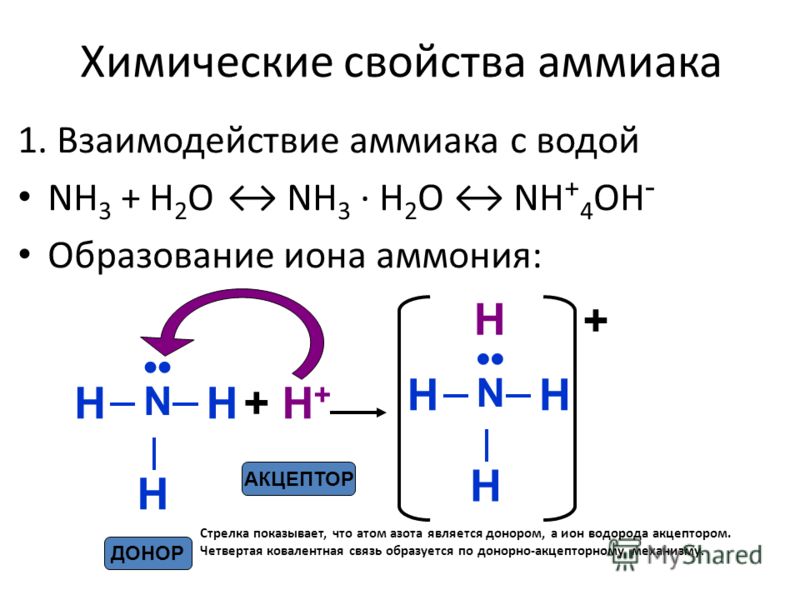 Растения, которые все еще демонстрируют хорошую ткань стержневого корня и кроны, скорее всего, не пострадают.
Растения, которые все еще демонстрируют хорошую ткань стержневого корня и кроны, скорее всего, не пострадают.
25 апреля 2008 г.
Кристин Шефер, Департамент энтомологии
Департамент сельского хозяйства и управления земельными ресурсами штата Айова разрабатывает новый реестр, в котором помимо пасек будет указан список местонахождений уязвимых культур.
25 апреля 2008 г.
Джон Х. Хилл и Алан Л. Эггенбергер, отделение патологии растений
23 апреля 2008 г.
Клиника помогает садоводам и специалистам в области агробизнеса диагностировать и бороться с болезнями растений, проблемами с сорняками и насекомыми на всех видах растений.
22 апреля 2008 г.
Боб Хартцлер, Департамент агрономии
По мере того, как близится конец апреля, а полевых работ мало, получение урожая в почве становится приоритетом для многих фермеров.