Содержание
Фізичні та хімічні властивості води
Вода — це справжнє джерело життя на землі, вона приймає участь у безлічі біологічних процесів і є невід’ємним їх компонентов. Це можливо завдяки її унікальним властивостям.
Фізичні властивості води
Хімічні властивості води
Взаємодія води з простими речовинами
Реакції з оксидами неметалів
Фотосинтез
Вода – ідеальний розчинник
У блозі ми часто посилаємося на певні властивості води, але рідко розкриваємо їх суть. Сьогодні спробуємо побути Вікіпедією і зануритися в курс фізики та хімії води, простою мовою розповісти про те, чому ж вона не тільки «джерело життя на землі», а й воістину особлива хімічна речовина.
Фізичні властивості води
Чиста вода не має смаку і запаху, за нормальної температури (20 оС) знаходиться в рідкому вигляді.
«Вода» — це тривіальна назва, хімічну сполуку називають оксидом водню. З назви можна зрозуміти, що в її складі містяться іони водню і кисню, які пов’язані між собою так званим ковалентним зв’язком.
З назви можна зрозуміти, що в її складі містяться іони водню і кисню, які пов’язані між собою так званим ковалентним зв’язком.
Атом водню має валентність (здатність утворювати зв’язки) 1, а атом кисню — 2. Завдяки цьому формула води саме H2O.
Також кожна молекула води здатна утворювати до чотирьох водневих зв’язків (2 з них водень, 2 кисень). Всі аномалії фізичних властивостей води пов’язані саме з ними — у води досить висока температура кипіння (100°C). Якби не існувало водневих зв’язків, то вода кипіла б при температурі -80°C, а замерзала б при -100°C. Така будова дозволяє нам бачити воду в трьох агрегатних станах (лід, рідина, газ) в навколишньому природному середовищі. Тут коротко описані фізичні властивості води, а ось детальніше про те, як кипить і замерзає вода , як та чим відрізняється важка вода , ми писали раніше.
Хімічні властивості води
Тут ми детальніше поговоримо про те, які хімічні властивості може проявляти вода, і як вони пов’язані з показниками води на Землі.
Якщо розглядати воду, як компонент реакцій, то основні хімічні властивості H2O, які потрібно знати, щоб розуміти процеси в навколишньому середовищі, можна описати невеликим списком.
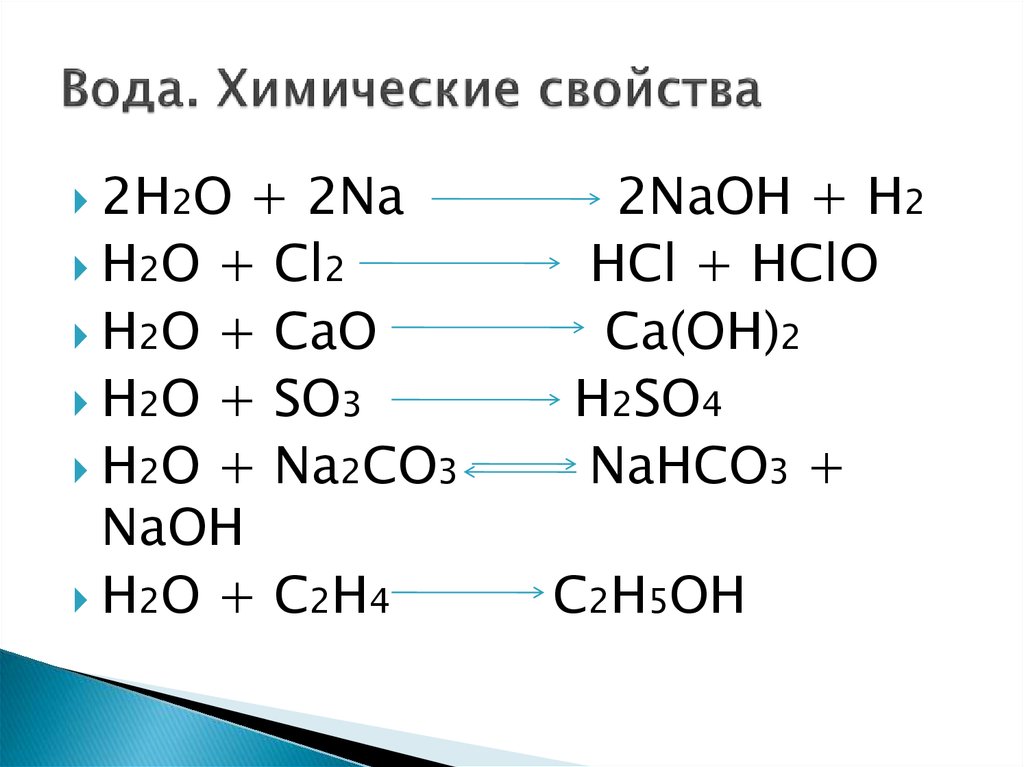
Взаємодія води з простими речовинами
З лужними та лужноземельними металами взаємодія відбувається досить бурхливо з виділенням тепла, а іноді навіть світла, наприклад, натрій, калій, кальцій здатні рухатися і навіть «стрибати» по воді.
2Na + 2H2O = H2 + 2NaOH.
Менш активні метали реагують або при нагріванні, або не реагують зовсім, наприклад залізо:
3Fe + 4H2O = 4H2+ Fe3O4 (лише при нагріванні)
Ці реакції в природному середовищі не відбуваються, а ось реакція корозії, коли до води приєднується повітря, дуже навіть поширена:
4Fe + 3O2 + 6H2O ➝ 4Fe(OH)3.
Це рівняння описує формування іржі на залізних поверхнях. Подібні процеси можуть відбуватися також з міддю, цинком і їх сплавами.
Подібні процеси можуть відбуватися також з міддю, цинком і їх сплавами.
Реакції з неметалами відбуваються виключно при нагріванні або інших типах впливу. Вони також не принципові для вивчення властивостей води.
Реакції з оксидами неметалів
Дуже часто вода в природі зустрічається з вуглекислим газом, а також оксидами сірки та азоту, які є компонентами вихлопних газів, за таким механізмом:
SO2 + H2O = H2SO4.
В результаті саме цих процесів утворюються кислотні дощі.
Фотосинтез
Ця унікальна реакція дозволяє рослинам під впливом сонячного випромінювання з вуглекислого газу і води синтезувати поживні речовини: крохмаль і глюкозу.
6nCO2 + 5nH2O = (C6H10O5)n + 6nO2
Це, мабуть, все реакції, які можуть бути цікаві щодо води, як окремого елемента.
Вода – ідеальний розчинник
Вода є ідеальним розчинником, тому багато процесів відбувається невидимо для нашого ока. Ось вони — якраз, і найцікавіші. У природі не існує води, яка не містить домішок. У воді завжди розчинені неорганічні солі, гази, а при антропогенному впливі ще й величезний асортимент органічних речовин.
Наприклад, природна твердість води обумовлена тим, що під час її руху через породи, вона насичується мінералами. Залежно від складу порід, їх розчинності, температури навколишнього середовища певні їх концентрації здатні розчинятися у воді. Переважно такі породи представлені карбонатами, сульфатами, нітратами кальцію, магнію, натрію, калію та ін. катіонів. Мабуть, основними мінералами, які становлять базис жорсткості, є гіпс (CaSO4), доломіт (CaCO3 • MgCO3), вапняки (CaCO3).
Що стосується розчиненого заліза і марганцю, то вони характерні переважно для природних свердловинних вод, оскільки розчинні солі заліза зазвичай «мешкають» в просторі з недостачею повітря. Джерелами їх є переважно магнітний, бурий, червоний залізняки, магнезит та ін.
Джерелами їх є переважно магнітний, бурий, червоний залізняки, магнезит та ін.
Сірководень також зберігається глибше ґрунтових вод, як продукт хімічних процесів серед органічних речовин. На повітрі теж схильний окиснюватися до елементарної сірки й випадати в осад (зазвичай невидимий людському оку).
У природних поверхневих водах завжди міститься розчинений кисень і азотовмісні компоненти, які виходять як наслідок життєдіяльності мікроорганізмів — це амоній, нітрити, нітрати, які з легкістю перетворюються один в одного. Також у водоймах завжди є білки й амінокислоти.
Що ж стосується антропогенного навантаження, то саме завдяки йому в воду вносяться найтоксичніші забруднювачі:
- солі важких металів;
- промислові органічні продукти;
- нітрати й фосфати застосовуються як добрива.
У воді постійно відбуваються якісь реакції. Це й обмінні процеси, які викликають, наприклад, осадження накипу, що складається з карбонату кальцію. І окислювально-відновні, через які у свердловинній воді з’являється рудувата залізна муть або осад на стінках. Вода — це складна хімічна система, і кожен елемент завжди має своє джерело.
І окислювально-відновні, через які у свердловинній воді з’являється рудувата залізна муть або осад на стінках. Вода — це складна хімічна система, і кожен елемент завжди має своє джерело.
Вода и ее химические свойства
Понять воду, значит понять Вселенную.
Масару Эмото (1943–2014), японский исследователь
Вода — один из самых распространённых соединений на нашей планете. Именно она является главной составляющей всего живого на планете, но также вода входит в состав комет, большинства планет солнечной системы и их спутников. Без воды нет жизни: ведь жизнь на Земле появилась только тогда, когда на ней появилась вода. Вся жизнь зародилась в воде, поскольку она является естественным универсальным растворителем, а значит вода растворяет питательные вещества и обеспечивает ими клетки живых организмов. Если рассматривать показатель количества данного оксида во всех агрегатных состояниях, то его на планете около 75 % от общей массы. По примерным подсчетам ученых на планете 1.4087 млрд. км3 воды (причем соленой воды от общего объема примерно 97 %, пресной всего 3 %).
По примерным подсчетам ученых на планете 1.4087 млрд. км3 воды (причем соленой воды от общего объема примерно 97 %, пресной всего 3 %).
Да и сам человек на 60–80 % (в зависимости от возраста) состоит из воды. Большая часть воды — это кровь, жидкость в выделительной системе, мускулах, мозге и других органах, а также в костях и коже.
В понятии химии вода — это H2O, то есть две молекулы водорода и одна молекула кислорода. Но это дистиллированная вода. В природе вода содержит различные примеси и очень редко встречается в чистом виде. При взаимодействии водорода с кислородом происходит выделение большого количества тепла. Это соединение очень устойчивое, молекулы которого распадаются только при температуре 1500°С.
Каждая молекула ориентирована вокруг другой, и все вместе они формируют общую кристаллическую решетку. Оксид построен в форме тетраэдра — атом кислорода в центре, а две пары электронов его и два атома водорода вокруг асимметрично. Если провести через центры ядер атомов линии и соединить их, то получится именно тетраэдрическая геометрическая форма. Угол между центром атома кислорода и ядрами водородов составляет 104,50. Длина связи О-Н = 0,0957 нм. Наличие электронных пар кислорода, а также его большее в сравнении с водородами сродство к электрону обеспечивают формирование в молекуле отрицательно заряженного поля. В противовес ему ядра водородов образуют положительно заряженную часть соединения. Таким образом, выходит, что молекула воды — диполь. Это определяет то, какой может быть вода и ее свойства. Для живых существ эти особенности играют жизненно важную роль.
Если провести через центры ядер атомов линии и соединить их, то получится именно тетраэдрическая геометрическая форма. Угол между центром атома кислорода и ядрами водородов составляет 104,50. Длина связи О-Н = 0,0957 нм. Наличие электронных пар кислорода, а также его большее в сравнении с водородами сродство к электрону обеспечивают формирование в молекуле отрицательно заряженного поля. В противовес ему ядра водородов образуют положительно заряженную часть соединения. Таким образом, выходит, что молекула воды — диполь. Это определяет то, какой может быть вода и ее свойства. Для живых существ эти особенности играют жизненно важную роль.
Рис. 1 Строение атома воды и оксид в виде тетраэдра
Вода — весьма активное в химическом отношении вещество. Большая часть химии, при её зарождении как науки, начиналась именно как химия водных растворов веществ, именно поэтому вода — это определяющий характер химии. Вода имеет различные физические и химические свойства, но посмотрим на воду с химической точки зрения.
Вода имеет различные физические и химические свойства, но посмотрим на воду с химической точки зрения.
-
Биохимические свойства воды.
Вода является неотъемлемой частью всех биохимических процессов организма, являясь растворителем, катализатором и средой. Вода способна растворять некоторые кислоты, основания и соли, представляющие ионные соединения и некоторые полярные неионные образования (простые спирты, сахара и аминокислоты). Благодаря воде сохраняется упругость и объем живой клетки, многие химические процессы организма протекают именно в водных растворах. Эти свойства дают клеткам теплопроводимость и теплоемкость, обеспечивающие терморегуляцию и защищает от температурных перепадов.
Без воды невозможен гидролиз — химическая реакция, которая сопровождает усвоение белков, жиров, углеводов, а ведь именно они являются обязательным компонентом нашей пищи, так, например, белок распадается на аминокислоты, углевод на глюкозу, жиры на глицерин. В результате этого процесса сложные органические вещества распадаются до простых веществ, которые, легко усваиваются живым организмом.
В результате этого процесса сложные органические вещества распадаются до простых веществ, которые, легко усваиваются живым организмом.
-
Вода-растворитель
Вода является наиболее распространённым растворителем на нашей планете. По растворимости в воде вещества делятся на три группы:
1) Хорошо растворимые: (сахар (С12Н22О11), гидроксид натрия (NaOH), спирт (C2H5OH), хлороводород (HCl).
2) Мало растворимые: (гипс, сульфат свинца (PbSO4), бензол (C6H6), метан (СH4), кислород).
3) Практически не растворимые: (стекло, серебро (Ag), золото (Au), керосин, растительное масло).
Из этого можно сделать вывод, что растворимость вещества прежде всего зависит от природы этого вещества, а также от температуры и давления окружающей среды. Сам процесс растворения обуславливается взаимодействием частиц растворителя и растворяемого вещества.
Сам процесс растворения обуславливается взаимодействием частиц растворителя и растворяемого вещества.
-
Вода — активное химическое вещество.
Вода может взаимодействовать:
1) с металлами с выделением водорода:
− с активными 2Na + 2H2O → H2 + 2NaOH (бурно)
− со средней активностью до H 3Fe + 4H2O → 4H2 + Fe3O4 (только при нагревании)
− с малоактивными после H (не взаимодействуют) Cu+ H2O ≠
Достаточно активные металлы могут участвовать в окислительно-восстановительных реакциях этого типа. Наиболее легко реагируют щелочные и щелочноземельные металлы I и II групп.
2) с неметаллами:
Из неметаллов с водой реагируют углерод и его водородное соединение (метан). Эти вещества гораздо менее активны, чем металлы, но все же способны реагировать с водой при высокой температуре:
C + H2O → H2 + CO (при сильном нагревании)
CH4 + 2H2O → 4H2 + CO2(при сильном нагревании)
3) с оксидами неметаллов:
Вода реагирует со многими оксидами неметаллов. В отличие от предыдущих, эти реакции не окислительно-восстановительные, а реакции соединения:
SO2+H2O → H2SO3 — сернистая кислота
SO3+H2O → H2SO4 — серная кислота
CO2+H2O → H2CO3 — угольная кислота
4) с оксидами металлов
Некоторые оксиды металлов также могут вступать в реакции соединения с водой.
CaO+ H2O → Ca(OH)2 гидроксид кальция (гашеная известь)
Не все оксиды металлов способны реагировать с водой. Часть из них практически не растворима в воде и поэтому с водой не реагирует: ZnO, TiO2, Cr2O3, из которых изготовляют, например, стойкие к воде краски. Оксиды железа также не растворимы в воде и не реагируют с ней.
5) с газами
Как говорилось в подпункте 4 вода взаимодействует с оксидами неметаллов. В данном случае CO2 — это газ. Если струю газообразного оксида углерода (IV) CO2 направить в воду, то часть его раствориться в ней. В этом растворе произойдет химическая реакция соединения и образуется вещество — угольная кислота H2CO3. Собирая углекислый газ над водой, ученый Джозеф Пристли обнаружил, что часть газа растворяется в воде и придает ей приятный терпкий вкус. По сути, Пристли впервые получил напиток газированный или содовой воды. Позже ученый Торберн Бергман создал аппарат, позволяющий насыщать жидкость углекислым газом под давлением и назвав его сатуратором.
По сути, Пристли впервые получил напиток газированный или содовой воды. Позже ученый Торберн Бергман создал аппарат, позволяющий насыщать жидкость углекислым газом под давлением и назвав его сатуратором.
Рис. 2 Джозеф Пристли и его прибор для исследования газов.
6) Гидраты.
Вода образует многочисленные соединения, в которых ее молекула полностью сохраняется. Это так называемые гидраты. Если гидрат кристаллический, то он называется кристаллогидратом.
H2SO4 + H2O → H2SO4.H2O (гидрат серной кислоты)
NaOH + H2O → NaOH.H2O (гидрат едкого натра)
Соединения, связывающие воду в гидраты и кристаллогидраты, используют в качестве осушителей. С их помощью удаляют водяные пары из влажного атмосферного воздуха.
7) Фотосинтез растений.
Фотосинтез — процесс, протекающий в зеленных листьях растений с использованием энергии света, при котором из углекислого газа и воды образуются органические вещества и кислород. Синтез растениями крахмала (C6H10O5)n и других подобных соединений (углеводов), происходящая с выделением кислорода:
6n CO2 + 5n H2O → (C6H10O5)n + 6n O2 (при действии света)
Рис. 3. Фотосинтез растений, как химическая реакция.
8) Электролиз воды.
Вода разлагается на водород и кислород при действии электрического тока. Это также окислительно-восстановительная реакция, где вода является одновременно и окислителем, и восстановителем.
Под действием электричества электрод, подключенный к отрицательному полюсу, становится катодом, а электрод, соединённый с положительным полюсом, превращается в анод. Катод и анод притягивают противоположные ионы: к катоду направляются положительно заряженные катионы, к аноду — отрицательно заряженные анионы.
Схема электролиза воды:
Анод 2H2O → O2 + 4H+ + 4e–
Катод 4H+ + 4e– → 2H2.
Вода — слабый электролит, поэтому электролиз чистой, дистиллированной воды протекает медленно или не идёт вовсе. Для ускорения процесса в воду добавляют сильный электролит, увеличивающий проводимость электрического тока, катионы которого будут иметь меньший электродный потенциал, чем H+ воды.
-
Минерализация воды
Минерализация — это показатель количества содержащихся в воде растворенных веществ (неорганические соли неорганические вещества).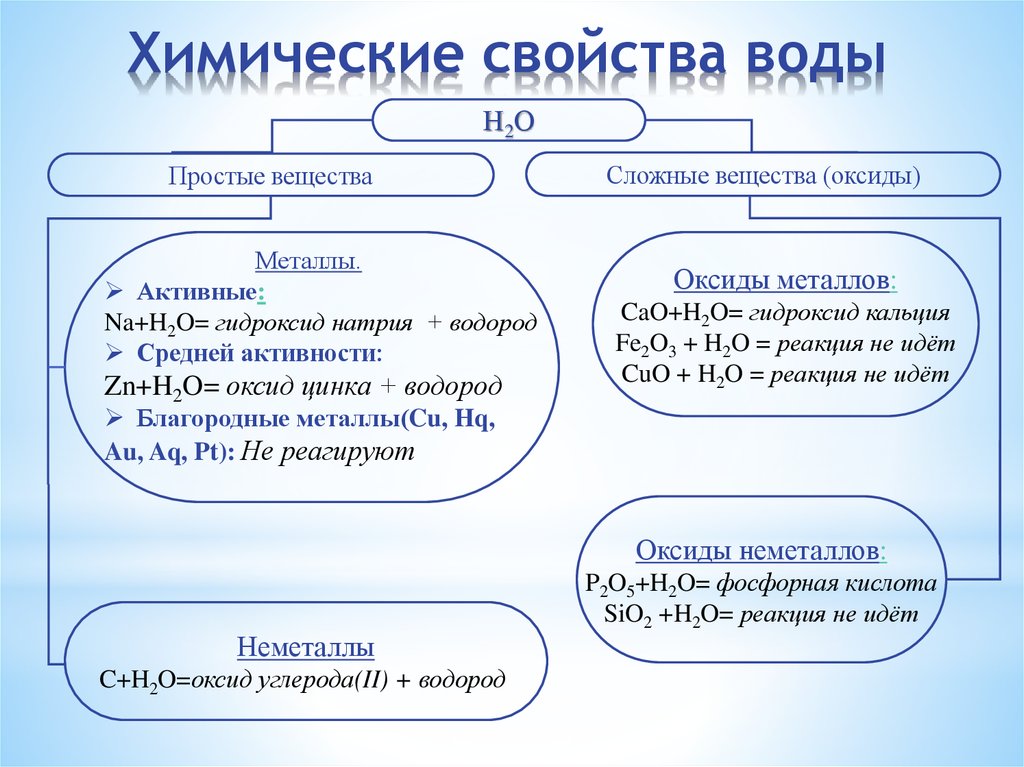 Как правило, это бикарбонаты, хлориды, сульфаты кальция, магния, калия, натрия и других веществ. Минерализацию считают в грамм на литр (г/л) или грамм на дециметр в кубе (г/дм3). С точки зрения бальнеологии по степени минерализации воду классифицируют на:
Как правило, это бикарбонаты, хлориды, сульфаты кальция, магния, калия, натрия и других веществ. Минерализацию считают в грамм на литр (г/л) или грамм на дециметр в кубе (г/дм3). С точки зрения бальнеологии по степени минерализации воду классифицируют на:
− Столовую — минерализация до 1 г/л
− Лечебно-столовую — минерализация от 1 г/л до 10 г/л
− Лечебная — минерализация более 10 г/л или высокое содержание биологически активных элементов: железо, брома, йода, сероводорода, фтора и т. д., при этом общая минерализация может быть невысокой.
Свойство минерализации основано на дипольном моменте оксида водорода. Благодаря его наличию молекулы способны присоединять к себе множество других веществ ионов и удерживать их. Так формируются ассоциаты, клатраты и прочие объединения.
-
Жесткость воды.
Жесткость воды — совокупность свойств, обусловленных содержанием в воде катионов кальция Ca2+ и магния Mg2+ (так называемых солей жесткости).
Из-за разного объема различных примесей в воде, она делится на два типа-жесткую и мягкую. Соли попадают в воду из-за того, что часть дождевых вод превращаются в грунтовую воду. Они протекают в недрах Земли, соприкасаются с минералами кальция и магния, вымывая из них мелкие частички. В воде, насыщенной углекислотой, карбонаты калия и магния растворяются, так как превращаются в кислые соли. В таком растворимом виде гидрокарбонаты металлов остаются в воде и обуславливают временную жесткость. При кипячении такой воды гидрокарбонаты разлагаются и выпадают в осадок. Но также существует постоянная жесткость, обуславливая присутствием в природной воде растворимых хлоридов и сульфатом кальция и магния. Жесткость воды количественно выражают числом ммоль эквивалентов (ммоль/экв) ионов кальция Ca2+ и магния Mg2+.
В жесткой воде плохо мылится мыло, которое представляет собой натриевые соли высших карбонатных кислот. Для устранения жесткости воды (ее умягчения) необходимы ионы Ca2+ и Mg2+ перевести в осадок. Временную карбонатную жесткость устраняют кипячение:
Ca(HCO3)2CaCO3 ↓ + H2O + CO2↑
Постоянную жесткость кипячением устранить нельзя. Для этого добавляют в воду смесь гашенной извести Ca(OH)2 или соды Na2CO3
Са(НСО3)2 + Са(ОН)2 → 2СаСO3↓ + 2Н2O
-
Теория Льюиса
В теории Льюиса (1923 г.) на основе электронных представлений было ещё более расширено понятие кислоты и основания. С точки зрения теории Льюиса — вода — это слабая кислота и слабое основание одновременно (амфолит). То есть можно сказать о некоторой амфотерности воды в химических свойствах.
Подводя итог вышесказанного можно сказать, что вода — это самое уникальное вещество на земле. Академик Владимир Иванович Вернадский писал: «Вода стоит особняком в истории нашей планеты. Нет природного тела, которое могло бы с ней сравниться по влиянию на ход основных, самых грандиозных, геологических процессов. Не только земная поверхность, но и глубокие — в масштабе биосферы — части планеты определяются, в самых существенных своих проявлениях, ее существованием и ее свойствами». Действительно, нет более важного для нас вещества на Земле, чем обыкновенная вода, и в то же время не существует другого такого же вещества, в свойствах которого было бы столько противоречий и аномалий, как в свойствах воды.
Литература:
-
Репетитор по химии / под. Ред. А. С. Егорова. –изд. 58-е- Ростов н/Д: Феникс, 2018 -
Пособие по химии для поступающих в вузы. — 4-е изд., испр. и доп. — М.: РИА «Новая волна»: Издатель Умеренков, 2018
— 4-е изд., испр. и доп. — М.: РИА «Новая волна»: Издатель Умеренков, 2018
-
https://www.syl.ru/article/172000/new_voda-i-ee-svoystva-fizicheskie-i-himicheskie-struktura-vodyi -
http://www.hemi.nsu.ru/ucheb175.htm -
https://ru.wikipedia.org -
https://obrazovaka.ru/himiya/elektroliz-vody-shema-processa.html -
http://www.cawater-info.net/bk/12–7.htm
Физические и химические свойства воды
Биохимия
- Сообщение от
Кеннеди Брем
02
Aug
Основные понятия
В этом уроке о свойствах воды вы узнаете о физических и химических свойствах воды. Вы также узнаете о структуре молекулы воды.
Темы, освещенные в других статьях
Полярность воды
Электроотрицательность
Растворитель и т. п. Растворенное вещество
п. Растворенное вещество
Удельная теплоемкость
Плотность
Словарь
Плотность- Масса на единицу объема
Удельная теплоемкость- Количество энергии, необходимое для повышения температуры 1 кг материала 90 2 90 3 C 90 1 Теплота 1 0 Испарение- Количество энергии, необходимое для преобразования количества жидкости в газ
Полярная молекула- Молекула с частично отрицательно заряженным концом и частично положительно заряженным концом
Электроотрицательность- Склонность атома притягивать общие электроны в химической связи
Введение в свойства воды
Вода (h30) является «универсальным растворителем» и самой распространенной поверхностью на Земле. Это также единственное обычное вещество, существующее в твердом, жидком и газообразном состояниях. Молекулы воды образуют водородные связи и чрезвычайно полярны. Пять основных свойств воды — это ее высокая полярность, высокая удельная теплоемкость, высокая теплота парообразования, низкая плотность в твердом состоянии и притяжение к другим полярным молекулам.
Полярность и структура
Один атом кислорода и два атома водорода составляют молекулу воды. Он имеет изогнутую молекулярную геометрию с кислородом, имеющим две неподеленные пары электронов. Разница в электроотрицательности между кислородом и водородом приводит к тому, что кислород имеет частичный отрицательный заряд, а водород — частичный положительный заряд. Эта разница в заряде вызывает полярность. Частичный положительный заряд водорода одной молекулы воды притягивает частичный отрицательный заряд кислорода другой молекулы воды. Это притяжение называется водородной связью.
Водородная связь слабее, чем ковалентная связь между кислородом и водородом одной и той же молекулы, но обуславливает многие уникальные свойства воды. Например, для разрыва водородных связей требуется больше энергии, поэтому вода имеет более высокую температуру плавления и кипения.
Универсальный растворитель
Вода — растворитель жизни. Гидрофильные вещества – это те, которые растворяются в воде, тогда как гидрофобные вещества плохо смешиваются с водой. Вещества могут растворяться в воде, если они могут соответствовать или преодолевать водородные связи между молекулами воды. Если они не могут, вещество образует осадок. Кислоты, спирты и соли хорошо растворимы в воде, а жиры и масла гидрофобны.
Вещества могут растворяться в воде, если они могут соответствовать или преодолевать водородные связи между молекулами воды. Если они не могут, вещество образует осадок. Кислоты, спирты и соли хорошо растворимы в воде, а жиры и масла гидрофобны.
Растворенное в воде ионное вещество отделяется. Например, NaCl распадается на катионы Na+ и анионы Cl-, окруженные молекулами воды. Вода амфотерна, то есть может действовать как кислота или основание в зависимости от раствора. Он может образовывать ионы H+ и OH-.
Удельная теплоемкость
Вода имеет высокую удельную теплоемкость 4184 Дж/(кг x К) при 20°C и высокую теплоту парообразования из-за водородных связей. Это позволяет водоемам иметь минимальные колебания температуры для регулирования климата.
Высокая температура испарения воды позволяет людям использовать пот для охлаждения. Пот в основном состоит из воды. Он поглощает избыточное тепло тела, когда оно испаряется. Этот процесс известен как испарительное охлаждение.
Плотность
Плотность воды составляет 1 грамм на кубический сантиметр. Это используется для определения грамма. Вместо того, чтобы подвергаться тепловому расширению, плотность увеличивается с температурой до пика 3,98 ° C, а затем уменьшается. Отрицательное тепловое расширение — это увеличение плотности между 32 и 390,16 F. В результате лед менее плотный, чем вода, которая имеет уменьшение плотности примерно на 10%. Вот почему водоемы могут иметь слой льда на поверхности, но содержать жидкость под ним. Это позволяет рыбам и морским обитателям выживать подо льдом. Высокая удельная теплоемкость поддерживает относительно стабильную температуру воды в течение зимы, что позволяет морской флоре и фауне выжить.
Содержание соли снижает температуру замерзания океана почти на 2°C. Лед по-прежнему плавает в океане, но лед практически не содержит солей, а его плотность аналогична плотности льда в пресноводных водоемах. Соль увеличивает соленость и плотность оставшейся воды, которая опускается за счет конвекции. Этот процесс называется отказом от рассола.
Этот процесс называется отказом от рассола.
Сжимаемость
Сжимаемость является результатом давления и температуры. Сжимаемость воды настолько мала, что ее часто считают несжимаемой. Низкая сжимаемость позволяет воде в глубоких океанах с высоким давлением уменьшаться в объеме всего на 1,8%.
Электропроводность
Чистая вода является хорошим изолятором, но деионизированная вода никогда не бывает полностью свободной от ионов. Вода в жидком состоянии подвергается процессу, называемому автоионизацией. Это означает, что две молекулы воды могут образовать один анион гидроксида (OH-) и один катион гидроксония (H 3 0+).
Когезия и адгезия
Водородные связи между молекулами воды постоянно разрываются и восстанавливаются с другими молекулами воды. Когезия – это способность молекул воды слипаться. Полярность воды также придает воде высокую адгезию: способность прилипать к другим поверхностям. Силы сцепления сильнее, чем силы сцепления.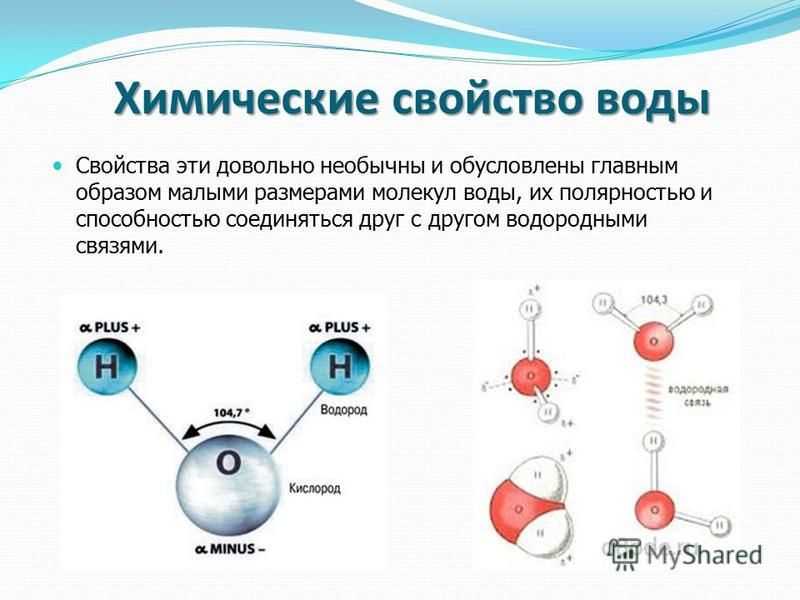
Благодаря сильному когезии и адгезии вода проявляет капиллярное действие. Капиллярное действие — это процесс течения жидкости через узкое пространство без и часто против силы тяжести. Вода прилипает к стенкам корней растений и поднимается в растение. Пористые материалы, такие как вода, также проявляют капиллярное действие. Деревья могут переносить воду за счет капиллярного действия на расстояние более 100 метров.
Поверхностное натяжение
Водородная связь также приводит к тому, что вода имеет высокое поверхностное натяжение 71,99 мН/м при 25. Поверхностное натяжение достаточно велико, чтобы насекомые могли ходить по воде. Поверхностное натяжение является результатом когезионных свойств воды. Капли воды и вода, поднимающаяся над краем стакана, показывают высокое поверхностное натяжение воды. Подробнее о свойствах воды читайте здесь.
Химические свойства воды — Eniscuola
Вода как ресурс
Химические свойства воды
Химическая формула молекулы воды h3O: два атома водорода (h3) связаны с одним атомом кислорода (O). Электроны атома (частицы с отрицательным зарядом) устанавливают связи между собой. Кислород лучше удерживает их рядом с собой, чем водород. В результате молекула воды заряжается отрицательно вблизи атома кислорода и положительно вблизи атома водорода. Поскольку противоположности притягиваются, молекулы воды имеют тенденцию соединяться вместе, как магниты.
Электроны атома (частицы с отрицательным зарядом) устанавливают связи между собой. Кислород лучше удерживает их рядом с собой, чем водород. В результате молекула воды заряжается отрицательно вблизи атома кислорода и положительно вблизи атома водорода. Поскольку противоположности притягиваются, молекулы воды имеют тенденцию соединяться вместе, как магниты.
Вода может растворить многие вещества
Воду называют универсальным растворителем, поскольку она может растворять больше веществ, чем любая другая жидкость. И нам очень повезло, что он может: если бы он не мог, мы не смогли бы выпить чашку горячего чая с сахаром, потому что сахар остался бы на дне чашки. Вот почему кажущиеся чистыми на первый взгляд воды рек, ручьев, озер, морей и океанов на самом деле содержат огромное количество растворенных элементов и минералов, выделяемых горными породами или атмосферой. Куда бы она ни текла, над землей, под землей или внутри нашего тела, вода растворяет и переносит чрезвычайно большое количество веществ. Таким образом, вода выполняет драгоценную задачу: переносит, иногда на большие расстояния, вещества, встречающиеся на ее пути. Чистая вода, как и дистиллированная вода, имеет рН 7 (нейтральный). Морская вода в основном щелочная, ее рН составляет около 8. Большинство пресных вод имеют рН от 6 до 8, за исключением, конечно, кислотных дождей, рН которых ниже 7.
Таким образом, вода выполняет драгоценную задачу: переносит, иногда на большие расстояния, вещества, встречающиеся на ее пути. Чистая вода, как и дистиллированная вода, имеет рН 7 (нейтральный). Морская вода в основном щелочная, ее рН составляет около 8. Большинство пресных вод имеют рН от 6 до 8, за исключением, конечно, кислотных дождей, рН которых ниже 7.
Специальные отчеты
15 апреля 2014 г.
Водный след, водообеспеченность и использование в планетарном масштабе…
26 февраля 2014 г.
Водный след и водопотребление…
8 июля 2022
Акула в моем гамбургере Наконец-то наступило лето! Как обычно, мы ждали его целый год и…
13 мая 2018
Задумывались ли вы, сколько места занимает яблоко или стейк?.
 ..
..26 августа 2022
В преддверии самого жаркого лета за многие годы давайте попробуем ответить на этот освежающий вопрос: холоднее ли в…
7 октября 2021
«Чистая, сладкая пресная вода», — писал Петрарка, которого многие считают предшественником итальянской литературы. До него святой Франциск посвятил два…
17 мая 2021 года
Согласно исследованию, проведенному французской и швейцарской исследовательской группой, недавно опубликованному в ведущем журнале Nature, континентальный…
15 апреля 2021 г.
Невидимое вторжение микропластика…
26 декабря 2019
Как можно жить и работать в Антарктиде…
15 апреля 2014 г.

Водный след, водообеспеченность и использование в планетарном масштабе…
26 февраля 2014 г.
Водный след и водопотребление…
8 июля 2022
Акула в моем гамбургере Наконец-то наступило лето! Как обычно, мы ждали его целый год и…
13 мая 2018 г.
Задумывались ли вы, сколько места занимает яблоко или стейк?…
26 августа 2022
В преддверии самого жаркого лета за многие годы попробуем ответить на животрепещущий вопрос: холоднее ли в…
7 октября 2021
«Чистая, сладкая пресная вода», — писал Петрарка, которого многие считают предшественником итальянской литературы. До него святой Франциск посвятил два…
15 апреля 2014 г.

Водный след, водообеспеченность и использование в планетарном масштабе…
26 февраля 2014 г.
Водный след и водопотребление…
8 июля 2022
Акула в моем гамбургере Наконец-то наступило лето! Как обычно, мы ждали его целый год и…
Из раздела Мультимедиа
вода
Наличие водных ресурсов
Смотреть
вода
Круговорот воды
Слушать
вода
Карта нехватки воды
Смотреть
вода
Годовое наличие пресной воды
Смотреть
вода
Поверхностное натяжение
Смотреть
вода
Наличие водных ресурсов
Смотреть
вода
Круговорот воды
Слушать
вода
Карта дефицита воды
Смотреть
Факты
В некоторых организмах вода может составлять до 90% их общего веса.
 ..
..Океанское течение Гумбольта идет на север вдоль побережья Перу и…
Только 3% общих запасов воды составляют пресные воды…
Самые высокие водопады мира находятся в Венесуэле…
Волновой дракон, который поглощает волны и вырабатывает электричество, является растением…
В Италии явление «кобыла в любви» встречается очень часто: часть морского побережья, где это происходит,…
Даже большие озера могут образовываться на поверхности, внутри или при контакте с…
Исландия характеризуется многочисленными ледяными щитами…
Очарование ледниковых пещер вдохновило исследователя.
 ..
..
13 мая 2011 г.
В некоторых организмах вода может составлять до 90% их общего веса…
Океанское течение Гумбольта идет на север вдоль побережья Перу и…
Только 3% общих запасов воды составляют пресные воды…
Самые высокие водопады в мире находятся в Венесуэле…
16 мая 2011 г.
Волновой дракон, который поглощает волны и генерирует электричество, является растением…
11 мая 2011 г.
В Италии явление «кобыла в любви» встречается очень часто: часть морского побережья, где это происходит,…
13 мая 2011 г.



 — 4-е изд., испр. и доп. — М.: РИА «Новая волна»: Издатель Умеренков, 2018
— 4-е изд., испр. и доп. — М.: РИА «Новая волна»: Издатель Умеренков, 2018
 ..
..

 ..
.. ..
..