Содержание
10 класс. Биология. Вода и её роль в жизнедеятельности клетки — Вода и её роль в жизнедеятельности клетки
Комментарии преподавателя
Цель урока – ознакомление со структурой молекулы воды, и её ролью в жизнедеятельности клетки.
Вода является одним из самых распространенных веществ на нашей планете. Для многих живых организмов вода важна вдвойне, т.к. она не только входит в состав их клеток, но и является средой обитания (рис. 1).
Рис. 1. Вода, как среда обитания. Часть кораллового рифа
В клетке в количественном отношении, вода занимает первое место среди всех химических соединений.
Вода в организме бывает свободной и связанной.
Свободная вода входит в состав цитоплазмы клетки, вакуоли; заполняет межклеточное пространство, сосуды, пространство между органами, — она нужна для транспорта и переноса веществ.
Связанная вода входит в состав клеточных структур (белков, мембран) и поддерживает их структуру.
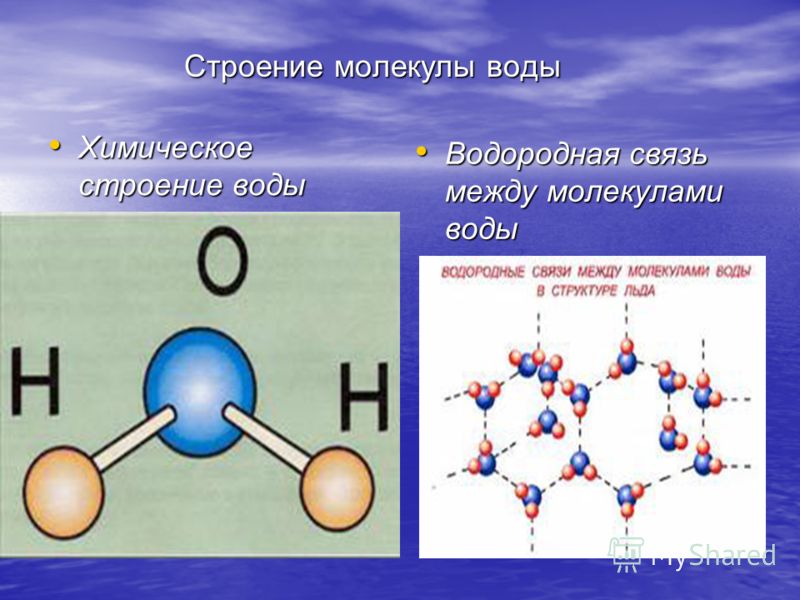
Вода имеет ряд свойств, исключительно важных для живых организмов. Уникальные свойства воды определяются структурой её молекулы.
Молекула воды состоит из атома кислорода и двух атомов водорода.
Атом кислорода как более электроотрицательный, чем атомы водорода, оттягивает электронную плотность на себя. В результате она смещается в его сторону, и на атомах водорода возникает частично положительный заряд, а на атоме кислорода частично отрицательный заряд.
Так как атомы в молекуле воды образуют угол (рис. 2), один конец молекулы воды несет положительный заряд, а другой – отрицательный. Такую молекулу называют диполем (рис. 2), или полярной молекулой.
Рис. 2. Распределение заряда в молекуле воды
Частичный положительный заряд атома водорода одной молекулы взаимодействует с частичным отрицательным зарядом атома кислорода другой молекулы. Между ними возникает электростатическое взаимодействие, и образуются водородные связи. Водородные связи слабые, но в воде их достаточно много, поэтому уникальные свойства воды как раз и определяется наличием водородных связей в воде.
Между ними возникает электростатическое взаимодействие, и образуются водородные связи. Водородные связи слабые, но в воде их достаточно много, поэтому уникальные свойства воды как раз и определяется наличием водородных связей в воде.
Рис. 3. Схема образования водородной связи между разноименно заряженными атомами в двух молекулах воды
Учитывая данную способность воды, рассмотрим те свойств воды, которые важны с биологической точки зрения.
Вода — универсальный растворитель. Она превосходный растворитель для полярных соединений. К ним относятся ионные соединения, такие как соли, у которых заряженные частицы, ионы, диссоциируют, то есть отделяются друг от друга в воде, когда вещество растворяется.
Рис. 4. Растворение полярного вещества в овде. Образование ионов с гидратной оболочкой
А также соединения, например, сахара и простые спирты, в молекулах которых присутствуют заряженные группы, то есть эти вещества имеют функциональные группы для взаимодействия с водой (рис.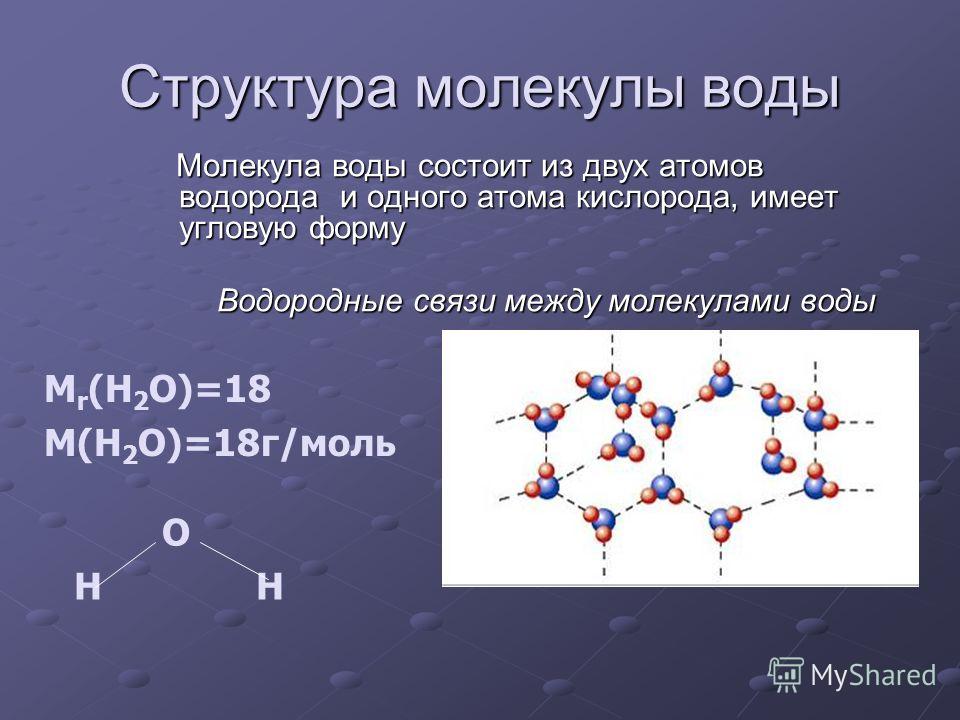 4).
4).
Рис. 5. Гидролиз сахарозы в воде
В растворе молекулы или ионы вещества начинают быстрее двигаться, и реакционная способность этого вещества возрастает. Все биохимические процессы проходят в водных растворах.
Полярные вещества «липиды» не смешиваются с водой, и поэтому могут разделять водные растворы на отдельные компартменты. Неполярные части молекул отталкиваются водой, и в ее присутствии притягиваются друг к другу.
Неполярные молекулы взаимодействуют с водой по-другому – они собираются в капли, образуют пленки. Такие вещества называют гидрофобными.
Рис. 6. Масло — вещество, которое не растворяется в воде – на поверхности воды оно образует пленки (слева) или собирается в капли (справа)
Подобные гидрофобные взаимодействия играют важную роль в обеспечении стабильности молекул субклеточных структур, а также белков и нуклеиновых кислот.
Вода обладает большой теплоёмкостью. То есть поглощает большое количество тепловой энергии при минимальном повышении собственной температуры.
Это достигается за счёт того, что большое количество энергии тратится на разрыв водородных связей. Большая теплоёмкость воды защищает организмы от перегрева. И кроме этого создает постоянные условия для протекания биохимических процессов в организме.
Вода обладает большой теплопроводностью, что обеспечит равномерное распределение тепла по всему организму. За счёт этого, биохимические процессы и все процессы жизнедеятельности проходят в относительно постоянных условиях.
У воды относительно большая теплота испарения. Испарение воды сопровождается охлаждение организма, потому что большое количество энергии тратится на разрыв водородных связей, и эта энергия черпается из окружающей среды.
Вода практически не сжимается, создавая тем самым тургорное давление, определяя объем и упругость клеток и тканей. Например, благодаря этому наша кожа упруга, а у круглых червей и медуз имеется гидростатический скелет.
Вода характеризуется большим поверхностным натяжением, что связано с образованием водородных связей между молекулами воды и другими соединениями.
Рис. 7. Использование поверхностного натяжения живыми организмами. Водомерка бежит по воде (слева). Кровь движется по капилляру (справа)
Благодаря силе поверхностного натяжения воды происходит капиллярный кровоток в нашем организме, восходящий и нисходящий токи воды в теле растений. Многие мелкие организмы извлекают для себя пользу из этого поверхностного натяжения, оно позволяет им удерживаться на воде или скользить по её поверхности.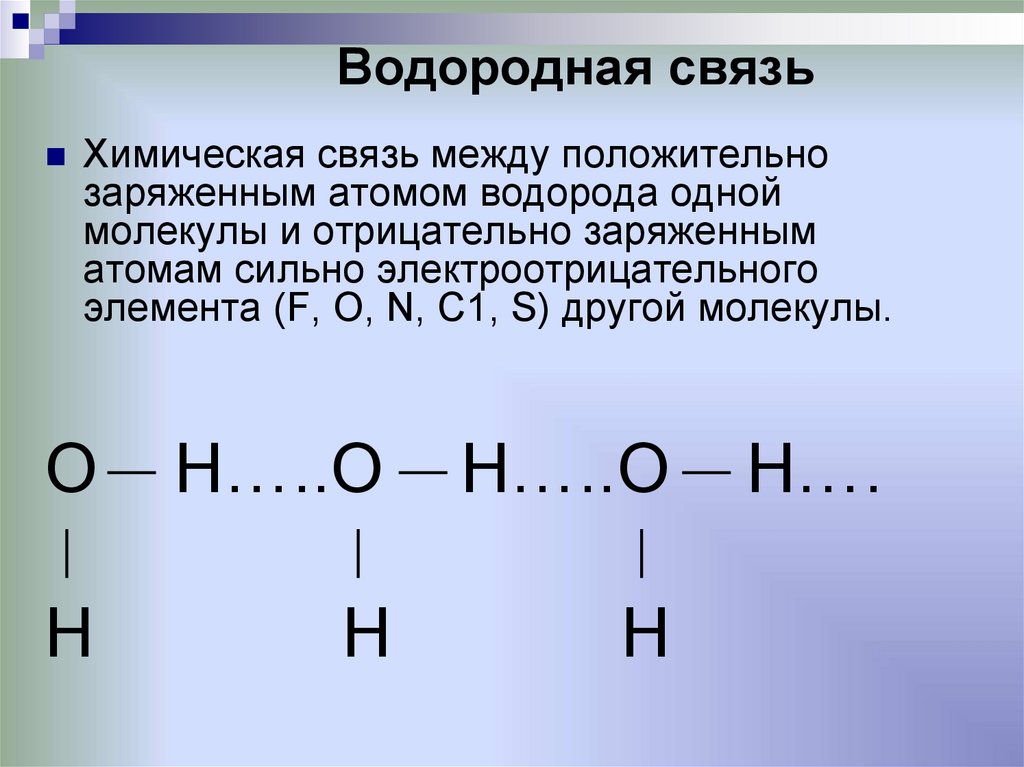
Рис. 8. Основные биологически важные свойства воды
Таким образом, мы рассмотрели структуру и свойства воды.
Значение потоотделения
Потоотделение – это выделение жидкого секрета на поверхность кожи. Вместе с потом выделяются такие вещества, как аминокислоты, мыла, жирные кислоты, аммиак, холестерин – вещества, которые являются продуктами жизнедеятельности живых организмов. Также с потом могут выделяться ионы тяжелых металлов, которые случайно попали в организм
Состав пота на разных участках человеческого тела не одинаков, и зависит от разных факторов: от состояния организма, от типа питания, от действия других факторов (например, влажности среды, температуры среды), а также от физических нагрузок.
Различают термическое и психогенное потоотделение.
Рис. 9. Виды потоотделения
Термическое потоотделение, зависит от температуры окружающей среды, является одним из механизмов терморегуляции, то есть спасает наш организм от перегрева.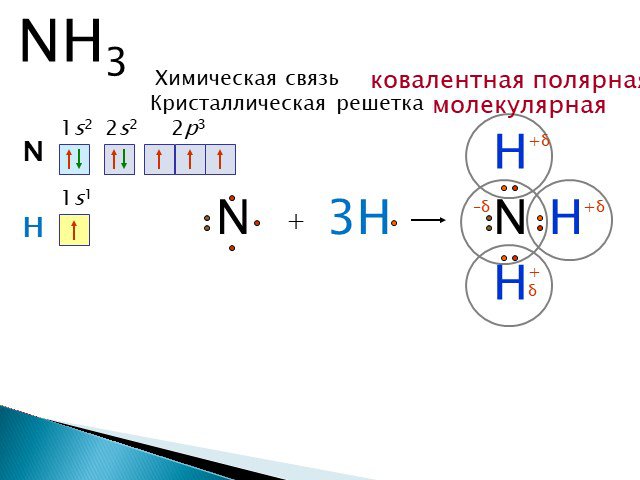 Термическое потоотделение развивается в течении нескольких минут.
Термическое потоотделение развивается в течении нескольких минут.
Психогенное потоотделение зависит от эмоционального состояния.
Психогенное потоотделение может развиваться на разных участках тела человека, это могут быть даже подошвы ног, подушки пальцев; и развивается в течении нескольких секунд.
Плотность воды и поведение её вблизи точки замерзания
Плотность воды максимально при +4оС. Она уменьшается от +4 до 0, то есть лёд менее плотный (а значит более легкий), чем вода.
Рис. 10. Лед, плавающий по поверхности воды (слева), и организмы, живущие подо льдом (справа)
Это имеет большое значение для живых организмов, обитающих в воде, потому что водоемы замерзают сверху, и многие организмы сохраняют в них жизнеспособность подо льдом.
Если бы водоемы замерзали бы снизу, от дна, тогда бы все эти живые организмы погибли бы зимой.
источник конспекта — http://interneturok.ru/ru/school/biology/10-klass/bosnovy-citologii-b/voda-i-eyo-rol-v-zhiznedeyatelnosti-kletki
источник видео — http://www.youtube.com/watch?v=UV_KBari7IY
источник видео — http://www.youtube.com/watch?v=iWV301UCPFU
источник видео — http://www.youtube.com/watch?v=Ho621rq82Qg
источник видео — http://www.youtube.com/watch?v=MllI3wMezXU
источник видео — http://www.youtube.com/watch?v=yrueRLAa84Q
источник презентации — http://www.myshared.ru/slide/download/
Водородная связь Вода Частичный заряд Химическая связь, водород, еда, химия, шарик png
Водородная связь Вода Частичный заряд Химическая связь, водород, еда, химия, шарик png
теги
- еда,
- химия,
- шарик,
- водород,
- фрукты,
- частичная зарядка,
- отрицательная тепловая экспансия,
- красная,
- природа,
- точка,
- площадь,
- оживленная Вода,
- вода,
- водородная,
- водородная связь,
- ковалентная,
- ковалентная связь,
- молекулярная,
- молекула,
- линия,
- искусство,
- атом,
- Украшения для тела,
- химическая связь,
- модный аксессуар,
- атом водорода,
- гидроний,
- межмолекулярная сила,
- изготовление ювелирных изделий,
- связь,
- png,
- прозрачный,
- бесплатная загрузка
Об этом PNG
Размер изображения
- 853x1024px
Размер файла
- 126.
 12KB
12KB MIME тип
- Image/png
Скачать PNG ( 126.12KB )
изменить размер PNG
ширина(px)
высота(px)
Лицензия
Некоммерческое использование, DMCA Contact Us
Молекула Вода Водородная связь Химическая полярность Химическая связь, 3d, сфера, химия, атом png
1100x747px
118.55KBВодородная связь Химическая связь Ковалентная связь Молекула Атом водорода, тройной час, Разное, другие, сфера png
2000x1985px
279.01KBМолекула Химия, одно-молекулярный магнит, синий, фотография, другие png
1072x1071px
186.62KB org/ImageObject»>Молекула воды Молекулярная модель Водородная связь Химическая связь, вода, текст, биология, химия png
1600x1491px
121.47KBБакминстерфуллерен Молекула Атом Наука, химия, фиолетовый, синий, химия png
1280x1280px
719.24KBВодородная связь Химическая связь Межмолекулярная сила Ковалентная связь Молекула, связывающая, разное, угол, текст png
1100x671px
41.26KBБакминстерфуллерен Молекула Нанотехнология Углерод, молекула, другие, сфера, шарик png
700x700px
261. 45KB
45KBХимия Водородная связь Химическая связь Ковалентная связь, органическая химия, химия, водород, украшения для тела png
1140x1106px
289.38KBАтом водорода Молекула воды Молекулярно-орбитальная диаграмма, вода, угол, электрон, химия png
2400x2008px
795.04KBголубая вода цепи иллюстрации, продление жизни украшения морщин старения тела, молекула иллюстрации, синий, другие, структура png
594x462px
330.47KBМолекула Вода Атом Химия Химическое соединение, молекула, сфера, химия, водород png
1200x864px
98.74KBСтруктура Льюиса Метан Простая связь Химическая связь Валентный электрон, молекулярная цепь, разное, угол, текст png
1041x1079px
10. 8KB
8KBAlamy Molecule Atom, контур, фиолетовый, синий, фотография png
800x785px
177.47KBМолекула Молекулярная модель, молекула, еда, другие, шарик png
2048x2048px
4.49MBСхема Водородная связь Молекула Вода Химическая связь, кислородный пузырь, угол, текст, логотип png
1638x1065px
59.27KBЧастичный заряд Электрический заряд Вода Молекула Химическая полярность, вода Химия, угол, текст, логотип png
2000x1356px
45.67KBХимия Молекула воды Структура Льюиса Теория ВСЭПР, вода, угол, текст, логотип png
773x576px
22.53KB org/ImageObject»>Структура Льюиса Ковалентная связь Диаграмма Молекула Химическая связь, другие, разное, угол, белый png
1100x933px
60.42KBМолекула воды Химическая формула Химическая связь Химия, вода, Химический элемент, сфера, химия png
590x590px
92.42KBПептид меди GHK-Cu Агонист гонадотропин-рилизинг-гормона Уход за кожей Синтез пептидов, Молекулярная биотехнология, синий, другие, химия png
609x450px
104.69KBАтомы в молекулах Вода Химическая полярность, вода, химия, водород, существительное Проект png
1200x1200px
261. 45KB
45KBМолекула Water Atom Chemistry Ковалентная связь, элемент покера, сфера, химия, водород png
640x599px
79.58KBMolecule Water Euclidean Компьютерный файл, молекула воды, сфера, химия, сюжет png
1200x1719px
679.74KBАтом Химия Модель Бора Лаборатория, Энергетика, разное, синий, угол png
1104x1081px
179.02KBХимия Водород Кислород Химическая реакция Вода, вода, угол, текст, химия png
1280x720px
80.82KBКруг Красный, круг, белый, шарик, обои для рабочего стола png
784x784px
41.19KB org/ImageObject»>Химическая полярность Дипольный момент связи Изогнутая молекулярная геометрия Вода, вода, угол, текст, логотип png
811x512px
6.2KBГрафит Углерод Аллотропия Макромолекула Алмаз, алмаз, химический элемент, угол, треугольник png
506x534px
53.65KBчерный шаблон искусства, лунная фаза луны, круглая граница, луна, абстрактное искусство, линия png
720x720px
58.16KBСтетоскоп Медицина Computer Icons Clinic, стетоскоп, сердце, шарик, больница png
881x1280px
438.46KB org/ImageObject»>Атомы в молекулах Атомы в молекулах Химия Атомное ядро, Господь Шива, разное, химический элемент, угол png
569x640px
53.32KBСпрайт Аура Анимация Супер Сайя, спрайт, синий, сфера, шарик png
1024x1024px
697.77KBХимическая полярность Частичный заряд Вода Одинокая пара Электрический заряд, ч, угол, текст, логотип png
1280x953px
34.07KBМолекула воды Молекулярная геометрия Химия Химическая связь, вода, угол, текст, логотип png
2000x857px
25.37KBДекоративные Бордюр Лунная фаза Круг, луна, форма, луна, монохромная фотография png
2324x2324px
104. 82KB
82KBКомпьютерные иконки, ДНК-молекула, другие, биология, шарик png
2169x2299px
1.25MBДиоксид серы структура Льюиса Молекула Молекулярная геометрия Резонанс, структура диоксида кремния, угол, текст, другие png
1100x568px
24.73KBТриглицерид Стеарин Глицерин Химия Стеариновая кислота, молекула, Разное, масло, шарик png
2000x1351px
369.52KBМолекула Химия Химическая структура, соединение, угол, цвет, днк png
512x512px
48.31KBПроизводство бисерной химии Dolkim Kimya Endüstri, другие, синий, химический элемент, другие png
1152x413px
264. 68KB
68KBДипольный момент связи Ковалентная связь Водородная связь Химическая связь, полярная биология, разное, угол, белый png
2844x745px
115.93KBМолекула химия ДНК пропидия моноазид Молекулярное связывание, синий, химический элемент, химия png
638x585px
69.09KBВодородная связь Вода Макромолекула Когезия, вода льется, синий, сфера, химия png
1150x752px
113.31KBМолекула эндокринного разрушителя Ацетилхолин, молекулярная цепь, фотография, сфера, шарик png
600x450px
144.62KBКомпьютерные Иконки Искусство, дизайн, фотография, прямоугольник, капля png
500x500px
55. 82KB
82KBМолекула Вода Ковалентная связь Химия Химическое соединение, печенье, химический элемент, сфера, химия png
1100x945px
146.41KB
иллюстрация красного, синего и серого цвета, молекула этанола, растворитель в химических реакциях Химическая структура Химия, молекула, Разное, другие, ацетон png
1000x1000px
264.86KB
Сила Ван-дер-Ваальса, лондонская дисперсионная сила, диполь, межмолекулярная сила, молекула, др., другие, электрон, химия png
2000x525px
51.68KB
Тетраэдрическая молекулярная геометрия Тетраэдр Структура Вода Лед, вода, угол, симметрия, сфера png
1015x912px
108.27KB
Циферблат Цифровые часы, цирк, угол, время, число png
2097x2097px
24.9KB
ковалентных связей | Биология для неспециалистов I
Результаты обучения
- Описывать характеристики ковалентных связей и различать полярные и неполярные связи
Другим способом соблюдения правила октета является разделение электронов между атомами с образованием ковалентных связей . Эти связи прочнее и встречаются гораздо чаще, чем ионные связи в молекулах живых организмов. Ковалентные связи обычно встречаются в органических молекулах на основе углерода, таких как наша ДНК и белки. Ковалентные связи также встречаются в неорганических молекулах, таких как H 2 O, CO 2 и O 2 . Одна, две или три пары электронов могут быть общими, образуя одинарную, двойную и тройную связи соответственно. Чем больше ковалентных связей между двумя атомами, тем прочнее их соединение. Таким образом, тройные связи являются самыми прочными.
Чем больше ковалентных связей между двумя атомами, тем прочнее их соединение. Таким образом, тройные связи являются самыми прочными.
Прочность различных уровней ковалентной связи является одной из основных причин, по которой живые организмы с трудом получают азот для использования в построении своих молекул, даже несмотря на то, что молекулярный азот N 2 — самый распространенный газ в атмосфере. Молекулярный азот состоит из двух атомов азота, соединенных тройной связью друг с другом, и, как и во всех молекулах, совместное использование этих трех пар электронов между двумя атомами азота позволяет заполнить их внешние электронные оболочки, что делает молекулу более стабильной, чем индивидуальную. атомы азота. Эта сильная тройная связь мешает живым системам расщеплять этот азот, чтобы использовать его в качестве составных частей белков и ДНК.
Образование молекул воды является примером ковалентной связи. Атомы водорода и кислорода, которые объединяются, образуя молекулы воды, связаны друг с другом ковалентными связями.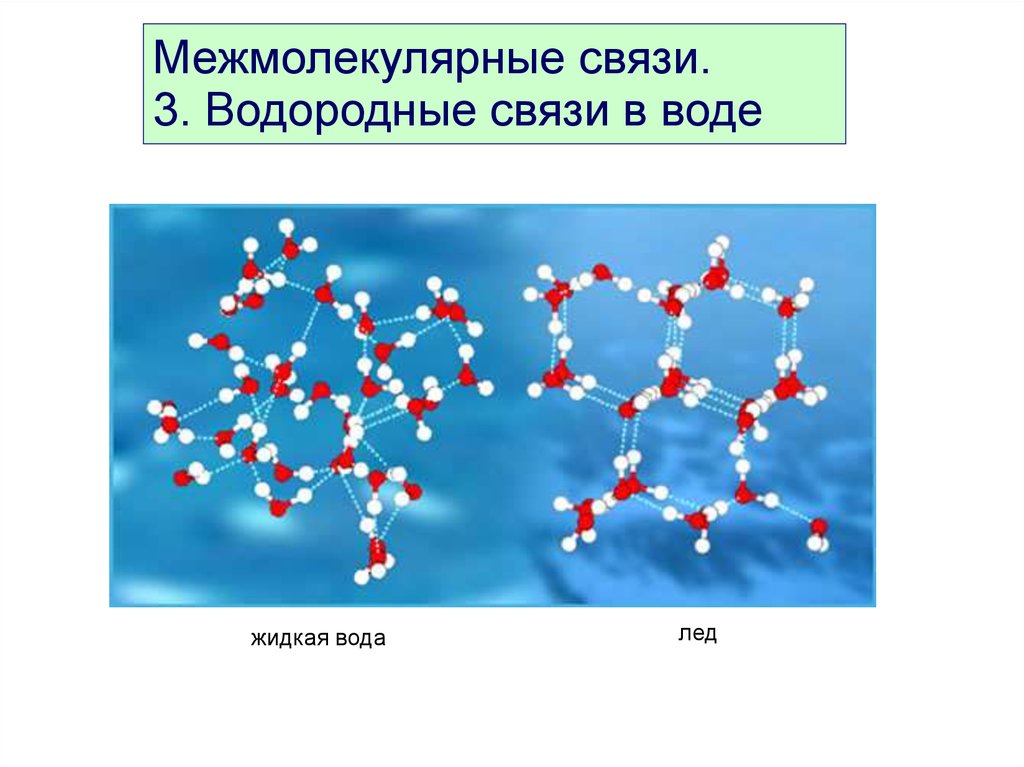 Электрон из водорода разделяет свое время между незавершенной внешней оболочкой атомов водорода и незавершенной внешней оболочкой атомов кислорода. Чтобы полностью заполнить внешнюю оболочку кислорода, который имеет шесть электронов во внешней оболочке, но который был бы более стабильным с восемью, необходимы два электрона (по одному от каждого атома водорода): отсюда известная формула H 2 O. Электроны распределяются между двумя элементами, чтобы заполнить внешнюю оболочку каждого из них, что делает оба элемента более стабильными.
Электрон из водорода разделяет свое время между незавершенной внешней оболочкой атомов водорода и незавершенной внешней оболочкой атомов кислорода. Чтобы полностью заполнить внешнюю оболочку кислорода, который имеет шесть электронов во внешней оболочке, но который был бы более стабильным с восемью, необходимы два электрона (по одному от каждого атома водорода): отсюда известная формула H 2 O. Электроны распределяются между двумя элементами, чтобы заполнить внешнюю оболочку каждого из них, что делает оба элемента более стабильными.
Посмотрите это короткое видео, чтобы увидеть анимацию ионной и ковалентной связи.
Вы можете просмотреть расшифровку «Анимации ионной и ковалентной связи» здесь (откроется в новом окне).
Полярные и неполярные ковалентные связи
Ковалентные связи бывают двух типов: полярные и неполярные. Неполярные ковалентные связи образуются между двумя атомами одного и того же элемента или между разными элементами, которые делят электроны поровну.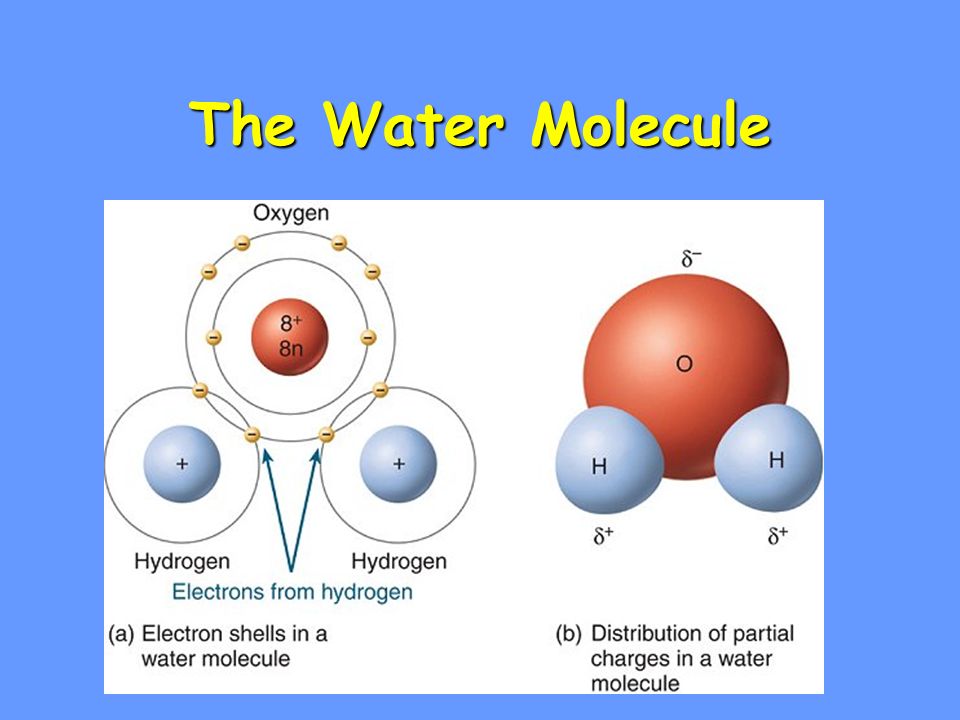 Например, атом кислорода может соединиться с другим атомом кислорода, чтобы заполнить их внешние оболочки. Эта ассоциация неполярна, потому что электроны будут равномерно распределены между каждым атомом кислорода. Две ковалентные связи образуются между двумя атомами кислорода, потому что кислороду требуется два общих электрона, чтобы заполнить его внешнюю оболочку. Атомы азота образуют три ковалентные связи (также называемые тройными ковалентными) между двумя атомами азота, потому что каждому атому азота требуется три электрона, чтобы заполнить его внешнюю оболочку. Другой пример неполярной ковалентной связи находится в метане (CH 4 ) молекула. Атом углерода имеет четыре электрона на внешней оболочке и нуждается в еще четырех электронах, чтобы заполнить ее. Он получает эти четыре из четырех атомов водорода, каждый атом дает один. Все эти элементы делят электроны поровну, создавая четыре неполярные ковалентные связи.
Например, атом кислорода может соединиться с другим атомом кислорода, чтобы заполнить их внешние оболочки. Эта ассоциация неполярна, потому что электроны будут равномерно распределены между каждым атомом кислорода. Две ковалентные связи образуются между двумя атомами кислорода, потому что кислороду требуется два общих электрона, чтобы заполнить его внешнюю оболочку. Атомы азота образуют три ковалентные связи (также называемые тройными ковалентными) между двумя атомами азота, потому что каждому атому азота требуется три электрона, чтобы заполнить его внешнюю оболочку. Другой пример неполярной ковалентной связи находится в метане (CH 4 ) молекула. Атом углерода имеет четыре электрона на внешней оболочке и нуждается в еще четырех электронах, чтобы заполнить ее. Он получает эти четыре из четырех атомов водорода, каждый атом дает один. Все эти элементы делят электроны поровну, создавая четыре неполярные ковалентные связи.
В полярной ковалентной связи электроны, общие для атомов, проводят больше времени ближе к одному ядру, чем к другому ядру.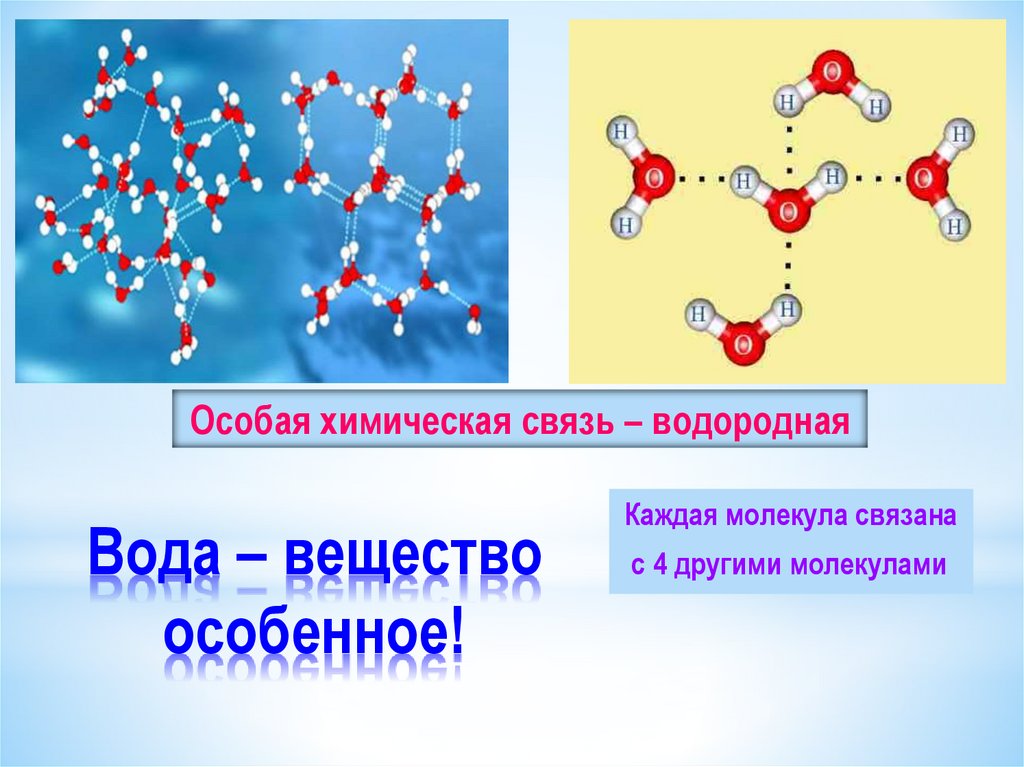 Из-за неравномерного распределения электронов между разными ядрами возникает слегка положительный (δ+) или слегка отрицательный (δ–) заряд. Ковалентные связи между атомами водорода и кислорода в воде являются полярными ковалентными связями. Общие электроны проводят больше времени возле ядра кислорода, придавая ему небольшой отрицательный заряд, чем возле ядер водорода, придавая этим молекулам небольшой положительный заряд. Полярные ковалентные связи чаще образуются, когда атомы, сильно различающиеся по размеру, имеют общие электроны.
Из-за неравномерного распределения электронов между разными ядрами возникает слегка положительный (δ+) или слегка отрицательный (δ–) заряд. Ковалентные связи между атомами водорода и кислорода в воде являются полярными ковалентными связями. Общие электроны проводят больше времени возле ядра кислорода, придавая ему небольшой отрицательный заряд, чем возле ядер водорода, придавая этим молекулам небольшой положительный заряд. Полярные ковалентные связи чаще образуются, когда атомы, сильно различающиеся по размеру, имеют общие электроны.
Примеры ковалентной связи
Рис. 1. Является ли молекула полярной или неполярной, зависит как от типа связи, так и от формы молекулы. И вода, и углекислый газ имеют полярные ковалентные связи, но углекислый газ является линейным, поэтому частичные заряды на молекуле компенсируют друг друга.
Видео-обзор
Посмотрите это видео, чтобы узнать больше о ковалентных связях и о том, как они образуются:
youtube.com/embed/Mo4Vfqt5v2A?feature=oembed&rel=0″ frameborder=»0″ allow=»accelerometer; autoplay; clipboard-write; encrypted-media; gyroscope; picture-in-picture» allowfullscreen=»» title=»Covalent Bonding»>
Попробуйте
Внесите свой вклад!
У вас есть идеи по улучшению этого контента? Мы будем признательны за ваш вклад.
Улучшить эту страницуПодробнее
Изучение круговорота воды
|

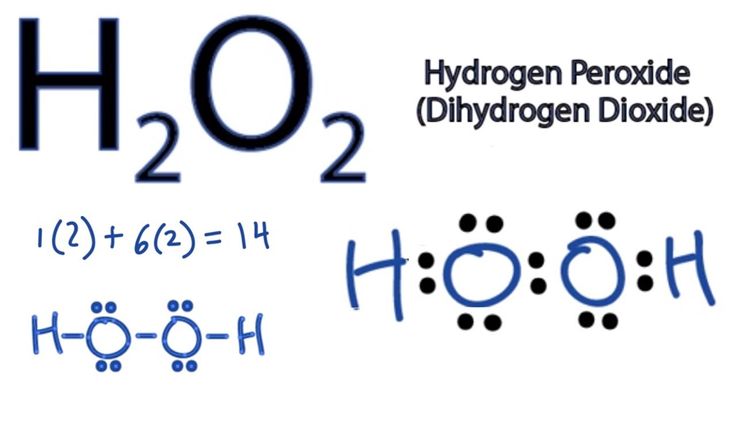 12KB
12KB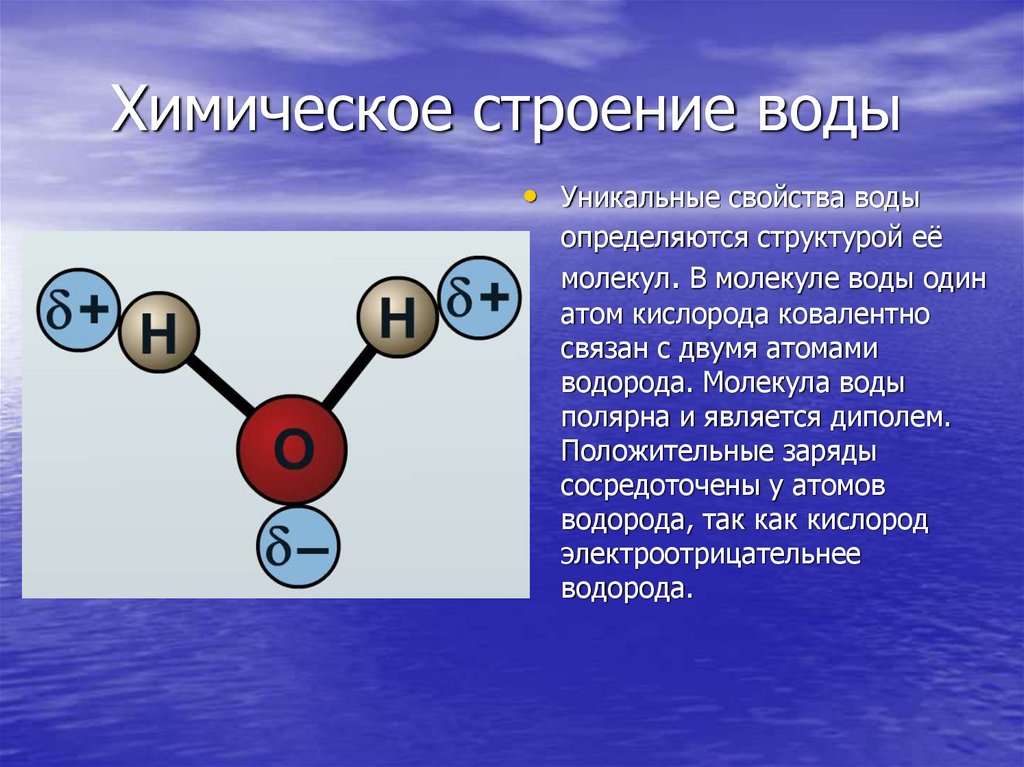 45KB
45KB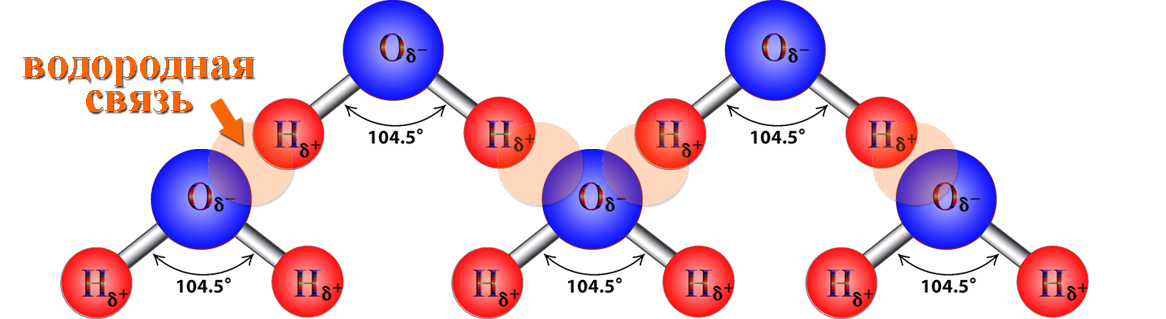 8KB
8KB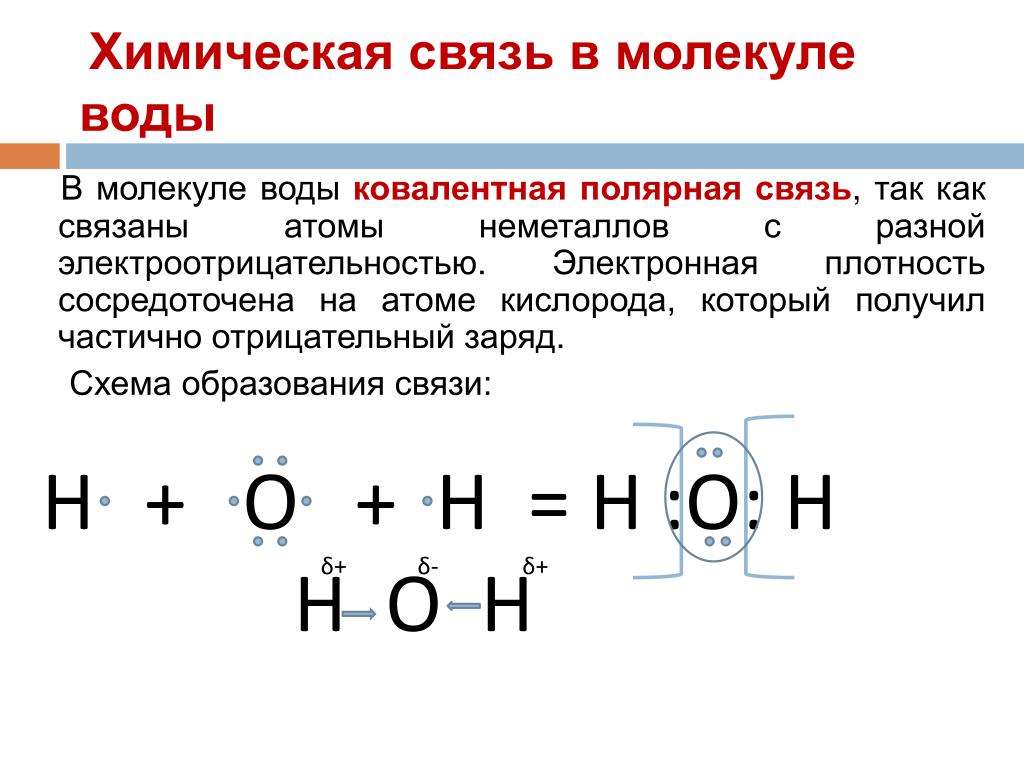 45KB
45KB 82KB
82KB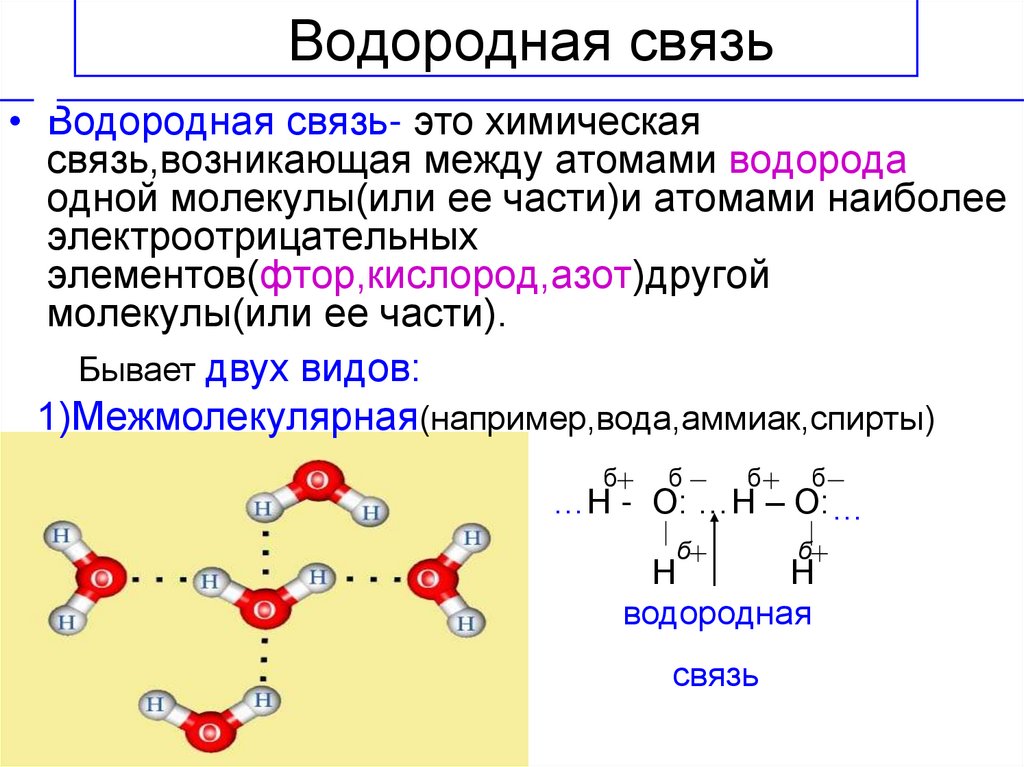 68KB
68KB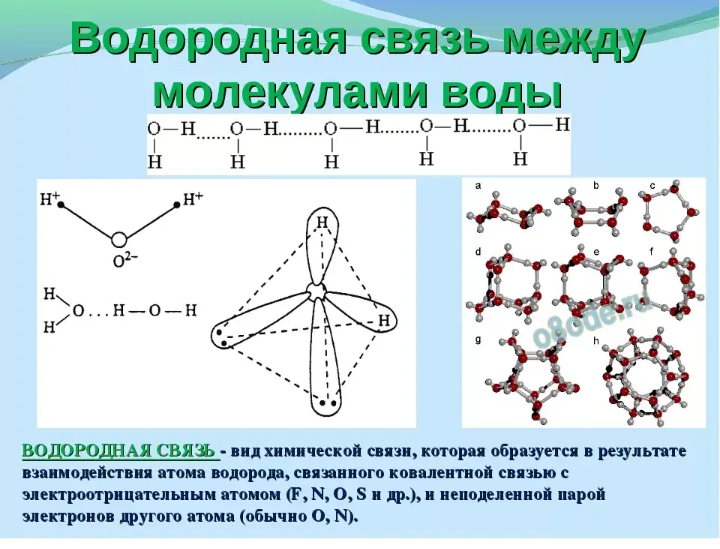 82KB
82KB е.
е.