Содержание
Урок «Растворимые и нерастворимые в воде вещества»
Цель: узнать опытным путем, какие твердые вещества растворяются в воде, а
какие не растворяются в воде.
Задачи:
Образовательные:
- Ознакомить обучающихся с понятиями: растворимые и нерастворимые
вещества. - Учить доказывать опытным путем правильность предположений о
растворимости (нерастворимости) твердых веществ.
Коррекционные:
Воспитательные:
Вид урока: лабораторная работа.
Средства обучения: учебник “Естествознание” Н.В. Королева, Е.В. Макаревич
Оборудование для лабораторной работы: мензурки, фильтры, инструкции.
Твердые вещества: соль, сахар, сода, песок, кофе, крахмал, земля, мел, глина.
Ход урока
I. Организационный момент
У: Здравствуйте, ребята. Поприветствуйте друг друга глазами. Рада вас
Рада вас
видеть, присаживайтесь.
II. Повторение пройденного
У: Повторим то, что уже знаем о воде:
– что происходит с водой при нагревании?
– что происходит с водой при охлаждении?
– что происходит с водой при замерзании?
– в каких трех состояниях встречается вода в природе?
У: Какие вы молодцы! Все знаете!
III. Изучение нового материала
(Заранее с учениками согласую группы, которыми они будут
работать, ребята сами выбирают руководителя лаборатории (на др. лабораторном
занятии может быть выбран другой ребенок), который записывает показатели опыта в
таблицу и дает устные комментарии при заполнении конечной части таблицы –
результата.)
У: Ребята, сегодня на лабораторной работе мы узнаем, какие вещества вода
может растворять, а какие – нет. Откройте тетрадь, запишите число и тему урока
«Растворимые и нерастворимые в воде вещества». (Прикрепляю к доске.)
(Прикрепляю к доске.)
Какую цель мы сегодня поставим на уроке?
Р: Узнать какие вещества растворяются в воде, а какие не растворяются. (Прикрепляю
к доске.)
У: Все вещества в природе можно разделить на две группы: растворимые и
нерастворимые. А какие вещества можно назвать растворимыми? (Сверимся с
учебником стр.80:2) Растворимые в воде вещества – такие, которые при
помещении их в воду становятся невидимыми и не оседают на фильтре при фильтрации.
(Прикрепляю к доске.)
У: А какие вещества можно назвать нерастворимыми? (сверимся с
учебником стр.47-2) Нерастворимые в воде вещества – такие, которые не
растворяются в воде и оседают на фильтре (прикрепляю к доске).
У: Ребята, как думаете, что нам понадобится для выполнения лабораторной
работы?
Р: Вода, какие-то вещества, мензурки, фильтр (показываю воду в
графине; мензурки, наполненные сл. веществами: солью, сахаром, содой, песком,
веществами: солью, сахаром, содой, песком,
кофе, крахмалом, мелом, глиной; пустые мензурки, фильтр).
У: Что такое фильтр?
Р: Устройство для очищения жидкостей от нерастворимых в ней веществ,
которые оседают на нем.
У: А из каких подручных средств можно изготовить фильтр? Молодцы! А мы
будем использовать вату (в воронку помещаю кусочек ваты).
У: Но прежде, чем приступить к выполнению лабораторной работы заполним
таблицу (таблица начерчена на доске, использую мелки двух цветов, если ученики
предполагают, что вещество полностью растворяется в воде, то отмечаю «+» во
второй колонке; если ученики предполагают, что вещество останется на фильтре ,
то «+» в третьей колонке, и наоборот; цветным мелком фиксирую предполагаемый
результат в четвертой колонке – Р (растворимое) или Н (нерастворимое))
|
Наши предположения |
Результат | ||
| Растворимость | Фильтрация | ||
1. Вода + песок Вода + песок | – | + | Н |
| 2. Вода + глина | |||
| 3. Вода + кофе | |||
| 4. Вода + крахмал | |||
| 5. Вода + сода | |||
6.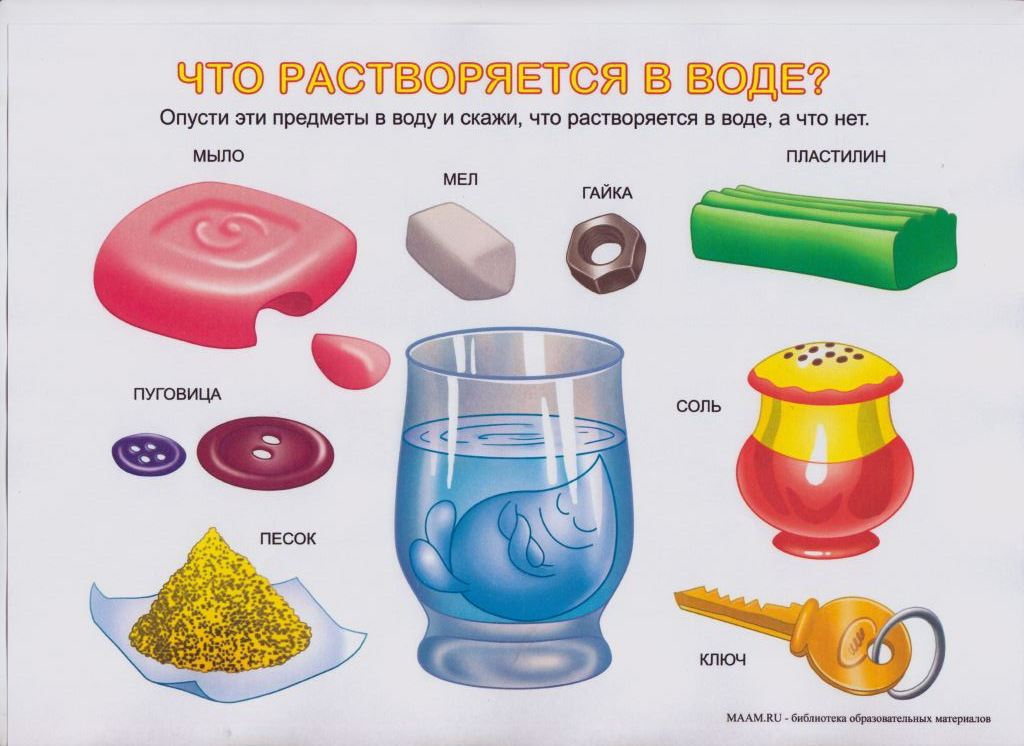 Вода + земля Вода + земля | |||
| 7. Вода + сахар | |||
| 8. Вода + мел | |||
У: А после выполнения лабораторной работы сверим наши предположения с
полученными результатами.
У: Каждая лаборатория будет исследовать два твердых вещества, все
результаты будете записывать в отчет «Растворимые и нерастворимые в воде
вещества». Приложение 1
У: Ребята, это первая ваша самостоятельная лабораторная работа и перед
тем, как вы приступите к ее выполнению, послушайте порядок ее проведения или
инструкцию. (Раздаю каждой лаборатории, после прочтения обговариваем.)
(Раздаю каждой лаборатории, после прочтения обговариваем.)
Приложение 2
Лабораторная работа
(Помогаю если есть необходимость. Может возникнуть трудность с фильтрацией
раствора кофе, т.к. фильтр окрасится. Для облегчения заполнения отчетов
предлагаю использовать словосочетания, которые прикрепляю на доску.
Приложение 3.)
У: А сейчас проверим наши предположения. Руководители лабораторий,
проверьте, подписан ли ваш отчет и прокомментируйте полученные опытным путем
результаты. (Начальник лаборатории отчитывается, фиксирую полученный результат
мелком другого цвета)
У: Ребята, какие вещества для исследования оказались
растворимыми? Какие нет? Сколько совпадений оказалось? Молодцы. Практически все
наши предположения подтвердились.
VI. Вопросы для закрепления
У: Ребята, а где человек использует раствор соли, сахара, соды, песка,
кофе, крахмала, глины?
VII. Итог урока
Итог урока
У: Какую цель мы сегодня ставили? Выполнили ее? Мы молодцы? Я вами очень
довольна! И ставлю всем «отлично».
VIII. Домашнее задание
У: Прочитаете текст для внеклассного чтения на стр.43, ответите на
вопросы.
Встаньте, пожалуйста, те ребята, кому наш урок не понравился.
Спасибо за честность. А теперь те, кому понравилась наша работа. Спасибо. Всем
до свидания.
Нерастворимые вещества в сточных водах
В стоках нерастворимые вещества могут находиться в двух состояниях: грубодисперсном и тонкодисперсном. Первые – это крупные взвеси. Вторые – пенные массы, суспензии, эмульсии.
По установленным методикам исследований загрязнений этого типа их часть задерживают на фильтре из бумаги и называют взвешенными веществами. Вес устанавливают по сухому веществу после просушки при температуре в +105 градусов С.
По корреляции уровню дисперсности загрязнений этого вида, они могут вести себя в воде по-разному: подниматься на поверхность, осаждаться на дно, сохраняться в жидкости во взвешенном состоянии.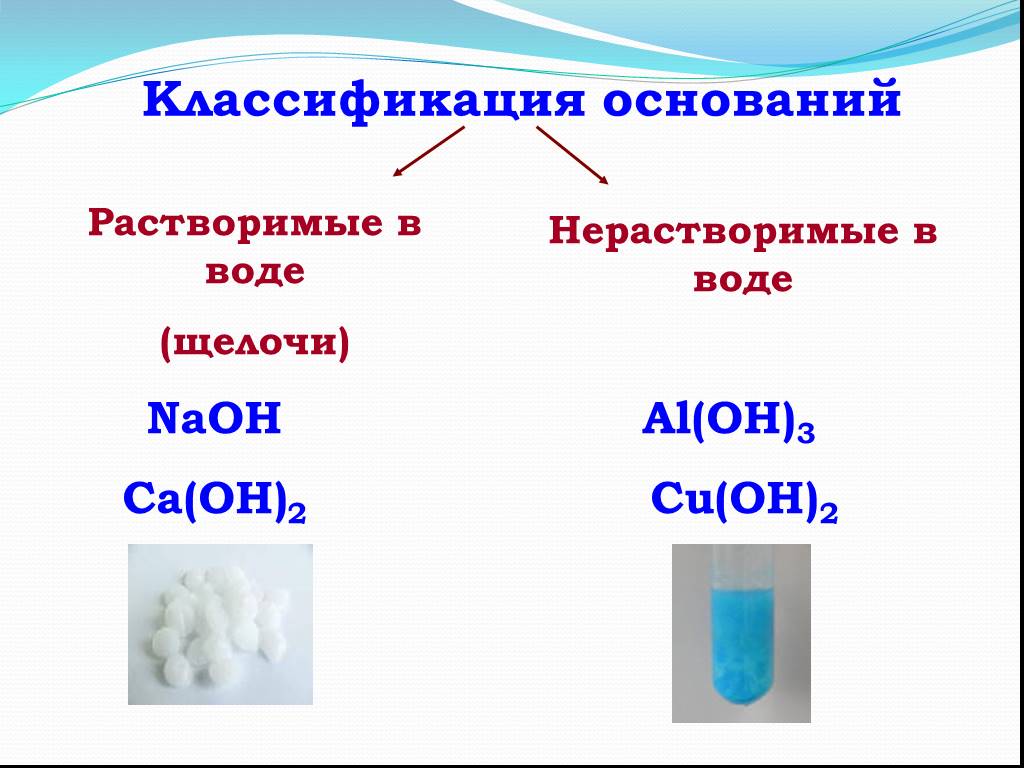 Тонкодисперсные примеси преимущественно находятся во взвешенном состоянии, поскольку сила тяжести для этих загрязнений меньше, чем сила воздействия среды.
Тонкодисперсные примеси преимущественно находятся во взвешенном состоянии, поскольку сила тяжести для этих загрязнений меньше, чем сила воздействия среды.
Оседающими примесями называют те, которые опускаются на дно в течение 2 часов в лабораторных условиях. Концентрация их выражается в сухом веществе после обработки высокой температурой или объему.
Типовые показатели для бытовых стоков составляют 65 грамм в сутки от 1 человека. Из них, на долю оседающих приходится от 35 до 50 граммов, что насчитывается до 75% от первоначальной массы.
По суточным нормативам водоотведения на 1 человека приходится 200 литров. Таким образом, концентрация варьируется от 35х1000/200 до 50х1000/200. Или 175 мг/литр до 250 мг/литр. При объемах водоотведения в 250 литров максимальный показатель концентрации может достигать 200 мг/литр. При 300 литров – 167 мг/литр.
Количество взвешенных частиц в сточных бытовых водах может быть увеличено посредством дробленого мусора из дома. Норма отходов, обработанных и сплавленных таким путем, составляет 100 грамм сухого вещества в сутки на одного человека.
При смешении бытовых и производственных стоков их осадок имеет особую структуру, он представляет собой промежуточное состояние между хлопьями и зернами. Для стоков предприятий вид взвешенных частиц не подлежит типовой классификации, а, следовательно, вид стоков тоже разнится.
Осадок нерастворимых веществ из предварительных отстойников характеризуют высокие показатели влажности. Соотношение объемов воды и объемов масс определяют в процентах. Влажность определяют путем сравнения веса сухого вещества после высушивания при температуре в +105 градусов С и изначальной массы.
В лаборатории объем осадка устанавливают в сосудах конической или цилиндрической формы, с градуированной нижней частью на кубические см, емкостью от 0,5 до 1 литра. Жидкость тщательно взбалтывают, затем определяют объемы осадка через 5, 10, 15 минут, полчаса, час, полтора часа, 2 часа. Показатели определяют в миллилитрах на один литр воды. Так определяется динамика образования осадка.
Также объемы осадка по контрольным замерам определяют в процентах от показателей, полученных после двух часового отстаивания, поскольку для бытовых стоков это время является моментом полного завершения процесса. Эти цифры выражают эффект осаждения. Графики для бытовых стоков представлены ниже.
Эти цифры выражают эффект осаждения. Графики для бытовых стоков представлены ниже.
Кривые осаждения взвешенных веществ, содержащихся в бытовых сточных водах
1– при начальной концентрации осаждающихся взвешенных веществ 0,5 – 1,5 мл/л; 2 – то же 1,6 – 2,5 мл/л; 3– то же 2,6 – 3,4 мл/л; 4 – то же 3,5 – 4,7 мл/л; 5 – то же 5,5 – 16,3 мл/л;
Всплывающие примеси с плотностью менее 1, такие, как масла, жиры, нефтепродукты, всплывают на поверхность. После завершения отстаивания их тоже можно измерять по массе или объему. После двухчасовой процедуры эти загрязнения имеют влажность в 97,5%. После уплотнения – до 93%. Объемы сухого вещества увеличиваются с 2,5%, максимально – до 7%. Поскольку влажность велика, плотность осадка почти тождественна плотности воды. Так можно считать, что объемы масс изменяются пропорционально весу. Показатели при уплотнении снижаются обратно пропорционально % содержания сухого вещества. Их можно рассчитать по формуле:
W2=W1(100- p1)/(100-p2), где
- W1 – объем осадочных масс при влажности p1;
- W2 – объем осадка при влажности p2.

Изменения объемов осадочных масс соответствует изменению влажности, при ее показателях не ниже 80%. При прохождении этого барьера наблюдается порывистый уход влаги, и расчеты – не корректны.
Для отстойников объемы осадка после процедуры, длящейся 1,5 часа, принято выражать 0,8 литра из расчета за 1 сутки на 1 человека. Влажность определяется в 95%, а вес по сухому веществу – в 40 граммов. Так же есть типовые характеристики по прохождению стоков в очистных сооружениях: на песколовках задерживается до 12 грамм, на решетках – до 2 грамм. Цифры даны на 1 человека в сутки.
Поскольку в стоках содержатся неорганические примеси и органика, их нужно определять. Для этого осадок высушивают при температуре в +105 градусов С. Массы взвешивают. Далее следует прокалка при температуре в +600 градусов С. Органика выгорает, неорганические вещества превращаются в золу. Отношение ее веса к массе сухого вещества в процентах показывает зольность. Потери – определяют беззольные объемы. Для бытовых стоков вес зольных масс варьируется от 20 до 30%. Для смеси бытовых и промышленных вод показатели могут незначительно отклоняться.
Для бытовых стоков вес зольных масс варьируется от 20 до 30%. Для смеси бытовых и промышленных вод показатели могут незначительно отклоняться.
Видео с вопросами: Использование правил растворимости в воде для определения того, какое соединение хлорида является нерастворимым
Стенограмма видео
Какое из следующих
соединения хлора нерастворимы в воде? (А) хлорид калия, (Б) серебро
хлорид, (C) хлорид алюминия, (D) хлорид магния или (E) хлорид натрия.
Вопрос просит нас
определить соединение, нерастворимое в воде, что означает, что при смешивании с водой
соединение не может быть растворено. Это означает ионное соединение,
который состоит из катионов и анионов, при добавлении в воду не распадается
на соответствующие ионы и не растворяются в воде, вероятно, оседая на
дно контейнера. Мы можем определить нерастворимое
соединения, ссылаясь на правила растворимости в воде.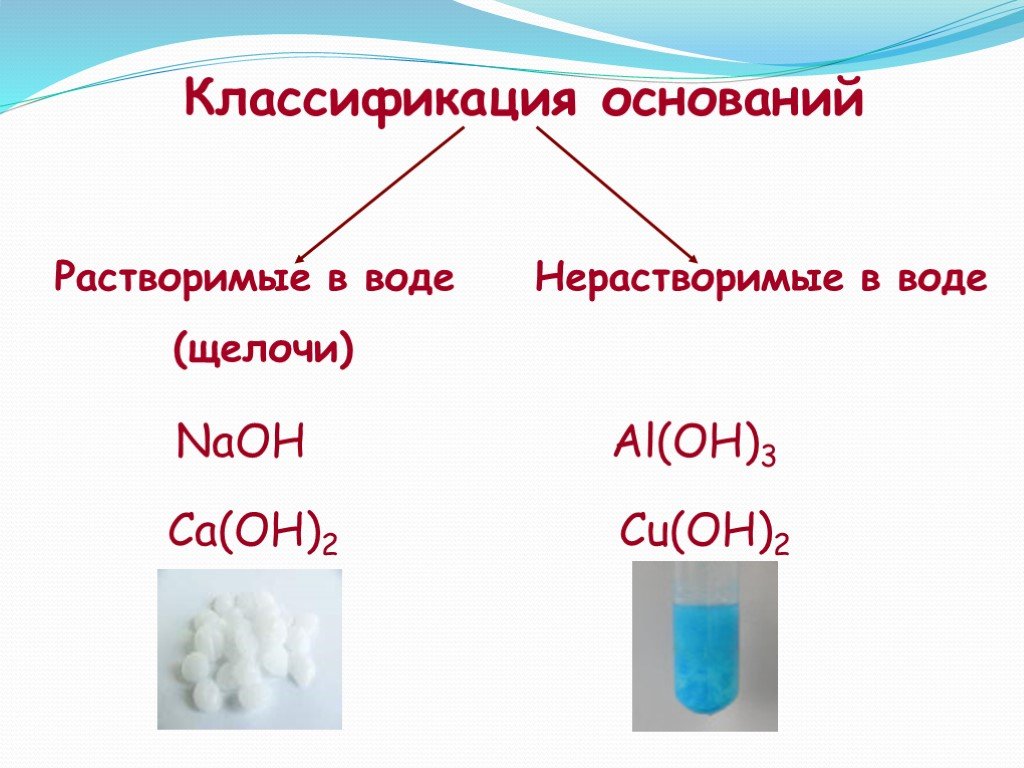
Сначала рассмотрим соединения, которые
считаются растворимыми в воде и какие ионы они содержат. Соединения, содержащие щелочной металл
катионы или ионы лития, натрия, калия, рубидия или цезия растворимы в воде
а также соединения, содержащие ионы аммония, нитрат-ионы, бикарбонат-ионы,
ионы хлората или ионы ацетата. Соединения, содержащие ионы галогенидов
такие как хлорид-ионы, бромид-ионы или йодид-ионы, также растворимы в воде, если только
соединение также содержит ионы серебра, ионы ртути (I) или ионы свинца (II). Соединения, содержащие сульфат-ионы
растворимы, если соединение также не содержит серебра, кальция, стронция, бария,
ионы ртути(I) или свинца(II).
Давайте посмотрим на ионы, которые
делают соединения нерастворимыми в воде. Соединения, содержащие карбонат
ионы, фосфат-ионы, сульфид-ионы или гидроксид-ионы обычно считаются
нерастворим в воде, за исключением ионов лития, натрия, калия, рубидия, цезия или
также присутствует аммоний. Соединения, содержащие сульфид-ионы
Соединения, содержащие сульфид-ионы
имеют дополнительные исключения в отношении их нерастворимости, когда ионы кальция, бария или
стронция присутствуют с соединениями, содержащими гидроксид-ионы, имеющими такое же
дополнительные исключения.
Ионные соединения, с которыми мы работаем
со всеми хлоридами, что мы можем видеть из названий соединений, приведенных в
варианты ответа. Если мы найдем наше правило разрешимости
относительно соединений, содержащих ионы хлорида, мы можем видеть, что соединения хлорида
обычно водорастворимы, если соединение также не содержит серебра, ртути (I) или
катионы свинца(II).
Посмотрим на ответ
выбор. Вариант ответа (А) содержит
ионов калия, который является щелочным металлом, и поэтому это соединение растворимо в
вода без исключения. Мы можем исключить выбор ответа
(А). Вариант ответа (B) содержит
Вариант ответа (B) содержит
Серебряный. Когда хлоридное соединение содержит
серебра, соединение нерастворимо, как указано в исключении из растворимости
хлоридсодержащие соединения. Следовательно, вариант ответа (В) является
соединение, нерастворимое в воде. Мы можем подтвердить это как ответ
варианты (C), (D) и (E) все содержат катионы, которые не указаны в качестве исключений из
растворимость хлорсодержащих соединений. Варианты ответов (C), (D) и (E)
все растворимы в воде.
Следовательно, ионное соединение
хлорид, нерастворимый в воде – вариант ответа (Б), хлорид серебра.
Растворимость в воде
| НИЗКАЯ | УМЕРЕННЫЙ | ВЫСОКИЙ |
Вы когда-нибудь пробовали растворять сахар в воде? Это может занять несколько минут. Перемешивание и немного тепла могут помочь ему лучше раствориться. Сахар хорошо растворяется в воде, но есть предел. Если вы добавите в воду слишком много сахара, вы увидите крупинки на дне, как бы долго вы ни перемешивали смесь.
Сахар хорошо растворяется в воде, но есть предел. Если вы добавите в воду слишком много сахара, вы увидите крупинки на дне, как бы долго вы ни перемешивали смесь.
Подобно сахару и соли, некоторые пестициды хорошо растворяются в воде.
- Легко растворяются. Их молекулы связываются с молекулами воды.
- Хорошо растворимые пестициды переносятся с водой по мере ее перемещения в окружающей среде.
- Они могут двигаться вниз по течению и сквозь почву. Это увеличивает их вероятность попадания в грунтовые воды.
- Они с большей вероятностью поглощаются корнями растений.
- Маловероятно, что они попадут в наш организм через кожу.
Подобно нефти, некоторые пестициды плохо растворяются в воде.
- Они остаются отдельными в присутствии воды, даже если вы пытаетесь ее взболтать. Молекулы масла не связываются с молекулами воды.
- Нерастворимые пестициды с большей вероятностью прилипают к почве в окружающей среде.
 Они не будут путешествовать так много с водой, как она движется.
Они не будут путешествовать так много с водой, как она движется. - Они вряд ли будут поглощаться корнями растений, но есть исключения.
- Они с большей вероятностью проникают через кожу, если воздействие длится достаточно долго.
Растворимость в воде измеряется в мг/л, это вес пестицида (в миллиграммах), который растворяется в одном литре воды (л).
| Низкая растворимость в воде: | менее 10 мг/л или 10 частей на миллион 1 |
| Умеренная растворимость в воде: | 10-1000 мг/л или 10-1000 частей на миллион 1 |
| Высокая растворимость в воде: | более 1000 мг/л или 1000 частей на миллион 1 |
1. Рональд Ней, «Судьба и перенос органических химических веществ в окружающей среде», 1995; п. 10
Если у вас есть вопросы о пестицидах и питьевой воде или о любой другой теме, связанной с пестицидами, звоните в NPIC по телефону 1-800-858-7378 (с 8:00 до 12:00 по тихоокеанскому времени) или по электронной почте npic@ace .


 Они не будут путешествовать так много с водой, как она движется.
Они не будут путешествовать так много с водой, как она движется.