Содержание
Три состояния воды в природе – примеры и описание кратко (3 класс, окружающий мир)
4.6
Средняя оценка: 4.6
Всего получено оценок: 128.
Обновлено 1 Июля, 2021
4.6
Средняя оценка: 4.6
Всего получено оценок: 128.
Обновлено 1 Июля, 2021
Вода — удивительное вещество. В природе её можно наблюдать в разных видах. Это дождь и снег, град и лёд на реке, иней и роса, летний и зимний туман. Почему вода такая разная, как объяснить природные явления, связанные с водой, что такое природный водоворот воды? Рассмотрим эти вопросы в статье, где кратко описаны свойства воды в разных состояниях.
Три состояния воды
Если вспомнить, как выглядит окружающий мир в разное время года, легко назвать три состояния воды: жидкое, твёрдое, газообразное.
- В жидком виде вода заполняет русла рек, углубления в рельефе, образуя озёра и пруды, льётся с крыш во время дождя. Это болота, каналы, моря и океаны.
- Твёрдое состояние вода демонстрирует зимой.
 Это снегопады, метели, иней, гололедица, лёд на реке.
Это снегопады, метели, иней, гололедица, лёд на реке. - В виде газа вода бывает невидимой. Например, в воздухе всегда есть пар. Высокое содержание пара ощущается как влажный воздух. Если температура воздуха понижается, пар превращается в капли воды и становится виден. Это туман.
Зимой тоже бывает туман. При похолодании ниже –10–15 °С пар в воздухе превращается в крошечные ледяные кристаллы, которые сверкают на солнце. Это красиво, но опасно, так как видимость на дорогах крайне низкая.
Рис. 1. Зимний туман.
Превращение воды в пар
Процесс превращения воды в пар называется испарением. Испарение хорошо видно над горячей водой, если вынести её на холод. Такое же явление наблюдается над горячими природными источниками, особенно зимой.
Рис. 2. Горячий источник зимой.
Обычно испарение происходит незаметно. Забытый стакан с водой через некоторое время оказывается пустым. Интенсивное испарение происходит при закипании воды (+100 °С), когда из носика чайника вырывается струя пара.
Если под такую струю подставить холодный предмет, он покроется каплями воды. Стекающую воду можно собрать в стакан. Этот опыт демонстрирует конденсацию воды.
Водный круговорот
Сочетание испарения и конденсации объясняет природный круговорот воды. Вода испаряется с поверхности водоёмов и почвы, поднимается в верхние слои атмосферы, где значительно холоднее. Происходит конденсация, пар превращается в капли воды или льдинки. Так образуются облака. Когда в облаке накапливается избыток воды или снега, начинается дождь или снегопад.
Замерзание воды
При снижении температуры воздуха ниже 0 °С вода покрывается тонкой коркой льда. При продолжительных морозах лёд становится толще. На реках и озёрах начинается ледостав. В городах заливают катки. Таяние льда начинается при температуре выше 0 °С.
Лёд занимает больший объём, чем вода, которая замёрзла. Поэтому стеклянные бутылки с минеральной водой, соками нельзя хранить на морозе. Они лопнут.
Лёд значительно легче воды и всегда поднимается к поверхности. Ледяной покров реки предохраняет её от промерзания, так как является хорошим теплоизолятором.
Ледяной покров реки предохраняет её от промерзания, так как является хорошим теплоизолятором.
Быстро текущая вода замерзает с трудом. На некоторых горных реках не бывает ледостава.
Замёрзший Ниагарский водопад — большая редкость. Даже в сильные морозы он не промерзает целиком. Под ледяным панцирем тонкой струйкой стекает вода.
Рис. 3. Замёрзший Ниагарский водопад.
Что мы узнали?
Вода в природе представлена в трёх состояниях. Она может быть твёрдой (лёд), жидкой (вода), газообразной (пар). Вода в разных состояниях имеет особые свойства. Примеры, приведённые в статье, можно использовать для доклада на урок в 3 классе.
Тест по теме
Доска почёта
Чтобы попасть сюда — пройдите тест.
Пока никого нет. Будьте первым!
Оценка доклада
4.6
Средняя оценка: 4.6
Всего получено оценок: 128.
А какая ваша оценка?
Состояния воды в природе: условия перехода, необычные факты
Удивительная вода: Freepick
Известные человечеству состояния воды не ограничиваются тремя базовыми вариантами, о которых большинство слышало в школе. Как создать горячий лед или сухую воду? Возможно ли наблюдать воду сразу жидкой, твердой и газообразной? Как на эти и многие другие вопросы отвечает наука?
Как создать горячий лед или сухую воду? Возможно ли наблюдать воду сразу жидкой, твердой и газообразной? Как на эти и многие другие вопросы отвечает наука?
Три состояния воды в природе
Воду как прозрачную жидкость, у которой отсутствует запах и вкус, знают все. Но только ли такой она бывает? Прежде чем ответить на вопрос о том, каковы возможные агрегатные состояния воды, выясним, что такое агрегатное состояние.
В физике под этим понятием подразумевают состояние вещества, обусловленное определенной температурой и давлением. Науке известно:
- газообразное;
- твердое;
- жидкое состояние вещества.
При этом одно и то же вещество может менять свое состояние в зависимости от условий окружающей среды.
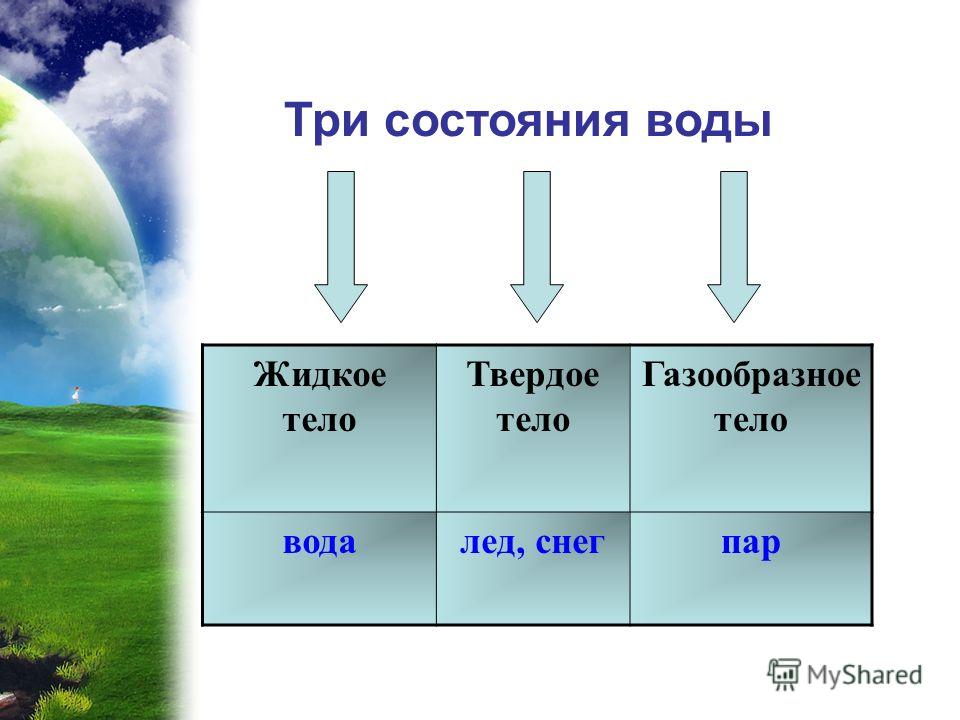
Хорошо известны три агрегатных состояния воды:
- Твердое состояние воды (лед). В этом состоянии частички воды имеют друг с другом сильную взаимосвязь. Кубик льда хорошо сохраняет форму, он довольно прочный и твердый на ощупь.

- Жидкое состояние. В нем частицы теряют строгую упорядоченность. Связи между ними разрушаются, а жидкость принимает форму того сосуда, в который она помещена. Однако молекулы все еще располагаются достаточно близко друг к другу.
- Газообразное состояние воды (пар). В этом состоянии частички максимально беспорядочно двигаются, а расстояния между ними становятся очень большими.
Состояние воды прямо связано с температурой. Эта жидкость обладает уникальным свойством: свое жидкое состояние она сохраняет в широком диапазоне от 0 до 100 °С. В верхней точке начинается закипание с постепенным переходом в газообразную фазу. При снижении температуры ниже 0 °С происходит образование льда.
При этом в природе можно часто увидеть, как вода и лед соседствуют друг с другом, а в этом время над ними витает невидимый глазу водяной пар. Благодаря таким удивительным способностям воды происходит ее постоянный круговорот в природе.
Жидкое состояние воды: Freepick
Если рассматривать все три состояния воды, то жидкое остается одним из наиболее важных.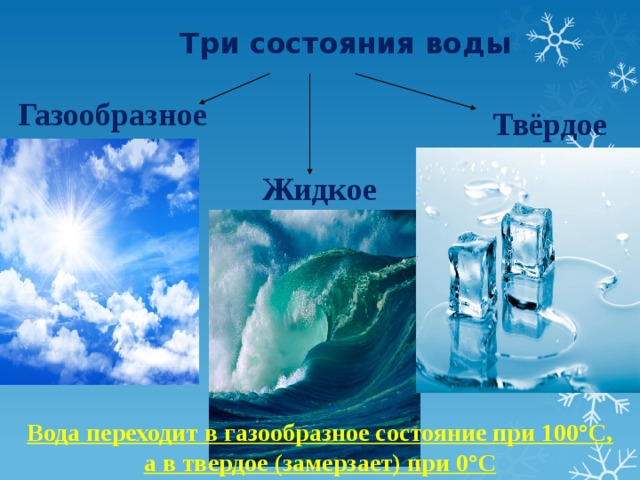 Жидкая вода служит универсальным растворителем для множества других веществ, является основным компонентом организма человека и средой для протекания всех химических процессов.
Жидкая вода служит универсальным растворителем для множества других веществ, является основным компонентом организма человека и средой для протекания всех химических процессов.
Более того, именно у жидкой воды ученым удалось обнаружить дополнительные состояния — «обычная» и «аномальная» вода. Последняя образуется при температуре –63 °С и может находиться в одном из двух состояний:
- иметь низкую плотность при низком давлении;
- иметь высокую плотность при высоком давлении.
Две эти жидкости заметно различаются по свойствам, а их плотность отличается на 20%, поэтому они не могут смешиваться между собой. Как ученым удалось уловить эти состояния, ведь хорошо известно, что происходит с водой при замерзании: она переходит в твердую фазу — в лед?
Авторам исследования понадобились специальные приборы. С помощью инфракрасного лазера лед нагревали, при этом образовывалась жидкая вода с высокой плотностью, а давление сохраняли повышенным.
За этим процессом вели наблюдение рентгеновским лазером.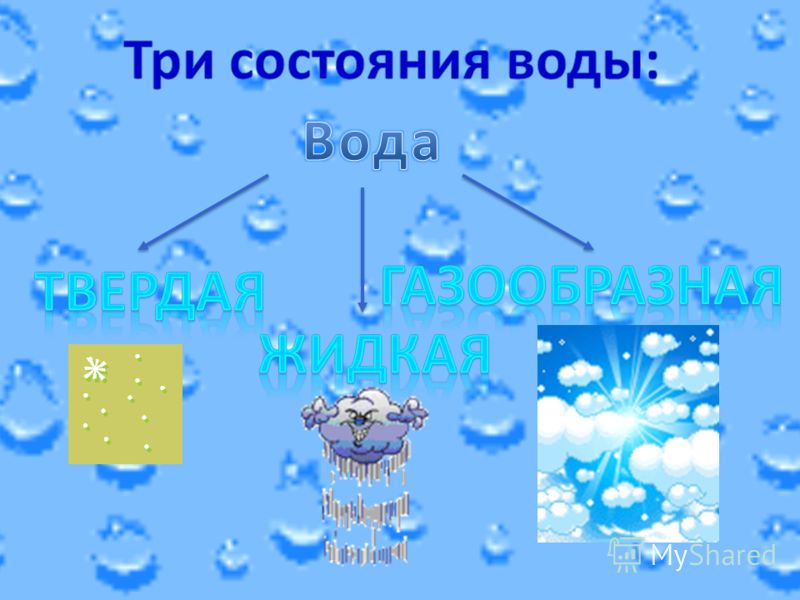 Было замечено образование пузырьков «аномальной» воды. Появлялись они на крайне маленький промежуток времени: были видны до 3-х микросекунд.
Было замечено образование пузырьков «аномальной» воды. Появлялись они на крайне маленький промежуток времени: были видны до 3-х микросекунд.
Эти исследования доказали, что ученым еще далеко не все известно о воде, хотя мы и сталкиваемся с ней ежедневно и ежечасно. Ее свойства продолжают изучать и открывать новые грани.
Состояния воды: необычные факты
Твердое состояние воды (лед): Freepick
Ученым оказалось недостаточно трех агрегатных состояний воды, поэтому они изобрели целый ряд необычных вариантов и продолжают работать в этом направлении.
Лед VII (горячий лед)
Для обычного холодного льда используется обозначение «лед Ih». Когда при нормальном давлении снижается температура и вода замерзает, то атомы кислорода в ее молекулах образуют шестигранники.
Если же давление будет возрастать, то можно получить лед VII, атомы которого располагаются в виде куба. Он очень противоречив:
- Этот лед горячий, так как формируется в необычных условиях.

- На Земле он мог бы образоваться глубоко под мантией, в области высокого давления.
- Но там и температура очень высока, из-за чего вода сразу же испаряется.
Ученым удалось создать такой лед в лаборатории. Кроме того, он был обнаружен в алмазах, которые нашли в недрах нашей планеты.
Сухая вода
Ее получают путем смешивания обычной воды и двуокиси кремния. Несмотря на то что жидкости в ней 25%, она является сухим веществом. Сахарообразные крупинки внутри содержат воду, а сверху покрыты оксидом кремния.
Сухую воду создали в 1968 для нужд косметологии. Затем о ней забыли, а сейчас рассматривают варианты использования для поглощения углекислого газа, чтобы хранить и транспортировать химикаты.
Сверхзвуковой лед
Этот лед также называют льдом XVIII. Он образуется при очень сильном повышении давления и температурных показателей — до тысяч градусов и миллионов атмосфер. В горячем плотном и черном на виде веществе узнать лед очень трудно.
Получить его экспериментально удалось совсем недавно с применением мощных лазеров, которые создавали ударные волны, мгновенно повышая температуру и давление. При этом происходило разделение атомов водорода и кислорода с параллельным образованием твердых кристаллов.
Сверхкритическая вода
Вода может стать такой из газообразного состояния. Это очень странный пар, который нельзя назвать газом. Образование такой воды происходит при 373 °С и давлении 220 бар. Снова жидкой она уже стать не может. Такая вода способна проходить сквозь твердые вещества, как газы, и быть растворителем подобно жидкости.
Аморфный лед
Этот лед получается при мгновенном охлаждении воды, когда молекулы не кристаллизуются, как следует. Получается своеобразное стекло — очень медленно движущаяся жидкость.
На нашей планете аморфный лед встречается редко, а вот на просторах Вселенной вода часто существует в этом состоянии.
Тройная точка воды
В этой точке вещество одновременно существует как твердое, жидкое и газообразное. Такое специфическое равновесие достигается путем сочетания показаний давления и температуры. Для воды они составляют 0,01 °С и 0,0060366 атмосфер.
Такое специфическое равновесие достигается путем сочетания показаний давления и температуры. Для воды они составляют 0,01 °С и 0,0060366 атмосфер.
Эта точка применяется, когда определяется температура по Кельвину, калибруются термометры и определяются тройные точки для других жидкостей. Из тройной точки воду можно перевести в любое из ее возможных агрегатных состояний.
Горящий лед
Это не чистая вода, а сочетание воды и метана, которое способно гореть, словно бумага. Такой лед образуется в результате естественных процессов в океанских глубинах, в зонах вечной мерзлоты, может засорить нефтепровод или газопровод.
При его формировании вначале замораживается метан, который постепенно покрывает настоящий лед. Ученые рассматривают его как чистый и экологичный источник топлива.
Таковы обычные и нестандартные состояния воды. Природа отменно поработала, чтобы создать такое чудо, но и ученые не остались в стороне. Они до сих пор работают над получением воды в уникальных состояниях.
Оригинал статьи: https://www.nur.kz/family/school/1904441-sostoyaniya-vody-v-prirode-usloviya-perehoda-neobychnye-fakty/
Состояние воды: газообразное, жидкое и твердое
Пресная вода | Water Science
часы
Обновлено
Пресновода, Water Science
Поскольку вода чрезвычайно универсальна, она может заменять состояния на следующие три формы:
- Газ
- Жидкость
- Сплошные
Состояние воды
Существует 3 типа фазовых переходов воды:
- ИСПАРЕНИЕ: когда вода находится в жидком состоянии, она может испаряться в газообразное состояние или замерзать в твердое состояние.

- ПЛАВЕНИЕ: Если вода находится в замороженном состоянии, то при добавлении тепла она тает и снова превращается в жидкость.
- КОНДЕНСАЦИЯ: Когда водяной пар в воздухе конденсируется, он снова превращается в жидкость, например, в виде дождя.
Существуют также фазовые переходы, при которых вода пропускает промежуточное жидкое состояние:
- СУБЛИМАЦИЯ: Сублимация происходит, когда вода сразу переходит из состояния в твердое.
- ОТЛОЖЕНИЕ: Отложение противоположно сублимации. Это когда газ переходит в твердое, минуя жидкое состояние.
Вода непрерывно переходит в фазы со слабыми связями. Итак, давайте поговорим о некоторых удивительных свойствах воды, благодаря которым все это происходит.
Каковы уникальные свойства воды?
Молекулы воды состоят из двух атомов водорода и одного атома кислорода. Таким образом, химический символ воды — H 2 O.
Но важно знать о воде то, что они несимметричны. Оба атома водорода свисают с атома кислорода под углом.
Поскольку вода имеет положительную и отрицательную полярные стороны, H 2 O может растворять другие минералы. Когда он что-то растворяет, он делает это раствором.
Жидкая вода образует слабые связи с другими атомами. Именно из-за этих слабых связей вода может непрерывно превращаться в 3 фазы воды.
Как испарение превращает жидкую воду в пар?
Если добавить достаточно энергии солнца, вода испарится из жидкости в газ. Другими словами, он разрывает ковалентную связь воды.
При испарении выделяется отдельная молекула, которая улетает с поверхности в виде пара. Поскольку молекулы воды поглощают энергию тепла, эти энергетические молекулы остаются дальше друг от друга.
Чтобы превратить жидкость в газ, требуется огромное количество энергии. Например, для испарения требуется 540 калорий на грамм. Это хорошо, потому что мы не хотим, чтобы вся вода на Земле испарялась слишком быстро.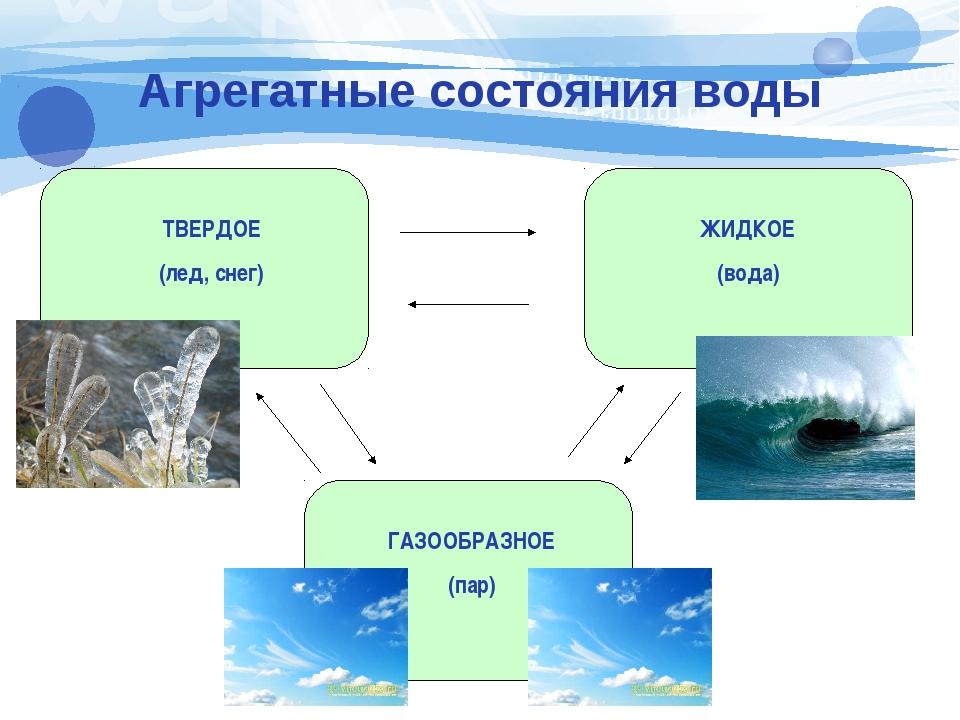
Земля на 71% состоит из воды, поэтому испарение происходит повсюду. Но быстрее всего это происходит на экваторе, потому что он получает больше всего солнечного света.
Но в среднем вода остается в атмосфере лишь короткий период времени. Фактически он проводит в атмосфере менее суток, где конденсируется и выпадает в осадок.
Как конденсат переходит из водяного пара в жидкость?
Конденсация по существу противоположна испарению. Вместо того, чтобы получать тепло, молекулы воды теряют энергию из-за потери тепла во время конденсации. В свою очередь, они переходят из газообразного состояния в жидкое.
Конденсация — это процесс образования мельчайших капелек воды. Они окружают частицу пыли или соли. В конце концов, они становятся слишком тяжелыми и выпадают в виде осадков.
Например, жидкая вода стекает по охлажденному стакану лимонада в жаркий день из-за конденсата. Когда водяной пар в воздухе вступает в контакт с холодным стеклом, он замедляет молекулы воды, заставляя их слипаться и образовывать жидкость.
В целом начало гидрологического цикла начинается с испарения с поверхности океана. Затем вода конденсируется и осаждается обратно в океан, ручьи, ледники или подземные воды. В конце концов, он возвращается в океан. И так весь цикл.
Что такое замораживание, плавление, осаждение и сублимация?
Когда температура опускается ниже точки замерзания, вода может замерзнуть. Когда вода замерзает, она расширяется. В озерах и ручьях замерзший лед более плавучий и остается наверху. Это уникальное свойство воды имеет важное значение для жизни и биосферы.
Плавление по существу противоположно замораживанию. Когда температура повышается до точки плавления, вода может таять. Это важно для понимания последствий глобального потепления. Например, если бы все ледники растаяли прямо сейчас, уровень моря поднялся бы примерно на 30 метров.
Наконец, две последние фазы — осаждение и сублимация, которые полностью противоположны друг другу. Сублимация — это переход твердого состояния в газообразное, не переходя в промежуточную жидкую фазу.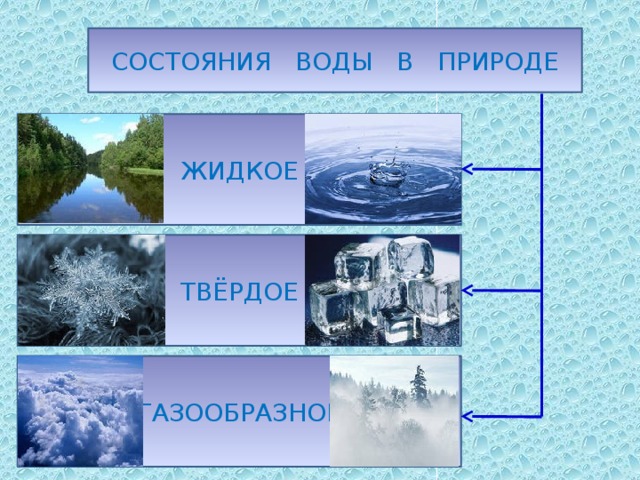 Тогда как осаждение — это когда газ переходит в твердое состояние.
Тогда как осаждение — это когда газ переходит в твердое состояние.
Состояния воды: газообразное, жидкое и твердое
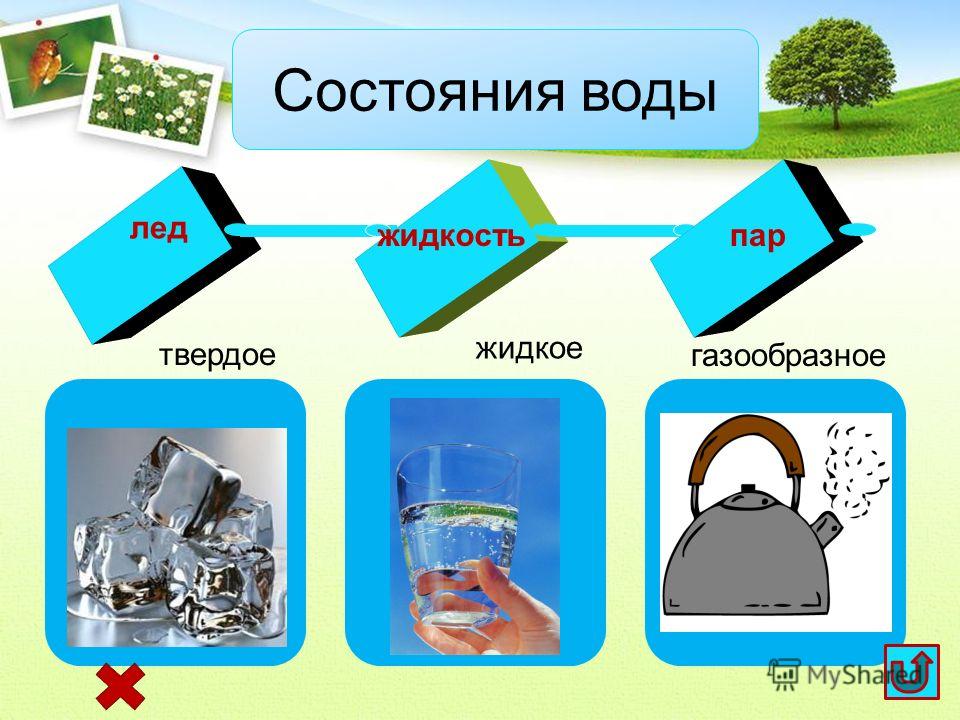
Вода — это вещество, которое играет важную роль в поддержании жизни. На самом деле, это основа жизни, какой мы ее знаем. Существует три состояния воды: жидкое, газообразное и твердое, в которые вода может переходить.
Если вы хотите узнать больше о науке о воде, вы найдете множество вакансий и курсов, которые помогут вам, включая следующие.
- Курсы океанографии
- Курсы морской биологии
- Курсы метеорологии
У вас есть вопросы о состояниях воды? Вернитесь к нам с вопросом или комментарием, используя форму комментария ниже.
Определение состояний материи
|

 Это снегопады, метели, иней, гололедица, лёд на реке.
Это снегопады, метели, иней, гололедица, лёд на реке.

 Это
Это

