Содержание
Температура замерзания воды | Интересные факты, мифы, заблуждения
Чистая вода при 0 °С не замерзает— как и вода морская.
Для того чтобы вода замерзла, ей нужно что-то, к чему могли бы прицепиться ее молекулы. Кристаллы льда формируются вокруг «ядер» — например, частичек пыли. Если же таковых нет, можно охладить воду до -42 °С, прежде чем та начнет замерзать.
Охлаждение воды без замораживания известно как «переохлаждение». Делать это нужно не торопясь. Можно, к примеру, поместить бутылку очень чистой воды в морозильник и переохладить ее. Но стоит вам вытащить бутылку наружу и постучать пальцем по стеклу — вода в момент превратится в лед.
Сверхбыстрое охлаждение воды имеет совершенно иной эффект. Минуя стадию льда (обладающую равномерной кристаллической решетчатой структурой), она трансформируется в хаотическое аморфное твердое тело, известное как «стеклообразная вода» (названная так из-за случайного расположения молекул, схожего со структурой стекла). Для получения «стеклообразной воды» температуру необходимо понизить до -137 °С буквально за пару миллисекунд. «Стеклообразную воду» на Земле можно встретить лишь в стенах лабораторий, но во Вселенной как раз эта форма воды встречается наиболее часто — именно из нее состоят кометы.
Для получения «стеклообразной воды» температуру необходимо понизить до -137 °С буквально за пару миллисекунд. «Стеклообразную воду» на Земле можно встретить лишь в стенах лабораторий, но во Вселенной как раз эта форма воды встречается наиболее часто — именно из нее состоят кометы.
Из-за высокого содержания солей морская вода регулярно охлаждается ниже 0 °С без замерзания. Кровь рыб, как правило, замерзает где-то при -0,5 °С, поэтому морских биологов долго ставил в тупик вопрос: как рыбы ухитряются выживать в полярных морях? Оказывается, такие виды, как антарктическая ледяная рыба и сельдь, вырабатывают в поджелудочной железе белки, впитываемые их кровью. Именно белки препятствуют образованию ядер кристаллизации льда (почти как антифриз в радиаторе автомобиля).
Зная об особенностях воды при низких температурах, вы не удивитесь, узнав, что точка ее кипения (даже при нормальном давлении) — не обязательно 100 °С. Она вполне может быть и гораздо выше. Правда, и здесь жидкость нужно нагревать медленно, причем в сосуде без единой царапины.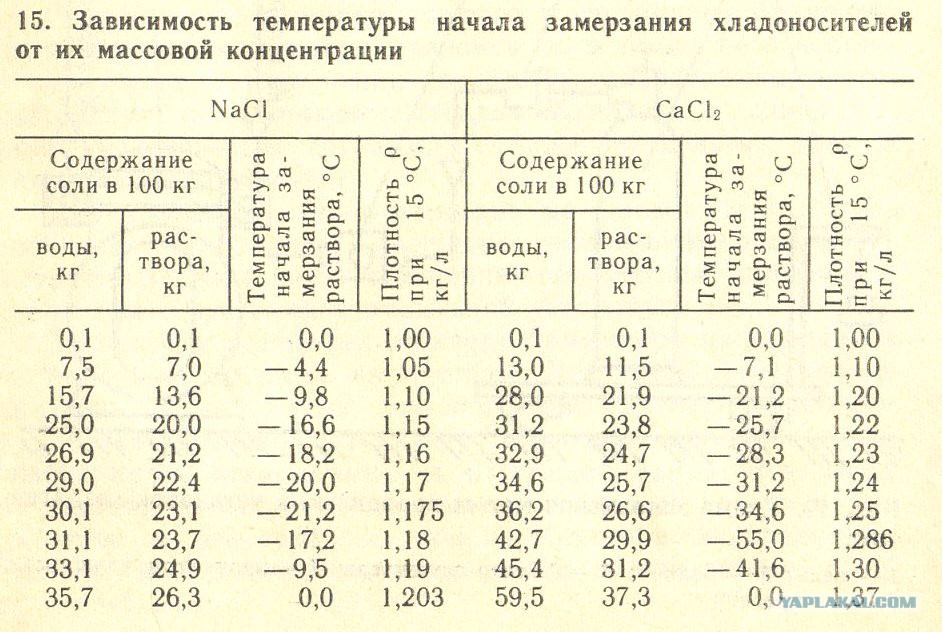 Именно в царапинах содержатся те самые воздушные полости, возле которых формируются первые пузырьки.
Именно в царапинах содержатся те самые воздушные полости, возле которых формируются первые пузырьки.
Кипение начинается, когда пузырьки водяного пара, расширяясь, пробивают поверхность воды. Чтобы такое произошло, температура должна быть достаточно высока — настолько, чтобы давление, создаваемое паровым пузырьком, превысило атмосферное. В нормальных условиях это 100 °С, но если в воде нет мест, где могут образовываться пузырьки, для преодоления поверхностного натяжения пробивающихся в жизнь пузырьков требуется больше тепла. (По той же причине надувать воздушный шарик вначале труднее, чем под конец.)
Этим, кстати, объясняется, почему чашка с кипящим кофе может взорваться, забрызгав все вокруг, стоит вынуть ее из микроволновой печи или помешать в ней ложкой. Движение вызовет цепную реакцию, в результате чего вся содержащаяся в кофе вода стремительно испарится.
И наконец, еще одна, последняя водяная странность: горячая вода замерзает быстрее холодной. Первым на это обратил внимание Аристотель еще в IV веке до н. э., однако научный мир признал его правоту лишь в 1963 г. — спасибо упорству танзанийского школьника по имени Эра-сто Мпемба. Мальчуган подтвердил слова древнего грека, наглядно продемонстрировав, что подслащенная молочная смесь превратится в мороженое быстрее, если ее сначала нагреть. Но в чем тут секрет, нам неизвестно до сих пор.
Первым на это обратил внимание Аристотель еще в IV веке до н. э., однако научный мир признал его правоту лишь в 1963 г. — спасибо упорству танзанийского школьника по имени Эра-сто Мпемба. Мальчуган подтвердил слова древнего грека, наглядно продемонстрировав, что подслащенная молочная смесь превратится в мороженое быстрее, если ее сначала нагреть. Но в чем тут секрет, нам неизвестно до сих пор.
Предыдущая статья: Какое из известных науке веществ самое необычное ?
Следующая статья: Самое крупное озеро
Температура замерзания воды — ???
Вода… Как много в этом слове. Порой так сильно хочется поправить таким образом поэта! Действительно, вода – синоним жизни. Это высказывание верно и для обитателей океанского побережья, и для жителей пустынь. Свойства воды за тысячелетия существования науки исследованы вдоль и поперек. Казалось бы, ничего неизвестного не осталось, но… давайте разберемся с таким, вроде бы, простым параметром, как температура замерзания воды.
Каждый знает, что температура кипения и температура замерзания воды являются ключевыми точками, выбранными в 1742 году Андерсом Цельсием для создания своей температурной шкалы, позже принятой в большинстве стран мира. Но всегда ли вода кипит при ста градусах и замерзает при нуле? Нет, не всегда. Существует большое количество параметров, которые могут изменить эти цифры. Начнем по порядку.
Во-первых, температура замерзания воды равняется нулю градусов только при нормальном атмосферном давлении, за которое принято считать давление в семьсот шестьдесят миллиметров ртутного столба. При понижении давления температура замерзания воды увеличивается, а температура кипения – уменьшается. При повышении давления – все с точностью до наоборот.
Во-вторых, повышенное содержание солей делает воду более «стойкой» к холоду. Температура замерзания соленой воды морей и океанов – около двух градусов ниже нуля по Цельсию. Те моря, где соленость выше средней, замерзают при еще более низкой температуре.
Всем хорошо известная природная вода – субстанция неоднородная. Да, львиная доля (более девяноста девяти процентов) воды приходится на то химическое соединение, которое обозначается формулой Н2О. Но есть в составе природной воды еще и так называемая «тяжелая» вода, и даже «сверхтяжелая». В первом случае в молекуле воды вместо двух атомов водорода присутствуют два атома его изотопа дейтерия, во втором случае – трития. В обычных условиях содержания дейтерия и трития в воде слишком невелико, чтобы оказывать негативное воздействие на человека или животных. Но в чистом виде дейтерий проявляет слабые токсичные свойства. А вот тритий, являясь радиоактивным веществом, в концентрированном виде просто опасен. Но, к счастью, в природе он встречается только в рассеянном виде.
Тритиевая и дейтериевая вода обладают физическими и химическими свойствами, отличными от обычной, «нашей» воды. Дейтериевая вода замерзает при температуре +3,81 градуса по Цельсию (при нормальном атмосферном давлении), а кипит при температуре +101,43 градуса. У тритиевой воды эти цифры отличаются ненамного: температура замерзания +1,25 и температура кипения +101,6 градуса по Цельсию.
У тритиевой воды эти цифры отличаются ненамного: температура замерзания +1,25 и температура кипения +101,6 градуса по Цельсию.
Свойства воды, этого, казалось бы, несложного химического соединения, исследованы еще далеко не полностью. Японец Масару научился, по его словам, даже разговаривать с водой. Он считает, что вода реагирует на музыку и энергию, заложенную в словах. И даже на записки! Это якобы хорошо видно после замораживания воды по форме получившихся кристаллов. Интересно, что на записку со словами «ты дурак» и на проигрывание композиций в стиле «heavy metal» вода реагирует одинаково, а вот надпись «спасибо» у нее ассоциируется с серией произведений для клавесина «Вариации Гольдберга» Иоганна Себастьяна Баха.
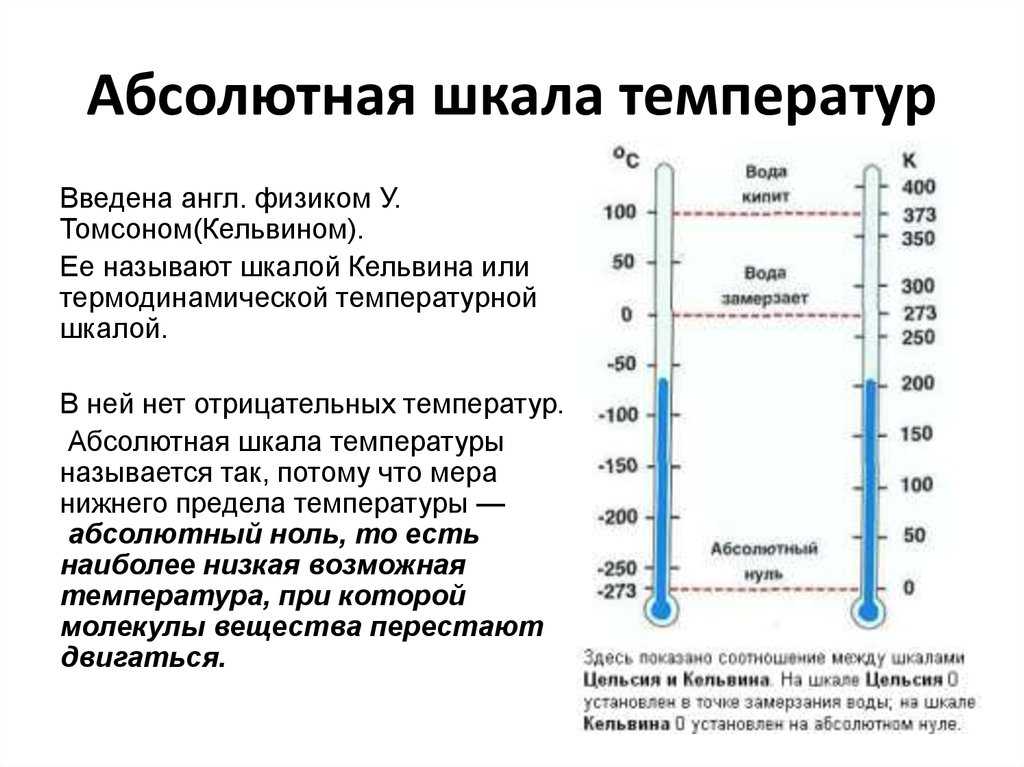
Какова температура замерзания воды? Фаренгейты, Цельсии и Кельвины Кельвин.
Знаете ли вы температуру замерзания воды? Совпадает ли точка замерзания с точкой плавления? Вот посмотрите на температуру точки замерзания, факторы, которые на нее влияют, и идентична ли она точке плавления.
Температура нормальной точки замерзания воды
Температура точки замерзания воды составляет 32 °F, 0 °C или 273,15 K . Обратите внимание, что у температуры Кельвина отсутствует символ градуса, потому что шкала Кельвина является абсолютной температурной шкалой. Это температура, при которой жидкая вода претерпевает фазовый переход в твердый лед при давлении в 1 атмосферу.
Разница между точкой замерзания и точкой плавления
Температура замерзания — это температура, при которой жидкость превращается в твердое вещество, а точка плавления — это температура, при которой твердое тело превращается в жидкость. Для большинства практических целей эти две температуры одинаковы. Таким образом, температура плавления воды также составляет 32 °F, 0 °C или 273,15 К.
Иногда температура замерзания чистой воды может быть намного ниже обычной точки замерзания или точки плавления. Причина в том, что воду легко переохладить. Переохлажденная вода — это вода, в которой отсутствуют примеси, пузырьки воздуха или поверхностные дефекты, способствующие образованию кристаллов. Очень чистая вода в гладком сосуде может достигать температуры от -40 до -42 °F (-40 °C), прежде чем замерзнуть!
Очень чистая вода в гладком сосуде может достигать температуры от -40 до -42 °F (-40 °C), прежде чем замерзнуть!
Факторы, которые могут изменить точку замерзания
Если вы посмотрите на фазовую диаграмму, то увидите, что температура точки замерзания зависит от давления. Для большинства веществ снижение давления ниже 1 атмосферы снижает температуру замерзания. Однако с водой происходит обратное. Первоначальное повышение давления дает более низкую точку замерзания. Причина в том, что водородные связи между молекулами воды делают жидкость более плотной, чем твердое, и очень стабильной. При очень низком давлении вода превращается из водяного пара в лед, не превращаясь в жидкость.
Температура замерзания воды зависит от ее давления. (изображение: Cmglee, CC 3.0)
Примеси также влияют на температуру замерзания воды. Почти во всех случаях растворение вещества (например, сахара, соли, спирта) снижает температуру замерзания. Это называется депрессией точки замерзания. Это коллигативное свойство материи, что означает, что оно зависит от количества частиц, добавленных в воду, а не от химической природы частиц. Ученые из Университета Лидса нашли исключение для депрессии точки замерзания. Сульфат аммония, соль, на самом деле повышает температуру замерзания воды.
Ученые из Университета Лидса нашли исключение для депрессии точки замерзания. Сульфат аммония, соль, на самом деле повышает температуру замерзания воды.
Частицы, которые не растворяются в воде, такие как пыль или пыльца, также повышают температуру замерзания воды. Частицы действуют как точки зарождения. По сути, они дают молекулам воды точку присоединения, чтобы начать процесс кристаллизации в лед. Горнолыжные курорты используют это свойство для образования снега при температуре выше нуля.
Ссылки
- Аткинс, П.В. (2017). Элементы физической химии . ISBN 978-0-19-879670-1.
- Педерсен, Ю.Р.; и другие. (август 2016 г.). «Термодинамика замерзания и плавления». Связь с природой . 7 (1): 12386. doi:10.1038/ncomms12386
- Zachariassen, K.E.; Кристиансен, Э. (декабрь 2000 г.). «Зарождение и антинуклеация льда в природе». Криобиология . 41 (4): 257–79. doi:10.1006/cryo.2000.228
Все мы знаем, при какой температуре замерзает вода, верно?!
ChemSci Выбор недели
Некоторые соли могут повышать температуру замерзания воды, а не понижать ее, говорят исследователи из Университета Лидса.
Поскольку зима в Великобритании подходит к концу, пришло время попрощаться с грузовиками с песком — большими желтыми грузовиками, часто с причудливыми названиями, которые патрулируют главные дороги страны ледяными ночами. Рассыпают смесь каменной соли и измельченного песка. Песок обеспечивает дополнительное сцепление автомобильных шин, а соль фактически снижает температуру плавления воды, уменьшая вероятность ее замерзания.
Если подумать, становится очевидным, что соленая вода замерзает при более низкой температуре, чем пресная, поэтому море должно быть очень холодным днем, прежде чем оно замерзнет. Но много ли мы знаем о том, почему это происходит? И этот эффект специфичен для соли, или он работает и для других веществ, растворенных в воде?
Фото: © Shutterstock
Очень круто
Томас Вейл из Университета Лидса объясняет, как работает замерзающая вода. Во-первых, обычно требуется присутствие мелких частиц другого твердого вещества. «Вопреки распространенному мнению, чистая жидкая вода обычно не замерзает при температуре плавления 0°C, а вместо этого может переохлаждаться до температуры -38°C. Для образования льда при относительно теплых температурах выше -20°C требуется гетерогенное вещество (твердая частица), называемое зародышеобразователем, для запуска начального события зародышеобразования, которое должно предшествовать росту кристаллов льда. Примеры зародышеобразователей включают минеральную пыль и биологические вещества».
Во-первых, обычно требуется присутствие мелких частиц другого твердого вещества. «Вопреки распространенному мнению, чистая жидкая вода обычно не замерзает при температуре плавления 0°C, а вместо этого может переохлаждаться до температуры -38°C. Для образования льда при относительно теплых температурах выше -20°C требуется гетерогенное вещество (твердая частица), называемое зародышеобразователем, для запуска начального события зародышеобразования, которое должно предшествовать росту кристаллов льда. Примеры зародышеобразователей включают минеральную пыль и биологические вещества».
Томас и его команда узнали, что растворение некоторых веществ в воде может повлиять на зародышеобразование и, следовательно, на замерзание. Как и ожидалось, они обнаружили, что морская соль ингибирует зародышеобразование, то есть снижает температуру замерзания, но неожиданно они обнаружили, что другой тип соли — сульфат аммония — усиливает его, то есть повышает температуру замерзания.
«Особенно поразительно и парадоксально, что некоторые соли могут вызывать замерзание воды при более высоких температурах, чем можно было бы ожидать», — говорит Томас.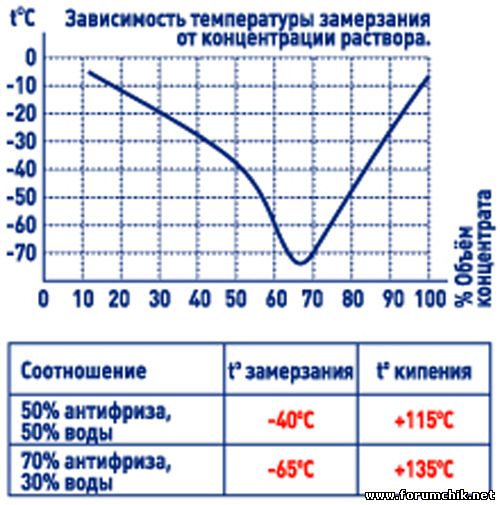
Грузовики с песком разбрасывают каменную соль, которая снижает температуру замерзания воды.
Фото: © Shutterstock
Ледяные облака
Есть несколько причин, по которым это важно для ученых. Во-первых, это важно для изучения образования облаков, особенно облаков со смешанной фазой, то есть облаков, состоящих из смеси капель воды и кристаллов льда. Эти типы облаков могут образовываться при температуре от 0 до -40°C и особенно преобладают в Арктике.
Атмосфера содержит большое количество морской соли и сульфата аммония, и баланс этих двух факторов определяет, будут ли образовываться кристаллы льда и, следовательно, как и где образуются смешанные фазовые облака.
Другая причина заключается в том, что образование кристаллов льда влияет на криоконсервацию клеток — метод, при котором клетки замораживают для хранения. «Если дать воде слишком сильно переохладиться в криоконсервированных клеточных суспензиях, — говорит Томас, — лед будет образовываться внутри клеток, повреждая и убивая их».