Содержание
Вода и её полезные свойства
Содержание
«Жизнь – это одушевленная вода»
Леонардо да Винчи, XVв.
Вода (оксид водорода) — бинарное неорганическое соединение с химической формулой Н2O. Молекула воды состоит из двух атомов водорода и одного — кислорода, которые соединены между собой ковалентной связью.
При нормальных условиях представляет собой прозрачную жидкость, не имеющую цвета (при малой толщине слоя), запаха и вкуса. В твёрдом состоянии называется льдом (кристаллы льда могут образовывать снег или иней), а в газообразном — водяным паром. Вода также может существовать в виде жидких кристаллов (на гидрофильных поверхностях). Составляет приблизительно около 0,05 % массы Земли.
Около 71 % поверхности Земли покрыто водой (океаны, моря, озёра, реки, льды) — 361,13 млн км2. На Земле примерно 96,5 % воды приходится на океаны, 1,7 % мировых запасов составляют грунтовые воды, ещё 1,7 % — ледники и ледяные шапки Антарктиды и Гренландии, небольшая часть находится в реках, озёрах и болотах, и 0,001 % в облаках (образуются из взвешенных в воздухе частиц льда и жидкой воды).
Большая часть земной воды — солёная, непригодная для сельского хозяйства и питья. Доля пресной составляет около 2,5 %, причём 98,8 % этой воды находится в ледниках и грунтовых водах. Менее 0,3 % всей пресной воды содержится в реках, озёрах и атмосфере, и ещё меньшее количество (0,003 %) находится в живых организмах. Является хорошим сильнополярным растворителем. В природных условиях всегда содержит растворённые вещества (соли, газы).
Исключительно важна роль воды в возникновении и поддержании жизни на Земле, в химическом строении живых организмов, в формировании климата и погоды.
Вода является важнейшим веществом для всех живых существ на Земле.
Вода и ее полезные свойства для живых существ:
Сложно переоценить то значение, которое имеет оксид водорода для всего живого. Ведь вода и есть сам источник жизни. Известно, что без нее человек не смог бы прожить и недели. Вода, ее свойства и значение просто колоссальны.
Вода, ее свойства и значение просто колоссальны.
- Это универсальный, то есть способный растворять и органические, и неорганические соединения, растворитель, действующий в живых системах. Именно поэтому вода — источник и среда для протекания всех каталитических биохимических преобразований, с формированием сложных жизненно важных комплексных соединений.
- Способность образовывать водородные связи делает данное вещество универсальным в выдерживании температур без изменения агрегатного состояния. Если бы это было не так, то при малейшем снижении градусов она превращалась бы в лед внутри живых существ, вызывая гибель клеток.
- Для человека вода — источник всех основных бытовых благ и нужд: приготовление пищи, стирка, уборка, принятие ванны, купание и плавание и прочее.
- Промышленные заводы (химические, текстильные, машиностроительные, пищевые, нефтеперерабатывающие и другие) не сумели бы осуществлять свою работу без участия оксида водорода.

- Издревле считалось, что вода — это источник здоровья. Она применялась и применяется сегодня как лечебное вещество.
- Растения используют ее как основной источник питания, за счет чего они продуцируют кислород — газ, благодаря которому существует жизнь на нашей планете.
Питьевая вода — это вода, которая предназначена для ежедневного неограниченного и безопасного потребления человеком и другими живыми существами. Главным отличием от столовых и минеральных вод является пониженное содержание солей (сухого остатка), а также наличие действующих стандартов на общий состав и свойства (СанПиН 2.1.4.1074-01 — для централизованных систем водоснабжения и СанПиН 2.1.4.1116-02 — для вод, расфасованных в ёмкости).
Вода многих источников пресной воды непригодна для питья людьми, так как может служить источником распространения болезней или вызывать долгосрочные проблемы со здоровьем, если она не отвечает определённым стандартам качества воды.
Вода, которая не вредит здоровью человека, и отвечает требованиям действующих стандартов качества, называется питьевой водой. В случае необходимости, чтобы вода соответствовала санитарно-эпидемиологическим нормам, её очищают или, официально говоря, «подготавливают» с помощью установок водоподготовки.
Водопроводная вода (проточная вода, вода из городского водопровода, городского водоснабжения) — вода, поступающая для потребления из крана, доставляется в дома коммунальным предприятием по водоснабжению. Стала доступна в городах развитого мира на протяжении последней четверти XIX века, и в общем в середине XX века. Как правило, это вода из речных водозаборов.
Сточные воды — любые воды и атмосферные осадки, отводимые в водоёмы с территорий промышленных предприятий и населённых мест через систему канализации или самотёком, свойства которых оказались ухудшенными в результате деятельности человека.
Вода – это важный источник энергоресурсов.
Смотрите так же:
- КНС
- Локальные очистные сооружения
- Станция биологической очистки
Аномалии физических свойств воды | Удивительные свойства воды
12.08 2009, 15:52 РИА «Новости»
Аномальные свойства воды, определяющие, в том числе и наличие жизни на Земле — её переменная плотность, высокая теплоемкость и большое поверхностное натяжение, объясняются двумя типами структур, в которые самоорганизуются молекулы жидкости, уверены авторы нового исследования, опубликованного в журнале Proceedings of the National Academy of Sciences.
Ученым давно были известны 66 необъяснимых свойств воды, отличающих её от большинства других химических веществ, встречающихся в жидком состоянии. Так, в отличие от всех известных жидкостей, плотность которых монотонно увеличивается с понижением температуры, плотность воды максимальна при 4 градусах Цельсия, а при дальнейшем понижении температуры вновь начинает убывать. Это уникальное свойство воды делает возможной жизнь в реках и озерах — в противном случае эти относительно мелкие водоемы неизбежно промерзали бы до дна в зимний период и были бы лишены всех живых организмов, за исключением, может быть, простейших бактерий экстремофилов.
Это уникальное свойство воды делает возможной жизнь в реках и озерах — в противном случае эти относительно мелкие водоемы неизбежно промерзали бы до дна в зимний период и были бы лишены всех живых организмов, за исключением, может быть, простейших бактерий экстремофилов.
Вода обладает огромной теплоемкостью — благодаря этому теплые океанические течения согревают многие северные регионы планеты, принося тепло из южных широт.
Аномально высокое поверхностное натяжение жидкой воды не только позволяет некоторым насекомым спокойно ходить по её поверхности, но и благодаря капиллярным силам обеспечивает поступление питательных веществ к кронам гигантских деревьев, достигающих нескольких десятков метров в высоту.
Объяснить эти свойства на основании лишь строения и химических параметров молекул воды ученые до последнего времени не могли. Секрет крылся в структуре, в которую самоорганизуются молекулы жидкой воды. Он долгое время оставался неразгаданным, так как изучить эту структуру теми же методами, что применяются для изучения строения твердых тел, практически невозможно.
Команда Андерса Нильсона (Anders Nilsson), ведущего специалиста Стенфордского центра синхротронного излучения (Stanford Synchrotron Radiation Lightsource), сумела преодолеть эти трудности благодаря новейшим методам изучения строения жидкостей с использованием мощного рентгеновского излучения, получаемого с помощью больших ускорителей элементарных частиц, называемых синхротронами. Один из использованных в работе синхротронов находится в Японии, а второй в США.
Ученые выяснили, что существовавшие до сих пор представления о молекулярной структуре воды были неверными — оказалось, что её молекулы формируют не одну структуру, а одновременно два типа структур, сосуществующих в жидкости вне зависимости от температуры. Один тип структуры формируется в виде сгустков примерно по 100 молекул, структура которых напоминает структуру льда. Второй тип структуры, окружающей сгустки, гораздо менее упорядочен.
Увеличение температуры вплоть до точки кипения воды приводит к некоторому искажению структуры сгустков и уменьшению их количества и доминированию разупорядоченной структуры.
«Этот процесс можно представить как танцевальный клуб, где часть людей сидит за столиками, отражая упорядоченную компоненту воды, а часть находясь в толпе, непрерывно перемещается в танце, отражая разупорядоченную. Увеличение температуры воды в этом случае можно сравнить с всеобщим поднятием настроения и ускорением музыки, когда люди начинают вставать из-за столов и присоединяться к танцующим, а часть пустующих столов и вовсе убирается для высвобождения места. Охлаждение — обратный процесс, когда танцпол заполняется столами, и за них присаживаются утомленные танцами гости клуба. При этом при одной и той же “температуре” танцующие и сидящие люди постоянно меняются местами — некоторые присаживаются отдохнуть а некоторые наоборот идут танцевать, тогда как общее соотношение танцующих и сидящих остается прежним» — пояснил результаты работы Нильсон, слова которого приводит пресс-служба Стенфордского центра линейных ускорителей в США.
Это, в частности, объясняет нелинейную зависимость плотности воды от температуры — упорядоченные скопления молекул имеют меньшую плотность, чем неупорядоченные, и она мало меняется с изменением температуры, которую можно сравнить с постоянным размером столов, не зависящим от настроения собравшихся или громкости музыки в ресторане.
Остались вопросы? Мы всегда готовы предоставить консультацию по всем вопросам очистки воды!
Заказать консультацию
2.2: Вода — Биология LibreTexts
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 1785
- OpenStax
- OpenStax
Навыки для развития
- Описать свойства воды, имеющие решающее значение для поддержания жизни
- Объясните, почему вода является отличным растворителем
- Приведите примеры когезионных и адгезивных свойств воды
- Обсудите роль кислот, оснований и буферов в гомеостазе
Почему ученые тратят время на поиски воды на других планетах? Почему вода так важна? Это потому, что вода необходима для жизни, какой мы ее знаем. Вода — одна из самых распространенных молекул и наиболее важная для жизни на Земле. Примерно 60–70 процентов человеческого тела состоит из воды. Без него жизнь, какой мы ее знаем, просто не существовала бы.
Вода — одна из самых распространенных молекул и наиболее важная для жизни на Земле. Примерно 60–70 процентов человеческого тела состоит из воды. Без него жизнь, какой мы ее знаем, просто не существовала бы.
Полярность молекулы воды и образующаяся в результате водородная связь делают воду уникальным веществом с особыми свойствами, тесно связанными с процессами жизни. Первоначально жизнь развивалась в водной среде, и большая часть клеточной химии и метаболизма организма происходит внутри водянистого содержимого цитоплазмы клетки. К особым свойствам воды относятся ее высокая теплоемкость и теплота парообразования, способность растворять полярные молекулы, ее когезионные и адгезивные свойства, а также ее диссоциация на ионы, что приводит к образованию рН. Понимание этих характеристик воды помогает понять ее важность для поддержания жизни.
Полярность воды
Одним из важных свойств воды является то, что она состоит из полярных молекул: водород и кислород внутри молекул воды (H 2 O) образуют полярные ковалентные связи. В то время как у молекулы воды нет чистого заряда, полярность воды создает слегка положительный заряд на водороде и слегка отрицательный заряд на кислороде, способствуя свойствам притяжения воды. Заряды воды образуются из-за того, что кислород более электроотрицательный, чем водород, что повышает вероятность того, что общий электрон будет находиться рядом с ядром кислорода, а не с ядром водорода, что приводит к частичному отрицательному заряду вблизи кислорода.
В то время как у молекулы воды нет чистого заряда, полярность воды создает слегка положительный заряд на водороде и слегка отрицательный заряд на кислороде, способствуя свойствам притяжения воды. Заряды воды образуются из-за того, что кислород более электроотрицательный, чем водород, что повышает вероятность того, что общий электрон будет находиться рядом с ядром кислорода, а не с ядром водорода, что приводит к частичному отрицательному заряду вблизи кислорода.
В результате полярности воды каждая молекула воды притягивает другие молекулы воды из-за противоположных зарядов между молекулами воды, образуя водородные связи. Вода также притягивает или притягивается к другим полярным молекулам и ионам. Полярное вещество, которое легко взаимодействует с водой или растворяется в ней, называется гидрофильным (гидро- = «вода»; -фильный = «любящий»). Напротив, неполярные молекулы, такие как масла и жиры, плохо взаимодействуют с водой, как показано на рисунке \(\PageIndex{1}\), и отделяются от нее, а не растворяются в ней, как мы видим в заправках для салатов, содержащих масло. и уксус (кислый водный раствор). Эти неполярные соединения называются гидрофобными (гидро- = «вода»; -фоб = «боязнь»).
и уксус (кислый водный раствор). Эти неполярные соединения называются гидрофобными (гидро- = «вода»; -фоб = «боязнь»).
Рисунок \(\PageIndex{1}\): Масло и вода не смешиваются. Как видно из этого макроизображения нефти и воды, нефть не растворяется в воде, а вместо этого образует капли. Это связано с тем, что это неполярное соединение. (кредит: Гаутам Догра).
Состояния воды: газ, жидкость и твердое тело
Образование водородных связей является важным качеством жидкой воды, которое имеет решающее значение для жизни, какой мы ее знаем. Поскольку молекулы воды образуют водородные связи друг с другом, вода приобретает некоторые уникальные химические характеристики по сравнению с другими жидкостями, и, поскольку живые существа имеют высокое содержание воды, понимание этих химических свойств является ключом к пониманию жизни. В жидкой воде водородные связи постоянно образуются и разрываются, когда молекулы воды скользят друг относительно друга. Разрыв этих связей вызывается движением (кинетической энергией) молекул воды за счет тепла, содержащегося в системе. Когда тепло повышается при кипении воды, более высокая кинетическая энергия молекул воды приводит к полному разрыву водородных связей и позволяет молекулам воды выходить в воздух в виде газа (пара или водяного пара). С другой стороны, когда температура воды снижается и вода замерзает, молекулы воды образуют кристаллическую структуру, поддерживаемую водородными связями (энергии недостаточно для разрыва водородных связей), что делает лед менее плотным, чем жидкая вода, явление не наблюдается при затвердевании других жидкостей.
Когда тепло повышается при кипении воды, более высокая кинетическая энергия молекул воды приводит к полному разрыву водородных связей и позволяет молекулам воды выходить в воздух в виде газа (пара или водяного пара). С другой стороны, когда температура воды снижается и вода замерзает, молекулы воды образуют кристаллическую структуру, поддерживаемую водородными связями (энергии недостаточно для разрыва водородных связей), что делает лед менее плотным, чем жидкая вода, явление не наблюдается при затвердевании других жидкостей.
Более низкая плотность воды в ее твердом состоянии обусловлена тем, как ориентируются водородные связи при замерзании: молекулы воды раздвигаются дальше друг от друга по сравнению с жидкой водой. Для большинства других жидкостей затвердевание при понижении температуры включает снижение кинетической энергии между молекулами, что позволяет им упаковываться даже более плотно, чем в жидкой форме, и придает твердому телу большую плотность, чем жидкость.
Низкая плотность льда, показанная и изображенная на рисунке \(\PageIndex{2}\), представляет собой аномалию, заставляющую его плавать на поверхности жидкой воды, например, в айсберге или в кубиках льда в стакане. ледяной воды. В озерах и прудах лед образуется на поверхности воды, создавая изолирующий барьер, защищающий животных и растения в пруду от замерзания. Без этого слоя изолирующего льда растения и животные, живущие в пруду, замерзли бы в сплошной глыбе льда и не смогли бы выжить. Губительное действие замерзания на живые организмы обусловлено расширением льда относительно жидкой воды. Кристаллы льда, образующиеся при замораживании, разрывают тонкие мембраны, необходимые для функционирования живых клеток, необратимо повреждая их. Клетки могут пережить замораживание только в том случае, если вода в них временно заменена другой жидкостью, такой как глицерин.
ледяной воды. В озерах и прудах лед образуется на поверхности воды, создавая изолирующий барьер, защищающий животных и растения в пруду от замерзания. Без этого слоя изолирующего льда растения и животные, живущие в пруду, замерзли бы в сплошной глыбе льда и не смогли бы выжить. Губительное действие замерзания на живые организмы обусловлено расширением льда относительно жидкой воды. Кристаллы льда, образующиеся при замораживании, разрывают тонкие мембраны, необходимые для функционирования живых клеток, необратимо повреждая их. Клетки могут пережить замораживание только в том случае, если вода в них временно заменена другой жидкостью, такой как глицерин.
Рисунок \(\PageIndex{2}\): Водородные связи делают лед менее плотным, чем жидкая вода. (а) решетчатая структура льда делает его менее плотным, чем свободно текущие молекулы жидкой воды, что позволяет ему (б) плавать на поверхности воды. (кредит a: модификация работы Джейн Уитни, изображение создано с помощью программного обеспечения Visual Molecular Dynamics (VMD) 1 ; кредит b: модификация работы Карлоса Понте)
Ссылка на обучение
Видео: Нажмите здесь, чтобы увидеть трехмерную анимацию структуры ледяной решетки. (Изображение предоставлено Джейн Уитни. Изображение создано с помощью программного обеспечения Visual Molecular Dynamics VMD. 2 )
(Изображение предоставлено Джейн Уитни. Изображение создано с помощью программного обеспечения Visual Molecular Dynamics VMD. 2 )
Высокая теплоемкость воды
Высокая теплоемкость воды – это свойство, обусловленное водородными связями между молекулами воды. Вода обладает наибольшей удельной теплоемкостью среди всех жидкостей. Удельная теплоемкость определяется как количество тепла, которое должен поглотить или отдать один грамм вещества, чтобы изменить его температуру на один градус Цельсия. Для воды это количество составляет одну калорию. Поэтому вода долго нагревается и долго охлаждается. На самом деле удельная теплоемкость воды примерно в пять раз больше, чем у песка. Это объясняет, почему суша остывает быстрее, чем море. Благодаря своей высокой теплоемкости вода используется теплокровными животными для более равномерного распределения тепла в их телах: она действует аналогично системе охлаждения автомобиля, перенося тепло из теплых мест в холодные, заставляя тело поддерживать более равномерная температура.
Теплота испарения воды
Вода также имеет высокую теплоту парообразования, количество энергии, необходимое для превращения одного грамма жидкого вещества в газ. Для осуществления этого превращения воды требуется значительное количество тепловой энергии (586 кал). Этот процесс происходит на поверхности воды. Когда жидкая вода нагревается, водородные связи затрудняют отделение молекул жидкой воды друг от друга, что необходимо для ее перехода в газообразную фазу (пар). В результате вода действует как поглотитель или резервуар тепла, и для ее кипения требуется гораздо больше тепла, чем для такой жидкости, как этанол (зерновой спирт), водородная связь которого с другими молекулами этанола слабее, чем водородная связь воды. В конце концов, когда вода достигает точки кипения 100 ° по Цельсию (212 ° по Фаренгейту), тепло может разорвать водородные связи между молекулами воды, а кинетическая энергия (движение) между молекулами воды позволяет им покинуть жидкость. как газ. Даже когда температура ниже точки кипения, отдельные молекулы воды получают достаточно энергии от других молекул воды, так что некоторые молекулы воды с поверхности могут ускользнуть и испариться: этот процесс известен как испарение.
Тот факт, что для испарения воды необходимо разорвать водородные связи, означает, что в процессе используется значительное количество энергии. Когда вода испаряется, процесс потребляет энергию, охлаждая окружающую среду, в которой происходит испарение. У многих живых организмов, в том числе и у человека, испарение пота, состоящего на 90 % из воды, позволяет организму охлаждаться для поддержания гомеостаза температуры тела.
Растворяющие свойства воды
Поскольку вода представляет собой полярную молекулу со слегка положительным и слегка отрицательным зарядом, ионы и полярные молекулы могут легко растворяться в ней. Поэтому воду называют растворителем, веществом, способным растворять другие полярные молекулы и ионные соединения. Заряды, связанные с этими молекулами, будут образовывать водородные связи с водой, окружая частицу молекулами воды. Это называется сферой гидратации или гидратной оболочкой, как показано на рисунке \(\PageIndex{3}\), и служит для разделения или диспергирования частиц в воде.
При добавлении к воде ионных соединений отдельные ионы реагируют с полярными областями молекул воды, и их ионные связи разрываются в процессе диссоциации. Диссоциация происходит, когда атомы или группы атомов отрываются от молекул и образуют ионы. Рассмотрим поваренную соль (NaCl или хлорид натрия): при добавлении кристаллов NaCl в воду молекулы NaCl диссоциируют на ионы Na + и Cl – , а вокруг ионов образуются сферы гидратации, как показано на рисунке \( \ИндексСтраницы{3}\). Положительно заряженный ион натрия окружен частично отрицательным зарядом кислорода молекулы воды. Отрицательно заряженный ион хлора окружен частично положительным зарядом водорода на молекуле воды.
Рисунок \(\PageIndex{3}\): Когда поваренная соль (NaCl) смешивается с водой, вокруг ионов образуются сферы гидратации.
Когезионные и адгезивные свойства воды
Вы когда-нибудь наполняли стакан водой до самого верха, а затем медленно добавляли еще несколько капель? Прежде чем перелиться через край, вода образует куполообразную форму над краем стакана. Эта вода может оставаться над стеклом благодаря свойству когезии. При когезии молекулы воды притягиваются друг к другу (из-за водородных связей), удерживая молекулы вместе на границе раздела жидкость-газ (вода-воздух), хотя в стекле больше нет места.
Эта вода может оставаться над стеклом благодаря свойству когезии. При когезии молекулы воды притягиваются друг к другу (из-за водородных связей), удерживая молекулы вместе на границе раздела жидкость-газ (вода-воздух), хотя в стекле больше нет места.
Когезия допускает развитие поверхностного натяжения, способности вещества противостоять разрыву при воздействии на него напряжения или нагрузки. По этой же причине вода образует капли, когда ее кладут на сухую поверхность, а не расплющивают под действием силы тяжести. Когда небольшой клочок бумаги помещается на каплю воды, бумага плавает поверх капли воды, даже если бумага плотнее (тяжелее), чем вода. Когезия и поверхностное натяжение сохраняют водородные связи молекул воды неповрежденными и поддерживают плавание предмета на поверхности. Можно даже «поплавать» иглой над стаканом с водой, если положить ее осторожно, не нарушая поверхностного натяжения, как показано на рисунке \(\PageIndex{4}\).
Рисунок \(\PageIndex{4}\): Вес иглы тянет поверхность вниз; в то же время поверхностное натяжение тянет его вверх, удерживая на поверхности воды и удерживая от погружения. Обратите внимание на углубление в воде вокруг иглы. (кредит: Кори Занкер)
Обратите внимание на углубление в воде вокруг иглы. (кредит: Кори Занкер)
Эти силы сцепления связаны со свойством воды прилипать или притяжением между молекулами воды и другими молекулами. Это притяжение иногда сильнее, чем силы сцепления воды, особенно когда вода подвергается воздействию заряженных поверхностей, таких как те, которые находятся внутри тонких стеклянных трубок, известных как капиллярные трубки. Адгезия наблюдается, когда вода «поднимается» вверх по трубке, помещенной в стакан с водой: обратите внимание, что вода кажется выше по бокам трубки, чем в середине. Это связано с тем, что молекулы воды притягиваются к заряженным стеклянным стенкам капилляра сильнее, чем друг к другу, и поэтому прилипают к нему. Этот тип адгезии называется капиллярным действием и показан на рисунке \(\PageIndex{5}\).
Рисунок \(\PageIndex{5}\): Капиллярное действие в стеклянной трубке вызвано силами сцепления, создаваемыми внутренней поверхностью стекла, превышающими силы сцепления между самими молекулами воды. (кредит: модификация работы Пирсона-Скотта Форесмана, переданная в дар Фонду Викимедиа)
(кредит: модификация работы Пирсона-Скотта Форесмана, переданная в дар Фонду Викимедиа)
Почему когезионные и адгезионные силы важны для жизни? Когезионные и адгезионные силы важны для транспорта воды от корней к листьям растений. Эти силы создают «притяжение» к толще воды. Это притяжение возникает из-за тенденции молекул воды, испаряющихся на поверхности растения, оставаться связанными с молекулами воды под ними, и поэтому они притягиваются. Растения используют это природное явление, чтобы переносить воду от корней к листьям. Без этих свойств воды растения не смогли бы получать воду и растворенные минералы, которые им необходимы. В другом примере насекомые, такие как водомерка, показанная на рисунке \(\PageIndex{6}\), используют поверхностное натяжение воды, чтобы оставаться на плаву в поверхностном слое воды и даже спариваются там. 9- (aq)} \nonumber\]
лакмусовая или pH-бумага, фильтровальная бумага, обработанная натуральным водорастворимым красителем, чтобы ее можно было использовать в качестве индикатора pH для определения содержания кислоты (кислотности) или основания ( щелочность) существует в растворе. Возможно, вы даже использовали некоторые из них, чтобы проверить, правильно ли очищается вода в бассейне. В обоих случаях тест pH измеряет концентрацию ионов водорода в данном растворе.
Возможно, вы даже использовали некоторые из них, чтобы проверить, правильно ли очищается вода в бассейне. В обоих случаях тест pH измеряет концентрацию ионов водорода в данном растворе.
Ионы водорода спонтанно образуются в чистой воде в результате диссоциации (ионизации) небольшого процента молекул воды на равное количество водорода (H + ) ионов и гидроксид (ОН — ) ионов. В то время как ионы гидроксида удерживаются в растворе за счет водородных связей с другими молекулами воды, ионы водорода, состоящие из голых протонов, немедленно притягиваются к неионизированным молекулам воды, образуя ионы гидроксония (H 3 0 + ). Тем не менее, условно ученые относятся к ионам водорода и их концентрации так, как если бы они находились в этом состоянии в жидкой воде в свободном состоянии.
Концентрация ионов водорода, диссоциирующих из чистой воды, составляет 1 × 10 -7 молей H + ионов на литр воды. Моли (mol) — это способ выражения количества вещества (которым могут быть атомы, молекулы, ионы и т. д.), при этом один моль равен 6,02 x 10 23 частиц вещества. Следовательно, 1 моль воды равен 6,02 х 10 23 молекул воды. pH рассчитывается как отрицательная величина логарифма по основанию 10 этой концентрации. Log10 1 × 10 -7 равен -7,0, и отрицательное значение этого числа (обозначаемое буквой «p» в «pH») дает значение pH 7,0, которое также известно как нейтральное значение pH. pH внутри человеческих клеток и крови являются примерами двух областей тела, где поддерживается почти нейтральный pH.
д.), при этом один моль равен 6,02 x 10 23 частиц вещества. Следовательно, 1 моль воды равен 6,02 х 10 23 молекул воды. pH рассчитывается как отрицательная величина логарифма по основанию 10 этой концентрации. Log10 1 × 10 -7 равен -7,0, и отрицательное значение этого числа (обозначаемое буквой «p» в «pH») дает значение pH 7,0, которое также известно как нейтральное значение pH. pH внутри человеческих клеток и крови являются примерами двух областей тела, где поддерживается почти нейтральный pH.
Ненейтральные показания рН возникают в результате растворения кислот или оснований в воде. Используя отрицательный логарифм для получения положительных целых чисел, высокие концентрации ионов водорода дают низкое число pH, тогда как низкие уровни ионов водорода приводят к высокому pH. Кислота — это вещество, которое увеличивает концентрацию ионов водорода (H + ) в растворе, обычно за счет диссоциации одного из его атомов водорода. Основание обеспечивает либо гидроксид-ионы (OH —), либо другие отрицательно заряженные ионы, которые соединяются с ионами водорода, снижая их концентрацию в растворе и тем самым повышая pH. В тех случаях, когда основание высвобождает ионы гидроксида, эти ионы связываются со свободными ионами водорода, образуя новые молекулы воды.
В тех случаях, когда основание высвобождает ионы гидроксида, эти ионы связываются со свободными ионами водорода, образуя новые молекулы воды.
Чем сильнее кислота, тем легче она отдает H + . Например, соляная кислота (HCl) полностью диссоциирует на ионы водорода и хлора и является очень кислой, тогда как кислоты в томатном соке или уксусе полностью не диссоциируют и считаются слабыми кислотами. И наоборот, сильные основания — это те вещества, которые легко отдают OH – или поглощают ионы водорода. Гидроксид натрия (NaOH) и многие бытовые чистящие средства сильно щелочные и выделяют OH – 9.0065 быстро при помещении в воду, тем самым повышая рН. Примером слабощелочного раствора является морская вода с pH около 8,0, что достаточно близко к нейтральному pH, чтобы морские организмы, адаптированные к этой соленой среде, могли процветать в ней.
Шкала рН, как упоминалось ранее, является обратным логарифмом и находится в диапазоне от 0 до 14 (Рисунок \(\PageIndex{7}\)). Все, что ниже 7,0 (от 0,0 до 6,9), является кислотным, а все, что выше 7,0 (от 7,1 до 14,0), является щелочным. Экстремальные значения pH в любом направлении от 7,0 обычно считаются негостеприимными для жизни. pH внутри клеток (6,8) и pH крови (7,4) очень близки к нейтральному. Однако среда в желудке очень кислая, с рН от 1 до 2. Так как же клетки желудка выживают в такой кислой среде? Как они гомеостатически поддерживают внутри себя близкий к нейтральному рН? Ответ в том, что они не могут этого сделать и постоянно умирают. Новые клетки желудка постоянно производятся для замены мертвых клеток, которые перевариваются кислотами желудка. Подсчитано, что слизистая оболочка человеческого желудка полностью обновляется каждые семь-десять дней.
Все, что ниже 7,0 (от 0,0 до 6,9), является кислотным, а все, что выше 7,0 (от 7,1 до 14,0), является щелочным. Экстремальные значения pH в любом направлении от 7,0 обычно считаются негостеприимными для жизни. pH внутри клеток (6,8) и pH крови (7,4) очень близки к нейтральному. Однако среда в желудке очень кислая, с рН от 1 до 2. Так как же клетки желудка выживают в такой кислой среде? Как они гомеостатически поддерживают внутри себя близкий к нейтральному рН? Ответ в том, что они не могут этого сделать и постоянно умирают. Новые клетки желудка постоянно производятся для замены мертвых клеток, которые перевариваются кислотами желудка. Подсчитано, что слизистая оболочка человеческого желудка полностью обновляется каждые семь-десять дней.
Рисунок \(\PageIndex{7}\): Шкала pH измеряет концентрацию ионов водорода (H + ) в растворе. (кредит: модификация работы Эдварда Стивенса)
Ссылка на обучение
Посмотрите это видео для простого объяснения рН и его логарифмической шкалы.
Так как же могут организмы, тела которых нуждаются в близком к нейтральному рН, поглощать кислые и щелочные вещества (например, человек, пьющий апельсиновый сок) и выживать? Буферы — это ключ. Буферы легко поглощают избыток H + или OH – , тщательно поддерживая pH тела в узком диапазоне, необходимом для выживания. Поддержание постоянного рН крови имеет решающее значение для благополучия человека. Буфер, поддерживающий pH крови человека, включает угольную кислоту (H 2 CO 3 ), ион бикарбоната (HCO 3 – ) и углекислый газ (CO 2 ). Когда ионы бикарбоната объединяются со свободными ионами водорода и становятся угольной кислотой, ионы водорода удаляются, что замедляет изменения pH. Точно так же, как показано на рисунке \(\PageIndex{8}\), избыточная углекислота может быть преобразована в углекислый газ и выдыхаться через легкие. Это предотвращает накопление слишком большого количества свободных ионов водорода в крови и опасное снижение pH крови. Аналогично, если слишком много OH – введен в систему, угольная кислота соединится с ним с образованием бикарбоната, понизив рН. Без этой буферной системы рН тела колебался бы достаточно, чтобы поставить под угрозу выживание.
Аналогично, если слишком много OH – введен в систему, угольная кислота соединится с ним с образованием бикарбоната, понизив рН. Без этой буферной системы рН тела колебался бы достаточно, чтобы поставить под угрозу выживание.
Рисунок \(\PageIndex{8}\): На этой диаграмме показана буферизация организмом уровней pH крови. Синие стрелки показывают процесс повышения pH по мере производства большего количества CO 2 . Фиолетовые стрелки указывают на обратный процесс: понижение pH по мере образования большего количества бикарбоната.
Другими примерами буферов являются антациды, используемые для борьбы с избытком желудочной кислоты. Многие из этих безрецептурных лекарств действуют так же, как буферы крови, обычно с по крайней мере одним ионом, способным поглощать водород и снижать рН, принося облегчение тем, кто страдает от «изжоги» после еды. Уникальные свойства воды, которые способствуют этой способности уравновешивать pH, а также другие характеристики воды, необходимы для поддержания жизни на Земле.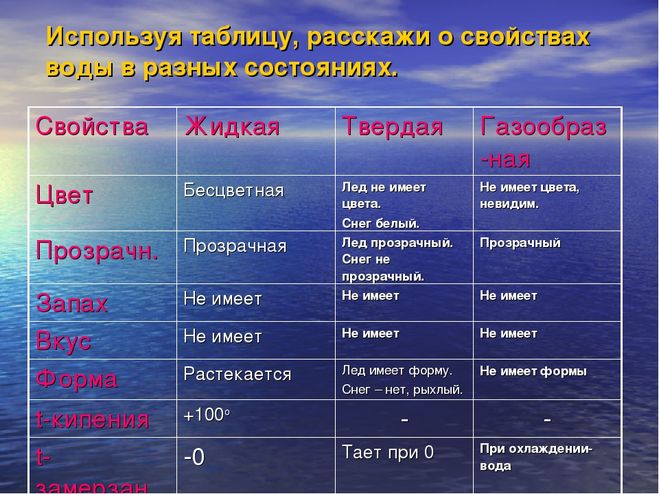
Ссылка на обучение
Чтобы узнать больше о воде. Посетите Геологическую службу США. Наука о воде для школ. Все о воде! Веб-сайт.
Резюме
Вода обладает многими свойствами, которые необходимы для поддержания жизни. Это полярная молекула, допускающая образование водородных связей. Водородные связи позволяют ионам и другим полярным молекулам растворяться в воде. Таким образом, вода является отличным растворителем. Водородные связи между молекулами воды приводят к тому, что вода обладает высокой теплоемкостью, а это означает, что для повышения ее температуры требуется много дополнительного тепла. При повышении температуры водородные связи между водой постоянно разрываются и формируются заново. Это позволяет общей температуре оставаться стабильной, хотя в систему добавляется энергия. Вода также обладает высокой теплотой испарения, что является ключом к тому, как организмы охлаждаются за счет испарения пота. Силы сцепления воды учитывают свойство поверхностного натяжения, тогда как ее адгезионные свойства проявляются, когда вода поднимается внутри капиллярных трубок. Значение pH является мерой концентрации ионов водорода в растворе и является одной из многих химических характеристик, которые строго регулируются в живых организмах посредством гомеостаза. Кислоты и основания могут изменять значения pH, но буферы имеют тенденцию смягчать вызываемые ими изменения. Эти свойства воды тесно связаны с биохимическими и физическими процессами, происходящими в живых организмах, и жизнь была бы совсем другой, если бы эти свойства изменились, если бы она вообще могла существовать.
Значение pH является мерой концентрации ионов водорода в растворе и является одной из многих химических характеристик, которые строго регулируются в живых организмах посредством гомеостаза. Кислоты и основания могут изменять значения pH, но буферы имеют тенденцию смягчать вызываемые ими изменения. Эти свойства воды тесно связаны с биохимическими и физическими процессами, происходящими в живых организмах, и жизнь была бы совсем другой, если бы эти свойства изменились, если бы она вообще могла существовать.
Сноски
- 1 W. Humphrey W., A. Dalke, and K. Schulten, «VMD—Visual Molecular Dynamics», Journal of Molecular Graphics 14 (1996): 33-38.
- 2 W. Humphrey W., A. Dalke и K. Schulten, «VMD-Visual Molecular Dynamics», Journal of Molecular Graphics 14 (1996): 33-38.
Глоссарий
- кислота
- молекула, отдающая ионы водорода и повышающая концентрацию ионов водорода в растворе
- адгезия
- притяжение между молекулами воды и другими молекулами
- база
- молекула, которая отдает ионы гидроксида или иным образом связывает избыток ионов водорода и снижает концентрацию ионов водорода в растворе
- буфер
- вещество, предотвращающее изменение pH за счет поглощения или выделения ионов водорода или гидроксида
- калорий
- количество теплоты, необходимое для изменения температуры одного грамма воды на один градус Цельсия
- капиллярное действие
- возникает из-за того, что молекулы воды притягиваются к зарядам на внутренних поверхностях узких трубчатых структур, таких как стеклянные трубки, притягивая молекулы воды к сторонам трубок
- сплоченность
- межмолекулярных сил между молекулами воды, вызванных полярной природой воды; отвечает за поверхностное натяжение
- диссоциация
- высвобождение иона из молекулы таким образом, что исходная молекула теперь состоит из иона и заряженных остатков исходной, например, когда вода диссоциирует на H + и ОХ —
- испарение
- выделение отдельных молекул с поверхности воды, листьев растений или кожи организма
- теплота парообразования воды
- требуется большое количество энергии для превращения жидкой воды в водяной пар
- гидрофильный
- описывает ионы или полярные молекулы, которые хорошо взаимодействуют с другими полярными молекулами, такими как вода
- гидрофобный
- описывает незаряженные неполярные молекулы, которые плохо взаимодействуют с полярными молекулами, такими как вода
.
- лакмусовая бумага
- (также pH-бумага) фильтровальная бумага, обработанная натуральным водорастворимым красителем, который меняет свой цвет при изменении pH окружающей среды, поэтому ее можно использовать в качестве индикатора pH
- pH-бумага
- см. лакмусовую бумажку
- Шкала pH
- шкала от нуля до 14, что обратно пропорционально концентрации ионов водорода в растворе
- растворитель
- вещество, способное растворять другое вещество
- удельная теплоемкость
- Количество тепла, которое должен поглотить или отдать один грамм вещества, чтобы изменить его температуру на один градус Цельсия
- сфера гидратации
- , когда полярная молекула воды окружает заряженные или полярные молекулы, удерживая их в растворенном состоянии и в растворе
- поверхностное натяжение
- напряжение на поверхности тела жидкости, препятствующее разделению молекул; создаваемые силами притяжения и сцепления между молекулами жидкости
Эта страница под названием 2. 2: Вода распространяется под лицензией CC BY 4.0 и была создана, изменена и/или курирована OpenStax.
2: Вода распространяется под лицензией CC BY 4.0 и была создана, изменена и/или курирована OpenStax.
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Автор
- ОпенСтакс
- Лицензия
- СС BY
- Версия лицензии
- 4,0
- Программа OER или Publisher
- ОпенСтакс
- Показать оглавление
- нет
- Теги
- кислота
- адгезия
- база
- буфер
- капиллярное действие
- сцепление
- диссоциация
- испарение
- теплота испарения воды
- гидрофильный
- гидрофобный
- лакмусовая бумага
- pH-бумага
- Шкала рН
- растворитель
- удельная теплоемкость
- сфера гидратации
- поверхностное натяжение
2.
 11: Биохимические свойства воды
11: Биохимические свойства воды
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 30616
- Suzanne Wakim & Mandeep Grewal
- Колледж Бьютт
Голубой мрамор
Его часто называют «водной планетой», и ему дали прозвище «голубой мрамор». Вы, наверное, просто называете это «домом». Почти три четверти нашей родной планеты покрыты водой, и без нее жизнь на Земле, какой мы ее знаем, не могла бы существовать. Вода, как и углерод, играет особую роль в живых существах. Он необходим всем известным формам жизни. Хотя вода состоит из простых молекул, каждая из которых содержит всего три атома, ее структура придает ей уникальные свойства, которые помогают объяснить, почему она жизненно важна для всех живых организмов.
Рисунок \(\PageIndex{1}\): Планета Земля
Химическая структура и свойства воды
Вероятно, вы уже знакомы со многими свойствами воды. Например, вы наверняка знаете, что вода без вкуса, без запаха и прозрачна. В небольших количествах он также бесцветен. Однако, когда наблюдается большое количество воды, например, в озере или океане, она на самом деле светло-голубого цвета. Голубой оттенок воды является внутренним свойством и обусловлен избирательным поглощением и рассеянием белого света. Эти и другие свойства воды зависят от ее химического строения.
Прозрачность воды важна для организмов, живущих в воде. Поскольку вода прозрачна, через нее может проходить солнечный свет. Солнечный свет необходим водным растениям и другим водным организмам для фотосинтеза.
Химическая структура воды
Каждая молекула воды состоит из одного атома кислорода и двух атомов водорода, поэтому она имеет химическую формулу H 2 O. Расположение атомов в молекуле воды показано на рисунке \( \PageIndex{2}\), объясняет многие химические свойства воды. В каждой молекуле воды ядро атома кислорода (с 8 положительно заряженными протонами) притягивает электроны гораздо сильнее, чем ядра водорода (только с одним положительно заряженным протоном). Это приводит к отрицательному электрическому заряду вблизи атома кислорода (из-за «притяжения» отрицательно заряженных электронов к ядру кислорода) и положительному электрическому заряду вблизи атомов водорода. Разница в электрическом заряде между различными частями молекулы называется 9.0477 полярность . Полярная молекула — это молекула, в которой часть молекулы заряжена положительно, а часть молекулы — отрицательно.
В каждой молекуле воды ядро атома кислорода (с 8 положительно заряженными протонами) притягивает электроны гораздо сильнее, чем ядра водорода (только с одним положительно заряженным протоном). Это приводит к отрицательному электрическому заряду вблизи атома кислорода (из-за «притяжения» отрицательно заряженных электронов к ядру кислорода) и положительному электрическому заряду вблизи атомов водорода. Разница в электрическом заряде между различными частями молекулы называется 9.0477 полярность . Полярная молекула — это молекула, в которой часть молекулы заряжена положительно, а часть молекулы — отрицательно.
Рисунок \(\PageIndex{2}\): Эта модель представляет собой атомную диаграмму воды, показывающую два атома водорода и атом кислорода в центре.
Вода является хорошим растворителем
Вода считается очень хорошим растворителем в биохимических реакциях. На рисунке \(\PageIndex{3}\) показано, как вода растворяет соли. Поваренная соль (NaCl) состоит из положительно заряженного иона натрия и отрицательно заряженного иона хлорида. Кислород воды притягивается к положительному иону Na. Водороды воды притягиваются к отрицательному иону Cl.
Кислород воды притягивается к положительному иону Na. Водороды воды притягиваются к отрицательному иону Cl.
Рисунок \(\PageIndex{3}\): На этой диаграмме показаны положительные и отрицательные части молекулы воды. На нем также показано, как заряд, например, иона (например, Na или Cl) может взаимодействовать с молекулой воды.
Водородная связь
Противоположные электрические заряды притягиваются друг к другу. Поэтому положительная часть одной молекулы воды притягивается к отрицательным частям других молекул воды. Из-за этого притяжения между атомами водорода и кислорода соседних молекул воды образуются связи, как показано на рисунке \(\PageIndex{4}\). В этом типе связи всегда участвует атом водорода, поэтому он называется 9.0477 водородная связь .
Водородные связи также могут образовываться внутри одной большой органической молекулы. Например, водородные связи, которые образуются между различными частями белковой молекулы, изгибают молекулу, придавая ей характерную форму, что важно для функций белка. Водородные связи также удерживают вместе две нуклеотидные цепи молекулы ДНК.
Водородные связи также удерживают вместе две нуклеотидные цепи молекулы ДНК.
Рисунок \(\PageIndex{4}\): Водородные связи образуются между положительно и отрицательно заряженными частями молекул воды. Связи удерживают молекулы воды вместе. Как вы думаете, как это может повлиять на свойства воды?
Липкая, влажная вода
Вода обладает некоторыми необычными свойствами благодаря своим водородным связям. Одним из свойств является сцепление , склонность молекул воды слипаться. Силы сцепления между молекулами воды ответственны за явление, известное как поверхностное натяжение . Молекулы на поверхности не имеют других подобных молекул со всех сторон и, следовательно, они сильнее связываются с молекулами, непосредственно связанными с ними на поверхности. Например, если вы капнете небольшое количество воды на очень гладкую поверхность, молекулы воды будут слипаться и образовывать капли, а не растекаться по поверхности. То же самое происходит, когда вода медленно капает из прохудившегося крана. Вода падает из крана не в виде отдельных молекул воды, а в виде капель воды. Склонность воды слипаться в капли также иллюстрируется каплями росы на рисунке \(\PageIndex{5}\).
Вода падает из крана не в виде отдельных молекул воды, а в виде капель воды. Склонность воды слипаться в капли также иллюстрируется каплями росы на рисунке \(\PageIndex{5}\).
Рисунок \(\PageIndex{5}\): Капли росы прилипают к паутине, демонстрируя сцепление, тенденцию молекул воды слипаться из-за водородных связей.
Другим важным физическим свойством воды является адгезия . С точки зрения воды адгезия — это соединение молекулы воды с другим веществом, например, с боковыми сторонами жилок листа. Этот процесс происходит потому, что водородные связи уникальны тем, что они разрываются и восстанавливаются с большой частотой. Эта постоянная перегруппировка водородных связей позволяет определенному проценту всех молекул в данном образце связываться с другим веществом. Эта характеристика захвата, которую образуют молекулы воды, вызывает капиллярность способность жидкости течь против силы тяжести в узком пространстве. Примером капиллярного действия является ситуация, когда вы опускаете соломинку в стакан с водой. Кажется, что вода поднимается вверх по соломинке еще до того, как вы кладете рот на соломинку. Вода создала водородные связи с поверхностью соломинки, заставляя воду прилипать к краям соломинки. Поскольку водородные связи продолжают меняться местами на поверхности соломинки, молекулы воды меняются местами, и некоторые из них начинают подниматься по соломинке.
Кажется, что вода поднимается вверх по соломинке еще до того, как вы кладете рот на соломинку. Вода создала водородные связи с поверхностью соломинки, заставляя воду прилипать к краям соломинки. Поскольку водородные связи продолжают меняться местами на поверхности соломинки, молекулы воды меняются местами, и некоторые из них начинают подниматься по соломинке.
Адгезия и капиллярное действие необходимы для выживания большинства организмов. Именно этот механизм отвечает за транспорт воды у растений через корни и стебли, а у животных — через мелкие кровеносные сосуды.
Водородные связи также объясняют, почему температура кипения воды (100°C) выше, чем у аналогичных веществ без водородных связей. Из-за относительно высокой температуры кипения воды большая часть воды существует на Земле в жидком состоянии. Жидкая вода необходима всем живым организмам. Следовательно, наличие жидкой воды позволяет жизни выжить на большей части планеты.
Кроме того, вода имеет высокую удельную теплоемкость, поскольку для повышения или понижения температуры воды требуется много энергии. В результате вода играет очень важную роль в регулировании температуры. Поскольку клетки состоят из воды, это свойство помогает поддерживать гомеостаз.
В результате вода играет очень важную роль в регулировании температуры. Поскольку клетки состоят из воды, это свойство помогает поддерживать гомеостаз.
Плотность льда и воды
Температура плавления воды равна 0°C. Ниже этой температуры вода находится в твердом состоянии (лед). В отличие от большинства химических веществ, вода в твердом состоянии имеет меньшую плотность, чем вода в жидком состоянии. Это происходит потому, что вода расширяется при замерзании. Опять же, причиной является водородная связь. Водородные связи заставляют молекулы воды менее эффективно выстраиваться во льду, чем в жидкой воде. В результате молекулы воды во льду разнесены дальше друг от друга, что придает льду меньшую плотность, чем жидкая вода. Вещество с меньшей плотностью плавает на веществе с большей плотностью. Это объясняет, почему лед плавает в жидкой воде, тогда как многие другие твердые тела опускаются на дно жидкой воды.
В большом водоеме, таком как озеро или океан, вода с наибольшей плотностью всегда опускается на дно. Вода наиболее плотная при температуре около 4°С. В результате вода на дне озера или океана обычно имеет температуру около 4°C. В климате с холодными зимами этот слой воды температурой 4°C изолирует дно озера от отрицательных температур. Озерные организмы, такие как рыбы, могут пережить зиму, оставаясь в этой холодной, но незамерзшей воде на дне озера.
Вода наиболее плотная при температуре около 4°С. В результате вода на дне озера или океана обычно имеет температуру около 4°C. В климате с холодными зимами этот слой воды температурой 4°C изолирует дно озера от отрицательных температур. Озерные организмы, такие как рыбы, могут пережить зиму, оставаясь в этой холодной, но незамерзшей воде на дне озера.
Обзор
- Опишите строение молекулы воды. Что такое полярность и почему вода полярна?
- Объясните, как внутренняя полярность молекулы воды делает ее хорошим растворителем?
- Объясните, как водородные связи заставляют молекулы жидкой воды слипаться.
- Что такое капиллярное действие? Приведите пример.
- Какое свойство воды помогает поддерживать гомеостаз и как?
Атрибуция
- Water Planet от НАСА/Роберта Симмона и Марит Джентофт-Нильсен, общественное достояние через Wikimedia Commons
- Water by Lumen Learning, лицензия CC BY 2.



