Содержание
Функции воды и других неорганических веществ в клетке
Вода играет важнейшую роль в жизни клеток и живых организмов в целом. Помимо того, что она входит в их состав, для многих организмов это еще и среда обитания. Роль воды в клетке определяется ее свойствами. Свойства эти довольно уникальны и связаны главным образом с малыми размерами молекул воды, с полярностью ее молекул и с их способностью, соединяться друг с другом водородными связями.
Молекулы воды имеют нелинейную пространственную структуру. Атомы в молекуле воды удерживаются посредством полярных ковалентных связей, которые связывают один атом кислорода с двумя атомами водорода. Полярность ковалентных связей (т.е. неравномерное распределение зарядов) объясняется в данном случае сильной электроотрицательностью атомов кислорода по отношению к атому водорода; атом кислорода оттягивает на себя электроны из общих электронных пар.
Вследствие этого на атоме кислорода возникает частично Отрицательный заряд, а на атомах водорода — частично положительный. Между атомами кислорода и водорода соседних молекул возникают водородные связи.
Между атомами кислорода и водорода соседних молекул возникают водородные связи.
Благодаря образованию водородных связей молекулы воды им одна с другой, что и обусловливает ее исходное состояние при нормальных условиях.
Вода является превосходным растворителем для полярных веществ, например солей, сахаров, спиртов, кислот и др. Вещества хорошо растворимые в воде, называются гидрофильными.
Абсолютно неполярные вещества типа жиров или масел вода не растворяет и не смешивается с ними, поскольку она не может образовывать с ними водородные связи. Нерастворимые в воде вещества называютсягидрофобными.
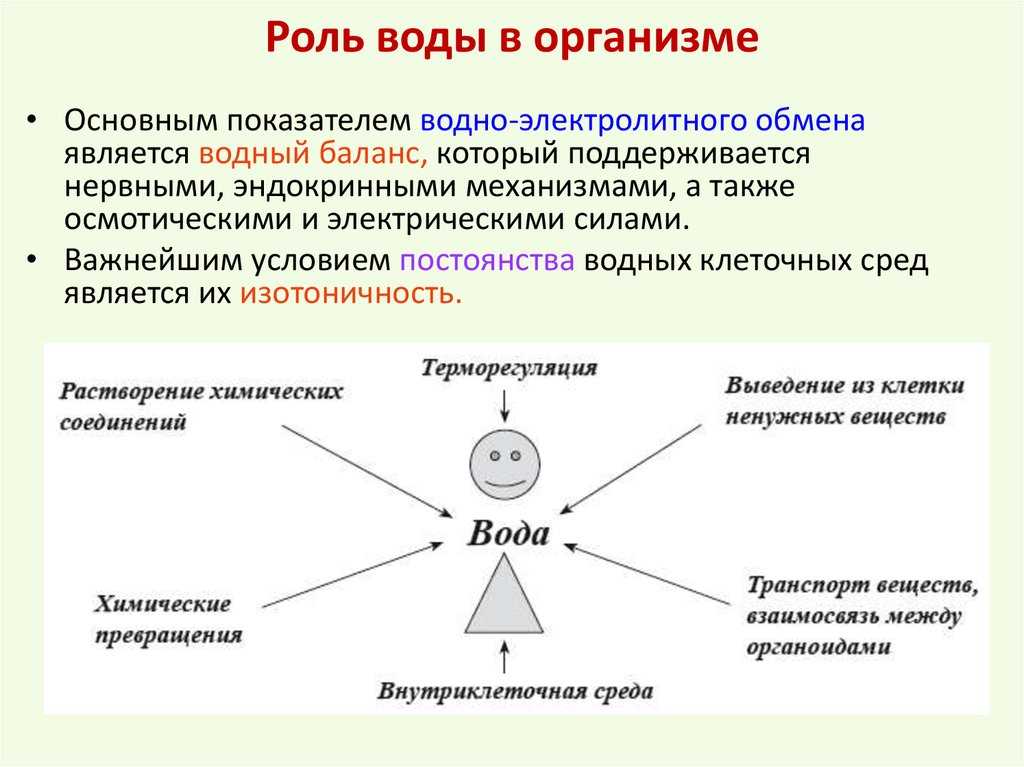
Вода обладает высокой удельной теплоемкостью. Для разрыва водородных связей, удерживающих молекулы воды, требуется поглотить большое количество энергии. Это свойство обеспечивает поддержание теплового баланса организма при значительных перепадах температуры в окружающей среде. Кроме того, вода обладает высокой теплопроводностью, что позволяет организму поддерживать одинаковую температуру во всем его объеме.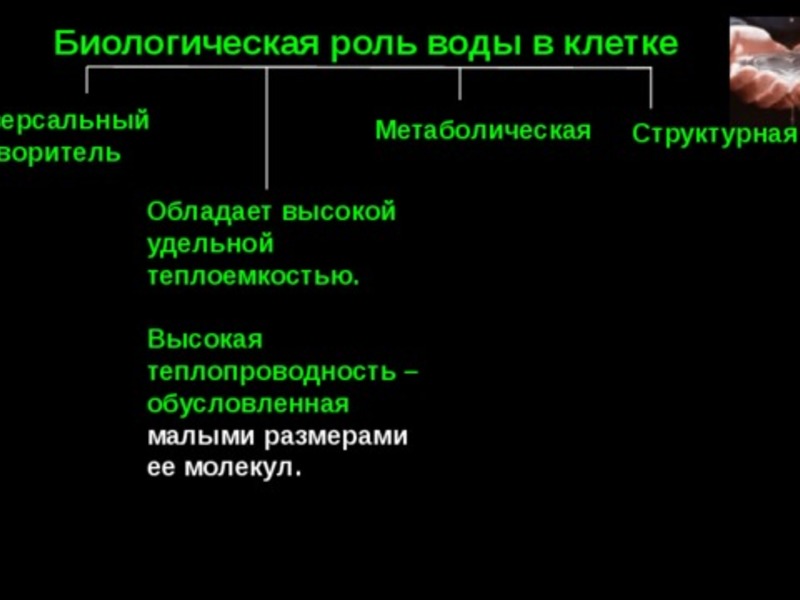
Вода обладает также высокой теплотой парообразования, т.е. способностью молекул уносить с собой значительное количество тепла, охлаждая организм. Это свойство воды используется при потоотделении у млекопитающих, тепловой одышке у крокодилов и транспирации у растений, предотвращая их перегрев.
Для воды характерно исключительно высокое поверхностное натяжение. Это свойство имеет очень важное значение для адсорбционных процессов, для передвижения растворов по тканям (кровообращение, восходящий и нисходящий токи в теле растений). Многие мелкие организмы извлекают для себя пользу из поверхностного натяжения: оно позволяет им удерживаться на воде или скользить по ее поверхности.
Биологические функции воды
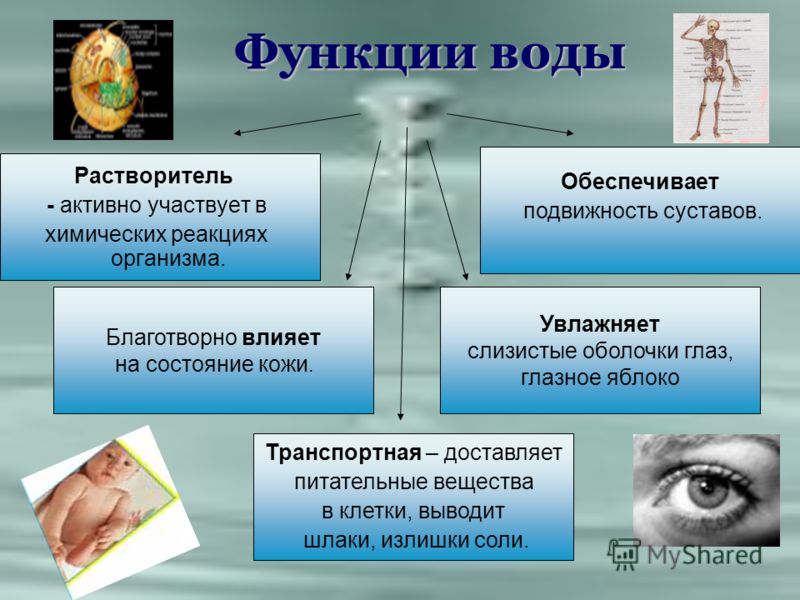
Транспортная. Вода обеспечивает передвижение веществ в клетке и организме, поглощение веществ и выведение продуктов метаболизма.
Метаболическая. Вода является средой для всех биохимических реакций в клетке. Ее молекулы участвуют во многих химических реакциях, например при образовании или гидролизе полимеров. В процессе фотосинтеза вода является донором электронов и источником атомов водорода. Она же является источником свободного кислорода.
В процессе фотосинтеза вода является донором электронов и источником атомов водорода. Она же является источником свободного кислорода.
Структурная. Цитоплазма клеток содержит от 60 до 95 % воды. У растений вода определяет тургор клеток, а у некоторых животных выполняет опорные функции, являясь гидростатическим скелетом (круглые и кольчатые черви, иглокожие).
Вода участвует в образовании смазывающих жидкостей (синовиальная в суставах позвоночных; плевральная в плевральной полости, перикардиальная в околосердечной сумке) и слизей (которые облегчают передвижение веществ по кишечнику, создают влажную среду на слизистых оболочках дыхательных путей). Она входит в состав слюны, желчи, слез, спермы и др.
Минеральные соли. Молекулы солей в водном растворе диссоциируют на катионы и анионы. Наибольшее значение имеют катионы: К+, Na+, Са2+, Mg2+ и анионы: Cl—, H2PO4—, HPO42-, HCO3—, NO3—, SO42-. Существенным является не только содержание, но и соотношение ионов в клетке.
Существенным является не только содержание, но и соотношение ионов в клетке.
Разность между количеством катионов и анионов на поверхности и внутри клетки обеспечивает возникновение потенциала действия, что лежит в основе нервного и мышечного возбуждения. С разностью концентрации ионов по разные стороны мембраны связывают активный перенос веществ через мембрану, а также преобразование энергии.
Анионы фосфорной кислоты создают фосфатную буферную систему, поддерживающую pH внутриклеточной среды организма на уровне 6,9.
Угольная кислота и ее анионы создают бикарбонатную буферную систему, которая поддерживает рН внеклеточной среды (плазма крови) на уровне 7,4.
Некоторые ионы участвуют в активации ферментов, создании осмотического давления в клетке, в процессах мышечного сокращения, свертывании крови и др.
Некоторые катионы и анионы могут включаться в комплексы с различными веществами (например, анионы фосфорной кислоты входят в состав фосфолипидов, АТФ, нуклеотидов и др.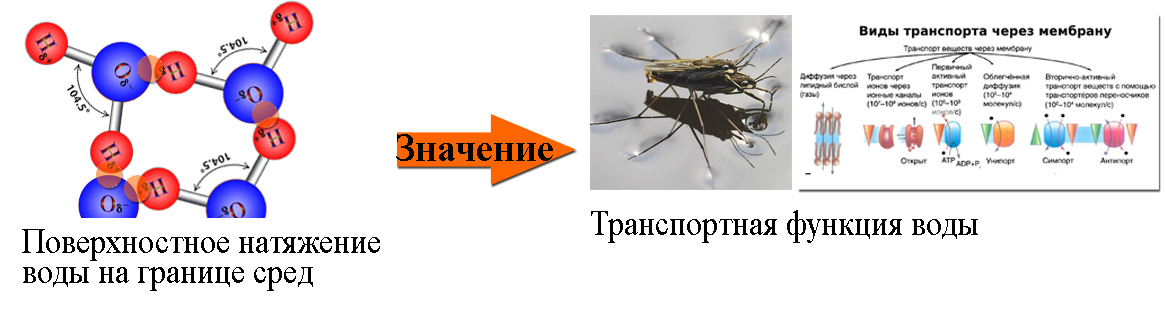 ; ион Fe2+ входит в состав гемоглобина и т.д.).
; ион Fe2+ входит в состав гемоглобина и т.д.).
Вода в клетке
Contents
- 1 Зачем нужна вода в клетке
- 2 Сколько воды содержится в клетке
- 3 В каких клетках больше всего воды
- 4 Роль воды в клетке
- 5 Метаболическая роль воды в клетке
- 6 Транспортная роль воды в клетке
- 7 Функции воды в клетке
- 8 К чему приводит недостаток воды в клетках
Зачем нужна вода в клетке
Вода жизненно необходима живым организмам и растениям. На ее долю приходится большая часть содержимого всех тканей. Строение молекул воды и их свойства помогают поддерживать жизнедеятельность клеток, регулировать обменные процессы, доставлять питательные вещества и выводить отработанные. Форма и упругость клеток поддерживается благодаря свойствам молекул воды.
Доминирующую роль в наполнении содержимого клетки играет вода, на долю которой приходится 80% массы клеточного вещества.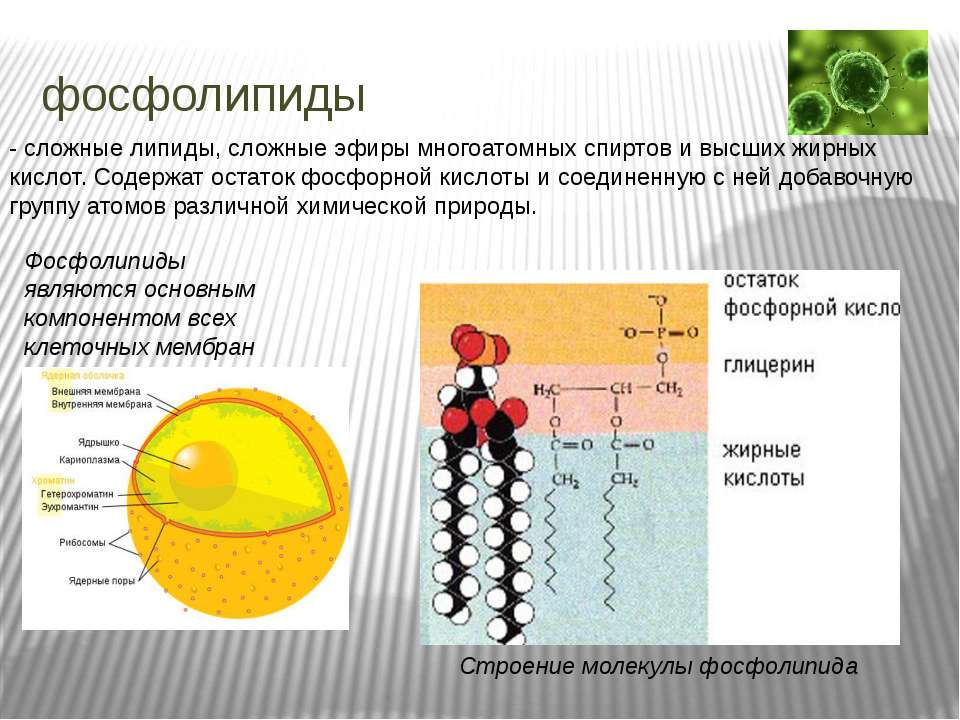 Выступая в качестве компонента клетки, вода одновременно является средой обитания для микроорганизмов.
Выступая в качестве компонента клетки, вода одновременно является средой обитания для микроорганизмов.
Благодаря физическим свойствам воды, клетка может сохранять форму, обладая упругостью. Сохранение тепла тоже происходит благодаря свойствам водного раствора. Химические реакции, протекающие внутри клетки, возможны благодаря водной составляющей. В жидкости растворяются полезные вещества и с нею же выводятся через мембрану отработанные. Интенсивность протекания обменных процессов напрямую зависит от количественного содержания воды. Установлено, что свойства воды при температуре близкой к нулю, помогают выжить многим микроорганизмам. Кроме того, вода используется организмом в качестве смазочного материала, например, в системе пищеварения.
Все эти особенности воды обусловлены ее молекулярным строением и способностью молекул создавать водородные связи. Вода вступает во взаимодействие с полярными молекулами многих веществ, растворяя их. К таким веществам относятся сахара, соли, аминокислоты, некоторые кислоты, спирты. Называются они гидрофильными, то есть обладают способностью вступать во взаимодействие с водой, образуя прочные связи.
Называются они гидрофильными, то есть обладают способностью вступать во взаимодействие с водой, образуя прочные связи.
Гидрофобные, которые не создают соединений с молекулами воды, растекаясь по поверхности, образуют тонкий слой. В нем формируется уникальная среда, в которой происходят химические реакции. К веществам, нерастворимым в воде, принадлежат жиры, отдельные белки, нуклеиновые кислоты.
Способность поддерживать теплообмен напрямую зависит от физического свойства воды – она обладает высокой удельной теплоемкостью и теплопроводностью. Поглощение тепла происходит быстро, при этом процесс нагревания протекает медленно. Чтобы началось испарение, требуется затратить много энергии. Чтобы начался процесс охлаждения, достаточно разорвать водородные связи.
Сколько воды содержится в клетке
Имея много общего, все живые организмы отличаются друг от друга. При этом и содержание воды у разных представителей флоры и фауны отличается. Разница зависит и от географической привязки, климатических особенностей, возраста и вида растения или животного. Даже принадлежность к одному виду, обитающему в разных условиях, не гарантирует одинаковое процентное соотношение жидкости в клетках.
Разница зависит и от географической привязки, климатических особенностей, возраста и вида растения или животного. Даже принадлежность к одному виду, обитающему в разных условиях, не гарантирует одинаковое процентное соотношение жидкости в клетках.
Наличие воды в листьях, стебле и корнях одного растения тоже сильно отличается. Так, если в листьях содержится более 90% водного раствора, то на долю семян приходится чуть больше 10%. В некоторых случаях содержание жидкости не превышает 6%, но при этом жизненные процессы не прекращаются, а приостанавливаются на время. Наступление благоприятных климатических условий запускают процесс накопления воды.
Люди тоже подвержены зависимости от многих факторов. Возраст, образ жизни, состояние здоровья человека и местность проживания с климатическими особенностями определяют процентное содержание жидкости в тканях. Установлено, что больше всего воды находится в лимфе и крови, а меньше всего в клетках костной ткани зубов.
Вода в растениях находится в живых клетках, мертвых элементах, в межклетниках. Самое большое количество воды приходится на межклетники листьев, где она сохраняется в парообразном состоянии. В виде жидкости – в разных частях клеток, занимая более 95% составляющего. Содержание воды в оболочке не превышает 50%.
Самое большое количество воды приходится на межклетники листьев, где она сохраняется в парообразном состоянии. В виде жидкости – в разных частях клеток, занимая более 95% составляющего. Содержание воды в оболочке не превышает 50%.
В различных частях растительной или животной клетки вода может создавать разные формы.
В каких клетках больше всего воды
В разных клетках животных или растительных разный процент содержания воды. Самое большое количество находится в жидких тканях – крови и лимфе. Недостаточное содержание воды в клетках лимфы и крови приводит к загустению, ломкости сосудов. Густая кровь неизбежно приводит к возникновению тромбов и местных кровоизлияний.
Самое большое содержание воды в клетках эмбриона, достигает 98%. Мозг человека содержит чуть меньше – 80%, а в жировых тканях всего 40%. Установлено, что 70% воды находится внутри клеток.
Старение организма ведет к потере жидкости, происходит постепенное обезвоживание. Если процесс происходит слишком быстро, то это может вызвать смерть, для этого достаточно потерять 20% воды.
Если процесс происходит слишком быстро, то это может вызвать смерть, для этого достаточно потерять 20% воды.
Роль воды в клетке
Вода в клетках выполняет важнейшие функции, принимая участие в химических реакциях, благодаря которым сохраняется жизнеспособность и работоспособность клеток. Процессы, протекающие во внутриклеточном пространстве, возможны благодаря образованию водородных связей и обратимой ионизации.
Внутри клеток вода находится в двух формах: свободной и связной. Свободная занимает межклеточное пространство, сосуды, полости органов. Ей отводится роль перевозчика веществ в клетку и обратно. Связная вода это составная частью отдельных клеточных структур, расположена между молекулами белка, мембранами, волокнами, связана с молекулами белка.
- Воды в клеточной структуре больше всего, это необходимо для протекания химических реакций. Молекулы воды идеально подходят на роль катализатора. Гидролиз жиров и белков при переваривании еды высвобождает энергию, которая тратится на поддержание работы клеток.
 Электроны и протоны высвобождаются при гидролизе солей.
Электроны и протоны высвобождаются при гидролизе солей. - Вода реализует потребность клетки в питательных веществах, выполняя роль своеобразного транспорта. Отработанные продукты выводятся за пределы оболочки, а взамен поставляются новые вещества. Проникающая способность молекул воды позволяет им беспрепятственно перемещаться внутри клеток и в межклеточном веществе.
- Форма клетки, ее физические параметры удерживаются благодаря воде. Вода обладает упругостью, ее сложно сжать. Молекулы воды прочно удерживают форму, поддерживают постоянное давление внутри клетки. Благодаря этой особенности все ткани четко структурированы и имеют постоянную форму.
- Поддержание постоянной температуры внутри клетки обусловлена физическими свойствами воды. Повышенная теплоемкость выступает в качестве регулятора постоянной температуры. Дополнительная энергия, которая тратится на согрев клеток высвобождается при расщеплении жиров.
Метаболическая роль воды в клетке
Вода в клетке служит средой для нормального протекания внутренних биохимических реакций. Молекулы воды принимают участие в химических реакциях: образование или гидролиз полимеров. Фотосинтез у растений возможен благодаря тому, что вода является донором электронов и источником атомов водорода. В воде содержится свободный кислород.
Молекулы воды принимают участие в химических реакциях: образование или гидролиз полимеров. Фотосинтез у растений возможен благодаря тому, что вода является донором электронов и источником атомов водорода. В воде содержится свободный кислород.
Транспортная роль воды в клетке
Особая структура молекул воды позволяет ей беспрепятственно проникать через оболочку клетки в межклеточное вещество. Вместе с водой осуществляют путешествие микроорганизмы и полезные вещества, необходимые для поддержания жизнедеятельности клетки. Молекулы воды, выполняя транспортную функцию, доставляют питание. Отработанные вещества необходимо захватить и переместить наружу, чтобы освободить место для новых. Происходит постоянная циркуляция воды, обогащенной полезными веществами внутрь клетки и выведение ненужных продуктов наружу. Это постоянный процесс, который продолжается на протяжении всей жизни организма.
Чем больше в клетке воды, тем интенсивнее происходит процесс обмена.
У растений транспортная функция осуществляется с использованием капиллярного способа водного раствора. Питательные вещества из почвы всасываются корнями, на которых расположены мельчайшие волоски, и дальше устремляются по стеблю к листьям и цветоносам.
Функции воды в клетке
Осуществляя поддержание процессов жизнедеятельности клетки, вода является еще и благотворной средой обитания для различных микроорганизмов. Важнейшие функции воды возможны благодаря ее особенному строению, маленьким размером молекул, способным вступать в реакцию со многими веществами. Полярность молекул и их соединение водородными связями решают важнейшие задачи в организме.
Самая важная задача, которую выполняет в клетке вода – поддержание и сохранение ее жизнедеятельности. Выделяют три функции воды: транспортную, метаболическую и структурную. Нарушение одной из них ведет к сбоям функционирования клетки, ее деформации или усыханию и гибели.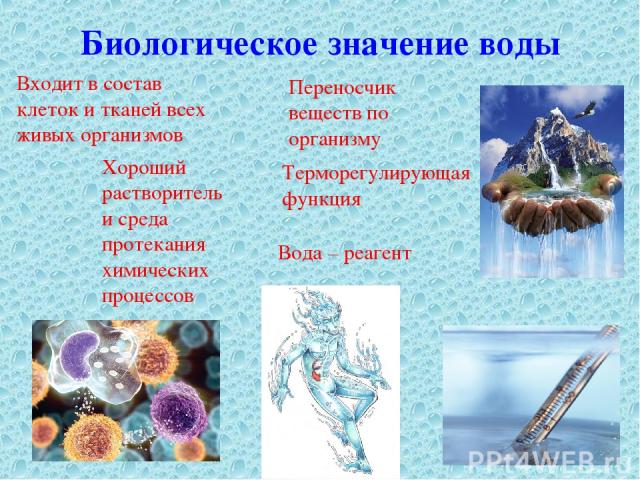 Неизбежным итогом является болезнь организма и преждевременная смерть.
Неизбежным итогом является болезнь организма и преждевременная смерть.
Транспортная функция поддерживает жизнедеятельность клетки благодаря своей проникающей способности. Мембрана и оболочка не являются препятствием для молекул воды, которые свободно совершают перемещение внутрь клетки и наружу. Своевременная доставка свежих полезных веществ и удаление отработанных, сохраняет баланс внутри клетки и позволяет ей выполнять свои функции.
Химические процессы, происходящие внутри клеточного пространства, невозможны без молекул воды. Гидролиз и образование полимеров происходит с их участием. Вода выступает в роли главного поставщика свободного кислорода. Электроны и атомы кислорода задействованы в процессе фотосинтеза.
Сохранение клеточной структуры выполняет именно вода, благодаря своему свойству: в жидком виде она достаточно упругая. Ее содержание в клетках у кольчатых червей, выполняет роль гидростатического скелета. У растений вода определяет тургор клеток.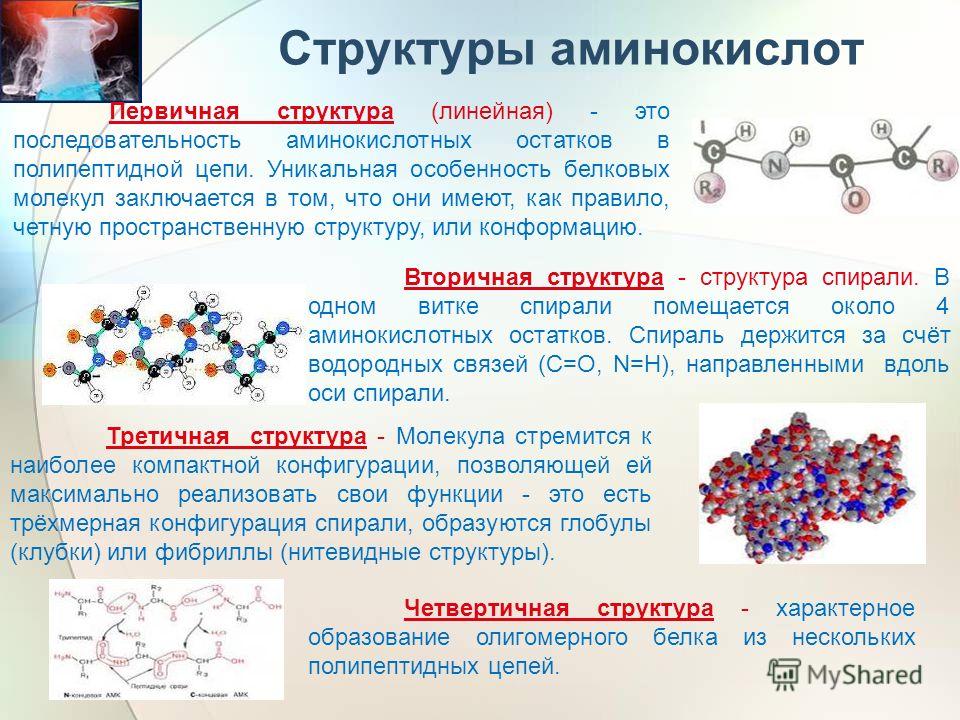 В цитоплазме содержание воды колеблется от 60 до 95%.
В цитоплазме содержание воды колеблется от 60 до 95%.
К чему приводит недостаток воды в клетках
Недостаточное потребление жидкости, обезвоживание организма опасно для любого организма независимо от возраста. В результате необдуманных действий начинается интенсивное использование скрытых резервов, добывание воды из организма. В качестве такого источника выступает клетка, межклеточное пространство и кровь. В первую очередь расходуется содержимое, находящееся во внутриклеточном пространстве. Если дефицит продолжается, то задействуются остальные запасы, постоянно истощая все водные резервы. Опасность заключается в том, что на состоянии здоровья это никак не сказывается, нет внешних симптомов или болевых ощущений. Они появляются только тогда, когда все внутренние резервы уже полностью исчерпаны и клетке нанесен непоправимый ущерб.
Недостаточное количество воды в клетке сказывается на нарушение ее жизнеспособности и функционировании. Сокращение жидкости приводит, в первую очередь, к снижению транспортной функции: внутрь клетки перестают своевременно поступать питательные вещества в необходимом количестве, отработанные продукты задерживаются внутри. Происходит постепенное изменение и усыхание клетки изнутри. Теряется эластичность и способность к удерживанию постоянного внутреннего давления жидкостью.
Сокращение жидкости приводит, в первую очередь, к снижению транспортной функции: внутрь клетки перестают своевременно поступать питательные вещества в необходимом количестве, отработанные продукты задерживаются внутри. Происходит постепенное изменение и усыхание клетки изнутри. Теряется эластичность и способность к удерживанию постоянного внутреннего давления жидкостью.
Происходит нарушение теплообмена, в результате которого клетка утрачивает способность поддерживать оптимальную температуру. После длительного обезвоживания организм все чаще испытывает озноб или происходит повышение температуры.
Обезвоживание в стареющем организме – это естественный процесс, который наглядно показывает постепенную потерю воды в клетках. Недостаток воды отражается на сосудах – они теряют эластичность, постепенно начинают разрушаться. Изменяется лимфа, густеет кровь. Возникновение тромбов и повышенное артериальное давление – наиболее яркие проявления нехватки воды в клетках в пожилом возрасте.
Неизбежными спутниками хронического обезвоживания являются болезни, например, ожирение, аллергия, артрит, астма и другие.
Société Française d’Exobiologie – Французское общество астробиологов » Архив блога » Роль воды в структуре и функционировании биологических макромолекул
Экзобиология и астробиология
Главная / Химие / Роль воды в структуре и функционировании биологических макромолекул
Пар Кристин Бартик
L’eau joue probablement un rôle essential pour l’apparition le la vie. В этой статье Кристин Бартик [1] мы описали роль сущности жизни, которая состоит из структуры биологических макромолекул, которая может быть более стабильной и динамичной. L’eau est maintenant considerée comme partie intégrante des systèmes biomoléculaires.
Понятно, что жизнь на Земле зависит от наличия жидкой воды. В живых системах вода вездесуща и вездесуща, и ее нельзя рассматривать как простой разбавитель. Он выполняет множество функций: транспортирует, структурирует, стабилизирует, смазывает, реагирует и разделяет. Доказательством тонко настроенного участия воды в жизненных процессах служит тот факт, что тяжелая вода токсична для этих процессов.
Он выполняет множество функций: транспортирует, структурирует, стабилизирует, смазывает, реагирует и разделяет. Доказательством тонко настроенного участия воды в жизненных процессах служит тот факт, что тяжелая вода токсична для этих процессов.
Белки и нуклеиновые кислоты выполняют важные биологические функции: они катализируют и регулируют реакции, транспортируют субстраты, кодируют и транскрибируют генетическую информацию. Широко известно, что молекулы воды играют неоценимую роль в управлении структурой, стабильностью, динамикой и функциями этих биомолекул. Действительно, в отсутствие воды им не хватает активности. Однако только в последние годы воду начали количественно рассматривать как неотъемлемый компонент биомолекулярных систем.
Различные экспериментальные и компьютерные исследования подтверждают активную роль воды в структуре, стабильности и динамике биомолекул. Экспериментально информацию получают из измерений рентгеновской дифракции, дифракции нейтронов, ядерного магнитного резонанса (ЯМР) и фемтосекундной спектроскопии [1-3]. Моделирование молекулярной динамики может дополнить знания, полученные в ходе экспериментов, и предложить описание биомолекулы и растворителя, а также зависимость их динамики от времени [4;5].
Моделирование молекулярной динамики может дополнить знания, полученные в ходе экспериментов, и предложить описание биомолекулы и растворителя, а также зависимость их динамики от времени [4;5].
Роль воды в структуре, стабильности и динамике белков и нуклеиновых кислот обсуждается ниже. Также рассматривается его важность в процессах молекулярного распознавания, в которых участвуют эти биологические макромолекулы.
I. Роль воды в фолдинге, структуре и стабильности белков
Белки представляют собой полимеры альфа-аминокислот, которые при нормальных условиях pH, температуры и ионной силы обычно принимают предпочтительную трехмерную (3D) укладку. Боковые цепи 20 аминокислот, из которых состоят белки, имеют различные функциональные группы (амидные, карбоксильные, гидроксильные, тиоловые, ароматические и т. д.).
Последовательность аминокислот в белковом полимере известна как его первичная структура. Распределение атомов в пространстве описывается в терминах вторичной и третичной структуры, которые характеризуют, соответственно, элементы регулярной вторичной структуры (альфа-спирали и бета-листы,…) и глобальную складку (альфа-бочонки, 4 пучка спиралей). , …) белка. Однако интересно отметить, что теоретические модели предсказывают, что существует лишь ограниченное число белковых складок и что открытие совершенно новой укладки будет редким событием в будущем [6;7].
, …) белка. Однако интересно отметить, что теоретические модели предсказывают, что существует лишь ограниченное число белковых складок и что открытие совершенно новой укладки будет редким событием в будущем [6;7].
Термин «первичная структура» ошибочно предполагает, что связность в биологической макромолекуле является ее первичным структурным дескриптором. Однако одной белковой последовательности недостаточно для предсказания трехмерной структуры белка. Белки с разными последовательностями могут иметь почти идентичные трехмерные структуры, в то время как небольшие изменения в последовательности могут привести к разным складкам. В случае белков прионного типа мы сталкиваемся даже с ситуацией, когда белок может принимать две совершенно разные складки.
Взаимодействия между нековалентно связанными атомами (нековалентные взаимодействия) играют важную роль в определении структуры и стабильности нативных (биологически активных) белков. Термодинамические и спектроскопические исследования растворов проводятся специально, чтобы попытаться понять и количественно оценить эти нековалентные взаимодействия. Разница в свободной энергии между нативным и развернутым состояниями белка обусловлена энтальпийным и энтропийным вкладами, которые обычно компенсируют друг друга. Запас стабильности нативных белков по отношению к их денатурированным неактивным формам едва превышает 50 кДжмоль-1 [8]. Этот тонкий запас стабильности гарантирует, что белки сохраняют достаточную гибкость для выполнения своих разнообразных ролей. Многие силы вносят небольшой и противоречивый вклад в стабильность белка. Нынешнее понимание того, как эти силы «взаимодействуют», является неполным; очень часто мутации (замена одной аминокислоты на другую) приводят к эффекту, противоположному предсказанному. Важно отметить, что в то время как различные экспериментальные методы могут прояснить структуру нативных белков, аналогичное подробное описание неактивных (денатурированных) состояний все еще помогает исследователям в наши дни. Денатурированное/неактивное состояние, безусловно, не является «случайной катушкой» и полностью гибким.
Разница в свободной энергии между нативным и развернутым состояниями белка обусловлена энтальпийным и энтропийным вкладами, которые обычно компенсируют друг друга. Запас стабильности нативных белков по отношению к их денатурированным неактивным формам едва превышает 50 кДжмоль-1 [8]. Этот тонкий запас стабильности гарантирует, что белки сохраняют достаточную гибкость для выполнения своих разнообразных ролей. Многие силы вносят небольшой и противоречивый вклад в стабильность белка. Нынешнее понимание того, как эти силы «взаимодействуют», является неполным; очень часто мутации (замена одной аминокислоты на другую) приводят к эффекту, противоположному предсказанному. Важно отметить, что в то время как различные экспериментальные методы могут прояснить структуру нативных белков, аналогичное подробное описание неактивных (денатурированных) состояний все еще помогает исследователям в наши дни. Денатурированное/неактивное состояние, безусловно, не является «случайной катушкой» и полностью гибким. Незнание структурных деталей развернутых белков затрудняет количественный анализ всех данных.
Незнание структурных деталей развернутых белков затрудняет количественный анализ всех данных.
Электростатические взаимодействия, среди которых так называемые «солевые мостики» (кулоновские взаимодействия между противоположными зарядами) и взаимодействия «катион-» (заряд-ароматический цикл), а также взаимодействия Ван-дер-Ваальса (Лондон) играют важную роль в определении стабильности белки. Лондонские взаимодействия слабы и ненаправленны, но важны из-за того, что они вездесущи. Гидрофобный эффект и водородные связи также имеют первостепенное значение, и вода играет важную роль в этом вкладе в структуру и стабильность белка [9].]. Поэтому здесь они будут рассмотрены более подробно. Рисунок 1 представляет собой схематическое изображение того, как вода участвует в структуре и стабильности белка.
Гидрофобный эффект обычно считается основной движущей силой фолдинга глобулярных белков. Это приводит к захоронению гидрофобных боковых цепей аминокислот в ядре белка. Основываясь на работе Франка и Эванса [10], объясняющей на молекулярном уровне низкую растворимость неполярных частиц в воде, Каузман ввел еще в конце 19 в.50-х годов появилась концепция «гидрофобности» для объяснения сложностей фолдинга белков [11]. Вода имеет тенденцию образовывать упорядоченные клетки вокруг неполярных групп (гидрофобная гидратация), что приводит к уменьшению энтропии системы. Эти молекулы воды приобретают энтропию, когда они высвобождаются после соприкосновения гидрофобных поверхностей друг с другом. Это вносит очень благоприятный вклад в свободную энергию стабилизации белка. Таким образом, вода играет фундаментальную роль в сворачивании белков из-за ее роли в определении гидрофобных свойств.
Основываясь на работе Франка и Эванса [10], объясняющей на молекулярном уровне низкую растворимость неполярных частиц в воде, Каузман ввел еще в конце 19 в.50-х годов появилась концепция «гидрофобности» для объяснения сложностей фолдинга белков [11]. Вода имеет тенденцию образовывать упорядоченные клетки вокруг неполярных групп (гидрофобная гидратация), что приводит к уменьшению энтропии системы. Эти молекулы воды приобретают энтропию, когда они высвобождаются после соприкосновения гидрофобных поверхностей друг с другом. Это вносит очень благоприятный вклад в свободную энергию стабилизации белка. Таким образом, вода играет фундаментальную роль в сворачивании белков из-за ее роли в определении гидрофобных свойств.
Гидрофобный «коллапс» белка обязательно сопровождается и направляется образованием водородных связей между благоприятными функциональными группами [12]. Водородная связь (Н-связь) возникает, когда два электроотрицательных атома, таких как азот и кислород, взаимодействуют с одним и тем же водородом. Прочность водородной связи составляет от 2 до 20 кДж/моль. Однако это не обязательно то количество энергии, которое водородная связь вносит в стабилизацию свернутого белка. Действительно, в развернутом состоянии потенциальным партнерам по водородным связям в полипептидной цепи удовлетворяются водородные связи с водой. Когда белок складывается, эти Н-связи белок-вода разрываются, некоторые из них заменяются внутрибелковыми Н-связями, и энтропия растворителя увеличивается. Баланс между энтропийными и энтальпийными членами близок, но Н-связи вносят положительный вклад в стабилизацию белка [13;14]. Несмотря на небольшой вклад водородных связей в стабильность белка, если внутримолекулярная водородная связь в белке разорвана или удалена без возможности образования компенсирующей Н-связи с растворителем, белок будет дестабилизирован и может потерять свою структуру.
Прочность водородной связи составляет от 2 до 20 кДж/моль. Однако это не обязательно то количество энергии, которое водородная связь вносит в стабилизацию свернутого белка. Действительно, в развернутом состоянии потенциальным партнерам по водородным связям в полипептидной цепи удовлетворяются водородные связи с водой. Когда белок складывается, эти Н-связи белок-вода разрываются, некоторые из них заменяются внутрибелковыми Н-связями, и энтропия растворителя увеличивается. Баланс между энтропийными и энтальпийными членами близок, но Н-связи вносят положительный вклад в стабилизацию белка [13;14]. Несмотря на небольшой вклад водородных связей в стабильность белка, если внутримолекулярная водородная связь в белке разорвана или удалена без возможности образования компенсирующей Н-связи с растворителем, белок будет дестабилизирован и может потерять свою структуру.
.
Рис. 1 : Схематическое представление различных способов участия молекул воды в структуре и стабильности белка.
.
Рентгеновский снимок и ЯМР показывают, что хорошо упорядоченные молекулы воды являются неотъемлемой частью всех свернутых белков, и было обнаружено, что молекулы воды консервативны среди гомологичных белков. ЯМР-исследования гидратации белка в водном растворе дают время пребывания этих внутренних молекул воды в диапазоне от 10-2 до 10-8 с [2]. Некоторые из них вносят вклад в структуру и стабильность белков, связывая посредством водородных связей различные функциональные группы, присутствующие в белке. Эти мостиковые молекулы воды следует рассматривать как часть системы, а белок следует определять как систему полипептид + вода. Сети водородных связей, включающие несколько молекул воды, которые связывают отдельные части белка, также наблюдались экспериментально. Мутации могут влиять на количество структурных молекул воды в белковом ядре и нарушать основные взаимодействия, опосредованные водородными связями воды, что приводит к дестабилизации [15]. Также считается, что захороненные молекулы воды в некоторых случаях способствуют стабилизации белковых конформаций просто за счет заполнения карманов в белковой структуре (природа не терпит пустоты).
Также считается, что захороненные молекулы воды в некоторых случаях способствуют стабилизации белковых конформаций просто за счет заполнения карманов в белковой структуре (природа не терпит пустоты).
Интересно отметить, что сообщалось о значительном улучшении предсказания структуры белка путем добавления потенциала, основанного на знаниях о воде, к установленному гамильтониану для предсказания структуры белка [16]. Эти исследования показывают, что вода не только индуцирует сворачивание и связывание белков, но также активно участвует в этом посредством контактов, опосредованных водой. Ожидается, что «мокрые» гамильтонианы будут предсказывать более точные структуры.
Вода на поверхности биологических макромолекул определяет слой, который получил название «биологическая вода» [17]. Гидратация воды в непосредственной близости от поверхности белка демонстрирует динамические свойства, заметно отличающиеся от характеристик объема и времени пребывания в субнаносекундном диапазоне.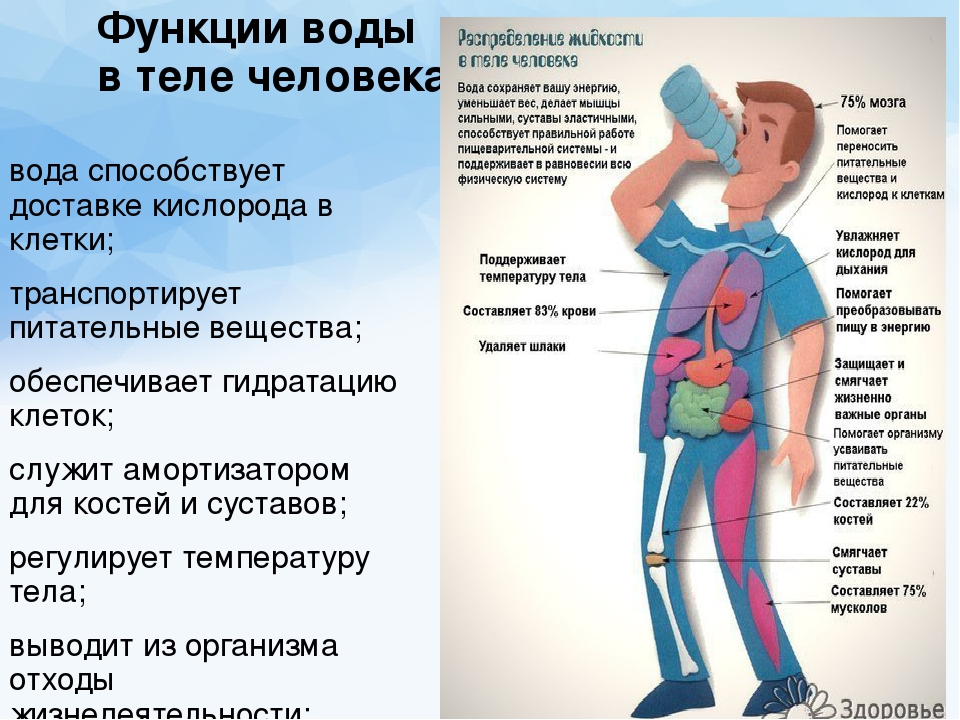 Эти молекулы воды играют важную роль в процессах распознавания, которые будут обсуждаться в разделе 3.9.0003
Эти молекулы воды играют важную роль в процессах распознавания, которые будут обсуждаться в разделе 3.9.0003
II. Роль воды в структуре и стабильности нуклеиновых кислот
Основной повторяющейся единицей дезоксирибонуклеиновой кислоты (ДНК) и рибонуклеиновой кислоты (РНК) является нуклеотид [18]. Он состоит из циклического сахара (дезоксирибозы в ДНК или рибозы в РНК), который фосфорилирован в одном положении и замещен одним из четырех различных гетероциклических ароматических оснований в другом. Основаниями являются аденин (A), гуанин (G), цитозин (C) и тимин (T) в ДНК, а тимин заменен функционально эквивалентным урацилом (U) в РНК. Нуклеотиды связаны друг с другом через фосфатные группы (фосфодиэфирные связи). Специфические функции молекул ДНК и РНК модулируются их трехмерной структурой, которая зависит не только от последовательности нуклеотидов и состава оснований, но также в значительной степени от условий окружающей среды.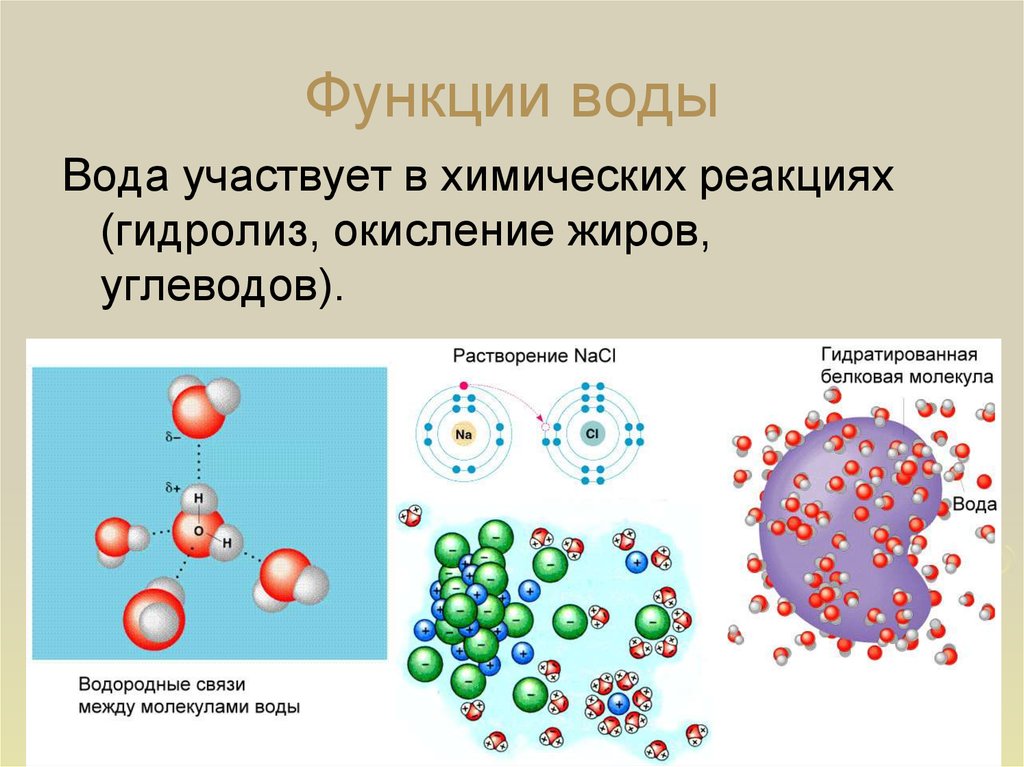 9ДНК 0017 является двухцепочечной (две нити антипараллельны друг другу) и обычно рассматривается как правая двойная спираль с комплементарными основаниями (C-G и AT), соединяющимися через Н-связи друг с другом (рис. 2). Пары оснований расположены в центре двойной спирали, компланарны и перпендикулярны оси спирали. Внешняя оболочка двойной спирали не является цилиндрически гладкой, но может иметь две канавки разной ширины и глубины. Эта трехмерная структура способна к значительным изменениям и может подвергаться структурным переходам между рядом различных конформаций. В то время как некоторые из этих изменений довольно незаметны, другие очень драматичны и могут, например, включать полное изменение хиральности двойной спирали. Было идентифицировано пять основных структурных вариантов двойной спирали ДНК. Они были обозначены как A-ДНК, B-ДНК, C-ДНК, D-ДНК, Z-ДНК (или S-ДНК). Правосторонняя B-ДНК является преобладающей структурной формой in vivo , и две бороздки одинаково глубоки, но не имеют одинаковой ширины.
9ДНК 0017 является двухцепочечной (две нити антипараллельны друг другу) и обычно рассматривается как правая двойная спираль с комплементарными основаниями (C-G и AT), соединяющимися через Н-связи друг с другом (рис. 2). Пары оснований расположены в центре двойной спирали, компланарны и перпендикулярны оси спирали. Внешняя оболочка двойной спирали не является цилиндрически гладкой, но может иметь две канавки разной ширины и глубины. Эта трехмерная структура способна к значительным изменениям и может подвергаться структурным переходам между рядом различных конформаций. В то время как некоторые из этих изменений довольно незаметны, другие очень драматичны и могут, например, включать полное изменение хиральности двойной спирали. Было идентифицировано пять основных структурных вариантов двойной спирали ДНК. Они были обозначены как A-ДНК, B-ДНК, C-ДНК, D-ДНК, Z-ДНК (или S-ДНК). Правосторонняя B-ДНК является преобладающей структурной формой in vivo , и две бороздки одинаково глубоки, но не имеют одинаковой ширины. В правосторонней А-ДНК две бороздки не имеют одинаковой глубины или ширины, более узкая из них глубже. Левосторонняя Z-ДНК предпочтительнее при высоких концентрациях соли и представляет собой одну бороздку. РНК не являются двухцепочечными, а имеют правильную укладку, и обычно более половины нуклеотидов участвуют в спаривании оснований. Последовательное наложение пар оснований приводит к образованию спиралей А-образного типа, соединенных одноцепочечными отрезками.
В правосторонней А-ДНК две бороздки не имеют одинаковой глубины или ширины, более узкая из них глубже. Левосторонняя Z-ДНК предпочтительнее при высоких концентрациях соли и представляет собой одну бороздку. РНК не являются двухцепочечными, а имеют правильную укладку, и обычно более половины нуклеотидов участвуют в спаривании оснований. Последовательное наложение пар оснований приводит к образованию спиралей А-образного типа, соединенных одноцепочечными отрезками.
.
Рисунок 2: Спаривание оснований Уотсона-Крика и возможные места для связывания воды с парными основаниями. (с http://www.lsbu.ac.uk/water/nucleic.html)
.
Нуклеиновые кислоты представляют собой высокозаряженные полианионы. Нейтрализующие заряды обеспечиваются противоионами в окружающей водной среде. Такие металлы, как Mg++, Ca++, Na+ и K+, присутствуют в организме в миллимолярных концентрациях, а нуклеиновые кислоты встречаются в виде комплексов, скоординированных с этими металлами. Помимо этой диффузной противоионной атмосферы, также существуют специфические участки для связывания металлов [19].]. Например, известно, что Mg++ играет важную роль в стабилизации третичной структуры тРНК [20].
Помимо этой диффузной противоионной атмосферы, также существуют специфические участки для связывания металлов [19].]. Например, известно, что Mg++ играет важную роль в стабилизации третичной структуры тРНК [20].
Наряду с водородными связями между парами оснований и лондонскими дисперсионными силами между уложенными основаниями вода способствует стабилизации структур РНК и ДНК [20-23]. Роль воды в стабилизации трехмерной структуры нуклеиновых кислот еще более важна, чем в белках, из-за наличия отрицательно заряженных фосфатных групп. Фосфатно-фосфатное электростатическое отталкивание уменьшается в воде благодаря высокой диэлектрической проницаемости воды. Степень гидратации нуклеиновых кислот также играет ключевую роль в их конформации. Например, высокая активность воды благоприятствует форме В ДНК, а пониженная активность воды (или повышенная ионная сила) приводит к переходу от формы В к формам С и А и, если позволяет последовательность, к формам D и Z-ДНК.
Как и в белках, вода является неотъемлемой частью структур нуклеиновых кислот. Вокруг двойных спиралей ДНК располагается непроницаемая для катионов гидратная оболочка [18]. Он состоит примерно из 18-19 молекул воды на нуклеотид в В-ДНК и примерно из 13-14 в А-ДНК. Эти молекулы воды специфически связаны с фосфатными группами и основаниями. Рентгеновские исследования показывают, что на каждый фосфат приходится шесть сайтов гидратации и что положение и занятость этих сайтов зависят от конформации и типа нуклеотида [22-24]. Исследования кристаллических структур А-ДНК показали, что молекулы воды связывают соседние фосфатные группы и, таким образом, стабилизируют А-форму при более низкой активности воды. Однако молекулы воды вокруг фосфатных групп не расположены постоянно из-за довольно диффузного распределения электронов фосфатных групп. Парные основания способны образовывать водородные связи с водой внутри канавок (рис. 2). Шип гидратации, например, наблюдается с помощью рентгеновской кристаллографии в малой бороздке B-ДНК. Энергетические расчеты показывают, что наличие этого стержня гидратации является основной причиной сужения малой бороздки.
Вокруг двойных спиралей ДНК располагается непроницаемая для катионов гидратная оболочка [18]. Он состоит примерно из 18-19 молекул воды на нуклеотид в В-ДНК и примерно из 13-14 в А-ДНК. Эти молекулы воды специфически связаны с фосфатными группами и основаниями. Рентгеновские исследования показывают, что на каждый фосфат приходится шесть сайтов гидратации и что положение и занятость этих сайтов зависят от конформации и типа нуклеотида [22-24]. Исследования кристаллических структур А-ДНК показали, что молекулы воды связывают соседние фосфатные группы и, таким образом, стабилизируют А-форму при более низкой активности воды. Однако молекулы воды вокруг фосфатных групп не расположены постоянно из-за довольно диффузного распределения электронов фосфатных групп. Парные основания способны образовывать водородные связи с водой внутри канавок (рис. 2). Шип гидратации, например, наблюдается с помощью рентгеновской кристаллографии в малой бороздке B-ДНК. Энергетические расчеты показывают, что наличие этого стержня гидратации является основной причиной сужения малой бороздки. Гидратация более постоянна вокруг оснований, чем вокруг фосфатных групп, но время пребывания, о котором сообщается, для этих молекул воды все еще относительно короткое по сравнению со временем пребывания связанных молекул воды в белках. Вторая гидратная оболочка, неотличимая от объемной воды по проницаемости для ионов, окружает двойную спираль ДНК. В этой оболочке свойства молекул воды отличаются от свойств объемной воды, даже если время пребывания находится в субнаносекундном диапазоне. Подобно белкам, эта оболочка гидратации играет важную роль в процессах узнавания, которые будут обсуждаться в следующем разделе.
Гидратация более постоянна вокруг оснований, чем вокруг фосфатных групп, но время пребывания, о котором сообщается, для этих молекул воды все еще относительно короткое по сравнению со временем пребывания связанных молекул воды в белках. Вторая гидратная оболочка, неотличимая от объемной воды по проницаемости для ионов, окружает двойную спираль ДНК. В этой оболочке свойства молекул воды отличаются от свойств объемной воды, даже если время пребывания находится в субнаносекундном диапазоне. Подобно белкам, эта оболочка гидратации играет важную роль в процессах узнавания, которые будут обсуждаться в следующем разделе.
РНК имеет большую степень гидратации, чем ДНК, из-за дополнительных атомов кислорода (рибозы O2’) и неспаренных оснований. Наблюдаются стабильные модели гидратации, как и в ДНК вокруг двухцепочечных участков [20;25].
III. Роль воды в молекулярном распознавании биомолекул
Процессы связывания широко распространены в биологических системах, начиная от связывания небольших молекул, таких как лекарства, и заканчивая связыванием белков с ДНК. Большинство, но не все, из этих процессов связывания высокоспецифичны в отношении выбора сайтов связывания [26-28]. Исследования молекулярного распознавания долгое время были сосредоточены на геометрической комплементарности между партнерами, в конечном итоге после конформационных изменений (рис. 3). Это предполагает, что движущие силы для связывания возникают из-за прямого взаимодействия между партнерами (привлекательные лондонские взаимодействия и наличие соответствующих функциональных групп, ведущих к Н-связям, соляным мостикам). Однако процессы связывания обычно происходят в воде. Тот факт, что молекулы воды в изобилии наблюдаются экспериментально на границе раздела (био)молекул, предполагает, что вода необходима для биомолекулярного распознавания и самосборки.
Большинство, но не все, из этих процессов связывания высокоспецифичны в отношении выбора сайтов связывания [26-28]. Исследования молекулярного распознавания долгое время были сосредоточены на геометрической комплементарности между партнерами, в конечном итоге после конформационных изменений (рис. 3). Это предполагает, что движущие силы для связывания возникают из-за прямого взаимодействия между партнерами (привлекательные лондонские взаимодействия и наличие соответствующих функциональных групп, ведущих к Н-связям, соляным мостикам). Однако процессы связывания обычно происходят в воде. Тот факт, что молекулы воды в изобилии наблюдаются экспериментально на границе раздела (био)молекул, предполагает, что вода необходима для биомолекулярного распознавания и самосборки.
Вода является универсальным компонентом на границе биомолекулярных комплексов. Он может действовать как донор и акцептор водородных связей, налагая небольшие стерические ограничения на образование связи, и может принимать участие во множественных водородных связях.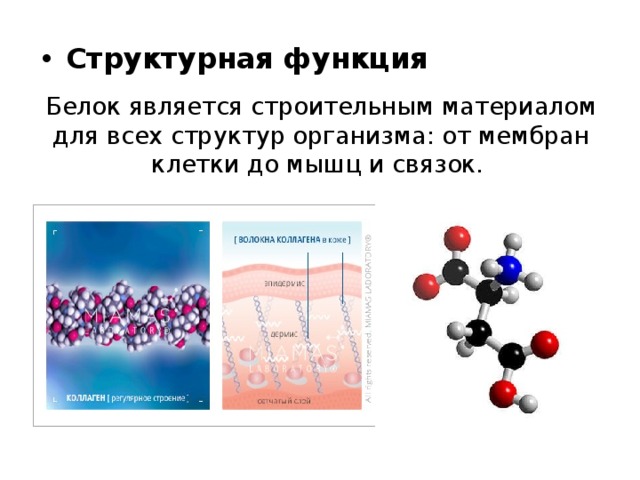 Таким образом, вода может придавать поверхности высокий уровень приспособляемости, допуская неразборчивое связывание, но она также может обеспечивать специфичность и повышенную аффинность к взаимодействию. Вода во взаимодействиях белок-лиганд может, например, функционировать как расширение структуры белка, позволяя различным лигандам размещаться в данном сайте связывания [28] или увеличивая сродство к конкретному лиганду (рис. 3). Для этих молекул воды энергетический выигрыш от контактов, опосредованных водой, больше, чем энтропийные затраты, возникающие в результате их иммобилизации. Однако включение молекул воды в конструкцию лиганда на основе структуры в настоящее время в значительной степени упускается из виду, потому что структурные и термодинамические эффекты включения воды трудно определить и смоделировать. (Био)молекулярные ассоциации, особенно комплексы белок-белок и белок-ДНК, конечно, также будут стабилизированы в результате гидрофобного эффекта и экранирования водой отталкивания заряда.
Таким образом, вода может придавать поверхности высокий уровень приспособляемости, допуская неразборчивое связывание, но она также может обеспечивать специфичность и повышенную аффинность к взаимодействию. Вода во взаимодействиях белок-лиганд может, например, функционировать как расширение структуры белка, позволяя различным лигандам размещаться в данном сайте связывания [28] или увеличивая сродство к конкретному лиганду (рис. 3). Для этих молекул воды энергетический выигрыш от контактов, опосредованных водой, больше, чем энтропийные затраты, возникающие в результате их иммобилизации. Однако включение молекул воды в конструкцию лиганда на основе структуры в настоящее время в значительной степени упускается из виду, потому что структурные и термодинамические эффекты включения воды трудно определить и смоделировать. (Био)молекулярные ассоциации, особенно комплексы белок-белок и белок-ДНК, конечно, также будут стабилизированы в результате гидрофобного эффекта и экранирования водой отталкивания заряда.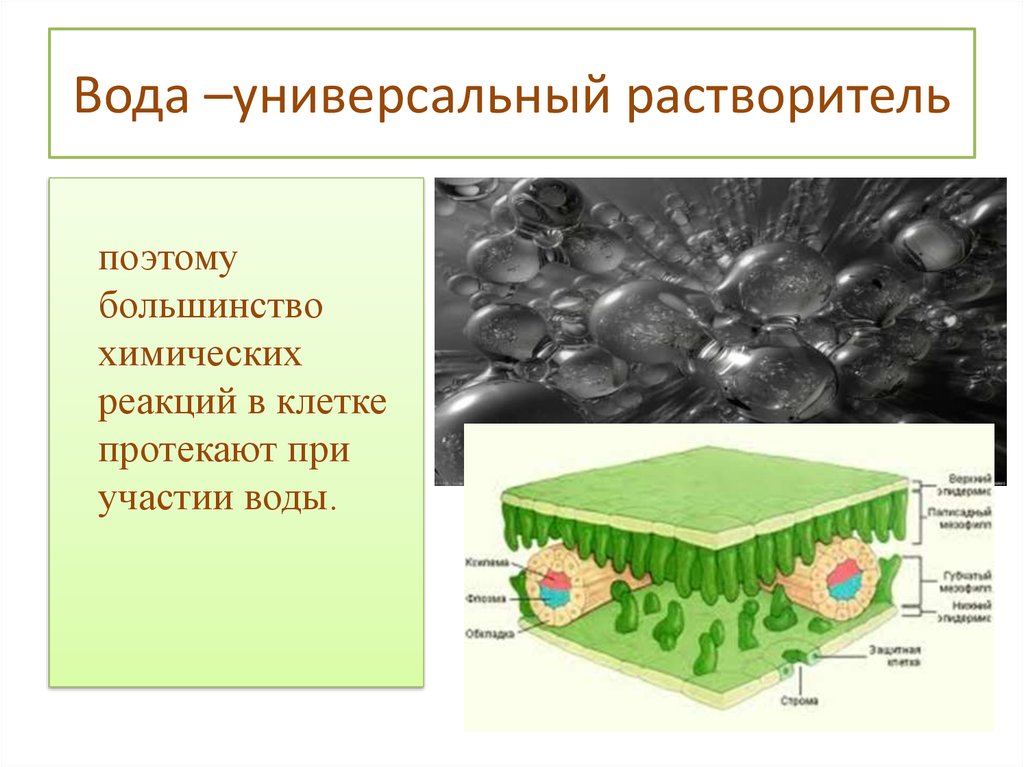
.
Рисунок 3: Схематическое изображение различных моделей, объясняющих взаимодействие белок-лиганд.
.
IV. Заключение
Как гидрофобные, так и гидрофильные эффекты являются доминирующими движущими силами биохимических процессов: укладки белков, стабильности нуклеиновых кислот и событий молекулярного распознавания/связывания. Воду, без всякого сомнения, следует считать составной частью биологических макромолекул. Живой мир следует рассматривать как равноправное партнерство между белками, нуклеиновыми кислотами и водой.
V. Ссылки
- 1 Мейер, Э. Молекулы внутренней воды и Н-связь в биологических макромолекулах: обзор структурных особенностей с функциональным значением; Белковая наука 1, 1543-62 (1992)
- 2 Оттинг, Г. ЯМР-исследования воды, связанной с биологическими молекулами; Progress in Nuclear Magnetic Resonance Spectroscopy 31, 259-285 (1997)
- 3 Пал С.
 К., Пеон Дж., Багчи Б. и Зевайл А.Х. Биологическая вода: фемтосекундная динамика макромолекулярной гидратации Journal of Physical Chemistry B 106, 12376-12395 (2002)
К., Пеон Дж., Багчи Б. и Зевайл А.Х. Биологическая вода: фемтосекундная динамика макромолекулярной гидратации Journal of Physical Chemistry B 106, 12376-12395 (2002) - 4 Фейг, М. и Брукс, К. Л. Последние достижения в разработке и применении неявных моделей растворителей в моделировании биомолекул Текущее мнение в структурной биологии 14, 217-224 (2004)
- 5 Беверидж, Д. Л. и МакКоннелл, К. Дж. Нуклеиновые кислоты: теория и компьютерное моделирование, Y2K Current Opinion in Structural Biology 10, 182-196 (2000)
- 6 Говиндараджан С., Рекабаррен Р. и Гольдштейн Р. А. Оценка общего количества белковых складок Белки: структура, функция и генетика 35, 408–414 (19).99)
- 7 Mittl, P.R.E. и Grutter, M.G. Структурная геномика: возможности и вызовы Current Opinion in Chemical Biology 5, 402-408 (2001)
- 8 Франкс, Ф. Стабильность белков: ценность «старой литературы» Biophysical Chemistry 96, 117-127 (2002)
- 9 Леви Ю. и Онучич Дж. Н. Вода и белки: отношения любви и ненависти.
 Proceedings of the National Academy of Sciences of the United States of America 101, 3325-3326 (2004)
Proceedings of the National Academy of Sciences of the United States of America 101, 3325-3326 (2004) - 10 Фрэнкс Х.С. и Эванс М.В. Свободный объем и энтропия в конденсированных системах III. Энтропия в бинарных жидких смесях. Дж. Хим. физ. 13, 507-532 (1945)
- 11 Kauzmann, W. Некоторые факторы интерпретации денатурации белков Advances in Protein Chem. (К. Б. Анфинсен, М. Л. Ансон, Кеннет Бейли и Джон Т. Эдсолл, редакторы Academic Press Inc.) 14, 1–63 (1959)
- 12 Fernandez, A., Kardos, J. and Goto, Y. Фолдинг белков: может ли гидрофобный коллапс сочетаться с образованием водородных связей? Письма FEBS 536, 187-192 (2003)
- 13 Макдональд, И. К. и Торнтон, Дж. М. Удовлетворение потенциала водородных связей в белках Journal of Molecular Biology 238, 777-93 (1994)
- 14 Пейс С.Н., Ширли Б.А., МакНатт М. и Гадживала К. Силы, способствующие конформационной стабильности белков FASEB Journal 10, 75-83 (1996)
- 15 Ковальт, Дж. К., младший, Рой, М.
 и Дженнингс, П. А. Мутации ядра и поверхности влияют на кинетику сворачивания, стабильность и кооперативность в IL-1b: играют ли роль изменения в погребенной воде? Журнал молекулярной биологии 307, 657-669 (2001)
и Дженнингс, П. А. Мутации ядра и поверхности влияют на кинетику сворачивания, стабильность и кооперативность в IL-1b: играют ли роль изменения в погребенной воде? Журнал молекулярной биологии 307, 657-669 (2001) - 16 Папоян, Г. А., Уландер, Дж., Иствуд, М. П., Лути-Шультен, З. и Волинс, П. Г. Вода в предсказании структуры белка. Труды Национальной академии наук Соединенных Штатов Америки. 101, 3352-7 (2004). )
- 17 Пал С.К. и Зевайл А.Х. Dynamics of Water in Biological Recognition Chemical Reviews (Вашингтон, округ Колумбия, США) 104, 2099-2123 (2004)
- 18 Saenger, W. Principles of Nucleic Acid Structure (1984) Springer-Verlag ed.
- 19 Денисов В.П. и Халле Б. Последовательность-специфическое связывание противоионов с В-ДНК Труды Национальной академии наук Соединенных Штатов Америки 97, 629-633 (2000)
- 20 Херманн Т. и Патель Д. Дж. Объединение третичных архитектур РНК Журнал молекулярной биологии 294, 829-49 (1999)
- 21 МакКоннелл, К.
 Дж. и Беверидж, Д. Л. Структура ДНК: кто главный? Журнал молекулярной биологии 304, 803-20 (2000)
Дж. и Беверидж, Д. Л. Структура ДНК: кто главный? Журнал молекулярной биологии 304, 803-20 (2000) - 22 Берман Х.М. Кристаллологическое исследование В-ДНК: ответы и вопросы Биополимеры 44, 23-44 (1997)
- 23 Wahl, M.C. and Sundaralingam, M. Crystal Structures of A-DNA duplexes Biopolymers 44, 45-63 (1997)
- 24 Schneider, B., Patel, K. и Berman, H.M. Гидратация фосфатной группы в двойной спирали ДНК. Biophysical Journal 75, 2422-2434 (19).98)
- 25 Ауффингер, П. и Вестхоф, Э. Гидратация РНК: три наносекунды множественного молекулярно-динамического моделирования шпильки сольватированного антикодона тРНКАсп Journal of Molecular Biology 269, 326-341 (1997)
- 26 Бен-Наим, А. Молекулярное распознавание – взгляд глазами растворителя Биофизическая химия 101-102, 309-319 (2002)
- 27 Лэдбери, Дж. Э. Просто добавь воды! Влияние воды на специфичность сайтов связывания белок-лиганд и ее потенциальное применение в разработке лекарств Химия и биология 3, 973-980 (1996)
- 28 Tame, J.
 R.H., Sleigh, S.H., Wilkinson, A.J. and Ladbury, J.E. The role of water in sequence-independent связывание лиганда белком-переносчиком олигопептида Nature Structural Biology 3, 998-1001 (1996)
R.H., Sleigh, S.H., Wilkinson, A.J. and Ladbury, J.E. The role of water in sequence-independent связывание лиганда белком-переносчиком олигопептида Nature Structural Biology 3, 998-1001 (1996)
.
[1] Профессор лаборатории молекулярной и биомолекулярной инженерии Свободного университета Брюсселя.
Товары по теме
Вода – определение, структура, характеристики, свойства, функции
Анупама Сапкота
Содержание
Определение воды
Вода представляет собой неорганическое жидкое химическое вещество без цвета, запаха и вкуса, которое составляет большую часть гидросферы Земли и жидкости в организме всех живых существ.
- Вода является чрезвычайно важным компонентом для существования жизни, поскольку она необходима для всех биологических процессов.
 Однако он не имеет ни калорийности, ни пищевой ценности.
Однако он не имеет ни калорийности, ни пищевой ценности. - Вода находится в жидком состоянии при стандартных атмосферных температуре и давлении.
- Занимает 71% всей суши на Земле и около 70% от общей массы тела человека.
- Количество воды на Земле поддерживается за счет непрерывного движения воды из земли в атмосферу и обратно, называемого круговоротом воды.
- Вода также важна для различных химических процессов, так как является универсальным растворителем.
Структура воды
- Химическая формула воды H 2 O указывает на то, что одна молекула воды состоит из двух атомов водорода и одного атома кислорода.
- Атомы в молекуле воды связаны друг с другом полярными ковалентными связями. Молекула сама по себе электрически нейтральна, но полярна с отрицательными и положительными зарядами, локализованными в разных областях.
В газовой фазе
- В молекуле воды s- и p-орбитали валентной оболочки имеют вид sp 3 гибридизуется с образованием четырех sp 3 гибридных орбиталей, тетраэдрически ориентированных вокруг атома кислорода.

- Две гибридные орбитали заняты по отдельности, в то время как неподеленные пары электронов занимают две другие.
- Каждая отдельная занятая sp 3 орбиталь перекрывается с наполовину заполненной орбиталью атома H.
- В результате атом кислорода связан с двумя атомами водорода двумя ковалентными связями O-H, и на атоме кислорода есть две неподеленные пары электронов.
- Наиболее устойчивое расположение атомов такое, при котором они находятся дальше всего. Угол между связями OH составляет около 104 °, а не идеальный тетраэдр (109 °) из-за отталкивания между неподеленными парами.
- Таким образом, структура молекулы воды представляет собой угловатую или изогнутую структуру.
- Молекула воды полярна, потому что кислород более электроотрицателен, чем водород. Таким образом, атом кислорода притягивает к себе общие электроны.
- В результате на атоме кислорода возникает частичный отрицательный заряд, а на атоме водорода — частичный положительный заряд.

В жидкой фазе
- В жидкой фазе молекулы воды удерживаются вместе межмолекулярными водородными связями.
- Одна молекула воды способна образовывать четыре водородные связи, поскольку она может образовывать две связи с неподеленной парой кислорода и отдавать два электрона водороду.
- В воде образование четырех водородных связей приводит к межмолекулярной тетраэдрической структуре, образующей открытую структуру и трехмерную сеть связей.
В твердой фазе
- Твердой формой воды является лед, который может существовать в различных кристаллических формах в зависимости от условий замерзания воды.
- В правильном шестиугольном льду каждый атом кислорода тетраэдрически окружен четырьмя другими атомами кислорода, тогда как один атом водорода находится между каждой парой кислорода.
- Такое расположение вызывает упаковку атомов с большими открытыми пространствами, что приводит к уменьшению плотности льда по сравнению с жидкой водой.
- Когда лед тает, некоторые водородные связи разрываются, и молекулы воды становятся более плотными.
90–113 Таким образом, каждый атом водорода ковалентно связан с одним атомом кислорода и связан с другим атомом кислорода водородной связью.
Водородная связь в воде
- Благодаря полярности молекул воды они способны притягиваться друг к другу. Эти взаимодействия представляют собой слабое притяжение, называемое водородными связями.
- Водородная связь в воде представляет собой слабое взаимодействие между частично положительным атомом водорода и частично отрицательным атомом кислорода.
- Водородная связь в воде межмолекулярная и возникает между двумя атомами двух разных молекул.
- Одна молекула воды способна образовывать четыре водородные связи, поскольку она может образовывать две связи с неподеленной парой кислорода и отдавать два электрона водороду.
- В воде образование четырех водородных связей приводит к межмолекулярной тетраэдрической структуре, образующей открытую структуру и трехмерную сеть связей.

- Структура, сформированная после образования водородных связей, приводит к тому, что коллективное основное состояние жидкой воды имеет энергию ниже, чем основное состояние в одиночных газообразных молекулах.
- Это создает стабильную структуру молекул воды в жидкой воде.
- Водородная связь, образующаяся в воде, является слабой связью, и ее прочность составляет одну двадцатую от прочности ковалентной связи ОН.
- Время жизни этих связей также очень короткое, и они постоянно разрываются и формируются в короткие промежутки времени. Таким образом, в жидкой воде поддерживается динамическое равновесие.
- Точно так же все молекулы воды в жидкой воде имеют по крайней мере одну водородную связь с соседней молекулой воды, при этом свободных молекул воды фактически нет.
- Водородные связи в воде удерживают молекулы воды примерно на 15% ближе, чем если бы существовали только взаимодействия Ван-дер-Ваальса.
- Однако водородные связи в воде носят направленный характер, что ограничивает число соседних молекул воды примерно четырьмя по сравнению с большим числом в других жидкостях.

Характеристики/ свойства воды
Физические свойства воды
- Чистая вода – прозрачная бесцветная жидкость без запаха, легко впитывающая запах любого растворенного в ней вещества.
- Температура замерзания, температура кипения, энтальпия плавления и энтальпия испарения воды выше по сравнению с гидридами других представителей той же группы за счет межмолекулярных водородных связей между молекулами.
- Вода обладает высоким дипольным моментом, что делает ее идеальной средой для растворения самых разных соединений.
- Высокая удельная теплоемкость воды позволяет ей поглощать тепло различных биохимических и физиологических реакций, протекающих в организме, при минимальном повышении температуры.
- Вода плохо проводит тепло и электричество, но добавление небольшого количества кислоты или щелочи делает ее электропроводной.
Растворяющее действие воды
- Воду также называют универсальным растворителем из-за ее способности растворять самые разные вещества.

- Эта способность обусловлена интенсивными водородными связями и полярностью молекул воды.
- Полярность воды приводит к тому, что вода по-разному ведет себя с полярными и неполярными соединениями.
- Полярные молекулы воды могут образовывать слабые электростатические взаимодействия с другими полярными молекулами и ионами.
- Таким образом, полярные молекулы и ионы взаимодействуют с частично положительными и частично отрицательными концами воды, при этом положительные заряды притягивают отрицательные заряды.
- Когда количество молекул воды в растворе больше, чем молекул растворенного вещества, взаимодействия приводят к образованию трехмерной сферы воды, называемой гидратной оболочкой вокруг молекул растворенного вещества.
- Образование гидратной оболочки обеспечивает равномерную дисперсию молекул растворенного вещества по всему раствору.
- Однако неполярные молекулы не взаимодействуют с водой и не образуют гидратных оболочек из-за отсутствия заряженных взаимодействий.

Высокая удельная теплоемкость
- Благодаря интенсивным водородным связям вода обладает очень высокой удельной теплоемкостью и высокой теплотой парообразования.
- Эти свойства позволяют воде смягчать климат и температуру Земли, амортизируя большие колебания температуры.
- Аналогичный процесс происходит и в организме, где вода предотвращает быстрое повышение температуры тела в результате различных биохимических реакций.
- Скрытая теплота плавления и парообразования воды также велика, что препятствует таянию ледяных ледников и дрейфующих льдов.
Аномальное расширение воды
- Аномальное расширение воды — это аномальное свойство воды, при котором вода расширяется, а не сжимается при изменении температуры от 4°C до 0°C.
- Таким образом, плотность воды максимальна при 4°C и уменьшается при понижении температуры.
- Это свойство воды возникает из-за того, что молекулы воды в замерзшем состоянии удерживаются вместе за счет притяжения Н-О, а не О-О.

- Но поскольку взаимодействие Н-О не такое тесное, как взаимодействие О-О, при замерзании наблюдается небольшое расширение воды.
Биологические функции воды
Некоторые биологические функции воды перечислены ниже:
- Вода является жизненно важной жидкостью организма, которая необходима для регулирования таких процессов, как пищеварение, транспорт питательных веществ и экскреция. Вода растворяет ионные и полярные органические соединения и обеспечивает транспортировку продуктов пищеварения к месту потребности в организме.
- Вода регулирует температуру тела посредством процесса потоотделения и испарения.
- Вода является средой для всех метаболических реакций в организме, так как все метаболические реакции в организме протекают в фазе раствора.
- Вода также обеспечивает среду обитания для различных животных в виде прудов, рек, морей и т. д.
- Вода необходима для прорастания семян и процесса фотосинтеза, с помощью которого растения готовят себе пищу.

- Вода является средой для переноса минералов из почвы в различные части растений.
- Вода помогает в поддержании структуры растения, обеспечивая соответствующее давление на ткани растения.
- Вода также способствует образованию различных биологических мембран за счет взаимодействия с различными органическими соединениями.
- Вода также влияет на основные компоненты всех клеток, такие как ДНК и белки, где водородные связи регулируют свертывание белков и нуклеиновых кислот.
- Структура двойной спирали ДНК также поддерживается молекулами воды, которые упорядоченно окружают ДНК.
Ссылки и источники
- СК (2006 г.). Концептуальная химия. С. Чанд и Компания Лтд. Нью-Дели.
- 2% – https://sebiology.weebly.com/blog/water
- 1% – https://www.youtube.com/watch?v=I6LbFf__Z0Y
- 1% – https://www.usgs.gov/special-topic/water-science-school/science/heat-capacity-and-water
- 1% – https://www.
 thoughtco.com/definition-of-hydrogen-bond-605872
thoughtco.com/definition-of-hydrogen-bond-605872 - 1% — https://www.slideshare.net/sureshss141/hydrogen-exercise-with-solutions
- 1% – https://www.reference.com/science/anomalous-expansion-water-7479а73146ба31д2
- 1% – https://www.entrancei.com/question-answer/all-metabolic-reactions-in-the-body-take-place-in-the-presence-of-27075
- 1% – https://quizlet.com/21532508/chap-3-water-and-life-flash-cards/
- 1% – https://pdfs.semanticscholar.org/9c1e/9c72b373726a426e4e3043f3f0a73a02cc16.pdf
- 1% – https://en.wikipedia.org/wiki/Вода_(свойства)
- 1% – http://www.esalq.usp.br/lepse/imgs/conteudo_thumb/Hydrogen-Bonding-in-Water.pdf
- <1% — https://yeahchemistry.com/questions/polar-vs-nonpolar-and-oil-vs-water
- <1% — https://www.usgs.gov/special-topic/water-science-school/science/ice-snow-and-glaciers-and-water-cycle
- <1% — https://www.thoughtco.com/water-chemistry-facts-and-properties-609401
- <1% — https://www.
 sciencedirect.com/topics/engineering/hydration-number
sciencedirect.com/topics/engineering/hydration-number - <1% – https://www.khanacademy.org/science/ap-biology/chemistry-of-life/structure-of-water-and-hydrogen-bonding/a/hydrogen-bonding-in-water
- <1% – https://www.gkseries.com/general-science-questions-answers-on-physics/discussion-1
- <1% – https://www.dummies.com/education/science/chemistry/the-unusual-properties-of-water-molecules/
- <1% — https://www.chegg.com/homework-help/questions-and-answers/1-angle-tetrahedral-bonds-diamond-angles-body-diagonals-cube-figure-10-use-vector -анализ-q18360262
- <1% — https://www.britannica.com/science/vertical-mixing
- <1% – https://www.britannica.com/science/photogenesis
- <1% – https://www.britannica.com/science/ice
- <1% — https://www.bartleby.com/essay/What-The-Boiling-Points-And-Enthalpy-Of-PKAUQJTW5G3D5
- <1% – https://ohtheme.com/water/
- <1% – https://en.wikipedia.org/wiki/Plant_nutrition
- <1% — https://en.


 Электроны и протоны высвобождаются при гидролизе солей.
Электроны и протоны высвобождаются при гидролизе солей. К., Пеон Дж., Багчи Б. и Зевайл А.Х. Биологическая вода: фемтосекундная динамика макромолекулярной гидратации Journal of Physical Chemistry B 106, 12376-12395 (2002)
К., Пеон Дж., Багчи Б. и Зевайл А.Х. Биологическая вода: фемтосекундная динамика макромолекулярной гидратации Journal of Physical Chemistry B 106, 12376-12395 (2002) Proceedings of the National Academy of Sciences of the United States of America 101, 3325-3326 (2004)
Proceedings of the National Academy of Sciences of the United States of America 101, 3325-3326 (2004)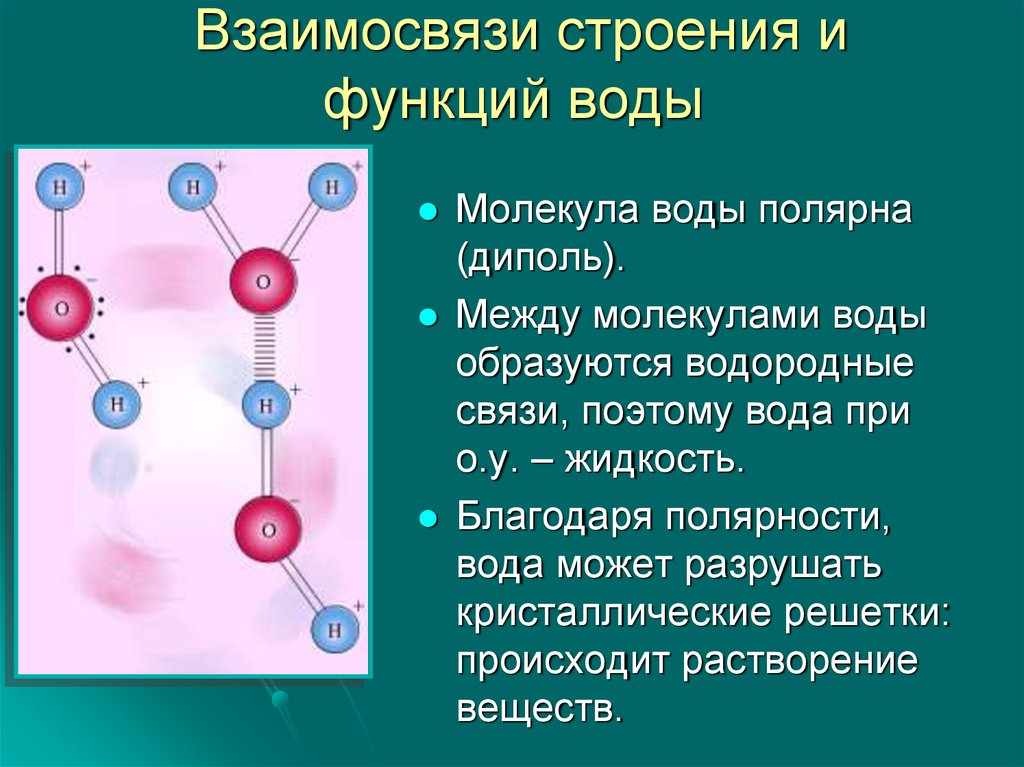 и Дженнингс, П. А. Мутации ядра и поверхности влияют на кинетику сворачивания, стабильность и кооперативность в IL-1b: играют ли роль изменения в погребенной воде? Журнал молекулярной биологии 307, 657-669 (2001)
и Дженнингс, П. А. Мутации ядра и поверхности влияют на кинетику сворачивания, стабильность и кооперативность в IL-1b: играют ли роль изменения в погребенной воде? Журнал молекулярной биологии 307, 657-669 (2001) Дж. и Беверидж, Д. Л. Структура ДНК: кто главный? Журнал молекулярной биологии 304, 803-20 (2000)
Дж. и Беверидж, Д. Л. Структура ДНК: кто главный? Журнал молекулярной биологии 304, 803-20 (2000) R.H., Sleigh, S.H., Wilkinson, A.J. and Ladbury, J.E. The role of water in sequence-independent связывание лиганда белком-переносчиком олигопептида Nature Structural Biology 3, 998-1001 (1996)
R.H., Sleigh, S.H., Wilkinson, A.J. and Ladbury, J.E. The role of water in sequence-independent связывание лиганда белком-переносчиком олигопептида Nature Structural Biology 3, 998-1001 (1996) Однако он не имеет ни калорийности, ни пищевой ценности.
Однако он не имеет ни калорийности, ни пищевой ценности.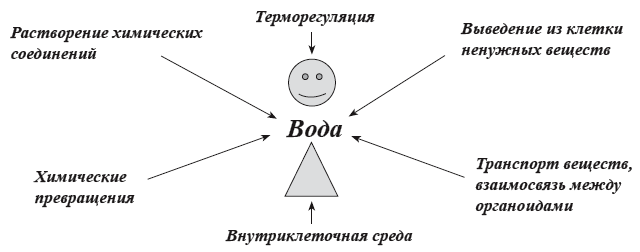





 thoughtco.com/definition-of-hydrogen-bond-605872
thoughtco.com/definition-of-hydrogen-bond-605872 sciencedirect.com/topics/engineering/hydration-number
sciencedirect.com/topics/engineering/hydration-number