Содержание
Химия Молекула воды Структура Льюиса Теория ВСЭПР, вода, угол, текст, логотип png
Химия Молекула воды Структура Льюиса Теория ВСЭПР, вода, угол, текст, логотип png
теги
- угол,
- текст,
- логотип,
- Wikimedia Commons,
- химия,
- номер,
- марка,
- молекула,
- природа,
- скелетная формула,
- svg,
- символ,
- площадь,
- vsepr Теория,
- вода,
- молекулярная геометрия,
- атом,
- линия,
- химическая Связь,
- химическая формула,
- химическаяПолярность,
- круг,
- ковалентная связь,
- диаграмма,
- h 2,
- h 2 O,
- атом водорода,
- черный и белый,
- структура Льюиса,
- png,
- прозрачный,
- бесплатная загрузка
Об этом PNG
Размер изображения
- 773x576px
Размер файла
- 22.
 53KB
53KB MIME тип
- Image/png
Скачать PNG ( 22.53KB )
изменить размер PNG
ширина(px)
высота(px)
Лицензия
Некоммерческое использование, DMCA Contact Us
Химическая формула Молекула Вода Химия Химическое соединение, вода, угол, текст, логотип png
1280x549px
12.36KBСтруктура Льюиса Метан Простая связь Химическая связь Валентный электрон, молекулярная цепь, разное, угол, текст png
1041x1079px
10.8KBчерно-белая иллюстрация, Молекула Химия Молекулярная геометрия Химическая структура, молекула, синий, текст, цвет png
2482x1761px
300. 48KB
48KBКофеин Кофеин Молекулы Химическая структура Молекулярная геометрия, Кофе, угол, белый, текст png
1200x987px
40.58KBСтруктура Льюиса Аммиак Молекула Химия Аммоний, точечная формула, угол, текст, логотип png
640x462px
4.05KBХимическое соединение Химический синтез Химия Органическое соединение Молекула, химическая формула, угол, белый, текст png
1917x1466px
134.17KBКислород Озон Молекула Перекись водорода Атом, др., другие, атом, o 2 png
600x600px
120.29KBСеротонин молекула химия химическая структура мелатонин, другие, угол, белый, текст png
800x587px
16. 54KB
54KBАтом водорода Молекула воды Молекулярно-орбитальная диаграмма, вода, угол, электрон, химия png
2400x2008px
795.04KBХлорид натрия Химия Молекула Химическая структура Химическое вещество, вода, угол, белый, текст png
614x1023px
20.99KBВодородный текст, Водород Химический элемент Символ Периодическая таблица Химический состав, элемент, разное, угол, белый png
1024x1024px
27.52KBСтруктура Льюиса Ковалентная связь Диаграмма Молекула Химическая связь, другие, разное, угол, белый png
1100x933px
60.42KBХимия, молекула, атом, углерод, химическое соединение, молекулярная модель, химический элемент, органическая химия, площадь, атом, углерод png
640x610px
155. 65KB
65KBЭтанол Скелетная формула Структурная формула Структура спирта, другие, разное, угол, текст png
1200x461px
14.77KBМолекула Молекулярная геометрия Химия Шестиугольник, здравый смысл, химический элемент, угол, текст png
615x679px
75.31KBХимическая формула Молекулярная формула Молекула Химия Вода, раковина, химический элемент, мебель, текст png
1280x867px
22.72KBСтруктура ацетилена Льюиса Химическая связь Тройная связь, наука, угол, текст, логотип png
1600x282px
12.97KBхимическая тематика иллюстрации, химическая лаборатория рисования науки, каракули, угол, текст, фреска png
1640x1064px
2. 32MB
32MBНоскапин Молекула Химическое соединение Химическая формула Химия, Структура, угол, белый, текст png
1060x958px
23.77KBСтруктурная формула Пропан Химическая формула Скелетная формула Химическое соединение, другие, угол, белый, текст png
800x470px
8.42KBУглекислый газ Молекула Угарный газ Атом, Молекулы с, химия, углерод, линия png
800x553px
168.72KBМолекула Модель с шариком и стержнем Химия Химическое соединение Химическое строение, молекула, Разное, другие, Wikimedia Commons png
2000x1715px
666.8KBСтруктура Льюиса Молекулярная геометрия Метан Молекула Химическая формула, другие, разное, угол, текст png
800x916px
5. 7KB
7KBОрбитальная гибридизация этилена, структура Льюиса, атомный орбиталь, ацетилен, др., угол, другие, химическая png
1024x1024px
79.35KBРисунок молекулы, ДНК, текст, фотография, сердце png
785x765px
171.36KBХимия Химическая формула Хлорид натрия Структурная формула Химическая структура, Металлическая молекулярная модель, знаменитости, металл Фон, структура png
500x500px
210.89KBВодородная связь Вода Частичный заряд Химическая связь, водород, еда, химия, шарик png
853x1024px
126.12KBЭтанол Химическая формула Алкоголь Химия Химическое вещество, другие, угол, белый, текст png
1280x837px
18. 88KB
88KBМолекула воды Молекулярная модель Водородная связь Химическая связь, вода, текст, биология, химия png
1600x1491px
121.47KBсправочный материал химическая структура, черно-синие соты, текстура, материал, угол png
1213x931px
187.12KBАтомы в молекулах Атомы в молекулах Химия, химия Газы с, фиолетовый, текст, лаборатория png
739x800px
30.68KBМолекула воды Химическая формула Химическая связь Химия, вода, Химический элемент, сфера, химия png
590x590px
92.42KBгазообразный водород атом атом водорода, другие, синий, текст, другие png
600x600px
42. 41KB
41KBОзон Химическая связь Заказ облигаций Молекула Льюиса структура, другие, угол, белый, текст png
1100x295px
16.57KBЦианид водорода Ацетонитрил Цианид отравляет структуру Льюиса, др., угол, текст, товарный знак png
1000x368px
10.02KBЭтаноловое топливо Алкоголь Структурная формула Структура, стоимость, организационная структура, угол, белый, текст png
1280x783px
14.72KBМолекула Химическое соединение Химическая формула Аминокислота Леводопа, дофамин, угол, белый, текст png
1280x546px
25.57KBХимическая формула Молекула Химическая структура Химия Химические вещества, другие, угол, текст, прямоугольник png
709x616px
8. 01KB
01KBКофеин Кофеин Молекула Химия Химическое вещество, Кофе, угол, белый, текст png
748x615px
25.92KBшестигранная форма, циклогексановая конформация структурная формула химическое вещество молекула, шестиугольник, разное, угол, белый png
1200x1380px
28.68KBУглекислый газ Структурная формула Молекула Угарный газ, химические формулы, угол, текст, углерод png
1700x500px
6.01KBЭтанол Структурная формула Алкоголь Скелетная формула Химическое соединение, абсолют, разное, угол, белый png
1200x742px
10.61KBХимическая формула Молекулярная формула Структурная формула Молекула Химическое вещество, Формула Один флаг, угол, белый, текст png
1024x508px
22. 3KB
3KBСтруктура Льюиса Атом водорода Электрон, водород, разное, угол, текст png
2000x2000px
21.78KBСтруктура Льюиса Кислород Валентный электрон Диаграмма, точки, Разное, текст, электрон png
1024x1024px
33.4KBШариковая модель Water Molecule Lone pair Молекулярная модель, вода, угол, сфера, 3 D png
1024x672px
119.3KBСтруктура Льюиса Атом Углерод Валентный электрон, символ, Разное, текст, электрон png
1000x1000px
15.7KBТетраэдрическая молекулярная геометрия Теория ВСЭПР Молекула Химическая связь, химия, разное, угол, другие png
1047x1100px
143. 79KB
79KBПериодическая таблица Атомный номер Химия Химический элемент, периодический, химический элемент, угол, мебель png
3840x2160px
177.66KBТаурин Молекула Химическое вещество Химическая формула Химия, Мочевой Кальций, угол, текст, треугольник png
1200x640px
22.31KB
Пропилен, структурная формула, химические, физические свойства
1
H
ВодородВодород
1,008
1s1
2,2
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
ГелийГелий
4,0026
1s2
Бесцветный газ
t°кип=-269°C
3
Li
ЛитийЛитий
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
БериллийБериллий
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
БорБор
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
УглеродУглерод
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
t°кип=4830°C
7
N
АзотАзот
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
КислородКислород
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
ФторФтор
18,998
2s2 2p5
4,0
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
НеонНеон
20,180
2s2 2p6
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
НатрийНатрий
22,990
3s1
0,93
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
МагнийМагний
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
АлюминийАлюминий
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
КремнийКремний
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
ФосфорФосфор
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
СераСера
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
ХлорХлор
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
АргонАргон
39,948
3s2 3p6
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
19
K
КалийКалий
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
КальцийКальций
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
СкандийСкандий
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
ТитанТитан
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип=3260°C
23
V
ВанадийВанадий
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
ХромХром
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
МарганецМарганец
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
ЖелезоЖелезо
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
КобальтКобальт
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
НикельНикель
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
МедьМедь
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
ЦинкЦинк
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
t°кип=907°C
31
Ga
ГаллийГаллий
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
ГерманийГерманий
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
МышьякМышьяк
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
СеленСелен
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°пл=217°C
t°кип=685°C
35
Br
БромБром
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
КриптонКриптон
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
РубидийРубидий
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
СтронцийСтронций
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
ИттрийИттрий
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
ЦирконийЦирконий
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
НиобийНиобий
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
МолибденМолибден
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
ТехнецийТехнеций
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
РутенийРутений
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
РодийРодий
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
ПалладийПалладий
106,42
4d10
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
СереброСеребро
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
КадмийКадмий
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
ИндийИндий
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
ОловоОлово
118,71
5s2 5p2
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
СурьмаСурьма
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
ТеллурТеллур
127,60
5s2 5p4
2,1
Серебристый блестящий полуметалл
t°пл=450°C
t°кип=990°C
53
I
ИодИод
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
КсенонКсенон
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
ЦезийЦезий
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
БарийБарий
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
ЛантанЛантан
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
ЦерийЦерий
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
ПразеодимПразеодим
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
НеодимНеодим
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
ПрометийПрометий
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
СамарийСамарий
150,36
f-элемент
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
ЕвропийЕвропий
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
ГадолинийГадолиний
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
ТербийТербий
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
ДиспрозийДиспрозий
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
ГольмийГольмий
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
ЭрбийЭрбий
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
ТулийТулий
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
ИттербийИттербий
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
ЛютецийЛютеций
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
ГафнийГафний
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
ТанталТантал
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
ВольфрамВольфрам
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
РенийРений
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
ОсмийОсмий
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
ИридийИридий
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
ПлатинаПлатина
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
ЗолотоЗолото
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
РтутьРтуть
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
ТаллийТаллий
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
СвинецСвинец
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
ВисмутВисмут
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
ПолонийПолоний
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
АстатАстат
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
РадонРадон
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
ФранцийФранций
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
РадийРадий
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
АктинийАктиний
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
ТорийТорий
232,04
f-элемент
Серый мягкий металл
91
Pa
ПротактинийПротактиний
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
УранУран
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
НептунийНептуний
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
ПлутонийПлутоний
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
АмерицийАмериций
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
КюрийКюрий
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
БерклийБерклий
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
КалифорнийКалифорний
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
ЭйнштейнийЭйнштейний
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
ФермийФермий
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
МенделевийМенделевий
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
НобелийНобелий
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
ЛоуренсийЛоуренсий
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
РезерфордийРезерфордий
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
ДубнийДубний
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
СиборгийСиборгий
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
БорийБорий
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
ХассийХассий
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
МейтнерийМейтнерий
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
ДармштадтийДармштадтий
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
Объяснитель урока: Свойства воды
В этом объяснителе мы научимся объяснять свойства полярной молекулы воды.
Вода имеет решающее значение для выживания всех организмов на нашей планете. Без надлежащего и устойчивого водоснабжения сельское хозяйство и промышленность не могли бы функционировать. Мы каждый день используем воду для приготовления пищи, уборки и питья.
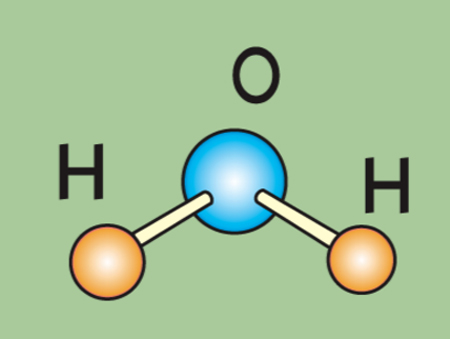
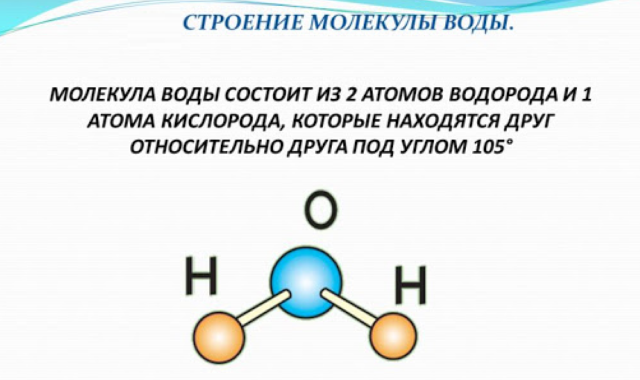
Одна молекула воды состоит из одного атома кислорода и двух атомов водорода.
Между каждым атомом водорода и центральным атомом кислорода существует ковалентная связь. Итак, молекула имеет две химические связи, и угол между этими химическими связями равен 104,5∘. Молекулярная формула воды HO2.
Каждый элемент периодической таблицы имеет свойство, известное как электроотрицательность.
Определение: Электроотрицательность
Электроотрицательность измеряет, насколько сильно атом притягивает электронную пару (или электронные пары) от химической связи.
Рассмотрим молекулу воды. Кислород более электроотрицателен, чем водород. Так, электроны ковалентных связей находятся ближе к атому кислорода и дальше от атомов водорода.
Мы можем видеть этот эффект на рис. 2. Оранжевые стрелки показывают, как электроны, образующие каждую ковалентную связь, притягиваются ближе к атому кислорода из-за его
более высокая электроотрицательность.
Электроотрицательность кислорода больше, чем у водорода, вызывает отрицательное
заряженные электроны располагаются ближе к атому кислорода. Чем ближе электроны, тем
на атоме кислорода образуется частичный отрицательный заряд. Частичная оплата
(𝛿+,𝛿−) в химии подобны полным зарядам ионов. Однако частичный заряд намного слабее полного заряда.
Ученые называют молекулы полярными, если они имеют постоянные частичные заряды. Есть некоторые исключения из этого, но нам не нужно исследовать это в этом объяснителе; мы можем сказать, что вода является полярной молекулой.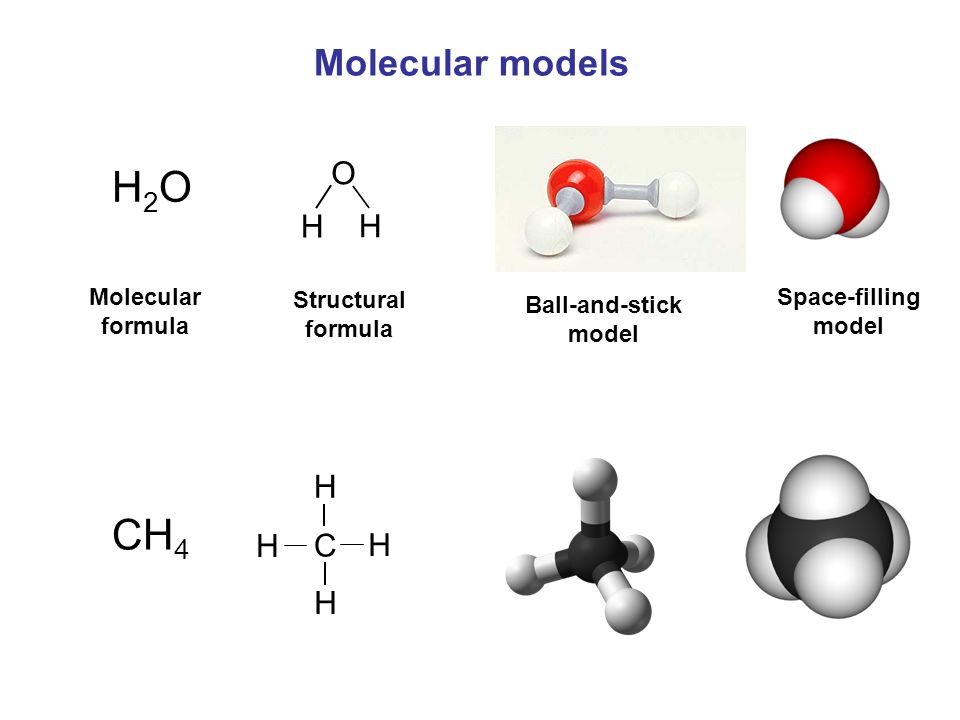
Определение: Полярная молекула
Полярная молекула представляет собой ковалентную молекулу, в которой разница в электроотрицательности между элементами в молекуле относительно велика. В полярной молекуле один конец молекулы слегка положительный, а другой конец слегка отрицательный.
Пример 1. Использование электроотрицательности для объяснения того, почему вода является полярной молекулой
Одна молекула воды состоит из двух атомов водорода и одного атома кислорода. Какое из следующих утверждений объясняет, почему вода
полярная молекула?
- Атомы водорода намного меньше атомов кислорода.
- Существует большая разница в электроотрицательности между атомами водорода и атомами кислорода.
- Между молекулами воды существуют межмолекулярные силы, известные как водородные связи.
- Электроотрицательность атомов водорода и атомов кислорода очень похожи.
- В каждой молекуле воды больше атомов водорода, чем атомов кислорода.

Ответ
Полярная молекула – это ковалентная молекула со значительной разницей в электроотрицательности между ее элементами. Эта разница в электроотрицательности означает, что молекула имеет постоянные частичные заряды.
Кислород имеет гораздо более высокую электроотрицательность, чем водород. Пары связывающих электронов от двух ковалентных связей притягиваются ближе к атому кислорода.
Если мы посмотрим на ответы, мы увидим, что B — правильный ответ; существует большая разница в электроотрицательности между атомами водорода и атомами кислорода.
Пример 2. Определение частичных зарядов молекулы воды
Кислород более электроотрицателен, чем водород, и притягивает связь
электроны в молекуле воды ближе к себе. 𝛿+
и 𝛿- используются для обозначения частичных зарядов в химии. На какой схеме правильно показаны парциальные заряды молекулы воды?
Ответ
Сила, с которой атом притягивает пару электронов, используемых для образования химической связи, измеряется электроотрицательностью. Поскольку кислород имеет более высокое значение электроотрицательности, чем водород, электроны, образующие ковалентные связи, притягиваются ближе к атому кислорода и удаляются от двух атомов водорода.
Поскольку кислород имеет более высокое значение электроотрицательности, чем водород, электроны, образующие ковалентные связи, притягиваются ближе к атому кислорода и удаляются от двух атомов водорода.
Следовательно, атом кислорода имеет частичный отрицательный заряд
(𝛿-), и в результате два атома водорода имеют частичный положительный заряд (𝛿+).
Мы можем использовать эту информацию, чтобы определить, что правильный ответ — A.
Другой распространенной полярной молекулой является аммиак (Nh4). Аммиак представляет собой простую молекулу, состоящую из одного атома азота и трех
атомы водорода. Как и кислород в молекуле воды, азот гораздо более электроотрицательный.
чем водород, что приводит к частичным зарядам внутри молекулы.
Возвращаясь к нашей теме воды, постоянные частичные заряды в каждой молекуле воды вызывают слабое электростатическое притяжение между частичными зарядами соседних молекул воды. Эти притяжения также можно назвать межмолекулярными силами.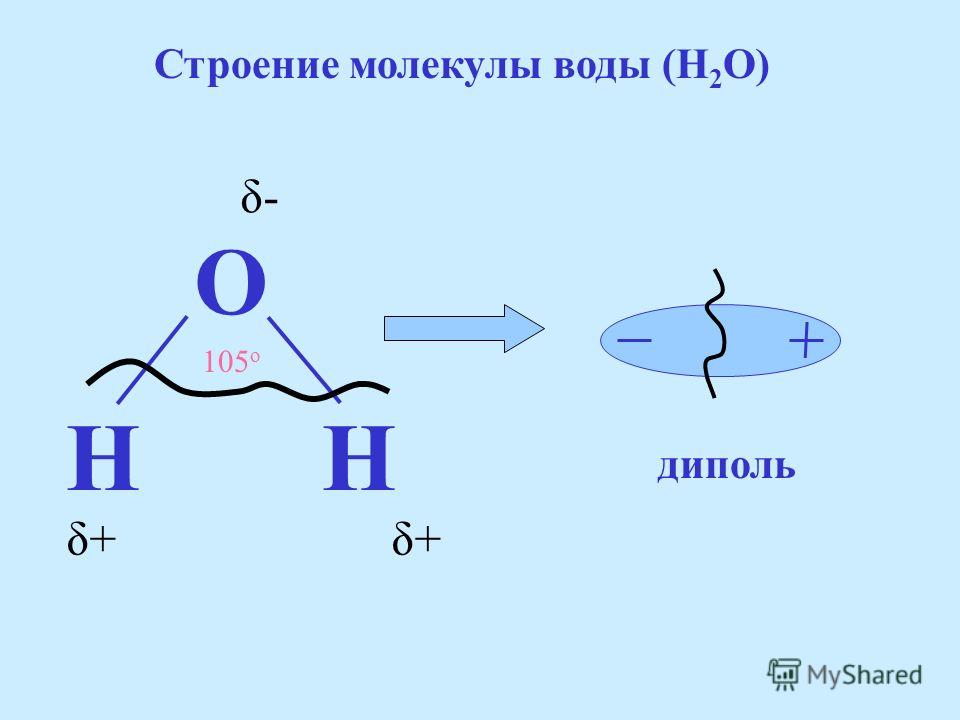
Мы называем это слабым электростатическим притяжением между молекулами воды водородными связями. Хотя мы используем слово связь , это не настоящая химическая связь, и лучше всего рассматривать ее как взаимодействие между молекулами.
Водородные связи слабее ковалентных, но чрезвычайно важны при объяснении и описании физических свойств воды.
Если бы вы попытались представить себе миллиарды и миллиарды молекул воды, которые существуют в стакане воды, вы могли бы начать видеть, как
водородные связи образуются и разрываются непрерывно, когда молекулы вращаются и перемещаются, сталкиваясь друг с другом и с контейнером. Этот
Идея показана на рис. 5, где водородные связи показаны синими пунктирными линиями.
Химическая связь и силы межмолекулярного притяжения, о которых мы только что говорили, придают воде некоторые очень уникальные свойства. Например, на рис. 6 показаны примеры воды во всех трех состояниях: в виде жидкости в океане, в виде твердого льда в айсберге и, хотя мы этого не видим, в виде водяного пара в воздухе и облаках.
Рисунок 6 : Различные состояния воды.
Вода — полярная молекула; как таковые, другие полярные соединения могут растворяться в воде, образуя растворы. По этой причине мы можем описать воду как полярный растворитель.
Такие вещества, как сахар, являются полярными веществами и растворяются в воде. Кроме того, ионные вещества, такие как соль, содержащие заряженные ионы, растворяются в полярных веществах. Нам нужно только подумать о соли в океанах или в чашке чая, чтобы понять, что мы имели непосредственный опыт этих примеров.
Неполярное вещество – это вещество, не содержащее частичных зарядов, поскольку разница в электроотрицательности между элементами атомов в молекулах очень мала.
Определение: неполярная молекула
Неполярная молекула представляет собой ковалентную молекулу, в которой разница в электроотрицательности между элементами в молекуле очень мала.
Однако неполярные растворители, такие как растительное масло, не растворяются в воде, и при добавлении в воду
они разделяются на два слоя.
Рисунок 7 : Смесь масла и воды.
Вода является превосходным полярным растворителем для большинства ионных веществ, таких как соль, и некоторых ковалентных соединений, таких как сахар, которые образуют водородные связи с молекулами воды.
Пример 3. Названия растворителей, растворяющих ионные вещества
Как называется такой растворитель, как вода, способный растворять ионные вещества, такие как соль?
- Полярный растворитель.
- Неполярный растворитель.
- Электростатический растворитель. Ионы имеют положительный и отрицательный заряд. Когда заряд распределяется таким образом в химии, это называется полярностью.
Некоторые другие вещества без ионного заряда все же имеют частичный заряд и также называются полярными. Например, вода представляет собой полярную молекулу.
Мы можем использовать стакан с водой, чтобы растворить столовую ложку хлорида натрия. Вещество, способное растворять полярные вещества, такие как ионные соли, известно как полярный растворитель, поэтому правильный ответ — А, полярный растворитель.

Водородные связи между молекулами воды также существенно влияют на температуры кипения и плавления воды.
вода. Давайте на минутку сравним воду с другим соединением: сероводородом (HS2). Водород
сульфид очень похож на воду; он имеет атом серы вместо атома кислорода.Сера находится в 16-й группе периодической таблицы, как и кислород, поэтому можно предположить, что точки плавления и кипения очень похожи. Однако, как показано в таблице 1, температуры плавления и кипения воды и сероводорода сильно различаются!
Таблица 1 : Температура плавления и кипения воды и сероводорода.
Соединение Температура плавления (∘C) Температура кипения (∘C) HO2 0 100 HS2 −82 −60 Из приведенной выше таблицы видно, что для разделения молекул воды при плавлении и кипении требуется больше энергии. Эта дополнительная энергия необходима для преодоления водородных связей, существующих между отдельными молекулами воды.
 Молекулы сероводорода не могут образовывать водородные связи, так как разница в электроотрицательности между серой и водородом недостаточно велика.
Молекулы сероводорода не могут образовывать водородные связи, так как разница в электроотрицательности между серой и водородом недостаточно велика.Еще одной замечательной характеристикой воды является ее плотность в твердом состоянии, известном как лед. Большинство веществ плотнее, когда они находятся в твердом состоянии; однако вода менее плотная. Когда жидкая вода остывает до температуры ниже 4∘C,
молекулы воды образуют большие шестиугольные кристаллы из-за более длинных водородных связей между отдельными молекулами. Когда жидкость замерзает при 0∘C, эти
крупные гексагональные кристаллы полностью сформированы, а более длинные водородные связи создают относительно
большое пространство между молекулами.Мы знаем, что плотность — это способ выразить количество массы в данном объеме,
а когда вода принимает форму твердого льда, лед имеет меньшую массу, чем тот же объем жидкой воды;
следовательно, вода становится менее плотной по мере замерзания и превращается в лед. Мы можем видеть более длинные водородные связи
Мы можем видеть более длинные водородные связи
и шестиугольное расположение молекул воды во льду на рисунке ниже.Пример 4: сопоставление состояния вещества воды с ее структурным устройством
На рисунке показаны молекулы воды в однородном фиксированном гексагональном расположении, созданном водородными связями.
В каком состоянии вещества вы ожидаете найти воду, если она находится в таком структурном расположении?
- Лед (твердый)
- Вода (жидкий)
- Пар (газ)
Ответ
Молекулы воды образуют большие шестиугольные кристаллы, когда жидкая вода замерзает при 0∘C. Эти шестиугольные кристаллы образуются из-за существования водородных связей между отдельными молекулами.
В жидком состоянии отдельные молекулы воды могут свободно двигаться и вращаться с помощью водородных связей, постоянно образуя и разрывая связи между различными молекулами.
В газообразном состоянии молекулы водяного пара можно рассматривать как независимые единицы с небольшим взаимодействием.

Если мы сравним эти три описания с диаграммой выше, мы увидим, что правильный ответ — A, лед (твердый).
Это уменьшение плотности при замерзании воды объясняет расширение льда при замерзании воды. При замерзании воды масса воды конечно не меняется, но объем увеличивается,
и, следовательно, плотность должна уменьшиться. Расширение льда при замерзании воды является причиной
для явлений физического выветривания, таких как замораживание-оттаивание, показанное на рисунке 9.. Это может также
будьте свидетелями дома, когда бутылки с напитками взрываются в морозильной камере!Рисунок 10 : Вода заполняет трещины в скале и замерзает, а расширение льда разрушает скалу. Рисунок 11 : Напитки замерзают и расширяются в морозильной камере, разрывая контейнеры.
Пример 5: Объяснение того, почему лед плавает на воде
Какая из следующих последовательностей утверждений правильно описывает, почему лед плавает на воде?
- 1
- 5
- 2
- 4
- 3
Ответ
Итак, мы можем начать отвечать на этот вопрос, заявив, что когда вода замерзает, она становится льдом, поэтому мы знаем, что ответ C неверен.

Благодаря водородным связям, существующим между молекулами воды, вода обладает некоторыми уникальными физическими свойствами. Когда вода замерзает и превращается в лед, образуются более длинные водородные связи, поскольку молекулы воды образуют шестиугольные кристаллы. Эти шестиугольные кристаллы имеют относительно большое пространство между собой из-за более длинных водородных связей и заставляют воду расширяться.
Теперь мы видим, что ответ E также неверен.
При замерзании воды количество воды и, следовательно, ее масса не изменяются, но поскольку вода при замерзании расширяется и становится льдом, ее объем увеличивается. Имея эту информацию, мы теперь можем исключить ответ D.
Если какое-либо вещество трансформируется, чтобы иметь больший объем, но ту же массу, то плотность уменьшится. В случае воды это делает лед менее плотным, поэтому правильный ответ — A.
Морская вода содержит соль, и эта соль влияет на ее плотность. В районах океана, где концентрация соли ниже, например, на Северном и Южном полюсах, плавать труднее, поскольку труднее создать силу против менее плотной жидкости.
 Напротив, есть некоторые места, такие как Мертвое море в Западной Азии, где концентрация соли настолько высока, что люди могут плавать практически без усилий!
Напротив, есть некоторые места, такие как Мертвое море в Западной Азии, где концентрация соли настолько высока, что люди могут плавать практически без усилий!Рисунок 12 : Мужчина плавает в (сильно) соленой морской воде Мертвого моря.
Мы начнем завершать это объяснение с рассмотрения некоторых химических свойств воды. Вода является нейтральным
соединение и не проявляет никаких кислотных или основных свойств. Мы можем проверить это с помощью лакмусовой бумажки. Красный
или синий лакмус не меняет цвет, если он находится в воде.Мы можем разложить воду на водород и кислород, используя процесс, известный как электролиз. Во время электролиза мы используем электричество для разрыва связей в химических соединениях. Когда мы явно проводим электролиз воды, мы используем уникальное научное оборудование, известное как вольтаметр Хофмана.
Вольтаметр Хофмана наполнен водой, которую мы подкислили, добавив небольшое количество разбавленной серной кислоты.
 Добавление кислоты улучшает его проводимость. К вольтаметру присоединяют блок питания, и через подкисленную воду пропускают постоянный ток. Затем вода разделяется в соответствии с
Добавление кислоты улучшает его проводимость. К вольтаметру присоединяют блок питания, и через подкисленную воду пропускают постоянный ток. Затем вода разделяется в соответствии с
следующее химическое уравнение:
2HO()2H()+O()222lggводаводородкислородэлектролизНа рисунке 14 ниже мы видим вольтаметр Гофмана. Обратите внимание, что газообразного водорода было произведено в два раза больше, чем газообразного кислорода.
Давайте внимательно посмотрим на атомы в этой химической реакции. Нам легко понять, почему мы получаем в два раза больше газообразного водорода, чем кислорода.
произведенный газ. На рис. 15 показано, как атомы в двух молекулах воды перестраиваются, образуя две молекулы газообразного водорода и одну молекулу газообразного кислорода.
при электролизе воды.Вода — удивительная молекула со многими необычными характеристиками. Многие из его свойств обусловлены тем, что он является полярной молекулой и существованием водородных связей между молекулами.

Подведем итог тому, что мы узнали о свойствах воды.
Ключевые моменты
- Вода является жизненно важным ресурсом.
- Один атом кислорода и два атома водорода составляют одну молекулу воды.
- Кислород более электроотрицателен, чем водород.
- Полярная молекула представляет собой ковалентную молекулу, в которой разница в электроотрицательности между элементами в молекуле относительно велика.
- На молекуле воды существуют постоянные частичные заряды, что делает молекулу полярной.
- Между молекулами воды существует электростатическое притяжение, известное как водородные связи.
- Вода может существовать в виде жидкости, куска твердого льда и газообразного пара.
- Вода является полярным растворителем, и другие полярные соединения могут растворяться в воде и образовывать растворы.
- Вода имеет высокие температуры плавления и кипения из-за водородных связей между молекулами воды.
- Вода образует шестиугольные кристаллы, когда замерзает и становится льдом.

- Лед менее плотный, чем вода.
- Вода нейтрально действует на синюю и красную лакмусовые бумажки.
- Электролиз может быть использован для разложения воды на кислород и водород.
- Вольтаметр Хофмана используется для электролиза подкисленной воды.
- При электролизе подкисленной воды образуется в два раза больше газообразного водорода, чем газообразного кислорода.
химических реакций и молекул | Биология для специальностей I
Результаты обучения
- Определение компонентов простых химических реакций
Все элементы наиболее стабильны, когда их внешняя оболочка заполнена электронами в соответствии с правилом октета. Это связано с тем, что атомам энергетически выгодно находиться в такой конфигурации, и это делает их стабильными. Однако, поскольку не у всех элементов достаточно электронов, чтобы заполнить их самые внешние оболочки, атомы образуют химических связей с другими атомами, получая таким образом электроны, необходимые им для достижения стабильной электронной конфигурации.
 Когда два или более атома химически связываются друг с другом, результирующая химическая структура представляет собой молекулу. Знакомая молекула воды, H 2 O, состоит из двух атомов водорода и одного атома кислорода; они соединяются вместе, образуя воду, как показано на рисунке 1. Атомы могут образовывать молекулы, отдавая, принимая или делясь электронами для заполнения своих внешних оболочек.
Когда два или более атома химически связываются друг с другом, результирующая химическая структура представляет собой молекулу. Знакомая молекула воды, H 2 O, состоит из двух атомов водорода и одного атома кислорода; они соединяются вместе, образуя воду, как показано на рисунке 1. Атомы могут образовывать молекулы, отдавая, принимая или делясь электронами для заполнения своих внешних оболочек.Рис. 1. Два или более атома могут связываться друг с другом, образуя молекулу. Когда два атома водорода и кислород делят электроны через ковалентные связи, образуется молекула воды.
Химические реакции происходят, когда два или более атома соединяются вместе, образуя молекулы, или когда связанные атомы распадаются. Вещества, используемые в начале химической реакции, называются 9.0279 реагентов (обычно находятся в левой части химического уравнения), а вещества, обнаруживаемые в конце реакции, известны как продукты (обычно находятся в правой части химического уравнения).
 Между реагентами и продуктами обычно рисуется стрелка, указывающая направление химической реакции; это направление не всегда является «улицей с односторонним движением». Для образования молекулы воды, показанной выше, химическое уравнение будет таким:
Между реагентами и продуктами обычно рисуется стрелка, указывающая направление химической реакции; это направление не всегда является «улицей с односторонним движением». Для образования молекулы воды, показанной выше, химическое уравнение будет таким:2H + O → H 2 O
Примером простой химической реакции является расщепление молекул перекиси водорода, каждая из которых состоит из двух атомов водорода, связанных с двумя атомами кислорода (H 2 O 2 ). Реагент перекись водорода распадается на воду, содержащую один атом кислорода, связанный с двумя атомами водорода (H 2 O), и кислород, который состоит из двух связанных атомов кислорода (O 2 ). В приведенном ниже уравнении реакция включает две молекулы перекиси водорода и две молекулы воды. Это пример сбалансированное химическое уравнение , в котором число атомов каждого элемента одинаково в каждой части уравнения. Согласно закону сохранения материи, число атомов до и после химической реакции должно быть одинаковым, так что при нормальных условиях ни один атом не образуется и не разрушается.

2H 2 O 2 (перекись водорода) → 2H 2 O(вода) + O 2 (кислород)
Несмотря на то, что все реагенты и продукты этой реакции являются молекулами (каждый атом остается связаны по крайней мере с одним другим атомом), в этой реакции только перекись водорода и вода являются представителями подкласса молекул, известного как соединения : они содержат атомы более чем одного типа элемента. С другой стороны, молекулярный кислород, как показано на рисунке 2, состоит из двух атомов кислорода, связанных двойной связью, и классифицируется не как соединение, а как элемент.
Рис. 2. Атомы кислорода в молекуле O 2 соединены двойной связью.
Некоторые химические реакции, такие как показанная выше, могут протекать в одном направлении, пока не будут израсходованы все реагенты. Уравнения, описывающие эти реакции, содержат однонаправленную стрелку и равны необратимый . Обратимые реакции — это реакции, которые могут идти в любом направлении.
 В обратимых реакциях реагенты превращаются в продукты, но когда концентрация продукта превышает определенный порог (характерный для данной реакции), часть этих продуктов снова превращается в реагенты; в этот момент обозначения продуктов и реагентов меняются местами. Это движение вперед и назад продолжается до тех пор, пока не установится определенный относительный баланс между реагентами и продуктами — состояние, называемое 9.0279 равновесие . Эти ситуации обратимых реакций часто обозначаются химическим уравнением с двунаправленной стрелкой, указывающей как на реагенты, так и на продукты.
В обратимых реакциях реагенты превращаются в продукты, но когда концентрация продукта превышает определенный порог (характерный для данной реакции), часть этих продуктов снова превращается в реагенты; в этот момент обозначения продуктов и реагентов меняются местами. Это движение вперед и назад продолжается до тех пор, пока не установится определенный относительный баланс между реагентами и продуктами — состояние, называемое 9.0279 равновесие . Эти ситуации обратимых реакций часто обозначаются химическим уравнением с двунаправленной стрелкой, указывающей как на реагенты, так и на продукты.Например, в крови человека избыточные ионы водорода (H + ) связываются с ионами бикарбоната (HCO 3 – ), образуя равновесное состояние с угольной кислотой (H 2 CO 3 ). Если в эту систему добавить угольную кислоту, часть ее превратится в бикарбонат и ионы водорода.
HCO 3 – + H + ↔ H 2 CO 3
Однако в биологических реакциях равновесие достигается редко, поскольку концентрации обоих реагентов или продуктов постоянно меняются, часто или когда продукт одной реакции является реагентом для другой.
 Возвращаясь к примеру с избытком ионов водорода в крови, основным направлением реакции будет образование угольной кислоты. Однако угольная кислота также может покидать тело в виде углекислого газа (через выдох) вместо того, чтобы снова превращаться в ион бикарбоната, что приводит к сдвигу реакции вправо по химическому закону, известному как 9.0279 закон действия масс . Эти реакции важны для поддержания гомеостаза нашей крови.
Возвращаясь к примеру с избытком ионов водорода в крови, основным направлением реакции будет образование угольной кислоты. Однако угольная кислота также может покидать тело в виде углекислого газа (через выдох) вместо того, чтобы снова превращаться в ион бикарбоната, что приводит к сдвигу реакции вправо по химическому закону, известному как 9.0279 закон действия масс . Эти реакции важны для поддержания гомеостаза нашей крови.HCO 3 — + H + ↔ H 2 CO 3 ↔ CO 2 + H 2 O 2 + H 2 O 2 + H 2 O 2 + H 2 o 2 + H 2 o in + H 2 o in + H 2 . насколько легко и какой тип химических связей образует конкретный атом. Образование соединений часто визуально описывается химическими уравнениями, которые показывают реагенты, участвующие в химических реакциях с образованием продуктов.


 53KB
53KB 48KB
48KB 54KB
54KB 65KB
65KB 32MB
32MB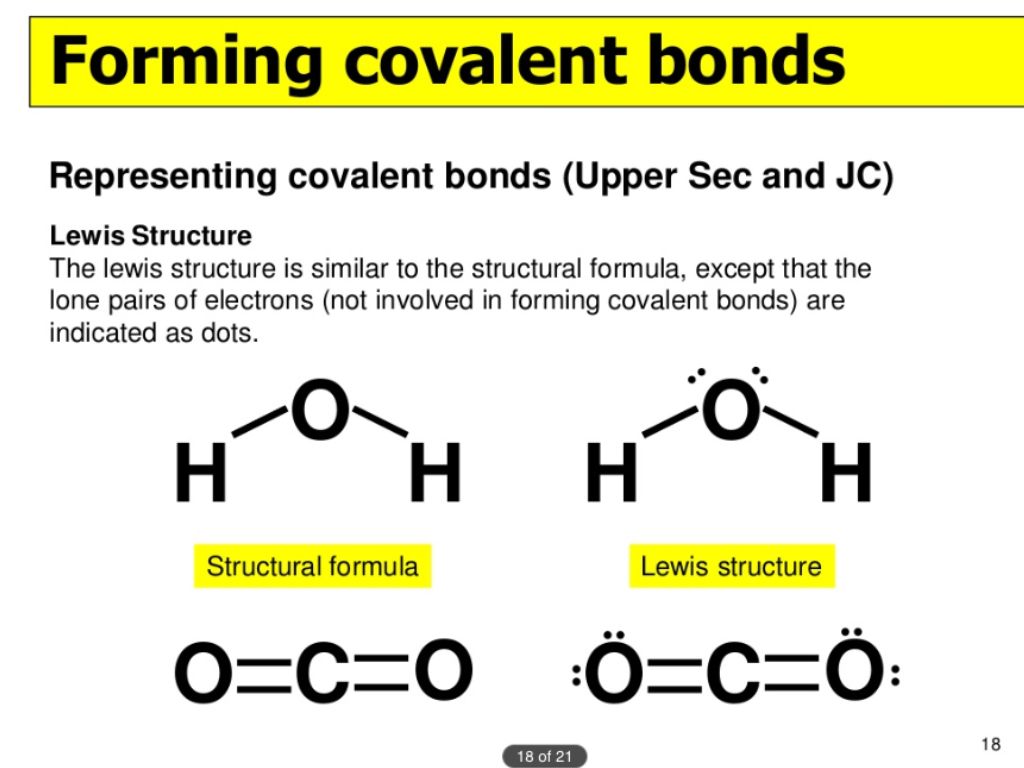 7KB
7KB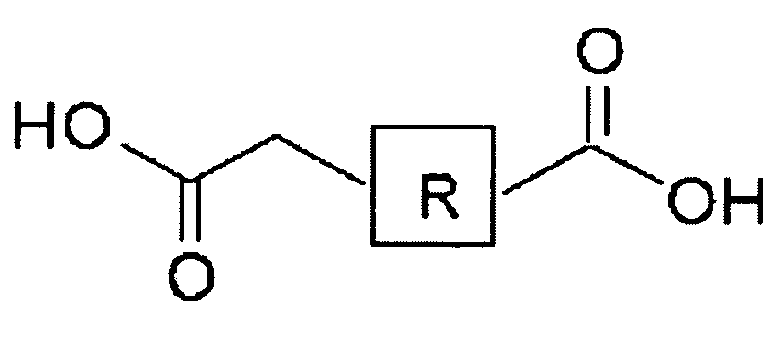 88KB
88KB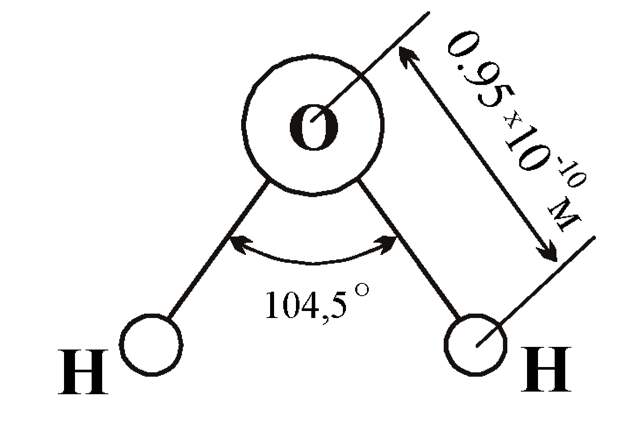 41KB
41KB 01KB
01KB 3KB
3KB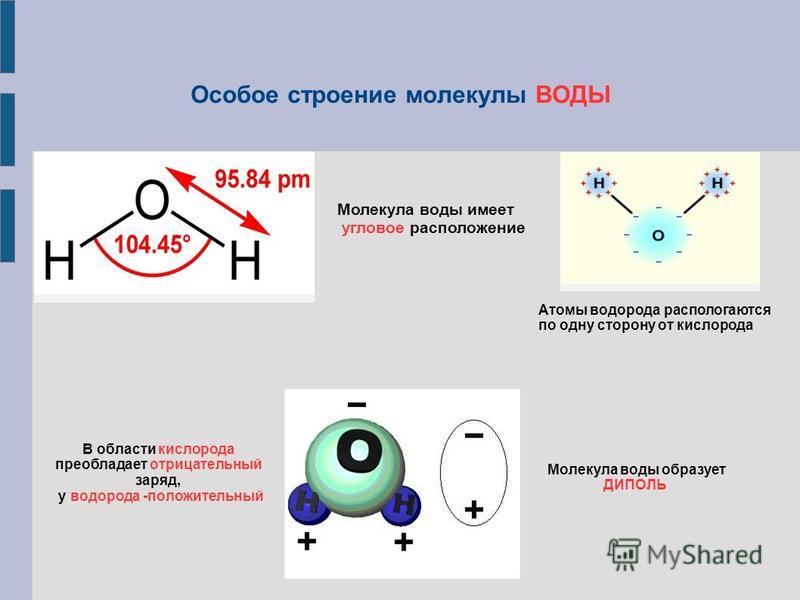 79KB
79KB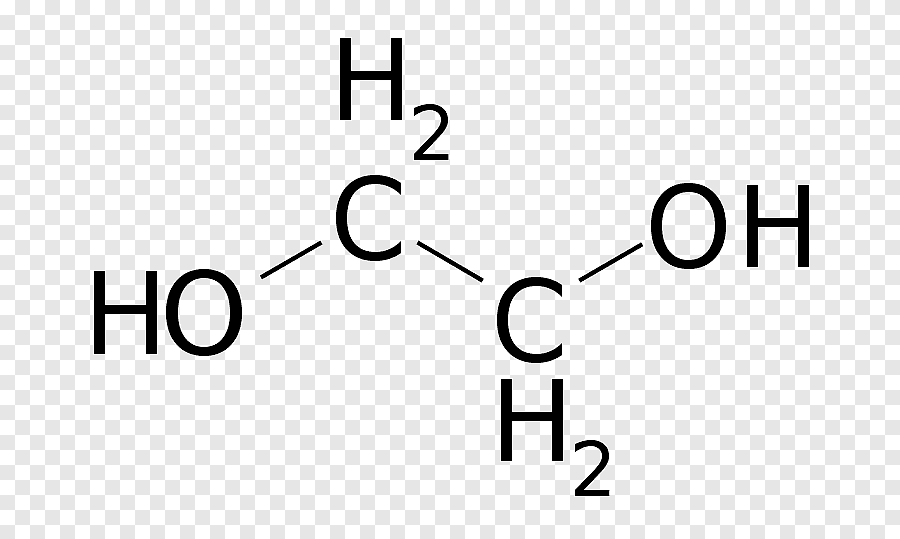
 Молекулы сероводорода не могут образовывать водородные связи, так как разница в электроотрицательности между серой и водородом недостаточно велика.
Молекулы сероводорода не могут образовывать водородные связи, так как разница в электроотрицательности между серой и водородом недостаточно велика. Мы можем видеть более длинные водородные связи
Мы можем видеть более длинные водородные связи

 Напротив, есть некоторые места, такие как Мертвое море в Западной Азии, где концентрация соли настолько высока, что люди могут плавать практически без усилий!
Напротив, есть некоторые места, такие как Мертвое море в Западной Азии, где концентрация соли настолько высока, что люди могут плавать практически без усилий!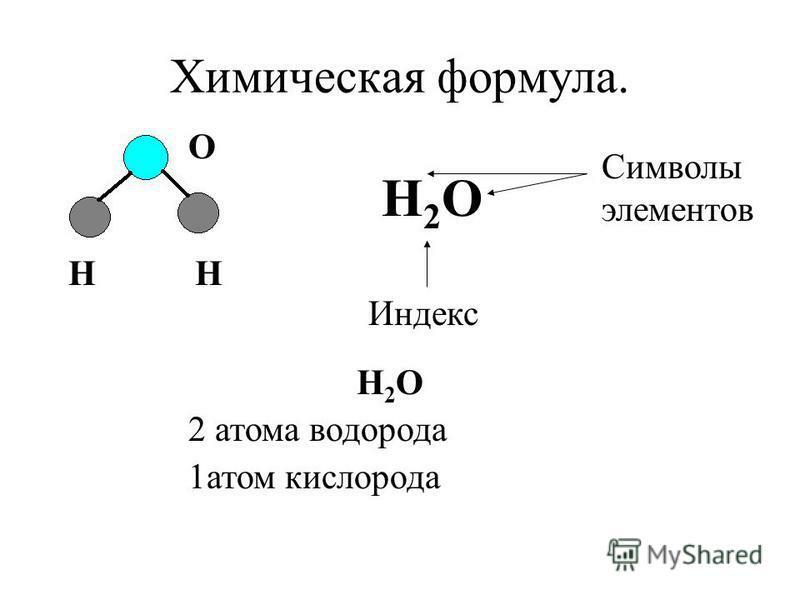 Добавление кислоты улучшает его проводимость. К вольтаметру присоединяют блок питания, и через подкисленную воду пропускают постоянный ток. Затем вода разделяется в соответствии с
Добавление кислоты улучшает его проводимость. К вольтаметру присоединяют блок питания, и через подкисленную воду пропускают постоянный ток. Затем вода разделяется в соответствии с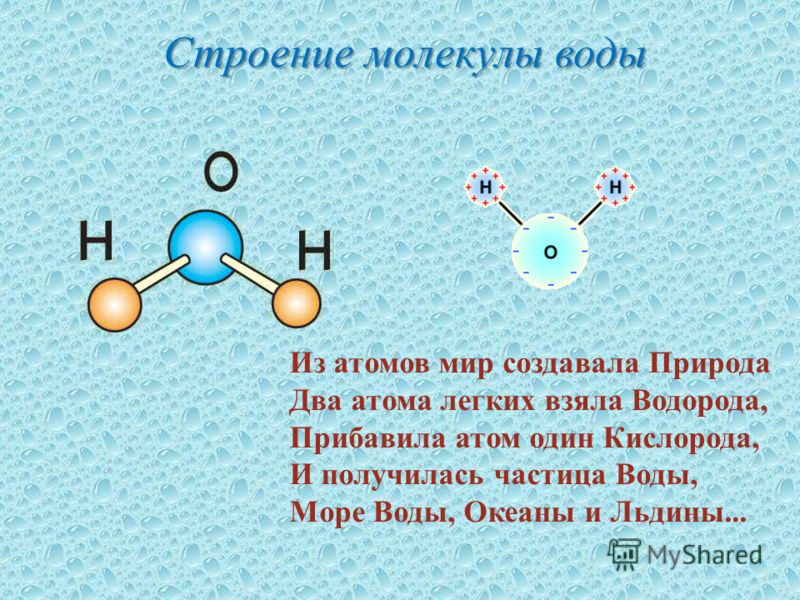

 Когда два или более атома химически связываются друг с другом, результирующая химическая структура представляет собой молекулу. Знакомая молекула воды, H 2 O, состоит из двух атомов водорода и одного атома кислорода; они соединяются вместе, образуя воду, как показано на рисунке 1. Атомы могут образовывать молекулы, отдавая, принимая или делясь электронами для заполнения своих внешних оболочек.
Когда два или более атома химически связываются друг с другом, результирующая химическая структура представляет собой молекулу. Знакомая молекула воды, H 2 O, состоит из двух атомов водорода и одного атома кислорода; они соединяются вместе, образуя воду, как показано на рисунке 1. Атомы могут образовывать молекулы, отдавая, принимая или делясь электронами для заполнения своих внешних оболочек. Между реагентами и продуктами обычно рисуется стрелка, указывающая направление химической реакции; это направление не всегда является «улицей с односторонним движением». Для образования молекулы воды, показанной выше, химическое уравнение будет таким:
Между реагентами и продуктами обычно рисуется стрелка, указывающая направление химической реакции; это направление не всегда является «улицей с односторонним движением». Для образования молекулы воды, показанной выше, химическое уравнение будет таким:
 В обратимых реакциях реагенты превращаются в продукты, но когда концентрация продукта превышает определенный порог (характерный для данной реакции), часть этих продуктов снова превращается в реагенты; в этот момент обозначения продуктов и реагентов меняются местами. Это движение вперед и назад продолжается до тех пор, пока не установится определенный относительный баланс между реагентами и продуктами — состояние, называемое 9.0279 равновесие . Эти ситуации обратимых реакций часто обозначаются химическим уравнением с двунаправленной стрелкой, указывающей как на реагенты, так и на продукты.
В обратимых реакциях реагенты превращаются в продукты, но когда концентрация продукта превышает определенный порог (характерный для данной реакции), часть этих продуктов снова превращается в реагенты; в этот момент обозначения продуктов и реагентов меняются местами. Это движение вперед и назад продолжается до тех пор, пока не установится определенный относительный баланс между реагентами и продуктами — состояние, называемое 9.0279 равновесие . Эти ситуации обратимых реакций часто обозначаются химическим уравнением с двунаправленной стрелкой, указывающей как на реагенты, так и на продукты. Возвращаясь к примеру с избытком ионов водорода в крови, основным направлением реакции будет образование угольной кислоты. Однако угольная кислота также может покидать тело в виде углекислого газа (через выдох) вместо того, чтобы снова превращаться в ион бикарбоната, что приводит к сдвигу реакции вправо по химическому закону, известному как 9.0279 закон действия масс . Эти реакции важны для поддержания гомеостаза нашей крови.
Возвращаясь к примеру с избытком ионов водорода в крови, основным направлением реакции будет образование угольной кислоты. Однако угольная кислота также может покидать тело в виде углекислого газа (через выдох) вместо того, чтобы снова превращаться в ион бикарбоната, что приводит к сдвигу реакции вправо по химическому закону, известному как 9.0279 закон действия масс . Эти реакции важны для поддержания гомеостаза нашей крови.