Содержание
Удивительные свойства воды – краткое описание опыта (физика 7 класс)
4.2
Средняя оценка: 4.2
Всего получено оценок: 92.
Обновлено 10 Августа, 2021
4.2
Средняя оценка: 4.2
Всего получено оценок: 92.
Обновлено 10 Августа, 2021
Из курса физики 7 класса известно, что вода — это вещество, имеющее исключительно важное значение для Земли. Облик нашей планеты и сама жизнь на ней определяется наличием воды во всех трёх агрегатных состояниях. Поговорим об удивительных свойствах воды, позволивших ей стать настолько важной для нашего существования.
Молекула воды
Молекула воды — это соединение двух атомов водорода с одним атомом кислорода. В электронной оболочке атома водорода один электрон, а во внешней оболочке атома кислорода — шесть электронов. Двум атомам водорода «энергетически выгодно» объединить свои оболочки с атомом кислорода, в результате чего образуется общая восьмиэлектронная оболочка.
За счёт большой разницы зарядов ядер, электроны в этой оболочке распределены неравномерно. Большая часть электронов находится около атома кислорода, что создаёт несимметричность молекулы. Молекула принимает вид равнобедренного треугольника с углом при вершине около 105 ⁰.
Большая часть электронов находится около атома кислорода, что создаёт несимметричность молекулы. Молекула принимает вид равнобедренного треугольника с углом при вершине около 105 ⁰.
Рис. 1. Строение молекулы воды.
Несимметричность распределения заряда (говорят «полярность» молекулы) обуславливает способность воды образовывать межмолекулярные связи (называемые водородными). В результате у воды появляется ряд интересных свойств.
Свойства воды
Важнейшее свойство воды — способность растворять многие вещества. Молекулы веществ, попадая в раствор, окружаются полярными молекулами воды, которые препятствуют возвращению молекул в исходное тело, вещество начинает растворяться. В растворе молекулы веществ получается более «свободными», в результате становятся возможными многие химические реакции, которые не происходят между твёрдыми веществами.
Лимонная кислота и пищевая сода не реагируют друг с другом в виде порошков. Однако стоит залить смесь порошков водой — начнётся бурная реакция.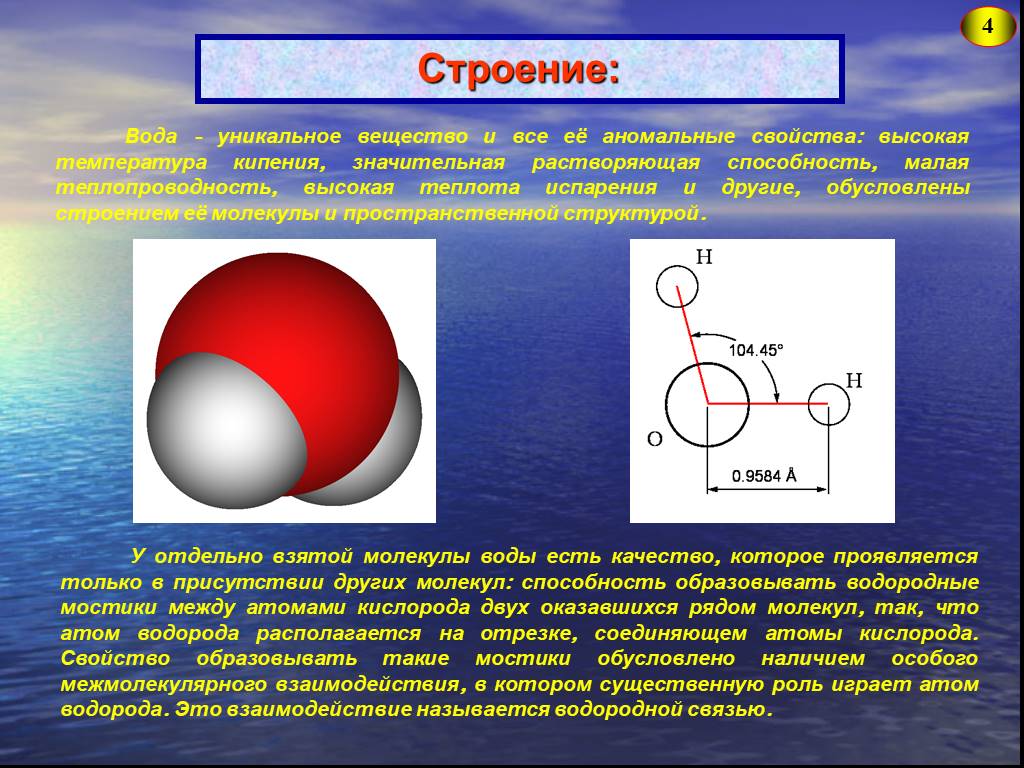
Более странное свойство демонстрирует вода при затвердевании. Из опыта все знают, что лёд плавает на поверхности воды, хотя большинство веществ в твёрдом состоянии увеличивают плотность. Следовательно, плотность льда меньше. Почему?
Дело опять в образовании водородных связей. При образовании льда молекулы воды образуют водородные связи и выстраиваются в «ажурную» структуру. Плотность льда оказывается меньше плотности воды.
Рис. 2. Молекулы льда и воды.
Не менее удивительны тепловые свойства воды. Они также определяются водородными связями. На их построение и разрыв требуется дополнительная энергия, поэтому вода обладает аномально высокой теплоёмкостью и теплотой парообразования.
Значение воды для жизни
Комплекс свойств воды делает её незаменимой для существования жизни на Земле. Фактически живые существа являются «растворами», содержащимися в клетках-«пробирках» из белковых оболочек. В каждой «пробирке» идёт множество биохимических реакций при непосредственном участии воды.
Растения в процессе фотосинтеза из углекислого газа и воды синтезируют глюкозу и выделяют кислород. Однако атомы кислорода, выделяемые растениями, изначально входят в молекулы воды. Атомы кислорода, входящие в поглощённую молекулу углекислого газа, переходят в молекулы глюкозы и усваиваются растениями.
Рис. 3. Фотосинтез.
Что мы узнали?
Молекула воды состоит из атома кислорода и двух атомов водорода и способна к образованию связей, называемых водородными. Это в свою очередь определяет способность воды растворять другие вещества, иметь высокую теплоёмкость и малую плотность в твёрдом состоянии. Кроме того, без воды невозможна жизнь.
Тест по теме
Доска почёта
Чтобы попасть сюда — пройдите тест.
Пока никого нет. Будьте первым!
Оценка доклада
4.2
Средняя оценка: 4.2
Всего получено оценок: 92.
А какая ваша оценка?
Структура воды
К.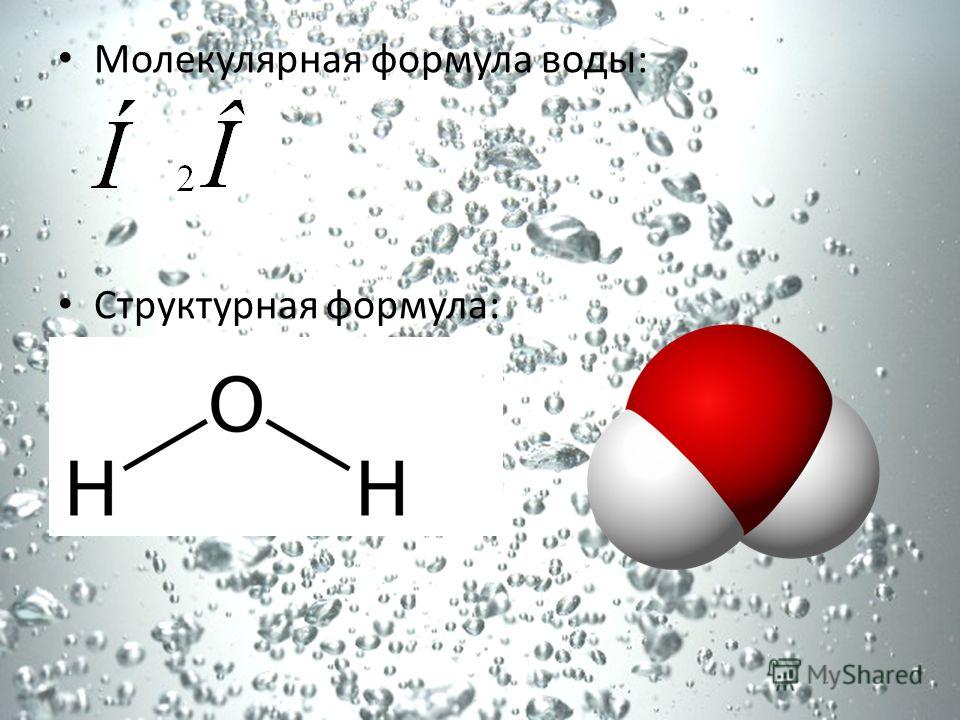 х.н. О.В. Мосин
х.н. О.В. Мосин
Молекула воды представляет собой маленький диполь, содержащий положительный и отрицательный заряды на полюсах. Так как масса и заряд ядра кислорода больше чем у ядер водорода, то электронное облако стягивается в сторону кислородного ядра. При этом ядра водорода “оголяются”. Таким образом, электронное облако имеет неоднородную плотность. Около ядер водорода имеется недостаток электронной плотности, а на противоположной стороне молекулы, около ядра кислорода, наблюдается избыток электронной плотности. Именно такая структура и определяет полярность молекулы воды. Если соединить прямыми линиями эпицентры положительных и отрицательных зарядов получится объемная геометрическая фигура — правильный тетраэдр.
Строение молекулы воды (рисунок справа)
Благодаря наличию водородных связей каждая молекула воды образует водородную связь с 4-мя соседними молекулами, образуя ажурный сетчатый каркас в молекуле льда. Однако, в жидком состоянии вода – неупорядоченная жидкость; эти водородные связи — спонтанные, короткоживущие, быстро рвутся и образуются вновь.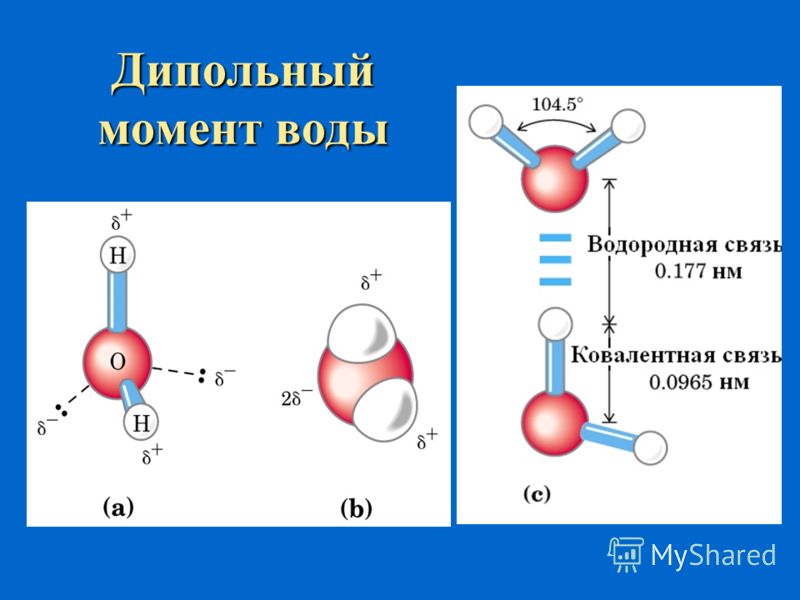 Всё это приводит к неоднородности в структуре воды.
Всё это приводит к неоднородности в структуре воды.
Водородные связи между молекулами воды (рисунок ниже слева)
То, что вода неоднородна по своему составу, было установлено давно. С давних пор известно, что лёд плавает на поверхности воды, то есть плотность кристаллического льда меньше, чем плотность жидкости.
Почти у всех остальных веществ кристалл плотнее жидкой фазы. К тому же и после плавления при повышении температуры плотность воды продолжает увеличиваться и достигает максимума при 4°C. Менее известна аномалия сжимаемости воды: при нагреве от точки плавления вплоть до 40°C она уменьшается, а потом увеличивается. Теплоёмкость воды тоже зависит от температуры немонотонно.
Кроме того, при температуре ниже 30°C с увеличением давления от атмосферного до 0,2 ГПа вязкость воды уменьшается, а коэффициент самодиффузии — параметр, который определяет скорость перемещения молекул воды относительно друг друга растёт.
Для других жидкостей зависимость обратная, и почти нигде не бывает, чтобы какой-то важный параметр вёл себя не монотонно, т. е. сначала рос, а после прохождения критического значения температуры или давления уменьшался. Возникло предположение, что на самом деле вода — это не единая жидкость, а смесь двух компонентов, которые различаются свойствами, например плотностью и вязкостью, а следовательно, и структурой. Такие идеи стали возникать в конце XIX века, когда накопилось много данных об аномалиях воды.
е. сначала рос, а после прохождения критического значения температуры или давления уменьшался. Возникло предположение, что на самом деле вода — это не единая жидкость, а смесь двух компонентов, которые различаются свойствами, например плотностью и вязкостью, а следовательно, и структурой. Такие идеи стали возникать в конце XIX века, когда накопилось много данных об аномалиях воды.
Первым идею о том, что вода состоит из двух компонентов, высказал Уайтинг в 1884 году. Его авторство цитирует Э.Ф. Фрицман в монографии “Природа воды. Тяжёлая вода”, изданной в 1935 году. В 1891 году В. Ренгтен ввёл представление о двух состояниях воды, которые различаются плотностью. После неё появилось множество работ, в которых воду рассматривали как смесь ассоциатов разного состава (“гидролей”).
Когда в 20-е годы определили структуру льда, оказалось, что молекулы воды в кристаллическом состоянии образуют трёхмерную непрерывную сетку, в которой каждая молекула имеет четырёх ближайших соседей, расположенных в вершинах правильного тетраэдра. В 1933 году Дж. Бернал и П. Фаулер предположили, что подобная сетка существует и в жидкой воде. Поскольку вода плотнее льда, они считали, что молекулы в ней расположены не так, как во льду, то есть подобно атомам кремния в минерале тридимите, а так, как атомы кремния в более плотной модификации кремнезёма — кварце. Увеличение плотности воды при нагревании от 0 до 4°C объяснялось присутствием при низкой температуре тридимитовой компоненты. Таким образом, модель Бернала — Фаулера сохранила элемент двухструктурности, но главное их достижение — идея непрерывной тетраэдрическои сетки. Тогда появился знаменитый афоризм И. Ленгмюра: „Океан — одна большая молекула“. Излишняя конкретизация модели не прибавила сторонников теории единой сетки.
В 1933 году Дж. Бернал и П. Фаулер предположили, что подобная сетка существует и в жидкой воде. Поскольку вода плотнее льда, они считали, что молекулы в ней расположены не так, как во льду, то есть подобно атомам кремния в минерале тридимите, а так, как атомы кремния в более плотной модификации кремнезёма — кварце. Увеличение плотности воды при нагревании от 0 до 4°C объяснялось присутствием при низкой температуре тридимитовой компоненты. Таким образом, модель Бернала — Фаулера сохранила элемент двухструктурности, но главное их достижение — идея непрерывной тетраэдрическои сетки. Тогда появился знаменитый афоризм И. Ленгмюра: „Океан — одна большая молекула“. Излишняя конкретизация модели не прибавила сторонников теории единой сетки.
Только в 1951 году Дж. Попл создал модель непрерывной сетки, которая была не так конкретна, как модель Бернала — Фаулера. Попл представлял воду как случайную тетраэдрическую сетку, связи между молекулами в которой искривлены и имеют различную длину. Модель Попла объясняет уплотнение воды при плавлении искривлением связей.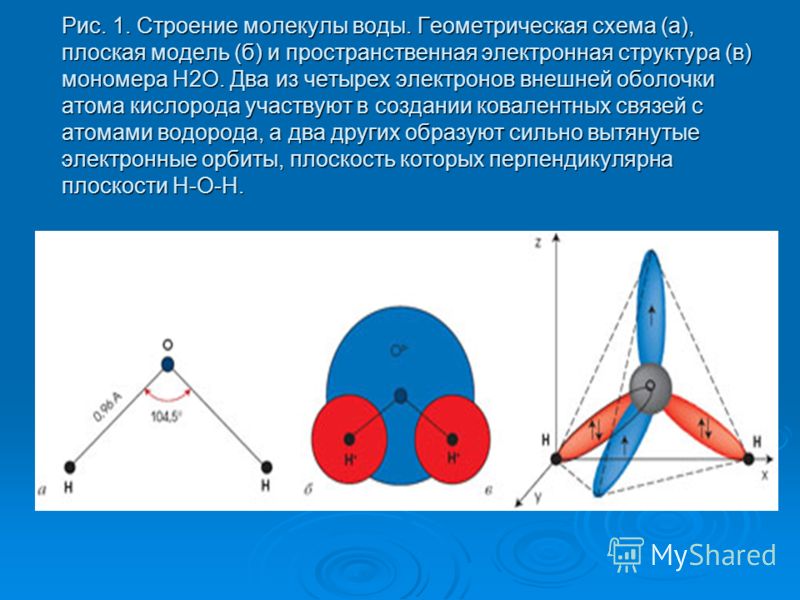 Когда в 60–70-е годы появились первые определения структуры льдов II и IX, стало ясно, как искривление связей может приводить к уплотнению структуры. Модель Попла не могла объяснить немонотонность зависимости свойств воды от температуры и давления так хорошо, как модели двух состояний. Поэтому идею двух состояний ещё долго разделяли многие учёные.
Когда в 60–70-е годы появились первые определения структуры льдов II и IX, стало ясно, как искривление связей может приводить к уплотнению структуры. Модель Попла не могла объяснить немонотонность зависимости свойств воды от температуры и давления так хорошо, как модели двух состояний. Поэтому идею двух состояний ещё долго разделяли многие учёные.
Но во второй половине XX века нельзя было так фантазировать о составе и строении „гидролей“, как это делали в начале века. Уже было известно, как устроен лёд и кристаллогидраты, и многое знали про водородную связь. Помимо „континуальных“ моделей (модель Попла), возникли две группы „смешанных“ моделей: кластерные и клатратные. В первой группе вода представала в виде кластеров из молекул, связанных водородными связями, которые плавали в море молекул, в таких связях не участвующих. Модели второй группы рассматривали воду как непрерывную сетку (обычно в этом контексте называемую каркасом) водородных связей, которая содержит пустоты; в них размещаются молекулы, не образующие связей с молекулами каркаса. Нетрудно было подобрать такие свойства и концентрации двух микрофаз кластерных моделей или свойства каркаса и степень заполнения его пустот клатратных моделей, чтобы объяснить все свойства воды, в том числе и знаменитые аномалии.
Нетрудно было подобрать такие свойства и концентрации двух микрофаз кластерных моделей или свойства каркаса и степень заполнения его пустот клатратных моделей, чтобы объяснить все свойства воды, в том числе и знаменитые аномалии.
Среди кластерных моделей наиболее яркой оказалась модель Г. Немети и Х. Шераги: предложенные ими картинки, изображающие кластеры связанных молекул, которые плавают в море несвязанных молекул, вошли во множество монографий.
Первую модель клатратного типа в 1946 году предложил О.Я. Самойлов: в воде сохраняется подобная гексагональному льду сетка водородных связей, полости которой частично заполнены мономерными молекулами. Л. Полинг в 1959 году создал другой вариант, предположив, что основой структуры может служить сетка связей, присущая некоторым кристаллогидратам.
В течение второй половины 60-х годов и начала 70-х наблюдается сближение всех этих взглядов. Появлялись варианты кластерных моделей, в которых в обеих микрофазах молекулы соединены водородными связями. Сторонники клатратных моделей стали допускать образование водородных связей между пустотными и каркасными молекулами. То есть фактически авторы этих моделей рассматривают воду как непрерывную сетку водородных связей. И речь идёт о том, насколько неоднородна эта сетка (например, по плотности). Представлениям о воде как о водородно-связанных кластерах, плавающих в море лишённых связей молекул воды, был положен конец в начале восьмидесятых годов, когда Г. Стэнли применил к модели воды теорию перколяции, описывающую фазовые переходы воды.
Сторонники клатратных моделей стали допускать образование водородных связей между пустотными и каркасными молекулами. То есть фактически авторы этих моделей рассматривают воду как непрерывную сетку водородных связей. И речь идёт о том, насколько неоднородна эта сетка (например, по плотности). Представлениям о воде как о водородно-связанных кластерах, плавающих в море лишённых связей молекул воды, был положен конец в начале восьмидесятых годов, когда Г. Стэнли применил к модели воды теорию перколяции, описывающую фазовые переходы воды.
В 1999 г. известный российский исследователь воды С.В. Зенин защитил в Институте медико-биологических проблем РАН докторскую диссертацию, посвященную кластерной теории, которая явилась существенным этапом в продвижении этого направления исследований, сложность которых усиливается тем, что они находятся на стыке трех наук: физики, химии и биологии. Им на основании данных, полученных тремя физико-химическими методами: рефрактометрии (С.В. Зенин, Б.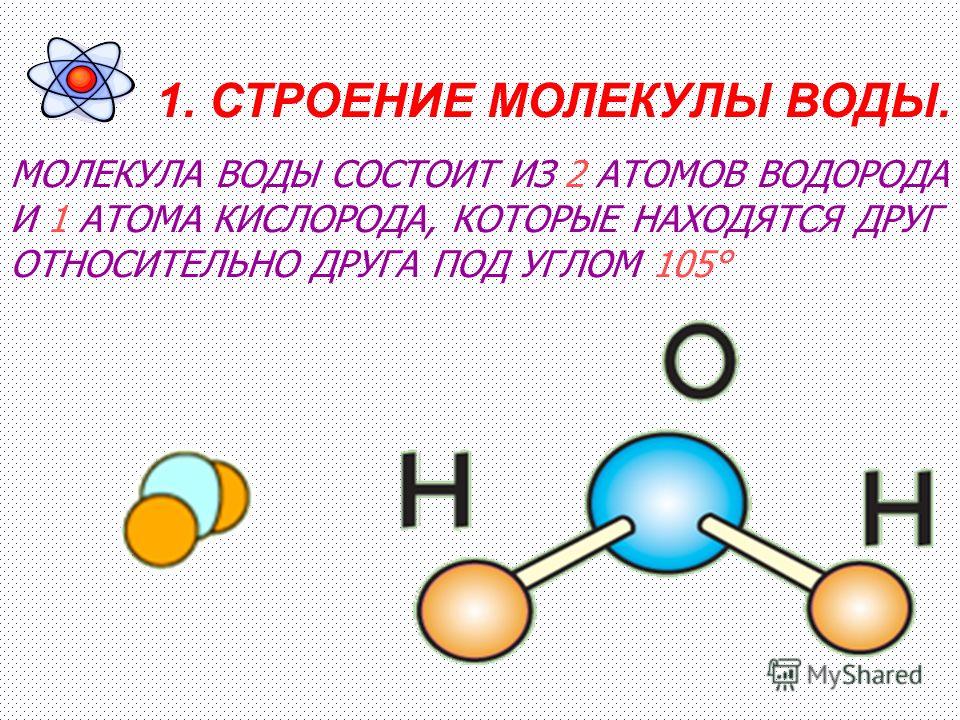 В. Тяглов, 1994), высокоэффективной жидкостной хроматографии (С.В. Зенин с соавт., 1998) и протонного магнитного резонанса (С.В. Зенин, 1993) построена и доказана геометрическая модель основного стабильного структурного образования из молекул воды (структурированная вода), а затем (С.В. Зенин, 2004) получено изображение с помощью контрастно-фазового микроскопа этих структур.
В. Тяглов, 1994), высокоэффективной жидкостной хроматографии (С.В. Зенин с соавт., 1998) и протонного магнитного резонанса (С.В. Зенин, 1993) построена и доказана геометрическая модель основного стабильного структурного образования из молекул воды (структурированная вода), а затем (С.В. Зенин, 2004) получено изображение с помощью контрастно-фазового микроскопа этих структур.
Сейчас наукой доказано, что особенности физических свойств воды и многочисленные короткоживущие водородные связи между соседними атомами водорода и кислорода в молекуле воды создают благоприятные возможности для образования особых структур-ассоциатов (кластеров), воспринимающих, хранящих и передающих самую различную информацию.
Структурной единицей такой воды является кластер, состоящий из клатратов, природа которых обусловлена дальними кулоновскими силами. В структуре кластров закодирована информация о взаимодействиях, имевших место с данными молекулами воды. В водных кластерах за счёт взаимодействия между ковалентными и водородными связями между атомами кислорода и атомами водорода может происходить миграция протона (Н+) по эстафетному механизму, приводящие к делокализации протона в пределах кластера.
Вода, состоящая из множества кластеров различных типов, образует иерархическую пространственную жидкокристаллическую структуру, которая может воспринимать и хранить огромные объемы информации.
На рисунке (В.Л. Воейков) в качестве примера приведены схемы нескольких простейших кластерных структур.
Некоторые возможные структуры кластеров воды
Переносчиками информации могут быть физические поля самой различной природы. Так установлена возможность дистанционного информационного взаимодействия жидкокристаллической структуры воды с объектами различной природы при помощи электромагнитных, акустических и других полей. Воздействующим объектом может быть и человек.
Вода является источником сверхслабого и слабого переменного электромагнитного излучения. Наименее хаотичное электромагнитное излучение создаёт структурированная вода. В таком случае может произойти индукция соответствующего электромагнитного поля, изменяющего структурно-информационные характеристики биологических объектов.
В течение последних лет получены важные данные о свойствах переохлаждённой воды. Изучать воду при низкой температуре очень интересно, поскольку её удаётся сильнее переохладить, чем другие жидкости. Кристаллизация воды, как правило, начинается на каких-то неоднородностях — либо на стенках сосуда, либо на плавающих частичках твердых примесей. Поэтому найти температуру, при которой бы переохлаждённая вода самопроизвольно закристаллизовалась нелегко. Но учёным удалось это сделать, и сейчас температура так называемой гомогенной нуклеации, когда образование кристаллов льдов идёт одновременно по всему объёму, известна для давлений вплоть до 0,3 ГПа, то есть захватывая области существования льда II.
От атмосферного давления до границы, разделяющей льды I и II, эта температура падает от 231 до 180 К, а потом слегка увеличивается — до 190К. Ниже этой критической температуры жидкая вода невозможна в принципе.
Структура льда (рисунок справа)
Однако с этой температурой связана одна загадка.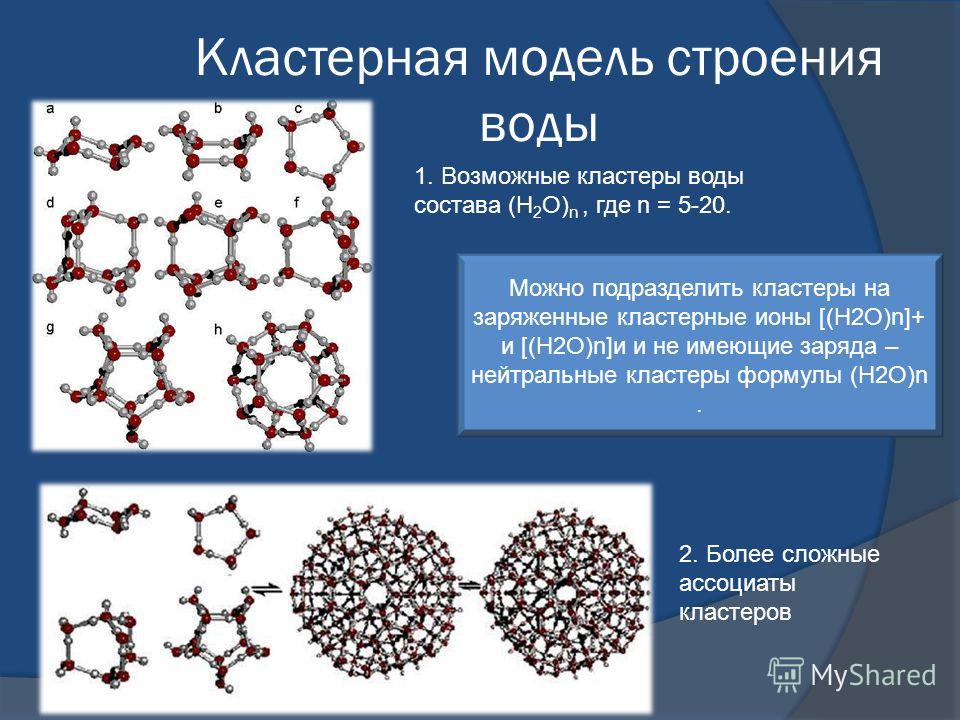 В середине восьмидесятых годов была открыта новая модификация аморфного льда — лёд высокой плотности, и это помогло возрождению представлений о воде как о смеси двух состояний. В качестве прототипов рассматривались не кристаллические структуры, а структуры аморфных льдов разной плотности. В наиболее внятном виде эту концепцию сформулировали Е.Г. Понятовский и В.В. Синицин, которые в 1999 году написали: „Вода рассматривается как регулярный раствор двух компонентов, локальные конфигурации в которых соответствуют ближнему порядку модификаций аморфного льда“. Более того, изучая ближний порядок в переохлаждённой воде при высоком давлении методами дифракции нейтронов, учёным удалось найти компоненты, соответствующие этим структурам.
В середине восьмидесятых годов была открыта новая модификация аморфного льда — лёд высокой плотности, и это помогло возрождению представлений о воде как о смеси двух состояний. В качестве прототипов рассматривались не кристаллические структуры, а структуры аморфных льдов разной плотности. В наиболее внятном виде эту концепцию сформулировали Е.Г. Понятовский и В.В. Синицин, которые в 1999 году написали: „Вода рассматривается как регулярный раствор двух компонентов, локальные конфигурации в которых соответствуют ближнему порядку модификаций аморфного льда“. Более того, изучая ближний порядок в переохлаждённой воде при высоком давлении методами дифракции нейтронов, учёным удалось найти компоненты, соответствующие этим структурам.
Следствием полиморфизма аморфных льдов стали также предположения о расслоении воды на два несмешивающихся компонента при температуре ниже гипотетической низкотемпературной критической точки. К сожалению, по оценке исследователей, эта температура при давлении 0,017 ГПа равна 230К — ниже температуры нуклеации, поэтому наблюдать расслоение жидкой воды никому ещё не удалось.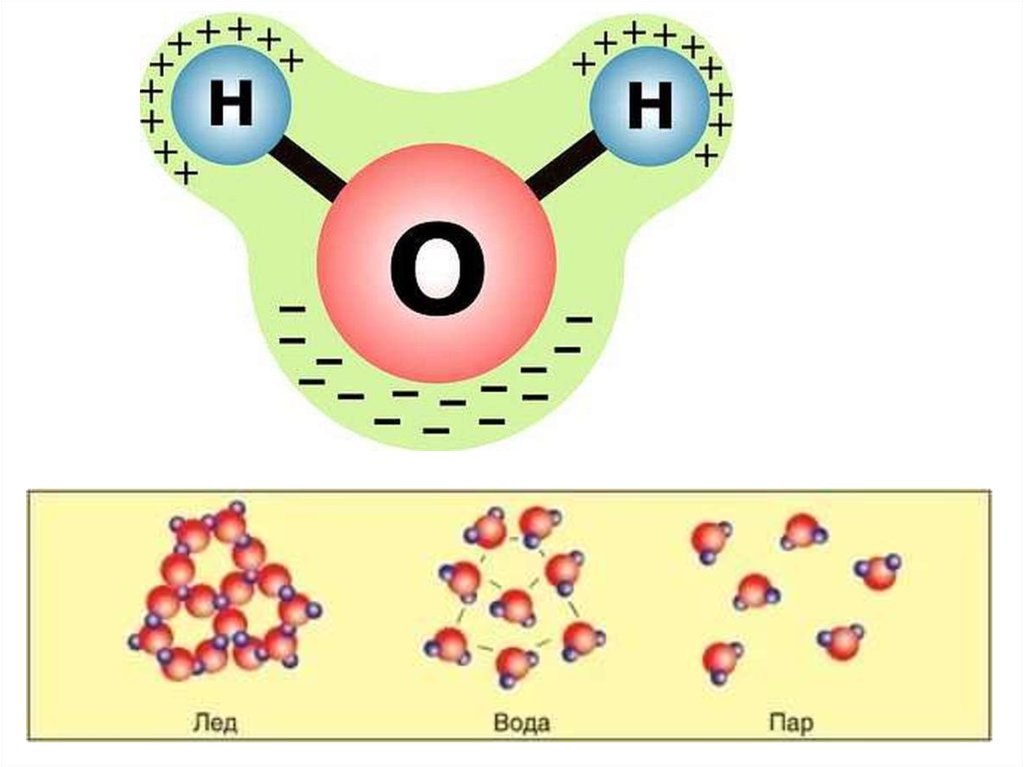 Так возрождение модели двух состояний поставило вопрос о неоднородности сетки водородных связей в жидкой воде. Разобраться в этой неоднородности можно только с помощью компьютерного моделирования.
Так возрождение модели двух состояний поставило вопрос о неоднородности сетки водородных связей в жидкой воде. Разобраться в этой неоднородности можно только с помощью компьютерного моделирования.
Говоря о кристаллической структуре воды, следует отметить, что известно 14 модификаций льда, большинство из которых не встречаются в природе, в которых молекулы воды и сохраняют свою индивидуальность, и соединены водородными связями. С другой стороны существует множество вариантов сетки водородных связей в клатратных гидратах. Энергии этих сеток (льдов высокого давления и клатратных гидратов) ненамного выше энергий кубического и гексагонального льдов. Поэтому фрагменты таких структур также могут появляться в жидкой воде. Можно сконструировать бесчисленное множество различных непериодических фрагментов, молекулы в которых имеют по четыре ближайших соседа, расположенных приблизительно по вершинам тетраэдра, но при этом их структура не соответствует структурам известных модификаций льда.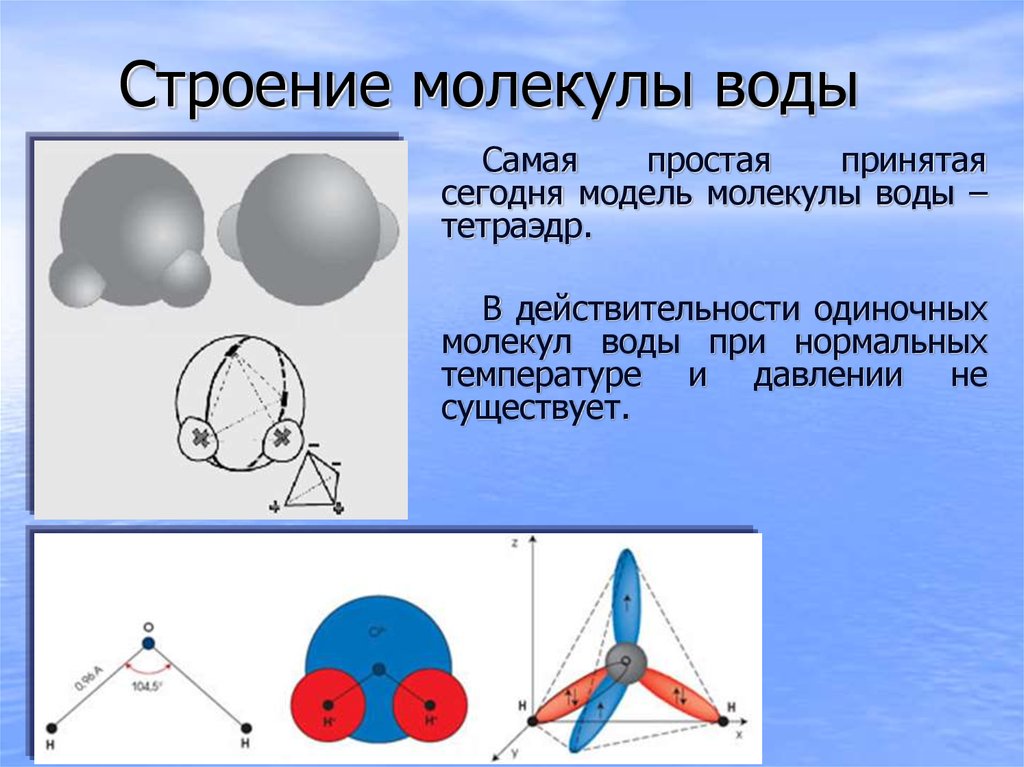 Как показали многочисленные расчёты, энергии взаимодействия молекул в таких фрагментах будут близки друг к другу, и нет оснований говорить, что какая-то структура должна преобладать в жидкой воде.
Как показали многочисленные расчёты, энергии взаимодействия молекул в таких фрагментах будут близки друг к другу, и нет оснований говорить, что какая-то структура должна преобладать в жидкой воде.
Структурные исследования воды можно изучать разными методами; спектроскопией протонного магнитного резонанса, инфракрасной спекроскопии, дифракцией рентгеновских лучей и др. Например, дифракцию рентгеновских лучей и нейтронов в воде изучали много раз. Однако подробных сведений о структуре эти эксперименты дать не могут. Неоднородности, различающиеся по плотности, можно было бы увидеть по рассеянию рентгеновских лучей и нейтронов под малыми углами, однако такие неоднородности должны быть большими, состоящими из сотен молекул воды. Можно было бы их увидеть, и исследуя рассеяние света. Однако вода — исключительно прозрачная жидкость. Единственный же результат дифракционных экспериментов — функции радиального распределения, то есть расстояния между атомами кислорода, водорода и кислорода-водорода.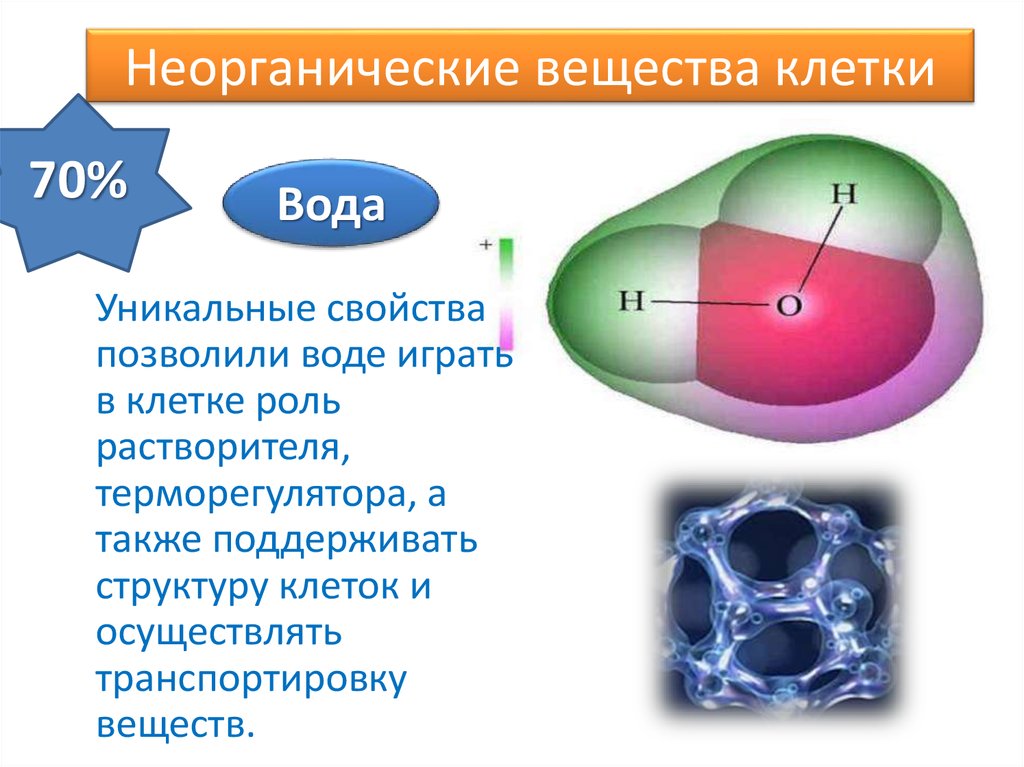 Из них видно, что никакого дальнего порядка в расположении молекул воды нет. Эти функции для воды затухают гораздо быстрее, чем для большинства других жидкостей. Например, распределение расстояний между атомами кислорода при температуре, близкой к комнатной, даёт только три максимума, на 2,8, 4,5 и 6,7 Å. Первый максимум соответствует расстоянию до ближайших соседей, и его значение примерно равно длине водородной связи. Второй максимум близок к средней длине ребра тетраэдра — вспомним, что молекулы воды в гексагональном льду располагаются по вершинам тетраэдра, описанного вокруг центральной молекулы. А третий максимум, выраженный весьма слабо, соответствует расстоянию до третьих и более далёких соседей по водородной сетке. Этот максимум и сам не очень ярок, а про дальнейшие пики и говорить не приходится. Были попытки получить из этих распределений более детальную информацию. Так в 1969 году И.С. Андрианов и И.З. Фишер нашли расстояния вплоть до восьмого соседа, при этом до пятого соседа оно оказалось равным 3 Å, а до шестого — 3,1 Å.
Из них видно, что никакого дальнего порядка в расположении молекул воды нет. Эти функции для воды затухают гораздо быстрее, чем для большинства других жидкостей. Например, распределение расстояний между атомами кислорода при температуре, близкой к комнатной, даёт только три максимума, на 2,8, 4,5 и 6,7 Å. Первый максимум соответствует расстоянию до ближайших соседей, и его значение примерно равно длине водородной связи. Второй максимум близок к средней длине ребра тетраэдра — вспомним, что молекулы воды в гексагональном льду располагаются по вершинам тетраэдра, описанного вокруг центральной молекулы. А третий максимум, выраженный весьма слабо, соответствует расстоянию до третьих и более далёких соседей по водородной сетке. Этот максимум и сам не очень ярок, а про дальнейшие пики и говорить не приходится. Были попытки получить из этих распределений более детальную информацию. Так в 1969 году И.С. Андрианов и И.З. Фишер нашли расстояния вплоть до восьмого соседа, при этом до пятого соседа оно оказалось равным 3 Å, а до шестого — 3,1 Å. Это позволяет делать данные о дальнем окружении молекул воды.
Это позволяет делать данные о дальнем окружении молекул воды.
Другой метод исследования структуры – нейтронная дифракция на кристаллах воды осуществляется точно также, как и рентгеновская дифракция. Однако из-за того, что длины нейтронного рассеяния различаются у разных атомов не столь сильно, метод изоморфного замещения становится неприемлемым. На практике обычно работают с кристаллом, у которого молекулярная структура уже приблизительно установлена другими методами. Затем для этого кристалла измеряют интенсивности нейтронной дифракции. По этим результатам проводят преобразование Фурье, в ходе которого используют измеренные нейтронные интенсивности и фазы, вычисляемые с учётом неводородных атомов, т.е. атомов кислорода, положение которых в модели структуры известно. Затем на полученной таким образом фурье-карте атомы водорода и дейтерия представлены с гораздо большими весами, чем на карте электронной плотности, т.к. вклад этих атомов в нейтронное рассеяние очень большой. По этой карте плотности можно, например, определить положения атомов водорода (отрицательная плотность) и дейтерия (положительная плотность).
Возможна разновидность этого метода, которая состоит в том, что кристалл образовавшийся в воде, перед измерениями выдерживают в тяжёлой воде. В этом случае нейтронная дифракция не только позволяет установить, где расположены атомы водорода, но и выявляет те из них, способные обмениваться на дейтерий, что особенно важно при изучение изотопного (H-D)-обмена. Подобная информация помогает подтвердить правильность установления структуры.
Другие методы также позволяют изучать динамику молекул воды. Это эксперименты по квазиупругому рассеянию нейтронов, сверхбыстрой ИК-спектроскопии и изучение диффузии воды с помощью ЯМР или меченых атомов дейтерия. Метод ЯМР-спектроскопии основан на том, что ядро атома водорода имеет магнитный момент — спин, взаимодействующий с магнитными полями, постоянными и переменными. По спектру ЯМР можно судить о том, в каком окружении эти атомы и ядра находятся, получая, таким образом, информацию о структуре молекулы.
В результате экспериментов по квазиупругому рассеянию нейтронов в кристаллах воды был измерен важнейший параметр — коэффициент самодиффузии при различных давлениях и температурах. Чтобы судить о коэффициенте самодиффузии по квазиупругому рассеянию нейтронов, необходимо сделать предположение о характере движения молекул. Если они движутся в соответствии с моделью Я.И. Френкеля (известного отечественного физика-теоретика, автора „Кинетической теории жидкостей“ — классической книги, переведённой на многие языки), называемой также моделью „прыжок-ожидание“, тогда время „осёдлой“ жизни (время между прыжками) молекулы составляет 3,2 пикосекунды. Новейшие методы фемтосекундной лазерной спектроскопии позволили оценить время жизни разорванной водородной связи: протону требуется 200 фс для того, чтобы найти себе партнёра. Однако всё это средние величины. Изучить детали строения и характера движения молекул воды можно только при помощи компьютерного моделирования, называемого иногда численным экспериментом.
Чтобы судить о коэффициенте самодиффузии по квазиупругому рассеянию нейтронов, необходимо сделать предположение о характере движения молекул. Если они движутся в соответствии с моделью Я.И. Френкеля (известного отечественного физика-теоретика, автора „Кинетической теории жидкостей“ — классической книги, переведённой на многие языки), называемой также моделью „прыжок-ожидание“, тогда время „осёдлой“ жизни (время между прыжками) молекулы составляет 3,2 пикосекунды. Новейшие методы фемтосекундной лазерной спектроскопии позволили оценить время жизни разорванной водородной связи: протону требуется 200 фс для того, чтобы найти себе партнёра. Однако всё это средние величины. Изучить детали строения и характера движения молекул воды можно только при помощи компьютерного моделирования, называемого иногда численным экспериментом.
Так выглядит структура воды по результатам компьютерного моделирования (по данным д.х.н. Г. Г. Маленкова). Общую беспорядочную структуру можно разбить на два типа областей (показаны тёмными и светлыми шариками), которые различаются по своему строению, например по объёму многогранника Вороного (а), степени тетраэдричности ближайшего окружения (б), значению потенциальной энергии (в), а также по наличию четырёх водородных связей у каждой молекулы (г). Впрочем, эти области буквально через мгновение, спустя несколько пикосекунд, изменят свое расположение.
Впрочем, эти области буквально через мгновение, спустя несколько пикосекунд, изменят свое расположение.
Моделирование проводится так. Берётся структура льда и, нагревается до расплавления. Затем после некоторого времени, чтобы вода «забыла» о кристаллическом происхождении, снимаются мгновенные микрофотографии.
Для анализа структуры воды выбираются три параметра:
— степень отклонения локального окружения молекулы от вершин правильного тетраэдра;
-потенциальная энергия молекул;
-объём так называемого многогранника Вороного.
Чтобы построить этот многогранник, берут ребро от данной молекулы до ближайшей, делят его пополам и через эту точку проводят плоскость, перпендикулярную ребру. Получается объём, приходящийся на одну молекулу. Объём полиэдра — это плотность, тетраэдричность — степень искажения водородных связей, энергия — степень устойчивости конфигурации молекул. Молекулы с близкими значениями каждого из этих параметров стремятся сгруппироваться вместе в отдельные кластеры. Области как с низкой, так и с высокой плотностью обладают разными значениями энергии, но могут иметь и одинаковые значения. Эксперименты показали, что области с разным строением кластеры возникают спонтанно и спонтанно распадаются. Вся структура воды живёт и постоянно меняется, причём время, за которое происходят эти изменения, очень маленькое. Исследователи следили за перемещениями молекул и выяснили, что они совершают нерегулярные колебания с частотой около 0,5 пс и амплитудой 1 ангстрем. Наблюдались также и редкие медленные скачки на ангстремы, которые длятся пикосекунды. В общем, за 30 пс молекула может сместиться на 8-10 ангстрем. Время жизни локального окружения тоже невелико. Области, составленные из молекул с близкими значениями объёма многогранника Вороного, могут распасться за 0,5 пс, а могут жить и несколько пикосекунд. А вот распределение времён жизни водородных связей очень велико. Но это время не превышает 40 пс, а среднее значение — несколько пс.
Области как с низкой, так и с высокой плотностью обладают разными значениями энергии, но могут иметь и одинаковые значения. Эксперименты показали, что области с разным строением кластеры возникают спонтанно и спонтанно распадаются. Вся структура воды живёт и постоянно меняется, причём время, за которое происходят эти изменения, очень маленькое. Исследователи следили за перемещениями молекул и выяснили, что они совершают нерегулярные колебания с частотой около 0,5 пс и амплитудой 1 ангстрем. Наблюдались также и редкие медленные скачки на ангстремы, которые длятся пикосекунды. В общем, за 30 пс молекула может сместиться на 8-10 ангстрем. Время жизни локального окружения тоже невелико. Области, составленные из молекул с близкими значениями объёма многогранника Вороного, могут распасться за 0,5 пс, а могут жить и несколько пикосекунд. А вот распределение времён жизни водородных связей очень велико. Но это время не превышает 40 пс, а среднее значение — несколько пс.
В заключение следует подчеркнуть, что теория кластерного строения воды имеет много подводных камней. Например, Зенин предполагает, что основной структурный элемент воды — кластер из 57 молекул, образованный слиянием четырёх додекаэдров. Они имеют общие грани, а их центры образуют правильный тетраэдр. То, что молекулы воды могут располагаться по вершинам пентагонального додекаэдра, известно давно; такой додекаэдр — основа газовых гидратов. Поэтому ничего удивительного в предположении о существовании таких структур в воде нет, хотя уже говорилось, что никакая конкретная структура не может быть преобладающей и существовать долго. Поэтому странно, что этот элемент предполагается главным и что в него входит ровно 57 молекул. Из шариков, например, можно собирать такие же структуры, которые состоят из примыкающих друг к другу додекаэдров и содержат 200 молекул. Зенин же утверждает, что процесс трёхмерной полимеризации воды останавливается на 57 молекулах. Более крупных ассоциатов, по его мнению, быть не должно. Однако если бы это было так, из водяного пара не могли бы осаждаться кристаллы гексагонального льда, которые содержат огромное число молекул, связанных воедино водородными связями.
Например, Зенин предполагает, что основной структурный элемент воды — кластер из 57 молекул, образованный слиянием четырёх додекаэдров. Они имеют общие грани, а их центры образуют правильный тетраэдр. То, что молекулы воды могут располагаться по вершинам пентагонального додекаэдра, известно давно; такой додекаэдр — основа газовых гидратов. Поэтому ничего удивительного в предположении о существовании таких структур в воде нет, хотя уже говорилось, что никакая конкретная структура не может быть преобладающей и существовать долго. Поэтому странно, что этот элемент предполагается главным и что в него входит ровно 57 молекул. Из шариков, например, можно собирать такие же структуры, которые состоят из примыкающих друг к другу додекаэдров и содержат 200 молекул. Зенин же утверждает, что процесс трёхмерной полимеризации воды останавливается на 57 молекулах. Более крупных ассоциатов, по его мнению, быть не должно. Однако если бы это было так, из водяного пара не могли бы осаждаться кристаллы гексагонального льда, которые содержат огромное число молекул, связанных воедино водородными связями. Совершенно неясно, почему рост кластера Зенина остановился на 57 молекулах. Чтобы уйти от противоречий, Зенин и упаковывает кластеры в более сложные образования — ромбоэдры — из почти тысячи молекул, причём исходные кластеры друг с другом водородных связей не образуют. Почему? Чем молекулы на их поверхности отличаются от тех, что внутри? По мнению Зенина, узор гидроксильных групп на поверхности ромбоэдров и обеспечивает память воды. Следовательно, молекулы воды в этих крупных комплексах жёстко фиксированы, и сами комплексы представляют собой твёрдые тела. Такая вода не будет течь, а температура её плавления, которая связана с молекулярной массой, должна быть весьма высокой.
Совершенно неясно, почему рост кластера Зенина остановился на 57 молекулах. Чтобы уйти от противоречий, Зенин и упаковывает кластеры в более сложные образования — ромбоэдры — из почти тысячи молекул, причём исходные кластеры друг с другом водородных связей не образуют. Почему? Чем молекулы на их поверхности отличаются от тех, что внутри? По мнению Зенина, узор гидроксильных групп на поверхности ромбоэдров и обеспечивает память воды. Следовательно, молекулы воды в этих крупных комплексах жёстко фиксированы, и сами комплексы представляют собой твёрдые тела. Такая вода не будет течь, а температура её плавления, которая связана с молекулярной массой, должна быть весьма высокой.
Какие свойства воды объясняет модель Зенина? Поскольку в основе модели лежат тетраэдрические постройки, её можно в той или иной степени согласовать с данными по дифракции рентгеновских лучей и нейтронов. Однако вряд ли модель может объяснить уменьшение плотности при плавлении — упаковка додекаэдров менее плотная, чем лёд. Но труднее всего согласуется модель с динамическими свойствами — текучестью, большим значением коэффициента самодиффузии, малыми временами корреляции и диэлектрической релаксации, которые измеряются пикосекундами.
Но труднее всего согласуется модель с динамическими свойствами — текучестью, большим значением коэффициента самодиффузии, малыми временами корреляции и диэлектрической релаксации, которые измеряются пикосекундами.
К.х.н. О.В. Мосин
Cписок литературы:
Г.Г. Маленков. Успехи физической химии, 2001
С.В.Зенин, Б.М. Полануер, Б.В. Тяглов. Экспериментальное доказательство наличия фракций воды. Ж. Гомеопатическая медицина и акупунктура. 1997.№2.С.42-46.
С.В. Зенин, Б.В. Тяглов. Гидрофобная модель структуры ассоциатов молекул воды. Ж.Физ.химии.1994.Т.68.№4.С.636-641.
С.В. Зенин Исследование структуры воды методом протонного магнитного резонанса. Докл.РАН.1993.Т.332.№3.С.328-329.
С.В.Зенин, Б.В.Тяглов. Природа гидрофобного взаимодействия. Возникновение ориентационных полей в водных растворах. Ж.Физ.химии.1994.Т.68.№3.С.500-503.
С.В. Зенин, Б.В. Тяглов, Г.Б.Сергеев, З.А. Шабарова. Исследование внутримолекулярных взаимодействий в нуклеотидамидах методом ЯМР. Материалы 2-й Всесоюзной конф. По динамич. Стереохимии. Одесса.1975.с.53.
Материалы 2-й Всесоюзной конф. По динамич. Стереохимии. Одесса.1975.с.53.
С.В. Зенин. Структурированное состояние воды как основа управления поведением и безопасностью живых систем. Диссертация. Доктор биологических наук. Государственный научный Центр «Институт медико-биологических проблем» (ГНЦ «ИМБП»). Защищена 1999. 05. 27. УДК 577.32:57.089.001.66.207 с.
В.И. Слесарев. Отчет о выполнении НИР по теме: «Воздействие фрактально-матричных транспарантов «Айрес» на характеристики структурно-информационного свойства воды». Санкт-Петербург. 2002.
С.В. Зенин, М.Ф.Меркулов, Д.Г. Мирза. Исследование медико-биологических свойств матричных аппликаторов «Айрес». Результаты апробации матричных аппликаторов «Айрес». СПб,2000.с.14-21.
Масару Эмото. Послания воды: Тайные коды кристаллов льда. Перев. с англ. М. ООО Издательский дом «София».2005.
Резников К.М. Вода жизни //Прикладные информационные аспекты медицины. – 2001. – Т.4. — №2. С.3-10.
О.В. Мосин, Д.А. Складнев, В.И. Швец. Биотехнология, Исследование физиологической адаптации бактерий к тяжёлой воде. 2001 г.
Биотехнология, Исследование физиологической адаптации бактерий к тяжёлой воде. 2001 г.
Галерея — картинки кластеров воды, полученных компъютерным моделированием
Структура воды: свойства
Версия для печати
Структура воды: свойства
Исследования показали, что кластеризация молекул воды в растворах происходит за счет так называемых водородных связей (слабое взаимодействие), которые составляют около 10% прочность ковалентной связи с водой. Это немаловажно, и для разрыва связей требуется энергия, или она выделяется при образовании водородных связей. Такие связи не являются постоянными, и происходит постоянный разрыв и восстановление связей, которые, по оценкам, длятся несколько триллионных долей секунды. Тем не менее, большая часть молекул воды в любой момент времени связана в растворе. Но эта структура приводит к другим важным свойствам воды.
В рамках данного курса мы рассмотрим только шесть из этих важных свойств:
- Теплоемкость
- Скрытая теплота (плавления и испарения)
- Тепловое расширение и плотность
- Поверхностное натяжение
- Точки замерзания и кипения
- Свойства растворителя
Как упоминалось выше, эти свойства важны для физических и биологических процессов на Земле. По сути, большое количество воды сдерживает изменения окружающей среды на поверхности Земли, а это означает, что изменения температуры поверхности Земли, например, относительно незначительны. Таким образом, высокая теплоемкость воды способствует непрерывности жизни на Земле, поскольку вода охлаждается/нагревается медленно по сравнению с сушей, способствуя сохранению и переносу тепла, сводя к минимуму экстремальные температуры и помогая поддерживать постоянную температуру тела в организмах. Однако есть и другие эффекты свойств воды. Его низкая вязкость позволяет быстрому потоку выравнивать перепады давления. Его высокое поверхностное натяжение позволяет передавать энергию ветра на поверхность моря, способствуя нисходящему смешиванию кислорода в больших водоемах, таких как океан. Кроме того, это высокое поверхностное натяжение помогает отдельным клеткам в организме сохранять свою форму и контролировать поведение при падении (вы видели «Жизнь муравья»?). Кроме того, высокая скрытая теплота испарения очень важна для переноса тепла/воды в атмосфере и является существенной составляющей переноса тепла из низких широт, где приток солнечной энергии более интенсивен, в высокие широты, испытывающие дефицит солнечной энергии.
По сути, большое количество воды сдерживает изменения окружающей среды на поверхности Земли, а это означает, что изменения температуры поверхности Земли, например, относительно незначительны. Таким образом, высокая теплоемкость воды способствует непрерывности жизни на Земле, поскольку вода охлаждается/нагревается медленно по сравнению с сушей, способствуя сохранению и переносу тепла, сводя к минимуму экстремальные температуры и помогая поддерживать постоянную температуру тела в организмах. Однако есть и другие эффекты свойств воды. Его низкая вязкость позволяет быстрому потоку выравнивать перепады давления. Его высокое поверхностное натяжение позволяет передавать энергию ветра на поверхность моря, способствуя нисходящему смешиванию кислорода в больших водоемах, таких как океан. Кроме того, это высокое поверхностное натяжение помогает отдельным клеткам в организме сохранять свою форму и контролировать поведение при падении (вы видели «Жизнь муравья»?). Кроме того, высокая скрытая теплота испарения очень важна для переноса тепла/воды в атмосфере и является существенной составляющей переноса тепла из низких широт, где приток солнечной энергии более интенсивен, в высокие широты, испытывающие дефицит солнечной энергии.
Видео: Вода — жидкость Потрясающе: ускоренный курс биологии №2 (11:16)
Потратьте несколько минут, чтобы узнать, почему вода — самое интересное и важное вещество во Вселенной.
Вода — жидкость Потрясающе: ускоренный курс биологии №2
Нажмите здесь, чтобы просмотреть стенограмму видеоролика «Вода — жидкость». вся наша планета Земля, которая встречается в природе в твердой, жидкой и газообразной формах, и чтобы отпраздновать эту волшебную связь между двумя атомами водорода и одним атомом кислорода здесь, сегодня мы собираемся отпраздновать чудесные поддерживающие жизнь свойства воды, но мы собираемся сделайте это чуть более одетым. Намного лучше.
Мы остановились здесь, на ускоренном курсе биологии, мы говорим о жизни и о довольно важном факте, что вся жизнь, какой мы ее знаем, зависит от того, есть ли вокруг вода. выяснить, есть ли жизнь где-то еще, потому что вы знаете, что это самый важный вопрос, который у нас есть прямо сейчас, я был очень взволнован, когда они находят воду где-то особенно в жидкой воде, и это одна из причин, почему я и многие другие люди в декабре прошлого года, когда семилетний марсоход Opportunity обнаружил на Марсе 20-дюймовую жилу гипса, которая почти наверняка была отложена, как долгоживущая жидкая вода на поверхности Марса, и это было, вероятно, миллиарды лет назад. . И поэтому будет трудно сказать, привела ли вода, которая была там, к какой-то жизни, но, возможно, мы сможем понять это, и это было бы действительно интересно. Но почему мы думаем, что вода необходима для жизни? Почему вода на других планетах нас так чертовски волнует?
выяснить, есть ли жизнь где-то еще, потому что вы знаете, что это самый важный вопрос, который у нас есть прямо сейчас, я был очень взволнован, когда они находят воду где-то особенно в жидкой воде, и это одна из причин, почему я и многие другие люди в декабре прошлого года, когда семилетний марсоход Opportunity обнаружил на Марсе 20-дюймовую жилу гипса, которая почти наверняка была отложена, как долгоживущая жидкая вода на поверхности Марса, и это было, вероятно, миллиарды лет назад. . И поэтому будет трудно сказать, привела ли вода, которая была там, к какой-то жизни, но, возможно, мы сможем понять это, и это было бы действительно интересно. Но почему мы думаем, что вода необходима для жизни? Почему вода на других планетах нас так чертовски волнует?
Итак, давайте начнем с изучения удивительных свойств воды. Чтобы сделать это, нам придется начать с этой самой популярной в мире молекулы или, по крайней мере, самой запоминающейся молекулы в мире, мы все знаем о ней, старой доброй воде. Два атома водорода один кислород каждый водород делит электрон с кислородом в том, что мы называем ковалентной связью. Итак, как вы можете видеть, вы нарисовали мою молекулу воды особым образом, и на самом деле она выглядит именно так, как будто она имеет форму буквы V, потому что этот большой атом кислорода немного более жаден к электронам. Она имеет небольшой отрицательный заряд, в то время как эта область с атомами водорода имеет небольшой положительный заряд, благодаря этой полярности все молекулы воды настолько сильно притягиваются друг к другу, что фактически слипаются, и это называется водородными связями, и мы говорили о них. в последний раз, по сути, происходит то, что положительный полюс вокруг этих атомов водорода связывается с отрицательным полюсом вокруг атомов кислорода другой молекулы воды, и поэтому это слабая связь, но посмотрите, они связаны серьезно, я не могу переоценить важность этой водородной связи. поэтому, когда ваш учитель спросит вас, что важно в воде, начните с водородных связей, и вы должны поместить ее во все промежутки и, возможно, несколько блесток вокруг нее.
Два атома водорода один кислород каждый водород делит электрон с кислородом в том, что мы называем ковалентной связью. Итак, как вы можете видеть, вы нарисовали мою молекулу воды особым образом, и на самом деле она выглядит именно так, как будто она имеет форму буквы V, потому что этот большой атом кислорода немного более жаден к электронам. Она имеет небольшой отрицательный заряд, в то время как эта область с атомами водорода имеет небольшой положительный заряд, благодаря этой полярности все молекулы воды настолько сильно притягиваются друг к другу, что фактически слипаются, и это называется водородными связями, и мы говорили о них. в последний раз, по сути, происходит то, что положительный полюс вокруг этих атомов водорода связывается с отрицательным полюсом вокруг атомов кислорода другой молекулы воды, и поэтому это слабая связь, но посмотрите, они связаны серьезно, я не могу переоценить важность этой водородной связи. поэтому, когда ваш учитель спросит вас, что важно в воде, начните с водородных связей, и вы должны поместить ее во все промежутки и, возможно, несколько блесток вокруг нее. Когезия поверхностного натяжения — это притяжение между такими вещами, как притяжение между одной молекулой воды и другой молекулой воды. самое высокое сцепление любой неметаллической жидкости, и вы можете увидеть это, если налейте немного воды на вощеную бумагу, или на тефлон, или на что-то еще, где вода собирается в бусинки, вот так некоторые листья растений делают это очень хорошо. Это довольно круто, так как вода слабо прилипает к вощеной бумаге или к растению, но сильно прилипает к самой себе, молекулы воды удерживают эти капли вместе в конфигурации, которая создает наименьшую площадь поверхности. Именно это высокое поверхностное натяжение позволяет некоторым жукам и даже мне подумайте, что одна ящерица, а также один Иисус могут ходить по тому, что Кюи силы воды делает в своих пределах.
Когезия поверхностного натяжения — это притяжение между такими вещами, как притяжение между одной молекулой воды и другой молекулой воды. самое высокое сцепление любой неметаллической жидкости, и вы можете увидеть это, если налейте немного воды на вощеную бумагу, или на тефлон, или на что-то еще, где вода собирается в бусинки, вот так некоторые листья растений делают это очень хорошо. Это довольно круто, так как вода слабо прилипает к вощеной бумаге или к растению, но сильно прилипает к самой себе, молекулы воды удерживают эти капли вместе в конфигурации, которая создает наименьшую площадь поверхности. Именно это высокое поверхностное натяжение позволяет некоторым жукам и даже мне подумайте, что одна ящерица, а также один Иисус могут ходить по тому, что Кюи силы воды делает в своих пределах.
Конечно, есть и другие вещества, к которым вода прилипает. Возьмем, к примеру, стекло, это называется адгезией, и вода здесь растекается, а не бьется, потому что силы сцепления между водой и стеклом сильнее, чем силы сцепления отдельных молекул воды в капле воды. Адгезия — это притяжение между водой и стеклом. два разных вещества, так что в этом случае молекулы воды и молекулы стекла эти свойства приводят к одной из моих любимых вещей в воде — тому факту, что она может бросить вызов гравитации. Эта действительно крутая вещь, которая только что произошла, называется капиллярным действием, и ее можно легко объяснить тем, что мы теперь знаем о когезии и адгезии, благодаря адгезии молекулы воды притягиваются к молекулам в соломинке, но когда молекулы воды прилипают к соломинке. другие молекулы втягиваются за счет когезии вслед за другими молекулами воды, благодаря когезии, поверхностное натяжение, созданное здесь, заставляет воду подниматься вверх по соломинке, и она будет продолжать подниматься до тех пор, пока в конечном итоге гравитация не потянет вниз вес воды, и соломинка не преодолеет силу. поверхностное натяжение. Тот факт, что вода является полярной молекулой, также делает ее действительно хорошей растворяющей жидкостью.
Адгезия — это притяжение между водой и стеклом. два разных вещества, так что в этом случае молекулы воды и молекулы стекла эти свойства приводят к одной из моих любимых вещей в воде — тому факту, что она может бросить вызов гравитации. Эта действительно крутая вещь, которая только что произошла, называется капиллярным действием, и ее можно легко объяснить тем, что мы теперь знаем о когезии и адгезии, благодаря адгезии молекулы воды притягиваются к молекулам в соломинке, но когда молекулы воды прилипают к соломинке. другие молекулы втягиваются за счет когезии вслед за другими молекулами воды, благодаря когезии, поверхностное натяжение, созданное здесь, заставляет воду подниматься вверх по соломинке, и она будет продолжать подниматься до тех пор, пока в конечном итоге гравитация не потянет вниз вес воды, и соломинка не преодолеет силу. поверхностное натяжение. Тот факт, что вода является полярной молекулой, также делает ее действительно хорошей растворяющей жидкостью.
Это хороший растворитель, заметьте, что вода не очень хороший растворитель, это потрясающий растворитель! Есть больше веществ, которые можно растворить в воде, чем в любой другой жидкости на Земле, и да, это включает в себя самую сильную кислоту, которую мы когда-либо создавали. Эти вещества, которые растворяются в воде, — это сахар или соль, и те, с которыми мы знакомы, называются гидрофильными. и они гидрофильны, потому что они полярны, а их полярность сильнее, чем силы сцепления стенки, поэтому, когда вы помещаете одно из этих полярных веществ в воду, оно достаточно сильное, чтобы разрушить все небольшие силы сцепления. Все эти маленькие водородные связи, и вместо водородных связей друг с другом вода будет водородной связью вокруг этих полярных веществ. Поваренная соль является ионом, и прямо сейчас она разделяется на ионы, поскольку полюса наших молекул воды взаимодействуют с ней, но что происходит, когда есть молекула, которая не может разрушить силы сцепления воды, она не может проникнуть в нее и проникнуть в нее, в основном, что происходит, когда это вещество не может преодолеть сильные силы сцепления воды и не может проникнуть внутрь воды? Вот и получается то, что мы называем гидрофобным веществом или будто бы чем-то, что боится воды.
Эти вещества, которые растворяются в воде, — это сахар или соль, и те, с которыми мы знакомы, называются гидрофильными. и они гидрофильны, потому что они полярны, а их полярность сильнее, чем силы сцепления стенки, поэтому, когда вы помещаете одно из этих полярных веществ в воду, оно достаточно сильное, чтобы разрушить все небольшие силы сцепления. Все эти маленькие водородные связи, и вместо водородных связей друг с другом вода будет водородной связью вокруг этих полярных веществ. Поваренная соль является ионом, и прямо сейчас она разделяется на ионы, поскольку полюса наших молекул воды взаимодействуют с ней, но что происходит, когда есть молекула, которая не может разрушить силы сцепления воды, она не может проникнуть в нее и проникнуть в нее, в основном, что происходит, когда это вещество не может преодолеть сильные силы сцепления воды и не может проникнуть внутрь воды? Вот и получается то, что мы называем гидрофобным веществом или будто бы чем-то, что боится воды.
Эти молекулы не имеют заряженных полюсов они неполярны и не растворяются в воде, потому что по существу они выталкиваются из воды силами сцепления воды воду мы можем назвать универсальным растворителем но это не значит что она растворяет все что есть В истории было много эксцентричных ученых, но все эти разговоры о воде заставили меня задуматься о, пожалуй, самом эксцентричном из эксцентриков человеке по имени Генри Кавендиш, он общался со своими служанками только с помощью записок и добавил лестницу к задней части своего дома, чтобы избегать контакта с его домработницей. Некоторые считают, что он, возможно, страдал от формы аутизма, но почти каждый признает, что он был научным гением. Его лучше всего помнят как первого человека, распознавшего газообразный водород как отдельное вещество и определившего состав воды в 1700-х годах. Большинство людей думали, что вода сама по себе является элементом, но Кавендиш заметил, что водород, который он назвал горючим воздухом, реагировал с кислородом, известным тогда как Устрашающее название размораживания закрытого воздуха для образования воды. Кавендиш не совсем понял, что он здесь открыл, отчасти потому, что он не верил в химические соединения. Он объяснил свои эксперименты с водородом с точки зрения огнеподобного элемента, называемого флогистоном. гравитация в основном сравнительная плотность водорода и других газов по отношению к обычному воздуху это особенно впечатляет, если учесть грубые инструменты, с которыми он работал, например, это то, с чем он делал свой газообразный водород, он продолжал не только устанавливать точный состав атмосферу, но и открыл плотность земли неплохо для парня, который был настолько болезненно застенчив, что единственный существующий его портрет был нарисован без его ведома, так что за все его десятилетия экспериментов было опубликовано всего около 20 работ в годы после его Исследователи смерти выяснили, что Кавендиш на самом деле открыл закон Рихтера, закон Ома, закон Кулона и несколько других законов.
Некоторые считают, что он, возможно, страдал от формы аутизма, но почти каждый признает, что он был научным гением. Его лучше всего помнят как первого человека, распознавшего газообразный водород как отдельное вещество и определившего состав воды в 1700-х годах. Большинство людей думали, что вода сама по себе является элементом, но Кавендиш заметил, что водород, который он назвал горючим воздухом, реагировал с кислородом, известным тогда как Устрашающее название размораживания закрытого воздуха для образования воды. Кавендиш не совсем понял, что он здесь открыл, отчасти потому, что он не верил в химические соединения. Он объяснил свои эксперименты с водородом с точки зрения огнеподобного элемента, называемого флогистоном. гравитация в основном сравнительная плотность водорода и других газов по отношению к обычному воздуху это особенно впечатляет, если учесть грубые инструменты, с которыми он работал, например, это то, с чем он делал свой газообразный водород, он продолжал не только устанавливать точный состав атмосферу, но и открыл плотность земли неплохо для парня, который был настолько болезненно застенчив, что единственный существующий его портрет был нарисован без его ведома, так что за все его десятилетия экспериментов было опубликовано всего около 20 работ в годы после его Исследователи смерти выяснили, что Кавендиш на самом деле открыл закон Рихтера, закон Ома, закон Кулона и несколько других законов. законов, это много чертовых законов, и если бы он получил признание за них все, нам пришлось бы иметь дело с восьмым недостатком Кавендиша и четвертым законом Кавендиша. Так что я лично рад, что он на самом деле не получил кредит.
законов, это много чертовых законов, и если бы он получил признание за них все, нам пришлось бы иметь дело с восьмым недостатком Кавендиша и четвертым законом Кавендиша. Так что я лично рад, что он на самом деле не получил кредит.
Прямо сейчас мы проведем удивительную науку, вы, ребята, не поверите, хорошо, вы готовы, она летает. Да, я знаю, что вы не удивлены этим, но вы должны быть удивлены, потому что все остальное, когда оно твердое, гораздо более плотное, чем когда оно жидкое, точно так же, как газы намного менее плотны, чем жидкости, но та простая характеристика воды, что она плавает в твердой форме, одна из причин, почему жизнь на этой планете, какой мы ее знаем, возможна, и почему твердая вода менее плотна, чем жидкая вода, в то время как все остальное является полной противоположностью этому. Что ж, вы можете еще раз поблагодарить свои водородные связи, так что при температуре около 32 градусов по Фаренгейту или нулю градусов по Цельсию, если вы ученый или из той части мира, где все имеет смысл, молекулы воды начинают затвердевать, и образуются водородные связи в этих молекулах воды. кристаллические структуры, которые распределяют молекулы более равномерно, что в свою очередь делает замороженную воду менее плотной, чем ее жидкая форма, поэтому почти во всех случаях плавающий водяной лед — это действительно хорошо, если я клянусь, что он плотнее воды, он замерзнет, а затем утонет, а затем замерзнет, чем утонет чем замерзнуть, чем утонуть, так что просто поверьте мне в этом, вы не хотите жить в мире, где я тону, это не только нанесет полный ущерб водным экосистемам, которые в основном являются тем, как жизнь сформировалась на земле, в первую очередь, это также Вы знаете, что весь лед и Северный полюс утонут, а затем вся вода повсюду поднимется, и у нас не будет земли, которая будет раздражать.
кристаллические структуры, которые распределяют молекулы более равномерно, что в свою очередь делает замороженную воду менее плотной, чем ее жидкая форма, поэтому почти во всех случаях плавающий водяной лед — это действительно хорошо, если я клянусь, что он плотнее воды, он замерзнет, а затем утонет, а затем замерзнет, чем утонет чем замерзнуть, чем утонуть, так что просто поверьте мне в этом, вы не хотите жить в мире, где я тону, это не только нанесет полный ущерб водным экосистемам, которые в основном являются тем, как жизнь сформировалась на земле, в первую очередь, это также Вы знаете, что весь лед и Северный полюс утонут, а затем вся вода повсюду поднимется, и у нас не будет земли, которая будет раздражать.
Есть еще одно удивительное свойство воды, о котором я забыл, так почему здесь так жарко. О, теплоемкость, да, у воды очень высокая теплоемкость, и, вероятно, это ничего не значит для вас, но в основном это означает, что вода действительно хорошо удерживает тепло, поэтому мы любим класть грелки в нашу кровать и с ними, когда мы вы одиноки, но кроме того, что вы искусственно согреваете свою постель, также очень важно, что океаны трудно нагревать и охлаждать, они становятся гигантскими поглотителями тепла, которые регулируют температуру и климат нашей планеты, поэтому, например, это намного приятнее. в Лос-Анджелесе, где температура океана постоянно держится на одном уровне, и, скажем, в Небраске в меньшем масштабе, мы можем очень легко и визуально увидеть высокую теплоемкость воды, поставив кастрюлю без воды на плиту и увидев, как плохо это проходит, но затем вы добавляете в него немного воды, и он кипит, черт возьми, целую вечность, о, и если вы еще этого не заметили, или когда вода испаряется с вашей кожи, она охлаждает вас теперь, это принцип за потоотделением, которое является чрезвычайно эффективной, хотя и несколько смущающей частью жизни, но это пример еще одной невероятно крутой вещи о воде, когда мое тело нагревается, и оно потеет, что тепло возбуждает некоторые молекулы воды на моей коже до такой степени, что они ломаются эти водородные связи и они испаряются, и когда они убегают, они забирают эту тепловую энергию с собой, оставляя меня прохладнее, прекрасно, это не было упражнением, хотя я не знаю, почему так сильно потею, это может быть пульверизатор, которым я продолжаю опрыскивать себя она, может быть, это просто потому, что это такое предприятие с высоким уровнем стресса, пытающееся научить вас людям вещам, я думаю, мне нужно немного воды, но пока я пью, а есть обзор всех вещей, о которых мы говорили сегодня, если у вас есть пара вещи, в которых вы не совсем уверены, просто вернитесь и посмотрите их, это не займет у вас много времени, и вы станете умнее.
в Лос-Анджелесе, где температура океана постоянно держится на одном уровне, и, скажем, в Небраске в меньшем масштабе, мы можем очень легко и визуально увидеть высокую теплоемкость воды, поставив кастрюлю без воды на плиту и увидев, как плохо это проходит, но затем вы добавляете в него немного воды, и он кипит, черт возьми, целую вечность, о, и если вы еще этого не заметили, или когда вода испаряется с вашей кожи, она охлаждает вас теперь, это принцип за потоотделением, которое является чрезвычайно эффективной, хотя и несколько смущающей частью жизни, но это пример еще одной невероятно крутой вещи о воде, когда мое тело нагревается, и оно потеет, что тепло возбуждает некоторые молекулы воды на моей коже до такой степени, что они ломаются эти водородные связи и они испаряются, и когда они убегают, они забирают эту тепловую энергию с собой, оставляя меня прохладнее, прекрасно, это не было упражнением, хотя я не знаю, почему так сильно потею, это может быть пульверизатор, которым я продолжаю опрыскивать себя она, может быть, это просто потому, что это такое предприятие с высоким уровнем стресса, пытающееся научить вас людям вещам, я думаю, мне нужно немного воды, но пока я пью, а есть обзор всех вещей, о которых мы говорили сегодня, если у вас есть пара вещи, в которых вы не совсем уверены, просто вернитесь и посмотрите их, это не займет у вас много времени, и вы станете умнее. Я обещаю, что ты так хорошо справишься с этим тестом, что ты либо не сдашь, либо подойдешь к нему хорошо, пока
Я обещаю, что ты так хорошо справишься с этим тестом, что ты либо не сдашь, либо подойдешь к нему хорошо, пока
Кредит: Ускоренный курс
‹ Конфигурация молекулы воды
вверх
Теплоемкость ›
Свойства воды — Уроки Византа
Автор: Сара В.
Вода встречается повсюду в природе и является необходимым компонентом почти всех органических
реакций. Это самое распространенное соединение на поверхности планеты. Большая часть воды на Земле
— это морская вода, а вода также присутствует в виде твердого льда и невидимых газообразных облаков. Вся жизнь на Земле
требует воды, чтобы выжить, и предполагается, что внеземная вода может быть признаком жизни (или, по крайней мере,
предшественником жизни) где-то еще во Вселенной. Наряду с обеспечением жизни вода оказывает влияние на неживые объекты, например, на выветривание и эрозию горных пород и почвы. Вода также действует как поглотитель тепла, поглощая избыточное тепло и защищая температуру Земли от экстремальных изменений. Вода является жизненно важной частью любой живой системы, от всей среды обитания до отдельных клеток. Так что же такое вода?
Вода является жизненно важной частью любой живой системы, от всей среды обитания до отдельных клеток. Так что же такое вода?
Химические свойства воды
Вода (также известная как H 2 O) представляет собой полярное химическое соединение, содержащее один атом кислорода (O) и два атома водорода (H) (как показано на первом рисунке). Эти три атома связаны вместе ковалентными связями, что означает, что они делят свои пары валентных или внешних электронов вместе. Каждый атом водорода отдельно связан с центральным атомом кислорода, а кислород также имеет две пары неподеленных электронов, что дает одной молекуле воды в общей сложности четыре общих и четыре неподеленных валентных электрона. Молекулы воды имеют изогнутую форму с углом 104,45° между двумя атомами водорода.
Несмотря на общие электроны, молекулы воды полярны, потому что валентные электроны
распределены неравномерно между атомами кислорода и водорода. Кислород имеет большую электроотрицательность
, чем водород, а это означает, что он сильно притягивает электроны, поэтому он сильнее притягивает общие
электроны и удерживает их ближе к себе. Это создает дипольный момент, то есть два электрических полюса. Это
Это создает дипольный момент, то есть два электрических полюса. Это
неравное распределение электронов означает, что отрицательные заряды электронов сгруппированы на кислородном конце 9-го атома.0061, оставляя водородный конец молекулы частично положительным, а кислородный конец
частично отрицательным. Полярность воды приводит к тому, что она прилипает ко многим другим веществам, что делает
отличным растворителем.
Полярные вещества хорошо растворяются в воде, поскольку «подобное растворяется в подобном», но неполярные
растворяются не так легко (или вообще не растворяются). Типичным примером такой растворимости является растворение поваренной соли (NaCl) в воде с образованием Na + и Cl – , окруженные молекулами воды, причем их положительные и отрицательные полюса ориентированы к ионам или от них в зависимости от заряда иона. Когда полярное растворенное вещество, такое как соль, растворяется в положительных и отрицательных ионах, молекулы воды ориентируются, окружая отдельные ионы, и направляют свои соответствующие полюса на ион в зависимости от его заряда; отрицательные полюса воды указывают на положительные ионы и наоборот.
При смешивании неполярного вещества с водой оно не растворяется, а остается в комках
вместе и по возможности отдельно от молекул воды. Вот почему вода и масло остаются отдельными при смешивании. Вода является хорошим растворителем гидрофильных веществ, таких как соли, в то время как
плохо растворяет гидрофобные вещества, такие как жиры и масла. Вещество не может растворяться в воде, если его притяжение к молекулам воды не превышает их притяжения друг к другу; он
разрушает межмолекулярные связи воды, не заменяя их, и поэтому энергетически
неблагоприятный. Гидрофильное растворенное вещество, напротив, быстро окружается молекулами воды и образует с ними
новых тонких связей.
Вода является амфотерным соединением, что означает, что она может действовать как основание или кислота в химической реакции
. Это позволяет ему участвовать в большом количестве реакций как в лаборатории, так и в природе. Вода также плохо поддается сжатию, а это означает, что ее (как жидкость) нельзя легко сжать в
меньший объем. Эти различные свойства воды очень важны в жизни Земли и в
Эти различные свойства воды очень важны в жизни Земли и в
жизнь отдельных организмов.
Физические свойства воды
Вода является жидкостью при стандартной температуре и давлении, но также встречается в природе в виде твердой
(замороженной) и газообразной фаз. Температура кипения воды (точка, при которой она переходит из жидкого состояния в газообразное или наоборот) равна 100 °С, а точка замерзания (при которой вода переходит из жидкого состояния в твердое или наоборот) равна 0 °С. Вода обладает высокой теплоемкостью, что означает, что она может поглощать большое количество энергии без значительного повышения ее температуры. Вода также имеет относительно высокую температуру кипения по сравнению с температурами кипения аналогичных соединений, а это означает, что в воду необходимо вложить больше энергии, чтобы разделить молекулы и превратить ее из жидкости в газ. Эти два свойства обусловлены его многочисленными межмолекулярными водородными связями (обсуждается ниже в параграфе «Особые свойства»). 0003
0003
В чистом виде вода не имеет вкуса и запаха, однако вода является универсальным растворителем и поэтому
часто встречается с растворенными в ней веществами, меняющими свои физические характеристики. Минералы
и другие примеси придают бутилированной воде ее вкус, а присутствие растворенных веществ придает воде
способность хорошо проводить электричество. Если бы в воде не было растворенных ионов, она была бы плохим проводником
электричества. Однако никакая вода не может быть полностью свободной от ионов, и даже в отсутствие растворенного вещества она может автоматически очищаться.0061 ионизируются с образованием отрицательных гидроксид-анионов (OH – ) и положительных катионов гидроксония (H 3 O + ). Эти ионы позволяют воде проводить некоторое количество электричества, даже если она чистая или «деионизированная». Электропроводность воды, а также ее способность растворять гидрофильные вещества имеют большое значение в химии и биологических науках.
Особые свойства воды
Многие особые свойства воды обусловлены водородными связями. Благодаря их атомной
состава и молекулярной формы, молекулы воды могут притягиваться друг к другу посредством водородных связей
. Эта слабая связь возникает, когда атом водорода, ковалентно связанный с более электроотрицательным атомом
, затем кратковременно электрически притягивается ко второму сильно электроотрицательному атому другой отдельной молекулы
. Водород действует как липкое, привлекательное арахисовое масло между двумя кусками электроотрицательного хлеба
. Это сближает две молекулы благодаря двойному притяжению водорода. Таким образом, молекулы воды работают как крошечные магниты, их частично положительные и отрицательные полюса
взаимодействуют друг с другом через водородные связи. Молекулы воды могут образовывать до четырех водородных связей каждая,
создавая локальную тетраэдрическую структуру из пяти молекул воды, связанных водородными связями (как видно на втором рисунке
). Водородные связи придают воде сцепление и поверхностное натяжение, позволяя ей цепляться друг за друга . Он
Водородные связи придают воде сцепление и поверхностное натяжение, позволяя ей цепляться друг за друга . Он
также сильно влияет на замерзание и плотность воды.
Плотность жидкой воды составляет примерно 1 грамм на кубический сантиметр (1 г/см 3 .) В отличие от большинства веществ, вода в жидкой фазе более плотная, чем в твердой фазе; это связано с тем, что молекулы воды образуют рыхлую гексагональную кристаллическую структуру по мере того, как они охлаждаются и замерзают вместе, запирая их в расширенной и менее плотной форме, чем их свободно движущаяся жидкая форма. При замораживании временные водородные связи между молекулами стабилизируются, создавая решетку из молекул воды, слегка отстоящих друг от друга. Из-за этой разницы в плотности твердый лед может плавать в жидкой воде. Благодаря этому свойству, а также высокой теплоемкости воды (хорошая теплоизоляция) озера и пруды на Земле медленно замерзают сверху вниз и редко полностью замерзают, что позволяет организмам в незамерзшей воде пережить зиму.
