|
Строение молекулы воды и ее агрегатное состояние. Свойства, в том числе аномальной природной воды Модель строения воды Молекула воды включает два атома водорода (Н) и один атом кислорода (О). Элементы, из которых состоит жидкость, определяют всю функциональность и особенности. Модель молекулы воды имеет форму треугольника. Вершину этой геометрической фигуры представляет крупный элемент кислорода, а внизу находятся небольшие атомы водорода.
Молекула воды обладает двумя положительными и двумя отрицательными полюсами зарядов. Отрицательные заряды формируются из-за излишка электронной плотности у атомов кислорода, а положительные – из-за нехватки электронной плотности у водорода.
Неравномерное распределение электрических зарядов создает диполе, где диполярный момент составляет 1,87 дебай. Вода обладает способностью растворять вещества, поскольку ее молекулы пытаются нейтрализовать электрическое поле.
Вода отличает большой устойчивостью при растворении прочих соединений. В обычных условиях из 1 млрд молекул только 2 распадаются, а протон переходит в строение иона гидроксония (образуется при растворении кислот).
Вода не меняет свой состав при взаимодействии с другими веществами и не влияет на структуру этих соединений. Такая жидкость считается инертным растворителем, что особо важно для живых организмов. Полезные вещества поступают к различным органам через водные растворы, поэтому важно, чтобы их состав и свойства оставались неизменными. Вода сохраняет в себе память о растворенных в ней веществах и может применяться многократно. Каковы особенности пространственной организации молекулы воды:
Соединение проводится противоположными зарядами; Появляются межмолекулярные водородные связи, которые исправляют электронную неполноценность водорода с помощью дополнительной молекулы; Вторая молекула фиксирует водород по отношению к кислороду; Благодаря этому образуются четыре водородные связи, которые могут контактировать с 4 соседями; Такая модель напоминает бабочку и имеет углы равные 109 градусам. 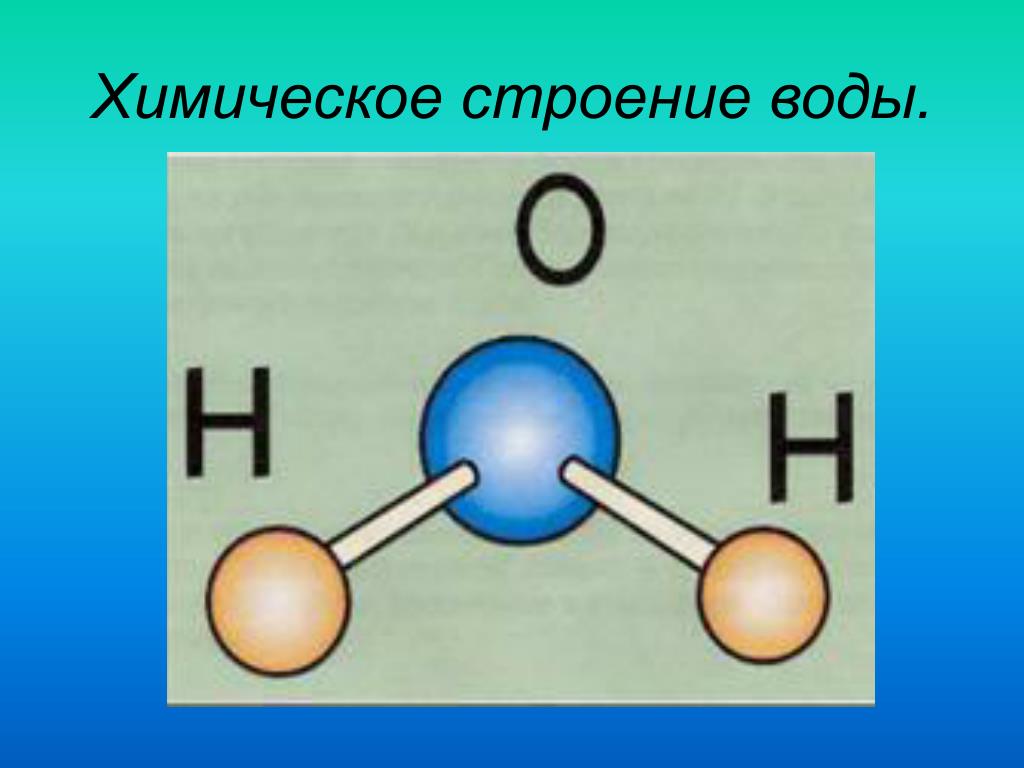
Атомы водорода соединяются с атомами кислорода и образуют молекулу воды с ковалентной связью. Водородные соединения более сильные, поэтому, когда они разрываются, то молекулы присоединяются к другим веществам, способствуя их растворению.
Прочие химические элементы, в состав которых входит водород, замерзают при -90 градусах, а закипают при 70 градусах. Но вода становится льдом, когда температура достигает нуля, а закипает при 100 градусах. Чтобы объяснить такие отклонения от нормы, требуется разобраться, в чем особенность строения молекулы воды. Дело в том, что вода – это ассоциированная жидкость.
Это свойство подтверждается и большой теплотой парообразования, что делает жидкость хорошим энергоносителем. Вода – отличный регулятор температуры, способен нормализировать резкие перепады этого показателя. Теплоемкость жидкости повышается, когда ее температура 37 градусов. Минимальные показатели соответствуют температуре человеческого тела.
Относительная молекулярная масса воды составляет 18. Рассчитать этот показатель достаточно легко. Следует заранее ознакомиться с атомной массой кислорода и водорода, которая равна 16 и 1 соответственно. В химических задачах нередко встречается массовая доля воды. Этот показатель измеряется в проценте и зависит от формулы, которую требуется рассчитать.. Строение молекулы в различных агрегатных состояниях воды
В жидком состоянии молекула воды состоит из моногидроля, дигидроля и тригидроля. Количество этих элементов зависит от агрегатного состояния жидкости. Пар включает одну H₂O – гидроль (моногидроль). Две H₂O обозначают жидкое состояние – дигидроль. Три H₂O включает лед.
Агрегатные состояния воды:
Жидкое. Между одиночными молекулами, которые связаны водородными связями, располагаются пустоты. Пар. Одиночные H₂O никак не соединяются между собой. Лед. 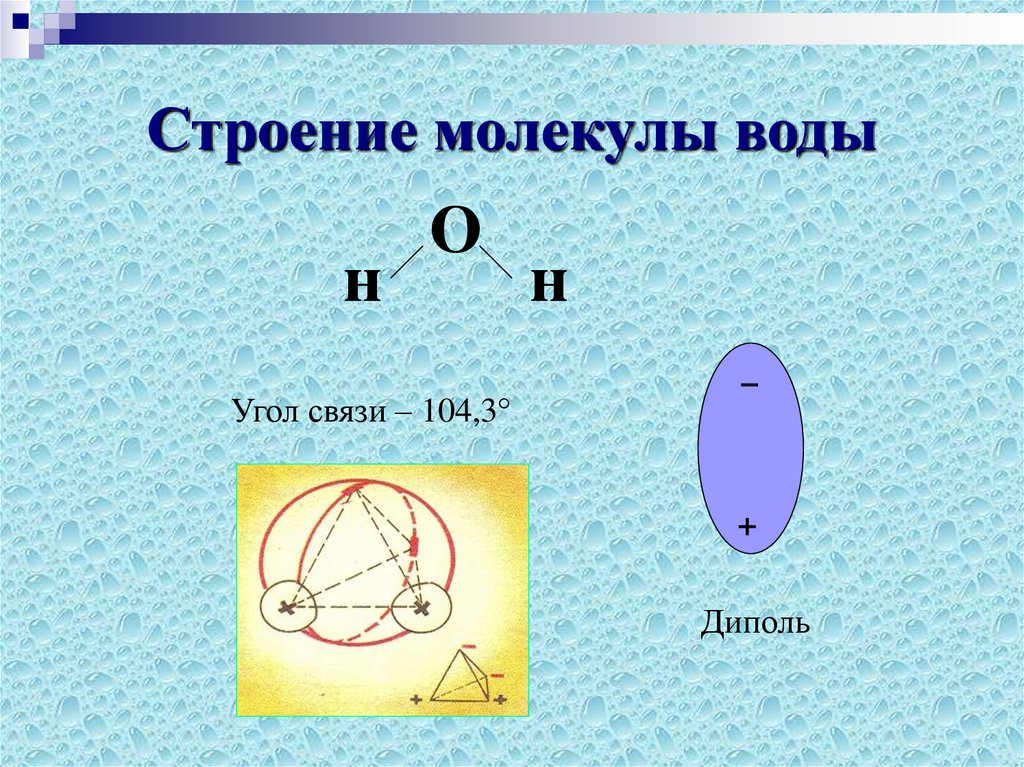 Твердое состояние отличается прочными водородными связи. Твердое состояние отличается прочными водородными связи.
Многих интересует, одинаковы ли объемы и состав молекул холодной и горячей воды. Важно запомнить, что состав жидкости не меняется ни в одном из агрегатных состояний. Молекулы при нагревании или остывании жидкости отличаются расположением. В холодной и горячей воде разные объемы, так как в первом случае структура упорядоченная, а во втором – хаотичная. Когда лед тает, то его температура не меняется. Только после того, как жидкость меняется свое агрегатное состояние, показатели начинают подниматься. Для таяния требуется определенное количество энергии, которое называется удельной теплотой плавления или лямбда воды. Для льда показатель равен 25000 Дж/кг. жүктеу/скачать 17,14 Kb. Достарыңызбен бөлісу: |
Вода (water)
Вода бесцветная жидкость без запаха и вкуса, регистрационный номер CAS 7732-18-5 молекулярная формула H2O молекулярная масса 18, 0149пл.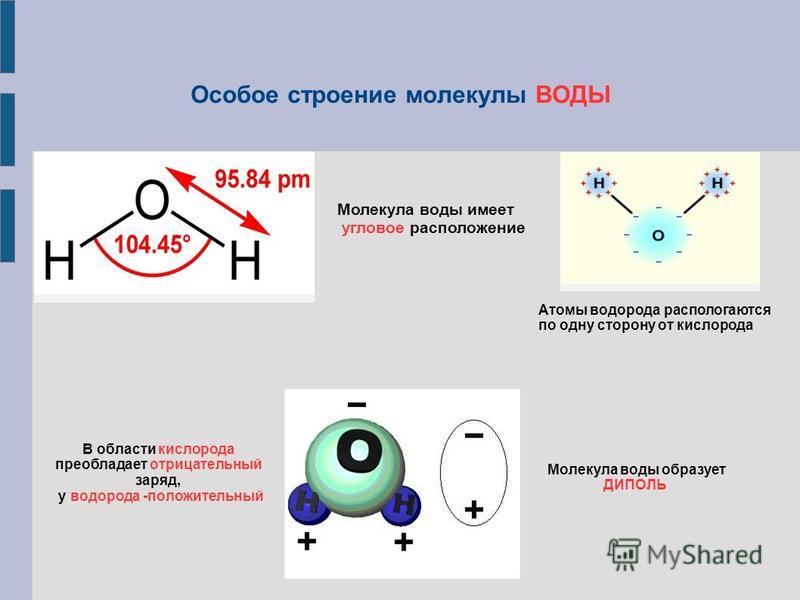 1.000г/см3. ( анг.water, синонимы монооксид дигидрогена, оксид дигидрогена)
1.000г/см3. ( анг.water, синонимы монооксид дигидрогена, оксид дигидрогена)
На территории России расположено 120 тыс. рек и 2 млн озёр. Больше совокупные объёмы воды только у Бразилии и то за счёт величайшей реки мира Амазонки. На территории Российской Федерации находится более четверти мировых запасов пресной воды, из которых 23% приходятся на озеро Байкал. Вода представляет собой полезный и жизненно необходимый ресурс. По мере резкого ухудшения качества поверхностных, подземных и атмосферных вод и связанного с этим снижения уровня здоровья населения всего мира в настоящее время происходит всё более широкое использования пресной воды чистых и целебных природных источников, а также вод, специально очищенных от технических и антропогенных загрязнений в расфасованном (бутилированном) виде.
Воду для лабораторных целей (дистиллированную воду) готовят обычно путем перегонки(дистилляции), дополнительной очистки ее от CO2 и других примесей. Для ответственных физико-химических и аналитических исследований пользуются , как правило дважды перегнанной водой (бидистиллатом).
Для ответственных физико-химических и аналитических исследований пользуются , как правило дважды перегнанной водой (бидистиллатом).
Вода так же образуется при сгорании водорода:
2H2+O2→2H2O
При поджигании смеси 2 объемов водорода с 1 объемом кислорода соединение газов происходит почти мгновенно и сопровождается сильным взрывом, поэтому такую смесь называют гремучим газом.
- Физические свойства воды.
Чистая вода представляет собой бесцветную прозрачную жидкость. Плотность воды при переходе ее из твердого состояния в жидкость не уменьшается, как у большинства других веществ, а возрастает. При нагревании воды от 0 до 40С плотность ее также увеличивается, и лишь при нагревании свыше 40С ее плотность в дальнейшем уменьшается. Большое значение в жизни природы имеет тот факт, что вода обладает аномально высокой теплоемкостью(4,18 Дж/(г∙К)). Поэтому в ночное время, а так же при переходе от лета к зиме вода остывает медленно, а днем, или при переходе от зимы к лету так же медленно нагревается, являясь, таким образом, регулятором температуры на земном шаре.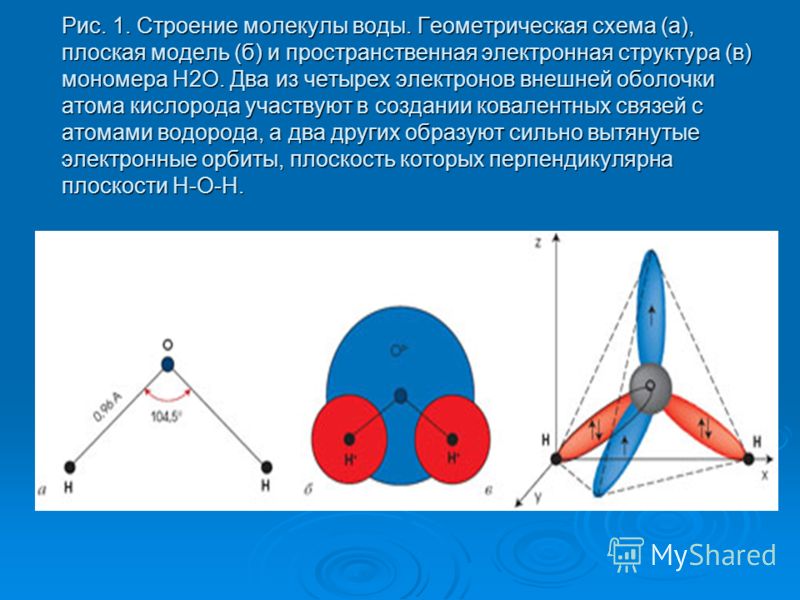
- Строение молекулы воды.
Молекула воды имеет угловое строение; входящие в ее состав ядра, образуют равнобедренный треугольник, в основании, которого находятся два протона, а в вершине—ядро атома кислорода. Межъядерные расстояния О—Н близки к 0.1 нм, расстояние между ядрами атомов, водорода равно примерно 0,15 нм. Из восьми электронов, составляющих внешний электронный слей атома кислорода в молекуле воды, две электронные пары образуют ковалентные связи О–Н, а остальные четыре электрона представляют собой две неподеленных электронных пары.
Молекулярная -масса парообразной воды равна 18 и отвечает ее простейшей формуле. Однако молекулярная масса жидкой воды, определяемая путем изучения ее растворов в других растворителях, оказывается более высокой. Это свидетельствует о том, что в жидкой воде происходит ассоциация молекул, т.е. соединение их в более сложные агрегаты, путем образования водородных связей между молекулами воды.
При плавлении льда его структура разрушается.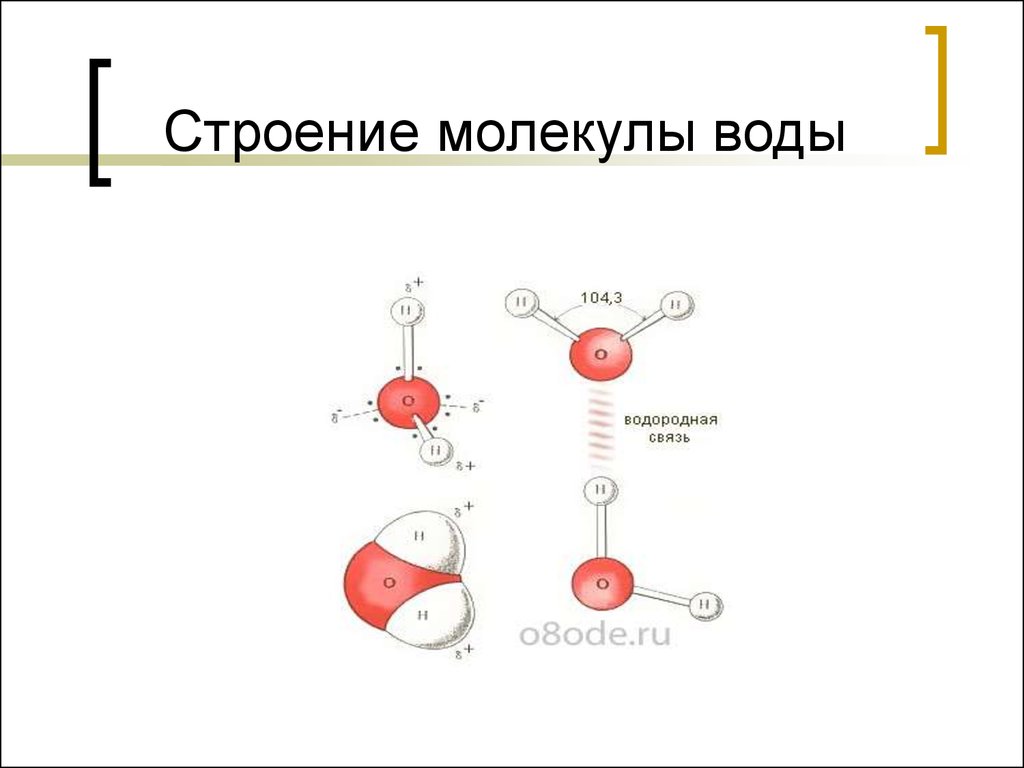 Но и в жидкой воде сохраняются водородные связи между молекулами: образуются ассоциаты — как бы обломки структуры льда, — состоящие из большего или меньшего числа молекул воды. Однако в отличие от льда каждый ассоциат существует очень короткое время: постоянно происходит разрушение одних и образование других агрегатов. В пустотах таких «ледяных» агрегатов могут размещаться одиночные молекулы воды; при этом упаковка молекул воды становится более плотной. Именно поэтому при плавлении льда объем, занимаемый водой, уменьшается, а ее плотность возрастает. По мере нагревания воды, обломков структуры льда в ней становится все меньше, что приводит к дальнейшему повышению плотности воды. В интервале температур от 0 до 4 °С этот эффект преобладает над тепловым расширением, так что плотность воды продолжает возрастать. Однако при нагревании выше 4 °С преобладает влияние усиления теплового движения молекул и плотность воды уменьшается. Поэтому при 4°С вода обладает максимальной плотностью. При нагревании воды часть теплоты затрачивается на разрыв водородных связей (энергия разрыва водородной связи в воде составляет примерно 25 кДж/моль).
Но и в жидкой воде сохраняются водородные связи между молекулами: образуются ассоциаты — как бы обломки структуры льда, — состоящие из большего или меньшего числа молекул воды. Однако в отличие от льда каждый ассоциат существует очень короткое время: постоянно происходит разрушение одних и образование других агрегатов. В пустотах таких «ледяных» агрегатов могут размещаться одиночные молекулы воды; при этом упаковка молекул воды становится более плотной. Именно поэтому при плавлении льда объем, занимаемый водой, уменьшается, а ее плотность возрастает. По мере нагревания воды, обломков структуры льда в ней становится все меньше, что приводит к дальнейшему повышению плотности воды. В интервале температур от 0 до 4 °С этот эффект преобладает над тепловым расширением, так что плотность воды продолжает возрастать. Однако при нагревании выше 4 °С преобладает влияние усиления теплового движения молекул и плотность воды уменьшается. Поэтому при 4°С вода обладает максимальной плотностью. При нагревании воды часть теплоты затрачивается на разрыв водородных связей (энергия разрыва водородной связи в воде составляет примерно 25 кДж/моль).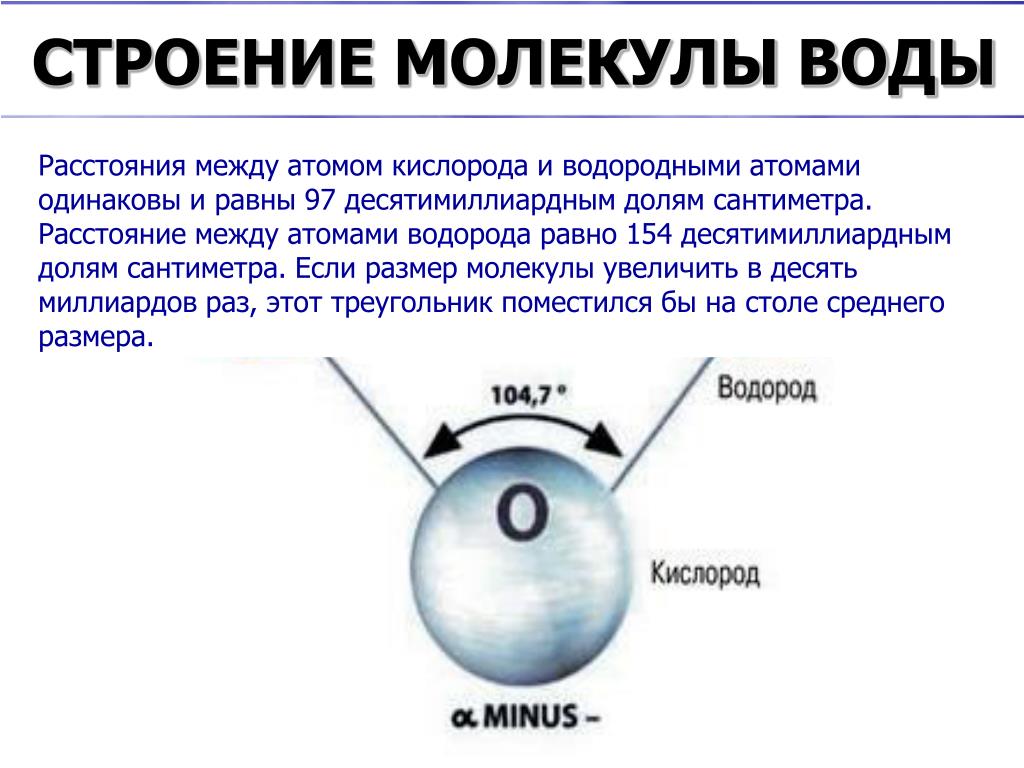 Этим объясняется высокая теплоемкость воды. Водородные связи между молекулами воды полностью разрываются только при переходе воды в пар.
Этим объясняется высокая теплоемкость воды. Водородные связи между молекулами воды полностью разрываются только при переходе воды в пар.
Изотопы воды
Химические свойства воды
Анализ воды, определение pH (Ph питьевой воды)
Ионы воды
Вкус и запах питьевой воды
Анализ дистиллированной воды
Анализ воды очищенной
Полный химический анализ воды
Анализ сточных вод для предприятий
Анализ котловой воды
Структура и свойства воды | Водная химия оксидов
Фильтр поиска панели навигации
Oxford AcademicThe Water Chemistry of OxidesInorganic ChemistryBooksJournals
Термин поиска мобильного микросайта
Закрыть
Фильтр поиска панели навигации
Oxford AcademicThe Water Chemistry of OxidesInorganic ChemistryBooksJournals
Термин поиска на микросайте
Расширенный поиск
Иконка Цитировать
ЦитироватьРазрешения
Делиться
- Твиттер
- Подробнее
CITE
Bunker, Bruce C и William H Casey,
‘Структура и свойства воды’
,
Водная химия оксидов
(
, Нью -Йорк,
2016;
онлайн онлайн. edn,
edn,
Oxford Academic
, 12 ноября 2020 г.
), https://doi.org/10.1093/oso/9780199384259.003.0008,
, по состоянию на 2 декабря 2022 г.
Выберите формат
Выберите format.ris (Mendeley, Papers, Zotero).enw (EndNote).bibtex (BibTex).txt (Medlars, RefWorks)
Закрыть
Фильтр поиска панели навигации
Oxford AcademicThe Water Chemistry of OxidesInorganic ChemistryBooksJournals
Термин поиска мобильного микросайта
Закрыть
Фильтр поиска панели навигации
Oxford AcademicThe Water Chemistry of OxidesInorganic ChemistryBooksJournals
Термин поиска на микросайте
Advanced Search
Abstract
Вода — одна из самых сложных жидкостей на Земле.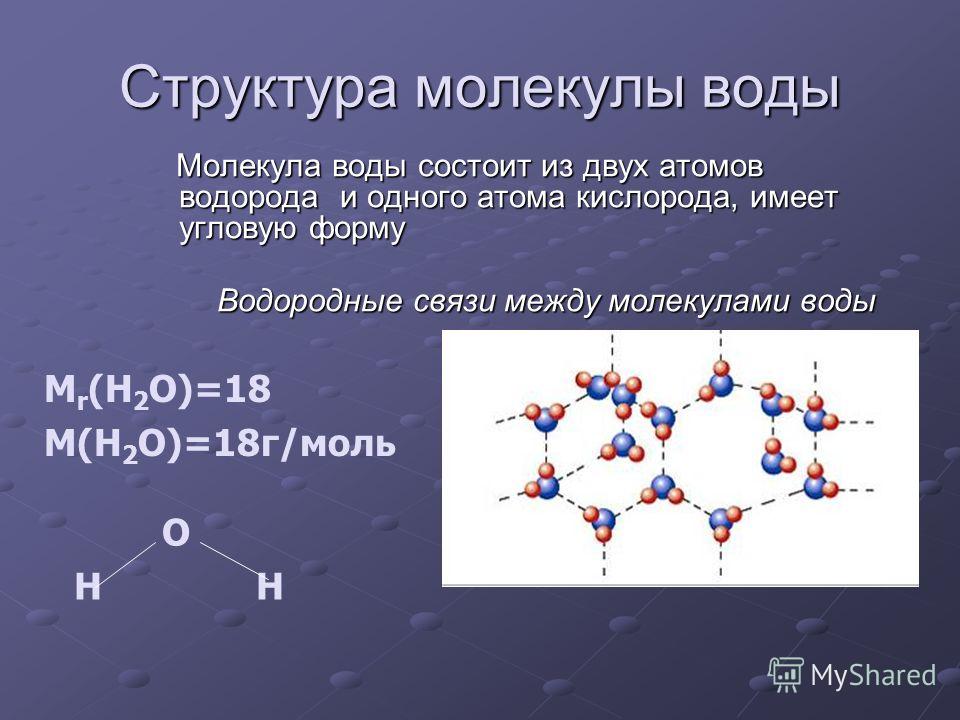 Даже после интенсивных исследований остается много аспектов структуры, свойств и химического состава воды, которые до конца не изучены. В этой главе мы выделяем свойства воды, которые определяют многие реакции, происходящие между водой и оксидами. Мы начинаем с одной молекулы воды и переходим к кластерам воды, а затем, наконец, к расширенным жидким и твердым фазам. Эта глава дает основу для оценки того, что происходит, когда вода сталкивается с простыми ионами, растворимыми оксидными комплексами, называемыми продуктами гидролиза, и расширенными оксидными фазами. Основным явлением, рассмотренным в этой главе, является водородная связь. Водородная связь доминирует в структуре и свойствах воды и влияет на многие взаимодействия вода-оксид. Одна молекула воды имеет восемь валентных электронов вокруг центрального аниона кислорода. Эти электроны содержатся в четырех sp3-гибридизированных молекулярных орбиталях, расположенных в виде лепестков, которые простираются от кислорода в тетраэдрической геометрии.
Даже после интенсивных исследований остается много аспектов структуры, свойств и химического состава воды, которые до конца не изучены. В этой главе мы выделяем свойства воды, которые определяют многие реакции, происходящие между водой и оксидами. Мы начинаем с одной молекулы воды и переходим к кластерам воды, а затем, наконец, к расширенным жидким и твердым фазам. Эта глава дает основу для оценки того, что происходит, когда вода сталкивается с простыми ионами, растворимыми оксидными комплексами, называемыми продуктами гидролиза, и расширенными оксидными фазами. Основным явлением, рассмотренным в этой главе, является водородная связь. Водородная связь доминирует в структуре и свойствах воды и влияет на многие взаимодействия вода-оксид. Одна молекула воды имеет восемь валентных электронов вокруг центрального аниона кислорода. Эти электроны содержатся в четырех sp3-гибридизированных молекулярных орбиталях, расположенных в виде лепестков, которые простираются от кислорода в тетраэдрической геометрии.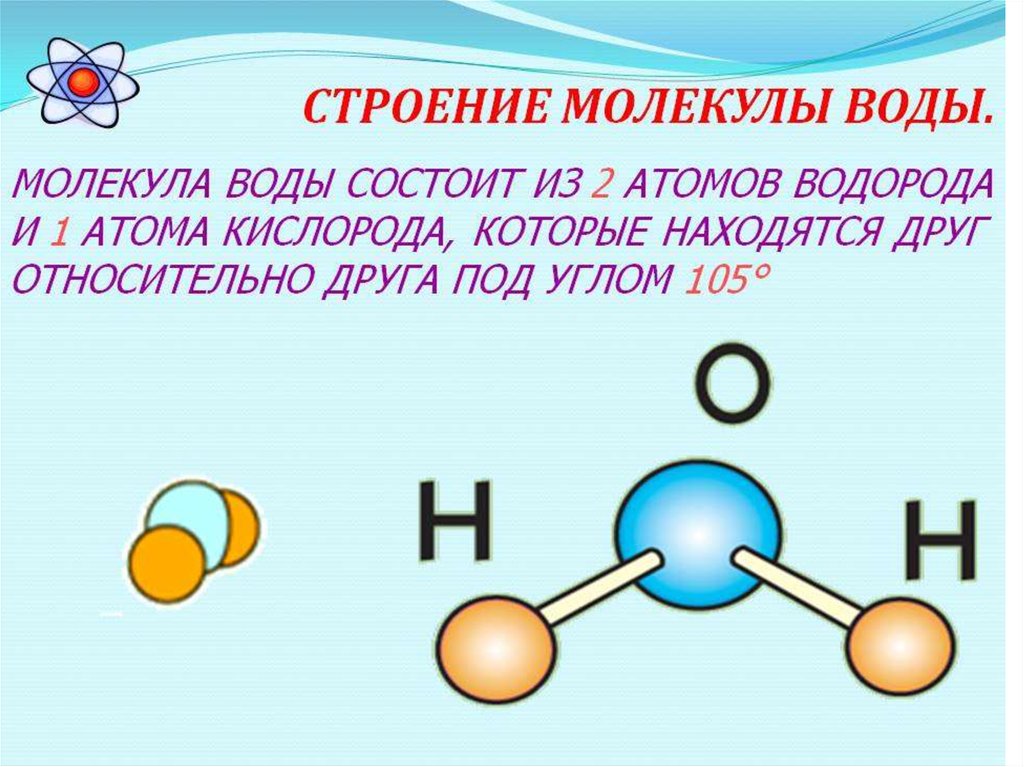 Каждая орбиталь занята двумя электронами. Две доли связаны с протонами; две другие доли называются неподеленными парами электронов. Валентный угол H–O–H, равный 104,5°, близок к тетраэдрическому углу 109°.0,5°. Длина связи O–H в одиночной молекуле воды составляет 0,96 ?. Важно признать, что эта длина связи на самом деле является мерой электронной плотности, связанной с неподеленной парой кислорода, связанной с протоном. Это связано с тем, что протон настолько мал (с ионным радиусом всего 1,3·10–5 ?), что не вносит никакого вклада в общую длину связи. Вся молекула воды имеет диаметр твердой сферы 2,9 ?, что довольно типично для аниона кислорода. Это означает, что незанятые неподеленные пары растянуты по сравнению с протонированными неподеленными парами примерно на 1,9?. Неравное распределение зарядов создает диполь внутри молекулы воды, что облегчает электростатические взаимодействия с другими молекулами.
Каждая орбиталь занята двумя электронами. Две доли связаны с протонами; две другие доли называются неподеленными парами электронов. Валентный угол H–O–H, равный 104,5°, близок к тетраэдрическому углу 109°.0,5°. Длина связи O–H в одиночной молекуле воды составляет 0,96 ?. Важно признать, что эта длина связи на самом деле является мерой электронной плотности, связанной с неподеленной парой кислорода, связанной с протоном. Это связано с тем, что протон настолько мал (с ионным радиусом всего 1,3·10–5 ?), что не вносит никакого вклада в общую длину связи. Вся молекула воды имеет диаметр твердой сферы 2,9 ?, что довольно типично для аниона кислорода. Это означает, что незанятые неподеленные пары растянуты по сравнению с протонированными неподеленными парами примерно на 1,9?. Неравное распределение зарядов создает диполь внутри молекулы воды, что облегчает электростатические взаимодействия с другими молекулами.
Ключевые слова:
Механизм Гротгуса, амфолиты, диэлектрическая релаксация, диффузия, ион гидроксония, колебательная спектроскопия, вода
Тема
Неорганическая химия
В настоящее время у вас нет доступа к этой главе.
Войти
Получить помощь с доступом
Получить помощь с доступом
Доступ для учреждений
Доступ к контенту в Oxford Academic часто предоставляется посредством институциональных подписок и покупок. Если вы являетесь членом учреждения с активной учетной записью, вы можете получить доступ к контенту одним из следующих способов:
Доступ на основе IP
Как правило, доступ предоставляется через институциональную сеть к диапазону IP-адресов. Эта аутентификация происходит автоматически, и невозможно выйти из учетной записи с IP-аутентификацией.
Войдите через свое учреждение
Выберите этот вариант, чтобы получить удаленный доступ за пределами вашего учреждения. Технология Shibboleth/Open Athens используется для обеспечения единого входа между веб-сайтом вашего учебного заведения и Oxford Academic.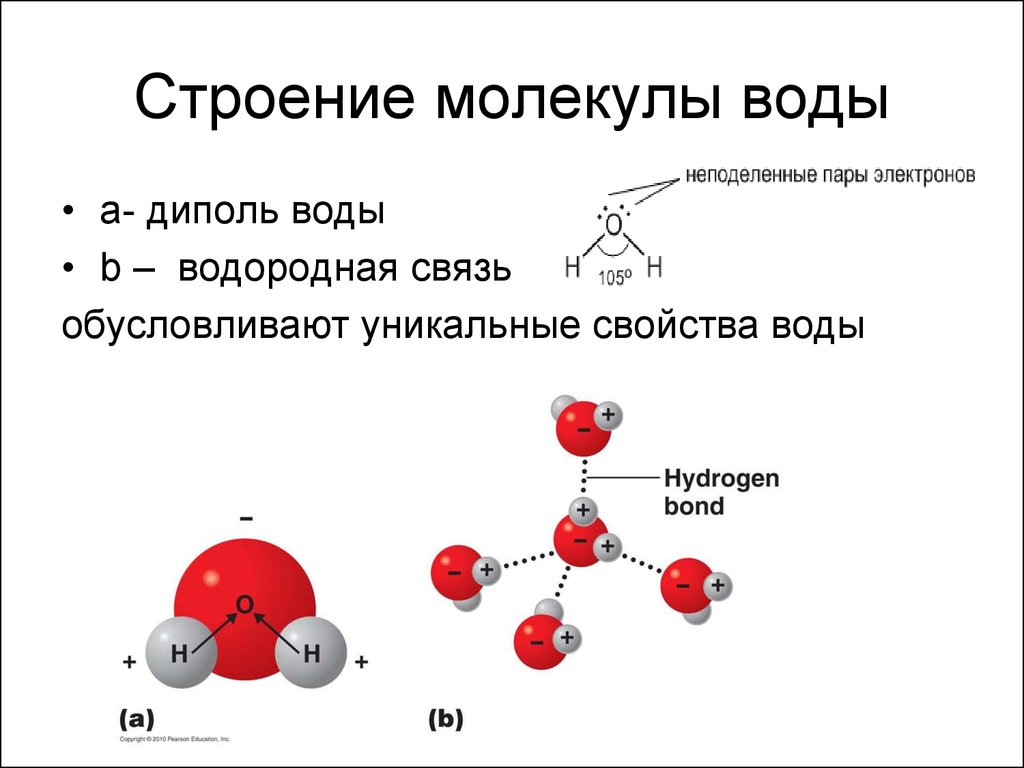
- Нажмите Войти через свое учреждение.
- Выберите свое учреждение из предоставленного списка, после чего вы перейдете на веб-сайт вашего учреждения для входа.
- При посещении сайта учреждения используйте учетные данные, предоставленные вашим учреждением. Не используйте личную учетную запись Oxford Academic.
- После успешного входа вы вернетесь в Oxford Academic.
Если вашего учреждения нет в списке или вы не можете войти на веб-сайт своего учреждения, обратитесь к своему библиотекарю или администратору.
Войти с помощью читательского билета
Введите номер своего читательского билета, чтобы войти в систему. Если вы не можете войти в систему, обратитесь к своему библиотекарю.
Члены общества
Доступ члена общества к журналу достигается одним из следующих способов:
Войти через сайт сообщества
Многие общества предлагают единый вход между веб-сайтом общества и Oxford Academic.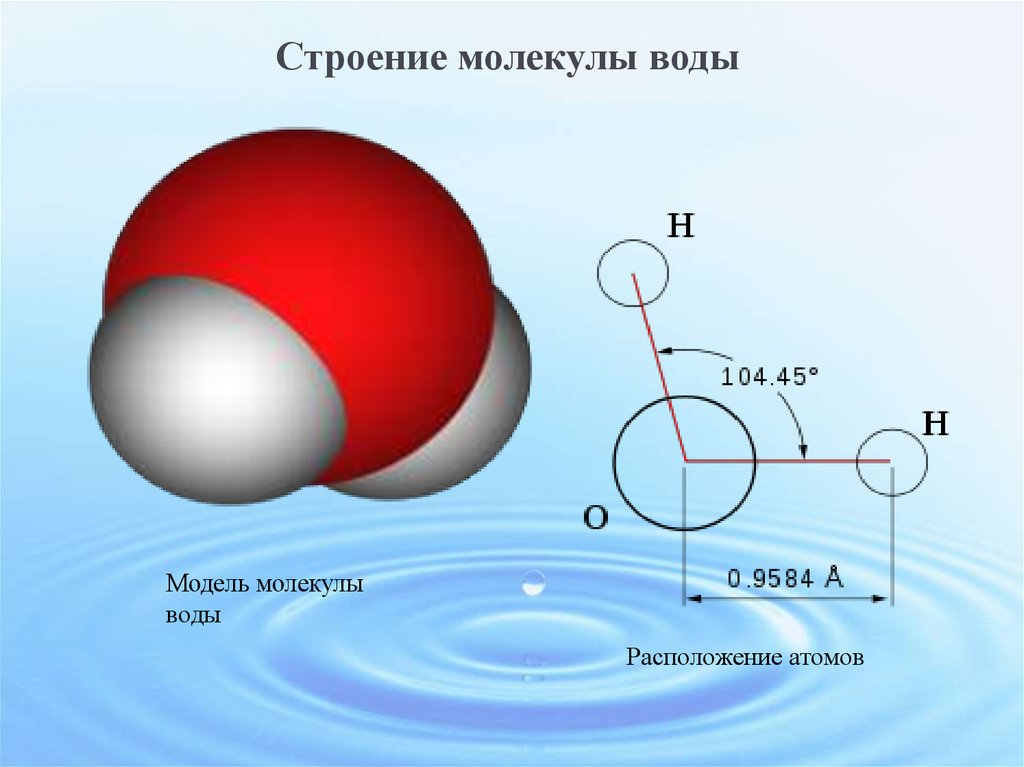 Если вы видите «Войти через сайт сообщества» на панели входа в журнале:
Если вы видите «Войти через сайт сообщества» на панели входа в журнале:
- Щелкните Войти через сайт сообщества.
- При посещении сайта общества используйте учетные данные, предоставленные этим обществом. Не используйте личную учетную запись Oxford Academic.
- После успешного входа вы вернетесь в Oxford Academic.
Если у вас нет учетной записи сообщества или вы забыли свое имя пользователя или пароль, обратитесь в свое общество.
Войти с помощью личного кабинета
Некоторые общества используют личные аккаунты Oxford Academic для предоставления доступа своим членам. Смотри ниже.
Личный кабинет
Личную учетную запись можно использовать для получения оповещений по электронной почте, сохранения результатов поиска, покупки контента и активации подписок.
Некоторые общества используют личные аккаунты Oxford Academic для предоставления доступа своим членам.
Просмотр учетных записей, вошедших в систему
Щелкните значок учетной записи в правом верхнем углу, чтобы:
- Просмотр вашей личной учетной записи и доступ к функциям управления учетной записью.
- Просмотр институциональных учетных записей, предоставляющих доступ.
Выполнен вход, но нет доступа к содержимому
Oxford Academic предлагает широкий ассортимент продукции. Подписка учреждения может не распространяться на контент, к которому вы пытаетесь получить доступ. Если вы считаете, что у вас должен быть доступ к этому контенту, обратитесь к своему библиотекарю.
Ведение счетов организаций
Для библиотекарей и администраторов ваша личная учетная запись также предоставляет доступ к управлению институциональной учетной записью. Здесь вы найдете параметры для просмотра и активации подписок, управления институциональными настройками и параметрами доступа, доступа к статистике использования и т. д.
д.
Покупка
Наши книги можно приобрести по подписке или приобрести в библиотеках и учреждениях.
Информация о покупке
Споры о структуре воды улажены? | Исследование
Возможно, найдено решение загадочных утверждений о том, что вода выстраивается в кольца и цепочки, а не в ожидаемую тетраэдрическую структуру
Shutterstock
Является ли структура воды асимметричной? Возможно, мы задаем неправильный вопрос, если не учитываем, в какой временной шкале
Споры о структуре жидкой воды, бушевавшие почти десятилетие, могут быть разрешены новым вычислительным исследованием. Томас Кюне и Рустам Халиуллин из Университета Майнца в Германии говорят, что обе стороны спора могут быть правы, в зависимости от того, как вы исследуете вопрос. 1
Тетраэдрическая координация молекул воды, каждая из которых связана водородными связями с четырьмя соседями, имеет почти знаковый статус в исследованиях структуры воды.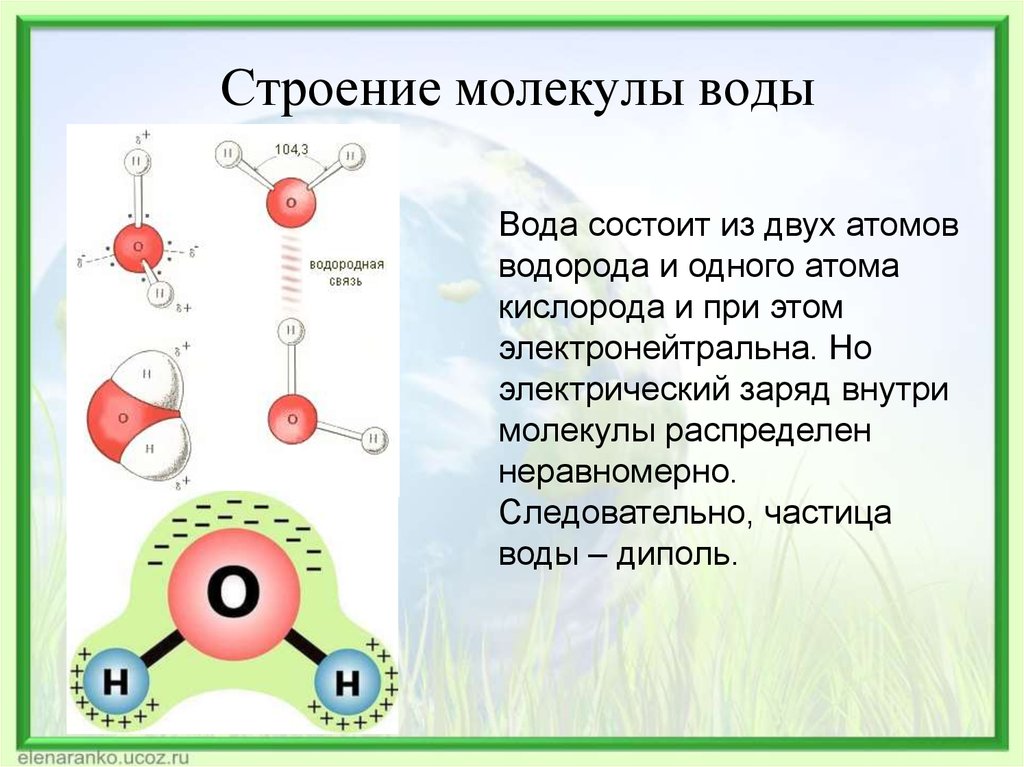 Именно так это выглядит во льду, и как эксперименты, так и моделирование, казалось, предполагали, что жидкое состояние имеет тот же самый мотив в своей динамической, менее упорядоченной сети водородных связей. Но эта картина была поставлена под сомнение в 2004 году измерениями спектра поглощения рентгеновских лучей водой (XAS), сделанными Андерсом Нильссоном из Стэнфордского университета и его коллегами. 2 Они утверждали, что их результаты показали, что молекулы воды связаны в основном в линейные цепи и кольца.
Именно так это выглядит во льду, и как эксперименты, так и моделирование, казалось, предполагали, что жидкое состояние имеет тот же самый мотив в своей динамической, менее упорядоченной сети водородных связей. Но эта картина была поставлена под сомнение в 2004 году измерениями спектра поглощения рентгеновских лучей водой (XAS), сделанными Андерсом Нильссоном из Стэнфордского университета и его коллегами. 2 Они утверждали, что их результаты показали, что молекулы воды связаны в основном в линейные цепи и кольца.
Это утверждение было сильно оспорено — некоторые утверждали, что Нильссон и его коллеги сделали необоснованные предположения при выводе структуры из своих необработанных данных. 3 Стэнфордская команда с тех пор изменила свою картину, предположив, что вода содержит смесь почти тетраэдрических связей и сильно искаженных водородных связей с небольшой направленностью. 4
Поверхностные воды
Кюне и Халиуллин не ставили перед собой задачу разрешить спор. «Изначально нам было интересно посмотреть, как меняется электронная структура молекул воды по мере их приближения к поверхности», — говорит Кюне. Для этого они использовали новую вычислительную технику, получившую название ALMO EDA, которая разбивает энергию молекулярного взаимодействия на компоненты, которым можно приписать физическое значение с точки зрения задействованной связи. 5
«Изначально нам было интересно посмотреть, как меняется электронная структура молекул воды по мере их приближения к поверхности», — говорит Кюне. Для этого они использовали новую вычислительную технику, получившую название ALMO EDA, которая разбивает энергию молекулярного взаимодействия на компоненты, которым можно приписать физическое значение с точки зрения задействованной связи. 5
К своему удивлению, они обнаружили, что даже в объемной фазе многие молекулы не имеют ожидаемой тетраэдрической координации с четырьмя эквивалентными водородными связями. Вместо этого две из этих связей были намного прочнее двух других: связь была асимметричной. Это произошло не из-за двух разных типов водородной связи, как ранее предполагали некоторые исследователи, а из-за разной силы связи из-за большего или меньшего искажения одного типа связи.
В результате окружение типичной молекулы воды сильно асимметрично в любой момент времени. Но поскольку асимметрия быстро колеблется, она усредняется на временных шкалах в несколько сотен фемтосекунд, восстанавливая видимость тетраэдральности.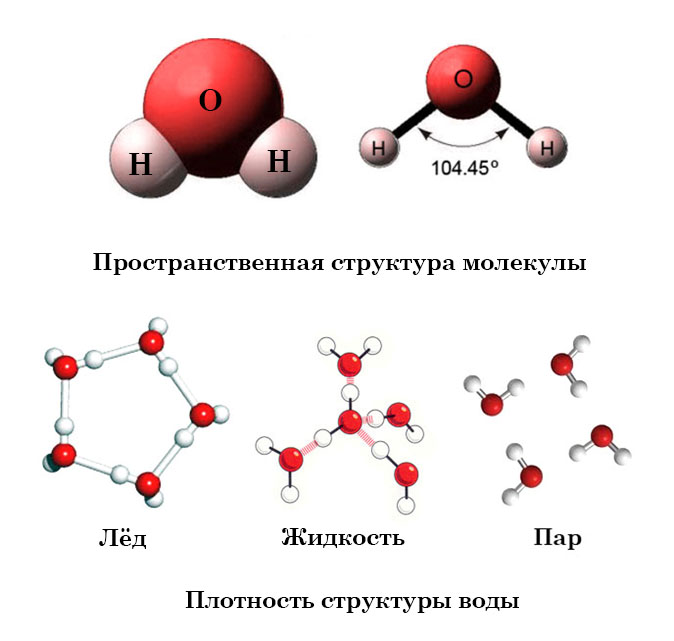 Поскольку XAS исследует временные масштабы менее фемтосекунды, говорят Кюне и Халиуллин, он «видит» мгновенную симметрию, которую команда Нильсона интерпретировала как свидетельство существования двухкоординатных структур.
Поскольку XAS исследует временные масштабы менее фемтосекунды, говорят Кюне и Халиуллин, он «видит» мгновенную симметрию, которую команда Нильсона интерпретировала как свидетельство существования двухкоординатных структур.
Контекст решает все
Таким образом, следует ли называть структуру воды тетраэдрической, следовательно, «сильно зависит от контекста», — говорит Кюне. «Мгновенное окружение молекулы воды совсем не похоже на тетраэдр».
«Это очень важный шаг вперед, — говорит Нильссон. «Это очень близко к нашему первоначальному предположению, что многие молекулы будут находиться в мгновенных конфигурациях с одной сильной и одной слабой водородной связью». Сопера из Лаборатории Резерфорда Эпплтона, Великобритания. «Это предполагает, что важным эффектом являются колебания электронной плотности между связанными молекулами, которые происходят в гораздо более быстром временном масштабе, чем это было бы очевидно в ядерных движениях. Это кажется очень рациональным взглядом, который в разных формах выражался другими авторами».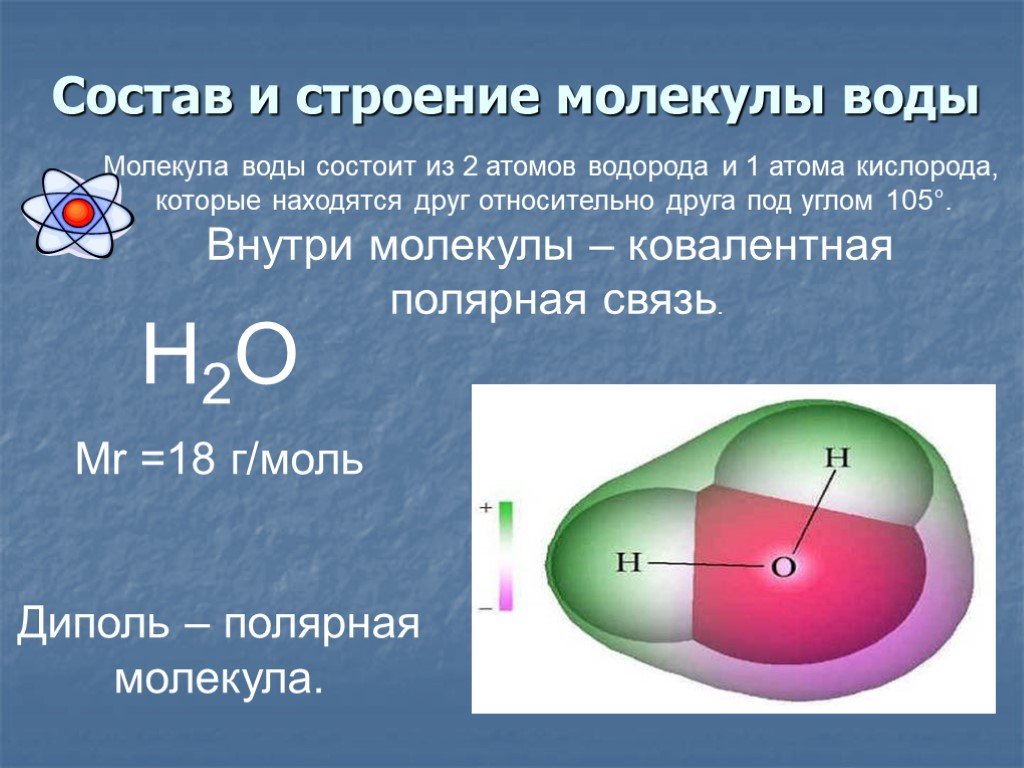
Однако Сопера не убедила интерпретация Нильссона и его коллег, и поэтому он не видит необходимости в какой-либо «резолюции». «Моя собственная точка зрения состоит в том, что никогда не существовало жизнеспособной «асимметричной» модели структуры воды: все существующие модели потенциала взаимодействия с водой приводят к представлению о структуре, которая является симметричной с почти двумя донорными и двумя акцепторными водородными связями в среднем, но со значительными флуктуациями вокруг среднего». «Если мы рассмотрим химическую связь в атомном масштабе, мы всегда будем видеть динамический объект с колеблющейся длиной и силой» 9.0003
Ссылки
1 Т. Кюне и Р. Халиуллин, Нац. коммун. , 2013, 4 , 1450 (DOI:10.1038/ncomms2459)
2 P Wernet и др. , Science , 2004, 304 , 995 (DOI: 10.1126/science.1096205)
3 GN I Clark et al , Mol. Phys ., 2010, 108 , 1415 (DOI: 10.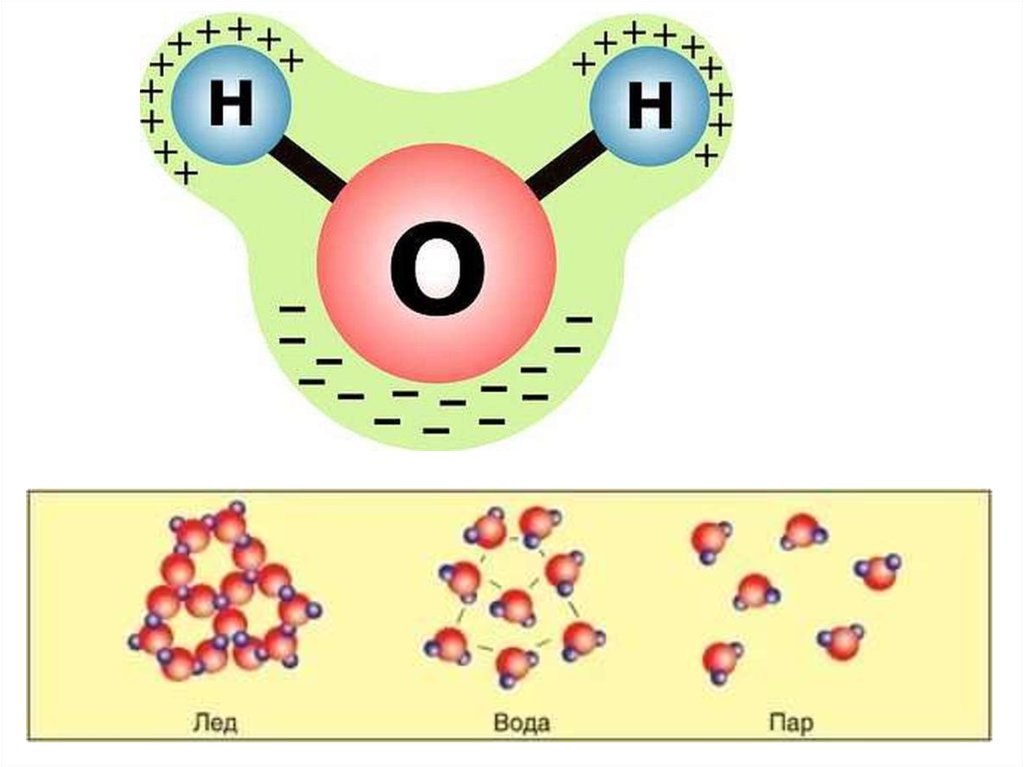

 Диполя приводят к тому, что на поверхности погруженных в жидкость веществ становятся слабее межатомные и межмолекулярные связи.
Диполя приводят к тому, что на поверхности погруженных в жидкость веществ становятся слабее межатомные и межмолекулярные связи.