Содержание
Степень — диссоциация — вода
Cтраница 1
Степень диссоциации воды ( а следовательно, константа диссоциации и ионное произведение воды) была впервые определена при помощи измерения электропроводности тщательно очищенной воды.
[1]
Степень диссоциации воды при комнатной температуре а 1 8 10 — 9, что составляет очень небольшую величину. Так, из 555 600 000 молекул воды в ионизированном состоянии находится всего лишь одна. Но, принимая во внимание очень большую скорость процесса диссоциации и высокую быстроту реакций между ионами, даже малая их концентрация может обусловливать и определенным образом направлять химический процесс. В связи с этим факт диссоциации воды имеет большое значение.
[2]
Степень диссоциации воды весьма мала.
[3]
| Значения Kw ПРИ разных температурах.
[4] |
Степень диссоциации воды возрастает до температуры 240 — 250 С, после чего начинает уменьшаться. В чистой воде концентрации ионов водорода и гидроксила, выраженные в грамм-ионах в литре, равны, и величина KW, или — 0 5 log Kw, характеризует концентрацию каждого из них.
В чистой воде концентрации ионов водорода и гидроксила, выраженные в грамм-ионах в литре, равны, и величина KW, или — 0 5 log Kw, характеризует концентрацию каждого из них.
[5]
Степень диссоциации воды а1 8 — 10 — 9, что составляет очень небольшую величину. Так, из 556 000 000 молекул Н2О в диссоциированном состоянии при комнатной температуре в среднем находится лишь одна. Несмотря на это, ионизация воды имеет большое значение.
[6]
Степень диссоциации воды а1 8 10 — 9, что составляет очень небольшую величину. Так, из 556 000 000 молекул FbO в диссоциированном состоянии при комнатной температуре в среднем находится лишь одна. Несмотря на это, ионизация воды имеет большое значение.
[7]
Степень диссоциации воды при очень высоких давлениях служила объектом многочисленных исследований. Ионное произведение активности воды Kw, измеренное при 25 С и при давлении 200 МПа, оказалось в 4 раза большим, чем при атмосферном давлении; при давлении же, равном 800 МПа, эта величина возросла в 51 3 раза. Особенно сильно возрастает Kw при одновременном действии высоких давлений и температур. Правда, в таких условиях воду уже нельзя считать жидкой фазой — давления и температуры соответствуют закритической области.
Особенно сильно возрастает Kw при одновременном действии высоких давлений и температур. Правда, в таких условиях воду уже нельзя считать жидкой фазой — давления и температуры соответствуют закритической области.
[8]
Степень диссоциации воды а0, найденная из опыта, 1 2 10 — 7 г-мол.
[9]
Степень диссоциации воды при комнатной температуре найдена равной а 1 8 — КГ9, что составляет очень небольшую величину. Так, из 555 600 000 молекул воды в ионизированном состоянии находится всего лишь одна. Но, принимая во внимание очень большую скорость процесса диссоциации и высокую быстроту реакций между ионами, даже малая их концентрация может обусловливать и — определенным образом направлять химический процесс. В связи с этим факт диссоциации воды имеет большое значение.
[10]
Степень диссоциации воды очень мала; чистая вода практически не проводит электрический ток.
[11]
Степень диссоциации воды очень мала и поэтому можно принять концентрацию недиссоциированных молекул постоянной.
[12]
Поскольку степень диссоциации воды очень мала, то сн.
[13]
Но степень диссоциации воды очень мала, и концентрацию ее недиссоциированных молекул в любом разбавленном водном растворе можно считать величиной постоянной. Таким образом, в правой части уравнения находятся две постоянные величины: [ Н О ] — концентрация недиссоциированных молекул воды и А — константа диссоциации. Но произведение двух постоянных величин есть также величина постоянная.
[14]
| Схема обозначений реакции среды.
[15] |
Страницы:
1
2
3
4
90. Диссоциация воды. Водородный показатель. . Общая химия
Чистая вода очень плохо проводит электрический ток, но все же обладает измеримой электрической проводимостью, которая объясняется небольшой диссоциацией воды на ионы водорода и гидроксид-ионы:
По величине электрической проводимости чистой воды можно вычислить концентрацию ионов водорода и гидроксид-ионов в воде. При 25°C она равна 10-7 моль/л.
При 25°C она равна 10-7 моль/л.
Напишем выражение для константы диссоциации воды:
Перепишем это уравнение следующим образом:
Поскольку степень диссоциации воды очень мала, то концентрация недиссоциированных молекул H2O в воде практически равна общей концентрации воды, т. е. 55,55 моль/л (1 л. содержит 1000 г. воды, т. е. 1000:18.02=55.55 моль). В разбавленных водных растворах концентрацию воды можно считать такой же. Поэтому, заменив в последнем уравнении произведение [H2O] новой константой KH2O будем иметь:
Полученное уравнение показывает, что для воды и разбавленных водных растворов при неизменной температуре произведение концентрата ионов водорода и гидроксид-ионов есть величина постоянная, Эта постоянная величина называется ионным произведением воды. Численное значение ее нетрудно получить, подставив в последнее уравнение концентрации ионов водорода и гидроксид-ионов. В чистой воде при 25°C [H+]=[OH-]=1·10-7 моль/л. Поэтому для указанной температуры:
В чистой воде при 25°C [H+]=[OH-]=1·10-7 моль/л. Поэтому для указанной температуры:
Растворы, в которых концентрации ионов водорода и гидроксид-ионов одинаковы, называются нейтральными растворами. При 25°C, как уже сказано, в нейтральных растворах концентрация как ионов водорода, так и гидроксид-ионов равна 10-7 моль/л. В кислых растворах больше концентрация ионов водорода, в щелочных — концентрация гидроксид-ионов. Но какова бы ни была реакция раствора, произведение концентраций ионов водорода и гидроксид-ионов остается постоянным.
— 244 —
Если, например, к чистой воде добавить столько кислоты, чтобы концентрация ионов водорода повысилась до 10-3 моль/л, то концентрация гидроксид-ионов понизится так, что произведение [H+][OH-] останется равным 10-14. Следовательно, в этом растворе концентрация гидроксид-ионов будет:
[OH-]=10-14/10-3=10-11 моль/л
Наоборот, если добавить к воде щелочи и тем повысить концентрацию гидроксид-ионов, например, до 10-5 моль/л, то концентрация ионов водорода составит:
[H+]=10-14/10-5=10-9 моль/л
Эти примеры показывают, что если концентрация ионов водорода в водном растворе известна, то тем самым определена и концентрация гидроксид-ионов. Поэтому как степень кислотности, так и степень щелочности раствора можно количественно охарактеризовать концентрацией ионов водорода:
Поэтому как степень кислотности, так и степень щелочности раствора можно количественно охарактеризовать концентрацией ионов водорода:
Кислотность или щелочность раствора можно выразить другим, более удобным способом: вместо концентрации ионов водорода указывают ее десятичный логарифм, взятый с обратным знаком. Последняя величина называется водородным показателем и обозначается через pH:
pH = — lg[H+]
Например, если [H+]=10-5 моль/л, то pH=5 ; если [H+]=10-9 моль/л, то pH=9 и т. д. Отсюда ясно, что в нейтральном растворе ([H+]=10-7 моль/л) pH=7. В кислых растворах pH<7 и тем меньше, чем кислее раствор. Наоборот, в щелочных растворах pH>7 и тем больше, чем больше щелочность раствора.
Для измерения pH существуют различные методы. Приближенно реакцию раствора можно определить с помощью специальных реактивов, называемых индикаторами, окраска которых меняется в зависимости от концентрации ионов водорода. Наиболее распространенные индикаторы — метиловый оранжевый, метиловый красный, фенолфталеин. В табл. 17 дана характеристика некоторых индикаторов.
Наиболее распространенные индикаторы — метиловый оранжевый, метиловый красный, фенолфталеин. В табл. 17 дана характеристика некоторых индикаторов.
Для многих процессов значение pH играет важную роль. Так, pH крови человека и животных имеет строго постоянное значение. Растения могут нормально произрастать лишь при значениях pH почвенного раствора, лежащих в определенном интервале, характерном для данного вида растения. Свойства природных вод, в частности их коррозионная активность, сильно зависят от их pH.
— 245 —
Таблица 17. Важнейшие индикаторы
{
Последняя обновленная дата: 02 -й январь 2023
•
Общее представление: 236,1K
•
Просмотры сегодня: 23,60K
Ответ
Проверено
236.1K+ Просмотры
HINT: 9003
236. {{\text{ — 2}}}}$.
{{\text{ — 2}}}}$.
Недавно обновленные страницы
В Индии по случаю бракосочетания фейерверк 12 класса химии JEE_Main
Щелочноземельные металлы Ba Sr Ca и Mg могут быть организованы 12 класса химии JEE_Main
Что из следующего имеет самый высокий электродный потенциал Химический класс 12 JEE_Main
Что из следующего является истинным пероксидом A rmSrmOrm2 Химический класс 12 JEE_Main
Какой элемент обладает наибольшим радиусом атомов Химический класс 11 JEE_Main
Фосфин получают из следующей руды А Кальций класса 12 по химии JEE_Main
В Индии по случаю бракосочетания фейерверков класс 12 по химии JEE_Main
Щелочноземельные металлы Ba Sr Ca и Mg могут быть отнесены к классу 12 по химии JEE_Main
Что из следующего имеет самый высокий электродный потенциал 12 класса химии JEE_Main
Что из перечисленного является истинным пероксидом A rmSrmOrm2 12 класса химии JEE_Main
Какой элемент обладает наибольшим атомным радиусом А класса 11 химии JEE_Main
Фосфин получают из следующей руды A Химический класс кальция 12 JEE_Main
Тенденции сомнений
Объяснение урока: Степень диссоциации
диссоциации слабой кислоты и с его помощью вывести закон разбавления Оствальда.
Обычно диссоциация вещества включает разделение
вещества на отдельные компоненты. Мы можем рассматривать степень диссоциации
точно так же мы думаем о процентной доходности.
Представьте себе обратимую реакцию, при которой вещество диссоциирует на
два кусочка.
Степень диссоциации аналогична проценту вещества,
диссоциированный.
Степень диссоциации определяется как доля вещества,
диссоциирован, и обычно выражается в виде десятичной дроби. Степень
диссоциации часто присваивается символ 𝛼 (альфа).
Уравнение: Степень диссоциации
Уравнение степени диссоциации
𝛼=().количество диссоциированного веществасуммарное количество диссоциированного и недиссоциированного вещества
При выражении сумм в
кроты, мы можем
выражают степень диссоциации следующим образом.
Уравнение: степень диссоциации с использованием количеств в молях
Уравнение степени диссоциации
𝛼=()().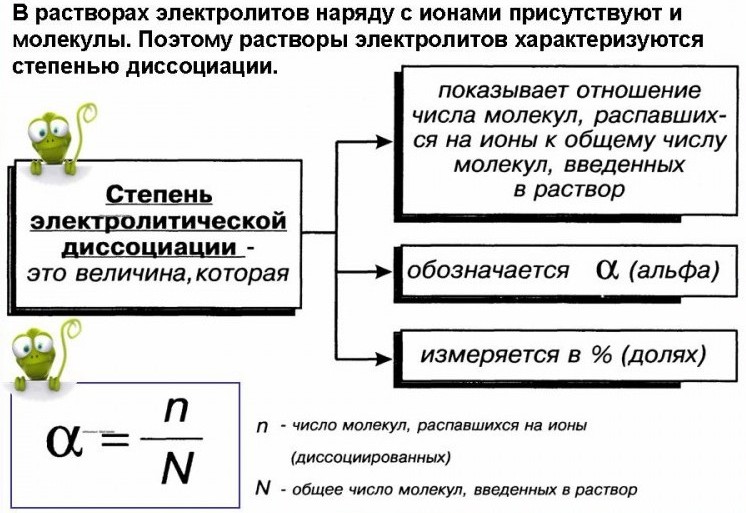 amountmolofdissociatedsubstancetotalalmountmolofsubstance
amountmolofdissociatedsubstancetotalalmountmolofsubstance
В таблице ниже показано, как мы можем анализировать имеющиеся у нас простые системы.
уже посмотрел. Нетрудно рассчитать количество
недиссоциированное вещество. Количество диссоциированного вещества можно определить
путем подсчета полных наборов продуктов диссоциации. Когда мы вычисляем
степени диссоциации важно, чтобы мы использовали общее количество
вещества (диссоциированного и недиссоциированного), когда мы выполняем деление.
Степени диссоциации всегда находятся в диапазоне от 0 до 1. При выполнении
расчетов, необходимо соблюдать осторожность, чтобы не считать количество отдельных частей. Только
количество единиц диссоциированного вещества следует измерять независимо от
на сколько частей распадается вещество. Нам нужно посчитать наборы
частей, а не самих частей.
Наиболее интересны степени диссоциации больше 0 и меньше 1. Если что-то полностью диссоциирует или вообще не диссоциирует, то мы делаем
вообще не нужно учитывать степень диссоциации.
Мы можем применять степени диссоциации ко многим различным типам химических веществ.
системы. Здесь мы сосредоточимся на слабых кислотах.
Слабая кислота по определению представляет собой кислоту, которая не полностью диссоциирует в воде. Степень диссоциации является важной характеристикой слабых кислот. Более сильная слабая кислота будет иметь более высокую степень диссоциации, чем более слабая.
слабая кислота.
Определение: Слабая кислота
Слабая кислота – это кислота, которая не полностью диссоциирует в воде.
При растворении слабой кислоты в воде часть кислоты также диссоциирует:
HAHA()H()+A()HO2aqaqaq+–
Как только система достигнет равновесия, будет фиксированная концентрация
ионов водорода (и, следовательно, фиксированный рН):
HA()H()+A()aqaqaq+–
константа диссоциации, 𝐾.
Определение: константа кислотной диссоциации, 𝐾
𝐚
Константа кислотной диссоциации – это константа равновесия для
диссоциация кислоты в воде. Константа кислотной диссоциации является мерой
Константа кислотной диссоциации является мерой
сила кислоты.
Константу кислотной диссоциации слабой кислоты можно выразить через
концентрации продуктов (H+
ионы А–) и реагенты
(HA):
Уравнение: константа кислотной диссоциации, 𝐾
𝐚
𝐾=[H][A][HA]+–
степень диссоциации с помощью этого уравнения.
Для начала давайте снова посмотрим на уравнение диссоциации:
HA()H()+A()aqaqaq+–
Если мы начнем с 1 моль
ГК, мы произведем
𝛼 моль
Н+
и 𝛼 моль
из А–. Пройдемся по началу,
изменение, равновесие (ICE) таблица шаг за шагом, чтобы увидеть, как мы приходим к
этот результат.
В этом сценарии мы начинаем с HA
с концентрацией 1 М. HA()H()A()Начальная концентрацияMaqaqaq+–+()100
Поскольку мы имеем дело со слабой кислотой, мы знаем, что она будет частично диссоциировать. Это произведет некоторое количество H+ и
ионы A–, но все равно будут некоторые
ХА ушел. Количество
Количество
ионы Н+
и образующиеся ионы A– будут зависеть от силы
кислоты.
Доля ГК, которая диссоциирует, равна
степень диссоциации, 𝛼. Следовательно, концентрация
HA уменьшится на
𝛼 М. Также,
диссоциация увеличит концентрацию H+
ионов и ионов А–
𝛼 М:
HA()H()A()InitialconcentrationMChangeinconcentrationMaqaqaq+–+()100()−𝛼𝛼𝛼
Затем мы можем рассчитать конечные концентрации в терминах степени
диссоциация:
HA()H()A()Начальная концентрацияMИзменение концентрацииMEравновесная концентрацияMaqaqaq+–+()100()−𝛼𝛼𝛼()1−𝛼𝛼𝛼
Теперь мы можем записать 𝐾 через 𝛼
в концентрации 1 М
для ГК:
𝐾==𝛼×𝛼(1−𝛼)=𝛼1−𝛼.M+–[H][A][HA]MMMM
Однако здесь что-то не так: это уравнение для
𝐾 применяется только тогда, когда концентрация точно
1 M. Мы можем, однако,
вывести уравнение для 𝐾 для общей концентрации,
𝑐 вместо
1 М. Начиная как прежде,
мы вычисляем его следующим образом:
HA()H()A()Начальная концентрацияИзменение концентрацииРавновесная концентрацияaqaqaq+–+𝑐00−𝑐𝛼𝑐𝛼𝑐𝛼𝑐(1−𝛼)𝑐𝛼𝑐𝛼
Когда мы подставляем эти термины в наше выражение для 𝐾, получается
что мы получаем:
𝐾==𝑐𝛼×𝑐𝛼𝑐(1−𝛼)=𝛼1−𝛼𝑐. [H][A][HA]+–
[H][A][HA]+–
Результат известен как закон разбавления Оствальда, и он применим к любому
константы диссоциации, а не только кислотные константы диссоциации.
Уравнение: Закон разбавления Оствальда
Закон разбавления Оствальда выглядит следующим образом:
𝐾=𝛼1−𝛼𝑐
𝐾 — константа кислотной диссоциации кислоты.
𝛼 степень диссоциации слабой кислоты
в состоянии равновесия.
𝑐 – общая концентрация слабой кислоты.
Для многих слабых кислот степень диссоциации достаточно близка к 0;
это позволяет нам использовать полезное приближение. Если 𝛼
очень мало, 1−𝛼 очень близко к 1.
Это означает, что мы можем получить приблизительное соотношение между степенями
констант диссоциации и кислотной диссоциации:
𝐾=𝛼1−𝛼𝑐,
и если 𝛼 очень мал,
𝐾≈𝛼𝑐⟹𝛼≈𝐾𝑐.
Уравнение: приблизительное соотношение между степенью диссоциации,
константа кислотной диссоциации и концентрация слабой кислоты
𝛼≈𝐾𝑐
Для достаточно слабых кислот степень диссоциации пропорциональна
квадратный корень из константы кислотной диссоциации, обратно пропорциональный
квадратный корень из его концентрации. По мере снижения концентрации степень
По мере снижения концентрации степень
диссоциации увеличивается, и чем больше константа диссоциации кислоты, тем
выше степень диссоциации.
Основным следствием этого является то, что, разбавляя раствор, мы уменьшаем
концентрация растворенного вещества путем добавления большего количества растворителя, и, таким образом, степень диссоциации
растворенного вещества повышается.
Пример 1. Определение фактора, повышающего степень диссоциации
a Слабая кислота в наборе факторов
Какой из следующих факторов увеличивает степень диссоциации
слабой кислоты?
- Увеличение разбавления
- Уменьшение объема
- Уменьшение разбавления
- Увеличение концентрации кислоты
Ответ
Степень диссоциации кислоты — это доля молекул кислоты
которые диссоциировали в данном растворе. Степень диссоциации будет
зависит от кислоты и таких факторов, как прочность внутренних связей или
сколько энергии высвобождается при диссоциации.
Слабая кислота – это кислота, которая при смешивании с водой диссоциирует только
маленький. Следовательно, только часть молекул кислоты будет диссоциировать,
а остальные растворятся как целые молекулы.
Константа диссоциации кислоты является постоянным свойством слабой кислоты
(при заданной температуре). Константы кислотной диссоциации связаны с
степень диссоциации по закону разбавления Оствальда, которая может быть
выражается в этой простой форме для слабой кислоты:
𝛼≈𝐾𝑐.
Здесь 𝛼 — степень диссоциации слабой кислоты.
в равновесии 𝐾 — константа диссоциации кислоты,
𝑐 — общая концентрация слабой кислоты
(включая диссоциированные и недиссоциированные формы).
Все четыре возможных ответа так или иначе связаны с концентрацией
кислоты. Увеличение разбавления снизит концентрацию кислоты,
в то время как уменьшение объема и уменьшение разбавления увеличит кислотность
концентрация.
Если мы увеличим концентрацию слабой кислоты, степень
диссоциация уменьшится в соответствии с законом разбавления Оствальда:
«Увеличивающееся разбавление». Это снизит концентрацию
слабой кислоты и увеличивают степень диссоциации.
Ответ — вариант А, увеличивающееся разведение.
Пример 2: расчет 𝐾
𝐚 с учетом концентрации и процента диссоциации
кислоты
0,3 М раствор
бензойная кислота диссоциировала на 1,47%. Что такое
значение 𝐾 с точностью до 2 знаков после запятой для этой кислоты? Предположим, что 1−𝛼≅1.
- 6,48×10 моль/л
- 4,41×10 моль/л
- 4,26×10 моль/л
- 1,32×10 8 моль/л0184 4,9×10 моль/л
Ответ
Бензойная кислота – слабая кислота. Мы можем догадаться об этом по низкому проценту
диссоциации (1,47%). Менее 2% молекул бензойной
кислоты в этом растворе находятся в диссоциированной форме: ион водорода и
ион бензоата.
Для расчета 𝐾, константы диссоциации кислоты,
нам нужно связать 𝐾 с процентом диссоциации.
Для этого воспользуемся законом разбавления Оствальда:
𝐾=𝛼1−𝛼𝑐.
Обычно указывается степень диссоциации 𝛼
как десятичное число, поэтому мы можем преобразовать процент диссоциации в десятичное число:
𝛼=1,47%÷100%=0,0147.
Мы могли бы подставить это значение в приведенное выше уравнение, но вопрос включает
одна дополнительная деталь: «Предположим, что 1−𝛼≅1». Это означает, что знаменатель уравнения, 1−𝛼,
приблизительно равно 1, поэтому мы можем переформулировать уравнение следующим образом:
𝐾≈𝛼𝑐.
Теперь все, что нам нужно сделать, это вставить значения из вопроса:
𝐾=0,0147×0,3=0,00021609×0,3=6,4827×10,МММ
Как и требовалось, приводим наш ответ с точностью до 2 знаков после запятой:
𝐾=6,48×10M
Ответ – вариант А.
На графике ниже показана зависимость между концентрацией и степенью
диссоциации этановой кислоты
𝐾=1,74×10.
Мы можем увеличить интересующую область: ниже
0,1 М.
Здесь мы видим, что степень диссоциации остается очень низкой до тех пор, пока
концентрация падает ниже примерно
0,01 м.
Зависимость между концентрацией и степенью диссоциации
особенно важно при работе с электролитами.
Если у нас есть слабый электролит (например, раствор этановой кислоты), мы могли бы
ожидать, что если мы удвоим концентрацию, электропроводность будет
также двойной. По мере увеличения концентрации ионов увеличивается электрическое
проводимость.
Однако электропроводность будет менее чем в два раза меньше предыдущей
ценить.
То же самое произойдет, если мы уменьшим концентрацию вдвое. Электропроводность
будет чуть больше половины его прежнего значения. Это потому, что, как
концентрация увеличивается, степень диссоциации снижается, а по мере
концентрация снижается, степень диссоциации возрастает.
На этом графике показано, как изменяется концентрация диссоциированной этановой кислоты
с общей концентрацией.
Диссоциация кислот зависит от температуры и других условий,
поэтому значения 𝐾 и 𝛼 могут
изменение по причинам, отличным от изменения концентрации.
Пример 3: Идентификация раствора кислоты с самой высокой электропроводностью на основе
степень диссоциации некоторых кислот в растворах
Вам дано 5 кислых растворов в лабораторном опыте, и каждая кислота
проявляет разную степень диссоциации, как видно из таблицы.
| ACID | HU | HW | HX | HY | HZ |
|---|---|---|---|---|---|
| СТРОИТЕЛЬСТВА of Degsociation 9282. | |||||
| ER of Degsociat0273 | 5,9% | 11,2% | 6,7% | 7,9% |
Какая кислота имеет лучшую электропроводность? Предположим, что их
концентрация одинакова и сохраняется комнатная температура.
Ответ
Кислота будет диссоциировать согласно этому уравнению:
HA(H()+A()aqaqaq+–
Чем выше степень диссоциации, тем больше H+
ионы А– будут находиться в растворе.
Электропроводность раствора является грубым показателем того, как
концентрированные ионы находятся в растворе. Чем выше концентрация ионов,
тем выше электропроводность раствора. Вопрос говорит нам
что все растворы кислот имеют одинаковые температуры и концентрации,
так что единственное, что нам нужно знать, чтобы найти наиболее проводящее решение
заключается в выявлении кислоты с наибольшей степенью диссоциации.
По порядку HU(2,8%)HM(5,9%)HY(6,7%)HZ(7,9%)HX(11,2%).
Поскольку HX имеет наивысшую степень диссоциации
из всех кислот, а в остальном они находятся в одинаковых условиях,
электропроводность раствора HX
будет высшим из всех решений.
Ответ: вариант E, HX.
Ключевые моменты
- Степень диссоциации вещества в растворе – это доля
образца, который диссоциировал.
Уравнение степени диссоциации имеет вид
𝛼=()().количество моль диссоциированного вещества к общему количеству моль вещества - Слабые кислоты имеют низкую степень диссоциации.


