Содержание
Химические свойства солей — реакции, определение и примеры
Впервые школьники знакомятся с химическими свойствами солей в 8 классе, и для понимания дальнейшего материала без этой темы никуда. Наша статья поможет освежить знания перед контрольной или экзаменом: вспомним, какие бывают соли и как они образуются, рассмотрим типичные реакции с ними.
Соли — это сложные вещества, в состав которых входят катионы металла и анионы кислотного остатка. Иногда в состав солей входят водород или гидроксид-ион.
Классификация и номенклатура солей
Так как соли — это продукт полного или частичного замещения металлом атома водорода в кислоте, по составу их можно классифицировать следующим образом.
Кислые соли
Образованы неполным замещением атомов водорода на металл в кислоте.
В наименованиях кислых солей указывают количество водорода приставками «гидро-» или «дигидро-», название кислотного остатка и название металла. Если металл имеет переменную валентность, то в скобках указывают валентность.
Если металл имеет переменную валентность, то в скобках указывают валентность.
Примеры кислых солей и их наименования:
LiHCO3 — гидрокарбонат лития,
NaHSO4 — гидросульфат натрия,
NaH2PO4 — дигидрофосфат натрия.
Средние соли
Образованы полным замещением атомов водорода в кислоте на металл.
Наименования средних солей складываются из названий кислотного остатка и металла. При необходимости указывают валентность.
Примеры средних солей с названиями:
Основные соли
Продукт неполного замещения гидроксогрупп на кислотный остаток.
В наименованиях основных солей указывают количество гидроксид-ионов приставкой «гидроксо-» или «дигидроксо-», название кислотного остатка и название металла с указанием валентности.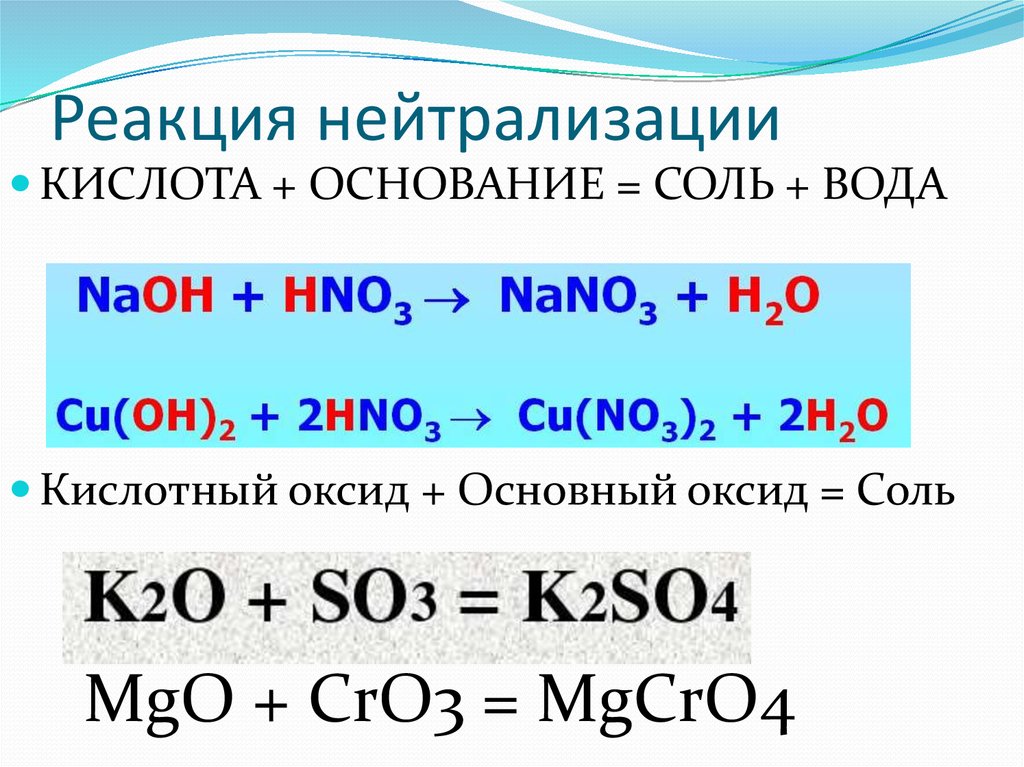
Пример: Mg(OH)Cl — гидроксохлорид магния.
Двойные соли
В состав входят два разных металла и один кислотный остаток.
Наименование складывается из названия аниона кислотного остатка и названий металлов с указанием валентности (если металл имеет переменную валентность).
Примеры двойных солей и их наименования:
Смешанные соли
Содержат один металл и два разных кислотных остатка.
Наименования смешанных солей складываются из названия кислотных остатков (по усложнению) и названия металла с указанием валентности (при необходимости).
Примеры смешанных солей с наименованиями:
Комплексные соли
Образованы комплексным катионом или анионом, связанным с несколькими лигандами.
Называют комплексные соли по схеме: координационное число + лиганд с окончанием «-о» + комплексообразователь с окончанием «-ат» и указанием валентности + внешняя сфера, простой ион в родительном падеже.
Пример: K[Al(OH)4] — тетрагидроксоалюминат калия.
Гидратные соли
В состав входит молекула кристаллизационной воды.
Число молекул воды указывают численной приставкой к слову «гидрат» и добавляют название соли.
Пример: СuSO4∙5H2O — пентагидрат сульфата меди (II).
Практикующий детский психолог Екатерина Мурашова
Бесплатный курс для современных мам и пап от Екатерины Мурашовой. Запишитесь и участвуйте в розыгрыше 8 уроков
Получение солей
Получение средних солей
Средние соли можно образовать в ходе следующих реакций:
Металл + неметалл:
2Na + Cl2 = 2NaCl
Fe + S =FeS
Так получают только соли бескислородных кислот.
Металл, стоящий левее h3 в ряду активности, с раствором кислоты:
Mg + 2HCl = MgCl2 + h3
Металл с раствором соли менее активного металла:
Fe + CuCl2 = FeCl2 + Cu
Основный оксид + кислотный оксид:
Na2O + CO2 = Na2CO3
Основный оксид и кислота:
CuO + H2SO4= CuSO4 + H2O
Основание с кислотным оксидом:
2NaOH + SO3 = Na2SO4 + H2O
Основание с кислотой (реакция нейтрализации):
Ca(OH)2 + 2HCl = CaCl2 + 2H2O
Взаимодействие соли с кислотой:
MgCO3 + 2HCl = MgCl2 + H2O + CO2
BaCl2 + H2SO4 = BaSO4 + 2HCl
Взаимодействие возможно, если одним из продуктов реакции будет нерастворимая соль, вода или газ.

Реакция раствора основания с раствором соли:
2NaOH + CuSO4 = Na2SO4 + Ba(OH)2
Взаимодействие растворов двух солей с образованием новых солей:
NaCl + AgNO3 = AgCl + NaNO3
Получение кислых солей
Кислые соли образуются при взаимодействии:
Кислот с металлами:
Zn + 2H2SO4 = H2 + Zn(HSO4)2
Кислот с оксидами металлов:
CaO + H3PO4 = CaHPO4 + H2O
Гидроксидов металлов с кислотами:
Ba(OH)2 + H3PO4 = BaHPO4 + 2H2O
Кислот с солями:
Ca3PO4 + 4H3PO4 = 3Ca(H2PO4)2
Аммиака с кислотами:
NH3 + H3PO4 = NH4H2PO4
Получение кислых солей возможно, если кислота в избытке.
Также кислые соли образуются в ходе реакции основания с избытком кислотного оксида:
KOH + CO2 = KHCO3
2SO2 + Ca(OH)2 = Ca(HSO3)2
Получение основных солей
Взаимодействие кислоты с избытком основания:
Fe(OH)3 + HCl = Fe(OH)2Cl + H2O
Добавление (по каплям) небольших количеств щелочей к растворам средних солей металлов:
Cu(NO3)2 + NaOH = CuOHNO3 + NaNO3
Взаимодействие солей слабых кислот со средними солями:
2MgCl2 + 2Na2CO3 + H2O = [Mg(OH)]2CO3 + CO2 + 4NaCl
Растворимые соли являются электролитами, следовательно, могут распадаться на ионы.
 Средние соли диссоциируют сразу:
Средние соли диссоциируют сразу:NaCl → Na+ + Cl—
Термическое разложение:
CaCO3 = CaO + CO2
Нитраты разлагаются в зависимости от активности металла соли:
Получение комплексных солей
Реакции солей с лигандами:
AgCl + 2Nh4 = [Ag(NH3)2]Cl
FeCl3 + 6KCN = K3[Fe(CN)6] + 3KCl
Zn(OH)2 + 2NaOH = Na2[Zn(OH)4]
Al2O3 + 2NaOH +3H2O = 2Na[Al(OH)4]
Получение двойных солей
Двойные соли получают совместной кристаллизацией двух солей:
Cr2(SO4)3 + K2SO4 + 24H2O = 2[KCr(SO4) 2 • 12H2O]
Химические свойства солей
Химические свойства средних солей
| Металл | Левее Mg, кроме Li | От Mg до Cu | Правее Cu |
| Продукты | MeNO3 + O2 | MexOy + NO2 + O2 | Me + NO2 + O2 |
| Пример | 2NaNO3 = 2NaNO2 + O2 | 2Cu(NO3)2 = 2CuO + 4NO2 + O2 | 2AgNO3= 2Ag + 2NO2 + O2 |
Соли аммония разлагаются с выделением азота или оксида азота (I), если в составе анион, проявляет окислительные свойства.
 В остальных случаях разложение солей аммония сопровождается выделением аммиака:
В остальных случаях разложение солей аммония сопровождается выделением аммиака:NH4Cl = NH3 + HCl
Взаимодействие солей с металлами:
Fe + CuSO4 = FeSO4 + Cu
Более активные металлы вытесняют менее активные металлы из растворов солей.
Некоторые соли подвержены гидролизу:
Na2CO3 + H2O = NaOH + NaHCO3
FeCl3+ H2O = Fe(OH)Cl2 + HCl
Обменные реакции соли и кислоты, соли с основаниями и взаимодействие солей с солями:
K2CO3 + 2HCl = 2KCl + CO2+H2O
Fe(NO3)3 + 3NaOH = Fe(OH)3 + 3NaNO3
AgCl + 2Na2S2O3 = Nа3[Ag(S2O3)2] + NaCl
Окислительно-восстановительные реакции, обусловленные свойствами катиона или аниона:
10FeSO4 + 2KMnO4 + 8H2SO4 = 5Fe2(SO4)3 + 2MnSO4 + K2SO4 + 8H2O
Химические свойства кислых солей
Диссоциация.
 Кислые соли диссоциируют ступенчато:
Кислые соли диссоциируют ступенчато:NaHCO3 → Na+ +HCO3−
HCO3− → H+ + CO32−
Термическое разложение с образованием средней соли:
Ca(HCO3)2 = CaCO3 + CO2 + H2O
Взаимодействие солей со щелочью. В результате образуется средняя соль:
Ba(HCO3)2 + Ba(OH)2 = 2BaCO3 + 2H2O
Химические свойства основных солей
Термическое разложение:
[Cu(OH)]2CO3 = 2CuO + CO2 + H2O
Реакции солей с кислотами — образование средней соли:
Sn(OH)Cl + HCl = SnCl2 + H2O
Диссоциация — так же как и кислые соли, основные соли диссоциируют ступенчато.

Химические свойства комплексных солей
Избыток сильной кислоты приводит к разрушению комплекса и образованию двух средних солей и воды:
Na[Al(OH)4] + 4HCl(изб.) = NaCl + AlCl3 + 4H2O,
Недостаток сильной кислоты приводит к образованию средней соли активного металла, амфотерного гидроксида и воды:
Na[Al(OH)4] + HCl = NaCl + Al(OH)3 + H2O,
Взаимодействие слабой кислоты с солью образует кислую соль активного металла, амфотерный гидроксид и воду:
Na[Al(OH)4] + H2S = NaHS + Al(OH)3 + H2O,
При действии углекислого или сернистого газа получаются кислая соль активного металла и амфотерный гидроксид:
K3[Cr(OH)6] + 3SO2 = 3KHSO3 + Cr(OH)3,
Реакция солей, образованных сильными кислотами с катионами Fe3+, Al3+ и Cr3+, приводит к взаимному усилению гидролиза.
 Продукты реакции — два амфотерных гидроксида и соль активного металла:
Продукты реакции — два амфотерных гидроксида и соль активного металла:K3[Cr(OH)6] +Al(NO3)3 = Al(OH)3 + Cr(OH)3 + 3KNO3
Разлагаются при нагревании:
K3[Cr(OH)6] =KCrO2 + 2H2O + 2KOH
Вопросы для самопроверки
С чем взаимодействуют средние соли?
Назовите типичные реакции солей.
Из предложенного списка солей выберите те, которые не реагируют с цинком: нитрит калия, бромид железа, карбонат цезия, сульфат меди.
Формула какого вещества пропущена в уравнении реакции:
MgO + … → MgCl2 + Н2O
HCl
Cl2
Cl2O7
HClO3
Соли, растворимость и устойчивость Реакции солей в воде.

Соль можно определить как соединение, которое образуется в результате реакции между кислотой и основанием, но не является водой. В данном разделе будут рассмотрены те свойства солей, которые связаны с ионными равновесиями.
реакции солей в воде
Несколько позже будет показано, что растворимость—это относительное понятие. Однако для целей предстоящего обсуждения мы можем грубо подразделить все соли на растворимые и нерастворимые в воде.
Некоторые соли при растворении в воде образуют нейтральные растворы. Другие соли образуют кислые либо щелочные растворы. Это обусловлено протеканием обратимой реакции между ионами соли и водой, в результате которой образуются сопряженные кислоты либо основания. Окажется ли раствор соли нейтральным, кислым или щелочным-зависит от типа соли. В этом смысле существуют четыре типа солей.
Соли, образуемые сильными кислотами и слабыми основаниями. Соли этого типа при растворении в воде образуют кислый раствор. В качестве примера приведем хлорид аммония Nh5Cl. При растворении этой соли в воде ион аммония действует как
При растворении этой соли в воде ион аммония действует как
Избыточное количество ионов h4O+, образуемое в этом процессе, обусловливает кислые свойства раствора.
Соли, образуемые слабой кислотой и сильным основанием. Соли этого типа при растворении в воде образуют щелочный раствор. В качестве примера приведем ацетат натрия Ch4COONa1 Ацетат-ион действует как основание, акцептируя протон у воды, которая выступает в этом случае в роли кислоты:
Избыточное количество ионов ОН-, образующихся в этом процессе, обусловливает щелочные свойства раствора.
Соли, образуемые сильными кислотами и сильными основаниями. При растворении в воде солей этого типа образуется нейтральный раствор. В качестве примера приведем хлорид натрия NaCl. При растворении в воде эта соль полностью ионизируется, и, следовательно, концентрация ионов Na+ оказывается равной концентрации ионов Cl-. Поскольку ни тот, ни другой ион не вступает в кислотно-основные реакции с водой, в растворе не происходит образования избыточного количества ионов h4O+ либо ОН . Поэтому раствор оказывается нейтральным.
Поэтому раствор оказывается нейтральным.
Соли, образуемые слабыми кислотами и слабыми основаниями. Примером солей такого типа является ацетат аммония. При растворении в воде ион аммония реагирует с водой как кислота, а ацетат-ион реагирует с водой как основание. Обе эти реакции описаны выше. Водный раствор соли, образованной слабой кислотой и слабым основанием, может быть слабокислым, слабощелочным либо нейтральным в зависимости от относительных концентраций ионов h4O+ и ОН-, образуемых в результате реакций катионов и анионов соли с водой. Это зависит от соотношения между значениями констант диссоциации катиона и аниона.
Оглавление:
- часть 1 (Cтроение атома, Химическая связь)
- часть 2 (Газы, жидкости и твердые вещества, Стехиометрия, Энергетика)
- часть 3 (Фазовые равновесия, Химическое равновесие, Ионы, Химическая кинетика)
- часть 4 (Электрохимия)
Что происходит, когда в воду добавляют соль?
Обновлено 19 ноября 2020 г.
Кевин Бек
Отзыв: Лана Бандоим, B.S.
Вид обыкновенной соли, растворенной в воде, вам, по всей вероятности, хорошо знаком, так как это явление буквально господствует на земном шаре. Более двух третей поверхности Земли покрыто океанской водой, которая имеет особенно соленый или «соленый» характер. («Сал» — латинское слово, обозначающее соль.)
Поваренная соль состоит из ионного соединения хлорид натрия, , который состоит из химических элементов натрия и хлора. Вы, вероятно, узнали в детстве из непреднамеренной игры за кухонным столом, что если вы посыпаете солью стакан с чистой водой, соль через некоторое время исчезает; чем больше соли вы добавите, тем больше времени это займет, и для этого может потребоваться некоторое встряхивание или перемешивание.
Твердые вещества растворяя в жидком растворителе (обычно вода в химических экспериментах) создают раствор, а растворение соли в воде является классическим примером того, как полярное растворенное вещество ведет себя в полярном растворителе, таком как H 2 O.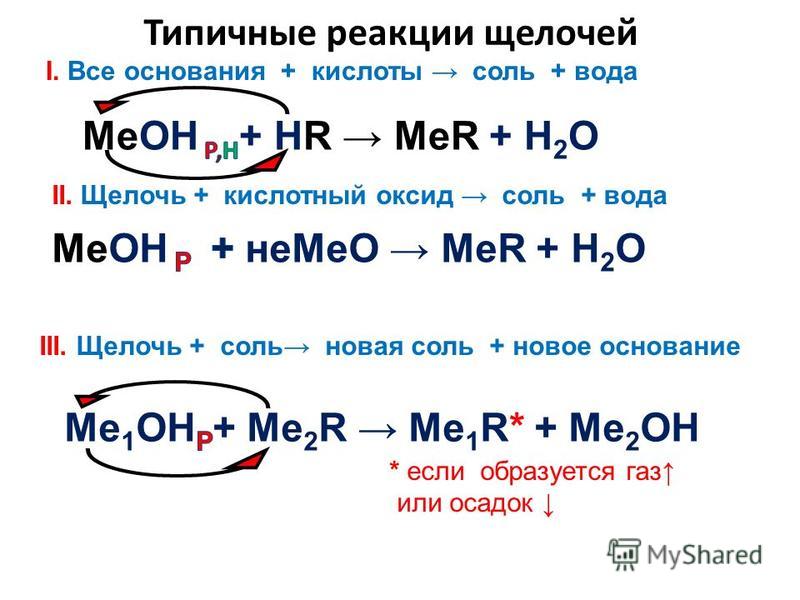 Попутно вы получите гарнир из кислотно-щелочной химии, чтобы дополнить «аромат» опыта в соленой воде!
Попутно вы получите гарнир из кислотно-щелочной химии, чтобы дополнить «аромат» опыта в соленой воде!
Соль и вода: основы
Вода (H 2 O) состоит из элементов водорода (обозначается H в периодической таблице элементов ) и кислорода (O) в соотношении 2-к -1 молярное отношение. Это означает, что на каждый атом О в воде приходится два атома Н. Однако, поскольку кислород примерно в 16 раз массивнее атома водорода, молекула воды почти на девять десятых состоит из кислорода по массе.
Вода является твердым веществом при температуре ниже 0 °C, жидкостью при температуре от 0 °C до 100 °C и газом (водяной пар) при температуре выше 100 °C. Он полярный, а это означает, что, хотя у него нет общего заряда, его части (в данном случае атом кислорода) слегка отрицательны из-за более высокой плотности электронов, а другие части (в данном случае атомы водорода) остаются слегка положительными.
Поваренная соль (хлорид натрия или NaCl) является ионным соединением, что означает, что связь, которую она образует, возникает в результате передачи электрона от одного атома (здесь, Na) другому (Cl), а не в результате обмена электронами, наблюдаемого в ковалентных связях. Это делает связь высоко электроотрицательной, последствия которой при растворении NaCl в воде вскоре станут очевидными.
Это делает связь высоко электроотрицательной, последствия которой при растворении NaCl в воде вскоре станут очевидными.
Реагирует ли NaCl с водой?
Проницательные читатели могут задаться вопросом, почему знакомая химическим лабораториям кислота HCl, соляная кислота, не образуется, когда NaCl помещают в воду. Предполагаемая реакция:
NaCl + H 2 O → NaOH + HCl
Хотя теоретически эта реакция может протекать, она крайне энергетически невыгодна. Это связано с тем, что HCl является гораздо более сильной кислотой, чем вода, и с радостью отдает свой протон в растворах с кислотностью, намного превышающей кислотность воды, которая имеет нейтральный pH 7. Кроме того, гидроксид натрия (NaOH) является очень сильным основанием, которое сожрет. до выпущенного H 9Ионы 0045 + в любом случае образуют воду.
Таким образом, стрелка в приведенном выше уравнении должна указывать в другом направлении, поскольку это благоприятствует термодинамике решения.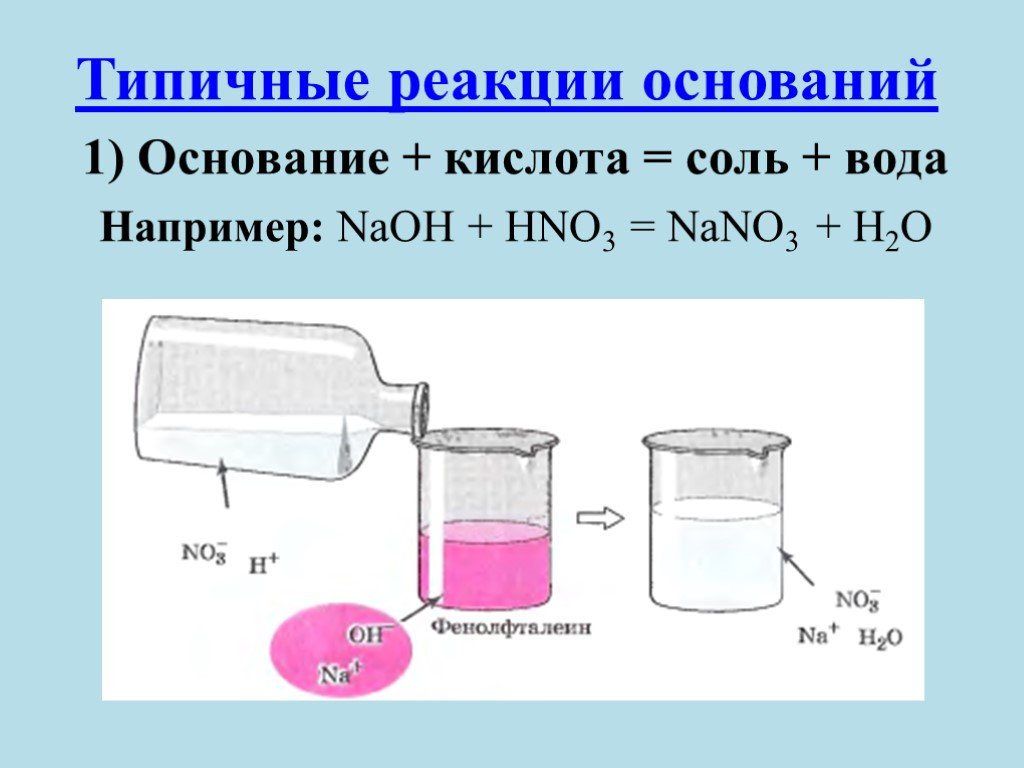
Соль, растворенная в воде: молекулярные взаимодействия
Уже отмечалась полярность как молекулы воды, которую можно представить примерно в форме бумеранга, так и молекулы NaCl, которая больше похожа на короткую гантель.
Когда поваренную соль помещают в воду, слегка электроположительная натриевая часть притягивается к слегка электроотрицательной кислородной части молекул воды. В то же время слегка электроотрицательная хлорная часть NaCl притягивается к слегка электроположительной водородной части воды.
Ни в том, ни в другом случае настоящая связь не создается, но притяжение создает «перетягивание каната», в котором напрягаются ионные связи NaCl и ковалентные связи H 2 O.
Более прочные ковалентные связи воды (которая также удерживается вместе, как правило, водородными связями между молекулами воды) побеждают, и NaCl разрывается, а ионы Na+ и Cl _ свободно занимают место между интактные молекулы H 2 O. тогда NaCl равен растворился .
тогда NaCl равен растворился .
Почему соленая вода тяжелее водопроводной?
••• Изображение голубой воды Кристиана Столтце с сайта Fotolia.com
Обновлено 25 апреля 2017 г. воды. Научно установлено, что объем соленой воды тяжелее, чем такой же объем водопроводной воды, потому что соленая вода имеет более высокую плотность, чем водопроводная вода. Водопроводная вода относительно чистая, обычно содержит небольшое количество минеральных солей и меньшее количество органических веществ. Водные растворы с высокой концентрацией растворенных солей имеют плотность намного большую, чем чистая или водопроводная вода.
Плотность и удельный вес
Плотность и удельный вес — это термины, описывающие концентрацию вещества по массе. Плотность определяется как масса вещества на единицу объема, обычно выражаемая в граммах на кубический сантиметр. Например, плотность чистой воды при температуре 39 градусов по Фаренгейту составляет 1 грамм на кубический сантиметр, а средняя плотность морской воды составляет около 1,027 грамма на кубический сантиметр. Удельный вес, который определяется как отношение плотности вещества к плотности воды, является измерением, используемым во многих научных приложениях. Для большинства веществ плотность и удельный вес почти одинаковы при комнатной температуре.
Удельный вес, который определяется как отношение плотности вещества к плотности воды, является измерением, используемым во многих научных приложениях. Для большинства веществ плотность и удельный вес почти одинаковы при комнатной температуре.
Растворимость солей
Объяснение более высокой плотности соленой воды можно найти в весовых формулах солевых соединений. Вода состоит из относительно легких атомов водорода и кислорода, имеющих атомный вес 1 и 16 соответственно. Большинство солей состоят из атомов более тяжелых металлов, таких как натрий, магний и калий, которые имеют атомный вес 23, 24 и 39 соответственно. Атомы металлов могут быть связаны с другими тяжелыми атомами, такими как хлор, бром и йод, которые имеют атомный вес 35, 80 и 127 соответственно. Соли диссоциируют на ионы (заряженные атомы) при растворении в воде. Молекулы воды координируются вокруг тяжелых ионов, так что объем раствора увеличивается, но в меньшей степени, чем вес раствора.
Плотность растворов солей
Сотни химических соединений классифицируются как соли. Некоторые соли, такие как хлорид натрия и йодид калия, хорошо растворяются в воде при комнатной температуре. Многие другие, такие как сульфат бария и фосфат кальция, практически нерастворимы даже при более высоких температурах. Максимальная плотность раствора соли зависит от веса формулы соли, естественной растворимости или «константы произведения растворимости» соли и температуры.
Плавучий эффект соленой воды
Предметы, погруженные в соленую воду, имеют большую тенденцию всплывать, чем в чистой или водопроводной воде, то есть они обладают большей плавучестью. Этот эффект возникает из-за большей выталкивающей или восходящей силы, действующей на объекты со стороны соленой воды из-за ее большей плотности. Выталкивающая сила, действующая на погруженные объекты со стороны жидкости, подразумевается в принципе Архимеда, который гласит, что любой объект, полностью или частично погруженный в жидкость, вытесняет собственный вес жидкости.


 Средние соли диссоциируют сразу:
Средние соли диссоциируют сразу: В остальных случаях разложение солей аммония сопровождается выделением аммиака:
В остальных случаях разложение солей аммония сопровождается выделением аммиака: Кислые соли диссоциируют ступенчато:
Кислые соли диссоциируют ступенчато:
 Продукты реакции — два амфотерных гидроксида и соль активного металла:
Продукты реакции — два амфотерных гидроксида и соль активного металла: