Содержание
Общая щелочность как свойство воды
Щелочность воды — это способность раствора воды нейтрализовать сильную кислоту. Если в воду вносятся любые изменения, которые могут повысить или понизить значение рН, щелочность защищает воду и ее жизненные формы от резких изменений pH. Эта способность нейтрализовать кислоту или ионы Н+ особенно важна в регионах, пораженных кислотными дождями.
Теоретически, щелочность может быть вызвана любым слабым кислотным анионом, это, как правило, только угольная или бикарбонатная щелочность, которая важна для пресных вод. Щелочные вещества в воде включают гидроксиды или основания. Они могут быть обнаружены их острым вкусом соды.
Исследование по этому направлению:
Санитарно-химический анализ воды
На общую щелочность влияют факторы окружающей среды: дождь, дезинфицирующие вещества, добавление воды и др. Наибольшая щелочность в поверхностной воде происходит от карбоната кальция CaCO3, изымается из пород и почвы. Этот процесс усиливается, если горные породы и грунт разъединить по какой-либо причине, например, горнодобывающая промышленность или городское развитие. Известняк содержит особенно высокий уровень карбоната кальция, и при использовании для снижения кислотности в домах может происходить сток в поверхностные воды, может увеличить щелочность. Вода также может быть непригодной для использования в орошении, если уровень щелочности в воде превышает естественный уровень щелочности в почве.
Этот процесс усиливается, если горные породы и грунт разъединить по какой-либо причине, например, горнодобывающая промышленность или городское развитие. Известняк содержит особенно высокий уровень карбоната кальция, и при использовании для снижения кислотности в домах может происходить сток в поверхностные воды, может увеличить щелочность. Вода также может быть непригодной для использования в орошении, если уровень щелочности в воде превышает естественный уровень щелочности в почве.
В естественной среде угольная щелочность, как правило, составляет большую часть общей щелочности благодаря обычному возникновению и растворению карбонатных пород и наличии диоксида углерода в атмосфере. Другие общие природные компоненты, которые могут способствовать щелочности, включают борат, гидроксид, фосфат, силикат, нитрат, растворенный аммиак, коньюгатные основы некоторых органических кислот и сульфида.
Поскольку концентрация карбоната кальция увеличивается, щелочность также увеличивается, а риск подкисления уменьшается.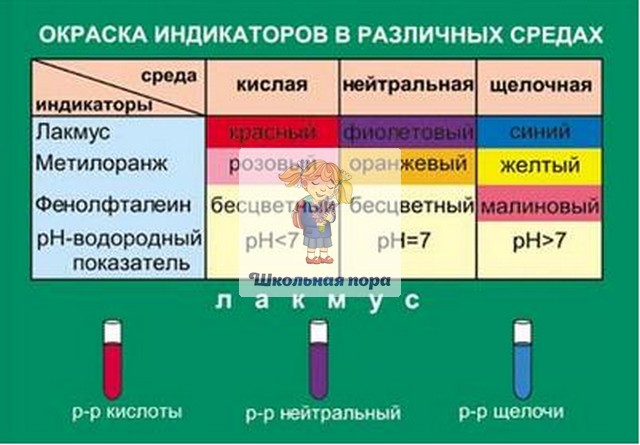
На самом деле можно регулировать уровень щелочности в организме сокращая пищевые продукты, которые производят кислоты, такие как кофеин, алкоголь, сода, мясо, молочные продукты, соль и сахар. Стоит только заменить эти продукты овощами и натуральными необработанными продуктами.
Другие материалы по этому направлению:
Можно ли пить воду с большим содержанием полифосфатов?
Можно ли пить воду с большим содержанием серебра?
Можно ли пить воду с большим содержанием нитратов?
Можно ли пить воду с большим содержанием магния?
Можно ли пить воду с большим содержанием никеля?
Можно ли пить воду с большим содержанием кальция?
Можно ли пить воду с большим содержанием цинка?
Можно ли пить воду с большим содержанием кобальта?
Можно ли пить воду с большим содержанием железа?
Опасность содержания хлора в питьевой воде
Можно ли пить воду, которая содержит нефтепродукты?
Безопасное содержание хрома в воде
Накопление алюминия в питьевой воде
Превышение нормы силикатов в воде
Формальдегид в питьевой воде
Озон при проведении дезинфекции воды
Бактерии E.
coli в питьевой воде
Выявление энтеробактерий в питьевой воде
Гетеротрофные микроорганизмы в питьевой воде
Потребность в кремнии
Загрязнение воды колиформными бактериями
Влияние марганца на организм человека
Поверхностно-активные вещества
Без проведения анализа воды невозможно заметить щелочного состояния через бикарбонатные ионы, кроме случаев, когда они присутствуют в больших количествах. В отличие от этого, специалисты Судебной независимой экспертизы Украины легко обнаруживают щелочность через даже небольшое количество ионов карбоната и гидроксида.
Высоко минерализованные щелочные воды вызывают чрезмерное высыхание кожи из-за того, что они склонны к удалению нормальных кожных масел.
Проблемные количества щелочности можно удалить обратным осмосом рядом с другими твердыми веществами. Другие способы очистки воды также удаляют общие растворенные твердые вещества, но они несколько менее подходят для домашнего использования по сравнению с обратным осмосом.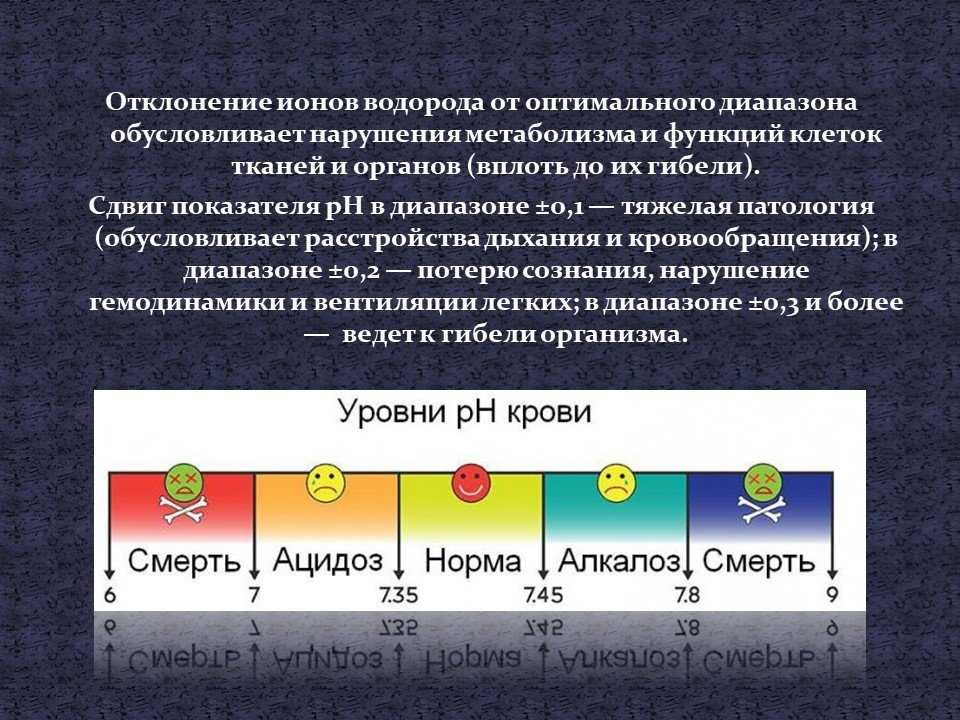 Такими методами являются дистилляция и деионизация (деминерализация).
Такими методами являются дистилляция и деионизация (деминерализация).
Популярные материалы:
Фестиваль Здоровья «СТОЛИЦА ЖИЗНИ»
Залитие квартиры, что делать если Вас затопили соседи?
Акт о заливе квартиры
Права и обязанности судебного эксперта
Как назначить судебную экспертизу? Информация для назначения судебной экспертизы.
Как определить размер морального ущерба?
Оценка автомобиля после ДТП
org/Article»>Результаты экспертизы и их использование. Заключение эксперта
Заключение эксперта. Как ознакомится с выводом судебной экспертизы?
Загрязнение воды колиформными бактериями
Ph воды — щелочность воды, нормы и расчет
Человек оценивает качество питьевой воды по двум основным показателям – цвету и запаху. Но есть не менее важные свойства, которые напрямую влияют на то, можно ли считать воду пригодной для питья. Особенно это касается щелочности, о которой осведомлены далеко не все. В данной статье мы постараемся разобраться в том, какая норма допустима, как ее определить и каким образом привести уровень щелочности к оптимальным показателям.
Что такое щелочность воды?
Во-первых, следует определиться с тем, что из себя представляет данное понятие. Если обращаться к учебникам, щелочность – это число гидроксильных ионов, которые содержатся в воде, и анионов слабых кислот. Следует отметить, что щелочной называется та среда, в которой водородный показатель превышает значение 7. Все, что ниже – это кислая среда. При этом щелочность и pH связаны напрямую – чем больше первый показатель, тем выше и второй. Щелочность измеряется в ммоль/дм³, pH – в единицах.
Следует отметить, что щелочной называется та среда, в которой водородный показатель превышает значение 7. Все, что ниже – это кислая среда. При этом щелочность и pH связаны напрямую – чем больше первый показатель, тем выше и второй. Щелочность измеряется в ммоль/дм³, pH – в единицах.
В соответствии с европейскими санитарными нормами допустимым значением pH для питьевой воды является диапазон 6,5-8,5 единиц, дистиллированной, то есть условно нейтральной – 7 единиц. Предельно допустимой концентрацией по щелочности согласно нормам СанПиН является значение 4,4 ммоль/дм³. Это касается нецентрализованных источников водоснабжения.
Каким образом показатели щелочности могут влиять на организм?
Нормам щелочности придается большое значение и тому есть важная причина – ее уровень напрямую влияет на состояние организма. Оптимальный показатель поможет стабилизировать различные функции организма, включая обменные процессы, а также активизировать мозговую деятельность.
Однако, в случае превышения установленной нормами концентрации возможно возникновение ряда проблем: зуда, высыпания, раздражения слизистой оболочки. Именно поэтому столь важно определять щелочность питьевой воды и контролировать эти показатели.
Именно поэтому столь важно определять щелочность питьевой воды и контролировать эти показатели.
Сохранение кислотно-щелочного баланса возможно благодаря оптимизации рациона, однако сложность в том, что большая часть продуктов имеет в своем составе кислую среду, поэтому важно также пить и воду, что увеличит объем переносимого кровью кислорода. Но подойдет не всякая вода, а со значениями, близкими к нейтральным.
Определение щелочности и регулирование уровня pH
Уровень pH может колебаться и зависит от региона. В случае превышения допустимых значений необходимо уделить внимание их стабилизации. Для измерения уровня pH в домашних условиях используются специальные тестеры, но для определения щелочности не обойтись без услуг профессиональных лабораторий, оснащенных современным оборудованием и имеющих необходимый уровень аккредитации.
После проведения исследования специалисты предоставят рекомендации по поддержанию уровня щелочности. В случае его превышения – помогут выбрать решение для его снижения за счет использования специальных фильтров. В частности, с этой проблемой эффективно справляются системы обратного осмоса, которые не только стабилизируют показатели, но также нормализуют состав воды, уменьшая жесткость и минерализацию.
В частности, с этой проблемой эффективно справляются системы обратного осмоса, которые не только стабилизируют показатели, но также нормализуют состав воды, уменьшая жесткость и минерализацию.
Подробная информация об услуге в разделеАнализ воды
Не знаете, какой анализ выбрать? Наши специалисты помогут!
Позвоните нам: +7 (495) 108-24-26 или заполните форму
Заявка на анализ
Телефон*
Сообщение
Я согласен(а) наобработку персональных данных
Метод анализа рН и щелочности
ARM Project Главная | Информация для волонтеров | Результаты
pH и щелочность
Метод отбора проб из озер — Метод отбора проб из рек — Протоколы анализа — Обслуживание pH-электрода
**
Исходная информация
pH – это мера концентрации ионов водорода в воде, оцениваемая по шкале от 1,0 до 14,0. Чем ниже рН воды, тем она более кислая. Чем выше рН воды, тем она более щелочная или щелочная.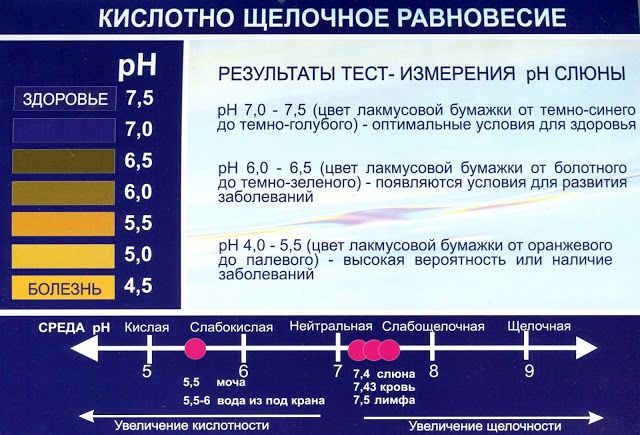 pH влияет на многие химические и биологические процессы в воде, и разные организмы имеют разные диапазоны pH, в которых они процветают. Наибольшее разнообразие водных животных предпочитает диапазон pH от 6,5 до 8,0. pH за пределами этого диапазона снижает разнообразие в ручье, потому что он подвергает стрессу физиологические системы большинства организмов и может снизить воспроизводство. Низкий pH также может позволить токсичным элементам и соединениям, таким как тяжелые металлы, стать мобильными и «доступными» для поглощения водными растениями и животными. Опять же, это может создать условия, токсичные для водных организмов, особенно для чувствительных видов, таких как форель.
pH влияет на многие химические и биологические процессы в воде, и разные организмы имеют разные диапазоны pH, в которых они процветают. Наибольшее разнообразие водных животных предпочитает диапазон pH от 6,5 до 8,0. pH за пределами этого диапазона снижает разнообразие в ручье, потому что он подвергает стрессу физиологические системы большинства организмов и может снизить воспроизводство. Низкий pH также может позволить токсичным элементам и соединениям, таким как тяжелые металлы, стать мобильными и «доступными» для поглощения водными растениями и животными. Опять же, это может создать условия, токсичные для водных организмов, особенно для чувствительных видов, таких как форель.
Изменения кислотности могут быть вызваны атмосферными отложениями (кислотные дожди или кислотный шок от таяния снега), окружающими породами и сбросами сточных вод. Технически шкала pH измеряет логарифмическую концентрацию ионов водорода (H+) и гидроксида (OH-), которые составляют воду (H+ + OH- = h30). Когда оба типа ионов находятся в одинаковой концентрации, pH равен 7,0 или нейтральному. Ниже 7,0 вода кислая (ионов водорода больше, чем гидроксид-ионов). Когда pH выше 7,0, вода является щелочной или щелочной (в ней больше ионов гидроксида, чем ионов водорода). Поскольку шкала логарифмическая, падение рН на 1,0 единицу соответствует 10-кратному увеличению кислотности. Так, проба воды с рН 5,0 в десять раз более кислая, чем проба с рН 6,0. pH 4,0 в 100 раз более кислый, чем pH 6,0.
Ниже 7,0 вода кислая (ионов водорода больше, чем гидроксид-ионов). Когда pH выше 7,0, вода является щелочной или щелочной (в ней больше ионов гидроксида, чем ионов водорода). Поскольку шкала логарифмическая, падение рН на 1,0 единицу соответствует 10-кратному увеличению кислотности. Так, проба воды с рН 5,0 в десять раз более кислая, чем проба с рН 6,0. pH 4,0 в 100 раз более кислый, чем pH 6,0.
Щелочность — это мера «буферной способности» реки или ее способности нейтрализовать кислоты. Щелочные соединения в воде, такие как бикарбонаты (одним из видов является пищевая сода), карбонаты и гидроксиды, удаляют ионы H+ и снижают кислотность воды (что означает повышение pH). Обычно они делают это, объединяясь с ионами H+, чтобы получить новые соединения. Без этой кислотонейтрализующей способности любая кислота, добавленная в реку, вызвала бы немедленное изменение pH. Измерение щелочности важно для определения способности реки нейтрализовать кислотное загрязнение (измеряемое рН) в результате дождя или таяния снега. Это один из лучших показателей чувствительности реки к воздействию кислоты. Щелочность возникает из-за горных пород и почв, солей, определенных видов деятельности растений и некоторых промышленных сбросов сточных вод. Общая щелочность измеряется путем отбора пробы воды и измерения количества кислоты, необходимой для доведения пробы до рН 4,2. При этом рН все щелочные соединения в образце «израсходованы». Результат указывается в миллиграммах на литр (мг/л) карбоната кальция.
Это один из лучших показателей чувствительности реки к воздействию кислоты. Щелочность возникает из-за горных пород и почв, солей, определенных видов деятельности растений и некоторых промышленных сбросов сточных вод. Общая щелочность измеряется путем отбора пробы воды и измерения количества кислоты, необходимой для доведения пробы до рН 4,2. При этом рН все щелочные соединения в образце «израсходованы». Результат указывается в миллиграммах на литр (мг/л) карбоната кальция.
Массачусетский проект мониторинга кислотных дождей классифицирует воды в соответствии с их щелочностью следующим образом:
| <0 * мг/л: Подкисленная | >5-10 мг/л: Высокочувствительный |
| >0-2 мг/л: критическая | >10-20 мг/л: чувствительный |
| >2-5 мг/л: Исчезающий | >20 мг/л: не чувствительный |
* и рН менее 5,0.
Метод отбора проб для озер
Полевое оборудование
- Бутыль для проб из полиэтилена высокой плотности, 500 мл
- Лист технических данных
- Охладитель и охладители или лед
- Пакет Zip-loc (размер 1 галлон)
Метод
Примечание: Поместите в холодильник достаточное количество льда или его эквивалента, чтобы как можно скорее снизить температуру образца до 4°C.
Метод отбора проб для рек
Полевое оборудование
- Бутыль для проб из полиэтилена высокой плотности, 500 мл
- Лист технических данных
- Охладитель и охладители или лед
- Пакет Zip-loc (размер 1 галлон)
Протокол отбора проб
Пробы следует брать из репрезентативной проточной воды. Вода должна быть глубже, чем бутыли с пробами, и на ее поверхности не должно быть пены и мусора. Если на вашем обычном месте отбора проб вода недостаточно глубока, поищите поблизости другое место, столь же репрезентативное для этого места, но более глубокое. Если его нет, не берите пробу и укажите в полевом листе, что уровень воды слишком низкий. Обратите внимание, что отбор проб из берега ручья не рекомендуется, так как это может привести к нерепрезентативным выборкам.
Осторожно войдите в ручей, двигаясь вверх по течению и избегая взбалтывания донных отложений. Подождите, пока вернутся условия, предшествующие возмущению (из-за перехода вброд), прежде чем брать пробу. Если вы находитесь в каноэ, пусть ваш партнер стабилизирует его.
Если вы находитесь в каноэ, пусть ваш партнер стабилизирует его.
Если возможно, возьмите пробу в середине потока. Если нет, отойдите от берега как можно дальше. Идите вверх по течению и соберите пробу так, чтобы вы не стояли и не плавали против течения бутылки.
Откройте бутыль с пробой и трижды промойте речной водой: частично наполните бутылку, закройте крышкой, встряхните и опорожните по течению.
Чтобы взять образец, полностью погрузите бутыль в воду, наполнив ее до краев.
Закройте бутыль крышкой, пока она еще находится под водой, чтобы удалить воздух из бутылки с пробой.
Вернитесь на берег и поместите образец в холодильник со льдом.
Немедленно полностью заполните полевой лист реки, написав «pH/ANC» в колонке «Химия»
Начало страницы
Метод анализа
Измерение pH
Необходимое оборудование:
- pH-метр0062
- Буферы (4.01 и 7.00)
- Вода деионизированная или дистиллированная
- Стеклянный стакан на 150 мл
- Магнитная мешалка
- Мешалка
- Градуированный цилиндр на 100 мл (дополнительно для измерения pH)
После калибровки глюкометра с буферами промойте электрод(ы) и стеклянную посуду дистиллированной или деионизированной водой. Тщательно отмерьте 100 мл вашего образца и поместите в химический стакан на 150 мл для определения pH и щелочности. Поместите промытый электрод в испытуемый образец. Мы настоятельно рекомендуем перед анализом дать всем образцам нагреться до комнатной температуры в плотно закрытой бутылке. Если вы проводите другие анализы с пробой воды, имейте в виду, что анализ pH следует проводить в течение 5 минут после открытия бутылки с пробой. Образец следует очень осторожно перемешать, желательно магнитной мешалкой. Стабилизация показаний может занять до 3 минут. Когда стабилизируется, но не более 5 минут, запишите рН образца с точностью до 0,01 единицы рН 9.0003
Тщательно отмерьте 100 мл вашего образца и поместите в химический стакан на 150 мл для определения pH и щелочности. Поместите промытый электрод в испытуемый образец. Мы настоятельно рекомендуем перед анализом дать всем образцам нагреться до комнатной температуры в плотно закрытой бутылке. Если вы проводите другие анализы с пробой воды, имейте в виду, что анализ pH следует проводить в течение 5 минут после открытия бутылки с пробой. Образец следует очень осторожно перемешать, желательно магнитной мешалкой. Стабилизация показаний может занять до 3 минут. Когда стабилизируется, но не более 5 минут, запишите рН образца с точностью до 0,01 единицы рН 9.0003
Измерение щелочности
Необходимое оборудование:
- pH-метр
- Многоразовый электрод
- Буферы (4.01 и 7.00)
- Вода деионизированная или дистиллированная
- Стеклянный стакан на 150 мл
- Магнитная мешалка
- Мешалка
- Градуированный цилиндр 100 мл
- Цифровой титратор
- Картридж с серной кислотой 0,16 н.

После размещения картриджа с серной кислотой в цифровом титраторе Hach обязательно продвигайте поршень вручную до тех пор, пока титрант не вытеснится из нагнетательного наконечника. Сделайте это так, как если бы вы использовали шприц для подкожных инъекций, подняв наконечник для доставки, чтобы удалить пузырьки. Убери все пузыри! Затем продвигайте поршень с помощью ручки подачи на конце титратора, пока не убедитесь, что наконечник подачи заполнен раствором. Проверьте наличие утечек в месте соединения наконечника с картриджем. ХОРОШО промойте наконечник дистиллированной водой или образцом; это важно, потому что титрант является концентрированным и его немного хватает на долгое время. Сбросьте счетчик на ноль, и вы готовы к титрованию.
После завершения титрования и записи цифр использованного титранта промойте наконечник подачи дистиллированной водой или следующей пробой, обнулите счетчик (ОБ ЭТОМ ЛЕГКО ЗАБЫТЬ, КОГДА ЗАНЯТЫ), и вы немедленно готовы к следующей пробе.
Титрование проходит лучше, если наконечник подачи находится под поверхностью титруемого раствора. Для одного или двух образцов титратор можно держать в руке, однако титратор проще закрепить на кольцевой подставке с помощью зажима. Старайтесь удерживать титратор в вертикальном положении во время всех титрований; горизонтальное размещение титратора на столе между титрациями может привести к образованию пузырьков на наконечнике.
Поставляемые кислотные картриджи представляют собой 0,16 н. серную кислоту. Наши воды, как правило, имеют довольно низкую щелочность, поэтому мы используем специальную процедуру определения щелочности с двойной конечной точкой для точного измерения щелочности ниже 20 мг л-1.
После считывания и записи pH, как описано выше, титруйте
с помощью цифрового титратора и картриджа с серной кислотой до pH 4,5; титрант, использованный до этого момента, запишите как А. Продолжайте титрование до рН 4,2. Запишите титрант, использованный до этой точки, как B.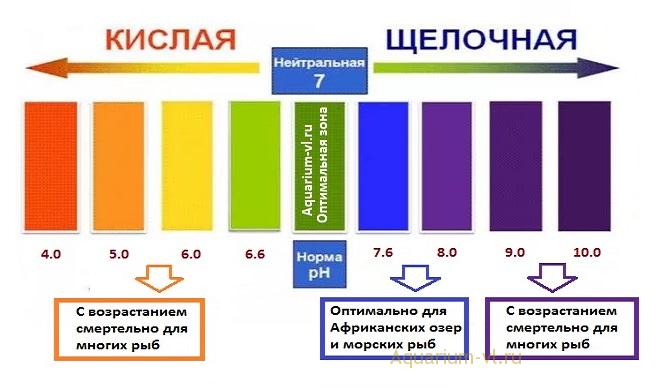 Если начальный pH меньше 4,5, запишите начальное значение pH. Титруйте до тех пор, пока pH не станет на 0,3 единицы ниже начальной точки. Введите цифры титранта, используемые как B; A = 0. Запишите показание pH на том месте, где вы остановились (для проверки точности). Мы будем использовать компьютеры для расчета щелочности, но вы можете сделать свои собственные расчеты, используя приведенные ниже формулы. Примеры помогут прояснить, какие могут быть несколько запутанные формулы.
Если начальный pH меньше 4,5, запишите начальное значение pH. Титруйте до тех пор, пока pH не станет на 0,3 единицы ниже начальной точки. Введите цифры титранта, используемые как B; A = 0. Запишите показание pH на том месте, где вы остановились (для проверки точности). Мы будем использовать компьютеры для расчета щелочности, но вы можете сделать свои собственные расчеты, используя приведенные ниже формулы. Примеры помогут прояснить, какие могут быть несколько запутанные формулы.
A = цифры, используемые для pH 4,5
B = цифры, используемые для pH 4,2 или 0,3 единиц pH ниже начального значения (общий титрант, включая A)
Щелочность двойной конечной точки = (2A — B) x 0,1
ПРИМЕР : Образцу требовалось 120 цифр, чтобы достичь pH 4,5. Для достижения pH 4,2 потребовалось еще 15 цифр, всего 135 цифр. Следовательно, A = 120 и B = 135.
Двойная конечная щелочность = (240 — 135) x 0,1 = 10,5 мг/л
ПРИМЕР: Образец имел начальный pH 4,3. Образцу требовалось 22 цифры, чтобы снизить рН до 4,0. Следовательно, А = 0; В = 22,
Образцу требовалось 22 цифры, чтобы снизить рН до 4,0. Следовательно, А = 0; В = 22,
Двойная конечная щелочность = (0 — 22) x 0,1 = -2,2 мг/л
Хотя может показаться, что отрицательная щелочность не имеет особого смысла, это чрезвычайно важный показатель для оценки подкисления.
Уход и техническое обслуживание pH-электрода
- Хранение
- Раствор для заполнения электрода сравнения
- Предварительное тестирование реакции электрода
- Стеклянный электрод для омоложения
- Окончательный тест на линейность
- Чувствительность движения
- Калибровка
- Значения буфера при различных температурах
- pH и щелочность QA/QC
Общие процедуры ухода за электродами и обращения с ними очень важны в вашей лаборатории, поскольку качество измерений pH зависит от состояния ваших электродов. Для большей точности ваших измерений и продления срока службы электрода есть несколько аспектов ухода за электродами, с которыми вы должны быть знакомы.
Хранение
Стеклянные комбинированные или отдельные pH-электроды и электроды сравнения должны быть влажными. Для электрода сравнения требуется свободнотекучее соединение, поэтому всегда следите за тем, чтобы уровень заполняющего раствора сравнения был значительно выше уровня раствора для хранения или пробы. Это обеспечит положительное давление напора, которое вытеснит заполняющий раствор через соединение. вместо раствора для хранения в зонд.
Для сухого хранения втулка или заглушка должны закрывать заливное отверстие, чтобы уменьшить поток заполняющего раствора. Однако во время измерения или хранения в буфере с pH 4 эту втулку или заглушку необходимо сдвинуть или снять, чтобы обеспечить поступление эталонного раствора в образец.
Чтобы получить более быстрый отклик электрода , стеклянный электрод следует хранить в слегка кислом растворе. В защитный колпачок для стеклянного электрода нанесите одну-две капли буфера с pH 4 и осторожно наденьте колпачок на электрод.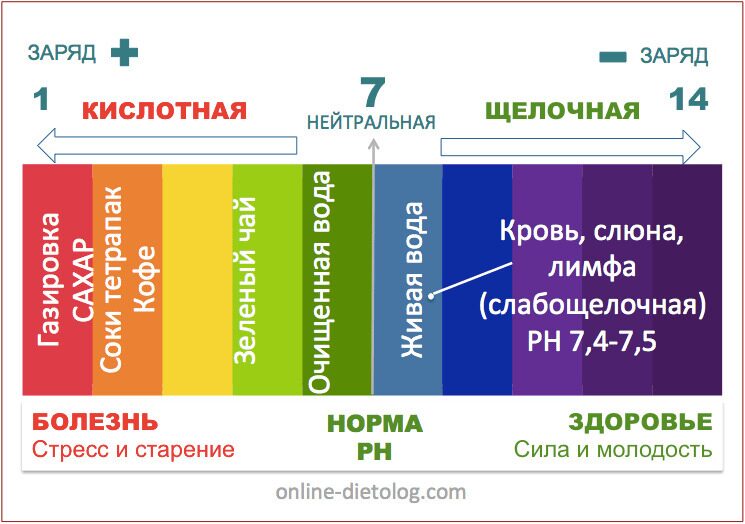 Дистиллированная вода извлекает ионы из колбы, вызывая более медленный отклик; Буфер с pH 7 в течение длительного периода времени немного старит электрод.
Дистиллированная вода извлекает ионы из колбы, вызывая более медленный отклик; Буфер с pH 7 в течение длительного периода времени немного старит электрод.
При использовании отдельного электрода сравнения лучшим решением было бы поместить электрод сравнения в собственный заполняющий раствор, но это может привести к беспорядку. Подача KCl с обеих сторон соединения обеспечивает более свободный поток. Для уменьшения солевой корки насыщенного раствора можно использовать примерно 0,1 М раствор KCl, но только для хранения. Опыт показывает, что в большинстве случаев достаточно просто закрыть заливное отверстие защитным рукавом и хранить в сухом состоянии, если соблюдается процедура замачивания.
Для комбинированных электродов храните электрод в комбинированном растворе примерно 0,1 М KCl в буфере с рН 4.
За день или более до анализа замочите оба электрода в буфере с pH 4 и во время анализа поместите электроды в тот же буфер, когда они не используются.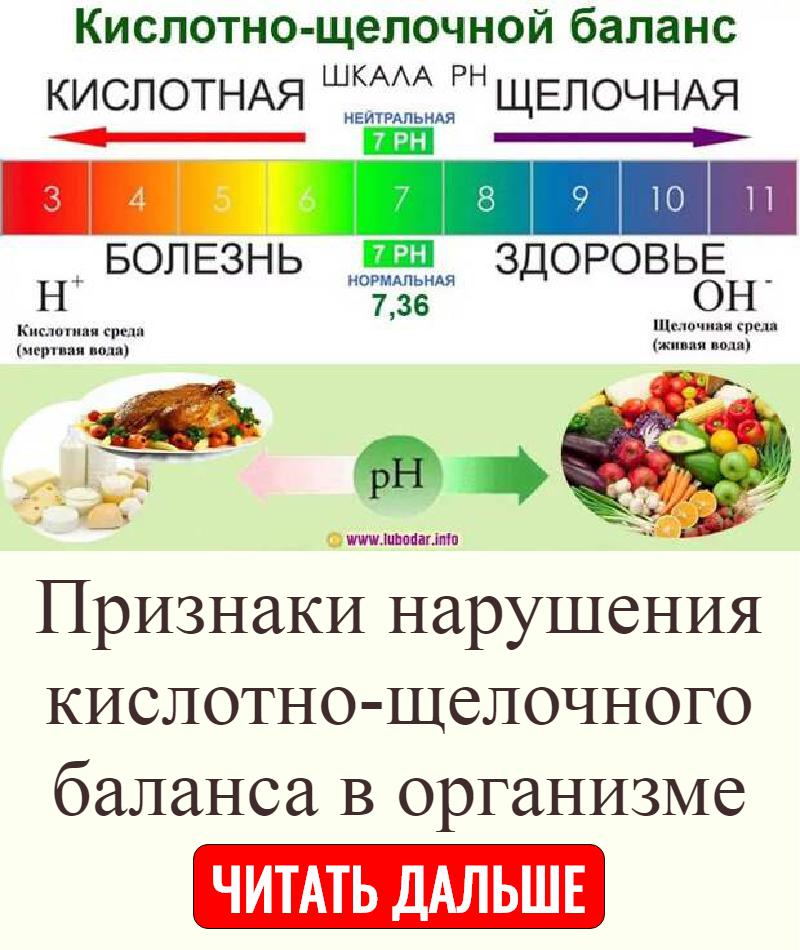
Раствор для заполнения электродов сравнения
Внимательно прочтите инструкции, прилагаемые к электродам. Насыщенные каломельные электроды сравнения, такие как те, которые используются в Проекте мониторинга кислотных дождей, должны , а не , заполняются растворами, содержащими хлорид серебра (AgCl). Мы используем только растворы 4M KCl. Однако наиболее распространенным заполняющим раствором для комбинированных электродов является 4 М KCl, насыщенный AgCl. Убедитесь, что раствор для заполнения подходит для ваших электродов, и еще раз проверьте, соответствует ли раствор для заполнения этим требованиям.
Постоянно заполненные или гелевые электроды Из-за их уникального соединения микропор рекомендуется хранить их в подвешенном состоянии.
Предварительное тестирование реакции электрода
Если ваш электрод демонстрирует медленную реакцию, плохой диапазон между двумя буферными значениями или чрезмерную чувствительность к движению электрода, для улучшения его работы может потребоваться омоложение.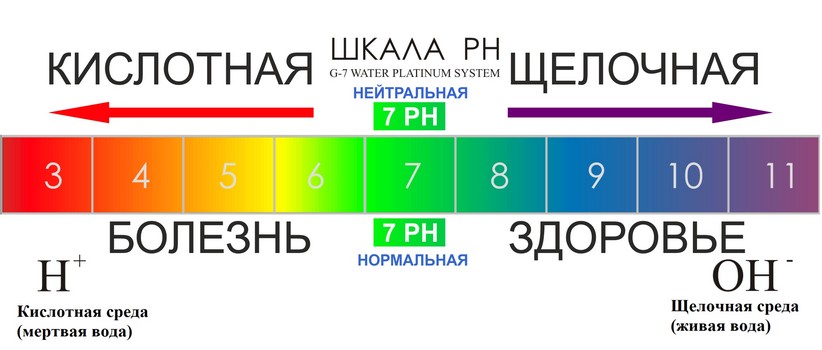
Реакция зависит от электрода и раствора, в котором он находится. Обычно рабочие электроды достигают 0,05 единиц pH от конечного показания в буфере в течение 10 секунд. Стабильное показание (изменение менее 0,01 единицы pH в минуту) должно быть достигнуто в пробах пресной воды в течение одной или двух минут. Если придется ждать слишком долго (5 минут и более), то может измениться и сам pH из-за контакта пробы воды с воздухом.
Для электродов также может потребоваться регулировка наклона до значений, значительно отличающихся от 100 % для двухточечной калибровки. Если вы сомневаетесь, выполните следующий тест:
Установите измеритель на 100% наклон и комнатную температуру, затем выполните стандартизацию, как обычно, с буферным раствором pH 7. Не перемещая шкалу наклона, считайте буфер с pH 4. Он должен быть между 3,85 и 4,15; установите наклон на значение pH 4, наклон должен составлять от 95% до 105%.
Если у вашего электрода есть одна из вышеперечисленных проблем или он чувствителен к движению, необходимо провести омоложение.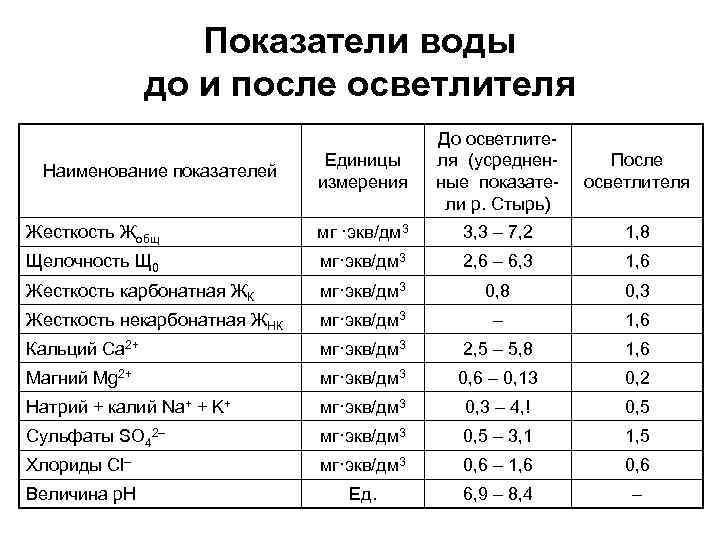
Омолаживающий стеклянный электрод
Для обработки колбы pH-электрода:
Используйте по 1 флакону кислоты и основания (0,1 н.).
БУДЬТЕ ОСТОРОЖНЫ ПРИ РАБОТЕ С ЭТИМИ РАСТВОРАМИ. ЕСЛИ НА ВАС ПОПАДАЛИ, СМОЙТЕ БОЛЬШИМ КОЛИЧЕСТВОМ ВОДЫ.
- Опустите грушу электрода в кислоту и подождите, пока измеритель не покажет pH ~1
- Промойте электрод, затем погрузите его в базу. Подождите, пока измеритель не покажет pH ~ 13
- Повторите этот цикл полоскания и погружения несколько раз (минимум 3 раза, лучше 6 раз)
- Для последнего цикла вы можете оставить электрод в щелочи на 5 минут, затем ненадолго в кислоте, пока он не достигнет pH ~ 1
- Затем промойте электрод водопроводной водой и оставьте в буфере с pH 4 на 2 часа
- Промойте электроды и повторно откалибруйте измеритель, как обычно, с буферами pH 7 и pH 4.
Для обработки электрода сравнения:
Замените 4M раствор KCl в электроде сравнения и избавьтесь от кристаллов, которые могли образоваться.
Если кристаллов много, вытряхните раствор, налейте чистую деионизированную воду в заливное отверстие и замочите кончик электрода в горячей водопроводной воде примерно на 15 минут, пока кристаллы не растворятся. Затем вытряхните всю жидкость из заливного отверстия в электроде сравнения и заполните свежим 4 М KCl. Оставьте электрод при комнатной температуре на ½ часа перед использованием. Часто добавляйте больше 4M раствора KCl к электроду сравнения, так как он будет постоянно вытекать и испаряться. Раствор в электроде должен находиться в пределах ½ дюйма от заливного отверстия. Отверстие должно быть открыто при измерении рН, но закройте его по истечении дня, иначе раствор испарится и сформируются новые кристаллы (но не закрывайте отверстие, если вы собираетесь хранить электрод, погруженный в раствор с рН 4). Если у вас все еще есть проблемы с медленным откликом, попробуйте потереть наконечник о синие джинсы или очень мелкую (зернистость 600) наждачную бумагу.
Для комбинированных электродов выполните обе процедуры, описанные выше.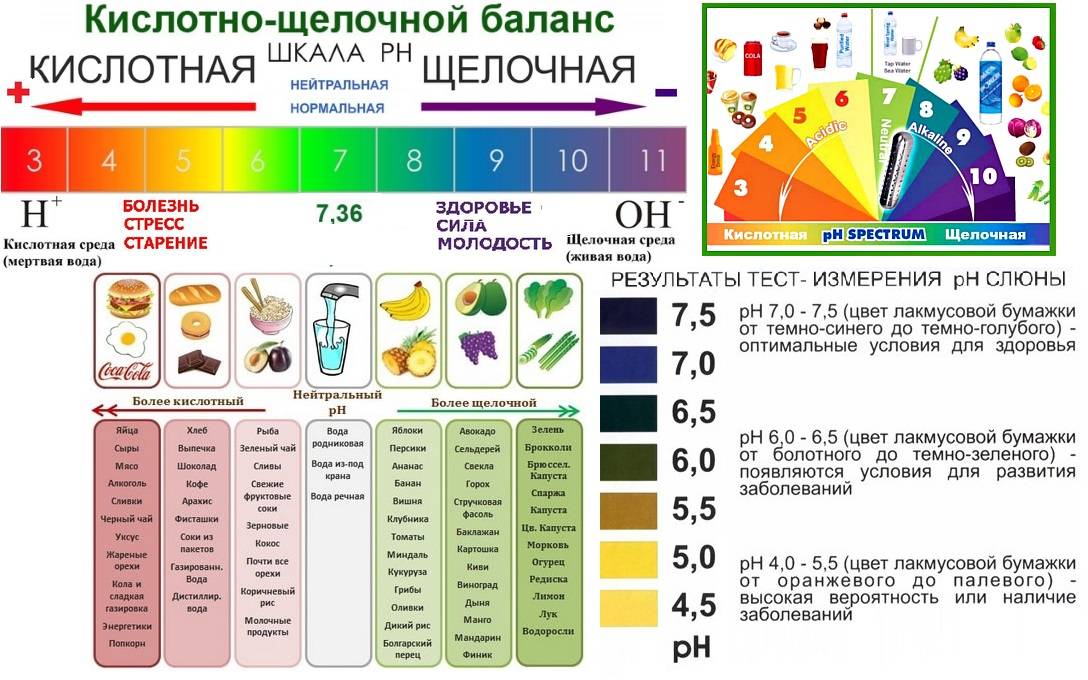
Окончательный тест на линейность
Стандартизируйте расходомер, как описано ниже. Промойте электроды и чашу для образцов чистой деионизированной водой. Затем титруйте 100,0 мл деионизированной воды 0,16 н. кислотой следующим образом: Убедитесь, что ваш цифровой титратор работает и обнулите его. Добавьте 10 цифр кислоты, запишите цифры и pH, увеличьте кислоту до 20 цифр, запишите pH; повторяйте, пока не добавите 100 цифр кислоты, и остановитесь. Отправьте нам результаты, и мы отправим вам отчет. Если вы хотите сами увидеть результаты, попробуйте построить график зависимости концентрации ионов водорода (H = 10(-pH)) от цифр и посмотрите, прямая ли линия.
Чувствительность к движению
Если ваш измеритель дает неверные показания и чувствителен к вашим прикосновениям, возможно, он неправильно заземлен. Попробуйте использовать вилку с тремя контактами или подсоедините провод от счетчика к трубе с холодной водой. Иногда проблему неустойчивых показаний или постоянства неверных показаний можно решить, несколько раз отсоединив и снова подсоединив коннекторы электродов. По-видимому, оксидный слой может иногда вызывать эти симптомы.
По-видимому, оксидный слой может иногда вызывать эти симптомы.
Калибровка
Измеритель pH должен быть стандартизирован (откалиброван) перед анализом проб и после каждых 25 анализов проб. Буферы должны быть комнатной температуры (68°F). Выньте электроды из буферного раствора с рН 4, где они находились не менее суток. Промыть деионизированной водой. Вставьте электроды в буферный раствор с pH 7,00 и отрегулируйте шкалу калибровки до тех пор, пока на приборе не отобразится точно pH 7,00. Снимите электроды и промойте деионизированной водой. Поместите электроды в буфер с pH 4,01 и регулируйте наклон, пока измеритель не покажет pH 4,01. Промыть деионизированной водой.
Примечание по буферам . Точность вашего измерения pH находится в прямой зависимости от точности стандартного буферного раствора, используемого для калибровки вашего pH-метра. Чтобы поддерживать разумную степень точности при измерении pH, следует соблюдать ряд мер предосторожности, касающихся обращения с буферными растворами и их использования. К ним относятся:
К ним относятся:
1. Не используйте буферы после истечения срока их действия. Рост плесени, поглощение CO2 и загрязнение вызывают изменения pH буфера.
2. Не используйте буферы, в которых плавает плесень.
3. Всегда закрывайте контейнер с буфером при хранении, чтобы предотвратить загрязнение и снизить поглощение CO2.
4. Значения pH буфера меняются в зависимости от температуры. Обязательно измерьте температуру буферного раствора и проверьте ее значение при этой температуре перед стандартизацией измерителя (см. ниже).
5. Не выливайте использованный буфер обратно в бутыль.
Буферные значения при различных температурах
| Температура | Буферы | |||
| °С | °F | pH 4 | рН 7 | |
| 0 | 32 | 4.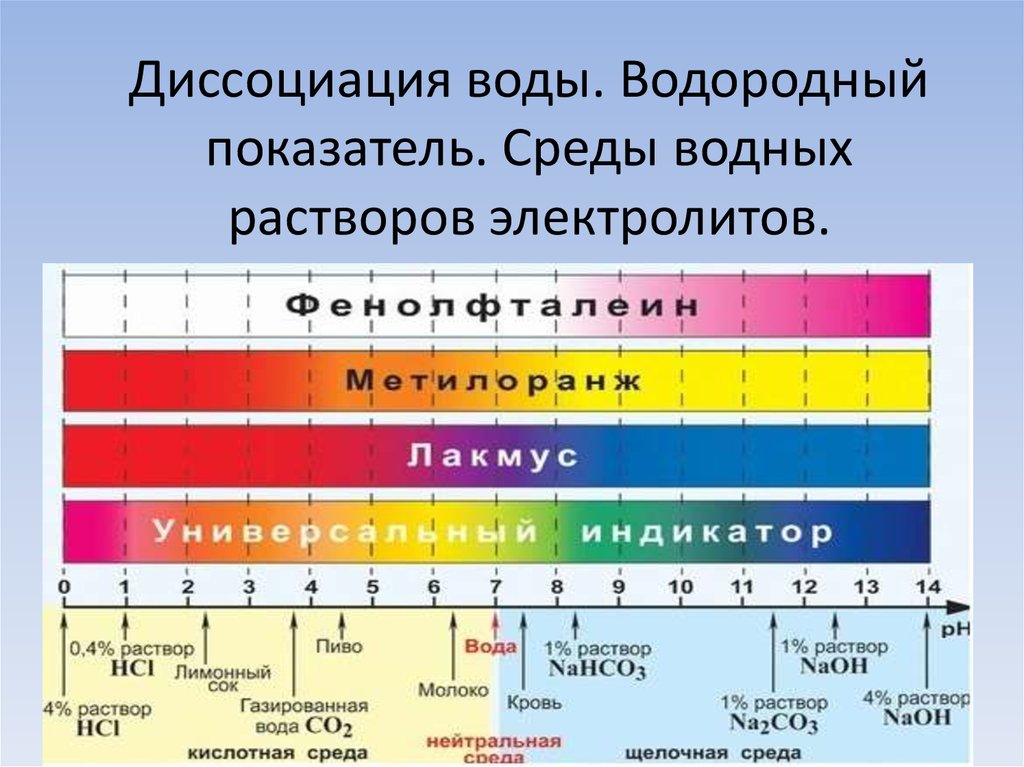 003 003 | 7.119 | |
| 5 | 41 | 3,998 | 7.086 | |
| 10 | 50 | 3,996 | 7.058 | |
| 15 | 59 | 3,996 | 7.035 | |
| 20 | 68 | 3,999 | 7.015 | |
| 25 | 77 | 4.004 | 7.000 | |
| 30 | 86 | 4.011 | 6,998 | |
pH и щелочность QA/QC
Контроль качества pH и щелочности состоит из обычного измерения pH и титрования образца, подготовленного WRRC и отправленного вам перед сбором в полевых условиях. Таких образцов будет три. За несколько дней до отбора проб вы получите от нас первый образец QA/QC вместе с открыткой для отчета о ваших результатах. Это диагностический образец. Следуйте процедурам, описанным для измерения pH и щелочности.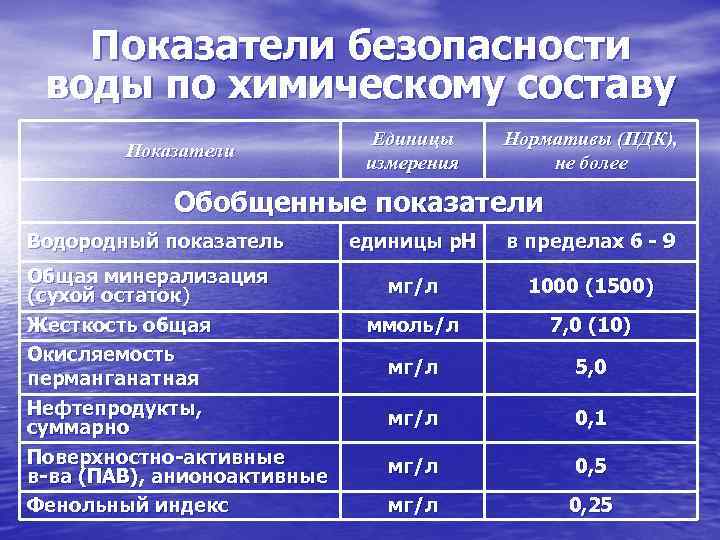 Проанализируйте две отдельные аликвоты этого образца и сообщите нам о результатах на открытке. Вам позвонят, если мы обнаружим значительное несоответствие между тем, что мы ожидаем, и тем, что вы измерили. Мы будем работать с вами, чтобы устранить проблему, чтобы вы были уверены в качестве анализа полевых образцов. Два других образца ОК/КК будут доставлены непосредственно перед полевым отбором проб. В отличие от первого образца QA/QC, они используются для документирования качества данных, помогая нам статистически определить точность и прецизионность ваших анализов. Проанализируйте две отдельные аликвоты одного из них непосредственно перед измерением pH и щелочности полевых образцов; проанализируйте две отдельные аликвоты второго образца QA/QC сразу после анализа полевых образцов. Другими словами, первые две анализируемые пробы должны быть взяты из одной из бутылей для обеспечения/контроля качества, затем анализируются полевые пробы и, наконец, анализируются две пробы из другой бутыли для обеспечения/контроля качества.
Проанализируйте две отдельные аликвоты этого образца и сообщите нам о результатах на открытке. Вам позвонят, если мы обнаружим значительное несоответствие между тем, что мы ожидаем, и тем, что вы измерили. Мы будем работать с вами, чтобы устранить проблему, чтобы вы были уверены в качестве анализа полевых образцов. Два других образца ОК/КК будут доставлены непосредственно перед полевым отбором проб. В отличие от первого образца QA/QC, они используются для документирования качества данных, помогая нам статистически определить точность и прецизионность ваших анализов. Проанализируйте две отдельные аликвоты одного из них непосредственно перед измерением pH и щелочности полевых образцов; проанализируйте две отдельные аликвоты второго образца QA/QC сразу после анализа полевых образцов. Другими словами, первые две анализируемые пробы должны быть взяты из одной из бутылей для обеспечения/контроля качества, затем анализируются полевые пробы и, наконец, анализируются две пробы из другой бутыли для обеспечения/контроля качества. Результаты должны быть указаны в листе данных лаборатории pH и щелочности.
Результаты должны быть указаны в листе данных лаборатории pH и щелочности.
К началу страницы
Общая щелочность в сравнении с pH и их роль в химическом составе воды
Вы когда-нибудь спрашивали: «В чем разница между pH и щелочностью?» Это понятно, учитывая, насколько размыта грань между такими словами, как «щелочной» и «щелочной». Действительно, щелочность и рН в химическом составе воды тесно связаны, но это не одно и то же, и в этой статье мы их разграничим.0003
В этой статье описано:
- Что такое рН?
- Роль рН в химическом составе воды
- Концентрация хлора (%HOCl)
- Комфорт купальщика (миф)
- Травление/масштабирование (фактически LSI)
- Растворенный CO 2 определяет pH
- Что такое общая щелочность (TA)?
- Как измеряется щелочность
- Роль ТА в химическом составе воды
- Снижение TA и pH
- Более высокая щелочность приводит к более высокому уровню pH
- Как повысить TA и pH
- Как снизить TA и pH
- Заключение
Что такое рН?
Шкала pH
pH означает potenz Hydrogen , чаще называемое «мощностью водорода». Это отрицательный логарифм концентрации ионов водорода в растворе. Чем ниже рН, тем экспоненциально больше водорода.
Это отрицательный логарифм концентрации ионов водорода в растворе. Чем ниже рН, тем экспоненциально больше водорода.
pH = -log[H + ]
Мы измеряем, насколько кислыми или щелочными (также называемыми щелочными) веществами являются вещества, используя шкалу рН. Шкала рН идет от 0 до 14 и относится к чистой воде, которая имеет совершенно нейтральный рН 7. Когда концентрация ионов водорода повышается, рН снижается (и наоборот). Шкала логарифмическая, что означает, что каждое целое число на шкале pH от 1 до 14 в 10 раз больше или меньше, чем числа вокруг него. Например, что-то с рН 6,0 будет в 10 раз более кислым, чем дистиллированная вода с рН 7,0. Что-то с pH 5,0 в 10 раз более кислое, чем 6,0, и в 100 раз более кислое, чем 7,0 (10×10=100).
Чтобы представить шкалу pH в перспективе, давайте посчитаем. Трихлор, популярный тип стабилизированного хлора, используемый в основном в открытых бассейнах, имеет pH около 3. Для этого расчета давайте просто округлим его до 3,0. Насколько кислым является трихлор с pH 3,0 по сравнению с водой с pH 7,0? Давайте разберемся.
Насколько кислым является трихлор с pH 3,0 по сравнению с водой с pH 7,0? Давайте разберемся.
(7,0 pH — 3,0 pH) = 4,0
pH является логарифмическим, поэтому это означает 10 4 , или 10x10x10x10 = 10 000
трихлора примерно7 10008 более кислая, чем чистая вода.
Эта математика предназначена только для объяснения самой шкалы рН и иллюстрации того, что означает логарифм.
Роль рН в химическом составе воды
Промышленный стандартный диапазон pH составляет от 7,2 до 7,8 в соответствии со стандартами PHTA. Нам говорят, что идеальный рН составляет 7,4-7,6. Но почему? Приводятся три основные причины: концентрация хлора, комфорт купающихся и коррозионная активность/образование накипи в воде. Давайте уделим время развенчанию всех трех… или, по крайней мере, двух с половиной.
Концентрация хлора (%HOCl)
Департаменты здравоохранения в основном заботятся о том, чтобы вода поддерживалась с достаточной скоростью дезинфекции. Таким образом, из трех названных причин для поддержания pH между 7,2 и 7,8, безусловно, наиболее важной для отдела здравоохранения является концентрация хлора (% HOCl).
Таким образом, из трех названных причин для поддержания pH между 7,2 и 7,8, безусловно, наиболее важной для отдела здравоохранения является концентрация хлора (% HOCl).
Действительно, pH определяет, насколько эффективным будет хлор в нестабилизированных бассейнах. Таким образом, в бассейнах без циануровой кислоты (CYA) чем ниже pH, тем сильнее будет хлор, потому что pH контролирует равновесие диссоциации между сильным и слабым хлором:
HOCl ⇌ H + + OCl —
Хлорноватистая кислота диссоциирует на водород и гипохлорит-ион
Поскольку pH примерно равен концентрации ионов водорода (H + ), чем ниже pH, тем выше процентное содержание HOCl по сравнению с его более слабым и медленным аналогом OCl — .
Но это не так актуально для бассейнов с CYA , потому что изоцианураты коренным образом меняют химический состав бассейна. См. рисунок ниже. На диаграмме слева показан нестабилизированный пул (нулевой CYA) по сравнению со стабилизированным пулом (30 ppm CYA):
Где теперь красная линия?
Пусть эта таблица не вводит вас в заблуждение. С CYA в вашем бассейне у вас все еще будет хлор, просто он не так зависит от pH, потому что в большинстве случаев он связан с CYA. Подробнее о взаимосвязи pH, CYA и хлора здесь.
С CYA в вашем бассейне у вас все еще будет хлор, просто он не так зависит от pH, потому что в большинстве случаев он связан с CYA. Подробнее о взаимосвязи pH, CYA и хлора здесь.
Таким образом, это представление о том, что pH контролирует концентрацию хлора, верно как минимум наполовину. Другая половина заключается в том, что pH не влияет на концентрацию хлора в бассейнах с CYA (а это практически все открытые бассейны в Америке).
Комфорт купальщика (миф)
Вторая основная причина, по которой в учебниках говорится, что нам необходимо поддерживать pH между 7,2 и 7,8, связана с комфортом купающихся. Предположительно, pH наших глаз имеет достаточно большое значение, поэтому pH воды должен быть совместим с ними, иначе глаза пловцов будут болеть. Но мы считаем, что это миф, и мы можем довольно легко его развенчать.
- Во-первых, pH ваших глаз (или, в частности, слез) зависит от того, насколько вы увлажнены. Одно опубликованное исследование показало, что pH слез человека у 44 испытуемых колебался от 6,5 до 7,6.
 1
1 - Во-вторых, за более чем десятилетний опыт соревнований по плаванию мы пришли к выводу, что именно побочные продукты хлорамина вызывают раздражение у купающихся. Ни для кого не секрет, что хлорамины и другие побочные продукты дезинфекции вредны и раздражают глаза, кожу, горло и легкие. Проблема связанного хлора тщательно изучена и хорошо изучена.
- В-третьих, pH питьевой воды в бутылках колеблется гораздо больше, чем в плавательном бассейне. Обычные бренды варьируются от 5,5 pH до более 9..5 рН. Это разница в кислотности в 10 000 раз! И все же мы едва можем почувствовать разницу. Оба освежают и могут быть употреблены. Должны ли мы действительно верить, что плавательный бассейн, поддерживаемый ПУТЬ в этом диапазоне pH, имеет достаточную разницу pH, чтобы раздражать кожу и глаза купающихся? Мы не покупаем это.
Связанный: Какой идеальный pH в бассейне?
Травление/масштабирование (фактически LSI)
Третья причина, по которой pH должен поддерживаться между 7,2 и 7,8, как нам говорят, связана с коррозионной активностью или склонностью воды к образованию накипи. Другими словами, низкий уровень pH разрушает поверхности бассейна и разъедает оборудование (например, нагреватели), тогда как высокий уровень pH приводит к образованию карбонатных отложений.
Другими словами, низкий уровень pH разрушает поверхности бассейна и разъедает оборудование (например, нагреватели), тогда как высокий уровень pH приводит к образованию карбонатных отложений.
Достаточно справедливо… за исключением того, что такие вещи на самом деле диктуются общим балансом воды, а не только рН. Мы измеряем общий водный баланс, используя индекс насыщения Ланжелье (LSI). LSI определяет, когда вода перенасыщена или недонасыщена карбонатом кальция (CaCO 3 ). И рН является основным фактором в LSI.
Нарушения LSI происходят локально, а не повсеместно в пуле. Поэтому pH имеет большое значение. Например, трихлор с pH 2,8 в поплавке может нанести ущерб, если он плавает над мелкой ступенькой или рядом со стеной в течение длительного периода времени. Низкий pH изменяет LSI в этой непосредственной области, вызывая коррозию этой области и травление поверхности цемента (или обесцвечивание виниловой прокладки, или разрушение гелькоута из стекловолокна).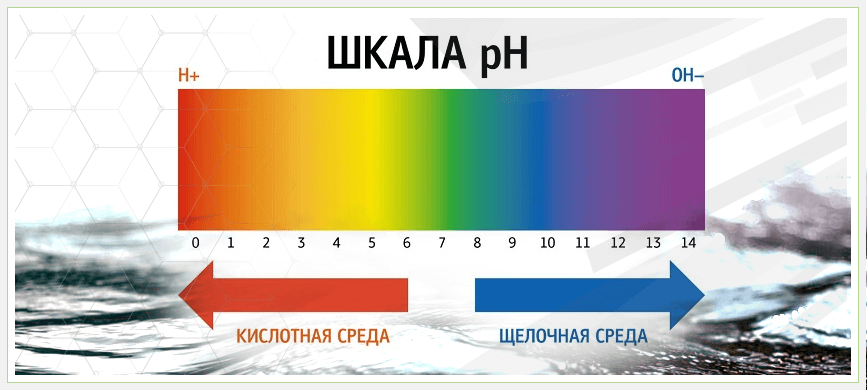
Ниже приведена таблица, показывающая равновесие типов щелочности. Когда pH достигает 8,3 и выше, ионы бикарбоната превращаются в ионы карбоната (CO 3 2-), и они очень хорошо связываются с кальцием (Ca 2+ ). Поэтому, когда ваш pH становится слишком высоким (более 8,3), кальций может осаждаться из раствора, даже если общий LSI вашего бассейна сбалансирован. Вы можете сами увидеть это явление. Просто добавьте кальцинированную соду слишком быстро, и она сразу же затуманит бассейн.
Таким образом, pH сам по себе не является причиной травления или образования накипи, причиной тому является LSI. Но рН является основным фактором в LSI. Однако низкий уровень pH можно компенсировать большей кальциевой жесткостью, щелочностью и более высокой температурой воды.
Растворенный CO
2 определяет pH
Технически pH представляет собой концентрацию ионов водорода, выраженную логарифмически в диапазоне от 0 до 14. Но это сложно и трудно уложить в голове. Таким образом, для практических целей лучший способ концептуализировать pH — это подумать о количестве углекислого газа (CO 2 ) растворяется в вашей воде.
Таким образом, для практических целей лучший способ концептуализировать pH — это подумать о количестве углекислого газа (CO 2 ) растворяется в вашей воде.
Чем больше CO 2 растворено в вашей воде, тем ниже pH, и наоборот. Это должно объяснить, почему инжекторы CO 2 снижают pH и почему аэрация (например, брызги, переливы и гидромассажные форсунки) повышает pH. Мы рассмотрим это более подробно в других статьях:
- Что вызывает высокий уровень pH?
- Содержащие pH по сравнению с регулирующим pH
- CO 2 , pH и закон Генри
Теперь, когда мы рассмотрели рН, давайте перейдем к щелочности.
Что такое общая щелочность?
Общая щелочность — это мера концентрации всех щелочных веществ, растворенных в воде, которые могут как притягивать, так и выделять ионы водорода (H + ). Это взаимодействие с водородом является причиной того, что щелочность защищает от изменения pH. Общая щелочность — это, прежде всего, бикарбонаты, карбонаты и гидроксиды, а также некоторые другие, такие как циануратная щелочность. При добавлении кислоты эти щелочи обладают способностью нейтрализовать часть кислоты. Проще говоря, общая щелочность равна 9.0007 измерение способности воды сопротивляться снижению рН.
Общая щелочность — это, прежде всего, бикарбонаты, карбонаты и гидроксиды, а также некоторые другие, такие как циануратная щелочность. При добавлении кислоты эти щелочи обладают способностью нейтрализовать часть кислоты. Проще говоря, общая щелочность равна 9.0007 измерение способности воды сопротивляться снижению рН.
Связанный: что такое щелочность?
Общая щелочность измеряется ее концентрацией в частях на миллион (частей на миллион), и идеальный диапазон промышленных стандартов составляет от 80 до 120 частей на миллион, в зависимости от типа используемого хлора. Например, трихлор имеет низкий pH 2,8, поэтому, учитывая, насколько кислым является трихлор, пул трихлора нуждается в более высокой щелочности. Другая причина большей щелочности в бассейне с трихлором заключается в том, что CYA в трихлоре компенсирует щелочность при выполнении поправок LSI.
Нестабилизированные хлорсодержащие вещества, такие как жидкий хлор (отбеливатель) или гипокальциемия, имеют высокий уровень pH. Таким образом, вы можете иметь более низкую щелочность, например 80 частей на миллион, или даже ниже 80 частей на миллион, если ваш LSI позволяет это. Бассейны с соляным хлором часто борются с накоплением накипи, которая отслаивается от соляной ячейки и попадает в бассейн. Соляные бассейны в сезон обычно выигрывают от более низкого уровня щелочности, например, 60 частей на миллион, при условии, что LSI остается сбалансированным . Суть в том, чтобы отмерить кислоту и разбавить ее перед заливкой, чтобы избежать чрезмерной коррекции. Слишком много кислоты с более низкой щелочностью вызовет большие проблемы, поэтому будьте осторожны.
Таким образом, вы можете иметь более низкую щелочность, например 80 частей на миллион, или даже ниже 80 частей на миллион, если ваш LSI позволяет это. Бассейны с соляным хлором часто борются с накоплением накипи, которая отслаивается от соляной ячейки и попадает в бассейн. Соляные бассейны в сезон обычно выигрывают от более низкого уровня щелочности, например, 60 частей на миллион, при условии, что LSI остается сбалансированным . Суть в том, чтобы отмерить кислоту и разбавить ее перед заливкой, чтобы избежать чрезмерной коррекции. Слишком много кислоты с более низкой щелочностью вызовет большие проблемы, поэтому будьте осторожны.
И да, мы знаем, что рекомендуем более низкие уровни общей щелочности, чем стандарты учебника (при условии, что ваш LSI остается сбалансированным, поэтому учитывайте температуру воды!). Более низкая щелочность позволит вам более эффективно сдерживать pH.
Как измеряется щелочность
Вы заметили, что общая щелочность не измеряется по шкале pH? Это важное различие, потому что обычно именно так путают рН и щелочность. Общая щелочность измеряется количество или концентрация (частей на миллион) в воде, а не насколько щелочной вода.
Общая щелочность измеряется количество или концентрация (частей на миллион) в воде, а не насколько щелочной вода.
Щелочность не может быть измерена в режиме реального времени с помощью зондов, по крайней мере, с использованием современных технологий. Возможно, когда-нибудь это станет возможным, но пока мы должны полагаться на титрование или изменение цвета на тест-полоске. Наиболее распространено титрование с использованием жидких реагентов, при котором учитывается каждая капля, поскольку она нейтрализует все больше и больше образца, пока не изменится цвет. Следуйте инструкциям производителя набора для тестирования.
Причина, по которой это стоит упомянуть, заключается в том, что контроллеры химической автоматизации могут считывать pH в режиме реального времени с помощью датчика, но контроллеры не знают, какова щелочность воды. В зависимости от контроллера это может привести к чрезмерному использованию кислоты, что может привести к гораздо более серьезным проблемам.
Роль общей щелочности в химическом составе воды
Если вы оператор бассейна, вы, вероятно, уже знаете, что pH колеблется. В частности, она естественным образом повышается. Коррекция pH почти всегда достигается за 9 0498 опускание кислотой или впрыскивание CO 2 .
Погоня за pH означает, что вы боретесь с физикой, и воду становится сложнее поддерживать. Введите щелочность. Простой способ думать о щелочности состоит в том, что она изолирует pH от слишком легкого снижения. Другими словами, щелочность защищает от снижения pH. Ионы щелочности делают это, высвобождая или притягивая ион водорода (H + ) по мере необходимости. Поэтому при добавлении кислоты ионы карбоната могут поглощать водород с образованием ионов бикарбоната. А при достаточном количестве кислоты ионы бикарбоната поглощают другой водород и превращаются в угольную кислоту, в которой растворяется CO 2 . Все это находится в равновесии, как и pH, поэтому может быть и наоборот. Равновесие выглядит так:
Равновесие выглядит так:
CO2 + H 2 O ⇌ h3CO3 ⇌ HCO3- + H+ ⇌ CO3 2- + H 2
диоксид углерода + вода ⇌ угольная кислота ⇌ бикарбонат + ион водорода ⇌ карбонат + газообразный водород
Вот как выглядит равновесие на графике. Как вы можете видеть, pH определяет тип вашей щелочности, и большая часть нашей щелочности в диапазонах химии бассейнов будет бикарбонатной:
Общая щелочность и снижение pH
Поскольку CO 2 определяет pH воды, давайте подумаем об этом с другой стороны. Если вы хотите снизить pH, вам нужно больше растворенного CO 2 (угольная кислота). Вы можете ввести CO 2 напрямую для снижения pH или использовать кислоту. Но подождите, кислота не содержит CO 2 … так где же кислота находит CO 2 ?
Кислота преобразует щелочность в растворенный CO 2 (угольная кислота), снижающая рН воды.
В частности, кислота преобразует бикарбонатную щелочность в угольную кислоту (H 2 CO 3 ) путем добавления к ней водорода. Упрощенно, мы думаем об этом как о том, что кислота «прожигает» щелочность, чтобы снизить pH.
Более высокая общая щелочность приводит к более высокому уровню pH
Вопреки большинству учений, общая щелочность на самом деле только защищает от снижения pH. На самом деле, чем больше щелочность в вашей воде, тем выше будет естественным образом повышаться ваш pH… и, вообще говоря, тем быстрее будет повышаться pH. Вот диаграмма потолка рН:
Для получения дополнительной информации о том, что означает этот график, прочитайте это.
Как увеличить общую щелочность и pH
Если вы хотите увеличить общую щелочность в бассейне, вам необходимо знать объем бассейна в галлонах и ваш pH.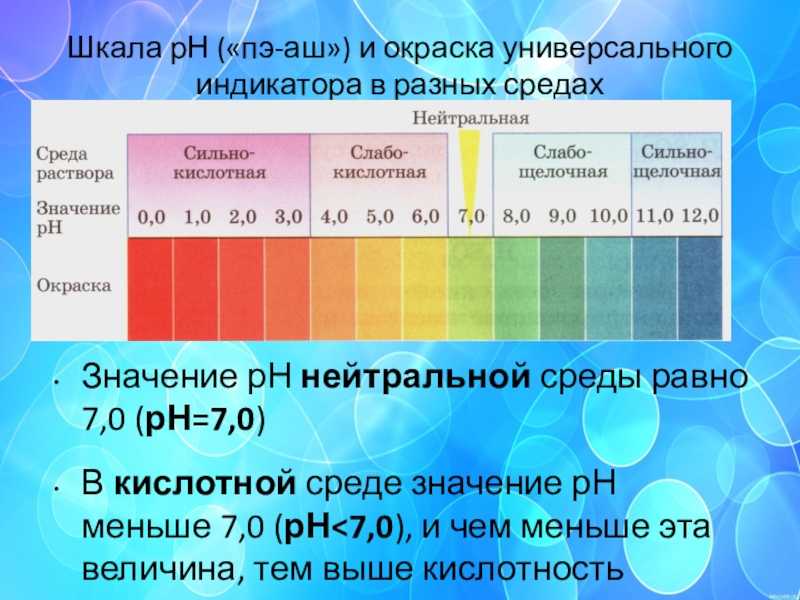 Это помогает иметь точный калькулятор дозирования. Поднять щелочность так же просто, как добавить бикарбонат натрия в воду.
Это помогает иметь точный калькулятор дозирования. Поднять щелочность так же просто, как добавить бикарбонат натрия в воду.
Вы можете добавить несколько фунтов бикарбоната натрия с pH 8,3 и добиться того же уровня pH, если добавите гораздо меньшее количество кальцинированной соды с pH 11,6. Но общая щелочность будет выше для бикарбоната натрия, потому что его просто больше в воде.
Связанный: Как повысить щелочность и pH
Как снизить общую щелочность и pH
Вы можете понизить pH и щелочность с помощью кислоты. Всегда разбавляйте кислоту в ведре воды и равномерно поливайте ею самые глубокие части бассейна. Не заливайте в колонку кислоту, в отличие от некоторых отраслевых практик. Заливка в колонку не дает никаких преимуществ по сравнению с разбавлением кислотой. Заливка через колонку может значительно снизить pH в концентрированном месте (на дне вашего бассейна, которое попадает прямо в основной сток). Это снижает уровень pH и приводит к повреждению оборудования. Всегда разбавляйте кислоту.
Всегда разбавляйте кислоту.
Понижение pH без воздействия на общую щелочность может быть достигнуто за счет введения углекислого газа. Мы рассмотрим эту тему более подробно в этой статье.
Связанный: Как снизить pH и щелочность
Заключение
pH говорит нам, насколько кислым или щелочным является вещество, по логарифмической шкале от 0 до 14, что говорит нам о концентрации ионов водорода (H + ). Общая щелочность (ТА) — это количество растворенной в воде щелочи, которая может как отдавать, так и отнимать ионы водорода. Из-за этого взаимодействия с водородом щелочность служит буфером против снижения pH.
В химическом составе воды важны как pH, так и TA. Оба являются факторами общего водного баланса (измеряется с помощью LSI).

 coli в питьевой воде
coli в питьевой воде
 Если кристаллов много, вытряхните раствор, налейте чистую деионизированную воду в заливное отверстие и замочите кончик электрода в горячей водопроводной воде примерно на 15 минут, пока кристаллы не растворятся. Затем вытряхните всю жидкость из заливного отверстия в электроде сравнения и заполните свежим 4 М KCl. Оставьте электрод при комнатной температуре на ½ часа перед использованием. Часто добавляйте больше 4M раствора KCl к электроду сравнения, так как он будет постоянно вытекать и испаряться. Раствор в электроде должен находиться в пределах ½ дюйма от заливного отверстия. Отверстие должно быть открыто при измерении рН, но закройте его по истечении дня, иначе раствор испарится и сформируются новые кристаллы (но не закрывайте отверстие, если вы собираетесь хранить электрод, погруженный в раствор с рН 4). Если у вас все еще есть проблемы с медленным откликом, попробуйте потереть наконечник о синие джинсы или очень мелкую (зернистость 600) наждачную бумагу.
Если кристаллов много, вытряхните раствор, налейте чистую деионизированную воду в заливное отверстие и замочите кончик электрода в горячей водопроводной воде примерно на 15 минут, пока кристаллы не растворятся. Затем вытряхните всю жидкость из заливного отверстия в электроде сравнения и заполните свежим 4 М KCl. Оставьте электрод при комнатной температуре на ½ часа перед использованием. Часто добавляйте больше 4M раствора KCl к электроду сравнения, так как он будет постоянно вытекать и испаряться. Раствор в электроде должен находиться в пределах ½ дюйма от заливного отверстия. Отверстие должно быть открыто при измерении рН, но закройте его по истечении дня, иначе раствор испарится и сформируются новые кристаллы (но не закрывайте отверстие, если вы собираетесь хранить электрод, погруженный в раствор с рН 4). Если у вас все еще есть проблемы с медленным откликом, попробуйте потереть наконечник о синие джинсы или очень мелкую (зернистость 600) наждачную бумагу. 1
1