Содержание
Нормы pH в питьевой воде — читайте в нашей статье
Каждый из нас слышал слово “рН”, используемое для описания качества питьевой воды. Но знаете ли вы, что оно означает? Водородный показатель рН — это измерение электрически заряженных частиц в веществе. Он показывает, насколько кислотным или щелочным (основным) является это вещество. Шкала рН колеблется от 0 до 14:
рН ниже 7 — кислотная вода. Наиболее кислые вещества имеют рН 0. В эту категорию входят электролиты в свинцовых аккумуляторах, лимонный и яблочный сок, лимонад, пиво, кофе.
рН от 8 или выше — щелочная вода. Наиболее щелочные вещества имеют рН 14. К ним относятся морская вода, нашатырный спирт, хлоросодержащие отбеливатели, раствор соды.
рН 7 — чистая вода. Вещества данной подгруппы считаются нейтральными, поскольку не обладают ни кислотными, ни основными качествами.
Показатель рН воды является одним из важнейших факторов, учитываемых экспертами при определении качества жидкости и ее пригодности для питья. Как определить значение данной величины и можно ли ее контролировать? Давайте разбираться вместе.
Как определить значение данной величины и можно ли ее контролировать? Давайте разбираться вместе.
Понятие и значение рН
Первым, кто основательно подошел к изучению показателя рН и преуспел в этом, стал датский ученый Серен Петер Лауриц Серенсен. В начале 20 столетия он придумал и ввел в употребление специальный термин, potentiahydrogeni. Таким образом ему удалось визуально обозначить уровень активности ионов водорода в жидкой среде. Именно по этому показателю в настоящее время определяется кислотно-щелочной баланс.
От значения данного равновесия напрямую зависит:
- скорость протекания химических реакций разной природы происхождения;
- степень коррозийного воздействия в агрессивной или пассивном отношении;
- токсикометрический показатель вещества.
Жидкости, содержащиеся внутри человеческого организма, имеют собственный кислотно-щелочной баланс. Его активный уровень оказывает непосредственное влияние на наше здоровье и самочувствие.
Норма pH питьевой воды для человека
Результатами многолетних научных исследований доказано, что оптимальным pH питьевой воды является показатель, равный 7,5 ммоль. Это значение полностью соответствует нормальному кислотно-щелочному балансу крови человека (слабощелочная среда).
Потребление достаточного количества такой воды способствует эффективной оптимизации физических и биологических процессов, протекающих внутри нашего организма. В частности, это касается:
- улучшения и нормализации обменных процессов;
- насыщения крови кислородом;
- нормализации функциональных качеств микрофлоры кишечника;
- укрепления врожденного и приобретенного иммунитета;
- увеличения средней продолжительности жизни.
Для достижения и сохранения всех перечисленных выше свойств важно периодически проводить лабораторный анализ и проверять уровень pH потребляемой вами воды. Основная задача такого контроля — не допустить серьезные отклонения от нормы и своевременно принять меры при их обнаружении.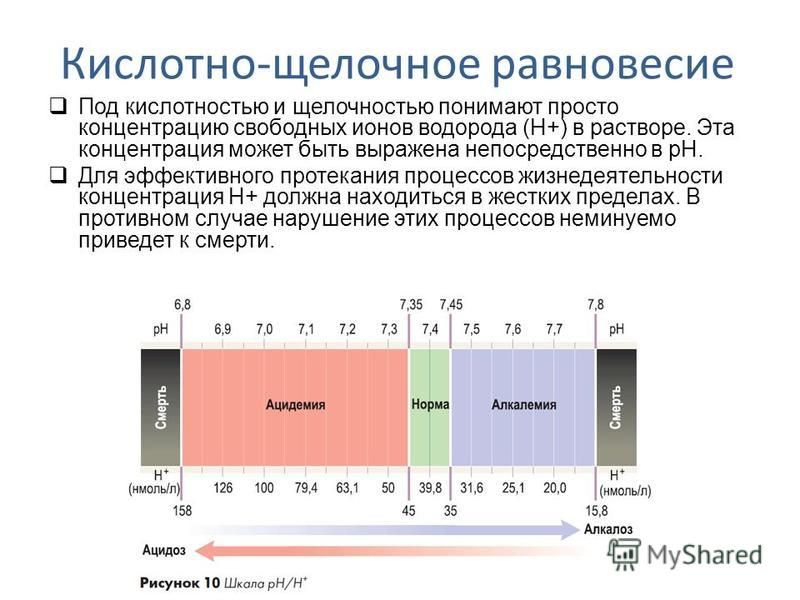
Как проверить pH воды в домашних условиях
Лакмусовая бумага. Предназначена для быстрого измерения pH воды. Наиболее простой и наименее затратный способ из всех существующих. Суть метода заключается в том, что при контакте с водой бумага меняет цвет в зависимости от текущего показателя кислотно-щелочного баланса. Для определения уровня pH достаточно воспользоваться прилагаемой к инструкции таблицей.
PH-метр. Специальный прибор для получения более точных аналитических результатов (в сравнении в предыдущим вариантом). Устройство определяет уровень кислотности с точностью до сотых долей. Недостатками является его высокая цена и необходимость предварительной калибровки.
Самодельный pH-тест. Для его изготовления произвольно нарежьте красную капусту (примерно 1/2 качана), залейте овощную заготовку литром чистой воды, прокипятите 30 минут на среднем огне. Остудите полученный отвар до комнатной температуры. Отрежьте полоску обычной бумаги для ксерокса, окуните ее в подготовленный раствор на 10 минут. Подождите, пока полоска полностью высохнет. Для оценки результата воспользуйтесь традиционной шкалой, предусмотренной для лакмусовой бумаги.
Подождите, пока полоска полностью высохнет. Для оценки результата воспользуйтесь традиционной шкалой, предусмотренной для лакмусовой бумаги.
ph метры, измерение ph, промышленные ph метры, уровень ph
ph метры, измерение ph, промышленные ph метры, уровень ph
Главная страница / Статьи сайта / Основные направления
Ежедневно мы используем воду и редко задумываемся о том, какими полезными или вредными свойствами эта вода обладает. В таких случаях люди, как правило, оперируют такими категориями как «вода из-под крана», «фильтрованная вода» и «столовая или минеральная вода», — не более того. Однако, кроме такой, слегка приземленной, оценки вода обладает массой признаков и свойств, по которым можно определить ее пригодность для использования в тех или иных случаях. Одной из важнейших параметров в оценке воды для бытового и промышленного употребления является уровень ph.
Уровень ph определяет степень кислотности или щелочности воды. Нейтральным принято считать уровень ph, равный 7 (в идеале это диапазон значений от 7,2 до 7,6 и максимально приближен к 7,4). При значении ph ниже 7 раствор является кислым, при значении ph выше 7 – щелочным. Уровень ph выше 7,8 приводит к накоплению различных минеральных отложений, известнякового камня и другого рода налетов. Кислый уровень ph способствует коррозии различных металлических покрытий. Влияние уровня ph воды мы ощущаем в быту: накипь в чайниках, барабанах стиральных машин, отчасти, ржавчина в водопроводных трубах, неблагоприятные воздействия «сырой» воды на кожу свидетельствуют либо о повышенной кислотности, либо о повышенной щелочности воды. Однако, куда важнее контроль кислотности и щелочности в воды. Ввиду того, что вода является дешевым легкодоступным рабочим телом, а также охладителем, она повсеместно применяется практически во всех существующих типах производств. Поэтому для исправной работы оборудования необходима определенная химподготовка воды, а также постоянный контроль уровня ph.
При значении ph ниже 7 раствор является кислым, при значении ph выше 7 – щелочным. Уровень ph выше 7,8 приводит к накоплению различных минеральных отложений, известнякового камня и другого рода налетов. Кислый уровень ph способствует коррозии различных металлических покрытий. Влияние уровня ph воды мы ощущаем в быту: накипь в чайниках, барабанах стиральных машин, отчасти, ржавчина в водопроводных трубах, неблагоприятные воздействия «сырой» воды на кожу свидетельствуют либо о повышенной кислотности, либо о повышенной щелочности воды. Однако, куда важнее контроль кислотности и щелочности в воды. Ввиду того, что вода является дешевым легкодоступным рабочим телом, а также охладителем, она повсеместно применяется практически во всех существующих типах производств. Поэтому для исправной работы оборудования необходима определенная химподготовка воды, а также постоянный контроль уровня ph.
Определить кислотность или щелочность среды можно с помощью нехитрых химических опытов, т.е. использовать химические индикаторы. Однако, в рамках сложных производственных процессов провести такие эксперименты зачастую не представляется возможным. Кроме того, большинство производственных циклов контролируется автоматическими или автоматизированными системами управления, отвечающими за исправность оборудования и безопасность персонала. Все это выдвигает определенные требования к типу представления и оперативности получения данных о состоянии технологического процесса, возможности их незамедлительной обработки посредством электронных систем и принятия соответствующих решений.
Однако, в рамках сложных производственных процессов провести такие эксперименты зачастую не представляется возможным. Кроме того, большинство производственных циклов контролируется автоматическими или автоматизированными системами управления, отвечающими за исправность оборудования и безопасность персонала. Все это выдвигает определенные требования к типу представления и оперативности получения данных о состоянии технологического процесса, возможности их незамедлительной обработки посредством электронных систем и принятия соответствующих решений.
В этих целях применяются ph метры. Эти приборы используют потенциометрический принцип измерения реакции среды, то есть измеряют электродвижущую силу, создаваемую электрохимической частью ph метра. Электрохимическая часть электрода представляет собой стеклянный ph-электрод и электрод сравнения (хлорсеребряный электрод), которые погружаются в раствор, ph-уровень которого требуется измерить. Основным параметром ph-метров является точность определения значения ph. Оптимальная точность прибора 0,01. Кроме того, ph метры в комплекте с соответствующими электродами способны измерять окислительно-восстановительный потенциал (это не относится к карманным и бюджетным ph метрам). Использование микропроцессорных систем позволяет проводить высококачественный и оперативный анализ, а также хранить параметры буферных растворов (применяются для оценки точности и позволяют избежать ошибок при измерении) и сохранять результаты измерений и наблюдений.
Оптимальная точность прибора 0,01. Кроме того, ph метры в комплекте с соответствующими электродами способны измерять окислительно-восстановительный потенциал (это не относится к карманным и бюджетным ph метрам). Использование микропроцессорных систем позволяет проводить высококачественный и оперативный анализ, а также хранить параметры буферных растворов (применяются для оценки точности и позволяют избежать ошибок при измерении) и сохранять результаты измерений и наблюдений.
К промышленным ph метрам стандартами государственной системы промышленных приборов и средств автоматизации предъявляются особые требования. К таким требованиям относится устойчивость к механическим, климатическим, электромагнитным и другим воздействиям, а также надежность прибора и способность его формировать электрические сигналы для связи с контроллерами автоматических систем управления. Некоторые ph-метры промышленного исполнения способны формировать цифровые сигналы и использовать различные протоколы для передачи данных и взаимодействия с контроллером и другими устройствами в системе управления. К слову, в промышленных ph-метрах в качестве электрохимической ячейки используется ph–датчик, в котором ph-электроды и сравнительные электроды выступают лишь некоторыми составными элементами.
К слову, в промышленных ph-метрах в качестве электрохимической ячейки используется ph–датчик, в котором ph-электроды и сравнительные электроды выступают лишь некоторыми составными элементами.
Широчайшее распространения получили ph метры и мультиметры HM Digital, Экотест, Эксперт, WTW, HANNA, Марк, Мультитест, Анион, Mettler Toledo.
Приборы для измерения водородного показателя (рН метры):
pH воды – Системы измерения окружающей среды
Что такое pH?
pH – это определенное значение, основанное на определенной шкале, аналогичной температуре. Это означает, что рН воды не является физическим параметром, который можно измерить как концентрацию или количество. Вместо этого это число от 0 до 14, определяющее, насколько кислым или щелочным является водоем по логарифмической шкале ¹. Чем меньше число, тем более кислая вода. Чем выше число, тем оно более базовое. pH 7 считается нейтральным. Логарифмическая шкала означает, что каждое число ниже 7 в 10 раз более кислое, чем предыдущее число при обратном отсчете. Точно так же при подсчете выше 7 каждое число в 10 раз больше основного, чем предыдущее число ².
Точно так же при подсчете выше 7 каждое число в 10 раз больше основного, чем предыдущее число ².
Логарифмическая шкала рН означает, что по мере увеличения рН концентрация Н+ будет уменьшаться в 10-й степени. Таким образом, при рН 0 концентрация Н+ составляет 1 М. При рН 7 она уменьшается до 0,0000001 М. При pH 14 имеется только 0,00000000000001 M H+.
pH означает «сила водорода» ³. Численное значение pH определяется молярной концентрацией ионов водорода (H+) ³. Для этого возьмем отрицательный логарифм концентрации H+ (-log(H+)). Например, если раствор имеет концентрацию H+ 10 -3 М, рН раствора будет -log(10 -3 ), что равно 3.
Это определение обусловлено влиянием ионов водорода (Н+) и ионов гидроксила (ОН-) на рН. Чем выше концентрация H+, тем ниже pH, чем выше концентрация OH-, тем выше pH. При нейтральном рН 7 (чистая вода) концентрация как ионов Н+, так и ионов ОН- составляет 10⁻⁷ М. Таким образом, ионы Н+ и ОН- всегда спарены – при увеличении концентрации одного концентрация другого будет уменьшаться; независимо от рН сумма ионов всегда будет равна 10⁻¹⁴ М². Из-за этого влияния H+ и OH- связаны с основными определениями кислот и оснований.
Из-за этого влияния H+ и OH- связаны с основными определениями кислот и оснований.
Кислоты и основания
Кислотно-основные пары могут нейтрализовать друг друга, как H+ и OH- в этом уравнении.
Согласно рабочему определению, кислота — это вещество, которое снижает pH при добавлении в чистую воду. Точно так же основание — это вещество, которое увеличивает pH воды ⁴. Для дальнейшего определения этих веществ Аррениус определил в 1884 году, что кислота выделяет ион водорода (H+) при растворении в воде, а основание выделяет ион гидроксила (OH-) в воде ⁴. Однако есть некоторые вещества, которые соответствуют рабочему определению (изменение рН), но не соответствуют определению Аррениуса (высвобождение иона). Чтобы учесть это, Бренстед и Лоури изменили определение кислот и оснований; кислота высвобождает ион водорода или протон (эквивалент H+), а основание принимает ион водорода или протон ⁴. Это означает, что кислоты и основания могут компенсировать друг друга, как показано в уравнении воды справа.
Основной или щелочной
Типичные примеры щелочей включают магнезиальное молоко – Mg(OH)2, едкий калий – KOH, гашеную известь/известковую воду – Ca(OH)2 и едкий натр (щелок) – NaOH.
Термины «щелочной» и «основной» означают примерно одно и то же. Согласно определению Бренстеда-Лоури, основание описывает любое вещество, которое снижает концентрацию ионов водорода и увеличивает рН воды, или, другими словами, основание ⁴. Щелочной происходит от щелочи, которая относится к ионным соединениям (солям), содержащим элементы щелочного металла или щелочноземельного металла, которые образуют гидроксид-ионы при растворении в воде ⁵. Щелочные соли очень распространены и легко растворяются. Из-за образующихся ими гидроксид-ионов (которые повышают pH) все щелочи являются основаниями. Некоторые источники определяют любое растворимое основание как щелочь ⁵. Таким образом, растворимые основания можно описать как «основные» или «щелочные». Однако нерастворимые основания (например, оксид меди) следует описывать только как основные, а не щелочные.
Щелочность и pH воды
Щелочность и pH напрямую связаны при 100% насыщении воздухом.
Щелочность не относится к щелочам, как к щелочным ⁶. Хотя щелочность и pH тесно связаны между собой, между ними есть явные различия. Щелочность воды или раствора — это количественная способность этого раствора буферировать или нейтрализовать кислоту. Другими словами, щелочность — это мера способности воды противостоять изменениям рН. Этот термин используется взаимозаменяемо с кислотонейтрализующей способностью (ANC) ⁷. Если водоем имеет высокую щелочность, это может ограничить изменения pH из-за кислотных дождей, загрязнения или других факторов ⁸. Щелочность ручья или другого водоема повышается за счет богатых карбонатами почв (карбонатов и бикарбонатов), таких как известняк, и снижается за счет оттока сточных вод и аэробного дыхания. Из-за присутствия карбонатов щелочность более тесно связана с жесткостью, чем с pH (хотя все же есть явные различия). Однако изменения pH также могут влиять на уровень щелочности (по мере снижения pH буферная способность воды также снижается) ⁶. pH и щелочность напрямую связаны, когда вода на 100% насыщена воздухом ⁹.
pH и щелочность напрямую связаны, когда вода на 100% насыщена воздухом ⁹.
Щелочность воды также играет важную роль в дневном уровне pH. В процессе фотосинтеза водорослями и растениями используется водород, что повышает уровень pH ¹⁰. Точно так же дыхание и разложение могут снизить уровень pH. Большинство водоемов способны амортизировать эти изменения из-за их щелочности, поэтому небольшие или локальные колебания быстро изменяются, и их может быть трудно обнаружить ¹⁰.
Единицы pH и щелочности
Значения pH определяются в логарифмической шкале.
Значения pH представляются в виде числа от 0 до 14 в качестве стандартной единицы pH. Эта единица эквивалентна отрицательному логарифму молярной концентрации ионов водорода (-log(H+)) в растворе. В зависимости от точности измерения значение рН может быть выполнено с точностью до одного или двух знаков после запятой.
Однако, поскольку шкала pH является логарифмической, попытка усреднения двух значений pH была бы математически неверной. Если требуется среднее значение, его можно указать как медиану или диапазон, а не как простой расчет ¹⁰.
Если требуется среднее значение, его можно указать как медиану или диапазон, а не как простой расчет ¹⁰.
Щелочность может быть выражена в мг/л или в микроэквивалентах на литр (мэкв/л). В мг/л это относится к концентрациям карбоната (CO3 2-), бикарбоната (HCO3 – ) или карбоната кальция (CaCO3), хотя чаще всего встречается карбонат кальция ¹¹.
1 мг/л щелочности в пересчете на CaCO3 = 0,01998 мг/л щелочности
1 мг/л щелочности в пересчете на CaCO3 = 0,5995 мг/л щелочности в пересчете на CO3 2-
1 мг/л щелочности в пересчете на CaCO3 = 1,2192 мг/л щелочности как HCO3 –
Почему pH важен?
Если рН воды слишком высокий или слишком низкий, живущие в ней водные организмы погибнут. pH также может влиять на растворимость и токсичность химических веществ и тяжелых металлов в воде ¹². Большинство водных существ предпочитают диапазон рН 6,5-9,0, хотя некоторые могут жить в воде с уровнем рН за пределами этого диапазона.
Уровни рН воды. Оптимальный уровень рН для рыб составляет от 6,5 до 9,0. За пределами оптимальных диапазонов организмы могут испытывать стресс или умирать.
Когда уровень pH выходит за пределы этого диапазона (вверх или вниз), это может привести к стрессу для систем животных и снижению показателей вылупления и выживаемости. Чем дальше значение pH от оптимального диапазона, тем выше уровень смертности. Чем более чувствителен вид, тем сильнее на него влияют изменения рН. В дополнение к биологическим эффектам экстремальные уровни pH обычно увеличивают растворимость элементов и соединений, делая токсичные химические вещества более «подвижными» и увеличивая риск их поглощения водными организмами ¹³.
Водные виды не единственные, на кого влияет рН. В то время как люди более терпимы к уровням pH (уровни для питья варьируются от 4 до 11 с минимальным раздражением желудочно-кишечного тракта), все еще есть проблемы ¹⁴. Значения pH выше 11 могут вызвать раздражение кожи и глаз, равно как и pH ниже 4. Значение pH ниже 2,5 вызовет необратимое повреждение кожи и внутренних органов ¹⁴. Более низкие уровни pH повышают риск мобилизации токсичных металлов, которые могут быть поглощены даже людьми, а уровни выше 8,0 не могут быть эффективно продезинфицированы хлором, вызывая другие косвенные риски ¹⁴. Кроме того, уровни pH за пределами 6,5-9.5 может повредить и вызвать коррозию труб и других систем, что еще больше повысит токсичность тяжелых металлов.
Значение pH ниже 2,5 вызовет необратимое повреждение кожи и внутренних органов ¹⁴. Более низкие уровни pH повышают риск мобилизации токсичных металлов, которые могут быть поглощены даже людьми, а уровни выше 8,0 не могут быть эффективно продезинфицированы хлором, вызывая другие косвенные риски ¹⁴. Кроме того, уровни pH за пределами 6,5-9.5 может повредить и вызвать коррозию труб и других систем, что еще больше повысит токсичность тяжелых металлов.
Незначительное повышение уровня pH может привести к тому, что олиготрофное (богатое растворенным кислородом) озеро станет эвтрофным (недостаточным растворенным кислородом).
Даже незначительные изменения pH могут иметь долгосрочные последствия. Небольшое изменение pH воды может повысить растворимость фосфора и других питательных веществ, что сделает их более доступными для роста растений ¹⁰. В олиготрофном озере или озере с низким содержанием питательных веществ для растений и высоким содержанием растворенного кислорода это может вызвать цепную реакцию. С более доступными питательными веществами процветают водные растения и водоросли, увеличивая потребность в растворенном кислороде. Это создает эвтрофное озеро, богатое питательными веществами и растениями, но с низким содержанием растворенного кислорода. В эвтрофном озере другие организмы, живущие в воде, будут подвергаться стрессу, даже если уровень pH остается в оптимальном диапазоне.
С более доступными питательными веществами процветают водные растения и водоросли, увеличивая потребность в растворенном кислороде. Это создает эвтрофное озеро, богатое питательными веществами и растениями, но с низким содержанием растворенного кислорода. В эвтрофном озере другие организмы, живущие в воде, будут подвергаться стрессу, даже если уровень pH остается в оптимальном диапазоне.
Факторы, влияющие на рН воды
Существует множество факторов, которые могут влиять на рН воды, как природных, так и техногенных. Большинство естественных изменений происходит из-за взаимодействия с окружающими породами (особенно карбонатными формами) и другими материалами. pH также может колебаться в зависимости от осадков (особенно кислотных дождей) и сточных вод или сбросов шахт ¹³. Кроме того, концентрация CO2 может влиять на уровень pH.
Двуокись углерода и pH
Уровни pH могут колебаться ежедневно из-за фотосинтеза и дыхания в воде. Степень изменения зависит от щелочности воды.
Углекислый газ является наиболее частой причиной повышения кислотности воды ¹⁵. Фотосинтез, дыхание и разложение способствуют колебаниям pH из-за их влияния на уровень CO2. Экстремальность этих изменений зависит от щелочности воды, но часто наблюдаются заметные суточные (суточные) вариации¹⁶. Это влияние более ощутимо в водоемах с высокой скоростью дыхания и разложения.
Хотя диоксид углерода существует в воде в растворенном состоянии (как и кислород), он также может реагировать с водой с образованием угольной кислоты:
CO2 + h3O <=> h3CO3
h3CO3 может терять один или оба иона водорода :
h3CO3 <=> HCO3 – + H+ …. HCO3 – <=> CO3 2- + H+
Высвобождающиеся ионы водорода снижают pH воды¹⁵. Однако это уравнение может работать в обоих направлениях в зависимости от текущего уровня pH, работая как собственная буферная система. При более высоком pH эта бикарбонатная система сдвинется влево, и CO3 2- захватит свободный ион водорода.
Эта реакция обычно минимальна, поскольку h3CO3 имеет низкую константу растворимости (закон Генри) ¹⁵. Однако по мере увеличения уровня CO2 во всем мире количество растворенного CO2 также увеличивается, и уравнение будет выполняться слева направо. Это увеличивает h3CO3, что снижает pH. Эффект становится все более очевидным в исследованиях pH океана с течением времени.
Общее изменение годового уровня pH океана с 1700-х по 1990-е годы. (данные: Атлас Мирового океана 2009 г.; фото предоставлено: Plumbago; Wikipedia Commons) Углекислый газ в атмосфере снижает pH осадков.
Приведенные выше уравнения также объясняют, почему рН дождя составляет примерно 5,65 ¹⁵. Когда капли дождя падают в воздух, они взаимодействуют с молекулами углекислого газа в атмосфере. Это создает h3CO3 в каплях дождя, снижая значение pH дождя ¹⁷. Уровень pH 5,65, хотя и кислый, не считается кислотным дождем. Ожидается, что естественный незагрязненный дождь или снег будет иметь уровень pH около 5,6 при стандартной концентрации CO2 в атмосфере 0,0355% ¹⁵.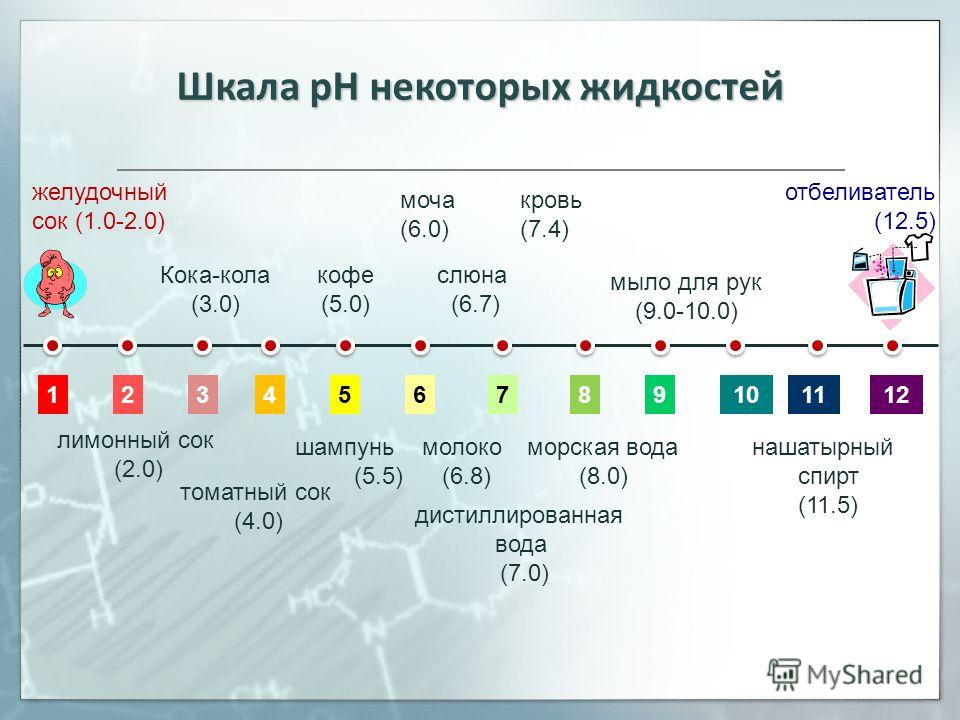 Кислотный дождь требует pH ниже 5,0 ²¹.
Кислотный дождь требует pH ниже 5,0 ²¹.
5,65 – это также pH воды, уравновешенной воздухом и не контактировавшей с карбонатными материалами или известняком.
Природные факторы, влияющие на уровень pH
Карбонатные материалы и известняк — это два элемента, которые могут смягчить изменения уровня pH в воде. Карбонат кальция (CaCO3) и другие бикарбонаты могут объединяться как с ионами водорода, так и с гидроксильными ионами для нейтрализации pH¹⁸. Когда в почве присутствуют карбонатные минералы, буферная способность (щелочность) воды увеличивается, поддерживая рН воды близким к нейтральному даже при добавлении кислот или оснований. Дополнительные карбонатные материалы помимо этого могут сделать нейтральную воду слегка щелочной.
Известняковые карьеры имеют более высокий уровень pH из-за карбонатных материалов в камне. Молния может снизить pH дождя.
Как упоминалось ранее, незагрязненный дождь слегка кислый (pH 5,6). Уровень pH дождя также может быть снижен из-за вулканического пепла, сульфатредуцирующих бактерий на водно-болотных угодьях, переносимых по воздуху частиц от лесных пожаров и даже молний ¹⁹.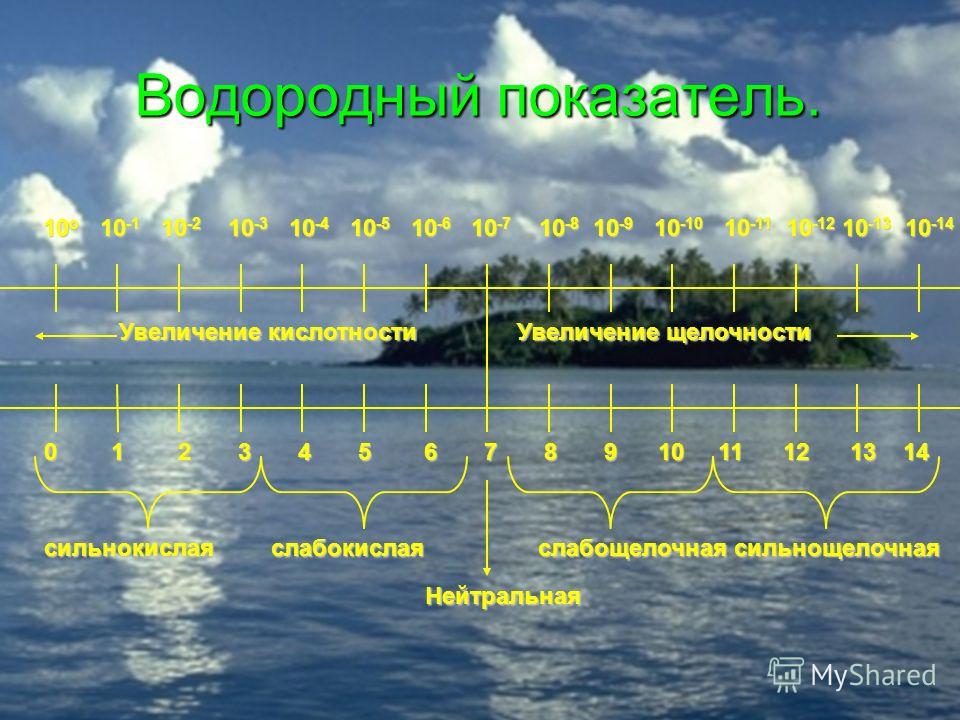 Если дождь падает на источник воды с плохой буферизацией, он может снизить pH близлежащей воды из-за стока.
Если дождь падает на источник воды с плохой буферизацией, он может снизить pH близлежащей воды из-за стока.
Разлагающиеся сосновые иголки могут снизить уровень pH.
Хвоя сосны или пихты также может снизить pH почвы и любой воды, которая стекает по ней, поскольку они разлагаются ¹⁸. Интенсивный фотосинтез увеличивает pH воды, удаляя CO2, хотя это изменение обычно происходит в течение суток ²⁰.
Искусственные регуляторы pH
Загрязнение воздуха, почвы или непосредственно воды может влиять на pH.
Антропогенные причины колебаний рН обычно связаны с загрязнением. Кислотные дожди — один из наиболее известных примеров влияния человека на рН воды. Любая форма осадков с уровнем pH менее 5,0 известна как кислотный дождь ²¹. Этот осадок возникает в результате реакции воды с оксидами азота, оксидами серы и другими кислыми соединениями, понижая ее и без того слабокислый рН. Эти выбросы обычно возникают в результате горнодобывающих и плавильных работ или сжигания ископаемого топлива (сжигание угля и автомобили) ¹⁸.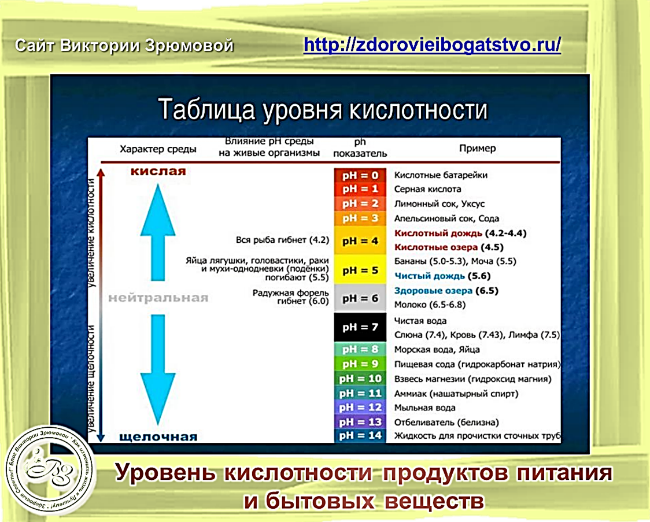 Чрезвычайно высокий уровень CO2 также может еще больше снизить pH дождя ¹⁷.
Чрезвычайно высокий уровень CO2 также может еще больше снизить pH дождя ¹⁷.
Загрязнение из точечного источника является распространенной причиной, которая может увеличивать или уменьшать pH в зависимости от вовлеченных химических веществ ¹⁸. Эти химические вещества могут поступать из сельскохозяйственных стоков, сбросов сточных вод или промышленных стоков. Добыча полезных ископаемых (особенно угля) приводит к кислотным стокам и просачиванию кислых грунтовых вод, если окружающая почва плохо защищена ²². Сброс сточных вод, содержащих моющие средства и продукты на основе мыла, может привести к тому, что источник воды станет слишком щелочным.
Типичные уровни pH
Рекомендуемые минимальные уровни pH для водных организмов.
Типичные уровни pH варьируются в зависимости от воздействия окружающей среды, особенно щелочности. Щелочность воды меняется из-за присутствия растворенных солей и карбонатов, а также минерального состава окружающей почвы. Как правило, чем выше щелочность, тем выше pH; чем ниже щелочность, тем ниже pH ⁶.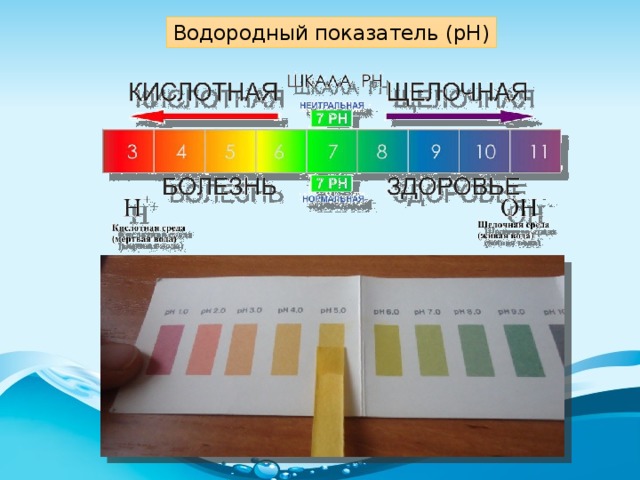 Рекомендуемый диапазон рН для большинства рыб составляет от 6,0 до 9,0 с минимальной щелочностью 20 мг/л, с идеальным уровнем CaCO3 от 75 до 200 мг/л²⁰.
Рекомендуемый диапазон рН для большинства рыб составляет от 6,0 до 9,0 с минимальной щелочностью 20 мг/л, с идеальным уровнем CaCO3 от 75 до 200 мг/л²⁰.
Океанические организмы, такие как рыба-клоун и коралл, требуют более высокого уровня pH. Уровень pH ниже 7,6 приведет к разрушению коралловых рифов из-за недостатка карбоната кальция ³⁹. Чувствительные пресноводные виды, такие как лосось, предпочитают уровни pH от 7,0 до 8,0, при этом уровень pH ниже 6,0 ⁴⁰ вызывает серьезные расстройства и физиологические повреждения из-за поглощенных металлов.
Соображения по охране окружающей среды
Естественные осадки, как дождь, так и снег, имеют pH около 5,6 из-за контакта с CO2 и других атмосферных воздействий. Большинство трав и бобовых предпочитают почвы с pH 4,5-7,0, поэтому небольшая кислотность дождя может пойти на пользу карбонатным почвам ²³.
Кислотность окружающей среды также может влиять на рН воды. Это наиболее очевидно вблизи районов добычи полезных ископаемых, но эффект может возникать и естественным путем.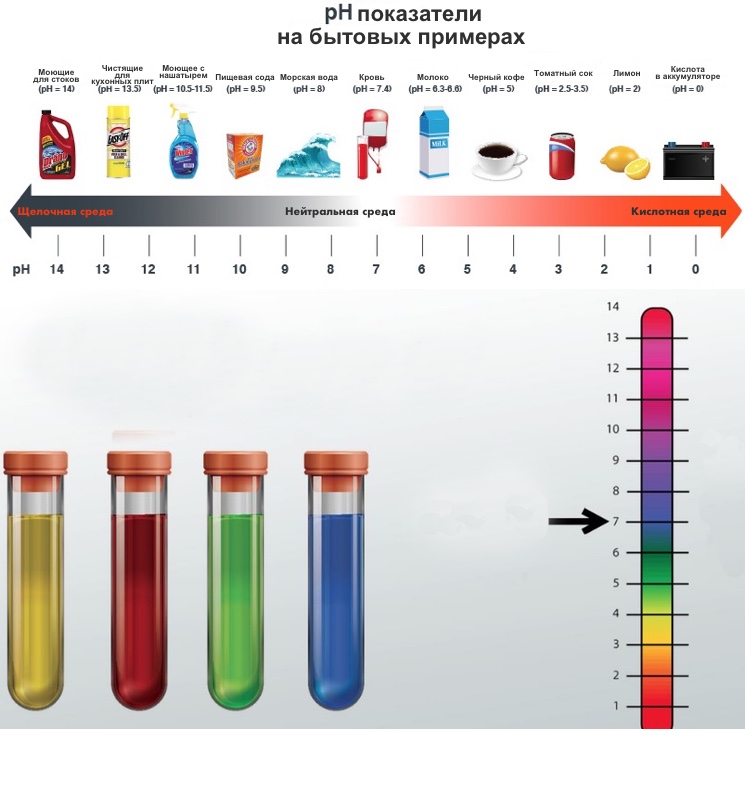 Кислотный сток истощает щелочность воды и снижает рН ниже оптимального уровня. Это может быть приемлемо для некоторых водных видов (например, лягушек), но не для большинства рыб. Некоторые лягушки и другие земноводные часто могут переносить уровень pH всего 4,0 ²⁴. Из-за кислых почв Амазонки многие озера и реки имеют низкий уровень pH ³⁸. Из-за растворенных гуминовых веществ из стока и поглощения источники «черной воды» могут иметь pH всего 4,43. Источники с «чистой водой» будут иметь немного более высокое, но все же кислое значение pH ³⁸. Вот почему рыбы-ангелы и дискусы из бассейна реки Амазонки могут вполне счастливо жить в водах с pH всего 5,0 ²⁵.
Кислотный сток истощает щелочность воды и снижает рН ниже оптимального уровня. Это может быть приемлемо для некоторых водных видов (например, лягушек), но не для большинства рыб. Некоторые лягушки и другие земноводные часто могут переносить уровень pH всего 4,0 ²⁴. Из-за кислых почв Амазонки многие озера и реки имеют низкий уровень pH ³⁸. Из-за растворенных гуминовых веществ из стока и поглощения источники «черной воды» могут иметь pH всего 4,43. Источники с «чистой водой» будут иметь немного более высокое, но все же кислое значение pH ³⁸. Вот почему рыбы-ангелы и дискусы из бассейна реки Амазонки могут вполне счастливо жить в водах с pH всего 5,0 ²⁵.
Морская вода имеет рН около 8,2, хотя он может варьироваться от 7,5 до 8,5 в зависимости от местной солености. Уровень pH будет увеличиваться с увеличением солености до тех пор, пока вода не достигнет насыщения карбонатом кальция (CaCO3) ¹⁶. Океаны, как правило, имеют более высокую щелочность из-за содержания карбонатов и, следовательно, обладают большей способностью буферизовать свободные ионы водорода ²⁷.
Пресноводные озера, пруды и ручьи обычно имеют pH 6-8 в зависимости от окружающей почвы и коренных пород ²¹. В более глубоких озерах, где происходит расслоение, рН воды обычно выше (7,5-8,5) у поверхности и ниже (6,5-7,5) на больших глубинах ¹⁰. Некоторые штаты, такие как Аляска, пытаются поддерживать стандарт pH для качества воды. Стандарт качества воды Аляски требует уровня pH от 6,5 до 8,5 для защиты многих популяций лосося в штате ⁴⁰.
Вопросы стратификации
Стратификация может привести к тому, что уровни pH в водоеме будут различаться выше и ниже клин.
Стратификация обычно вызывается разницей температур внутри водоема, когда каждый слой воды не смешивается со слоями выше или ниже ³⁷. Эти слои разделены клинами, известными как термоклины (температурные границы) или хемоклины (химические градиенты). Хемоклины могут быть основаны на кислороде, солености или других химических факторах, которые не пересекают клин, таких как углекислый газ. Из-за влияния CO2 на pH воды стратификация может привести к тому, что уровни pH будут различаться в зависимости от склона.
Различия в уровне pH между водными слоями обусловлены повышенным содержанием CO2 в результате дыхания и разложения ниже термоклина. В кратерных озерах, таких как озеро Ниос или озеро Монун, pH быстро падает с уровня поверхности примерно 7 до 5,5 ниже 60 м (в термоклине и хемоклине) ²⁶. Это значительное падение происходит из-за насыщенного CO2, который накапливается в нижних слоях озера.
Адаптивность
В то время как идеальный уровень pH для рыб составляет 7–8 (pH крови рыб составляет 7,4) ²⁰, большинство рыб могут адаптироваться к уровню pH окружающей среды (6,0–9)..0), если нет резких колебаний. Резким колебанием считается сдвиг рН на 1,4 (вверх или вниз)²². Для морских рыб pH воды должен оставаться в пределах 7,5–8,5 ⁹.
Необычные уровни pH и последствия
Каменистые кораллы начинают обесцвечиваться и портиться по мере падения уровня карбоната и pH.
Вредное воздействие становится заметным, когда pH воды падает ниже 5,0 или поднимается выше 9,6. Болезненные эффекты из-за подкисления более выражены у морских рыб из-за их адаптации к более высокому pH. Когда pH ниже оптимального уровня, рыба становится восприимчивой к грибковым инфекциям и другим физическим повреждениям ¹⁶. Когда рН воды падает, растворимость карбоната кальция снижается, что препятствует росту скорлупы водных организмов ¹⁶. Как правило, на воспроизводство рыб влияет уровень pH ниже 5,0, и многие виды (например, морские рыбы или чувствительные пресноводные рыбы, такие как малоротый окунь) покидают зону ²¹. Рыба начинает умирать, когда рН падает ниже 4,0 ¹².
Болезненные эффекты из-за подкисления более выражены у морских рыб из-за их адаптации к более высокому pH. Когда pH ниже оптимального уровня, рыба становится восприимчивой к грибковым инфекциям и другим физическим повреждениям ¹⁶. Когда рН воды падает, растворимость карбоната кальция снижается, что препятствует росту скорлупы водных организмов ¹⁶. Как правило, на воспроизводство рыб влияет уровень pH ниже 5,0, и многие виды (например, морские рыбы или чувствительные пресноводные рыбы, такие как малоротый окунь) покидают зону ²¹. Рыба начинает умирать, когда рН падает ниже 4,0 ¹².
Низкий уровень pH может способствовать растворимости тяжелых металлов ¹². По мере увеличения уровня ионов водорода катионы металлов, таких как алюминий, свинец, медь и кадмий, высвобождаются в воду вместо того, чтобы поглощаться осадком. С увеличением концентрации тяжелых металлов возрастает и их токсичность. Алюминий может ограничивать рост и размножение, повышая уровень смертности при таких низких концентрациях, как 0,1–0,3 мг/л²². Кроме того, мобилизованные металлы могут поглощаться организмами во время дыхания, вызывая физиологические повреждения ²². Это особенно губительно для таких видов, как радужная форель ¹³.
Кроме того, мобилизованные металлы могут поглощаться организмами во время дыхания, вызывая физиологические повреждения ²². Это особенно губительно для таких видов, как радужная форель ¹³.
С другой стороны, высокие уровни pH могут повредить жабры и кожу водных организмов и вызвать смерть при уровне выше 10,0. В то время как некоторые африканские цихлиды прекрасно себя чувствуют при высоком уровне pH (до 9,5), большинство рыб не переносят его. Смерть может наступить даже при типичном уровне (9,0), если в воде присутствует аммиак ²¹. При низком и нейтральном уровне pH аммиак соединяется с водой с образованием иона аммония:
Nh4 + h3O <=> Nh5 + + OH –
Устойчивые к низкому pH водоросли могут образовывать цветки, которые могут убить озеро.
Аммоний, Nh5⁺, не токсичен и не влияет на водную жизнь. Однако при уровне pH выше 9 уравнение меняется на противоположное, и в воду выделяется аммиак ²². Аммиак, Nh4, чрезвычайно токсичен для водных организмов, и по мере увеличения pH уровень смертности увеличивается с концентрацией Nh4.
Что касается экосистемы, то мхи могут начать заселять водоемы, когда pH воды падает ниже 5. В эвтрофных озерах могут доминировать устойчивые к pH водоросли, приводя уровни pH к дневным максимумам и минимумам, образуя цветение водорослей, которое может убить озеро ¹⁶.
Щелочные и кислотные озера
По всему миру разбросано множество озер с необычным уровнем pH. Щелочные озера, также известные как содовые, обычно имеют уровень pH от 9 до 12. Это часто связано с высоким содержанием соли (хотя не каждое соленое озеро имеет высокий pH). В этих озерах высокая концентрация минералов, особенно растворенных солей: карбонатов и бикарбонатов натрия, кальция, магния ²⁸. В зависимости от озера также могут присутствовать бораты, сульфаты и другие элементы (обычно ионы сильных оснований) ²⁹. Щелочные озера образуются, когда единственным выходом для воды является испарение, в результате чего минералы накапливаются ³⁰. Эти минералы часто образуют столбы месторождений полезных ископаемых, известные как столбы туфа. Многие щелочные озера являются коммерческим источником кальцинированной соды и поташа, в то время как другие являются популярными туристическими направлениями из-за их «волшебных» целебных свойств (из-за содержания минералов).
Многие щелочные озера являются коммерческим источником кальцинированной соды и поташа, в то время как другие являются популярными туристическими направлениями из-за их «волшебных» целебных свойств (из-за содержания минералов).
Мыльное озеро в Вашингтоне — это щелочное озеро, которое, как предполагается, обладает целебными свойствами (Фото: Стивен Павлов из Википедии Commons). Обызвествленный фламинго, сохранившийся благодаря минералам соды в озере Натрон. (Фото: © Nick Brandt, 2013 Предоставлено галереей Hasted Kraeutler, Нью-Йорк.)
Печально известным примером щелочного озера является озеро Натрон в Танзании. Озеро Натрон имеет pH до 10,5 из-за высоких концентраций декагидрата карбоната натрия (кальцинированной соды) и бикарбоната натрия (пищевой соды), которые попадают в воду из окружающей почвы ³¹. В то время как озеро поддерживает процветающую экосистему, включая фламинго, щелочную тиляпию и устойчивые к pH водоросли, фотограф Ник Брант создал множество запоминающихся изображений животных, погибших в этом озере ³¹. Тела этих животных сохраняются с помощью карбоната натрия, как в древнеегипетском процессе мумификации.
Тела этих животных сохраняются с помощью карбоната натрия, как в древнеегипетском процессе мумификации.
Кислые озера обычно образуются вблизи вулканов, где серная кислота, сероводород, плавиковая кислота, соляная кислота и углекислый газ могут попадать в воду ³². В невулканических районах кислотные озера также могут образовываться после кислотных отложений в результате таких явлений, как кислотные дожди, загрязнение или кислотные стоки при добыче полезных ископаемых ³³. Как и их щелочные аналоги, кислые озера не имеют выхода, кроме испарения, концентрирующего сульфаты и кислоты. Кислоты могут попасть в воду в результате атмосферной диффузии в результате сжигания угля, кислотных дождей или после извержения. В вулканических озерах кислоты могут попадать в воду через активную фумаролу или вулканическое отверстие.
Залежи серы и железа на одном из кислых озер Даллола.
Кислотные озера в Даллоле в Эфиопии являются результатом кислотного выщелачивания из близлежащих вулканов. Сера и железо в воде оставляют желтые и ржавые отложения у кромки воды.
Сера и железо в воде оставляют желтые и ржавые отложения у кромки воды.
При уровне pH ниже 5,0 немногие организмы могут жить в кислых озерах. Однако есть одно заметное исключение: елец Осорезан, или японский елец. Эта рыба прекрасно себя чувствует в кислых водах озера Осорезан, комфортно отдыхая при рН 3,5, и плавает в водах с нейтральным рН только для нереста ³⁴.
Окисление океана
По мере увеличения содержания CO2 в атмосфере увеличивается количество растворенного CO2, а pH воды снижается. (данные: NOAA/ESRL и Гавайский университет; кредит: SERC EarthLabs)
Закисление океана вызвано притоком растворенного углекислого газа. По мере того, как уровень CO2 в атмосфере увеличивается из-за антропогенных причин, также увеличивается количество растворенного CO2, что, в свою очередь, снижает pH воды.
Когда вода насыщается CO2, это не только снижает pH океана, но и истощает источники карбоната кальция ³⁵. Карбонат кальция, CaCO3, является необходимым компонентом для построения кораллов, раковин и экзоскелетов многих водных существ. По мере снижения уровня CO3²⁻ морским существам становится все труднее строить свои раковины.
По мере снижения уровня CO3²⁻ морским существам становится все труднее строить свои раковины.
Как уже упоминалось в разделе «Углекислый газ и pH», дополнительный CO2 увеличивает количество ионов водорода в воде, снижая pH:
CO2 + h3O <=> h3CO3 … h3CO3 <=> (H+) + HCO3⁻
При уровне pH от 6,4 до 10,33 некоторые из этих ионов водорода присоединяются к карбонат-ионам ²²:
(H+) + CO3 2- <=> HCO3 –
Таким образом, по мере увеличения уровня CO2 доступность карбоната , CO3 2- уменьшается, уменьшая количество, доступное для строительства раковин и кораллов ³⁶.
CO2 + h3O + CO3²⁻ <=> 2HCO3⁻
При рН океана 8,3 уровень карбоната достаточно высок для образования кораллов. По мере увеличения CO2 и снижения pH уровень карбоната быстро упадет ниже оптимального уровня.
Высокие уровни CO2 также затрудняют поддержание текущей скорлупы из-за более низкого уровня pH и конкуренции за карбонат ³⁵.
Кроме того, насыщение воды воздухом основано на парциальном давлении согласно закону Генри. По мере увеличения уровня CO2 в воздухе увеличивается и его парциальное давление. Это снижает парциальное давление кислорода, снижая уровень его насыщения и способствуя гипоксии (с низким содержанием O2) ³⁵.
По мере увеличения уровня CO2 в воздухе увеличивается и его парциальное давление. Это снижает парциальное давление кислорода, снижая уровень его насыщения и способствуя гипоксии (с низким содержанием O2) ³⁵.
Хотя океаны никогда не станут «кислыми» (с pH ниже 7), даже незначительное снижение pH вызывает стресс у морских организмов и увеличивает уровень смертности. pH является логарифмическим, а это означает, что уменьшение на 0,1 эквивалентно увеличению кислотности почти на 30% ³⁵.
Процитировать эту работу
Fondriest Environmental, Inc. «pH воды». Основы экологических измерений. 19 ноября 2013 г. Интернет. < https://www.fondriest.com/environmental-measurements/parameters/water-quality/ph/ >.
Дополнительная информация
- Методы измерения pH
- pH-метры
- Датчики pH
- Приложения
- Ссылки
Что такое pH? | Water & Wastes Digest
Об авторе:
Брайан Кэмпбелл является основателем WaterFilterGuru. com, где он ведет блог о качестве воды. Его стремление помочь людям получить доступ к чистой и безопасной воде проявляется в экспертном отраслевом освещении, которое он предоставляет. Подпишитесь на него в Twitter @WF_Guru или свяжитесь с ним по электронной почте [email protected].
com, где он ведет блог о качестве воды. Его стремление помочь людям получить доступ к чистой и безопасной воде проявляется в экспертном отраслевом освещении, которое он предоставляет. Подпишитесь на него в Twitter @WF_Guru или свяжитесь с ним по электронной почте [email protected].
Примечание редактора: в предыдущей версии этой статьи щелочная вода и основная вода использовались взаимозаменяемо. Хотя все щелочные растворы являются основными, не все основные растворы являются щелочными. Статья была обновлена, чтобы исправить эту ошибку.
Что такое рН?
Простое определение заключается в том, что он измеряет, насколько кислым или щелочным является раствор.
Более научное определение состоит в том, что оно указывает на концентрацию ионов водорода в жидкости. В то время как низкий pH указывает на более высокую концентрацию водорода, высокий pH указывает на более низкую концентрацию водорода.
Для тех, кто знаком с химией, можно рассчитать pH любого вещества, используя формулу: pH = — log [h4O+].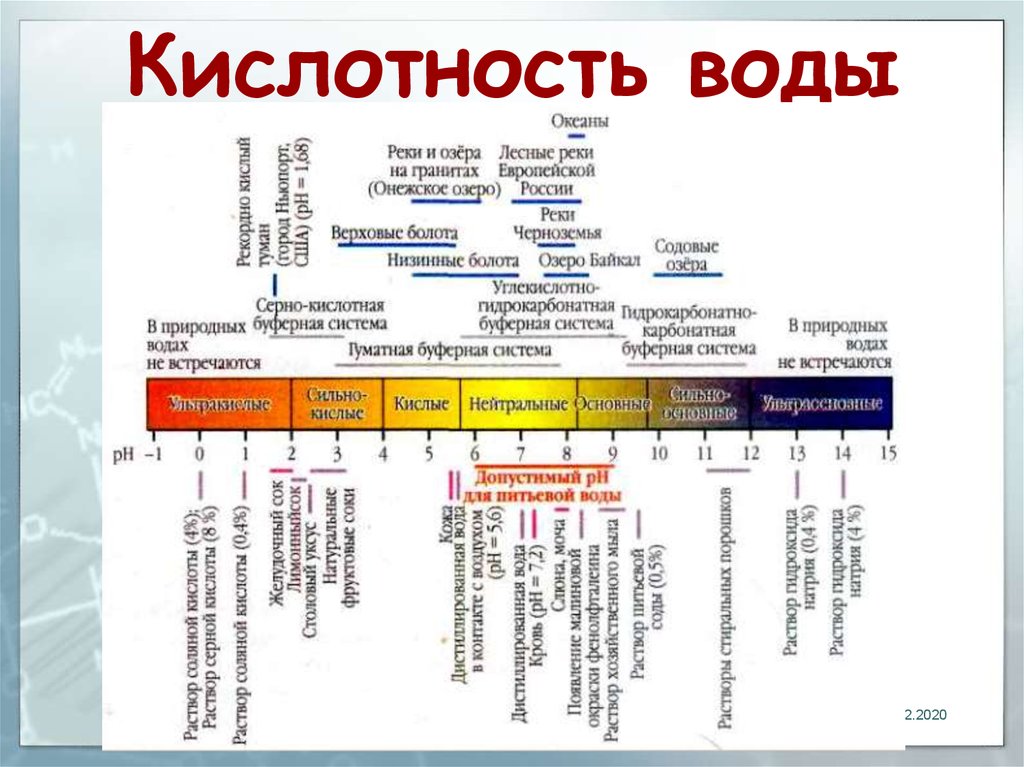
Однако эта формула — не единственный способ расчета pH воды. В этой статье объясняется, что на нее влияет, проблемы с кислой и щелочной водой и как проверить ее в воде в домашних условиях.
Что меняет рН воды?
Вода имеет нейтральный pH 7, что указывает на то, что она не является ни кислой, ни щелочной. Шкала варьируется от 0 (очень кислая) до 14 (очень щелочная). Для воды нормально иметь диапазон от 6,5 до 8,5 по шкале.
pH воды может колебаться в зависимости от различных факторов окружающей среды. Дождевая вода по своей природе более кислая и обычно имеет рН около 5,65. Но когда эта вода попадает в воздух, она взаимодействует с атмосферным углекислым газом, что повышает кислотность и, следовательно, снижает рН.
Когда дождевая вода попадет на землю, геология земли снова повлияет на ее рН. Когда эта вода просачивается сквозь слои богатой минералами породы, она становится более щелочной. Но если он подвергается воздействию только магматических пород, таких как гранит, маловероятно, что он вообще сильно изменится.
Сбросы шахт и сточные воды также могут влиять на нее, и в сточных водах она обычно нейтральна, но химические вещества, загрязняющие вещества и другие загрязнители в этой воде могут сделать ее очень кислой или щелочной.
Как это влияет на питьевую воду?
Кислотность или щелочность питьевой воды может влиять на ее состав. В то время как кислая вода с большей вероятностью будет содержать металлические примеси, щелочная вода обычно имеет высокую концентрацию полезных минералов.
Обычная вода считается более здоровой, чем вода с нейтральным значением, поскольку она предотвращает хронические заболевания из-за кислотности в организме. Однако до сих пор не так много научных доказательств, подтверждающих эти утверждения. Что мы знаем, так это то, что вода с немного более высоким показателем от 8 до 8,5, скорее всего, будет иметь более высокую концентрацию полезных минералов и электролитов, таких как кальций, калий и магний, которые необходимы человеческому организму для выживания.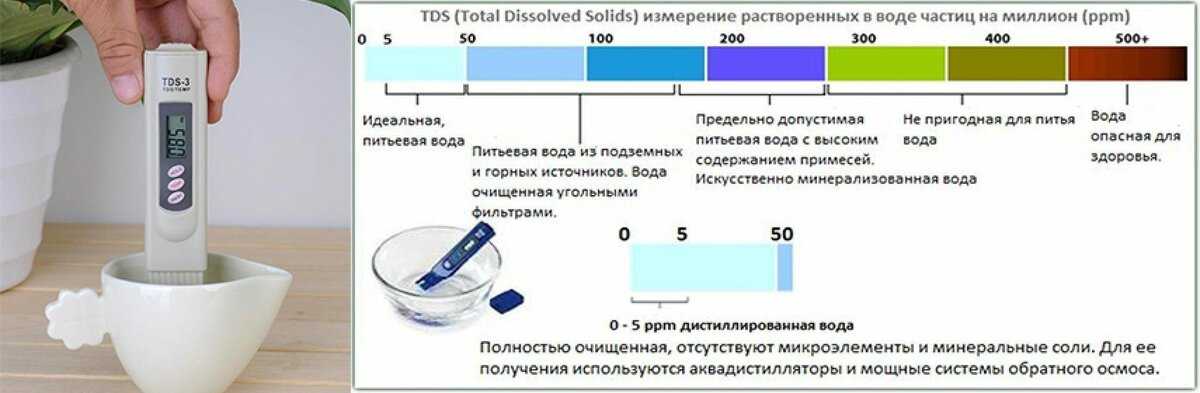
Кислая вода, с другой стороны, может разъедать зубы, поэтому ее пить не рекомендуется. Кислая вода также более восприимчива к выщелачиванию металлов, поэтому, употребляя воду с низкими показателями, человек больше рискует потреблять опасные уровни меди, свинца и подобных загрязняющих веществ.
Безопасный диапазон для питьевой воды
По данным Агентства по охране окружающей среды (EPA), безопасный диапазон pH воды составляет от 6,5 до 8,5. Любое значение выше или ниже этого значения, и вода не рекомендуется для питья. Оптимальное значение для питьевой воды равно 7.
Риски, связанные с небезопасными уровнями
Кислая вода и щелочная вода представляют свои специфические риски.
Некоторые риски, связанные с кислой водой, включают:
Повышенное потребление металлов
Вода с более низким pH с большей вероятностью захватывает тяжелые металлы, такие как медь, свинец, мышьяк, цинк и хром. Питьевая кислая вода подвергает вас большему риску потребления более высокой концентрации этих металлов.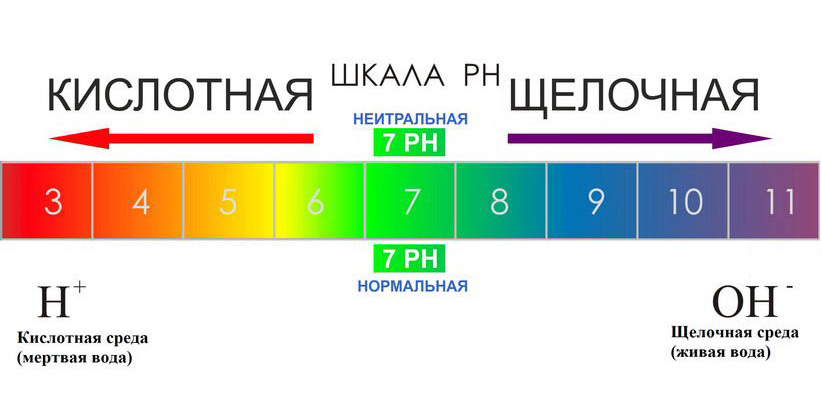 В долгосрочной перспективе это может привести к опасным состояниям, таким как токсичность и отравление тяжелыми металлами.
В долгосрочной перспективе это может привести к опасным состояниям, таким как токсичность и отравление тяжелыми металлами.
Повреждение зубов
Употребление кислой воды может ухудшить общее состояние зубов. Поскольку вода с низким pH более агрессивна, она может увеличить риск разрушения зубной эмали. Зубная эмаль важна для защиты внутренних слоев зуба от повреждений и сохранения белизны зубов. Разрушенная зубная эмаль более восприимчива к кариесу и инфекциям.
Повреждение водопровода
Коррозионные свойства кислой воды также могут повредить водопроводную систему вашего дома. Со временем вода с низким pH может растворять металлические трубы, в результате чего тяжелые металлы попадают в воду. Кислая вода также может привести к износу труб, что приведет к утечкам, ремонт которых может быть дорогостоящим.
Некоторые риски, связанные с употреблением обычной воды, включают:
Понижает кислотность желудка
Базовая вода может снизить рН в желудке. Это может снизить естественную кислотность желудка, которая необходима для уничтожения бактерий и других патогенов, предотвращая их попадание в кровоток.
Это может снизить естественную кислотность желудка, которая необходима для уничтожения бактерий и других патогенов, предотвращая их попадание в кровоток.
Метаболический алкалоз
Слишком большое количество щелочной воды может привести к состоянию, называемому метаболическим алкалозом, которое нарушает нормальный рН организма. При метаболическом алкалозе у вас могут возникнуть такие симптомы, как рвота, тошнота, подергивание мышц, тремор рук и спутанность сознания.
Плохое здоровье костей
Также известно, что алкалоз (связанный с основной водой) снижает уровень свободного кальция в организме, что может повлиять на здоровье костей. Кроме того, низкий уровень свободного кальция может замедлять частоту сердечных сокращений и вызывать мышечные спазмы.
Реклама
Тестирование
В лабораторных условиях рН-метры обычно используются для получения точных показаний в воде. Вы можете купить счетчик онлайн, но они могут быть более дорогими.
