Содержание
Реакция термического разложения воды
Химические реакции
Виктор Потехин
Реакция термического разложения воды.
Уравнение реакции термического разложения воды:
Вода разлагается под действием высокой температуры или электрического тока.
2H2O → 2H2 + O2 (t = 2000 °C или электрический ток).
Реакция термического разложения воды протекает при условии: при температуре 2000 °C.
В результате реакции термического разложения воды образуются водород и кислород.
Все химические реакции.
Примечание: © Фото https://www.pexels.com, https://pixabay. com
com
Коэффициент востребованности
212
- ← Ультразвуковой нож
- Реакция магния с водой →
Мировая экономика
Нефть Brent и WTI
USD/JPY
USD/AUD
USD/CHF
USD/GBP
USD/CAD
Серебро
Палладий
Золото
Справочники
Востребованные технологии
- Концепция инновационного развития общественного производства – осуществления Второй индустриализации России на период 2017-2022 гг. (107 463)
- Экономика Второй индустриализации России (104 147)
- Этилен (этен), получение, свойства, химические реакции (33 257)
- Программа искусственного интеллекта ЭЛИС (30 849)
- Метан, получение, свойства, химические реакции (28 418)
- Крахмал, свойства, получение и применение (28 138)
- Природный газ, свойства, химический состав, добыча и применение (27 474)
- Целлюлоза, свойства, получение и применение (26 784)
- Пропилен (пропен), получение, свойства, химические реакции (26 268)
- Прямоугольный треугольник, свойства, признаки и формулы (25 420)
Еще технологии
Поиск технологий
Выберите отрасль экономики или все отраслиПоиск по всем отраслямБиотехнологииВодоснабжение и водоотведениеДобыча, обработка и переработка полезных ископаемыхЗдравоохранениеИнформация и связьЛегкая промышленностьЛесная и деревообрабатывающая промышленностьНаноиндустрияНефтехимическая промышленностьОбразование. Подготовка кадровПищевая промышленностьПолучение энергии. ЭлектроэнергетикаПроизводство компьютеров, электронных и оптических изделийПроизводство лекарственных средств и материаловПроизводство машин и оборудованияПроизводство металлических изделийПроизводство прочей неметаллической минеральной продукцииПроизводство резиновых и пластмассовых изделийПроизводство транспортных средств и оборудованияПроизводство электрического оборудованияПромышленность строительных материаловСбор и утилизация отходов, ликвидация загрязненийСельское хозяйство, лесное хозяйство, охота, рыболовство и рыбоводствоСистемы (технологии) управленияСтекольная и фарфоро-фаянсовая промышленностьСтроительствоСупер прорывные технологииТопливная промышленностьТранспортировкаХимическая промышленностьХранениеЦеллюлозно-бумажная промышленностьЧерная и цветная металлургия
Подготовка кадровПищевая промышленностьПолучение энергии. ЭлектроэнергетикаПроизводство компьютеров, электронных и оптических изделийПроизводство лекарственных средств и материаловПроизводство машин и оборудованияПроизводство металлических изделийПроизводство прочей неметаллической минеральной продукцииПроизводство резиновых и пластмассовых изделийПроизводство транспортных средств и оборудованияПроизводство электрического оборудованияПромышленность строительных материаловСбор и утилизация отходов, ликвидация загрязненийСельское хозяйство, лесное хозяйство, охота, рыболовство и рыбоводствоСистемы (технологии) управленияСтекольная и фарфоро-фаянсовая промышленностьСтроительствоСупер прорывные технологииТопливная промышленностьТранспортировкаХимическая промышленностьХранениеЦеллюлозно-бумажная промышленностьЧерная и цветная металлургия
Поиск технологий
Финансирование:Технологии ожидают финансирования
В процессе разработки:Технологии в процессе разработки
О чём данный сайт?
Настоящий сайт посвящен авторским научным разработкам в области экономики и научной идее осуществления Второй индустриализации России.
Он включает в себя:
– экономику Второй индустриализации России,
– теорию, методологию и инструментарий инновационного развития – осуществления Второй индустриализации России,
– организационный механизм осуществления Второй индустриализации России,
– справочник прорывных технологий.
Мы не продаем товары, технологии и пр. производителей и изобретателей! Необходимо обращаться к ним напрямую!
Мы проводим переговоры с производителями и изобретателями отечественных прорывных технологий и даем рекомендации по их использованию.
О Второй индустриализации
Осуществление Второй индустриализации России базируется на качественно новой научной основе (теории, методологии и инструментарии), разработанной авторами сайта.
Конечным результатом Второй индустриализации России является повышение благосостояния каждого члена общества: рядового человека, предприятия и государства.
Вторая индустриализация России есть совокупность научно-технических и иных инновационных идей, проектов и разработок, имеющих возможность быть широко реализованными в практике хозяйственной деятельности в короткие сроки (3-5 лет), которые обеспечат качественно новое прогрессивное развитие общества в предстоящие 50-75 лет.
Та из стран, которая первой осуществит этот комплексный прорыв – Россия, станет лидером в мировом сообществе и останется недосягаемой для других стран на века.
Может быть интересно:
Реакция — разложение — вода
Cтраница 1
Реакция разложения воды является наиболее характерной для щелочных металлов.
[1]
| Сопоставление потенциалов разных электродов в растворах редокс-системы Се4 3.
[2] |
Реакция разложения воды: 2Се Н2О — — 2Се3 1 / 2О2 2Н, которая должна протекать активно, учитывая значения формальных потенциалов системы.
[3]
При изучении реакции электрохимического разложения воды в присутствии окислительно-восстановительных ферментов — гидрогеназ — было установлено, что их эффективность значительно возрастает, если фермент включен в полимерные матрицы, обладающие электронной проводимостью.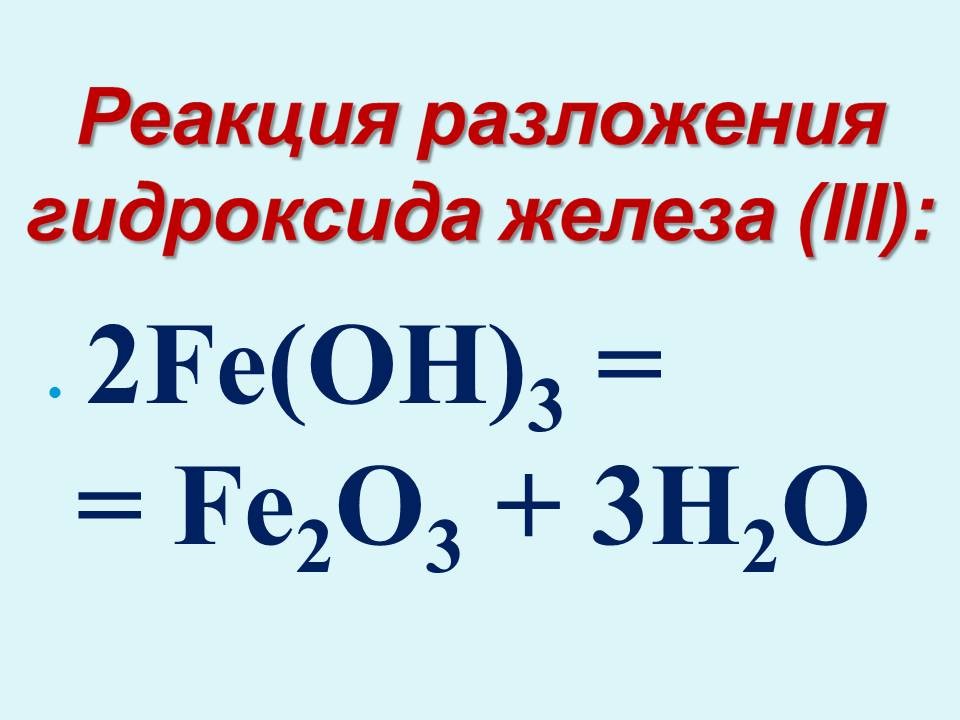
[4]
Химически активные материалы являются катализаторами реакции разложения воды.
[5]
Рассмотрение химического равновесия при наличии нескольких реакций разложения воды приводит к алгебраическим уравнениям высокой степени. Как известно, число корней уравнения равно его степени.
[6]
Имея в виду, что теоретический предел энергозатрат реакции разложения воды составляет 3 эВ / моль, КПД описанного процесса составит 90 — 97 / о в зависимости от параметров системы. Учитывая расход тепла на процесс испарения воды и на потери тепла в системе, авторы исследования считают, что на получение 1 м3 Н2 таким методом энергетические затраты составят 3 5 кВт — ч, против 6 кВт — ч при обычном электролизе. Кроме того, авторы отмечают более простое технологическое оформление процесса.
[7]
Данные по теплотам хемосорбции были получены путем измерения равновесий реакции разложения воды на палладии и сплавах палладия с серебром. Для палладиевой черни была получена величина теплоты адсорбции, равная — 24 ккал / моль.
Для палладиевой черни была получена величина теплоты адсорбции, равная — 24 ккал / моль.
[8]
Примером такой задачи является поиск химических рабочих тел для осуществления реакций разложения воды на водород и кислород в замкнутом цикле при наличии ограничений на температуру.
[9]
Потеря некоторого количества электричества обусловливается побочными реакциями, из которых главное значение имеет реакция разложения воды во время заряда аккумулятора. Известное значение здесь имеет также отделение активной массы от электродов.
[10]
| Зависимость. — рН для платиновых ( X, золотых ( и стеклянных ( Д, ЭО-01, ( О, ЭО-021 электродов.
[11] |
Из этого следует, что хотя система СlOj 1 обладает ярко выраженными окислительными свойствами, но от кислых до нейтральных растворов реакцию разложения воды можно не учитывать.
[12]
Расход энергии в балансе электролизера состоит из теплового эффекта реакции разложения хлорида натрия и воды на хлор, водород и гидроокись натрия и реакции разложения воды на водород и кислород, а также физического тепла, уносимого из электролизера катодными щелоками, хлором и водородом, энтальпии паров воды, уносимых из электролизера газообразными продуктами электролиза, и потерь тепла через стенки аппарата в окружающую среду.
[13]
Расход энергии в балансе электролизера будет включать тепловой эффект реакции разложения хлорида натрия и воды на хлор, водород и гидроокись натрия, а также реакции разложения воды на водород и кислород, физическое тепло, уносимое из электролизера с катодными щелоками, хлором и водородом, энтальпию паров воды, уносимых из электролизера с газообразными продуктами электролиза, и потери тепла стенками аппарата в окружающую среду.
[14]
| Изменение потенциала во времени после включения тока для замедленной электрохимической стадии при л 25 мВ. / — С 50 мкФ / см2. / КГ2 А / см2, т, 0 24 В, 1 / 1, 100. 2 — С 50 мкФ / см1. / 10 2А / см2, Т 0 36 В, J / t, 1000.
[15] |
Страницы:
1
2
3
Water — Scientific American
Share на Facebook
Share в Twitter
Share на Reddit
Share на LinkedIn
Depainta Email
- Водонепроницаемая рабочая зона
- Помощник для взрослых
- Графит для механического карандаша (достаточно толстый, чтобы не сломаться) или деревянный карандаш и нож, чтобы ваш взрослый помощник извлек графит
- Клей
- Play-Doh или другая глина
- Два или три одноразовых пластиковых стаканчика (лучше всего подходят прозрачные пластиковые стаканчики на 18 унций).
- Ножницы
- Перманентный маркер
- Две металлические кнопки
- Дистиллированная вода
- Пищевая сода
- Аккумулятор на девять вольт
- Две прозрачные соломинки (большой размер)
- Чайная ложка
- Медицинская капельница
- Таймер
- Бумажные полотенца
- Индикаторные полоски pH (дополнительно)
- Поваренная соль (хлорид натрия — NaCl) (по желанию)
- Ваша рабочая зона должна быть водонепроницаемой; разливы воды могут произойти во время деятельности.

- Соберите свой прочный механический графитовый карандаш. Убедитесь, что у вас есть два куска длиной около 2,5 см (один дюйм). Если вы решите использовать деревянный карандаш, попросите взрослого взять нож и извлечь из карандаша графитовый грифель. (Для этого у вас также должно получиться два куска длиной примерно 2,5 сантиметра). Это будут ваши графитовые электроды.
- Аккуратно отрежьте ножницами (или отрежьте взрослым) открытый конец одного пластикового стаканчика так, чтобы он был на высоте девятивольтовой батареи. В нижней части чашки прорежьте отверстие, чтобы кончик батареи (с двумя полюсами) мог пройти через него.
- Возьмите другую чашку и держите дно этой чашки поверх девятивольтовой батареи. Несмываемым маркером на внутренней стороне чашки нарисуйте две точки внизу, где чашка соприкасается с двумя полюсами батареи.
- Снимите чашку с батареи и с помощью чертежной кнопки проделайте по одному отверстию в каждой отмеченной точке на дне пластиковой чаши.

- Осторожно вставьте два графитовых штифта (карандашного стержня) в два отверстия, по одному в каждое. Возможно, вам придется сделать отверстия немного больше, чтобы они подходили.
- Используйте клей, чтобы сделать уплотнение вокруг графитовых штифтов на внешней стороне чашки и дайте ему высохнуть. Это должно предотвратить просачивание воды. Убедитесь, что графитовые контакты не все покрыты клеем, иначе они больше не будут контактировать с батареей.
- Поместите разрезанную чашку открытой стороной вниз на батарею. Дно чашки и аккумулятор должны совпадать, образуя ровную поверхность, на которую можно поставить другую чашку.
- Поместите чашку с графитовыми штифтами на перевернутую обрезанную чашку сверху батареи. Он должен сидеть там прочно, и каждый из графитовых штифтов должен касаться одного из полюсов батареи.
- Заклейте один конец обеих соломинок для питья пластилином Play-Doh или глиной.
- Возьмите чашку с графитовыми штифтами и налейте в чашку около 300 миллилитров дистиллированной воды подальше от батареи.
 Убедитесь, что он не протекает. Если это так, вам может понадобиться добавить немного клея, чтобы сделать плотное соединение. Примечание. Не прикасайтесь к воде или электродам после того, как чаша будет помещена на батарею, так как вы можете почувствовать покалывание электричества в пальцах.
Убедитесь, что он не протекает. Если это так, вам может понадобиться добавить немного клея, чтобы сделать плотное соединение. Примечание. Не прикасайтесь к воде или электродам после того, как чаша будет помещена на батарею, так как вы можете почувствовать покалывание электричества в пальцах. - Как и раньше, поместите его на перевернутую обрезанную чашку сверху батареи так, чтобы каждый из графитовых штифтов касался одного из полюсов батареи. Возможно, вам придется немного прижать его, чтобы установить хорошее соединение. Обратите внимание на два графитовых электрода. Что ты видишь? Что-то происходит на электродах?
- Снимите чашу с дистиллированной водой с аккумулятора. Насыпьте одну чайную ложку пищевой соды и размешайте ее в дистиллированной воде, пока все не растворится. Как вы думаете, что изменит пищевая сода? Какую функцию он выполняет?
- Теперь снова поставьте чашку на батарею и соедините графитовые электроды с полюсами батареи.
 Что вы сейчас наблюдаете? На графитовых штифтах ничего не происходит? Как вы думаете, что является продуктом реакции? Сравните реакции, происходящие на каждом из графитовых электродов. Вы видите разницу между обеими сторонами? Есть ли один графитовый электрод, на котором реакция выражена сильнее? К какому полюсу батареи подключен этот графитовый штифт, к положительному или отрицательному?
Что вы сейчас наблюдаете? На графитовых штифтах ничего не происходит? Как вы думаете, что является продуктом реакции? Сравните реакции, происходящие на каждом из графитовых электродов. Вы видите разницу между обеими сторонами? Есть ли один графитовый электрод, на котором реакция выражена сильнее? К какому полюсу батареи подключен этот графитовый штифт, к положительному или отрицательному? - Засуньте нос в чашку и понюхайте продукты реакции. Есть запах? Если да, то как он пахнет?
- Снова снимите чашку с батареи. С помощью пипетки наполните обе закупоренные большие соломинки раствором пищевой соды из чашки с графитовыми штифтами. Когда они наполнятся, закройте каждую одним пальцем и переверните вверх дном. Опустите их в чашку с раствором пищевой соды и осторожно поместите их поверх графитовых штифтов (по одной соломинке на каждую), чтобы соломинки оставались полностью заполненными раствором пищевой соды. Если соломинки не стоят вертикально, вы можете прислонить их к краю чашки.
 Как вы думаете, что будет с соломинкой?
Как вы думаете, что будет с соломинкой? - После того, как соломинки будут размещены поверх графитовых штифтов, поставьте чашку обратно на батарею. Оставьте его там на 10 минут и немного нажмите на чашку, чтобы убедиться, что электроды остаются подключенными и электродные реакции происходят непрерывно в течение всего этого времени. Обратите внимание на огромные соломинки, которые вы надеваете на графитовые булавки. Что происходит с водой, которую вы туда заливаете? Вы замечаете разницу между двумя уровнями воды в обеих соломинках? Какой из них выше, какой ниже; к каким полюсам батареи подключен каждый из них?
- По истечении 10 минут отметьте уровень воды в каждой соломинке несмываемым маркером. Насколько больше воды было вытеснено продуктами реакции на отрицательном полюсе по сравнению с положительным полюсом? Одинаковые, двойные или тройные?
- Дополнительно: Если у вас есть полоски pH, которые могут измерять кислотность или щелочность растворов, используйте их для измерения pH в каждой большой соломинке после того, как уровень воды упадет примерно на 50 процентов.
 Осторожно снимите большие соломинки с электродов и сразу же запечатайте каждую из них пальцем, как только вы оторвете ее от электродов. Убедитесь, что вы не потеряли воду, которая находится внутри, окуните тест-полоску pH внутрь. Какой цвет показывает тест-полоска и какое значение рН она представляет? Есть ли разница между растворами в двух соломинках? Чем они отличаются и почему, на ваш взгляд, это так?
Осторожно снимите большие соломинки с электродов и сразу же запечатайте каждую из них пальцем, как только вы оторвете ее от электродов. Убедитесь, что вы не потеряли воду, которая находится внутри, окуните тест-полоску pH внутрь. Какой цвет показывает тест-полоска и какое значение рН она представляет? Есть ли разница между растворами в двух соломинках? Чем они отличаются и почему, на ваш взгляд, это так? - Дополнительно: Повторите эксперимент, но вместо пищевой соды в дистиллированную воду добавьте чайную ложку поваренной соли (хлорида натрия или NaCl) и дайте электролизу поработать пять минут. Изменяются ли электродные реакции? Что можно сказать о запахе продуктов реакции; Вы можете разобрать определенный запах на этот раз? Как вы думаете, почему это так?
- Дополнительно: Замените графитовые электроды металлическими кнопками. Для этого вам может понадобиться свежая чашка. Вставьте кнопки в дно чашки так, чтобы они не касались друг друга, но так, чтобы каждая из них касалась одного из полюсов батареи, как только вы поместите чашку на батарею.
 При использовании кнопок клеевое уплотнение не требуется. Повторите исходную процедуру, но на этот раз добавьте в дистиллированную воду одну чайную ложку поваренной соли. Наблюдайте за электродными реакциями. Что будет на этот раз? Посмотрите внимательно на контакт, который подключен к положительному полюсу аккумулятора. Вы видите другие продукты реакции, кроме газа? Как вы думаете, что произошло? Как выглядят металлические кнопки после того, как вы их снова вытащите?
При использовании кнопок клеевое уплотнение не требуется. Повторите исходную процедуру, но на этот раз добавьте в дистиллированную воду одну чайную ложку поваренной соли. Наблюдайте за электродными реакциями. Что будет на этот раз? Посмотрите внимательно на контакт, который подключен к положительному полюсу аккумулятора. Вы видите другие продукты реакции, кроме газа? Как вы думаете, что произошло? Как выглядят металлические кнопки после того, как вы их снова вытащите? Все реагенты и продукты должны быть записаны с использованием их химических формул. Например H₂.
Количество атомов каждого элемента должно быть одинаковым в обеих частях уравнения. Чтобы сбалансировать количество атомов, их коэффициенты будут использоваться перед химическими формулами. Пример: 2Mg + O2 → 2MgO.
Реакции разложения используются для производства топлива и других химических веществ
Разложение метана на двуокись углерода и воду используется для производства угольного газа
Разложение этанола на этиленгликоль и воду используется для производства полиэфирных волокон
Разложение мочевины на аммиак и диоксид углерода используется при производстве удобрений
Разложение различных других органических соединений используется в производство пластмасс, лекарств и красителей.

Разложение используется для разложения опасных отходов
Реакции разложения используются для определения количества продукта в образце. реакции разложения используются для измерения уровня углекислого газа, образующегося при различных типах дыхания.
Разложение используется для проведения реакции разложения других химических соединений карбоната кальция (CaCO) соляной кислотой (HCl).
Разложение пищи играет важную роль в пищеварительной системе человека. расщепление белков, липидов и углеводов на аминокислоты, жирные кислоты и моносахариды обеспечивает организм питательными веществами, необходимыми ему для функционирования.
Изучите концепцию — важно изучить концепцию реакции разложения, потому что разложение является обычной реакцией в организме.
 Что поможет вам легче понять.
Что поможет вам легче понять.Изучение механизма реакции разложения. Механизм реакции разложения — хороший способ изучить реакцию разложения. реакции разложения также имеют множество применений, поэтому механизм реакции разложения поможет вам лучше понять разложение.
Знайте задачи на декомпозицию — попробуйте попрактиковаться в задачах на декомпозицию, потому что это также поможет вам лучше понять декомпозицию.
Читайте статьи о разложении — вы можете прочитать статьи, рассказывающие о том, как реакции разложения используются в разных областях и как они работают. Это будет лучший способ изучения реакций разложения.
Изучите примеры реакций разложения — также важно, чтобы вы изучили некоторые примеры реакций разложения, которые вы можете найти в Интернете, и изучите их.

77777777777777777777777777777777777777777777777777777777777777777777777777777777777777777777777777777777777777777777777777 Вы знаете, что воду можно разделить на два составных элемента, используя всего несколько предметов домашнего обихода? Посмотрите, из чего на самом деле состоит ваша вода, в этом занятии по разрушению молекул.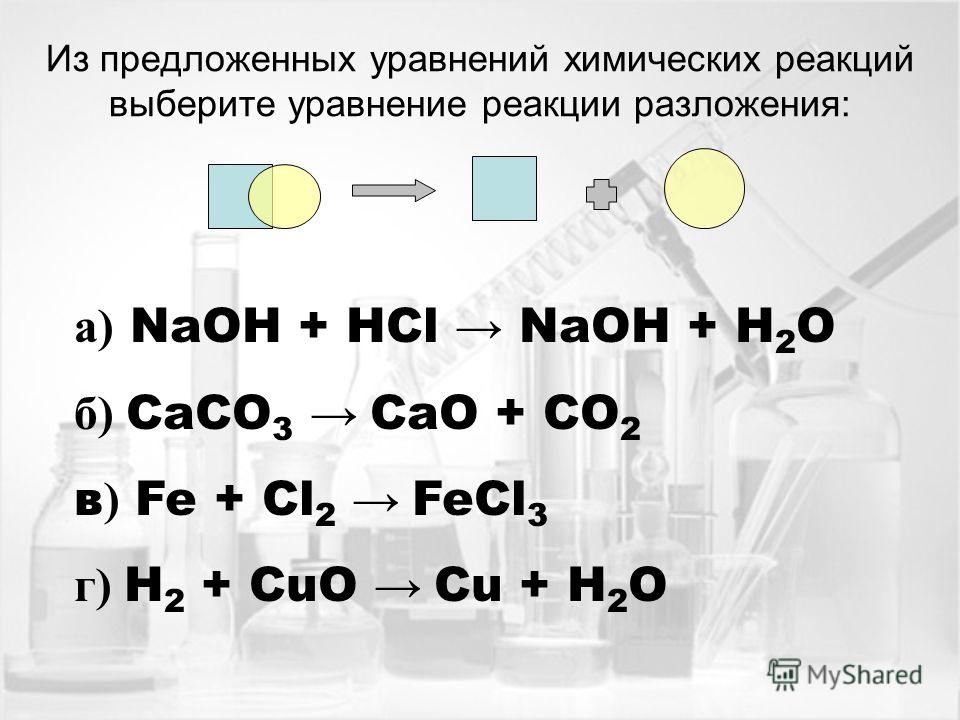 Все, что нужно, это немного сока! Кредит: Джордж Рецек
Все, что нужно, это немного сока! Кредит: Джордж Рецек
Ключевые понятия
Вода
Химия
Электричество
Молекулы
Введение
Пользуешься им каждый день и без него не выживешь — нет, это не интернет, а вода! Это одно из самых важных соединений в мире, и проблема становится все более важной во всем мире. Вы, наверное, слышали, что во многих местах засуха или загрязнение воды ограничивают запасы чистой питьевой воды, и эти запасы продолжают сокращаться. Размышляя об этом, задумывались ли вы когда-нибудь, почему мы не делаем воду сами? Из чего на самом деле состоит вода? В этой научной деятельности вы будете использовать энергию в виде электричества для расщепления воды на отдельные компоненты; так что соберите все материалы и приготовьтесь узнать, что это такое, — и разделите их сами!
Фон
Чтобы узнать, из чего состоит вода, полезно посмотреть на ее химическую формулу: h3O. Это в основном говорит нам о том, что молекула воды состоит из двух элементов: водорода и кислорода или, точнее, двух атомов водорода (h3) и одного атома кислорода (O). Водород и кислород являются газами при комнатной температуре. Значит ли это, что мы можем просто соединить оба газа и получить воду? Это не так просто. В уравнении отсутствует энергетическая составляющая химической реакции. Изготовление воды из ее элементов производит большое количество энергии. Химические реакции, в результате которых выделяется энергия, также называют экзотермическими реакциями. В случае водорода и кислорода выделяемая энергия настолько велика, что ее практически невозможно контролировать, и в большинстве случаев она приводит к взрыву. К счастью, эта реакция не происходит самопроизвольно, а происходит только при поджигании газовой смеси зажигалкой.
Водород и кислород являются газами при комнатной температуре. Значит ли это, что мы можем просто соединить оба газа и получить воду? Это не так просто. В уравнении отсутствует энергетическая составляющая химической реакции. Изготовление воды из ее элементов производит большое количество энергии. Химические реакции, в результате которых выделяется энергия, также называют экзотермическими реакциями. В случае водорода и кислорода выделяемая энергия настолько велика, что ее практически невозможно контролировать, и в большинстве случаев она приводит к взрыву. К счастью, эта реакция не происходит самопроизвольно, а происходит только при поджигании газовой смеси зажигалкой.
Если делать воду из ее элементов так опасно, то как насчет обратной реакции? Разделить воду на два компонента гораздо проще, и это называется электролизом воды. Получение водорода или кислорода таким способом кажется простым. Но, как вы, вероятно, подозревали, эта обратная реакция требует затрат энергии, поэтому ее также называют эндотермической реакцией. При электролизе воды источником энергии, используемой для протекания реакции, является электричество. Самый простой способ получения электричества — аккумулятор. Однако, поскольку чистая вода плохо проводит электричество, для электролиза требуется добавление электролита 9.0047, , такие как соль или кислота. Электролит растворяется в воде и разделяется на ионы (электрически заряженные частицы), которые перемещаются в растворах и таким образом могут проводить электричество. Чтобы добавить электричества в раствор, вам также понадобятся два электрических проводника, которые соприкасаются с водой. Они называются электродами и в основном представляют собой металлы или другие проводящие материалы. Когда на электроды подается электрический ток, ионы (электрически заряженные атомы) в электролите, включая положительно заряженные протоны (H + ) и отрицательно заряженные гидроксильные ионы (ОН — ), образующиеся в результате самоионизации воды, начинают двигаться к электроду с противоположным зарядом, где образуется либо водород, либо кислород.
При электролизе воды источником энергии, используемой для протекания реакции, является электричество. Самый простой способ получения электричества — аккумулятор. Однако, поскольку чистая вода плохо проводит электричество, для электролиза требуется добавление электролита 9.0047, , такие как соль или кислота. Электролит растворяется в воде и разделяется на ионы (электрически заряженные частицы), которые перемещаются в растворах и таким образом могут проводить электричество. Чтобы добавить электричества в раствор, вам также понадобятся два электрических проводника, которые соприкасаются с водой. Они называются электродами и в основном представляют собой металлы или другие проводящие материалы. Когда на электроды подается электрический ток, ионы (электрически заряженные атомы) в электролите, включая положительно заряженные протоны (H + ) и отрицательно заряженные гидроксильные ионы (ОН — ), образующиеся в результате самоионизации воды, начинают двигаться к электроду с противоположным зарядом, где образуется либо водород, либо кислород. Вы можете убедиться в этом сами в этом упражнении и даже зафиксировать оба газа!
Вы можете убедиться в этом сами в этом упражнении и даже зафиксировать оба газа!
Материалы
Подготовка
Процедура
Наблюдения и результаты
Удалось ли вам разделить воду на водород и кислород? Вы видели много пузырьков на обоих графитовых штифтах? Первоначально, когда вы ставили чашку с дистиллированной водой на аккумулятор, вы, вероятно, не видели, что происходит на графитовых электродах. Это связано с тем, что дистиллированная вода не очень хорошо проводит электричество, поэтому электродные реакции отсутствуют или возможны лишь незначительные реакции. Однако, если вы добавите электролиты, такие как пищевая сода, добавленные ионы могут проводить электричество, и вы должны были увидеть пузырьки газа, появляющиеся на обоих графитовых штифтах. С одной стороны, на положительном полюсе образуется кислород, тогда как на отрицательном полюсе образуется водород.
С одной стороны, на положительном полюсе образуется кислород, тогда как на отрицательном полюсе образуется водород.
Присмотревшись, вы могли заметить, что на графитовом электроде, соединенном с отрицательным полюсом батареи, образовалось больше газа, чем на другой стороне. Сбор двух газов с помощью гигантских соломинок, вероятно, продемонстрировал это еще лучше. Через 10 минут уровень воды на отрицательном полюсе должен был быть примерно вдвое меньше, чем на положительном полюсе, а это означает, что вы собрали примерно вдвое больше газообразного водорода по сравнению с кислородом. Разница связана с тем, что на одну молекулу воды приходится два атома водорода на один атом кислорода, как объяснялось выше. Это означает, что для образования одной молекулы кислорода (O2) требуется две молекулы воды (2 ч3О). Однако в то же время из двух молекул воды (2 ч3О) можно получить две молекулы водорода (2 ч3). В то время как на электродах образуются водород и кислород, остаточными продуктами реакции из воды являются протоны (H + на стороне кислорода) и ионы гидроксила (ОН — на стороне водорода). Вы можете визуализировать это, поместив полоску pH в растворы в больших соломинках над каждым электродом. Раствор в соломинке, помещенной поверх электрода отрицательного полюса батареи, должен иметь щелочной pH (7 или выше), тогда как другой раствор должен быть кислым (pH менее 7).
Вы можете визуализировать это, поместив полоску pH в растворы в больших соломинках над каждым электродом. Раствор в соломинке, помещенной поверх электрода отрицательного полюса батареи, должен иметь щелочной pH (7 или выше), тогда как другой раствор должен быть кислым (pH менее 7).
Могут происходить и другие электродные реакции, если в растворе есть ионы, конкурирующие с образованием водорода или кислорода. Возможно, вы заметили, что после того, как вы добавили соль (хлорид натрия) в электролит, он начал пахнуть, как в бассейне. Вместо кислорода на положительном полюсе батареи вырабатывается хлор, который также используется для дезинфекции воды в бассейне. Если вы использовали металлические кнопки в качестве электродов вместо графитовых штифтов, металл (обычно сталь или латунь) будет растворяться или подвергаться коррозии на положительном полюсе батареи, и вместо (или в дополнение) к выделению газа вы должны увидеть, что металлическая кнопка становится красно-коричневой. Это свидетельствует о том, что электролиз — это не только способ расщепления воды на компоненты, но и способ запуска других реакций, которые в противном случае не происходили бы самопроизвольно.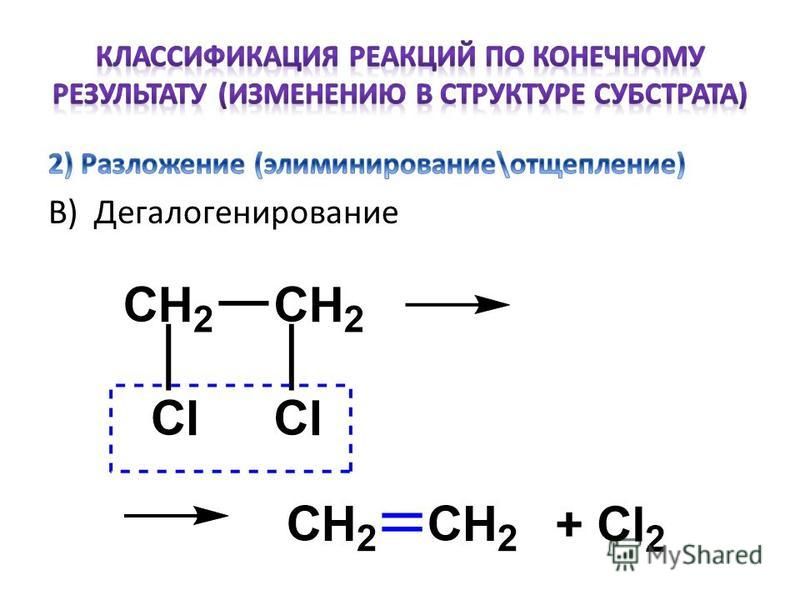
Очистка
Вытрите любые разливы полотенцем. Вылейте воду с электролитом (пищевой содой или солью) в канализацию. Выньте электроды (графитовые штифты или металлические кнопки) из чашек и выбросьте их в мусорное ведро. Выбросьте пластиковые стаканчики и запечатанные большие соломинки в мусорное ведро. Вы можете повторно использовать девятивольтовую батарею.
Еще для изучения
Почему мы не можем производить воду?, из книги «Как это работает»
Химия воды, из книги Джилл Грейнджер
«Электролиз воды — водород и кислород из воды», от «Альтернативное обучение»
«Топливные элементы — подпитка будущего!» от Science Buddies
Научная деятельность для всех возрастов!
ОБ АВТОРЕ(АХ)
Реакция разложения | Типы и классификация реакций разложения
Процесс, при котором химические вещества взаимодействуют друг с другом с образованием нового химического вещества с помощью различных составов, называется химическими реакциями, а также когда реагенты превращаются в продукты. Способы изменения состава элемента или соединения определяются химическими свойствами элемента или соединения.
Способы изменения состава элемента или соединения определяются химическими свойствами элемента или соединения.
Обычно химическая реакция представляется химическим уравнением, которое отражает переход от реагентов к продуктам. В химическом уравнении левая часть будет представлять реагенты, а правая часть будет представлять продукты реакции. Чтобы показать относительные количества реагентов и продуктов, участвующих в реакции, химическая реакция будет записана со стехиометрическими коэффициентами.
В химической реакции примечание в скобках о состоянии соединения будет дано для каждого соединения, т.е. для твердого вещества как (s), для жидкости как (l) и для газа как (g) и для водного раствора, в котором соединения растворяются в воде, будет использоваться символ (aq).
Форма химической реакции будет выглядеть следующим образом:
A (водн.) + B(g) → C(s) + D (водн.)
Здесь A и B реагируют вместе, образуя продукты C и D.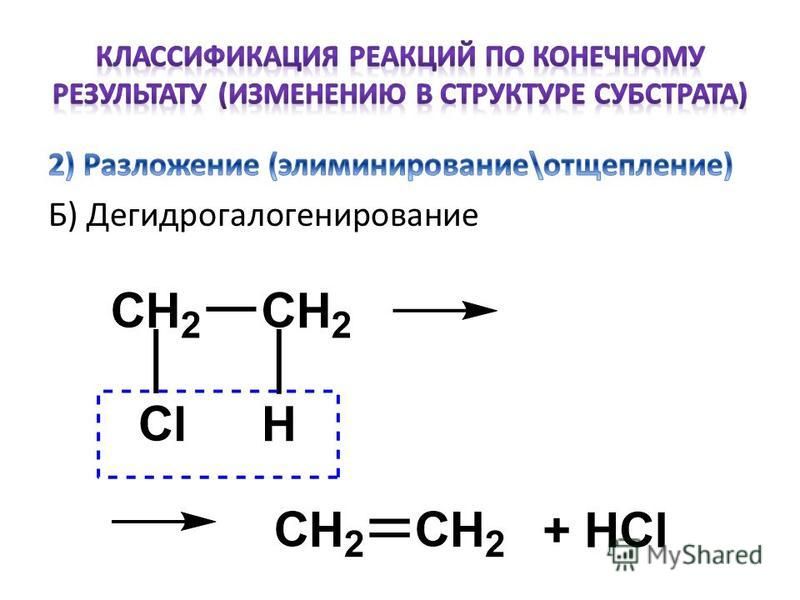
Чтобы получить точное химическое уравнение, должны присутствовать следующие вещи:
Осаждение или реакция двойного замещения
Осаждение – это реакция, происходящая при взаимодействии водных растворов катионов, являющихся положительно заряженными ионами, и анионов, являющихся отрицательно заряженными ионами. Осадок представляет собой нерастворимое твердое вещество, а оставшаяся жидкость представляет собой супернатант.
Кислотно-основная реакция или реакция нейтрализации
Реакция, происходящая при смешивании кислоты и основания, называется реакцией нейтрализации.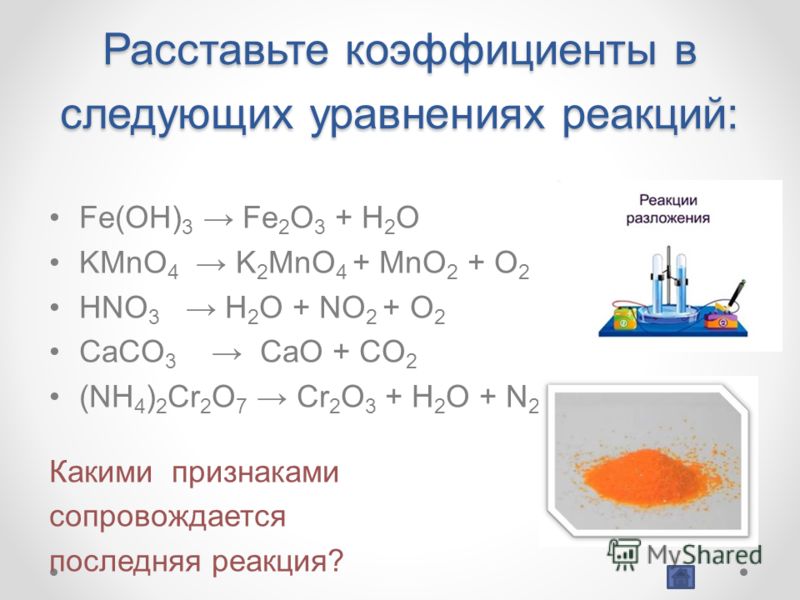 Ионы H+ производятся кислотным веществом, а ионы OH- образуются щелочным веществом.
Ионы H+ производятся кислотным веществом, а ионы OH- образуются щелочным веществом.
Соль и вода, являющиеся ионными соединениями, образуются в результате кислотно-щелочной реакции. Реакция между соляной кислотой и гидроксидом натрия является примером типичной кислотно-основной реакции.
Ниже приведено уравнение вышеупомянутой реакции:
HCl(водн.) + NaOH(водн.) → NaCl(водн.) + H₂O(л)
В упомянутой выше реакции HCl и NaOH являются кислотой и основанием веществ и солью является NaCl.
Окислительно-восстановительные или окислительно-восстановительные реакции
При изменении степени окисления атомов, участвующих в реакции, происходит окислительно-восстановительная реакция. Процесс, при котором степень окисления атома увеличивается, называется процессом окисления. Процесс, при котором степень окисления атома уменьшается, называется реакцией восстановления.
Реакция между газообразным водородом и газообразным фтором является примером окислительно-восстановительной реакции.
h3(г) + F2(г) → 2HF(г)
В вышеупомянутой реакции водород окисляется от степени окисления 0 до +1, поэтому он является восстановителем. При восстановлении от 0 до -1 фтор является окислителем.
Реакция горения
Тип окислительно-восстановительной реакции, во время которой топливо взаимодействует с окислителем с выделением энергии в виде тепла, называется реакцией горения. Такие реакции, при которых выделяется энергия, называются экзотермическими реакциями, а реакции, при которых происходит поглощение тепла, называются эндотермическими реакциями.
Ниже приведен пример реакции горения глюкозы.
C6h22O6 + 6O2 → 6CO2 + 6h3O
Реакции синтеза
Когда одно или несколько соединений объединяются вместе с образованием комплексного соединения, говорят, что происходит реакция синтеза.
Серебро в сочетании с газообразным кислородом с образованием оксида серебра является примером реакции синтеза.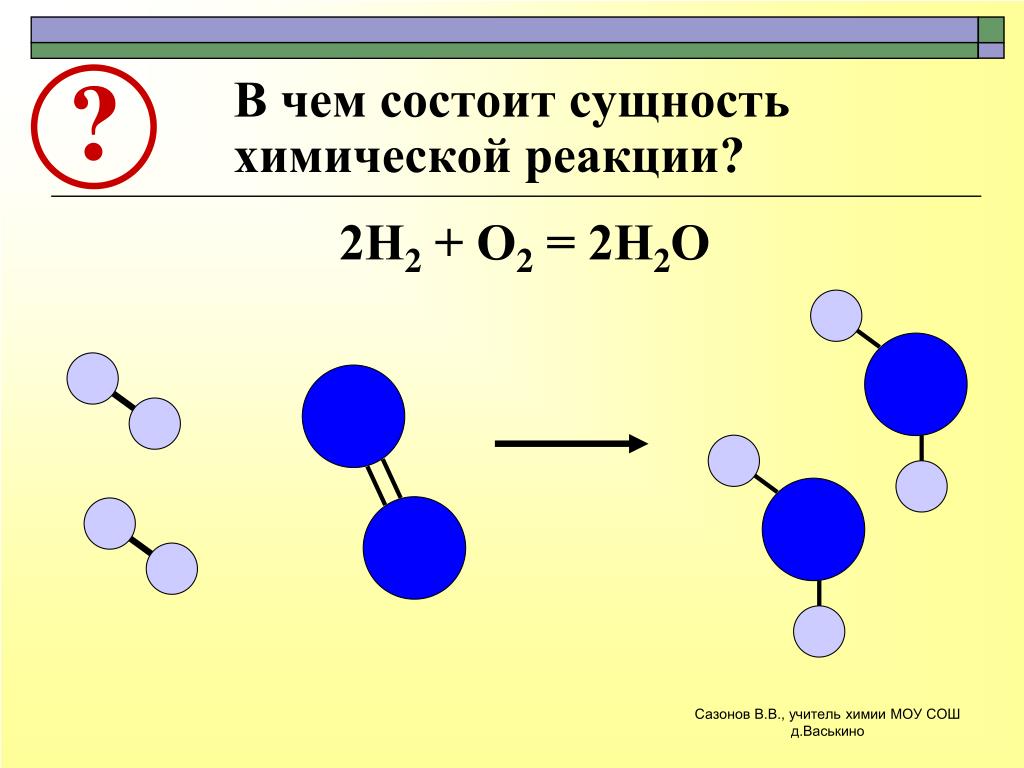
2Ag + O2 → 2AgO
Реакция разложения
Реакция, противоположная реакции синтеза, называется реакцией разложения. В процессе реакции разложения многие сложные соединения распадаются на множество более простых соединений.
Разделение вещества или материала на два или более веществ или материалов, которые могут отличаться друг от друга и от исходного или уникального вещества, называется реакцией разложения.
От нашей повседневной жизни до химической лаборатории реакция разложения происходит повсюду. Процесс пищеварения — это тип реакции разложения, при которой пища расщепляется с образованием воды, углекислого газа и тепла, поэтому это важный тип реакции.
Распространенным примером реакции разложения является переваривание пищи в нашем организме. Здесь пища, такая как белки, жиры, углеводы и т. д., будет разлагаться на ряд более простых и меньших единиц. Чтобы наше тело продолжало работать, происходит дальнейшая реакция, высвобождающая большое количество энергии.
Разложение пероксида водорода на кислород и газообразный водород является типичным примером реакции разложения.
H₂O₂ → H₂ + O₂
Классификация реакции разложения
Реакция термического соединения или термолиз – это разложение под действием тепла. Реакция электролитического разложения или электролиз – это разложение с помощью электричества. Реакция фоторазложения или фотолиз – это разложение под действием света.
Реакции разложения можно разделить на три типа. Они следующие:
1. Реакция термического разложения
Химическая реакция, при которой одно вещество распадается на два или более простых вещества при нагревании, называется реакцией термического разложения. Поскольку для разрыва связей в веществе требуется тепло, эта реакция обычно эндотермическая.
Реакция разложения карбоната кальция
Известняк или кальций при нагревании разлагается на негашеную известь или оксид кальция и диоксид углерода. Основным компонентом цемента является негашеная известь.
Основным компонентом цемента является негашеная известь.
Реакция разложения хлората калия
Хлорат калия при сильном нагревании разлагается на хлорид калия и кислород, и эта реакция используется для получения кислорода.
В присутствии двуокиси марганца, если проводить разложение, то оно будет происходить при более низкой температуре. В качестве катализатора в этой реакции используется диоксид марганца.
Реакция разложения нитрата свинца
Когда небольшое количество порошкообразного бесцветного нитрата свинца помещают в сухую пробирку и нагревают над горелкой, то можно наблюдать, что выделяются коричневые пары диоксида азота и желтый остаток оксида свинца. останется в трубе. Если горящую свечу положить на горлышко пробирки, она загорится и снова начнет гореть. Газообразный кислород также выделяется во время этой реакции, как показано здесь.
Реакция разложения гидратированной щавелевой кислоты
Разложение гидратированной щавелевой кислоты на щавелевую кислоту и воду происходит при нагревании.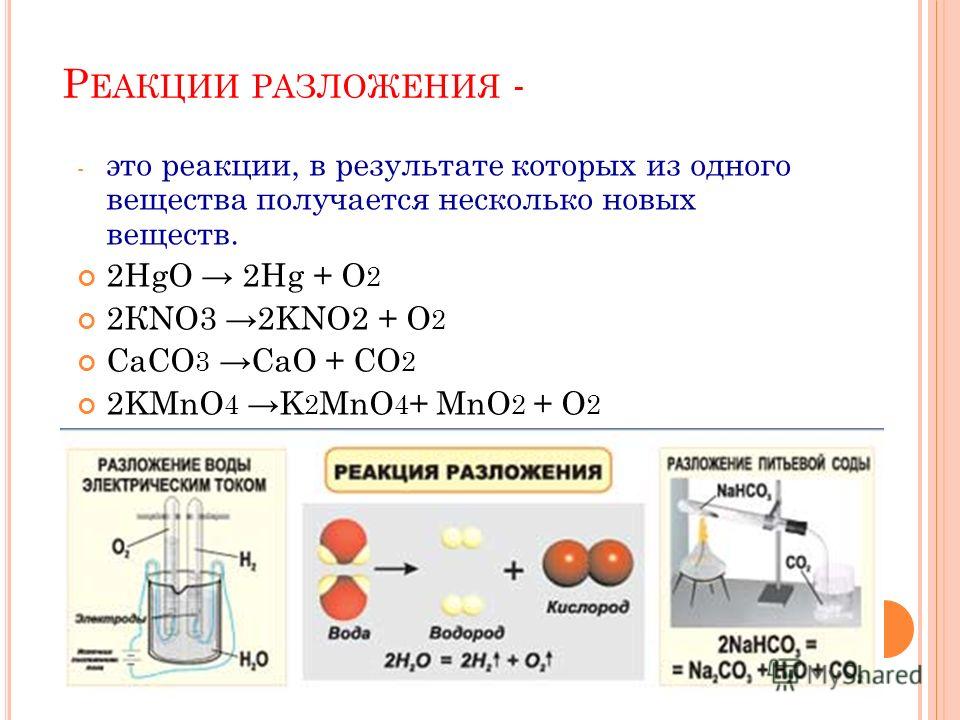
2. Реакция электролитического разложения:
Когда электрический ток пропускают через водный раствор соединения, это может привести к реакции электролитического разложения. Электролиз воды является хорошим примером реакции электролитического разложения.
Электролиз воды: Разложение воды на кислород и водород при прохождении через нее электрического тока называется электролизом воды.
Реакция разложения хлорида натрия
Когда электричество проходит через расплавленный хлорид натрия, он разлагается на натрий и хлор.
3. Фотореакция разложения или фотолиз
Реакция разложения хлорида серебра
цвет. Согласно анализу, разложение хлорида серебра на серебро и хлор вызвано солнечным светом.
Таким же образом разлагается бромид серебра.
Реакция разложения перекиси водорода
Разложение перекиси водорода на воду и кислород происходит в присутствии света.
Под действием света, тепла или электричества для большинства реакций разложения требуется энергия. Разрыв связей, присутствующих в реагирующем веществе, которое разлагается с образованием продукта, вызывается поглощением энергии.
Примеры реакций разложения:
При нагревании карбонаты разлагаются на оксиды металлов и углекислый газ.
CaCO₃ (т) → CaO (т) + CO₂ (г)
Na₂CO3 (т) → Na₂O (т) + CO₂ (г)
Разложение оксикислот приводит к образованию двуокиси углерода и воды.
H₂CO3 → H₂O (ж) + CO₂ (г)
Реакция двойного разложения
Реакция между двумя соединениями, в которой части каждого соединения заменяются местами с образованием двух новых соединений, называется реакцией двойного разложения. Реакция между двумя соединениями, при которой положительный ион одного соединения заменяется положительным ионом другого соединения, называется реакцией двойного замещения.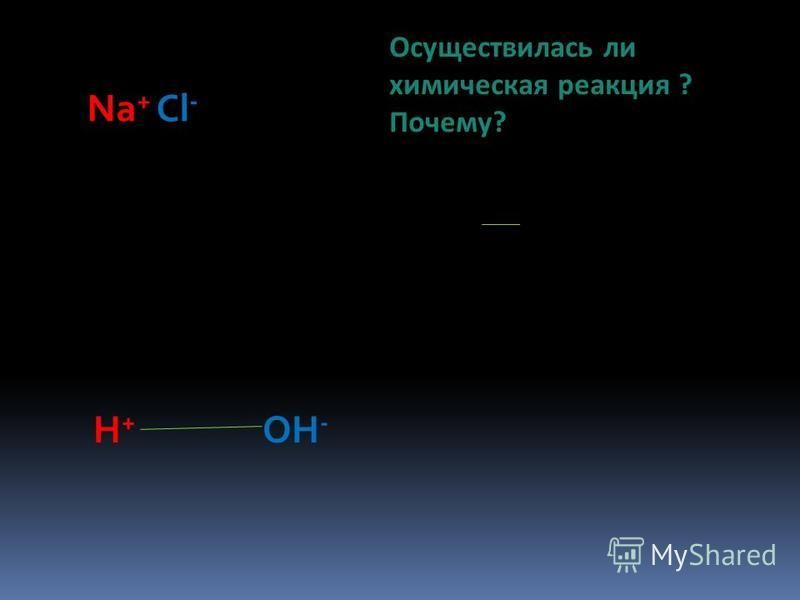
Использование реакции разложения
Для извлечения металлов реакции разложения используются следующими способами:
При электролитическом разложении металлы извлекаются из их расплавленных солей.
Пример: из природной руды цинка карбонат цинка сначала разлагается с образованием оксида цинка, а затем восстанавливается с получением металлического цинка.
Реакция разложения — это тип реакции, при которой связи разрываются и образуются новые. реакции разложения могут быть классифицированы как экзотермические или эндотермические, в зависимости от того, выделяют ли они или поглощают тепло во время реакции. реакции разложения также классифицируются по количеству необходимых стадий. разложение может быть одностадийным или многостадийным процессом, в зависимости от того, требуется ли для его завершения одна или несколько отдельных реакций.
Разложение экзотермическое | разлагается на два более простых продукта, которые имеют более низкое содержание энергии в молекуле из-за выделения тепла во время этого типа реакции разложения Пример реакции: Металлический натрий реагирует с водным раствором гидроксида натрия с выделением газообразного водорода и эндотермическим разложением гидроксида натрия | разлагается на два более простых продукта, которые имеют более высокое содержание энергии в молекуле из-за поглощения тепла во время этого типа реакции разложения Пример реакции: Кристаллы нитрата аммония реагируют с водой с образованием водного раствора аммиака, газообразного кислорода и гидроксида аммония.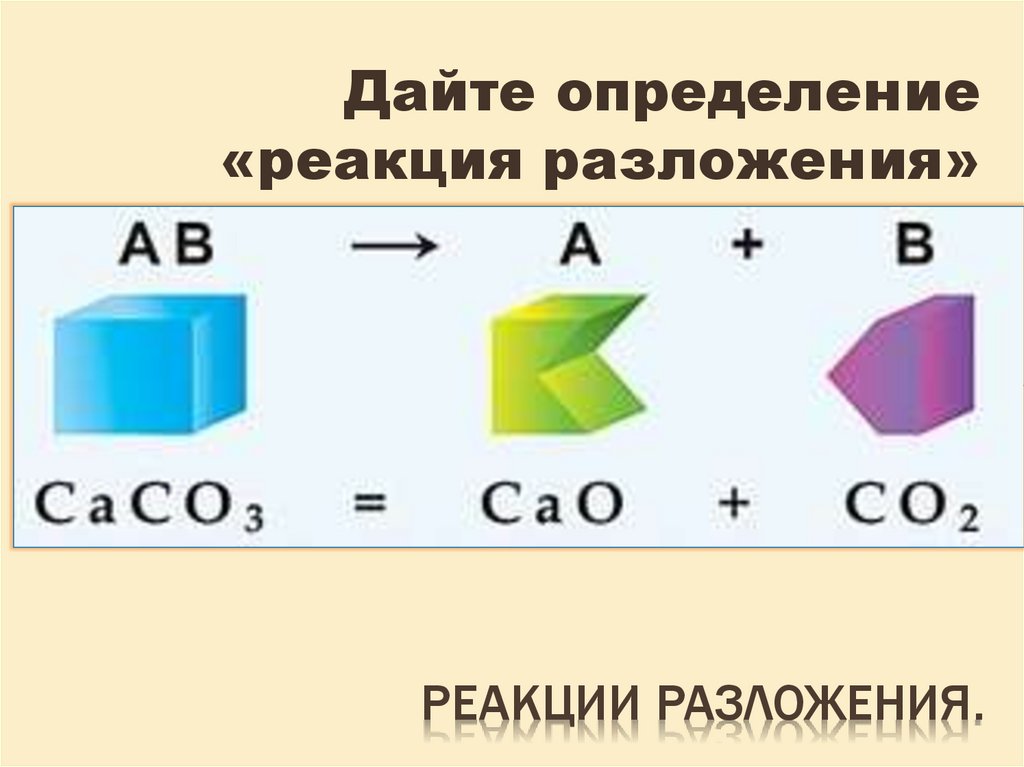
Одноэтапное разложение | разложение одного соединения путем разрыва его связей через одну индивидуальную стадию реакции. Это происходит, когда существует только одно химическое уравнение или результирующее ионное уравнение для каждого чистого элемента, участвующего в фазовом переходе.



 Убедитесь, что он не протекает. Если это так, вам может понадобиться добавить немного клея, чтобы сделать плотное соединение. Примечание. Не прикасайтесь к воде или электродам после того, как чаша будет помещена на батарею, так как вы можете почувствовать покалывание электричества в пальцах.
Убедитесь, что он не протекает. Если это так, вам может понадобиться добавить немного клея, чтобы сделать плотное соединение. Примечание. Не прикасайтесь к воде или электродам после того, как чаша будет помещена на батарею, так как вы можете почувствовать покалывание электричества в пальцах.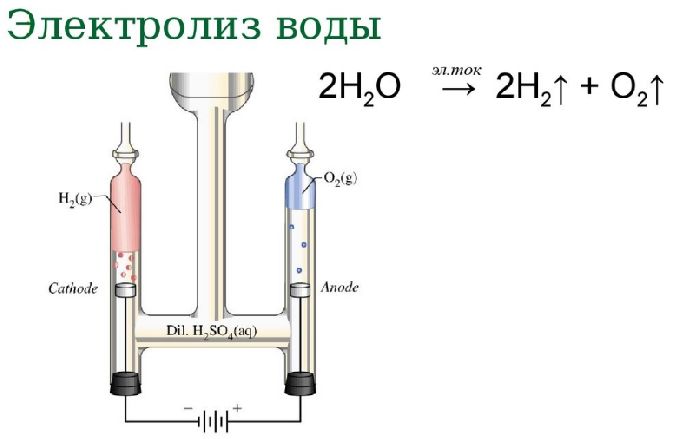 Что вы сейчас наблюдаете? На графитовых штифтах ничего не происходит? Как вы думаете, что является продуктом реакции? Сравните реакции, происходящие на каждом из графитовых электродов. Вы видите разницу между обеими сторонами? Есть ли один графитовый электрод, на котором реакция выражена сильнее? К какому полюсу батареи подключен этот графитовый штифт, к положительному или отрицательному?
Что вы сейчас наблюдаете? На графитовых штифтах ничего не происходит? Как вы думаете, что является продуктом реакции? Сравните реакции, происходящие на каждом из графитовых электродов. Вы видите разницу между обеими сторонами? Есть ли один графитовый электрод, на котором реакция выражена сильнее? К какому полюсу батареи подключен этот графитовый штифт, к положительному или отрицательному?  Как вы думаете, что будет с соломинкой?
Как вы думаете, что будет с соломинкой? 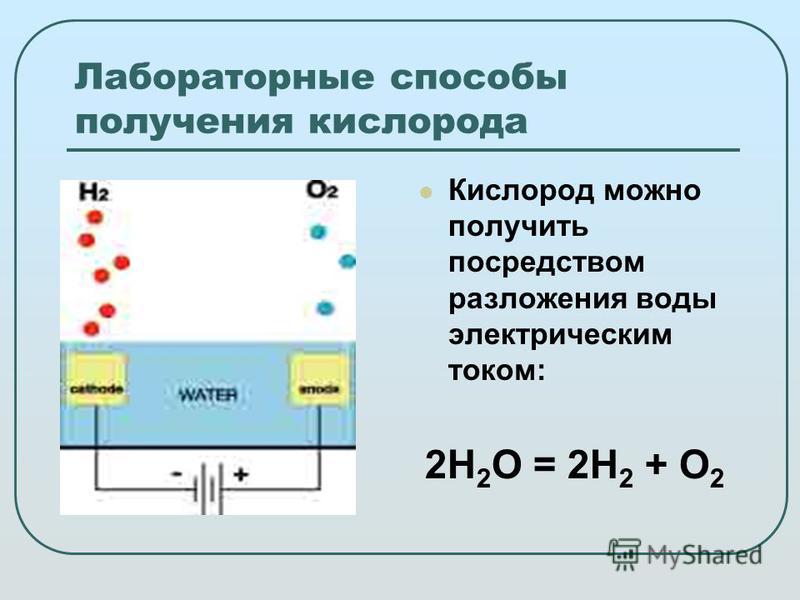 Осторожно снимите большие соломинки с электродов и сразу же запечатайте каждую из них пальцем, как только вы оторвете ее от электродов. Убедитесь, что вы не потеряли воду, которая находится внутри, окуните тест-полоску pH внутрь. Какой цвет показывает тест-полоска и какое значение рН она представляет? Есть ли разница между растворами в двух соломинках? Чем они отличаются и почему, на ваш взгляд, это так?
Осторожно снимите большие соломинки с электродов и сразу же запечатайте каждую из них пальцем, как только вы оторвете ее от электродов. Убедитесь, что вы не потеряли воду, которая находится внутри, окуните тест-полоску pH внутрь. Какой цвет показывает тест-полоска и какое значение рН она представляет? Есть ли разница между растворами в двух соломинках? Чем они отличаются и почему, на ваш взгляд, это так?  При использовании кнопок клеевое уплотнение не требуется. Повторите исходную процедуру, но на этот раз добавьте в дистиллированную воду одну чайную ложку поваренной соли. Наблюдайте за электродными реакциями. Что будет на этот раз? Посмотрите внимательно на контакт, который подключен к положительному полюсу аккумулятора. Вы видите другие продукты реакции, кроме газа? Как вы думаете, что произошло? Как выглядят металлические кнопки после того, как вы их снова вытащите?
При использовании кнопок клеевое уплотнение не требуется. Повторите исходную процедуру, но на этот раз добавьте в дистиллированную воду одну чайную ложку поваренной соли. Наблюдайте за электродными реакциями. Что будет на этот раз? Посмотрите внимательно на контакт, который подключен к положительному полюсу аккумулятора. Вы видите другие продукты реакции, кроме газа? Как вы думаете, что произошло? Как выглядят металлические кнопки после того, как вы их снова вытащите?