Содержание
6.4 Взаимодействие металлов с водой, кислотами и щелочами
Важным
практическим вопросом является
устойчивость металлов в воде и в водных
растворах кислот и оснований. Возможность
протекания данных окислительно-восстановительных
реакций в большинстве случаев согласуется
с положением металлов в электрохимическом
ряду.
С
водой
взаимодействуют металлы от лития до
железа включительно.
Щелочные и щелочноземельные металлы
энергично вытесняют водород из воды.
Железо реагирует при температуре
красного каления (500 оС)
с образованием Fе3О4.
Например:
1)
2К + 2Н2О
= Н2
+ 2КОН,
2)
6Fe
+ 8Н2О
= 8Н2
+ 2Fe3О4.
Ряд
активных металлов Аl,
Zn,
Ве и др. непосредственно с водой не
реагируют из-за наличия на их поверхности
защитной оксидной пленки.
С
соляной
и серной (разбавленной) кислотами
реагируют все металлы, расположенные
в электрохимическом ряду до водорода.
Например:
1)
Fe
+2НСl
= Н2
+ FeСl2,
2)
2Аl
+ 3Н2SO4
= 3Н2 +
Аl2(SO4)3.
В
случае образования на поверхности
металлов нерастворимых в воде соединений
(PbSО4
и др.) реакции практически не протекают.
С
серной
концентрированной и азотной кислотами
реагируют все металлы за исключением
золота и большинства металлов платиновой
группы.
Например:
1)
2Fe + 6Н2SO4(конц.)
= Fe2(SO4)3+
3SO2
+6Н2О,
2)
3Сu
+ 8НNO3(разб.)
= 3Сu(NO3)2
+ 2NO
+ 4Н2О,
3)
Сu
+ 4НNO3(конц.)
= Сu(NO3)2
+ 2NO2
+ 2Н2О.
Наиболее
вероятные продукты восстановления
серной и азотной кислот металлами
приведены в таблице 6. 1.
1.
Таблице
6.1 – Продукты взаимодействия металлов
с HNO3
и H2SO4
Кислоты | Положение | ||
от | от | от | |
HNO3разб. | NH4NO3 | NO, | NO |
HNO3конц. | N2O | NO2, | NO2 |
H2SO4разб. | H2, | H2 | не |
H2SO4конц. | S, | SO2, | SO2 |
Из
приведенной схемы видно, что в случае
азотной кислоты, чем активней металл и
более разбавлена кислота, тем в большей
степени происходит восстановление
азота.
В
очень концентрированных кислотах многие
металлы «пассивируются» из-за образования
на их поверхности нерастворимых
соединений.
В
водных
растворах щелочей
растворятся алюминий, цинк и другие
амфотерные металлы.
Например:
2Аl
+ 2NаOН
+ 6Н2О
= 2Nа[Аl(ОН)4]
+ 3Н2.
7 Гальванические элементы
Гальванические
элементы
– это
устройства для превращения энергии
химической окислительно-восстановительной
реакции непосредственно в электрическую
энергию.
В
ходе окислительно-восстановительных
реакций происходит переход электронов
непосредственно от восстановителя к
окислителю. В случае гальванического
элемента процессы окисления и
восстановления разделены и переход
электронов осуществляется по проводнику
первого рода, что позволяет энергию
химической реакции превратить
непосредственно в электрическую энергию.
7.1 Принцип работы гальванического элемента
В
основе работы гальванического элемента
лежит явление возникновения электродного
потенциала на границе металл –раствор.
Металлы
– это вещества,
в узлах кристаллической решетки которых
находятся катионы,
а в межатомном пространстве свободные
электроны (электронный газ). При
При
контакте металлов с водой в результате
взаимодействия катионов металла (Men+)
с полярными молекулами воды часть ионов
металла перейдет в раствор в виде
гидратов (Men+·nH2O),
а электроны останутся на металле, т.е.
раствор будет иметь положительный
заряд, а металл –
отрицательный. Таким
образом, на границе металл–раствор
образуется двойной
электрический слой.
В результате образования двойного
электрического слоя на границе
металл–раствор возникает скачок
потенциала, который называют электродным
потенциалом и обозначают φ.
Принцип
работы гальванического элемента разберем
на примере работы элемента, составленного
из цинкового и медного электродов,
опущенных в 1М растворы своих солей,
схема которого приведена на рисунке
7.1.
Цинковый
и медный электроды соединены проводником
первого
рода (металл), а растворы электролитов
– электролитическим мостиком. В
гальваническом элементе различают
внешнюю цепь – проводник первого
рода и внутреннюю цепь – проводник
второго рода (раствор электролита). Во
Во
внешнюю цепь включен гальванометр.
Рисунок
7.1 – Схема гальванического элемента
Дениеля-Якоби
Цинковый
электрод в сравнении с медным имеет
более низкое значение электродного
потенциала. После соединения данных
электродов возникает электродвижущая
сила (ЭДС), которая приводит к переходу
электронов с цинкового электрода на
медный. Таким образом, цинковый электрод
является анодом, а медный – катодом.
Переход электронов приводит к изменению
электродных потенциалов на электродах
и для восстановления их значений будет
происходить частичное окисление Zn
и восстановление Cu+2.
Накапливающиеся в анодном участке
Zn+2,
а в катодном нескомпенсированные SО4–2
через электролитический мостик будут
взаимодействовать с образованием ZnSО4.
Электрическая цепь замкнута, поэтому
гальванический элемент будет работать
до полного окисления цинкового электрода
или восстановления всех ионов меди.
На
примере данного элемента покажем
схематическую форму записи гальванического
элемента и напишем реакции, протекающие
на электродах и
во
внутренней цепи.
Схема
гальванического элемента: (А) Zn
| ZnSО4
|| CuSО4
| Cu
(К).
Реакции
на аноде и катоде:
А)
Zn
– 2е = Zn2+,
К)
Cu2+
+ 2е = Cu.
Реакция,
обеспечивающая проводимость во внутренней
цепи:
Zn2+
+ SО42–
= ZnSО4.
Суммарная
реакция, протекающая в ходе работы
гальванического элемента, имеет вид
Zn
+ CuSО4
= Cu
+ ZnSО4.
Электродвижущая
сила гальванического элемента (ЭДС)
равна разности электродных потенциалов
двух полуэлементов:
E
= φ0(Cu2+/Cu)
–
φ0(Zn2+/Zn)
= +0,34 – (–0,76) = 1,1 В.
В
общем виде – это разность потенциалов
катодного и анодного процессов:
Eгальван. | (7.1) |
Взаимодействие металлов с водой, щелочами, кислотами, солями, простыми веществами
Похожие презентации:
Сложные эфиры. Жиры
Физические, химические свойства предельных и непредельных карбоновых кислот, получение
Газовая хроматография
Хроматографические методы анализа
Искусственные алмазы
Титриметрические методы анализа
Биохимия гормонов
Антисептики и дезинфицирующие средства. (Лекция 6)
Клиническая фармакология антибактериальных препаратов
Биохимия соединительной ткани
Взаимодействие металлов
с водой, щелочами,
кислотами, солями,
простыми веществами
Лабораторная работ
теория
2.
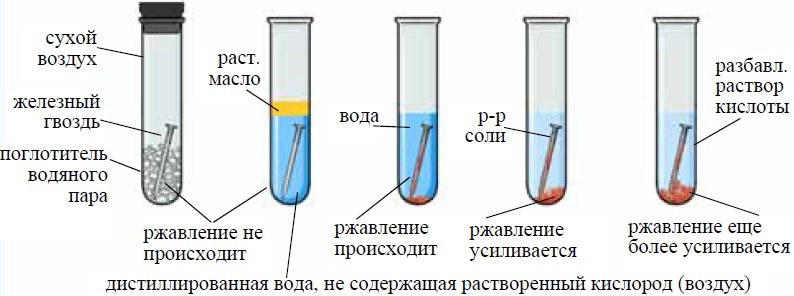 Химические свойства металлов
Химические свойства металлов
Цель работы: Изучение химических свойств металлов.
Теоретическая часть Свободные металлы являются восстановителями. Их
восстановительная способность меняется в широких пределах и служит мерой
химической активности. За меру химической активности металла принимается
его способность переходить в состояние положительно заряженного иона, теряя
при этом электроны.
Русский ученый Н.Н. Бекетов расположил все металлы в порядке уменьшения их
активности. Полученный ряд был назван «вытеснительным рядом», теперь он
известен как ряд активности металлов.
Li>K>Ba>Ca>Na>Mg>Be>Al>Zn>Cr>Fe>Cd>Bi>Sn>Pb>H>Sb>Bi>Cu>Hg>Ag>Pt>Au
Металлы, расположенные в ряду активностей левее цинка, считаются активными.
Металлы, начиная с цинка и до водорода, считаются средней активности.
Металлы, стоящие после водорода, являются малоактивными.
3. Взаимодействие металлов с водой
• Активные металлы (щелочные и щелочноземельные) разлагают воду с
вытеснением водорода при комнат. температуре, образуя гидроксиды:
температуре, образуя гидроксиды:
2Na+2h3O=2NaOH+h3
• Менее активные металлы (до Fe включительно, так как ϕ Fe <0,41 В) вступают
в реакцию с водой при нагревании, образуя оксиды:
Zn+h3O=ZnO+h3
Mg и Al — сначала зачистить, убрать
оксидную пленку и кипящая вода
• Неактивные металлы с водой не реагируют
Взаимодействие металлов с щелочами
Со щелочами могут взаимодействовать только амфотерные металлы (Ве, Zn,
Al). В этом случае металлы образуют анионы своих кислот или гидроксокомплексы.
2Al+ 2NaОН(р-р) +2Н2О = 2NaAlО2+3Н2 (при нагревании)
Zn+ 2NaОН(тв) = Na2ZnО2+Н2
(при сплавлении)
2Al+6NaОН(р-р) +6Н2О = 2Na3[Al(OH)6] +3Н2 (комнатн.)
4. Взаимодействие металлов с кислотами
Реакция металлов с кислотами зависит от активности металла и конц. кислоты.
• С галогеноводородными кислотами разной конц-ции (HCl, HBr), а также с
разбавленной h3SO4 реагируют только металлы, стоящие левее водорода.
Окислителем являются ионы Н+, они вытесняются из кислоты металлом.
• В концентрированном растворе h3SO4 окислителем выступают атомы серы
со степенью окисления +6. Металлы малой активности восстанавливают
серную кислоту до диоксида серы SO2, среднеактивные металлы – до
атомарной S, а более активные – до h3S.
h3SO4 (конц.) пассивирует на холоде Fe и Al. Пассивацией металла называется его энергичное
окисление концентрированной кислотой, в результате чего поверхность металла покрывается
плотной пленкой оксида, предохраняющей металл от дальнейшего окисления.
• В растворе HNO3 любой концентрации окислителем являются атомы азота
со степенью окисления +5. Продукты восстановления HNO3 металлом
зависят от концентрации кислоты и активности металла.
HNO3 (конц.) при обычной температуре пассивирует более широкий спектр металлов:
Fe, Al, Ni , Cr , Co, Mn. Но при нагревании реакция идет.
• В разбавл. кислотах образуется Fe (+2), а в конц. кислотах образуется Fe (+3)
• В конц. кислотах металлы переменной валентности окисляются до высшей
степени окисления. Если ст. о. ≥ +4 , то образуется не соль, а кислота или оксид.
Если ст. о. ≥ +4 , то образуется не соль, а кислота или оксид.
English
Русский
Правила
Реакция металлов с водой Класс 10 Наука
Различные металлы реагируют с водой с разной скоростью. Большинство металлов не реагируют с водой. Однако щелочные металлы бурно реагируют с водой.
Реакция натрия с водой
Реакция между натрием и водой протекает очень энергично. При взаимодействии натрия с водой образуются гидроксид натрия и водород. Эта реакция сильно экзотермична. В ходе реакции выделяется столько тепла, что реакционная смесь загорается. Следующее уравнение показывает эту реакцию.
Na + H 2 O ⇨ NaOH + H 2
Поскольку натрий обладает высокой реакционной способностью, его хранят под керосином, чтобы он не вступал в реакцию с влагой, которая может присутствовать в воздух. Это сделано для того, чтобы предотвратить случайное возгорание.
Реакция калия с водой
Когда калий реагирует с водой, образуются гидроксид калия и газообразный водород. В ходе этой реакции выделяется много тепла. Следующее уравнение показывает эту реакцию.
В ходе этой реакции выделяется много тепла. Следующее уравнение показывает эту реакцию.
K + H 2 O ⇨ KOH + H 2
Реакция кальция с водой
При взаимодействии кальция с водой образуются гидроксид кальция и газообразный водород. Это тоже экзотермическая реакция. Когда пузырьки газообразного водорода прилипают к металлу, кальций начинает плавать. Следующее уравнение показывает эту реакцию.
Ca + 2H 2 O ⇨ Ca(OH) 2 + H 2
Реакция магния с водой
Магний не реагирует с холодной водой. Он реагирует с горячей водой и образует гидроксид магния и газообразный водород. Магний начинает плавать из-за прилипших к мясу пузырьков водорода. Следующее уравнение показывает эту реакцию.
Mg + 2H 2 O ⇨ Mg(OH) 2 + H 2
Изображение Ref: NCERT Учебник, класс 10, магний, реакция становится быстрой. В этой реакции образуются оксид магния и газообразный водород.
Mg + H 2 O ⇨ MgO + H 2
Реакция алюминия с водой
Алюминий не реагирует с холодной или горячей водой. Но когда пар проходит над алюминием, образуется оксид алюминия и газообразный водород. Следующее уравнение показывает эту реакцию.
2Al + 3H 2 O ⇨ Al 2 O 3 + 2H 2
Реакция цинка с водой или холодной водой не реагирует
25 Zin 90 Металлический цинк образует оксид цинка и газообразный водород, когда над ним пропускают пар.
Zn + H 2 O ⇨ ZnO + H 2
Реакция железа с водой
Реакция железа с холодной водой слишком медленная, чтобы ее можно было заметить. При взаимодействии железа с атмосферной влагой образуется ржавчина (оксид железа). Но это очень медленная реакция.
При пропускании пара над железом образуются оксид железа и газообразный водород. Следующее уравнение показывает это.
3Fe + 4H 2 O ⇨ Fe 3 O 4 + 4H 2
Свинец, медь, серебро и золото не реагируют с водой при любой температуре.
Реакцию воды с металлами можно обобщить следующим образом:
- Реакция воды с натрием и калием сильно экзотермична, и реакционная смесь загорается.
- Реакция между водой и кальцием экзотермическая, но реакционная смесь не загорается.
- Магний не реагирует с холодной водой, но реагирует с горячей водой.
- Алюминий, железо и цинк не реагируют с холодной или горячей водой, но реагируют с паром.
- Некоторые металлы вообще не реагируют с водой, напр. свинец, медь, серебро и золото.
- Предыдущий
- Физические свойства
- Реакция с водой
- Реакция с кислотой
- Серия реактивности
- Неметаллы
- Реакция между металлами и неметаллами
- Ионные связи
- Добыча: металлы
- Металлы с низкой реакционной способностью
- Металлы с высокой реакционной способностью
- Решение NCERT
- Образцовые решения
- Викторина
- Следующий
Кулоновский взрыв на ранних стадиях реакции щелочных металлов с водой
Хаттон А.
 Т. Эффектная демонстрация для широкой аудитории – образование гидроксильных ионов при реакции натрия с водой. J. Chem. Образовательный 58 , 506 (1981).
Т. Эффектная демонстрация для широкой аудитории – образование гидроксильных ионов при реакции натрия с водой. J. Chem. Образовательный 58 , 506 (1981).Артикул
КАСGoogle ученый
Карневали, С., Пруст, К. и Сусиль, М. Нестационарные аспекты реакции натрий-вода-воздух. Хим. англ. Рез. Дизайн 91 , 633–639 (2013).
Артикул
КАСGoogle ученый
Krebs, R. E. История и использование химических элементов нашей Земли (Гринвуд Пресс, 2006).
Google ученый
Коммандер, Дж. К. Анализ взрывоопасности эвтектического раствора NaK и KO2. Нукл. науч. Тезисы 32 , 21922 (1975).
Google ученый
Мукасян А.С., Хина Б.
 Б., Ривз Р.В., Сон С.Ф. Механическая активация и безгазовый взрыв: наноструктурные аспекты. Хим. англ. J. 174 , 677–686 (2011).
Б., Ривз Р.В., Сон С.Ф. Механическая активация и безгазовый взрыв: наноструктурные аспекты. Хим. англ. J. 174 , 677–686 (2011).Артикул
КАСGoogle ученый
Бернардин, Дж. Д. и Мудавар, И. Модель активации полости и роста пузырей в точке Лейденфрост. J. Heat Transfer 124 , 864–874 (2002).
Артикул
КАСGoogle ученый
Грубельник А., Мейер В. Р., Бютцер П. и Шёненбергер У. В. Металлический калий взрывоопасен – не используйте его! J. Chem. Образовательный 85 , 634 (2008).
Артикул
КАСGoogle ученый
Алчагиров Б.Б. и др. Поверхностное натяжение и адсорбция компонентов в системах натрий-калиевый сплав: эффективные жидкометаллические теплоносители, перспективные в атомной и космической энергетике.
 Неорг. Матер. заявл. Рез. 2 , 461–467 (2011).
Неорг. Матер. заявл. Рез. 2 , 461–467 (2011).Артикул
Google ученый
Бьюкенен Д. Дж. и Даллфорк Т. А. Механизм паровых взрывов. Природа 245 , 32–34 (1973).
Артикул
КАСGoogle ученый
Гибсон Г.Э. и Арго В.Л. Спектры поглощения голубых растворов некоторых щелочных и щелочноземельных металлов в жидком аммиаке и метиламине. Дж. Ам. хим. соц. 40 , 1327–1361 (1918).
Артикул
Google ученый
Харт, Э. Дж. Исследовательские потенциалы гидратированного электрона. Согл. хим. Рез. 2 , 161–167 (1969).
Артикул
КАСGoogle ученый
Кристенсен Х. и Сехестед К. Гидратированный электрон и его реакции при высоких температурах.
 J. Phys. хим. 90 , 186–190 (1986).
J. Phys. хим. 90 , 186–190 (1986).Артикул
КАСGoogle ученый
Вилчиз, В. Х., Клёпфер, Дж. А., Жермен, А. С., Ленченков, В. А. и Брэдфорт, С. Э. Карта динамики релаксации горячих фотоэлектронов, инжектированных в жидкую воду посредством порогового фотоотрыва анионов и надпороговой ионизации растворителя. J. Phys. хим. А 105 , 1711–1723 (2001 г.).
Артикул
КАСGoogle ученый
Элкинс, М. Х., Уильямс, Х. Л., Шрив, А. Т. и Ноймарк, Д. М. Механизм релаксации гидратированного электрона. Наука 342 , 1496–1499 (2013).
Артикул
КАСGoogle ученый
Манди, С. Дж., Хаттер, Дж. и Парринелло, М. Микросольватация и химическая реактивность кластеров натрия и воды. Дж. Ам. хим. Соц .
 122 , 4837–4838 (2000).
122 , 4837–4838 (2000).Артикул
КАСGoogle ученый
Меркури, Ф., Манди, С.Дж. и Парринелло, М. Формирование реакционноспособного промежуточного соединения в молекулярно-лучевой химии натрия и воды. J. Phys. хим. А 105 , 8423–8427 (2001 г.).
Артикул
КАСGoogle ученый
де ла Мора, Дж. Ф. Об исходе кулоновского деления заряженной изолированной капли. J. Коллоидный интерфейс Sci . 178 , 209–218 (1996).
Артикул
КАСGoogle ученый
Дафт Д., Ахтцен Т., Мюллер Р., Хубер Б. А. и Лейснер Т. Кулоновское деление – рэлеевские струи левитирующих микрокапель. Природа 421 , 128–128 (2003).
Артикул
КАСGoogle ученый
Эхт О.
 , Шайер П. и Марк Т. Д. Многозарядные кластеры. C. R. Phys. 3 , 353–364 (2002).
, Шайер П. и Марк Т. Д. Многозарядные кластеры. C. R. Phys. 3 , 353–364 (2002).Артикул
КАСGoogle ученый
Ласт, И., Леви, Ю. и Йортнер, Дж. За пределом неустойчивости Рэлея для многозарядных конечных систем: от деления до кулоновского взрыва. Проц. Натл акад. науч. США 99 , 9107–9112 (2002 г.).
Артикул
КАСGoogle ученый
Рэлей Л. О равновесии жидких проводящих масс, заряженных электричеством. Фил. Маг. 14 , 184–186 (1882).
Артикул
Google ученый
Лебедев Р. В. Измерение межфазного поверхностного натяжения натрий-калиевых сплавов. Изв. Вус. Физ. 15 , 155–158 (1972).
КАС
Google ученый
Ю.
 М. и Тринкл Д. Р. Точный и эффективный алгоритм интегрирования зарядов Бейдера. J. Chem. физ. 134 , 064111 (2011).
М. и Тринкл Д. Р. Точный и эффективный алгоритм интегрирования зарядов Бейдера. J. Chem. физ. 134 , 064111 (2011).Артикул
Google ученый
VandeVondele, J. & Hutter, J. Базисные наборы Гаусса для точных расчетов молекулярных систем в газовой и конденсированной фазах. J. Chem. физ. 127 , 114105 (2007 г.).
Артикул
Google ученый
Гедекер С., Тетер М. и Хаттер Дж. Сепарабельные гауссовские псевдопотенциалы в двойном пространстве. Физ. Ред. B 54 , 1703–1710 (1996).
Артикул
КАСGoogle ученый
Бекке, А. Д. Приближение обменной энергии функционала плотности с правильным асимптотическим поведением. Физ. Ред. A 38 , 3098–3100 (1988 г.).
Артикул
КАСGoogle ученый
Ли, К.
 Т., Ян, В.Т. и Парр, Р.Г. Преобразование формулы корреляционной энергии Колле-Сальветти в функционал электронной плотности. Физ. Ред. B 37 , 785–789 (1988).
Т., Ян, В.Т. и Парр, Р.Г. Преобразование формулы корреляционной энергии Колле-Сальветти в функционал электронной плотности. Физ. Ред. B 37 , 785–789 (1988).Артикул
КАСGoogle ученый
Гримме, С., Энтони, Дж., Эрлих, С. и Криг, Х. Последовательный и точный ab initio параметризация поправки на дисперсию функционала плотности (DFT-D) для 94 элементов H–Pu. J. Chem. физ. 132 , 154104 (2010).
Артикул
Google ученый
Дженовезе Л., Дойч Т., Неелов А., Гедекер С. и Бейлкин Г. Эффективное решение уравнения Пуассона со свободными граничными условиями. J. Chem. физ. 125 , 074105 (2006 г.).
Артикул
Google ученый
VandeVondele, J. et al. QUICKSTEP Быстрые и точные расчеты функционала плотности с использованием смешанных волн Гаусса и плоских волн.
 Комп. физ. коммун. 167 , 103–128 (2005).
Комп. физ. коммун. 167 , 103–128 (2005).Артикул
КАСGoogle ученый
Йоргенсен, В. Л. Параметры OPLS и OPLS-AA для органических молекул, ионов и нуклеиновых кислот (Йельский университет, 1997).
Google ученый
Бхансали А. П., Баязитоглу Ю. и Маруяма С. Моделирование молекулярной динамики испаряющейся капли натрия. Междунар. J. Термальные науки. 38 , 66–74 (1999).
Артикул
КАСGoogle ученый
Берендсен, Х. Дж. К., Григера, Дж. Р. и Страатсма, Т. П. Недостающий член в эффективных парных потенциалах. J. Phys. хим. 91 , 6269–6271 (1987).
Артикул
КАСGoogle ученый
Кастенгольц, М.



 Т. Эффектная демонстрация для широкой аудитории – образование гидроксильных ионов при реакции натрия с водой. J. Chem. Образовательный 58 , 506 (1981).
Т. Эффектная демонстрация для широкой аудитории – образование гидроксильных ионов при реакции натрия с водой. J. Chem. Образовательный 58 , 506 (1981). Б., Ривз Р.В., Сон С.Ф. Механическая активация и безгазовый взрыв: наноструктурные аспекты. Хим. англ. J. 174 , 677–686 (2011).
Б., Ривз Р.В., Сон С.Ф. Механическая активация и безгазовый взрыв: наноструктурные аспекты. Хим. англ. J. 174 , 677–686 (2011). Неорг. Матер. заявл. Рез. 2 , 461–467 (2011).
Неорг. Матер. заявл. Рез. 2 , 461–467 (2011). J. Phys. хим. 90 , 186–190 (1986).
J. Phys. хим. 90 , 186–190 (1986). 122 , 4837–4838 (2000).
122 , 4837–4838 (2000). , Шайер П. и Марк Т. Д. Многозарядные кластеры. C. R. Phys. 3 , 353–364 (2002).
, Шайер П. и Марк Т. Д. Многозарядные кластеры. C. R. Phys. 3 , 353–364 (2002). М. и Тринкл Д. Р. Точный и эффективный алгоритм интегрирования зарядов Бейдера. J. Chem. физ. 134 , 064111 (2011).
М. и Тринкл Д. Р. Точный и эффективный алгоритм интегрирования зарядов Бейдера. J. Chem. физ. 134 , 064111 (2011). Т., Ян, В.Т. и Парр, Р.Г. Преобразование формулы корреляционной энергии Колле-Сальветти в функционал электронной плотности. Физ. Ред. B 37 , 785–789 (1988).
Т., Ян, В.Т. и Парр, Р.Г. Преобразование формулы корреляционной энергии Колле-Сальветти в функционал электронной плотности. Физ. Ред. B 37 , 785–789 (1988). Комп. физ. коммун. 167 , 103–128 (2005).
Комп. физ. коммун. 167 , 103–128 (2005).