Содержание
Для скачивания — Кафедра химии
- Главная
- Университет
- Для скачивания
- Кафедра химии
Лекция. Растворы неэлектролитов
Размер файла:
638.79 kB
Автор:
Апанович, З.В.
Дата:
26.12.2016 12:03
Растворы неэлектролитов. Лекция по курсу «Общая химия» для студентов инженерно-технологического факультета / З.В. Апанович. – Гродно : ГГАУ , 2016. – 33 с.
Учебно-методическое пособие включает лекцию по теме «Растворы неэлектролитов» курса «Общая химия» и предназначено для контролируемой самостоятельной работы студентов инженерно – технологического факультета. Использование пособия, в котором рассмотрены важнейшие теоретические вопросы в доступной и сжатой форме, позволит студентам быстрее и эффективнее изучить материал.
Скачать
Лекция. Окислительно-восстановительные реакции
Размер файла:
609.98 kB
Автор:
Апанович, З.В.
Дата:
26.12.2016 12:03
Окислительно – восстановительные реакции. Лекция по курсу «Общая химия » для студентов инженерно-технологического факультета / З.В. Апанович. – Гродно : ГГАУ, 2016. – 31 с.
Лекция по курсу «Общая химия » для студентов инженерно-технологического факультета / З.В. Апанович. – Гродно : ГГАУ, 2016. – 31 с.
Учебно-методическое пособие включает лекцию по теме «Окислительно – восстановительные реакции» и предназначено для контролируемой самостоятельной работы студентов инженерно–технологического факультета. Использование такого пособия, в котором рассмотрены важнейшие вопросы в доступной и сжатой форме, позволит студентам быстрее и эффективнее изучить материал.
Скачать
Лекция. Комплексные соединения
Размер файла:
531.46 kB
Автор:
Апанович, З.В.
Дата:
26.12.2016 12:03
Лекция «Комплексные соединения» по курсу «Общая химия» для студентов инженерно-технологического факультета / З.В. Апанович. – Гродно : ГГАУ, 2016. – 26 с.
Учебно-методическое пособие включает лекцию по теме «Комплексные соединения» курса «Общая химия». Комплексные соединения играют важную роль в природе и технике, прежде всего, это ферментативные и фотохимические процессы, перенос кислорода в биологических системах, тонкая технология редких металлов, каталитические реакции и т. д. Координационные свойства проявляются всеми элементами периодической системы.
д. Координационные свойства проявляются всеми элементами периодической системы.
Скачать
Лекция. Кинетика химических реакций. Химическое равновесие
Размер файла:
768.32 kB
Автор:
Апанович, З.В.
Дата:
26.12.2016 12:03
Кинетика химических реакций. Химическое равновесие. Лекции по курсу «Общая химия» для студентов инженерно-технологического факультета / З.В. Апанович. – Гродно : ГГАУ, 2016. – 44 с.
Учебно-методическое пособие включает лекции по отдельным темам курса «Общая химия» и предназначено для контролируемой самостоятельной работы студентов инженерно – технологического факультета. Использование таких пособий, в которых рассмотрены важнейшие теоретические вопросы в доступной и сжатой форме, позволит студентам быстрее и эффективнее изучить материал.
Скачать
Предэкзаменационные тесты по органической и биологической ХИМИИ
Размер файла:
1.30 MB
Автор:
Макарчиков А.Ф., Колос И.К.
Дата:
26. 12.2016 12:02
12.2016 12:02
Предэкзаменационные тесты по органической и биоло-гической химии для студентов биотехнологического факультета / А.Ф. Макарчиков, И.К. Колос – Гродно: ГГАУ, 2016. – 205 с.
В пособии приведен перечень вопросов для проведения предэкзаменационного тестирования студентов, обучающихся на биотехнологическом факультете, по предмету «Химия (органическая и биологическая)»
Скачать
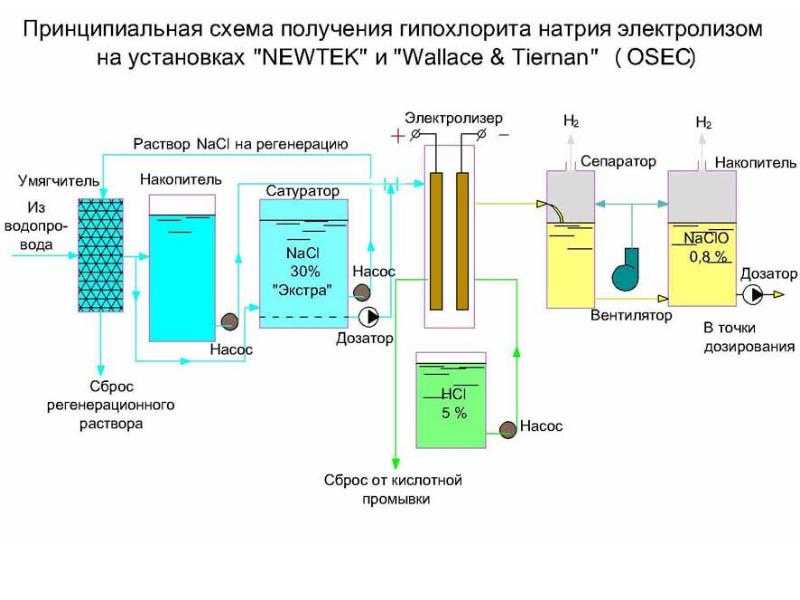
Лекция. Электролиз. Коррозия металлов и методы защиты металлов от коррозии
Размер файла:
758.87 kB
Автор:
Апанович, З.В.
Дата:
26.12.2016 12:02
Электролиз. Коррозия металлов и методы защиты металлов от коррозии. Лекция по курсу «Общая химия» для студентов инженерно-технологического факультета / З.В. Апанович. – Гродно : ГГАУ, 2016. – 31 с.
Учебно-методическое пособие включает лекции по отдельным темам курса «Общая химия» и предназначено для контролируемой самостоятельной работы студентов инженерно – технологического факультета. Использование таких пособий, в которых рассмотрены важнейшие теоретические вопросы в доступной и сжатой форме, позволит студентам быстрее и эффективнее изучить материал.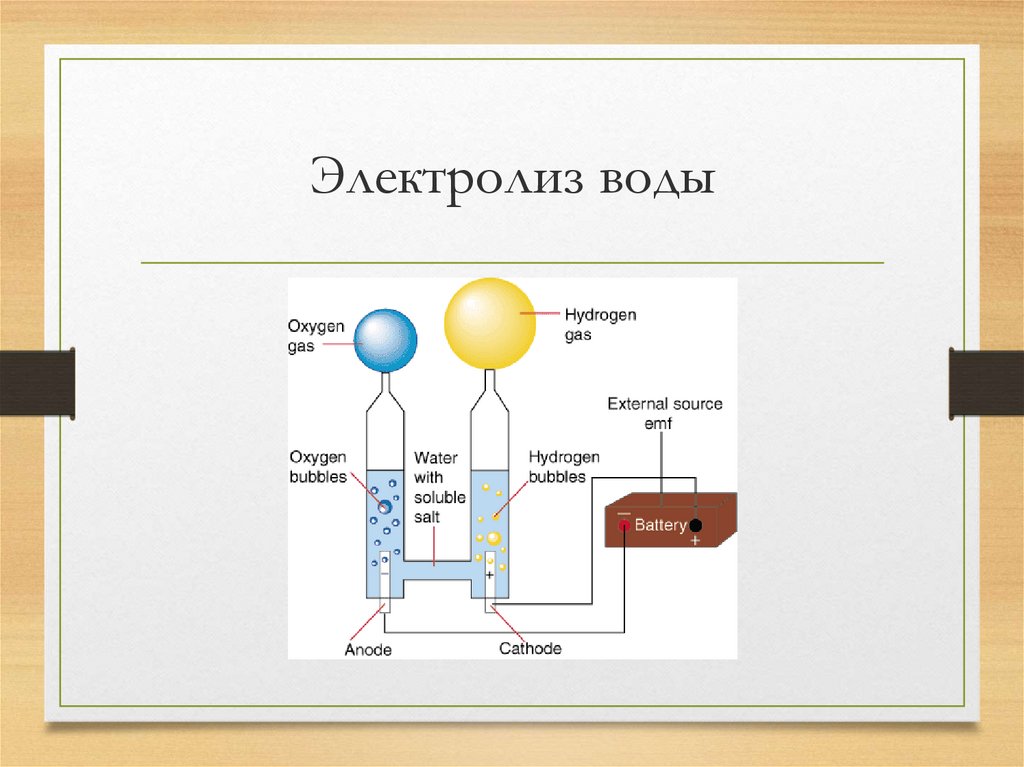
Скачать
Лекция. Энергетика химических процессов.
Размер файла:
604.00 kB
Автор:
Апанович, З.В.
Дата:
26.12.2016 12:02
Энергетика химических процессов. Лекция по курсу «Общая химия» для студентов инженерно-технологического факультета / З.В. Апанович. – Гродно : ГГАУ, 2016. – 25 с.
Учебно-методическое пособие включает лекцию по теме «Энергетика химических процессов» и предназначено для контролируемой самостоятельной работы студентов инженерно – технологического факультета. Использование такого пособия, в котором рассмотрены важнейшие вопросы в доступной и сжатой форме, позволит студентам быстрее и эффективнее изучить материал.
Скачать
Лекция. Строение атомов элементов
Размер файла:
789.90 kB
Автор:
Апанович, З.В.
Дата:
26.12.2016 12:02
Строение атомов элементов. Лекция по курсу «Общая химия» для студентов инженерно-технологического факультета / З.В. Апанович. – Гродно : ГГАУ , 2016.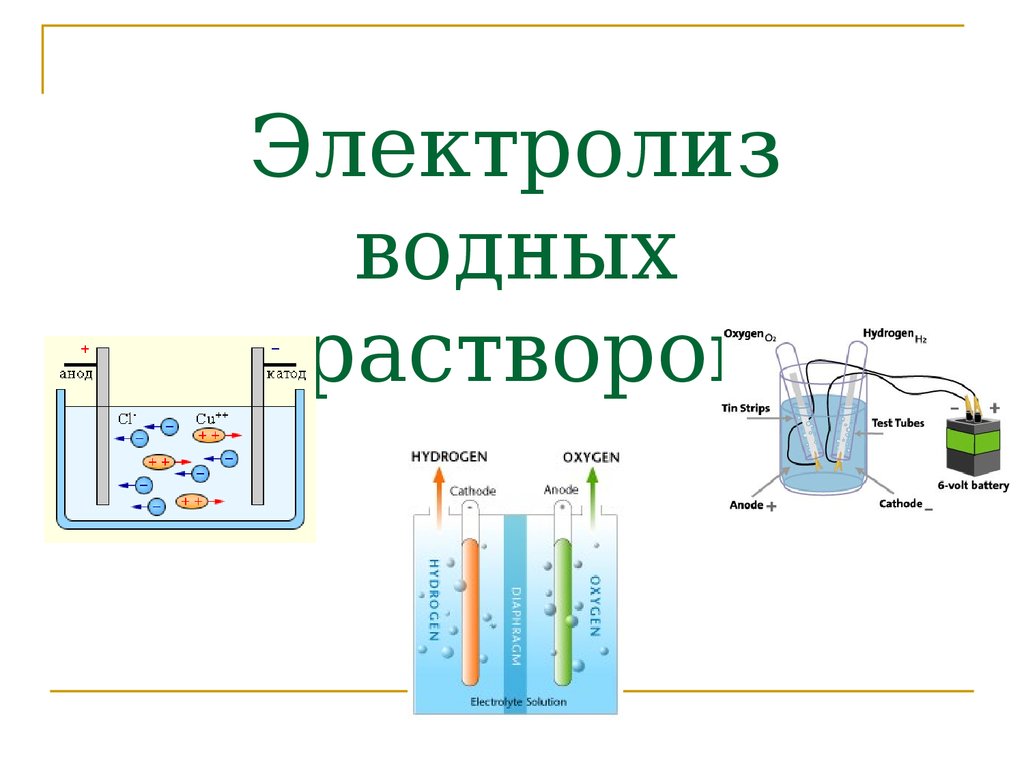 – 23 с.
– 23 с.
Учебно-методическое пособие включает лекцию по теме «Строение атомов элементов» курса «Общая химия» и предназначено для контролируемой самостоятельной работы студентов инженерно – технологического факультета. Использование пособия, в котором рассмотрены важнейшие теоретические вопросы в доступной и сжатой форме, позволит студентам быстрее и эффективнее изучить материал.
Скачать
Лекция. Основные понятия и законы химии
Размер файла:
675.23 kB
Автор:
Апанович, З.В.
Дата:
26.12.2016 12:03
Основные понятия и законы химии. Лекция по курсу «Общая химия» для студентов инженерно-технологического факультета / З.В. Апанович. – Гродно : ГГАУ, 2016. – 30 с.
Учебно-методическое пособие включает лекцию по теме «Основные понятия и законы химии» курса «Общая химия» и предназначено для контролируемой самостоятельной работы студентов инженерно – технологического факультета. Использование студентами распечатки лекционной темы значительно сэкономит время для понимания материала, излагаемого лектором, и конспектирования.
Скачать
Предэкзаменационные тесты по химии
Размер файла:
813.02 kB
Автор:
Макарчиков А.Ф., Колос И.К.
Дата:
14.11.2016 11:47
Предэкзаменационные тесты по химии для студентов, обучающихся на агробиологических специальностях / А.Ф. Макарчиков, И.К. Колос – Гродно: ГГАУ, 2016. – 201 с.
В пособии приведен перечень вопросов для проведения предэкзаменационного тестирования студентов, обучающихся на агробиологических специальностях, по предмету «Химия».
Скачать
Методическое пособие для лабораторных работ по аналитической химии
Размер файла:
544.41 kB
Автор:
Апанович З.В., Тараненко Т.В., Томашева Е.В., Кулеш И.В., Цветницкая Э.В.
Дата:
28.12.2015 12:22
В пособие излагается материал по аналитической химии в объеме соответствующих программ по специальностям: «Ветеринарная медицина», «Аграномия», «Биотехналогия». Содержатся методические указания по технике выполнения лабораторных работ по качественному и количественному анализу.
Скачать
Комментарии для работы с рабочими тетрадями по химии элементов
Размер файла:
655.75 kB
Дата:
28.12.2015 12:22
Комментарии для работы с рабочими тетрадями по химии элементов / З.В. Апанович, Ю.А. Лукашенко.
Учебно-методическое пособие включает лекции по отдельным темам курса «Неорганическая химия» и предназначено для контролируемой самостоятельной работы студентов инженерно – технологического факультета, для которых введен отдельный курс по химии элементов, а также может быть использовано студентами других факультетов.
Скачать
Практикум по физической химии
Размер файла:
1.03 MB
Дата:
01.04.2013 04:24
Учебно-методическое пособие (для проведения лабораторных занятий) для студентов инженерно-технического факультета
Практикум по физической химии: учеб.-мет. пособие / О. И. Валентюкевич.- Гродно: ГГАУ, 2008 – 88с.
Данное пособие предназначено для студентов технологических специальностей аграрного университета. Целью данного пособия является оказание помощи в изучении теоретического материала, а также выработка навыков экспериментальной работы.
Целью данного пособия является оказание помощи в изучении теоретического материала, а также выработка навыков экспериментальной работы.
Скачать
Коллоидная химия
Размер файла:
834.37 kB
Дата:
01.04.2013 04:09
Учебно-методическое пособие (для проведения лабораторных занятий) для студентов инженерно-технического факультета
К-60 Практикум по физической химии: учеб.-мет. пособие / И. В. Кулеш, О. И. Валентюкевич.- Гродно: ГГАУ, 2013 – 94с.
Данное пособие предназначено для студентов технологических специальностей аграрного университета. Целью данного пособия является оказание помощи в изучении теоретического материала, а также выработка навыков экспериментальной работы.
Скачать
Курс лекций по дисциплине «Неорганическая химия»
Размер файла:
1.33 MB
Дата:
28.12.2015 12:22
Лекции по курсу «Неорганическая химия »для студентов инженерно – технологического факультета / З.В. Апанович.
Скачать
Рабочая тетрадь и методические указания по неорганической химии
Размер файла:
701. 32 kB
32 kB
Дата:
28.12.2015 12:23
Рабочая тетрадь и методические указания по неорганической химии. Для студентов технологических специальностей / З.В. Апанович.
Скачать
Ионные равновесия и обменные реакции в растворах электролитов
Скачать
Лабораторные работы по химии элементов для студентов технологических специальностей
Скачать
Университет
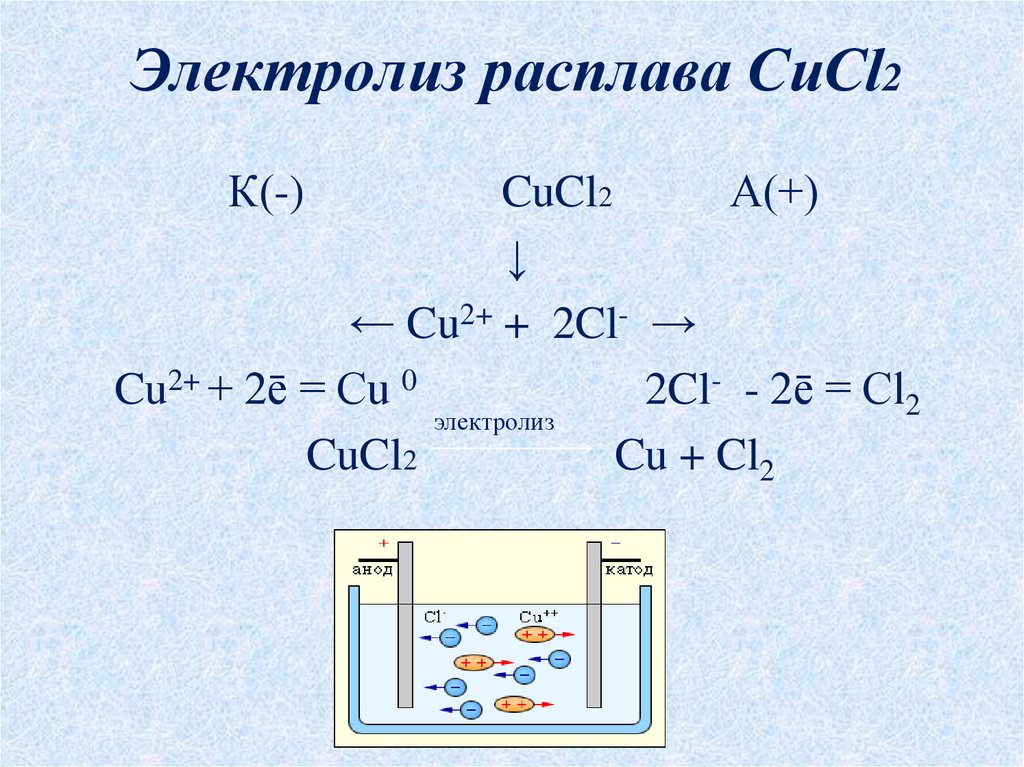
электролиз воды
МИНОБРНАУКИ
РОССИИ
Федеральное
государственное бюджетное образовательное
учреждение
высшего образования
Нижегородский
государственный технический университет
им. Р.Е. Алексеева
(НГТУ)
Институт
физико-химических технологий и
материаловедения (ИФХТиМ)
Кафедра
«Технология электрохимических производств
и
химии органических веществ (ТЭПиХОВ)»
Дисциплина
«Электрохимические технологии»
ДОКЛАД
по
теме
«Электролиз
воды»
Выполнила: Студентка |
Принял: |
_________________________________________ |
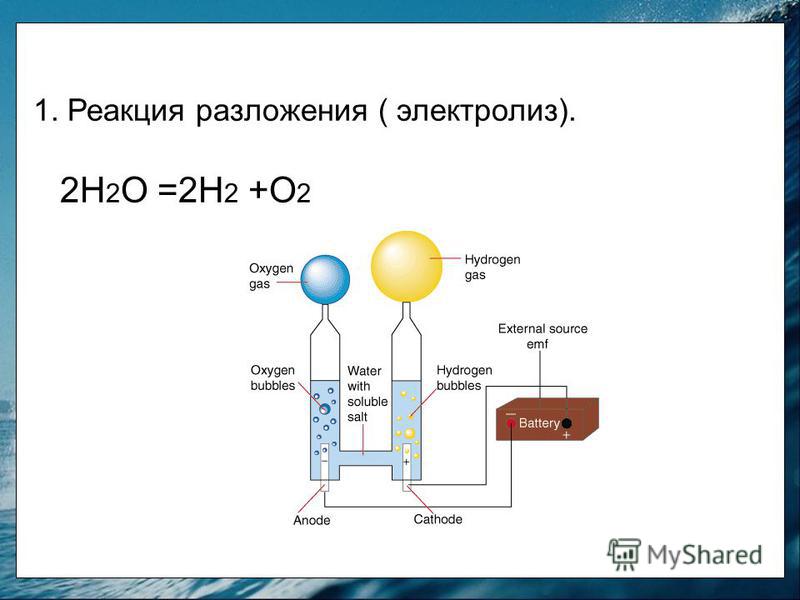
Электролиз
воды
–физико-химический процесс, при котором
под действием постоянного электрического
тока вода разлагается на кислород и
водород. Постоянное напряжение для
ячейки получается, как правило,
выпрямлением трехфазного переменного
тока. В электролитической ячейке
дистиллированная вода подвергается
электролизу, при этом химическая реакция
идет по следующей известной схеме:
Для
раздельного получения газов используют
электролизеры с диафрагмами или
мембранами, разделяющими катодное и
анодное пространство.
Использование
специальных электродов позволяет
производить из воды озон и перекись
водорода.
На
аноде производится озон: 3H2O
→ O3 +
6e− +
6H+ (вода
подкисляется).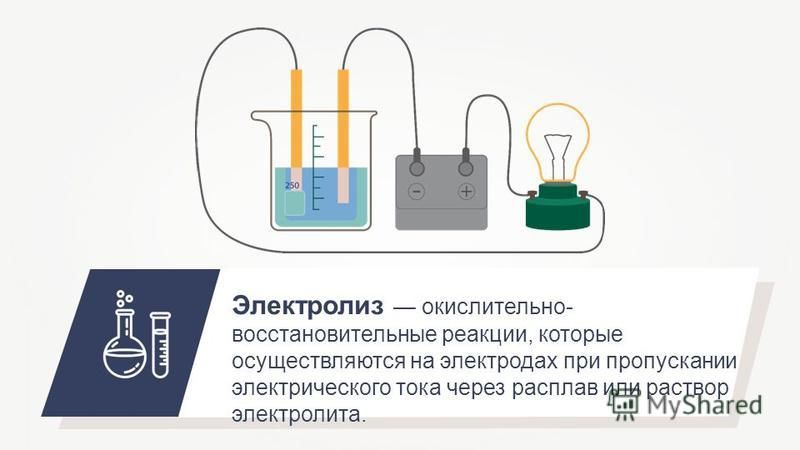
На
катоде – перекись
водорода: O2 +
2H2O
+ 2e− → H2O2 +
2OH− (вода
подщелачивается).
Удельная проводимость
очищенной воды незначительна: при 18°С
она составляет 4,41·10-6 Ом-1·м-1. Поэтому
электролитическое разложение воды
проводят в присутствии фонового
электролита. Ввиду существенных
коррозионных проблем, возникающих при
электролизе кислот, в настоящее время
почти все электролизеры используют
водные растворы на основе гидроксидов
калия и натрия с концентрацией 350-400
г./л. Растворы КОН имеют преимущества
перед NaOH в силу больше проводимости
иона К+ против иона Na+. Концентрация КОН
соответствует оптимальным значениям
плотностей тока. Небольшие примеси к
КОН не являются препятствием к его
использованию. Для предотвращения или
уменьшения коррозии деталей электролизеров
при приготовлении электролита применяют
только чистые КОН и NaOH.
Раствор
электролита, используемый в установках
для электролиза воды, содержит 16-20% NaOH
или 25-30% КОН.
Побочные
реакции:
Естественная
пресная (не дистиллированная) вода
всегда содержит минеральные соли –
сульфаты, карбонаты, хлориды. В целях
получения хлора для пролонгированного
эффекта обеззараживания воды интересны
только хлориды. В воде они представлены
в основном хлоридом натрия (NaCl), хлоридом
кальция (CaCl) и хлоридом калия (KCl).
На
примере с хлоридом натрия реакция
образования хлора электролизом будет
следующей.
Соль,
растворенная в воде: 2NaCl + H2O →
2Na+ +2Cl– +
2H2O
Во
время электролиза на аноде формируется
хлор: 2Cl– → Cl2+2e– (вода
подкисляется).
А
у катода образуется гидроокись
натрия: Na+ + OH– → NaOH (вода
подщелачивается).
Эта
реакция является недолгой, поскольку
любой хлор, произведенный у анода, быстро
потребляется для формирования гипохлорита
натрия: Cl2 +
2NaOH → H2 +
2NaOCl.
Подобные
реакции электролиза происходят и с
хлоридами кальция и калия.
Материал
электродов:
Для
электролиза воды применяют нержавеющую
сталь, часто покрытую никелем, с целью
уменьшения перенапряжения водорода.
Конструкции
электролизеров
Промышленные
электролизеры для производства водорода
бывают двух типов:
— монополярные
— электроды питаются параллельно в одной
и той же емкости;
— биполярные
— электроды питаются последовательно
(электрод с одной стороны поверхности
является анодом, а с другой — катодом) и
образуют укладку ячейки.
При
монополярном включении электродов все
электроды одного знака присоединены к
шине, идущей от соответствующего полюса
источника постоянного тока. При биполярном
включении электродов ток подводится
только к крайним электродам 1 и 2, которые
являются монополярными электродами.
Все остальные электроды подвода тока
не имеют и работают биполярно.
Соотношение
между током и напряжением в электролизерах
Чем
ниже напряжение на ячейке электролизера,
тем меньшую он потребляет мощность. С
С
ростом температуры электролита напряжение
электролизера снижается поэтому
энергетически выгодно было бы
эксплуатировать электролизеры при
повышенных температурах (при работе
под давлением — с температурой 100°С и
даже выше). Однако с ростом температуры
электролита усиливаются коррозионные
процессы и значительно ускоряется
старение прокладочного материала
паронита. Поэтому для небольших
электролизных установок на электростанциях
основное значение имеет надежность
оборудования и длительность работы
между ремонтами, температуру электролита
следует поддерживать 60-75°С, а в тех
случаях, когда не требуется работа
электролизера с полной нагрузкой,
желательно поддерживать 40-50°С. При
этом для сохранения нужной производительности
электролизера следует повышать
напряжение.
Для
того чтобы ток проходил через электролизер
с биполярным включением электродов,
напряжение на электролизере (U) должно
быть равно:
U=
U1·n,
(22)
где,
U1 —
напряжение на одной ячейке;
n
— количество ячеек.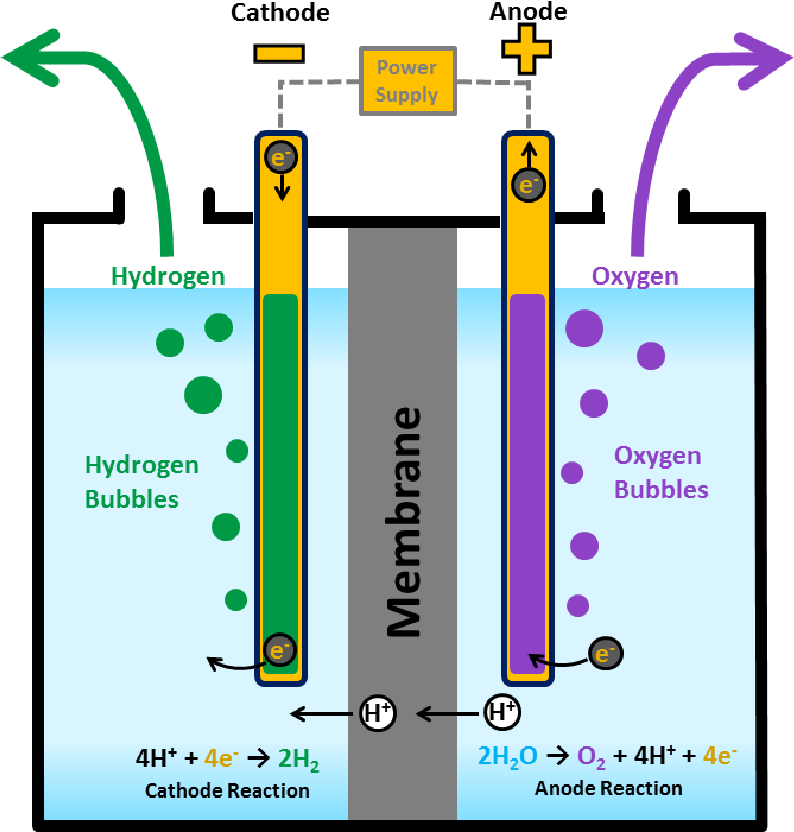
Напряжение
на монополярном электролизере равно
напряжению между парой электродов (на
одной ячейке U= U1).
Ток
(I), подводимый к монополярному
электролизеру, разветвляется на все
электроды в соответствии с законами
параллельного соединения. Поэтому ток,
идущий через пару электродов I1=I/n.
В
биполярном электролизере
ток, идущий через каждую пару электродов,
равен току через весь электролизер
(I1=I)
— закон последовательного соединения.
Таким
образом, при одинаковой токовой нагрузке
на монополярный и биполярный электролизеры
количество полученного вещества в
биполярном электролизере в n раз больше.
Поэтому для биполярного электролизера
существуют понятия линейной и эквивалентной
силы тока. Эквивалентная сила тока
равняется линейной силе тока, проходящего
через электролизер, умноженной на
количество ячеек:
Iэкв=I·n.
Монополярные
электролизеры не создаются на токовые
нагрузки выше 200 — 300 кА, биполярные
электролизеры работают при эквивалентной
токовой нагрузке до 2000 кА. Следовательно,
Следовательно,
биполярные электролизеры более мощные
и более производительные.
Другим
достоинством биполярных электролизеров
является снижение падения напряжения
в ошиновке электролизера и в контактах
за счет уменьшения их количества
Кроме
того, уровень автоматизации биполярных
электролизеров выше, чем монополярных,
что уменьшает затраты рабочей силы на
их обслуживание.
Все
современные конструкции электролизеров
для электролиза воды относятся к
фильтр-прессному типу с биполярным
включением электродов.
Схема
фильтр-прессного электролизера
Увлажняющий
элемент (1) сборочного узла содержит
электролитную полость (2) и пористую
мембрану (3), пропускающую через себя
пары воды и не пропускающую жидкость.
Пористая мембрана (3) отделяет увлажняющий
элемент (1) от электролизной ячейки (4),
которая включает в себя кислородную
(5) и паро-водородную (6) полости, пористый
катод (7), пористый анод (8) и пористую
электролитосодержащую матрицу (9).
Схема
биполярного фильтр-прессного электролизера
Как
видно из фиг. 1, электролизер состоит из
1, электролизер состоит из
блока дистанцированных друг от друга
электродов 2 и охватывающего блок
диэлектрического стакана 3, погруженных
в электролит 4 в корпусе 5. Ток к концевым
электродам блока 2 подведен изолированными
снаружи проводниками 6, пропущенными в
электролит 4 через гермовводы 7. Через
патрубок 8 из корпуса 5 выходит
водородно-кислородная смесь, а через
патрубок 1 корпус пополняют электролитом.
Список
литературы:
Якименко
Л.Н. Получение водорода, кислорода,
хлора и щелочей. — М.: Химия, 1981;Фиошин
М.Я., Павлов В. Н., Электролиз в неорганической
химии, М., 1976;Мазанко
А.Ф., Камарьян Г.М., Помашин О.П., Промышленный
мембранный электролиз, М., 1989;А.И.
Левин, Теоретические основы электрохимии,
Гос. Научно-техн. Издат., Москва, 1963;Л.М.
Якименко и др., Электролиз воды, изд.
«химия», Москва, 1970.
Электролиз воды – уравнение, схема и эксперимент
Содержание
Электролиз воды
Электролиз воды – это процесс превращения воды (h3O) в ионов водорода (H+) и гидроксида (OH-) путем пропускания через него электрического тока. Ионы движутся к противоположным электродам, выделяя чистый водород (h3) и кислород (O2). Электролиз воды — это окислительно-восстановительная реакция , которая не протекает самопроизвольно. Поскольку тепло в виде электричества поступает в электролизер при электролизе воды, реакция эндотермический.
Ионы движутся к противоположным электродам, выделяя чистый водород (h3) и кислород (O2). Электролиз воды — это окислительно-восстановительная реакция , которая не протекает самопроизвольно. Поскольку тепло в виде электричества поступает в электролизер при электролизе воды, реакция эндотермический.
Применение электролиза воды
- Электролиз воды используется для получения кислорода для Международной космической станции.
- Водород, полученный в качестве побочного продукта хлорно-щелочного процесса, используется для производства специальных химикатов и других небольших применений.
- Газообразный водород, полученный таким образом, можно использовать в качестве водородного топлива или смешивать с кислородом для получения газообразного водорода, который используется при сварке и других применениях.
- Тяжелая вода создается электролизом воды.
- Электролиз производит около 5% газообразного водорода, производимого во всем мире.

Поверхностное натяжение
World Ozone Day 2022
Меж государственный совет
SSC CGL
Электролиз уравнения воды
Электролиз Электролиз из водного места. состоит из положительно заряженного анода и отрицательно заряженный катод , оба из которых обычно изготавливаются из платины . Химическую реакцию электролиза воды можно разделить на две половины, протекающие на катоде и аноде. Уравнение электролиза воды можно записать так:
На катоде ионы водорода приобретают электроны и превращаются в газообразный водород в реакции восстановления. Ниже приведена полуреакция:
2 H + (водн.) + 2 e – → H 2 (g)
Реакция окисления происходит, когда молекулы воды переносят электроны на анод и выделяют газообразный кислород. Полуреакция изображена ниже.
Полуреакция изображена ниже.
2 H 2 O (ж) → O 2 (г) + 4 H + (водн.) + 4 e –
В целом, уравнение электролиза воды
2 H 2 O (л) + электрическая энергия → 2 H 2 (г) + O 2 (г)
В результате реакции электролиза воды из воды выделяются водород и кислород .
Широта и долгота Индии
Международная линия даты
Электролиз с диаграммой воды
Электролиз воды приведен ниже:
. Реакция с водой
В результате реакции электролиза воды образуется водород и газообразный кислород . Электролитическая ячейка состоит из пары 9Платиновые электроды 0007 , погруженные в воду с небольшим количеством электролита , такого как h3SO4 . Электролит необходим, потому что чистая вода не может нести достаточный заряд из-за нехватки ионов . Вода окисляется до газообразного кислорода и ионов водорода на аноде . Вода восстанавливается до газообразного водорода и ионов гидроксида на катоде.
Вода окисляется до газообразного кислорода и ионов водорода на аноде . Вода восстанавливается до газообразного водорода и ионов гидроксида на катоде.
окисление (анод): 2h3O(ж)→O2(г)+4H+(водн.)+4e- E0=-1,23 В
восстановление (катод): 2h3O(ж)+2e-→h3(г)+2OH-(водн.) E0=-0,83 В
общая реакция: 2h3(g) E0cell=−2,06 В
Чтобы получить общий электролиз реакции воды, полуреакция восстановления была умножена на два, чтобы уравнять электроны. Ионы водорода и гидроксид-ионы, образующиеся в каждой реакции, объединяются, образуя воду. h3SO4 не используется в реакции . 9
Эксперимент по электролизу воды водород и кислород) мы проведем эксперимент Электролиз воды :
Необходимые материалы:
- Пластиковая кружка
- Резиновая пробка
- Угольные электроды (анод и катод)
- Аккумулятор
- Вода
- Разбавленная серная кислота и
- Пробирка
Экспериментальная процедура:
- Просверлите два отверстия на дне пластиковой кружки.

- Вставьте две резиновые заглушки в соответствующие отверстия.
- Вставьте анодный и катодный угольные электроды в резиновые пробки.
- Подсоедините 6-вольтовую батарею к этим угольным электродам.
- Наполните пластиковую кружку наполовину водой так, чтобы угольные электроды были погружены в воду.
- В эту воду добавьте несколько капель серной кислоты.
- Наполните две пробирки водой, затем переверните пробирки на угольные электроды.
- Включить ток от 6-вольтовой батареи.
- Дайте устройству отдохнуть некоторое время.
На обоих электродах в пробирках будут образовываться пузырьки (что означает образование или выделение газа из воды)
Вода начинает двигаться в пробирке в результате образования пузырьков.
- Осторожно извлеките пробирки из кружки после того, как они будут заполнены газами.
- Поместите зажженную свечу рядом с горлышком пробирки, чтобы определить, какой газ присутствует.

Результат:
- Когда мы подносим зажженную свечу к горлышку одной из пробирок, газ воспламеняется и горит с хлопком, указывая на наличие водорода в пробирке.
- Когда мы помещаем горящую свечу рядом с горлышком другой пробирки, свеча начинает ярко гореть, указывая на то, что пробирка содержит кислород.
- Отрицательный газ, собранный на аноде, представляет собой кислород, а положительный газ, собранный на катоде, представляет собой водород.
Реакция разложения:
2H3O (L)-→ Электричество-→ 2H3 (G) + O2 (G)
(вода) (водород) + (кислород)
Вывод:
Реакция разложения происходит, когда один реагент распадается с образованием более простых продуктов в этом эксперименте по электролизу воды. При правильных условиях вода разлагается с образованием водорода и кислорода . В этом случае электричество является подходящим условием для разложения воды.
Электролиз воды – реакция разложения
Электролиз воды – реакция разложения . Это связано с тем, что под действием электрического тока вода распадается на составные элементы, водород и кислород. Молярное отношение водородных и кислородных газов , выделяющихся при электролизе воды, составляет 2:1 .
Штаты и столицы
Союзные территории в Индии
Электролиз воды – часто задаваемые вопросы
Q1. Какие электроды используются при электролизе воды?
Ответ. Платиновые электроды используются при электролизе воды.
Q2. К какому типу химической реакции относится электролиз воды?
Ответ. Электролиз воды — это реакция разложения, при которой вода расщепляется на составные элементы, водород и кислород, под действием электрического тока.
Q3. Что происходит при электролизе воды?
Ответ. Во время электролиза воды вода разлагается на газообразный кислород и газообразный водород. Для этого через раствор пропускают электрический ток. Катод вырабатывает газообразный водород, а анод генерирует газообразный кислород.
Во время электролиза воды вода разлагается на газообразный кислород и газообразный водород. Для этого через раствор пропускают электрический ток. Катод вырабатывает газообразный водород, а анод генерирует газообразный кислород.
К общему пониманию кинетики реакции выделения кислорода при электролизе воды с полимерным электролитом
К общему пониманию кинетики реакции выделения кислорода при электролизе воды с полимерным электролитом†
Тобиас
Шулер, и
Таро
Кимура, 9 лет0064 аб
Томас Дж.
Шмидт ак
а также
Феликс Н.
Бюхи
* и
Принадлежности автора
*
Соответствующие авторы
и
Лаборатория электрохимии, Институт Пауля Шеррера, CH-5232 Villigen PSI, Швейцария
Электронная почта:
felix. [email protected]
[email protected]
б
в отпуске: Центр наноматериалов топливных элементов, Университет Яманаси, 6-43 Миямаэ-тё, Кофу 400-0021, Япония
с
Лаборатория физической химии, ETH Zürich, CH-8093 Zürich, Швейцария
Аннотация
Электролиз воды является ключевой технологией для будущих энергетических систем, предназначенных для хранения изменчивых возобновляемых источников энергии и модернизации экологичной промышленной продукции.

 ____________
____________