Проект по химии "Вода как реактив и среда для химических процессов". Реагент вода
Проект по химии "Вода как реактив и среда для химических процессов"
Министерство образования Нижегородской области
Государственное бюджетное профессиональное
образовательное учреждение
«Борский Губернский колледж»
18.02.05 Производство тугоплавких неметаллических и силикатных материалов и изделий
Проект по биологии
на тему:
«Вода как реактив и среда
для химических процессов»
Выполнил:
студент группы ТС-11
Арнаутов Е.И.
Проверила:
преподаватель биологии
Устинова А.Н.
Городской округ город Бор
2016 г.
Оглавление
Введение…………………………………………………………………………...3
1. Строение молекулы воды………………………………………………………3
2. Физические свойства воды…………………………………………………......6
3. Химические свойства воды…………………………………………………….6
4. Виды воды……………………………………………………………………….7
5. Почему не кончается вода на Земле?.................................................................8
6. Вода в природе………………………………………………………………….9
7. Аномалии воды…………………………………………………………………9
8. Применение воды……………………………………………………………...11
Заключение……………………………………………………………………….12
Список литературы………………………………………………………………13
Введение
Вода (оксид водорода) - бинарное неорганическое соединение, химическая формула Н2O. Молекула воды состоит из двух атомов водорода и одного - кислорода, которые соединены между собой ковалентной связью.
Вода, не является питательным веществом, но она жизненно необходима, как стабилизатор температуры тела, переносчик питательных веществ и пищеварительных отходов, реагент и реакционная среда в ряде химических превращений. Кроме того, вода формирует органолептические показатели продукта.
Общий запас воды на Земле составляет 1359000 м3. Около 70% поверхности планеты покрыто морями и океанами, но эта вода - соленая. На долю пресной воды приходится 2,8%, причем 2,2% из них недоступно людям, так как это ледники северного Ледовитого океана, Гренландии, Антарктиды.
На Земле происходит непрерывный круговорот воды, включающий использование воды на бытовые и производственные нужды человека, использование воды растениями и животными, испарение воды и фильтрацию ее через почву многое другое. Характер процессов, протекающих с участием воды, во многом определяется ее свойствами как индивидуального вещества.
Вода - самое удивительное соединение на Земле.
1. Строение молекулы воды
Вода (оксид водорода) Н2О - простейшее устойчивое соединение. Молекула воды (h3O) состоит из двух атомов водорода (h2) и одного атома кислорода (O16).
Молекулярная масса воды 18,0160, на водород приходится 11,19% по массе, а на кислород - 88,81%.
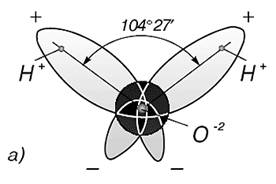
Три ядра в молекуле воды образуют равнобедренный треугольник с двумя протонами водорода в основании и кислородом в вершине.
Модель молекулы воды, предложенная Нильсом Бором:
Свойства воды в основном зависят от величины водородных связей.
Из-за большой разности электроотрицательностей атомов водорода и кислорода электронные облака сильно смещены в сторону кислорода.
По этой причине, а также из-за того, что ион водорода не имеет внутренних электронных слоев и обладает малыми размерами, он может проникать в электронную оболочку отрицательно поляризованного атома соседней молекулы.
Благодаря чему, каждый атом кислорода притягивается к атомам водорода других молекул и наоборот.
infourok.ru
Реагентное умягчение воды: обзор химических реагентов
АкваЩит - Умягчение воды
Ситуация с водой сегодня такова, что не очищать ее невозможно. Экология, заводы, фабрики, многочисленные выбросы вредных производств, атомные могильники и вот уже вода в озере становится грязной, и даже не просто грязной, а вредной, и даже убийственной. Каких только болезнетворных бактерий и вирусов там нет. Так, что пить такую воду категорически запрещено, в ней и купаться то, не всегда разрешают.
У нас с вами есть и другая вода – водопроводная. Что же с ней не так? О накипи сегодня не слышал только ленивый. Она портит бытовые приборы. Она вредит здоровью, и она заставляет за себя платить лишние деньги. Не забываем, что и для удаления накипи придется потратить приличное количество личного времени. Но одной накипью вред не заканчивается. Непосредственно жесткая вода отличается плохой растворимостью. Обычная стирка в воде такого качества аукается порчей тканей, расходом порошка, мыла и самой воды.
 От жесткости воды страдают и растения, и кафель, и водопроводные трубы. Как впрочем, и вся сантехника в купе с отопительной системой. Использование некачественной воды ведет к необратимым последствиям. Кто-то до сих пор удаляет накипь, проклиная все на свете, а кто-то уже давно понял все преимущества химического метода умягчения воды. На сегодня - это единственный способ получить качественную воду с нужным уровнем жесткости для личного потребления, или же для производства.
От жесткости воды страдают и растения, и кафель, и водопроводные трубы. Как впрочем, и вся сантехника в купе с отопительной системой. Использование некачественной воды ведет к необратимым последствиям. Кто-то до сих пор удаляет накипь, проклиная все на свете, а кто-то уже давно понял все преимущества химического метода умягчения воды. На сегодня - это единственный способ получить качественную воду с нужным уровнем жесткости для личного потребления, или же для производства.
Не только человек нуждается в хорошей, вкусной воде, качественная вода нужна и предприятиям и производству. О химии, фармакологии и пищевой промышленности подумали сразу все. Но этими отраслями применение мягкой воды не ограничивается. Воду применяют для охлаждения, а это металлургия , ее применяют для устранения пыли и прочих мелких частиц, любые абразивные работы сюда также подпадают. Обойтись без качественной воды не может и микроэлектроника.
Без безреагентной водоподготовки не может обойтись теплоэнергетика и водоснабжение. Там отсутствие очистки некачественной воды может привести к поломке оборудования, резкому расходу топлива и большим, а главное постоянным расходам. Кстати, реагентное умягчение воды очень часто используется именно в промышленности. Для применения его в быту, в нем есть главный недостаток - реагенты. Они вредны для человеческого организма. Поэтому его мало когда используют, или же после такого умягчения, вода подвергается доочистке, чтобы устранить вредные примеси умягчителей.
Выходит, многие производственные процессы обойтись без реагентного умягчения воды просто не могут. Кабы не было такого способа очистки, мы бы и в бассейнах купаться не смогли, и производство лекарств не достигло бы подобного уровня развития. В результате, проблемы с водой на таких производствах нужно решать еще до пуска системы в работу, иначе потом это все приведет к дополнительным издержкам.
Устранять накипь можно самыми различными путями и реагентный обезжелезиватель воды здесь путь не единственный. Реагенты также используются для очисток от накипи, как и для очистки воды от лишнего количества солей жесткости. Очень часто можно услышать советы применять колу или спрайт для очисток стенок того же чайника от накипи. На практике же такие реагенты бесполезны, их и реагентами то назвать можно с натяжкой. Куда более действенными будут лимонная кислота и обычный уксус или его концентрат.
Таблица 1. Потреля напора фильтра, в зависимости от выбора химического реагента
| Толщина слоя, м, катионита крупностью 3,7—8,3 мм или 6,1—9,0 мм | Потери напора, м, в фильтре при скорости работы химического реагента, м/ч | ||||
| 7 | 9 | 11 | 14 | 17 | |
| 3 | 5 | 7 | 9 | 10 | 15 |
| 3,7 | 2,9 | 3,9 | 7,1 | 8,5 | 4,2 |
Если вы хотите защитить стиральную машинку от вредного влияния жестковатой воды, то лучше, хотя бы минимально следить за образованием накипи. Для этого вам и пригодится лимонная кислота. Не реагентное умягчение воды конечно, но работает вполне качественно. Вам нужно раз в полгода запускать стиральную машинку вхолостую и использовать вместо порошка лимонную кислоту грамм сто. Важно только выбирать режим стирки белого белья с высокой температурой. Это очень приличная по качеству альтернатива реагентной очистке воды.
Если вы используете недорогие порошки, то вполне может быть, что они не содержат по умолчанию в своем составе химикатов, которые умягчают воду. Вот в этом случае лимонная кислота или уксус вам и пригодятся. Также эти вещества можно использовать для чистки кастрюль, чайников, когда налет невелик.
Однако, все понимают, что постоянные чистки приведут к порче поверхностей, к лишним расходам и затрате драгоценного свободного времени. Поэтому лучше всего использовать специальные умягчители воды. Это могут быть, как специальные приборы в виде электромагнитного умягчителя воды Акващит, который обезвредит соли жесткости до того, как они выпадут в осадок в оборудовании, так и определенные вещества.
Они часто служат для очистки сточных вод, и также для подготовки воды в бассейнах. Вот эти вещества – яркие представители реагентного умягчения воды.
Еще один вариант подобного способа довести воду до кондиции – применение ионообменного фильтра для воды. Он тоже относится к реагентным установкам. Хотя в быту, его химическая сущность полностью нивелируется, т.к. основной картридж с фильтрующим веществом заменяют, а не восстанавливают, как на производстве.
Самыми популярными веществами, используемыми для умягчения можно назвать хлор, натрий – хлор, известь, полифосфаты. Реагентное умягчение воды хоть и позволяет получить умягченную воду, но само по себе достаточно вредное. Но из-за его относительно низкой стоимости, его по-прежнему очень часто используют.
Ниже рассмотрим, круг самых популярных веществ, которые сегодня применяют для доочистки, опреснения воды. Просто так добавлять в воду реагенты нельзя, существует большой риск передозировать, поэтому давно уже изобрели специальные приборы-дозаторы, которые устанавливают на трубы. Они спустя определенный отрезок времени, заранее заданный, впрыскивают реагенты в воду в определенном количестве.
Таблица 2
| Удельный расход химического реагента на утилизацию катионита, г/г-экв | 20 | 40 | 60 | 80 |
| Коэффициент эффективности утилизации реагента катионита, aВ | 7,35 | 9,47 | 3,12 | 8,42 |
У реагентов, кроме того, что они вредные, есть еще один существенный недостаток, который делает их хуже, чем безреагентная очистка с помощью естественных физических процессов. Когда вы добавляете в воду, какие-то вещества, они вступают в реакцию с солями жесткости и делают их малорастворимыми. Получается, что в новой форме вещества легко вымываются из оборудования. Но есть такой побочный эффект, как образование нерастворимых соединений, которые точно также откладываются на поверхностях оборудования. Размер таких отложений меньше, чем образование накипного слоя. Но при этом убрать подобный слой в разы труднее. Т.к. неизвестно, чем его растворять. В результате узкие места систем могут забиваться новообразованиями.
Вернемся к рассмотрению веществ, используемых для реагентного умягчения воды. Наиболее популярный и всем известный калгон, в праве им именоваться. Его можно добавлять в стирку, каждый раз, и вода будет мягкой. Неоправданно дорогой, и в большой степени раскручен рекламой. Из этого вещества можно использовать таблетки для посудомоечной машины. Там его работа более наглядна, и более эффективна.
Как правило, химические вещества занимаются не только реагентным умягчением воды. Попутно они могут устранять бактерии, не дадут развиться илу на поверхностях. Так что свой резон применение подобных веществ имеет.
Обзор химических реагентов для умягчения воды
Реагент Аминат БП
 Первым рассмотрим работу амината БП. Данный реагент отлично блокирует рост иловых наростов на поверхностях. Справится Аминат БП и с порами и разного рода бактериями. Держит свои свойства в течении долгого времени и не грешит коррозионной активностью, что для водных систем крайне важно. При этом отличается сохранностью всех показателей на широком диапазоне температур и показаний кислотно-щелочного баланса. Аминат БП применяют в оборотных водных системах, а также для кондиционирования. Часто применяют это вещество для градирен. Оно не токсично для людей и животных. Впрыскивание такого вещества в бассейн или пруд можно осуществлять с помощью специальных насосов.
Первым рассмотрим работу амината БП. Данный реагент отлично блокирует рост иловых наростов на поверхностях. Справится Аминат БП и с порами и разного рода бактериями. Держит свои свойства в течении долгого времени и не грешит коррозионной активностью, что для водных систем крайне важно. При этом отличается сохранностью всех показателей на широком диапазоне температур и показаний кислотно-щелочного баланса. Аминат БП применяют в оборотных водных системах, а также для кондиционирования. Часто применяют это вещество для градирен. Оно не токсично для людей и животных. Впрыскивание такого вещества в бассейн или пруд можно осуществлять с помощью специальных насосов.
Реагент Гидроксид натрия
 Сода, едкий натрий или по научному - гидроксид натрия. Гидроксид натрия легко растворить, при этом достаточно просто открыть крышку сосуда, где он содержится. Он легко растворяется в воздухе. Когда его растворяют в воде, то идет бурная реакция и в воздух выделяется большое количество тепла. При этом хорошо контактирует с метанолом и этанолом, полностью в нем растворяясь. Жидкий аммиак и этиловый спирт на гидроксид натрия не влияет. Этот вид реагента очень часто применяют при создании различных замедлителей развития коррозии, и отложений солей. Его же применяют и для жидкостей, которые растворяют как органический, так и неорганический налет. Еще одна сфера применения гидроксида натрия - фильтр для устранения железистых соединений.
Сода, едкий натрий или по научному - гидроксид натрия. Гидроксид натрия легко растворить, при этом достаточно просто открыть крышку сосуда, где он содержится. Он легко растворяется в воздухе. Когда его растворяют в воде, то идет бурная реакция и в воздух выделяется большое количество тепла. При этом хорошо контактирует с метанолом и этанолом, полностью в нем растворяясь. Жидкий аммиак и этиловый спирт на гидроксид натрия не влияет. Этот вид реагента очень часто применяют при создании различных замедлителей развития коррозии, и отложений солей. Его же применяют и для жидкостей, которые растворяют как органический, так и неорганический налет. Еще одна сфера применения гидроксида натрия - фильтр для устранения железистых соединений.
Хлорку я думаю, знают все. Но ее задание, прежде всего, воду обеззаразить, а не умягчить. Да и остаточное включение хлора держится очень долго, что и обусловило его широкое использование в бассейнах, где купается большое количество людей и обеззараживать воду следует постоянно. Ядовитости хлора, это правда, не отменяло.
Реагент Гипохлорит натрия
 Но развитие не стоит на месте. И сегодня на смену ядовитому хлору пришел гипохлорит натрия. Его сегодня очень часто используют в очистных системах. Для реагентного умягчения воды он также подходит. Когда воду очищают с помощью гипохлорита, то включение железа после обработки составляет не больше 0,1 миллиграмма на литр. Плюс данного вещества в том, что когда стандартные методы обезжелезивания не работают, он помогает.
Но развитие не стоит на месте. И сегодня на смену ядовитому хлору пришел гипохлорит натрия. Его сегодня очень часто используют в очистных системах. Для реагентного умягчения воды он также подходит. Когда воду очищают с помощью гипохлорита, то включение железа после обработки составляет не больше 0,1 миллиграмма на литр. Плюс данного вещества в том, что когда стандартные методы обезжелезивания не работают, он помогает.
К недостаткам гипохлорита натрия относят сложность установки и ввода вещества в воду. За процессом нужно постоянно следить, а также контролировать размер вещества в воде. Как я уже говорила, многие вещества образуют другие образования, которые не так просто убрать. Так вот гипохлорит натрия, как раз кристаллизуется быстро и потому насос, впрыскивающий его в воду, часто нужно чистить от таких кристаллических отложений.
Нельзя использовать этот реагент бесконтрольно, он легко разлагается, его нужно, прежде чем использовать, немного отстоять. Помогает стимулировать создания хлопьевидных осадков, для улучшения отфильтровывания.
Коагулянты
 Еще один вариант вещества для очищения воды – коагулянт РАХ-18. Его применяют в качестве умягчителя, а также очистителя для сточных вод. Вот коагулянт как раз помогает объединить вредные примеси в осадительные белые хлопья. Потом их легко устранить с помощью осадительных фильтров. Такие вещества можно использовать только в пластмассовых приборах. Подойдет еще гуммированная сталь, стекловолокно из полиэфира и титан.
Еще один вариант вещества для очищения воды – коагулянт РАХ-18. Его применяют в качестве умягчителя, а также очистителя для сточных вод. Вот коагулянт как раз помогает объединить вредные примеси в осадительные белые хлопья. Потом их легко устранить с помощью осадительных фильтров. Такие вещества можно использовать только в пластмассовых приборах. Подойдет еще гуммированная сталь, стекловолокно из полиэфира и титан.
Очень часто в качестве очищающего вещества используют обычные коагулянты. Коагулянт - отличный восстановитель, особенно для фильтров-обезжелезивателей.
И еще один, наверное самый популярный коагулянт и восстановитель – соль в таблетках. Ее постоянно используют для восстановления промышленных ионообменных установок. Соль здесь используют не простую, хотя для восстановления ионообменных картриджей можно применять и обычную экстру, если припечет.
Так вот специальная очищенная соль представляет собой чистейший натрий, без примесей. Он не растворяется быстро, он постепенно насыщает собой воду, не преступая границ пресыщения. И распределяется по воде равномерно. Его не нужно размешивать.
Простой ионообменный фильтр для воды, в процессе умягчения никаких химических веществ не использует, а вот для восстановления да. Поэтому его и отнесли к реагентному умягчению воды. Картридж из пористой или гранулированной гелевой смолы задерживает в себе все вредоносные соли жесткости. Взамен отдает в воду натрий. Получается мягкая вода. Этот прибор один из самых лучших умягчителей. Если вам необходимо снизить процент жесткости, то подойдет как раз такое устройство, тем более, что очистить воду через установку можно несколько раз. Но при этом и отходов после него много.
Когда вы восстанавливаете ионообменную смолу для умягчения воды, то промывку делаете как раз сверхочищенной солью. И получается, что после восстановления отходы будут содержать сильносоленые включения, состоящие из соли концентрированной и солей жесткости. Просто так, выкинуть подобные отходы не получится. Нужно в обязательном порядке проводить доочистку отходов или опреснение. Да и разрешение получить придется. Это главные недостатки данного реагентного метода умягчения воды.
Однако более всего в мире принята следующая классификация веществ реагентного умягчения воды. Они делятся на флокулянты, комплексоны и коагулянты.
Комплексоны представляют собой органические вещества, которые вступая в реакцию с катионами, образуют прочные вещества. То есть попадая в воду с повышенной жесткостью, эти вещества хорошо растворяются, они безвредны для человека и прекрасно связывают катионы солей жесткости. Они создают внутри воды центры кристаллизации, куда соли жесткости и оседают, вместо стенок оборудования. Кроме того комплексоны помогут притормозить развитие коррозии на поверхностях.
Флокулянты нашли себя в очистке сточных вод. Как уже понятно, сточные воды - это те воды, которые уже определенный цикл прошли. Те же отходы после ионного обмена тоже можно отнести к сточным водам. И как раз справится с их проблемами, и помогают флокулянты. Они образуют хлопья устойчивых частиц, которые потом проще устранить. Флокулянты работают с нестабильными соединениями.
Популярны также в качестве реагентного метода умягчения воды и полифосфаты. Их применяют как подготовительный этап, после того, как воду очистят известью или содой. Использование при очистке флокулянтов помогает избежать дальнейшего применения ионного обмена.
Сульфиты и фосфаты дают самое главное – стабильность состава воды. Да и коррозия при таком составе идет куда медленнее. Больше всего используют ортофосфаты, гексаметофосфаты и фосфаты натрия. Последние чаще всего, используют для работы теплоносителей.
То есть не одними безреагентными способами можно умягчать воду. Не смотря на свой состав, но реагентное умягчение воды своих лидирующих позиций по-прежнему не сдает, тем более, что это самый простой и быстрый способ устранить лишнюю жесткость.
vodopodgotovka-vodi.ru
Реагенты для водоподготовки
АкваЩит - Водоподготовка
Работая с водой, зачастую приходится выбирать, как бороться с солями жесткости, коих в нынешней воде содержится в избытке. Процессы умягчения сегодня получили большое распространение. Как раз из-за того, что найти качественную воду, мягкую с нормальным показателем кислотно-щелочного баланса с каждым годом все сложнее и сложнее. Пребывание человечества на Земле отражается на экологии все острее.
Но умягчение воды подразумевает не только применение специальных фильтрующих установок. Так уж повелось, что многие современные приборы работают с использованием реагентов для водоподготовки. К тому же для определенных сфер жизни и отраслей промышленности обойтись без применения подобных химических веществ нельзя, даже с учетом установки водоподготовки.
 Так работа в бассейне подразумевает обязательное использование реагентов для водоподготовки. Не могут без них обойтись ионообменные умягчители, а также разного рода сорбционные фильтры и обезжелезиватели. И это при том, что удаление накипи проводить не надо, закупать средства для такого устранения тоже. Реагенты для водоподготовки по-прежнему актуальны.
Так работа в бассейне подразумевает обязательное использование реагентов для водоподготовки. Не могут без них обойтись ионообменные умягчители, а также разного рода сорбционные фильтры и обезжелезиватели. И это при том, что удаление накипи проводить не надо, закупать средства для такого устранения тоже. Реагенты для водоподготовки по-прежнему актуальны.
Рассматривая более подробно виды используемых в системе умягчения воды реагентов, рассмотрим, как работает система очищения воды и какие фильтры могут применяться на этих этапах. Также скажем пару фраз о целесообразности устранения излишков жесткости воды.
Использование грязной воды может вылиться во множество негативных последствий. Вы будете использовать намного больше топлива или электричества. Есть высокий риск остаться без дорогостоящего оборудования. Постоянные чистки приведут к сокращению срока эксплуатации приборов. Из-за жесткой воды вы будете использовать гораздо больше моющих средств, т.к. она плохо их растворяет.
Для солей жесткости нет особой разницы, где оседать. Будут это ваши внутренние органы или волосы, им все равно. Образовывать накипь и вредить соли жесткости могут на любых поверхностях. Потому для человеческого здоровья излишняя жесткость излишне вредна. С использованием и потреблением подобной воды, вы можете нажить себе и язву, и хронический пиелонефрит.
Для промышленности применение подобной воды выливается в бешенные просто расходы на электроэнергию. Но главное, из-за плохой передачи тепла, промышленное оборудование, вместе с бытовыми приборами пачками выходит из строя. Не пропуская тепло, накипь заставляет всю мощь нагрева застревать внутри поверхности. Она начинает раскалять себя. Не в состоянии отдать тепло дальше, материал поверхности трескается, в лучшем случае, в худшем – промышленное оборудование разрывает. Часто при неправильной очистке поверхностей от накипи такое явление происходит в котельных.
Поэтому водоподготовка что для квартиры, что для собственного дома или крупного производства нужна. Только вот в быту наши люди еще не дошли до той степени восприятия вреда от использования жестковатой воды, чтобы не стремиться экономить на водоочистке. В промышленности же, особенно в таких отраслях, как микроэлектроника или производство любых напитков обойтись без системы водоподготовки для коттеджа нельзя. Они часть производственного процессе иногда и сам основной процесс.
С актуальностью и насущностью реагентов для водоподготовки в свете самой системы немного разобрались. Теперь, в качестве краткого вводного курса – состав системы водоочистки. Постараюсь привести пример наиболее наполненной системы, чтобы было понятно, на каких этапах могут применяться реагенты для водоподготовки.
Начинают подготовку воды с механической чистки. Эта ступень есть всегда, когда забор воды ведется из реки, озера, в общем, из любых источников без предварительной очистки, или же очистки централизованной. Здесь из воды устраняют любые твердые загрязнения, вплоть до песчинок.
После того, как все твердые включения удалены, не мешало бы устранить запах из воды. Вот в таких сорбционных фильтрах очень часто применяют разнообразные реагенты для водоподготовки. Но о них чуть позже.
После устранения запаха, из воды убирают излишки железа и бактерии с вирусами. Здесь также могут использовать фильтрующий песок, который поможет удержать железистые примеси. Для дезинфекции больше всего используют реагенты для водоподготовки. Собственно основное назначение реагентов – дезинфекция. Поэтому здесь очень много разных веществ применяют, и мы постараемся просмотреть самые основные.
После дезинфекции уже наступает пора умягчения воды. Здесь могут устанавливать самые разные фильтрующие установки. Если говорить об тех же реагентах, то их могут использовать в химических умягчителях воды. В качестве примера можно привести ионообменный фильтр для воды, который восстанавливается с помощью сильно соляного раствора, в качестве реагента для водоподготовки.
Здесь также могут установить электромагнитный умягчитель воды АкваЩит, он идеально подходит для обработки воды в теплоэнергетике или собственном доме. Но фильтрующих элементов в этой установке нет. Реагенты при его работе не используются, в чем собственно его основной плюс эксплуатации в подобных отраслях.
Другой вариант применяемых фильтров – ультрафильтрация, микрофильтрация с помощью обратного осмоса и других мембранных устройств. Здесь могут использоваться реагенты для водоподготовки, но только в определенных моделях устройств. И заканчивается вся система очистки от нежелательных примесей фильтром-кондиционером. Если того требует итоговое состояние воды. Такой фильтр устанавливают в том случае, когда в конце нужно получить качественную питьевую воду. Причем вода должна быть не только мягкой, но и полезной.
Основные виды реагентов для водоподготовки
Медленно, но верно, мы добрались к рассмотрению основных видов реагентов для водоподготовки. Применение таких веществ, не просто помогают очищать воду, они выполняют куда более широкую функцию. С их помощью поддерживается на должном уровне водно-химический режим бассейнов, приборов умягчения, охлаждения на производстве. Любая сложная система подготовки воды без химических вкраплений не будет работать столь эффективно, во многих направлениях. Заменить реагенты может только таблетированная соль для умягчения воды и купить ее можно везде сейчас.
Как я уже говорила, добавление в воду реагентов для водоподготовки поможет качественно улучшить осветление воды. Все реагенты можно разделить на следующие группы – коагулянты, флокулянты, антискаланты, биоциды. Еще есть группа специальных моющих веществ, которые используют для очистки мембран в том же обратном осмосе.
- Особняком стоят реагенты с определенным целевым назначением. Одни используются для парового котельного оборудования, другие для открытых и закрытых систем охлаждения, И наконец есть еще группа реагентов для водоподготовки теплообменных устройств.Задача коагулянтов состоит в том, чтобы поспособствовать быстрому слипанию мелких частичек. Они становятся в процессе слипания большими по размеру, потом эти частицы быстрее оседают. И так же легче вымываются из системы.
- Флокулянты служат для ускорения соединения неустойчивых частиц. Таким образом, в воде быстрее образуются белые хлопья, которые легче отфильтровываются. Флокулянты как раз необходимы для осветления воды. С их помощью производительность фильтров-осветлителей повышается.
- Антискаланты позволяют убрать умягчение из водоподготовки перед системой обратного осмоса. Да и срок использования мембран эти реагенты для водоподготовки значительно продлевают. Часто их также применяют для поддержания на определенном уровне химического состояния воды в системах охлаждения. При этом использование антискалантов помогает предотвратить образование накипи в таких промывочных системах и тоже способствует увеличению производительности систем.
- Отдельный вид реагентов для водоподготовки составляют специальные моющие средства, предназначенные для очистки тонких и чувствительных мембран в любых мембранных фильтрах для воды. Естественно, когда мембраны находятся постоянно в работе, то спустя время они забиваются примесями разного рода. Кроме того, на мембранах, из-за фильтрации и бактерий с вирусами может образовываться и развиваться биопленка. С помощью специальных реагентов для водоподготовки, вы быстро растворите эту пленку и мембрана снова начнет работать, как новая. При этом целостность мембран сохраняется.
- Следующим популярным видом реагентов являются биоциды. Их прямое назначение пруды, бассейны. Эти вещества не дают развиваться эрозии, и наростам различных иловых биологических отложений. Биоциды облюбовали бактерии, грибки, плесень, почти все виды микроорганизмов. Они прекрасно с ними справляются и что немаловажно за короткое время.
- В качестве реагентов для водоподготовки в паровых котельных, где, кстати требования к качеству получаемого пара очень и очень жесткие, чаще всего используют смесь различных аминов. Они должны в обязательном порядке работать с любым видом котлов и кондиционеров. Амины не производят в первозданном виде. Их получают смешиванием нескольких веществ. После получения такой смеси, обязательно ее тестируют. Амины должны легко устранять или нейтрализовать угольную кислоту в воде. Этот же реагент должен в процессе работы создавать на поверхностях углеродистой стали незаметную, но очень полезную магнитную пленку, которая будет защищать поверхности оборудования от коррозии и отложений накипи.
Следующая группа видов реагентов служит для защиты систем охлаждения двух видов – открытого и закрытого. Оборотные системы водоснабжения зависят от качества исходной воды очень сильно. Мало того, вода будет работать тем эффективнее, чем дольше она будет оставаться качественной после оборотов, чем постоянее химический состав оборотной воды, тем дольше и качественнее работает оборотная система.
Что может по препятствовать качественной работе таких систем? Естественно, это образование коррозии и ее остатки в системе, шлам, биологические наросты, тот же ил можно сюда отнести. Все это значительно снижает КПД работы системы. Да и эксплуатационные расходы на постоянные чистки системы растут. Добавьте сюда ускорившийся процесс износа деталей оборудования в системе. Если же в оборотной системе разработать и установить фильтры для водоподготовки, хотя бы с использованием реагентов для умягчения, это уже решит процентов 80-90 всех проблем.
И еще одна группа реагентов для водоподготовки – это группа веществ, которые служат защитой для теплообменников. Для этого также есть специальные вещества, которые максимально эффективно работают в сложном теплообменном оборудовании. Очень часто реагенты представлены смесью ортофосфарной кислоты и активных комплексонов.
Плюсы использования химических реагентов для водоподготовки
- Отлично чистит поверхности разборных теплонасосов и паяных моделей насосов, компрессоров и конденсаторов, маслоохладителей, любых приборов систем охлаждения;
- нет агрессивных реакций при контакте с нержавейкой, медью или их сплавами;
- реагенты отлично устраняют ржавчину с окалиной, а также накипные отложения.
Такие реагенты для водоподготовки лучше всего разводить с водой в пропорциях – один к трем или пяти. Промывать стоит по-разному, в зависимости от степени загрязнения. Такая чистка может продлиться от 2 до 10 часов. При работе этих веществ, следует гарантировать в системе постоянную циркуляцию и статическое травление. Плюсом котловых реагентов является тот факт, что они не вредные для человеческого здоровья и могут разлагаться внутри котлов, не оставляя после себя какие-либо следы. Это огромный плюс в пользу таких реагентов.
Реагенты, применяемые для водогрейного котельного оборудования немного отличаются от них же, но для паровых котлов. Задача подготовки воды для котлов состоит еще и в том, чтобы устранить из воды излишки растворенных газообразных веществ в воде. Для этого очень часто используют деаэраторы. Это вещества способные поспособствовать выведению из воды растворенного кислорода, который крайне негативно влияет на котельное оборудование.
Уровень содержания кислорода в котельном оборудовании не должно превышать 20-50 мкг на литр. Чтобы устранить излишек содержания растворенного кислорода, как раз и используют реагенты для водоподготовки котлов, которые называются редукторами кислорода.
 Такие вещества вступают в реакцию с растворенным кислородом и делают его неактивным. Коррозионная активность водных ресурсов при этом значительно снижается. Применение таких веществ дает значительное улучшение, и стабильность работы котла. Плюс снижение колебаний концентраций кислорода в воде дает возможность получать качественный пар без перепадов значений.
Такие вещества вступают в реакцию с растворенным кислородом и делают его неактивным. Коррозионная активность водных ресурсов при этом значительно снижается. Применение таких веществ дает значительное улучшение, и стабильность работы котла. Плюс снижение колебаний концентраций кислорода в воде дает возможность получать качественный пар без перепадов значений.
Чтобы поддерживать показатель содержания кислорода в воде на нужном уровне необходимо установить в системе подготовки воды дозатор, который автоматически с определенной периодичностью будет впрыскивать в систему такие редукторы кислорода.
Из реагентов для водоподготовки можно еще отметить нейтрализаторы конденсата. В процессе работы с подпиточной жестковатой водой в системе выделяется углекислый газ. И все бы ничего, кабы в процессе работы воды и газа не образовывалась угольная кислота. Она очень способствует коррозионной активности, образующегося конденсата на поверхностях. Это потом приводит к резкому сокращению срока службы трубопроводов.
Из всего вышеперечисленного можно сделать вывод, что одного химического умягчения воды для создания надежной защиты от жесткости в воде будет недостаточно. Так или иначе, но обойтись без специальных реагентов, особенно в теплоэнергетике и в системах тонкой очистки не обойтись. Поэтому так важно знать и понимать, какие вещества, сегодня используются для этих целей. Тогда и процесс производства будет защищен от вредных примесей, еще на стадии проектировки системы подготовки воды. Мы рассмотрели минусы и плюсы использования реагентов для водоподготовки. Продолжение смотрите в следующей нашей статье.
vodopodgotovka-vodi.ru
Вода как реагент и как среда для химического процесса (аномальные свойства воды)
Вятский Государственный Гуманитарный Университет
Химический факультет
Реферат по дисциплине :
Химия
«Вода как реагент и как среда для химического процесса (аномальные свойства воды)»
Выполнила студентка I курса
Химического факультета
Учебной группы ЭПБ – 11
Мисюкевич Дарья Анатольевна
Преподаватель:
к.п.н Даровских Л.В.
Киров 2013
План:
- Введение
- Структура молекул воды
- Химические свойства воды
1.Введение
Вода́ (оксид водорода) — бинарное неорганическое соединение, химическая формула Н2O. Молекула воды состоит из двух атомов водорода и одного — кислорода, которые соединены между собой ковалентной связью. При нормальных условиях представляет собой прозрачную жидкость, не имеет цвета (в малом объёме), запаха и вкуса. В твёрдом состоянии называется льдом, снегом или инеем, а в газообразном — водяным паром. Вода также может существовать в виде жидких кристаллов (нагидрофильных поверхностях).
Около 71 % поверхности Земли покрыто водой (океаны, моря, озёра, реки, льды) — 361,13 млн км. На Земле примерно 96,5 % воды приходится на океаны, 1,7 % мировых запасов составляют грунтовые воды, ещё 1,7 % на ледники и ледяные шапки Антарктиды и Гренландии, небольшая часть в реках, озёрах и болотах, и 0,001 % в облаках (образуются из взвешенных в воздухе частиц льда и жидкой воды). Бо́льшая часть земной воды — солёная, и она непригодна для сельского хозяйства и питья. Доля пресной составляет около 2,5 %, причём 98,8 % этой воды находится в ледниках и грунтовых водах. Менее 0,3 % всей пресной воды содержится в реках, озёрах и атмосфере, и ещё меньшее количество (0,003 %) находится в живых организмах.
Является хорошим сильнополярным растворителем. В природных условиях всегда содержит растворённые вещества (соли,газы)
Вода имеет ключевое значение в создании и поддержании жизни на Земле, в химическом строении живых организмов, в формировании климата и погоды. Является важнейшим веществом для всех живых существ на планете Земля.
На Земле происходит непрерывный круговорот воды, включающий использование воды на бытовые и производственные нужды человека, использование воды растениями и животными, испарение воды и фильтрацию ее через почву многое другое. Характер процессов, протекающих с участием воды, во многом определяется ее свойствами как индивидуального вещества. Вода – самое удивительное соединение на Земле.
2.Внутренняя структура молекул воды
Вода (оксид водорода) h3O − простейшее устойчивое соединение водорода с кислородом. Молекулярная масса воды 18,0160, на водород приходится 11,19 % по массе, а на кислород – 88,81 %.
Восемь электронов внешнего электронного слоя атома кислорода образуют четыре электронные пары, из которых 2 создают ковалентные связи О−Н, а две другие представляют собой неподеленные электронные пары.
С современных позиций строения атома электронное облако молекулы воды имеет вид усеченного четырехлопастного винта, который может быть размещен в неправильном кубе (неправильный тетраэдр). Атом кислорода оказывается при этом в центре, а два атома водорода − в противоположных
углах одной из граней куба. Угол между ними составляет 104°31'. Два из восьми электронов атома кислорода расположены около ядра, два других связаны с атомами водорода, а две неподеленные пары электронов образуют ветви, расположенные в противоположном направлении по отношению к электронным облакам водородов. Таким образом, электронное облако молекулы воды имеет вид
четырех лепестков, направленных к вершинам неправильного тетраэдра. В двух вершинах одной грани находятся электронные пары, осуществляющие связь О—Н, а в двух вершинах противоположной грани находятся неподеленные электронные пары атома кислорода .Электронное облако в молекуле воды смещается к атому кислорода, так как он имеет большую электроотрицательность. Вследствие этого вблизи ядер атомов водорода создается избыток положительного заряда. Поэтому молекула воды полярна. Полярные молекулы характеризуются электрическим моментом диполя, который влияет на свойства веществ, состоящих из таких молекул. Электрический момент диполя представляет собой произведение одного из зарядов на расстояние между центрами положительного и отрицательного заряда. Расстояние между ними составляет 0,9568 Å. Для воды электрический момент диполя p = el равен 6*10-28 Кл-м или 1,8 дебая (1,8 * 10-18 ед. СГСЭ).Благодаря большому значению электрического момента диполя между молекулами воды проявляется сильное взаимодействие за счет образования водородных связей между атомом кислорода одной молекулы воды и атомом водорода другой. Водородная связь возникает в результате внедрения очень малого по мразмерам положительно поляризованного атома водорода одной молекулы в электронную оболочку отрицательно поляризованного атома кислорода другой молекулы воды. Длина водородной связи О ... Н изменяется в пределах от 1,76 А. Энергия ее составляет 17—33 кДж/моль.
Возникновение водородной связи объясняется свойством атома водорода взаимодействовать с сильно электроотрицательным элементом, например с кислородом другой молекул воды. Такая особенность водородного атома обусловливается тем, что, отдавая свой единственный электрон на образование ковалентной связи с кислородом, он остается в виде ядра очень малого размера, почти лишенного электронной, оболочки. Поэтому он не испытывает отталкивания от электронной оболочки кислорода другой молекулы воды, а, наоборот, притягивается ею, и может вступить с нею во взаимодействие. Следует отметить, что согласно принятым представлениям водородную связь нельзя рассматривать как чисто электростатическую. Согласно методу молекулярных орбиталей водородная связь образуется за счет дисперсионных сил, ковалентной связи и электростатического взаимодействия.
Каждая молекула воды может образовать четыре водородных связи: две возникают при взаимодействии неподеленных электронных пар атома кислорода с атомами водорода соседних молекул воды и две дают атомы водорода, взаимодействующие с атомами Существованием водородных связей объясняется аномально высокая температура плавления воды по сравнению с водородными соединениями аналогов кислорода (h3S, h3Se, h3Te). Водородные связи и донорно-акцепторные взаимодействия способствуют возникновению высокой упорядоченности внутренней структуры в жидкой воде. Водородные связи обусловливают высокое внутреннее давление, которое и способствует появлению у воды некоторых особых свойств
3.Химические свойства воды
Вода является наиболее распространённым растворителем на планете Земля, во многом определяющим характер земной химии, как науки. Большая часть химии, при её зарождении как науки, начиналась именно как химия водных растворов веществ. Её иногда рассматривают, как амфолит — и кислоту и основание одновременно (катионH+ анион OH−). В отсутствие посторонних веществ в воде одинакова концентрация гидроксид-ионов и ионов водорода (или ионов гидроксония), pKa ≈ 16.
Вода — химически активное вещество. Сильно полярные молекулы воды сольватируют ионы и молекулы, образуют гидраты и кристаллогидраты. Сольволиз, и в частности гидролиз, происходит в живой и неживой природе, и широко используется в химической промышленности.
- Воду можно получить в ходе реакций:
- В ходе реакций нейтрализации:
- Восстановлением оксида меди водородом :
- Вода реагирует при комнатной температуре:
- С активными металлами (натрий, калий, кальций, барий и др.)
- Со фтором и межгалоидными соединениями
(при низких температурах)
- С солями, образованными слабой кислотой и слабым основанием, вызывая их полный гидролиз:
- С ангидридами и галогенангидридами карбоновых и неорганических кислот
- С активными металлорганическими соединениями (диэтилцинк, реактивы Гриньяра, метилнатрий и т. д.)
- С карбидами, нитридами, фосфидами, силицидами, гидридами активных металлов (кальция, натрия, лития и др.)
- Со многими солями, образуя гидраты
- С боранами, силанами
- С кетенами, недоокисью углерода
- С фторидами благородных газов
Вода реагирует при нагревании:
- С железом, магнием:
- с углем, метаном:
- С некоторыми алкилгалогенидами
Вода реагирует в присутствии катализатора:
- с амидами, эфирами карбоновых кислот
- с ацетиленом и другими алкинами
- с алкенами
- с нитрилами
- Разложение в образование воды в биосфере
Для одних и тех же атомов водорода и кислорода вода не является постоянной формой нахождения. Растения в процессе фотосинтеза разлагают воду . выделяя кислород в атмосферу. Разложение воды происходит в условиях биосферы и при процессах химического выветривания минералов. К числу наиболее распространенных среди них относятся силикаты . Их изменения в условиях биосферы можно выразить реакцией:
2Ca [Al2Si2O8] + 6 h3O = Al4 [Si4 O15] (OH) 4 + 2Ca2+ + 4OH-
Выветривание других силикатов ,а также сульфидов , карбонатов, сульфатов тоже идет с разложением воды.
Существенное влияние на растворимость минералов оказывает широко распространенная в биосфере углекислота. Однако в её присутствии продолжается разложение воды:
Аномалии воды
Химически чистая вода обладает рядом свойств, резко отличающих ее от других природных тел и химических аналогов (гидридов элементов 6 группы периодической системы Менделеева) и от других жидкостей. Эти особые свойства известны под названием аномалии воды.
Исследуя воду и, особенно ее водные растворы, ученые раз за разом убеждались, что вода обладает ненормальными — аномальными свойствами, присущими только ей, ее Величеству — Воде, подарившей нам Жизнь и возможность мыслить. Мы даже и не подозреваем, что столь привычные и естественные свойства воды в природе, в различных технологиях, наконец, в обыденной жизни нашей являются уникальными и неповторимыми.
Плотность
- Для всей биосферы исключительна важной особенностью воды является ее способность при замерзании увеличивать, а не уменьшать свой объем, т.е. уменьшать плотность.
- Действительно, при переходе любой жидкости в твердое состояние молекулы располагаются теснее, а само вещество, уменьшаясь в объеме, становится плотнее. Да, для любой из необозримо разных жидкостей, но не воды. Вода здесь представляет исключение.
- При охлаждении вода сначала ведет себя как и другие жидкости: постепенно уплотняясь, уменьшает свой объем. Такое явление можно наблюдать до +3,98 °С. Затем, при дальнейшем снижении температуры до 0 °С, вся вода замерзает и расширяется в объеме. В результате удельный вес льда становится меньше воды и лед плавает. Если бы лед не всплывал, а тонул, то все водоемы (реки, озера, моря) промерзли бы до дна, испарение бы резко сократилось, все пресноводные животные и растения погибли бы. Жизнь на Земле стала бы невозможной.
- Вода — единственная жидкость на Земле, лед которой не тонет за счет того, что его объем на 1/11 больше объема воды.
Поверхностное натяжение
- Благодаря тому, что круглые шарики воды очень упруги, идет дождь, выпадает роса.
- Что же это за удивительная сила, которая сохраняет капли росы, а поверхностный слой воды в любой лужице делает эластичным и относительно прочным?
- Известно, что если стальную иголку осторожно положить на поверхность воды, налитой в блюдце, то иголка не тонет. А ведь удельная масса металла значительно больше, чем у воды. Молекулы воды связаны силой поверхностного натяжения, которая позволяет им подниматься вверх по капиллярам, преодолевая силу земного притяжения. Без этого свойства воды жизнь на Земле была бы также невозможна.
yaneuch.ru
|
|
 |
|
 |
Химводоподготовка
Коррекционная обработка воды реагентами, химводоподготовка
К числу наиболее эффективных и эргономичных технологий по химводоподготовке можно отнести коррекционную обработку специальными реагентами: ингибиторами коррозии, биоцидами, антискалантами (реагентами от отложений). В процессе эксплуатации паросилового хозяйства оборудование постепенно загрязняется, подвергается действию коррозии, появляется накипь и разнообразные минеральные отложения. Отсутствие своевременных мер по химводоподготовке может привести к снижению КПД теплосетей, выходу из строя оборудования, частому и затратному ремонту и пр. Использование специальных комплексонатов позволяет предотвратить процессы коррозии и накипеобразования, продлить срок службы оборудования и увеличить его рентабельность.
Особенности использования реагентов
Химводоподготовка, как правило, включает обработку специальными реагентами воды для следующих типов оборудования:
систем производства пара;водогрейных котлов;теплосетей;систем охлаждения;систем оборотного водоснабжения;систем кондиционирования;систем отопления.
Комплексный реагент для водоподготовки Advantage K 350 B, предназначенный для водогрейных котлов и тепловых сетей, обеспечивает стабилизацию ключевых показателей в процессе химводоподготовки, т.е. эффективно препятствует процессам образования накипи и коррозии. В частности, реагенты позволяют выровнять уровень кислотности и нейтрализовать кислород в системе, который и является одной из причин коррозии. Помимо этого современные реагенты для водоподготовки позволяют стабилизировать и связать соединения и вещества, негативно влияющие на состояние систем водоснабжения.
Современные реагенты, производства компании Ashland относятся к классу пожаровзрывобезопасных реагентов, что позволяет использовать их как в системах открытого водозабора, так и в замкнутых циклах. Следует особо отметить низкий уровень токсичности ингибиторов, использование которых наиболее целесообразно.
Коррекционная обработка воды для паровых и водогрейных котлов, защита от накипи
Основными критериями выбора водоподготовки для парового котла являются его рабочее давление и конструкция, причем, чем выше давление, тем более жесткие требования предъявляются к очистке воды и защиты от накипи. Наиболее правильно ориентироваться на те требования, которые предъявляются поставщиками котельного оборудования в проектной документации. При отсутствии таких требований в проекте следует их запросить и только в случае отказа руководствоваться требованиями ПУБЭ.
В подавляющем большинстве случаев поверхностная вода и вода из скважин, а также муниципальная вода, не соответствуют предъявляемым требованиям.
Этапы водоподготовки, их последовательность зависят от конкретного вида и концентраций примесей в источнике водоснабжения, а также желаемого качества воды.
Основные проблемы, возникающие в системах производства пара:
коррозия
накипеобразование или накипь
формирование отложений
С целью избежать возникновения эксплуатационных проблем используют водоподготовку, которая состоит в общем случае из:
Докотловая обработка
Обработка воды: подпиточной, конденсата, или и той и другой вместе взятой, до поступления в котел с целью удаления из нее солей жесткости (или всех солей), взвешенных частиц, кремния, кислорода и углекислого газа.
Внутрикотловая обработка
Обработка воды: питательной, котловой, а также пара и конденсата при помощи корректирующих химреагентов.
Продувка
Слив части воды из котла для поддержания определенного уровня солесодержания и концентрации химикатов в котловой воде по отношению к питательной воде.
КОРРОЗИЯ
Коррозия – это химическое повреждение металла. Кислород и углекислый газ, растворенные в воде, являются основными причинами коррозии, поэтому содержание этих элементов должно быть сведено к минимуму. Кислородная коррозия возникает в самом котле, а также в паро- и конденсатопроводах.
Углекислотная коррозия имеет место, в основном, в конденсатной системе. При конденсации пара, образуется углекислота, которая растворяет железо в металле конденсатопровода, приводя к его преждевременному износу. Коррозионное железо попадает в деаэратор, а затем с питательной водой и в котел, где образует отложения, приводящие к выходу жаровых труб из строя.
ПРЕДОТВРАЩЕНИЯ КОРРОЗИИ
Для удаления кислорода и углекислого газа из питающей воды применяются деаэраторы различных конструкций. Применение деаэратора позволяет существенно снизить содержание свободного кислорода (до 0,02 мг/л), остальное же количество должно связываться химическим способом. Для успешного удаления кислорода из питающей воды используются комплексные реагенты для водоподготовки или специальные реагенты для водоподготовки, предназначенные только для связывания кмслорода.
УГЛЕКИСЛОТНАЯ КОРРОЗИЯ
Даже полностью удалив CO2 в деаэраторе, углекислый газ может впоследствии образуется в котле за счет присутствия в питательной воде гидрокарбонатов HCO3-, распадающихся под воздействием высоких температур.
ПРЕДОТВРАЩЕНИЕ УГЛЕКИСЛОТНОЙ КОРРОЗИИ В КОНДЕНСАТНОМ ТРАКТЕ
Причиной образования свободного углекислого газа является недостаточный уровень рН воды, пара или конденсата. Для предотвращения углекислотной коррозии в конденсатном тракте используются специальные, летящие с паром реагенты. Использование комплексных реагентов Ashland позволяет предотвратить углекислотную коррозию, а также связать остаточный кислород и предотвратить образование отложений и накипи.
НАКИПЬ И ОТЛОЖЕНИЯ РАЗЛИЧНЫХ ТИПОВ
Образование накипи происходит вследствие разложения бикарбонатов кальция и магния при воздействии высокой температуры.
Наличие накипи на поверхностях теплообмена приводит к снижению эффективности работы котлов, образованию участков с очень высокой температурой, неравномерному перегреву и выходу жаровых труб из строя.
Как правило, большинство котельных агрегатов работает на питательной воде хорошего качества с общей жесткостью 0,002-0,02 мг-экв/л. Но даже использование такой воды без дополнительной коррекционной обработки не решит проблему накипеобразования.
Возникновение отложений может происходить вследствие коррозии из продуктов коррозии. Поэтому при наличии отложений следует однозначно убедиться, отчего они образуются. Наша компания проводит анализ систем водоподготовки с целью выявления эксплуатационных проблем.
Причиной отложений может также оказаться присутствие в воде после докотловой обработки органических соединений типа гумусовых кислот. Отложения такого типа часто возникают в зонах с пониженной циркуляцией.
Наша компания подберет реагенты для водоподготовки, химводоподготовку, сопутствующее дозирующее оборудование, а также обучит персонал вашей компании работе с данной технологией. КОНТАКТЫ
akva-kompozit.ru
Реагенты для водоподготовки и водоочистки
Оглавление
Часть 1. Введение
1.1 Качество воды
1.2 Источники водоснабжения
1.3 Использование воды
1.4 Технологические проблемы, связанные с использованием воды
Образование отложений
Коррозия металлических поверхностей
Биологическое обрастание
1.5 Промышленная водоподготовка
Часть 2. Объем использования и водоотведения воды в России
2.1. Общие показатели водопользования и водоотведения
2.2. Показатели забора и использования воды по субъектам РФ
2.3. Объем оборотной и последовательно используемой воды
2.4. Объем сброса сточных вод по субъектам РФ
Часть 3. Основные сегменты и реагенты для подготовки и очистки воды
3.1. Основные направления водоподготовки и водоочистки с использованием реагентов
Подготовка и очистка свежей воды
Коррекционная обработка котловой воды, систем тепло- и горячего водоснабжения
Обработка систем охлаждения и оборотного водоснабжения
Обработка сточных вод
Обработка установок обратного осмоса
3.2. Реагенты для очистки и подготовки воды
Коагулянты
Флокулянты
Ионообменные смолы
Гипохлориты натрия и кальция
Биоциды
Ингибиторы коррозии и отложений
Поглотители кислорода
Пеногасители
Прочие
Часть 4. Внешнеэкономические поставки реагентов в 2013-2017 гг.
4.1. Импорт реагентов
Общие показатели импорта
Коагулянты
Флокулянты
Ингибиторы коррозии и солеотложений
Биоциды
Ионообменные смолы
Поглотители кислорода
Прочие реагенты
4.2. Экспорт реагентов
4.3. Основные производители импортных реагентов
1. Kemira
2. SNF Group
3. Nalco
4. BASF SE
5. Dow Chemical
6. Lanxess
7. Ge Water & Process Technologies
8. Purolite
9. Shandong Dongda International Trading
10. Vidar Water Industrial Co. Ltd
11. Solenis International
12. Jurby Watertech (Джурби ВотэТек)
13. ПАО «Азот»
14. ПАО «Мариупольский Металлургический Комбинат Им Ильича»
15. BK Giulini GmbH («БК Джюлини»)
16. UAB «Arionex LT»
17. Oy Banmark Ab
18. ООО «Технохимреагент»
19. Thermax
Часть 5. Показатели производства реагентов в России
5.1. Региональная структура производства в России
5.2. Общие показатели производства
5.3. Производство реагентов в зависимости от механизма действия
1. Коагулянты
2. Флокулянты
3. Ингибиторы
4. Ионообменные смолы
5. Гипохлорит натрия и кальция
6. Биоциды
5.4. Основные производители реагентов для очистки и подготовки воды
Ингибиторы (коррозии, отложений)
1. ООО «НТЦ Салаватнефтеоргсинтез»
2. ООО ХГ «Основа» (ГК «Миррико»)
3. ООО «КОЛТЕК-ЭкоХим» (Группа Компаний КОЛТЕК)
4. ООО «Лаборатория Водных технологий» (ООО «ВТЛ»)
5. ООО «Фирма Аквахим»
6. ЗАО «НИИЭПМ»
7. ОАО «Химический завод им. Л. Я. Карпова»
8. ООО «Гидротехинжиниринг»
9. ООО «Аквилон»
10. ООО «Аква-Хим»
11. ООО «Аква-Кемикал»
12. ООО «НПФ Траверс»
13. ООО «Экоэнерго»
14. ООО «Инженерно-технологический центр ОРГХИМ»
15. ООО «НПО «Агротех»
16. ООО «ВОДЭКО»
17. ООО «НПО Экотехнологии»
18. ООО «Компания «Налко»
19. Jurby Watertech (Джурби ВотэТек) 20. ПАО «Химпром», г. Новочебоксарск
21. ОАО ХК «Нитон»
22. ООО «ЭкоХимРеагент»
23. ООО «ТехноХимПром»
Биоциды
24. ООО «НПО «Софэкс-Химзащита» (ЗАО НПК «СОФЭКС»)
25. ОАО «НПО «Технолог»
Коагулянты
26. ОАО «Аурат»
27. ООО «Метахим»
ООО «Аква-Реагент»
ООО «Алхим»
ООО «Урал-Коагулянт»
28. ООО НПО «Завод химических реагентов»
29. ООО «ЭФ «Вода Евразии»
30. ООО «Сибресурс»
31. АО «СИТТЕК»
32. ООО «Северхимпром» г. Череповец
33. АО «Сорбент»
34. АО «Бром»
35. ЧАО «Крымский ТИТАН»
36. ООО «Даль-Оха»
37. ООО «Ишимбайский специализированный химический завод катализаторов»
38. ООО «Химпродукт»
39. ООО «Харвест»
Флокулянты
40. ООО «Акрипол»
41. ООО «Полифлок»
42. ФКП «Завод имени Я. М. Свердлова»
43. ЗАО «Соленис Технолоджис МСП»
44. ООО «Химсинтез»
45. ООО «СНФ Восток» (Планируют производить)
Ионообменные смолы
46. ООО ПО «Токем»
47. ПАО «Уралхимпласт»
Гипохлорит кальция и натрия
48. АО «Башкирская содовая компания» (ранее ОАО «Каустик», Стерлитамак) (ГК «Башхим»)
49. ООО «ПО Химпром» г. Кемерово
50. ООО «Сода-Хлорат»
51. ОАО «Соликамский магниевый завод»
52. ООО «Мегалит»
53. ООО Новомосковский Хлор» (Еврохим)
54. ООО «Скоропусковский Синтез» (ООО НПФ «Бурсинтез-М»)
Прочие и потенциальные
55. ЗАО «Экспериментальный Химический Завод»
56. ОАО «Казанский завод синтетического каучука»
57. ООО «Экова»
58. ООО «Пента Силикон»
59. ООО «ТехноГаз-НК»
60. ООО «Казанский завод химических реагентов»
61. ООО «НПО БиоМикроГели» (Планируют производить)
62. Прочие
Часть 6. Показатели закупок реагентов в 2014-2017 гг.
Часть 7. Объем и структура потребления реагентов
7.1. Общие показатели рынка реагентов
Расчетное потребление
Видимое потребление
7.2. Объем рынка в зависимости от назначения реагентов
Коагулянты
Флокулянты
Ионообменные смолы
Ингибиторы (коррозии, солеотложений, биоциды)
Гипохлориты (натрия, кальция)
Поглотители кислорода
Прочие
7.3. Объем рынка в зависимости от сегмента потребления
Подготовка свежей воды
Обработка систем охлаждения и оборотного водоснабжения
Коррекционная обработка котловой воды, систем тепло- и горячего водоснабжения
Обработка сточных вод
Реагенты для мембранных технологий
7.4. Основные отрасли потребления реагентов
Производство и распределение электроэнергии, газа и воды
Производство нефтепродуктов
Химическое производство
Целлюлозно-бумажное производство
Металлургическое производство
Производство машин и оборудования
Добыча полезных ископаемых
Пищевая
7.5. Крупнейшие потребители реагентов
1. АО «Мосводоканал»
2. ГУП «Водоканал Санкт-Петербурга»
3. ОАО «Ярославльводоканал»
4. ОАО «Российские коммунальные системы» (ОАО «РКС-Менеджмент»)
5. ОАО «Нижегородский водоканал»
6. ООО «Челныводоканал»
7. МУП «Водоканал», г. Екатеринбург
8. МУП ЖКХ «Вологдагорводоканал»
9. МУП г. Костромы «Костромагорводоканал»
10. АО «ПО «Севаш»
11. МУП г. Ижевска Ижводоканал
12. МУП «Водоканал» г. Архангельск
13. МУП «Водоканал», г. Череповец
14. УМУП «Ульяновскводоканал»
15. МУП «Новгородский водоканал»
Часть 8. Ценовая конъюнктура рынка
8.1. Структура ценообразования
8.2. Ценовые характеристики реагентов
Часть 9. Перспективы рынка реагентов
Часть 10. Выводы
Часть 11. Приложения
11.1. Перечень таблиц в исследовании
11.2. Перечень диаграмм, схем и рисунков в исследовании
11.3. Список опрошенных экспертов, данные которых были использованы в исследовании
www.atconsult.ru



















