Содержание
Урок по аналитической химиии «Определение общей жесткости воды методом комплексонометрии»
Данный урок — лабораторная работа разработан по
предмету «Аналитическая химия» для обучающихся
по профессии «Технология продукции
общественного питания». В ходе лабораторной
работы в основе определения общей жесткости воды
используется один из методов титриметрического
анализа — комплексонометрический.
Вода является универсальным растворителем на
планете Земля. Как в загородных домах, так и в
городе в квартирах с централизованным
водопроводом существует проблема жесткой воды.
Жесткость воды зависит от наличия в ней солей
кальция и магния. Жесткость воды является
характеристикой конкретного источника
водоснабжения и не изменяется в процессе
подготовки питьевой воды к централизованному
водоснабжению. Как определить степень жесткости
воды?
Цель: повторить основные понятия,
используемые в титриметрическом анализе;
научить определять общую жесткость воды
комплексонометрическим методом; закрепить
навыки работы с лабораторным оборудованием;
развивать вычислительные навыки; воспитывать
чувство ответственности и дисциплинированности
при выполнении практической работы.
Оборудование: конические колбы, мерные
круглодонные колбы, бюретки для титрования,
реактивы: трилон Б, индикатор эриохром черный Т,
водопроводная вода, аммиачно-буферная смесь;
таблицы, инструкционные карты.
Ход урока
I. Организационный момент
II. Актуализация знаний учащихся
Сегодня на уроке мы с Вами будем говорить о
самом замечательном веществе на планете Земля -
воде.
Вы, как будущие технологи общественного
питания, будете использовать питьевую воду не
только в быту, но и в своей профессиональной
деятельности.
В Старом Осколе питьевая вода поступает в город
из 14 водозаборов, расположенных в разных частях
города и района.
1. Одинакова ли питьевая вода по своим
свойствам? (нет)
2.Чем она отличается? (содержанием
различных веществ — жесткостью)
Абсолютно чистой воды в природе не существует.
Она всегда содержит различные примеси как в
растворенном, так и во взвешенном состоянии. От
концентрации и природы этих примесей зависит
пригодность воды для бытовых и промышленных
нужд.
3.Что такое жесткость воды?
Жесткость воды определяется содержанием в ней
растворимых солей магния, кальция,
гидрокарбонатов, сульфатов, хлоридов.
4. Какие виды жесткости воды Вы знаете?
Жесткость временная (карбонатная)
обусловлена содержанием гидрокарбонатов
кальция и магния.
Жесткость постоянной (некарбонатной) обусловленна
присутствием в воде хлоридов, сульфатов и других
солей магния и кальция.
Общая жесткость воды представляет сумму
жесткости карбонатной и некарбонатной.
5. Почему нежелательно использовать жесткую
воду в быту?
Жесткая вода образует плотные слои накипи на
внутренних стенках паровых котлов и
кипятильников, в ней плохо развариваются пищевые
продукты, при стирке белья в жесткой воде
расходуется больше мыла.
III. Изучение нового материала
Тема нашего урока «Определение общей
жесткости воды комплексонометрическим
методом». Запишем ее в тетради.
В ходе урока мы должны научиться
практическим путем определять общую жесткость
воды, используя титриметрический анализ, в
частности комплексонометрический метод.
Вспомним основы комплексонометрического
метода анализа.
1. В чем состоит сущность
комплексонометрического метода?
Сущность комплексонометрического метода
состоит в образовании комплексных соединений
анализируемых катионов с органическими
реагентами — комплексонами.
2.Что такое титрование?
Титрование — постепенное добавление
раствора известной концентрации до достижения
точки эквивалентности.
3. Что такое точка эквивалентности?
Точка эквивалентности — момент
окончания реакции, т. к. вещества реагируют между
к. вещества реагируют между
собой в эквивалентных количествах.
4. С помощью чего устанавливают точку
эквивалентности? (индикатора)
5. Что такое индикатор?
Индикаторы — вещества, при помощи
которых устанавливают момент эквивалентности
между взаимодействующими растворами.
6. Что такое стандартный (рабочий) раствор?
Стандартный раствор — раствор с точно
установленной концентрацией, используемый для
титриметрических измерений.
7. Какие правила техники безопасности
необходимо соблюдать при выполнении
практической работы?
Правила техники безопасности при работе
со стеклянной посудой; жидкостями и сыпучими, а
также ядовитыми веществами.
Работу выполняем по парам. На столах имеются
инструкционные карты.
IV. Выполнение практической работы
Работу выполняем по парам. На столах имеются
инструкционные карты.
В тетради:
Цель работы: определить общую жесткость воды
методом комплексонометрии.
Оборудование: бюретки, мерный цилиндр, мерные
круглодонные колбы, конические колбы, цилиндры,
воронки, шпатель; реактивы: раствор Трилона Б,
эриохром черный Т (сухой), аммиачно-буферная
смесь, водопроводная вода.
Ход работы
1. Мерной колбой отмерить 100 мл исследуемой Н2О
и перелить ее в коническую колбу.
2. Добавить к воде 5 мл аммиачно-буферной смеси,
затем 7-8 капель спиртового раствора индикатора
эриохром черного Т или щепотку его смеси с NaCl или
KCl (сухую).
3. Тщательно перемешать, раствор окрасится в
винно-красный цвет.
4. Смесь оттитровать 0,05 Н раствором Трилона Б. К
концу титрования раствор Трилона Б добавлять по
каплям, встряхивая смесь в колбе после
добавления каждой капли.
5.Титрование можно считать законченным если
после добавления очередной капли окраска
раствора приобретает синий цвет с зеленоватым
оттенком и с добавлением лишней капли раствора
комплексона не изменяется.
6. Определить объем трилона Б, израсходованного
на титрование.
7.Титрование повторить 2-3 раза и для расчета
взять среднее значение.
V1
V2
V3
Vср
8. Произвести расчет общей жесткости воды.
Расчет:
Величину общей жесткости воды (Ж0) в мг*экв/л
вычисляют по формуле:
| Жо = | N х V х 1000 | , |
| V1 |
где N — нормальность раствора трилона Б, г-экв/л;
V — объем раствора трилона Б, мл;
V1 — объем воды, мл.
9. Сделайте вывод о типе воды, пользуясь данными
значениями жесткости воды.
Типы воды (по жесткости):
- Очень мягкие — 0-1,5 мг-экв/л;
- Мягкие — 1,5- 3,0 мг-экв/л;
- Среднежесткие — 3,0- 4,5 мг-экв/л;
- Довольно жесткие — 4,5 — 6,5 мг-экв/л;
- Жесткие — 6,5 — 11,0 мг-экв/л;
- Очень жесткие — свыше 11,0 мг-экв/л.
V. Подведение итогов работы
Сегодня на уроке мы практическим путем
определили общую жесткость воды. Водопроводная
вода, которую мы используем, является
среднежесткой.
Какие способы устранения жесткости Вы знаете?
Способы устранения жесткости воды:
- Карбонатная (временная) жесткость — кипячение;
добавление известкового молока или соды. - Некарбонатная (постоянная) жесткость -
добавление соды.
Общая жесткость — путем ионного обмена.
ИССЛЕДОВАНИЕ ЖЕСТКОСТИ ВОДЫ
- Авторы
- Руководители
- Файлы работы
- Наградные документы
Ибатова Э.В. 1
1
Тоюшева Э.П. 1
1
Автор работы награжден дипломом победителя III степени
Диплом школьникаСвидетельство руководителя
Текст работы размещён без изображений и формул.
Полная версия работы доступна во вкладке «Файлы работы» в формате PDF
1. Введение
Вода — это древний универсальный символ чистоты, плодородия и источник самой жизни. (Мосин О.В.)
Что современный человек знает об этом природном веществе сегодня? Все ли тайны раскрыты?
С уверенностью сказать о том, что да, мы познали смысл этого вещества, сложно. О воде написано очень много статей, воде посвящены стихи и пословицы, она — воплощение жизни в литературных произведениях. Процесс её освоения не окончен. К пониманию важности и значения пресной воды в нашем повседневном мире привлечено внимание многих учёных планеты. Процесс изучения физико-химических характеристик воды в наши дни постепенно переходит на новый уровень.
О воде написано очень много статей, воде посвящены стихи и пословицы, она — воплощение жизни в литературных произведениях. Процесс её освоения не окончен. К пониманию важности и значения пресной воды в нашем повседневном мире привлечено внимание многих учёных планеты. Процесс изучения физико-химических характеристик воды в наши дни постепенно переходит на новый уровень.
Н.В.Ширшина,«Химия. Проектная деятельность учащихся», Волгоград,2008:
Тип проекта: реферативно-исследовательский, индивидуальный,
межпредметный, среднесрочный.
Тема исследовательского проекта: Изучение жёсткости воды.
Цель: Изучить, исследовать и сравнить жёсткость воды.
Задачи:
1. Изучить литературные источники по проблемам химического состава воды.
Изучить литературные источники по проблемам химического состава воды.
2. Практически ознакомиться с методами исследования жёсткости воды.
3. Совершенствовать навыки работы с дополнительными источниками по выбранной теме исследования.
4. Оценить воду на содержание минеральных солей, определить жёсткость воды в исследуемых образцах.
Объекты исследования: артезианская вода верхней и нижней части деревни.
Предмет исследования: проблема жёсткости воды.
Гипотеза: Высокое качество питьевой воды обеспечивает здоровье, благополучие и рассвет нации.
Актуальность исследования. Вода – наиболее удивительное вещество на Земле, удивительное потому, что оно обеспечивает условия для развития и роста всевозможных видов жизни. Эта тема актуальна, так как я живу в деревне Пелемеш Агрызского района Республики Татарстан, где как и перед многими жителями района стоит проблема чистой питьевой воды. К пониманию важности и значения пресной воды в нашем повседневном мире привлечено внимание многих учёных планеты.
Эта тема актуальна, так как я живу в деревне Пелемеш Агрызского района Республики Татарстан, где как и перед многими жителями района стоит проблема чистой питьевой воды. К пониманию важности и значения пресной воды в нашем повседневном мире привлечено внимание многих учёных планеты.
Методы исследования: сбор информации о воде в литературных источниках, изучение методики проведения экспериментальных опытов, проведение экспериментальных опытов.
Материалы и методика исследования: Материалы для исследования собирала Ибатова Эльвина ученица 9 класса Бимской СОШ Агрызского района Республики Татарстан. В декабре-январе я провела исследование жёсткости воды в школьной химической лаборатории под руководством учителя химии первой категории Тоюшевой Эльверы Петровны.
2. Теоретическая часть
2. 1. Значение воды
1. Значение воды
Воде была дана волшебная власть стать соком жизни на земле. (5)
Вода-наиболее удивительное вещество на Земле, удивительное потому, что оно обеспечивает условия для развития и роста всевозможных видов жизни. Окажись вы в пустыне под её беспощадно палящим солнцем, вы будете готовы променять все ценности на воду, на хотя бы один глоток этого живительного и бесценного «жидкого золота». Будь вы хоть самым богатым человеком на свете, все ваше богатство не окажетесь в пустыне, и ваш запас воды иссякнет.
Говорится: нет воды — нет жизни, есть воды – есть жизнь. Роль воды огромна для всего живого. Что было бы, если на Земле не имелось бы рек, морей и океанов? Как бы тогда развивалось всё живое? В этом случае жизнь на нашей планете не могла бы даже появиться. Собственно воде Земля обязана появлением и развитием жизни, следовательно, не будь её, не было бы и нас. Ни один живой организм не выжил бы, а жизнь бы не появилась.
Ни один живой организм не выжил бы, а жизнь бы не появилась.
2.2. О питьевой воде.
(Ростова Л. «Исцеляющая вода». Ростов-на-Дону. «Феникс», 2011 год)
Развитие жизни неразрывно связано с гидросферой. Вода явилась той основой, благодаря которой возникла жизнь. По одной из гипотез, жизнь возникла на границе Мирового океана, атмосферы и земли.
В процессе развития цивилизации вода используется не только для питьевых и бытовых целей, но и как мощнейшее средство развития производительных сил. Сельскохозяйственное орошение, транспорт, энергетика – всё это основано на использовании воды. Однако наличия только водного объекта не всегда достаточно. Для того чтобы использовать воду в каких-либо целях, необходимо создать ряд сооружений.
С момента своего появления на Земле человек использует природные водные источники. И одна из этих целей – приготовление питьевой воды. Под приготовлением питьевой воды понимается изыскание источников воды, определение её пригодности для питьевых целей, добыча воды, улучшение качества, а также транспортирование к месту потребления. В общей структуре использования воды потребление её для питьевых целей занимает совершенно незначительное место. Достаточно сказать, что в зависимости от степени благоустройства жилища человека нормами предусмотрено потребление до 350 л воды питьевого качества в сутки. Из них непосредственно для питья человек расходует не более 2-3 л. Однако приготовлению воды именно питьевого качества цивилизованное человечество уделяет особое внимание.
И одна из этих целей – приготовление питьевой воды. Под приготовлением питьевой воды понимается изыскание источников воды, определение её пригодности для питьевых целей, добыча воды, улучшение качества, а также транспортирование к месту потребления. В общей структуре использования воды потребление её для питьевых целей занимает совершенно незначительное место. Достаточно сказать, что в зависимости от степени благоустройства жилища человека нормами предусмотрено потребление до 350 л воды питьевого качества в сутки. Из них непосредственно для питья человек расходует не более 2-3 л. Однако приготовлению воды именно питьевого качества цивилизованное человечество уделяет особое внимание.
2.3. Современное отношение к питьевой воде.
(Ростова Л. «Исцеляющая вода». Ростов-на-Дону. «Феникс», 2011 год)
На основе множества самых разнообразных исследований специалисты создали стандарты, нормы содержания различных веществ в воздушном бассейне города, в различной по использованию воде и т. д.; если эти нормы не превышены, то непосредственной угрозы человеческому здоровью нет. Есть такие нормы и для питьевой воды. Их называют ПДК- предельно допустимые концентрации.
д.; если эти нормы не превышены, то непосредственной угрозы человеческому здоровью нет. Есть такие нормы и для питьевой воды. Их называют ПДК- предельно допустимые концентрации.
Обычно полагают, что плохая питьевая вода – это вода, содержащая микробы, вирусы, то есть различные микроорганизмы, возбуждающие болезни. Такую воду надо прокипятить, а для страховки от заразы ещё принять рюмку водки, продезинфицировав тем самым кишечник, но не всё так просто… Вода часто становится источником заражения человека животными паразитами – глистами. С загрязнённой водой в организм человека могут попасть яйца некоторых паразитических червей. В кишечнике они превращаются в паразитов (аскариды, острицы). Также через воду иногда происходит заражение лямблиями, которые поражают печень. Попавшие в воду возбудители кишечных инфекций сохраняют жизнеспособность длительное время. Например, палочка брюшного тифа может сохраняться в речной воде до 183 дней, дизентерии – до 92 дней.
Вода природных источников содержит большое количество разнообразных микроэлементов, их роль в жизнедеятельности организма значительна. Избыток или недостаток тех или иных микроэлементов способен оказывать влияние на здоровье, привести к нарушению обмена веществ, в результате возникают геохимические эпидермии. Например, эндемический зоб, вызываемый недостатком йода. Нормальным считается, когда человек ежесуточно получает с питьевой водой и пищей 0,05-0,1 мг йода.
Жители городов употребляют привозные продукты, получая в общей сложности достаточное количество этого микроэлемента. А в небольших населённых пунктах целесообразно использовать при питании йодированную поваренную соль.
Другое заболевание, связанное с составом питьевой воды, эндемический флюороз (поражение эмали зубов). Оно возникает там, где в воде содержится избыток фтора (более 1,5 мг/л). Недостаток фтора в питьевой воде (менее 0,6 мг/л) тоже вреден – возникает кариес зубов.
Недостаток фтора в питьевой воде (менее 0,6 мг/л) тоже вреден – возникает кариес зубов.
Установлено и предельно допустимое содержание нитратов в воде, оно составляет 10 мг/л по азоту. При повышении этого количества могут наблюдаться признаки кислородного голодания. Содержание нитратов в питьевой воде в концентрации ниже 10 мг/л является безвредным. Нитраты природного происхождения, например в Татарии, — обычное явление в подземных водах. Также не предусматривается содержание в воде нитритов. Согласно современным данным, нитриты в кишечнике человека под влиянием обитающих в нём бактерий восстанавливаются в нитраты переносе кислорода. Всасывание нитратов ведёт к частичной потере активности гемоглобина в переносе кислорода.
Важным показателем воды является её жёсткость. Для измерения жёсткости воды используют другую единицу: грамм-эквивалент. Жёсткость воды также зависит от времени года: минимальна она во время весенних паводков и максимальна зимой.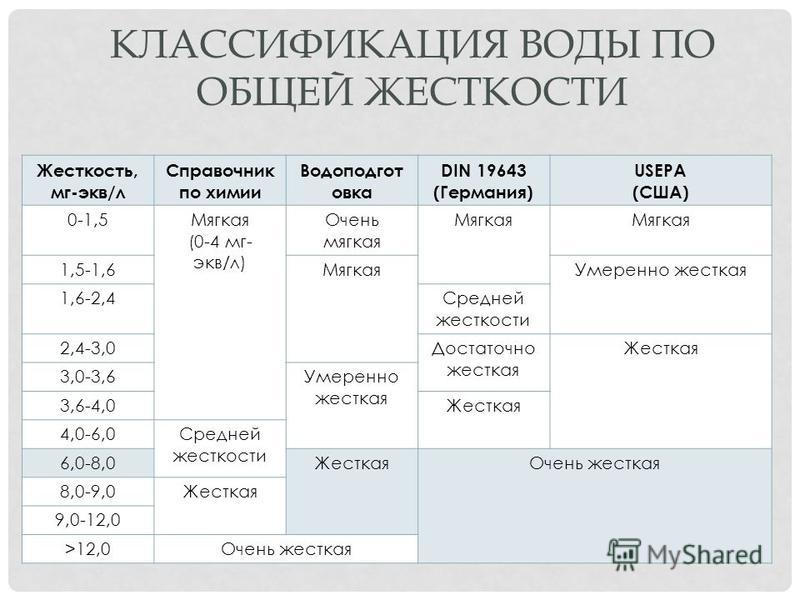
2.4. Природа жёсткой воды.
(Ростова Л. «Исцеляющая вода». Ростов-на-Дону. «Феникс», 2011 год)
Жёсткость воды – это содержание в воде растворённых солей щелочноземельных металлов, прежде всего кальция и магния. Различают кальциевую и магниевую жёсткость, а их сумма называется общей жёсткостью воды. В таблице 1 содержатся сведения об общей жёсткости воды.
Таблица 1
Общая жёсткость различной воды
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Жесткую воду не желательно использовать для различных бытовых, технических целей.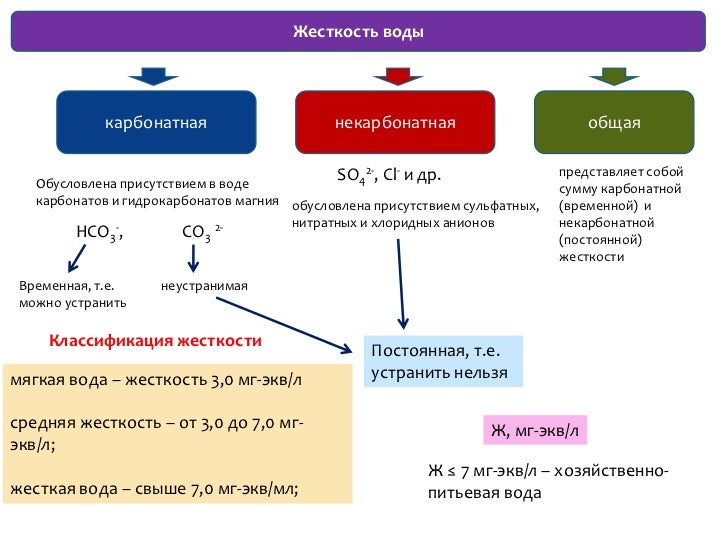 А человеческое здоровье? Как оно реагирует на содержание кальция и магния в воде? Оказывается, и мало солей плохо, и много тоже плохо. Исследования германских специалистов показали: чем мягче питьевая вода, тем выше процент сердечно сосудистых заболеваний среди населения. В то же время употребление жесткой воды увеличивает опасность мочекаменной болезни, неблагоприятно влияет на состояние сосудов. Избыток ионов Са2+ в организме приводит к отложению солей в шейном, грудном, поясничном отделах позвоночника, суставах конечностей.
А человеческое здоровье? Как оно реагирует на содержание кальция и магния в воде? Оказывается, и мало солей плохо, и много тоже плохо. Исследования германских специалистов показали: чем мягче питьевая вода, тем выше процент сердечно сосудистых заболеваний среди населения. В то же время употребление жесткой воды увеличивает опасность мочекаменной болезни, неблагоприятно влияет на состояние сосудов. Избыток ионов Са2+ в организме приводит к отложению солей в шейном, грудном, поясничном отделах позвоночника, суставах конечностей.
Жесткая вода мало пригодна для стирки белья. Содержащиеся в ней растворимые известковые соли (кальция и магния) соединяются с мылом, образуя нерастворимый осадок, который вместе с загрязнениями остаётся на ткани, придавая ей желтоватый или серый цвет и делая бельё хрупким и липким. Для умягчения воды чаще всего применяют щелочи: соду, тринатрийфосфат, поташ, силикат натрия (жидкое стекло). Вода также умягчается при кипячении. При этом из неё улетучивается углекислый газ, входящий в состав известковых солей, вследствие чего известковые соли переходят в нерастворимое состояние и осаждаются на стенках посуды, образуя накипь. Самым простым индикатором жесткости воды является растворимость мыла. Немного измельченного мыла (в виде стружек) кладут в стакан с горячей водой. Если мыло полностью растворится и после охлаждения получится прозрачный раствор, значит вода мягкая, если же на поверхности образуется плёнка нерастворимого мыла – вода жесткая.
При этом из неё улетучивается углекислый газ, входящий в состав известковых солей, вследствие чего известковые соли переходят в нерастворимое состояние и осаждаются на стенках посуды, образуя накипь. Самым простым индикатором жесткости воды является растворимость мыла. Немного измельченного мыла (в виде стружек) кладут в стакан с горячей водой. Если мыло полностью растворится и после охлаждения получится прозрачный раствор, значит вода мягкая, если же на поверхности образуется плёнка нерастворимого мыла – вода жесткая.
2.5. Чистая вода в Республике Татарстан
(2011 Газета «Вечерняя Казань». RSS-каналы).
Карту качества воды в России создали участники федеральной экспедиции «В поисках чистой воды»: экологи, блогеры и звезды эстрады. Этим летом они прошли вдоль Волги (от самого ее истока до Каспийского моря) и собрали пробы воды из колодцев, родников, рек и водопроводных кранов в разных волжских городах и селах. Получилось 300 образцов. Их отдали на химический анализ. Все источники в Татарстане не выдержали проверку на содержание фторидов. К безвредным участники экспедиции отнесли у нас четыре источника: два родника в Камско-Устьинском районе (в Буртасах и Мордовском Каратае), родник в деревне Воробьевка Верхнеуслонского района и участок Волги в Тетюшах Подкачали воды Татарстана и по жесткости и содержанию железа. Жители Камского Устья, например, пользовались колонкой и не подозревали, что жесткость воды в ней составляет более 19 мг-экв/л. У человека от такой воды заиливаются суставы, накапливается песок в почках и мочевом пузыре, предупреждают медики. Для техники жесткость воды вообще смертельна — причина поломок в 90% случаев. Жители деревень Мордовский Каратай Камско-Устьинского района и Большие Тарханы Тетюшского района тоже не догадывались, что их колодцы – рекордсмены по превышению норм содержания железа. А как поясняют справочники, употребление воды, содержащей избыток железа, способствует развитию рака, влияет на формулу крови, приводит к ошелушиванию кожи и выпадению волос.
Получилось 300 образцов. Их отдали на химический анализ. Все источники в Татарстане не выдержали проверку на содержание фторидов. К безвредным участники экспедиции отнесли у нас четыре источника: два родника в Камско-Устьинском районе (в Буртасах и Мордовском Каратае), родник в деревне Воробьевка Верхнеуслонского района и участок Волги в Тетюшах Подкачали воды Татарстана и по жесткости и содержанию железа. Жители Камского Устья, например, пользовались колонкой и не подозревали, что жесткость воды в ней составляет более 19 мг-экв/л. У человека от такой воды заиливаются суставы, накапливается песок в почках и мочевом пузыре, предупреждают медики. Для техники жесткость воды вообще смертельна — причина поломок в 90% случаев. Жители деревень Мордовский Каратай Камско-Устьинского района и Большие Тарханы Тетюшского района тоже не догадывались, что их колодцы – рекордсмены по превышению норм содержания железа. А как поясняют справочники, употребление воды, содержащей избыток железа, способствует развитию рака, влияет на формулу крови, приводит к ошелушиванию кожи и выпадению волос. Вообще специалисты по качеству воды говорят, что колодцы, дескать, нынче вообще бактериологически опасны, если только не рыть их на глубину больше 100 метров. Если подытожить, то в список «красных» источников в Татарстане участники экспедиции, включили еще родник в селе Монастырском Тетюшского района. Там оказались превышены нормы по жесткости, железу и фторидам. Желтыми тревожными значками они отметили Казанку и колонку в Камском Устье за превышение норм по жесткости и фторидам. А за фториды и железо в желтый список был также включен родник в селе Малые Салтыки Камско-Устьинского района.
Вообще специалисты по качеству воды говорят, что колодцы, дескать, нынче вообще бактериологически опасны, если только не рыть их на глубину больше 100 метров. Если подытожить, то в список «красных» источников в Татарстане участники экспедиции, включили еще родник в селе Монастырском Тетюшского района. Там оказались превышены нормы по жесткости, железу и фторидам. Желтыми тревожными значками они отметили Казанку и колонку в Камском Устье за превышение норм по жесткости и фторидам. А за фториды и железо в желтый список был также включен родник в селе Малые Салтыки Камско-Устьинского района.
2.6. Артезианская вода.
(Материал из Википедии — свободной энциклопедии.)
Артезиа́нская во́да — это напорные подземные воды, заключенные в водоносных пластах горных пород между водоупорными слоями. При вскрытии буровой скважиной или шурфом артезианские воды поднимаются выше кровли водоносного пласта, иногда фонтанируют. Источники артезианского типа относятся к важнейшим полезным ископаемым. Обычно залегают на глубине от 100 до 1000 метров. Артезианская скважина — это скважина, которая бурится на второй водоносный горизонт (известняк водоносный), как указан на рисунке. Глубина залегания такой скважины составляет 30-200метров.
Источники артезианского типа относятся к важнейшим полезным ископаемым. Обычно залегают на глубине от 100 до 1000 метров. Артезианская скважина — это скважина, которая бурится на второй водоносный горизонт (известняк водоносный), как указан на рисунке. Глубина залегания такой скважины составляет 30-200метров.
3. Исследовательская часть
3.1. Определение жесткости воды.
(Химия в школе,2000 год, №5)
Определение жесткости воды провели методом титрования. Метод основан на осаждении ионов Са+2 и Mg+2 избытком раствора ортофосфата натрия Na3PO4 : 3 MeCI2 + 2 Na3PO4 = Me3(PO4)2 ↓ + 6NaCI
Для исследования и сравнения жесткости воды взяли артезианскую воду верхней и нижней части деревни Пелемеш. В мерную колбу вместимостью 250 мл перенесли 100 мл анализируемой воды, добавили точно измеренный объём – 25 мл 0,2 н раствора Na3PO4 и отстаивали 30 минут, затем довели до метки дистиллированной водой, тщательно перемешали и фильтровали через плотный бумажный фильтр в сухую ёмкость.В коническую колбу объёмом 250 мл отобрали 100 мл фильтрата для проведения титрования и добавили 2-3 капли индикатора метилоранжа. Карбонатная жесткость воды ЖК определяется методом нейтрализации. Он основан на титровании воды, в которую добавляется метиловый оранжевый, раствором соляной кислоты до перехода желтой окраски индикатора в оранжевую. Метиловый оранжевый является кислотно-основным индикатором, который при pH < 3,1 имеет красную окраску, а при pH > 4,4 окрашивается в желтый цвет. В интервале значений pH 3,1 — 4,4 окраска индикатора становится оранжевой.Титрование воды раствором HCl сопровождается протеканием реакции нейтрализацииOH¯ + H+ →H2O, в которой ионы H+ диссоциирующей кислоты нейтрализуют гидроксид-ионы OH‾, образующиеся в результате гидролиза анионов HCO3‾ в воде HCO3¯ + H2O ↔ H2CO3 + OH¯.
В мерную колбу вместимостью 250 мл перенесли 100 мл анализируемой воды, добавили точно измеренный объём – 25 мл 0,2 н раствора Na3PO4 и отстаивали 30 минут, затем довели до метки дистиллированной водой, тщательно перемешали и фильтровали через плотный бумажный фильтр в сухую ёмкость.В коническую колбу объёмом 250 мл отобрали 100 мл фильтрата для проведения титрования и добавили 2-3 капли индикатора метилоранжа. Карбонатная жесткость воды ЖК определяется методом нейтрализации. Он основан на титровании воды, в которую добавляется метиловый оранжевый, раствором соляной кислоты до перехода желтой окраски индикатора в оранжевую. Метиловый оранжевый является кислотно-основным индикатором, который при pH < 3,1 имеет красную окраску, а при pH > 4,4 окрашивается в желтый цвет. В интервале значений pH 3,1 — 4,4 окраска индикатора становится оранжевой.Титрование воды раствором HCl сопровождается протеканием реакции нейтрализацииOH¯ + H+ →H2O, в которой ионы H+ диссоциирующей кислоты нейтрализуют гидроксид-ионы OH‾, образующиеся в результате гидролиза анионов HCO3‾ в воде HCO3¯ + H2O ↔ H2CO3 + OH¯.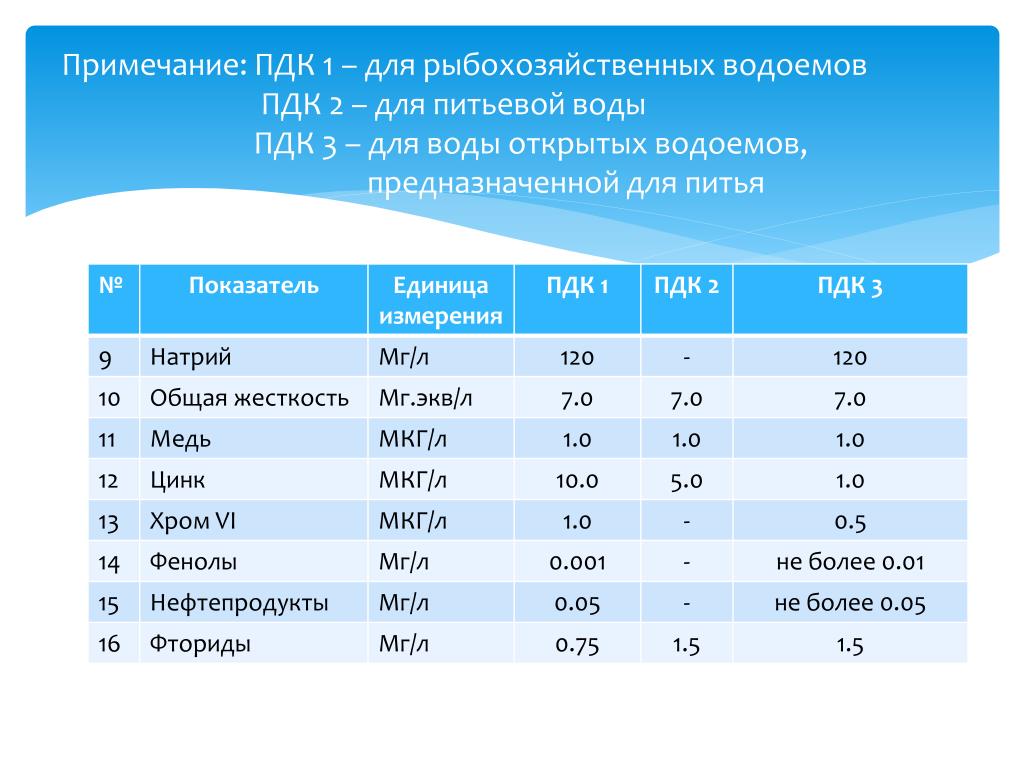
( Габриелян О. С., Л.П.Ватлина. «Химический эксперимент в школе». Дрофа. Москва. 2005г) :
Затем титровали соляной кислотой до появления бледно-розовой окраски раствора. Параллельно определили объём соляной кислоты, пошедшей на определение временной жесткости в идентичных условиях. Для этого взяли мерную колбу вместимостью 250 мл, добавили 100 мл анализируемой воды, довели до метки дистиллированной водой и тщательно перемешали. После этого в коническую колбу для титрования отобрали 100 мл раствора, добавили 2-3 капли метилоранжа и титровали соляной кислотой до появления бледно-розовой окраски.
На определение временной жесткости воды верхней части деревни израсходовали 0,8 мл 0,1 н. раствора HCI на 100 мл пробы. А для воды нижней части деревни израсходовали 2,4 мл 0,1 н раствора HCI на 100 мл пробы.
3. 2. Расчет временной жесткости воды.
2. Расчет временной жесткости воды.
( Химия в школе,2000 год,№5)
Жв = (cэ(HCI) •V(HCI) / Vпр ) • ( Vколбы / V(H2O)) • 1000, где
V(HCI) – объём соляной кислоты, пошедшей на титрование, л;
cэ(HCI) – молярная концентрация эквивалента соляной кислоты, моль/л;
V(H2O) – объём анализируемой воды, л;
Vколбы — объём мерной колбы, л;
Vпр – объём воды, взятой для титрования, л.
Жв=(0,8 •10-3 л •0,1 моль/л /100 •10-3л )•(250 •10-3л / 100 •10-3л )•1000 = 2 ммоль/л. (для воды верхней части деревни)
Жв=(2,4 •10-3 л •0,1 моль/л /100 •10-3л )•(250 •10-3л / 100 •10-3л )•1000 =6 ммоль/л. (для воды нижней части деревни)
(для воды нижней части деревни)
4. Выводы
В процессе исследования мы установили, что наши образец воды нижней части деревни является умеренно жесткой — жесткой, а вода верхней части деревни является мягкой. Но мы, к сожалению, не проводили эксперименты на определение показателей таких качеств воды как рН, общее солесодержание, концентрации солей, ионов железа, содержание растворённого кислорода.
5. Заключение
Одна из экологических проблем – это проблема чистой питьевой воды. Мыло в жесткой воде не мылится, овощи плохо развариваются, а при использовании такой воды в паровых котлах, стиральных машинах, электро-чайниках образуется накипь, которая снижает эффективность их работы и может привести к разрыву. Жесткую воду перед употреблением целесообразно умягчить, удалив катионы кальция и магния. Однако для жизнедеятельности человеческого организма кальций и магний необходимы, так как играют важную роль в процессах формирования костей, свёртываемости крови, сокращения сердечной мышцы, передачи нервных импульсов. Избыток Ca+2 в организме приводит к отложению солей в шейном, грудном, поясничном отделах позвоночника, суставах конечностей. Отсюда следует, что важно вести контроль за содержанием солей кальция и магния в питьевой воде.
Однако для жизнедеятельности человеческого организма кальций и магний необходимы, так как играют важную роль в процессах формирования костей, свёртываемости крови, сокращения сердечной мышцы, передачи нервных импульсов. Избыток Ca+2 в организме приводит к отложению солей в шейном, грудном, поясничном отделах позвоночника, суставах конечностей. Отсюда следует, что важно вести контроль за содержанием солей кальция и магния в питьевой воде.
Список литературы
1. Химия в школе,2000 год,№5
2. Химия в школе, 2001 год, №7
3. Габриелян О. С., Л.П.Ватлина. «Химический эксперимент в школе». Дрофа. Москва. 2005г
4. Н.В.Ширшина, «Химия. Проектная деятельность учащихся», Волгоград,2008 год.
5. Ростова Л. «Исцеляющая вода». Ростов-на-Дону. «Феникс», 2011 год.
Ростова Л. «Исцеляющая вода». Ростов-на-Дону. «Феникс», 2011 год.
6. (2011 Газета «Вечерняя Казань». RSS-каналы).
7. Материалы из Википедии – свободной энциклопедии.
Приложения
15
Просмотров работы: 4960
Простой способ расчета жесткости воды
Если вы не уверены, что такое жесткость воды, вы не одиноки. Тем не менее, вы, возможно, испытали на себе его последствия, даже не зная, что это было.
Жесткая вода относится к воде, которая содержит высокий процент минералов, таких как магний и кальций. Это не опасно для потребления человеком, но не очень хорошо для наших приборов и бытовых приборов.
Жесткая вода может оставлять следы на приборах и оборудовании, которые со временем могут изнашивать их и приводить к поломке.
Если в вашем доме жесткая вода, вы можете подумать о покупке устройства для смягчения воды, чтобы решить эту проблему. Прежде всего, вам нужно определить жесткость вашей воды. Читайте дальше, чтобы узнать, как рассчитать жесткость воды.
Что такое жесткость воды?
Жесткость воды зависит от того, сколько в ней растворенных минералов. Жесткая вода обычно содержит высокий процент как магния, так и кальция.
Когда вы принимаете душ или купаетесь в этой воде, ваша кожа может не чувствовать себя чистой. Некоторые люди реагируют сухой, красной кожей. Другие могут заметить, что вы чувствуете себя немного склизкой, особенно после использования мыла.
Это потому, что кальций в воде вступает в реакцию с мылом и затрудняет его разложение и смывание.
Еще одним распространенным признаком жесткой воды в вашем доме являются пятна на столовых приборах и стаканах. Даже если вы только что вынули их из посудомоечной машины, вы увидите их на многих предметах. Это тоже из-за жесткой воды. Из них безопасно есть и пить, но они не выглядят привлекательно.
Это тоже из-за жесткой воды. Из них безопасно есть и пить, но они не выглядят привлекательно.
При нагревании жесткой воды может образовываться очень толстый слой известкового налета, также известного как карбонат кальция. Это то, что действительно может нанести вред технике и технике. Это также может сделать ваш водонагреватель менее эффективным.
Чтобы вернуть очкам первоначальный блеск, можно время от времени мыть их уксусом. Кислота в уксусе может избавиться от известкового налета. Потом можно сразу смыть.
Жесткая вода не всегда так уж плоха. В нем много минералов, полезных для нас. Очень жаль, что это может нанести такой ущерб нашим домам.
Временная жесткость и постоянная жесткость воды
Возможно, вы слышали термины «временная жесткость» и «постоянная жесткость», когда речь идет о воде. Что именно это означает?
Временная жесткость возникает, когда гидрокарбонаты натрия и кальция растворяются в воде. Вы можете смягчить этот тип смягчителем извести, таким как гидроксид кальция.
Постоянно жесткая вода требует более глубокой обработки для ее смягчения. Он содержит стойкие соединения, для которых потребуется умягчитель воды, такой как ионообменная система.
Постоянная жесткость считается суммой магниевой жесткости + кальциевой жесткости вашей воды. Чтобы рассчитать этот уровень жесткости, вы можете купить наборы, которые проверяют вашу воду.
Расчет жесткости воды
Как упоминалось выше, жесткость воды может определяться двумя способами. Один постоянный, а другой временный. Постоянную жесткость воды можно рассчитать с помощью калькулятора жесткости воды.
Это делается по следующей формуле:
Жесткость по кальцию + Жесткость по магнию = Общая постоянная жесткость
Несколько связующих соединений составляют молярную массу.
- Mg2+= 24,3 г/моль
- Ca2+ = 40, 1 г/моль
- CaC03 = 100,1 г/моль
Вот соотношения для молярных масс:
- MCaCo3/Mg = 100,1/24,3 =4,1
- MCaCo3/MCa = 100,1/40,1 =2,5
В приведенной ниже формуле общая жесткость воды представлена как CaCO3. Формула показывает, как определить общую жесткость воды.
Формула показывает, как определить общую жесткость воды.
- (CaCO3) = 2,5 . (Ca2+) + 4,1 (Mg2+)
Следовательно, для расчета жесткости вашей воды вы можете использовать приведенные выше формулы.
Как измерить жесткость воды
Жесткость воды можно измерить разными способами. Это зависит от того, предпочитаете ли вы указывать жесткость в литрах, миллионах или галлонах. Таким образом, жесткость воды выражается в миллиграммах кальция на литр, частях на миллион или гранах на галлон.
Чтобы узнать жесткость водопроводной воды в вашем доме, вам необходимо взять пробу воды в лабораторию для анализа воды. Они дадут вам результаты отдельных соединений в воде. Используйте эту информацию в приведенных выше формулах, чтобы определить общую жесткость вашей воды.
Отчет о качестве воды
При проверке жесткости воды вам необходимо точно знать, что вы ищете. Если вам удастся получить отчет о качестве воды, поступающей в ваш дом, это руководство поможет вам расшифровать его.
Эти отчеты часто полны цифр, и их может быть очень трудно прочитать, если вы не знаете, что ищете.
Они также часто проверяют воду в том месте, где ее очищают, и тогда она может собрать дополнительные загрязнения по пути к вашему дому. Поэтому будьте осторожны, полностью доверяя их точности. Тем не менее, они являются хорошим способом дать вам представление о жесткости воды.
Обычно это значение указывается в мг/л карбоната кальция. Вот что вам нужно, чтобы определить, является ли ваша вода жесткой:
- 0–60 мг/л = мягкая вода
- 61–120 мг/л = умеренно жесткая вода
- 121–180 мг/л = жесткая вода
- Более 180 мг/л = очень жесткая вода
Способы измерения жесткости воды
Тест-полоски
Вы можете приобрести тест-полоску для самостоятельного определения жесткости водопроводной воды дома.
Если вы фильтруете воду, которую используете в своем доме, вам сначала нужно найти источник нефильтрованной воды для проверки. Не рекомендуется использовать внешний кран, который присоединяется к шлангу, который вы используете во дворе. Это связано с тем, что они часто собирают грязь и мусор, которые могут повлиять на результаты теста.
Не рекомендуется использовать внешний кран, который присоединяется к шлангу, который вы используете во дворе. Это связано с тем, что они часто собирают грязь и мусор, которые могут повлиять на результаты теста.
- Выньте из упаковки и не прикасайтесь к тест-полоске. Прикосновение к ней может повлиять на результаты, поэтому убедитесь, что вы касаетесь полоски только по ее краям.
- Наполните стакан водой, которую собираетесь тестировать. Вставьте в него тест-полоску и дайте ей постоять не менее 2 секунд. На упаковке будет инструкция, поэтому точное время смотрите в ней.
- Выньте полоску и встряхните ее, чтобы избавиться от лишней воды. Продолжайте встряхивать его, пока на нем не останется капель воды. Вам нужна влажная, но не капающая полоска.
- Сравните текущий цвет полоски с таблицей на упаковке. Это даст вам представление о жесткости воды. Цвета тест-полосок разных марок сильно различаются, поэтому просто проверьте упаковку, чтобы узнать, что искать.

- Необработанная вода может возвращаться со значениями до 425. Вы должны искать очищенную воду, чтобы она содержала значение 0. Это мягкая вода.
Инструменты
Колориметр можно использовать для проверки жесткости воды. Во время этого процесса через оптический фильтр проходит белый свет. Экран будет посылать цветной свет через фотодетектор.
Вам необходимо определить разницу между количеством окрашенного света в прозрачном и окрашенном образце. Тогда вы узнаете, сколько цветного света поглотил ваш образец.
Количество поглощаемого цветного света зависит от концентрации минералов в воде. Тест использует метр для измерения этого.
Мыло
Вам потребуется:
- Мерный стаканчик
- Средство для мытья посуды
- Маленькая бутылка с крышкой
Налейте воду в бутылку и сделайте отметку на линии подачи воды. Добавьте в него немного мыла и встряхните. Сейчас должны быть пузырьки.
Если не образуется пена, значит там много растворенной соли. Если вам не нужно использовать много мыла, то это показывает, что вода не содержит много минералов.
Если вам не нужно использовать много мыла, то это показывает, что вода не содержит много минералов.
Это ни в коем случае не точный тест. Но это хороший домашний тест, чтобы увидеть, стоит ли проверять вашу воду в испытательном центре.
Резюме
Знание того, жесткая ли вода в вашем доме, может быть полезной. Если это временная жесткая вода, это легко лечится. С постоянно жесткой водой, к сожалению, не так просто справиться.
Если в ваш дом постоянно поступает жесткая вода, то вы можете приобрести умягчитель воды, который поможет в этом. Это поможет вам избежать образования твердого известкового налета на ваших светильниках и приборах, что продлит их срок службы.
Попробуйте использовать один из приведенных выше тестов, чтобы узнать, может ли вода быть жесткой в вашем доме. Чем раньше вы узнаете, тем лучше, чтобы вы могли это исправить. Устранение этого быстро может избежать повреждения вашего дома.
Такие минералы, как магний и кальций в воде, — это не конец света.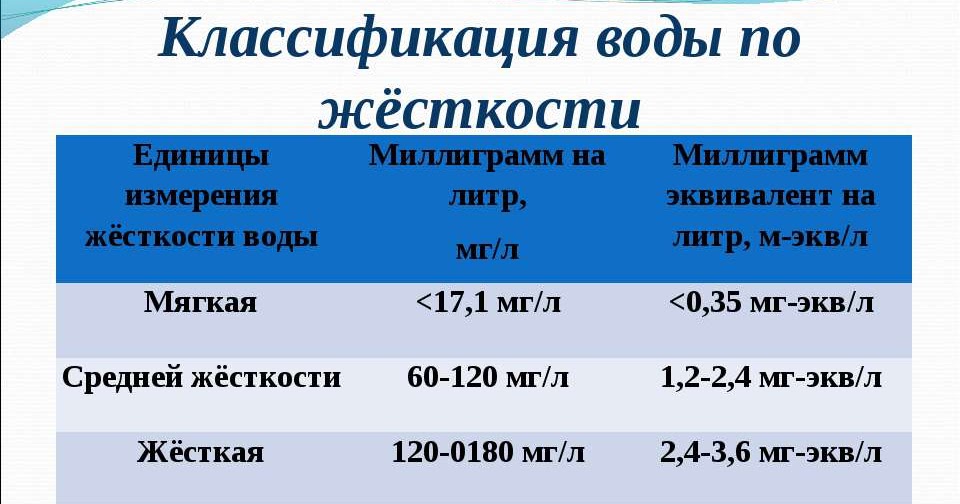 Если вы эффективно управляете своим водоснабжением, они вообще не проблема. И вы можете извлечь выгоду, используя фильтр для воды, потому что ваша вода будет более свежей и чистой.
Если вы эффективно управляете своим водоснабжением, они вообще не проблема. И вы можете извлечь выгоду, используя фильтр для воды, потому что ваша вода будет более свежей и чистой.
Жесткость – Качество воды – Доктор Даррин Лью
Последнее обновление: 28 декабря 2022 г. |
Качество воды
История вопроса
Первоначально жесткость воды служила мерой способности воды осаждать мыло. Он измерялся количеством мыла, необходимым для адекватного пенообразования, и служил также индикатором скорости образования накипи в водонагревателях и бойлерах. Мыло осаждается в виде серого осадка в виде «кольца в ванне», главным образом, в результате реакции с присутствующими катионами кальция и магния (Ca2+ и Mg2+), хотя другие поливалентные катионы могут играть второстепенную роль.
Жесткость имеет некоторое сходство с щелочностью. Как и щелочность, это свойство воды, которое не может быть отнесено к какой-либо одной составляющей, и, следовательно, для количественного выражения жесткости в виде концентрации необходимо принять некоторые правила. Как и щелочность, жесткость обычно выражается эквивалентной концентрацией CaCO3. Однако жесткость — это свойство катионов (Ca2+ и Mg2+), а щелочность — свойство анионов (HCO3- и CO32-).
Как и щелочность, жесткость обычно выражается эквивалентной концентрацией CaCO3. Однако жесткость — это свойство катионов (Ca2+ и Mg2+), а щелочность — свойство анионов (HCO3- и CO32-).
РИСУНОК 3.4 Диаграмма общая кислотность-общее количество карбонатов (диаграмма Деффея): На этом рисунке показаны отношения между общей кислотностью, pH и общим содержанием карбонатов. Если известны любые две из этих величин, третью можно определить по графику. Изменения состава, указанные на рисунке, относятся к примеру 3.5.
РИСУНОК 3.4 Диаграмма общая кислотность-общее количество карбонатов (диаграмма Деффея): На этом рисунке показаны отношения между общей кислотностью, pH и общим содержанием карбонатов. Если известны любые две из этих величин, третью можно определить по графику. Изменения состава, указанные на рисунке, относятся к примеру 3.5.
Расчет жесткости
В настоящее время общая жесткость определяется как сумма концентраций ионов кальция и магния в мг/л, выраженных в виде карбоната кальция. Жесткость обычно рассчитывается из отдельных измерений кальция и магния, а не измеряется непосредственно колориметрическим титрованием. 9= 2,497.
Жесткость обычно рассчитывается из отдельных измерений кальция и магния, а не измеряется непосредственно колориметрическим титрованием. 9= 2,497.
экв. вес. CaCO3 _ 50,04 экв. вес. Ca2+ _ 20,04
Множитель Mg2+ в виде CaCO3 = экв- вес: CaCQ3 = 5004 = 4,118.
3. Рассчитайте общую жесткость.
Общая жесткость (в пересчете на CaCO3) = 2,497 [Ca2+, мг/л] + 4,118 [Mg2+, мг/л]. (3.14) Уравнение 3.14 можно использовать для расчета твердости, если известны концентрации Ca2+ и Mg2+. Пример 3.6
Рассчитайте общую жесткость в виде CaCO3 пробы воды, в которой:
Ca2+ = 98 мг/л и Mg2+ = 22 мг/л.
Ответ: Из уравнения 3.14
Общая жесткость = 2,497 [98 мг/л] + 4,118 [22 мг/л] = 335 мг/л CaCO3.
И щелочность, и жесткость выражаются в единицах эквивалентной концентрации карбоната кальция. Как отмечалось ранее, щелочность возникает в результате реакций анионов CO32- и HCO3-, тогда как жесткость возникает в результате реакций катионов Ca2+ и Mg2+. Жесткость CaCO3 может превышать общую щелочность CaCO3. Когда это происходит, часть жесткости, равная щелочности, называется карбонатной жесткостью или временной жесткостью, а величина, превышающая щелочность, называется некарбонатной жесткостью или постоянной жесткостью.
Жесткость CaCO3 может превышать общую щелочность CaCO3. Когда это происходит, часть жесткости, равная щелочности, называется карбонатной жесткостью или временной жесткостью, а величина, превышающая щелочность, называется некарбонатной жесткостью или постоянной жесткостью.
Важность жесткости
Жесткость иногда используется как показатель, пропорциональный общему количеству растворенных твердых веществ, поскольку Ca2+, Mg2+ и HCO3- часто представляют наибольшую часть общего количества растворенных твердых веществ. Влияние твердости на здоровье человека не доказано; однако сообщалось об обратной связи с сердечно-сосудистыми заболеваниями. Более высокие уровни жесткости питьевой воды коррелируют с более низкой частотой сердечно-сосудистых заболеваний. Высокий уровень жесткости воды может ограничивать рост рыб; с другой стороны, низкая жесткость (мягкая вода) может повышать чувствительность рыб к токсичным металлам. В общем, более высокая твердость полезна за счет снижения токсичности металлов для рыб. Стандарты качества воды для водных организмов для многих металлов рассчитываются с использованием уравнения, включающего жесткость воды в качестве переменной.
Стандарты качества воды для водных организмов для многих металлов рассчитываются с использованием уравнения, включающего жесткость воды в качестве переменной.
Основными преимуществами ограничения уровня жесткости (посредством умягчения воды) являются экономичность: меньшая потребность в мыле при бытовой и промышленной очистке и меньшее образование накипи в трубах и котлах. Обработка воды методом обратного осмоса (RO) часто требует предварительной очистки воды для предотвращения образования накипи на мембранах RO. Более широкое использование моющих средств, которые не образуют осадка с Ca2+ и Mg2+, уменьшило важность жесткости при потреблении мыла. С другой стороны, недостатком мягкой воды является то, что она более «коррозионная» или «агрессивная», чем жесткая вода. В этом контексте «коррозионный» означает, что мягкая вода легче растворяет ионы металлов из водопроводной системы, чем жесткая вода. Таким образом, в водопроводных системах, содержащих латунь, медь, оцинкованное железо или свинцовые припои, система мягкой воды будет содержать более высокие уровни растворенной меди, цинка, свинца и железа, чем система жесткой воды.
Полезные правила
1. Чем выше твердость, тем терпимее многие стандарты ручных металлов к водной жизни.
2. Жесткость выше 100 мг/л может привести к образованию значительных отложений накипи в котлах.
3. Чем мягче вода, тем выше склонность к растворению металлов из труб водопроводных сетей.
4. Идеальная цель качества для общей жесткости составляет около 70-90 мг/л. Муниципальная очистка иногда позволяет довести общую жесткость до 150 мг/л, чтобы снизить затраты на химические реагенты и образование осадка в результате осаждения Ca2+ и Mg2+.
Вода будет «жесткой» везде, где грунтовые воды проходят через месторождения карбонатов кальция и магния. Такие отложения очень широко распространены, и подземные воды от твердых до умеренно жестких встречаются чаще, чем мягкие подземные воды. Часто встречаются очень жесткие грунтовые воды. Карбонаты кальция и магния являются наиболее распространенными карбонатными минералами и основными источниками жесткой воды. Геологическая карта, показывающая распространение карбонатных минералов, служит также приблизительной картой распространения жестких подземных вод. Наиболее распространенными источниками мягкой воды являются места, где непосредственно используется дождевая вода или где поверхностные воды питаются больше за счет осадков, чем за счет подземных вод.
Геологическая карта, показывающая распространение карбонатных минералов, служит также приблизительной картой распространения жестких подземных вод. Наиболее распространенными источниками мягкой воды являются места, где непосредственно используется дождевая вода или где поверхностные воды питаются больше за счет осадков, чем за счет подземных вод.
Эмпирические правила | ||
Степень твердости | мг CaCO3/л | Эффекты |
Мягкий | <75 | Может повышать токсичность растворенных металлов. Отсутствие отложений накипи. Эффективное использование мыла. |
Умеренно жесткий | 75 — 120 | Не вызывает возражений для большинства целей Требуется немного больше мыла для очистки. При концентрации выше 100 мг/л в котлах образуется значительное количество накипи. |


