Содержание
Строение молекул воды. Полярность химической связи. Ионизирующая способность воды.
Особенностью
строения молекулы воды (h3O),
является уголковая структура. Молекулы
расположены под углом 105 град. Это создаёт
смещение центров тяжести + и – зарядов.
Следствие развитие ядра-молекулярная
орбиталь смещается в сторону атома
кислорода, создаётся некоторый избыточный
заряд. Молекуа воды-диполь(+и-) Такие
молекулы называют полярными, а хим.
связь- полярной хим. Связью. Степень
полярности оценивается величиной
дипольного момента. Вода обладает
максимальной величиной дипольного
момента. Полярность создаёт возможность
электростатического взаимодействия
воды- водородная связь. Внутриполярной
связи молекул воды являются ковалентными,
а водородная связь- межмол. Связь-
донорно-акцепторной. Вода имеет
максимальную диэлектрическую постоянную.
Взаимодействие между точечными зарядами
снижается. Все аномальные физические
свойства воды объясняются полярностью
химических связей в молекуле воды, в
следствии этого явления- появляется
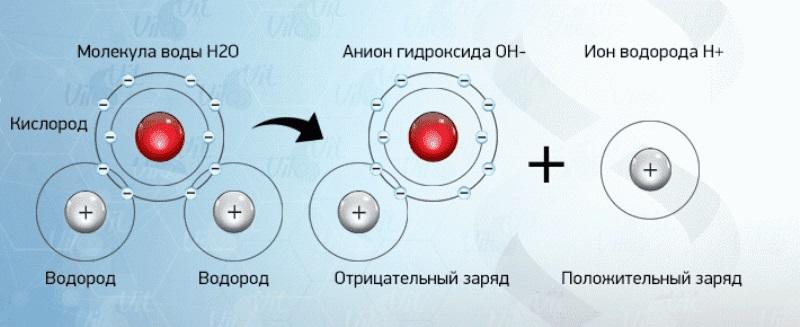
ещё одно важное свойство воды-ионизирующая
способность воды.
Строение
молекулы воды
а
—
угол между валентными связями О—Н; б
—
структура электронного
облака;
в
—
расположение зарядов
Физ. свойства
При таянии льда
его плотность увеличивается (с 0,9 до 1
г/см³). Почти у всех остальных веществ
при плавлении плотность уменьшается.При нагревании от
0 °C до 3,98 °C вода сжимается. Благодаря
этому в замерзающих водоёмах: когда
температура падает ниже 4 °C, более
холодная вода, как менее плотная,
остаётся на поверхности и замерзает,
а подо льдом сохраняется положительная
температура.Вода обладает
высокой температурой и удельной теплотой
плавления (0 °C и 333,55 кДж/кг), температура
кипения (100 °C) и удельная теплота
парообразования (2250 КДж/кг ), по сравнению
с соединениями водорода с похожим
молекулярным весом.Высокая теплоёмкость
жидкой воды.
Высокая вязкость.
Высокое поверхностное
натяжение.Отрицательный
электрический потенциал поверхности
воды.
Эти особенности воды
связаны с наличием водородных связей
При таянии льда
часть связей рвётся, что позволяет
уложить молекулы воды плотнее; при
нагревании воды связи продолжают
рваться, и плотность её растёт, но при
температуре выше 4 °С этот эффект слабее,
чем обычное тепловое расширение; при
испарении рвутся все оставшиеся связи.
Разрыв связей
требует много энергии, отсюда высокая
температура и удельная теплота плавления
и кипения и высокая теплоёмкость.
Вязкость воды обусловлена тем, что
водородные связи мешают молекулам воды
двигаться с разными скоростями.
Химические
свойства
Химические свойства
воды определяются особенностями ее
строения. Вода довольно устойчивое
вещество, она начинает разлагаться на
водород и кислород при нагревании по
крайней мере до 1000°С ( происходит
термическая диссоциация) или под
действием ультрафиолетового излучения
(фотохимическая диссоциация).
Вода относится к
химически активным соединениям. Например,
реагирует с фтором. Хлор при нагревании
или на свету разлагает воду с выделением
атомарного кислорода:
h3O + Cl2 = HCl + HClO (НСlО
= НСl + О)
При обычных условиях
она взаимодействует с активными
металлами:
2h3O + Ca =
Ca(ОН)
2 + h3
2h3O + 2Na =
2NaOH + h3
Вода вступает в
реакцию и со многими неметаллами.
Например, при взаимодействии с атомарным
кислородом образуется пероксид водорода:
h3O + O = h3O2
Многие оксиды
реагируют с водой, образуя основания и
кислоты:
CO2
+ h3O
= h3CO3
CaO
+ h3O
= Ca(OH)2
При взаимодействии
с некоторыми солями образуются
кристаллогидраты. При нагревании они
теряют кристаллизационную воду:
Na2CO3 + 10h3O = Na2CO3*10h3O.
Взаимодействие
ионов соли с водой, приводящее к
образованию молекул слабого электролита,
называют гидролизом
солей.
Различают несколько
вариантов гидролиза солей:
1. Гидролиз соли
слабой кислоты и сильного основания:
Na2CO3 + Н2О
= NaHCO3 + NaOH
CO32- + h3O
= HCO3- + OН-
(раствор имеет
щелочную среду, реакция протекает
обратимо)
2. Гидролиз соли
Гидролиз соли
сильной кислоты и слабого основания:
СuСl2 + Н2О = CuOHCl + HCl
Cu2+ + Н2О = CuOH+ + Н+
(раствор имеет
кислую среду, реакция протекает обратимо)
3. Гидролиз соли
слабой кислоты и слабого основания:
Al2S3 + 6h3O
= 2Al(OН)3
+ 3h3S
2Аl3+
+ 3S2- + 6Н2О
= 2Аl(OН)3(осадок)
+ ЗН2S(газ)
(Гидролиз в этом
случае протекает практически полностью,
так как оба продукта гидролиза уходят
из сферы реакции в виде осадка или газа).
Соль сильной кислоты
и сильного основания не подвергается
гидролизу, и имеет нейтральную среду.
Педагогическое сообщество «Урок.рф»
Педагогическое сообщество «Урок.рф»
| 12+ Свидетельство СМИ ЭЛ № ФС 77 — 70917 Лицензия на образовательную деятельность №0001058 | Пользовательское соглашение Контактная и правовая информация |
Педагогическое сообщество | Бесплатные всероссийские конкурсы | Бесплатные сертификаты | Нужна помощь? Инструкции для новых участников | Бесплатная онлайн-школа для 1-4 классов |
Всё для аттестацииПубликация в сборникеВебинарыЛэпбукиПрофтестыЗаказ рецензийНовости
ДОБРО ПОЖАЛОВАТЬ!
Педагогическое сообщество «УРОК.РФ» предназначено для работников школьного, дошкольного и дополнительного образования, а также для всех специалистов, занимающихся образовательной и воспитательной деятельностью.
Педагогическое сообщество «УРОК.РФ» – это сайт, созданный учителями для учителей!
Узнать больше о сайте
Новости
- Итоги конкурсов детского творчества от учебного центра «Урок»
- Итоги Осенней серии конкурсов от учебного центра «Урок»
- Открыт этап регистарции в интеллектуально-творческом марафоне для школьников
- Стартовал блиц-конкурс на лучшую статью с призами от Учебного центра «Урок»
Все новостиАнонсы мероприятий
Новое
0
#УМК В.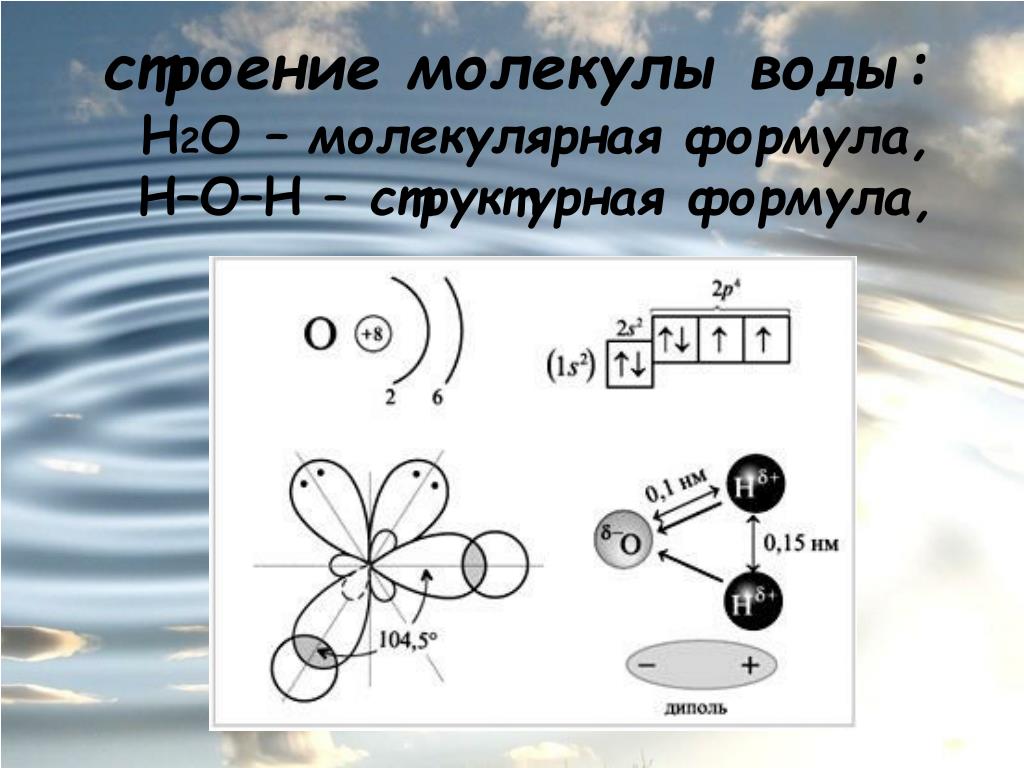 Я. Коровиной #Школьное образование #Учитель-предметник #Урок #Методические разработки #ФГОС #Литература #6 класс
Я. Коровиной #Школьное образование #Учитель-предметник #Урок #Методические разработки #ФГОС #Литература #6 класс
Конспект урока по литературе
Ихавова Зайнаб Османовна
0
1
#Школьное образование #Учитель-предметник #Научно-исследовательская работа #Методические разработки #Математика
Данная статья «МОТИВАЦИЯ НА ОБУЧЕНИЕ: ВИДЫ И СПОСОБЫ ФОРМИРОВАНИЯ, МОДЕЛИ ВНЕДРЕНИЯ» подготовлена для участия в конкурсе методических разработок учителей-предметников с целью практического применения
Беляева Наталья Александровна0
Опубликовано в группе «УРОК.РФ: группа для участников конкурсов»
4
#ПЕСОчница (отдыхаем от работы)
Https://vk. com/topic-47976727_49171369
com/topic-47976727_49171369
Русаков Владимир Николаевич
Опубликовано в группе «Летние каникулы online»
1
#Школьное образование #Учитель начальных классов #Презентация #Учебно-методические материалы #Окружающий мир #2 класс
Цель: познакомить учащихся с зимними явлениями природы, с изменениями, происходящими в мире живой природы в зимнее время года.
Сидорова Алевтина Александровна
0
0
#Первая категория #Музыкальный руководитель #Анализ/ Самоанализ #Документы
Мониторинг — сводная таблица на начало учебного года. Подготовительная группа
Туркина Ирина Ивановна
0
1
#Школьное образование #Студент-практикант #Учитель начальных классов #Презентация #Учебно-методические материалы #Математика #1 класс
Презентация предназначена к уроку повторения и обобщения знаний по теме » Сложение и вычитание в пределах 10″ 1 класс
Aлла Рябоконь
0
0
#УМК «Полярная звезда» А. И. Алексеева #Школьное образование #Учитель-предметник #Урок #Методические разработки #ФГОС #География #6 класс
И. Алексеева #Школьное образование #Учитель-предметник #Урок #Методические разработки #ФГОС #География #6 класс
Технологическая карта урока географии 6 класс
Тема урока: «Атмосферное давление»
Раздаточный материал. Задачи.
Раздаточный материал. Задачи. Урок Атмосферное давление.
Презентация к уроку.
Царёва Светлана Владимировна
0
1
#Дошкольное образование #Консультация учеников (советы, рекомендации) #Методические разработки
Роль родителей в развитии речи дошкольника
Анна
0
0
#Дошкольное образование #Логопед #Психолог #Задача / упражнение / практикум #Учебно-дидактические материалы
Артикуляционная гимнастик звук «Р»
Анна
0
2
#Музыкальный руководитель #Воспитатель #План профилактической работы #Планы #ФГОС
План на летне — оздоровительный период 2015 г.
Туркина Ирина Ивановна
0
Закрыть
Полярность воды | bartleby
Что такое полярность?
Простыми химическими терминами полярность относится к разделению зарядов в химическом веществе, ведущему к образованию двух полярных концов: положительно заряженного конца и отрицательно заряженного конца. Полярность в любой молекуле возникает из-за различий электроотрицательностей связанных атомов. В воде, как мы все знаем, два атома водорода связаны с атомом кислорода. Поскольку кислород более электроотрицательный, чем водород , в связях существует полярность, поэтому вода известна как полярный растворитель.
Почему Воду называют Универсальным Растворителем?
Вода является жизненно важным средством, необходимым для всех живых организмов. В народе воду называют универсальным растворителем из-за ее способности растворять многие вещества и, следовательно, в большинстве случаев действовать как растворитель. Эта способность растворять многочисленные вещества объясняется высокой полярностью воды. Многие повседневные действия, такие как приготовление пищи, действие мыла и моющих средств, таяние льда и т. д. – это различные результаты полярности воды.
В народе воду называют универсальным растворителем из-за ее способности растворять многие вещества и, следовательно, в большинстве случаев действовать как растворитель. Эта способность растворять многочисленные вещества объясняется высокой полярностью воды. Многие повседневные действия, такие как приготовление пищи, действие мыла и моющих средств, таяние льда и т. д. – это различные результаты полярности воды.
Почему вода полярная?
Вода полярна в основном из-за двух основных понятий: разницы в электроотрицательности и молекулярной формы.
Электроотрицательность
Электроотрицательность — это способность вещества притягивать к себе пару электронов. Он увеличивается по периоду и убывает по группе периодической таблицы. Электроотрицательность водорода равна 2,1, а кислорода имеет электроотрицательность 3,5. Поскольку кислород явно электроотрицательнее водорода, он притягивает к себе электроны атомов водорода, вызывая разделение зарядов в обеих связях O-H, следовательно, в молекуле существует полярность. Разница электроотрицательностей между кислородом и водородом не так велика, как в случае ионных связей, поэтому связи в воде ковалентны, но они также полярны, поэтому их называют полярными ковалентными связями.
Разница электроотрицательностей между кислородом и водородом не так велика, как в случае ионных связей, поэтому связи в воде ковалентны, но они также полярны, поэтому их называют полярными ковалентными связями.
Молекулярная форма
Вода не является линейной структурой и имеет изогнутую геометрию с sp3-гибридизацией. Здесь кислород имеет две заполненные орбитальные связи с атомами водорода и две неподеленные пары. Поскольку отталкивание одинокой пары от одинокой пары выше по своей природе, одинокие пары занимают максимально возможное расстояние. Но поскольку между кислородом и водородом существует притяжение из-за разницы в электроотрицательности, обе связи O-H выравниваются таким образом, чтобы уравновесить отталкивание и притяжение, что приводит к изогнутой геометрии или V-образной форме. Это важная причина, почему вода полярна, потому что, если бы вода имела линейную структуру, заряды нейтрализовали бы друг друга по обе стороны от кислорода. Это могло привести к неполярной молекуле, как в случае двуокиси углерода, которая имеет линейную геометрию.
Дипольный момент
Дипольный момент — это векторная величина, которая служит мерой полярности связей. Математически дипольный момент представляет собой произведение зарядов и расстояния между зарядами. Обозначается буквой «мк».
μ=q.d
Где q — величина зарядов, измеренная в кулонах (Кл), а dis — расстояние между положительными и отрицательными зарядами в системе, измеренное в метрах (м). Дипольный момент измеряется в единицах Дебая, обозначаемых буквой «D».
1 D = 3,33564 × 10−30 см
Как упоминалось ранее, дипольный момент является векторной величиной, имеющей как величину, так и направление, поэтому вода, изогнутая по форме, делает ее полярной молекулой, поскольку векторы не сокращаются. друг друга в V-образной форме. Но в случае двуокиси углерода (CO2) геометрия является линейной, поэтому векторы выравниваются равным и противоположным образом, компенсируя друг друга. Вот почему, хотя между кислородом и углеродом существует хорошая разница в электроотрицательности, CO2 не является полярным, как в случае воды.
Известно, что чистый дипольный момент воды составляет 1,85 единицы Дебая. Это немного высокое значение для ковалентной молекулы, поэтому связи в воде известны как полярные ковалентные связи в соответствии с правилом Фаяна.
Дипольный момент служит основным свойством для определения характера связи между атомами в молекуле. Очень высокие дипольные моменты наблюдаются в ионных связях, умеренные значения получаются для полярных ковалентных связей, а наименьшие значения получаются для неполярных связей и ковалентных связей, как в органических молекулах. С другой стороны, металлические связи и связи в гомоядерных двухатомных молекулах постоянно не обладают дипольным моментом. Но могут проявиться временные слабые силы, если они находятся в контакте с другими молекулами.
Как полярность влияет на растворимость в воде?
Когда дело доходит до растворимости, всегда следует следовать одному основному правилу: « Подобное растворяется подобно ». Это означает, что полярные растворенные вещества могут растворяться только в полярных растворителях, а неполярные растворенные вещества могут растворяться только в неполярных растворителях.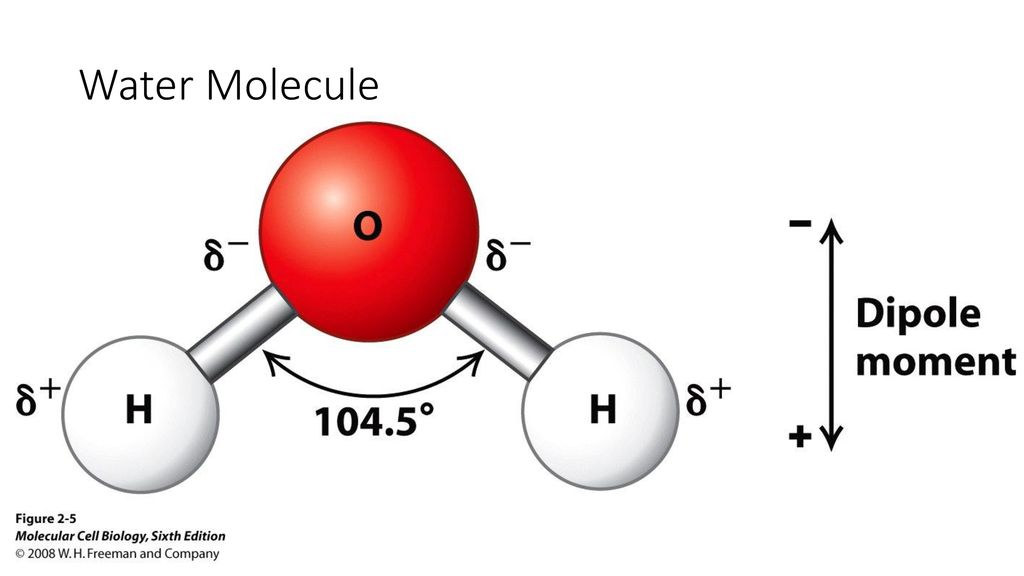 Это правило относится и к универсальной воде-растворителю, которая является полярным растворителем. Будучи полярным растворителем, вода может растворять только полярные вещества, а неполярные вещества в воде не растворяются.
Это правило относится и к универсальной воде-растворителю, которая является полярным растворителем. Будучи полярным растворителем, вода может растворять только полярные вещества, а неполярные вещества в воде не растворяются.
Очень популярным примером является растворение поваренной соли в воде. Соль представляет собой ионное соединение с ионами Na+Cl–, обладающее полярностью. Поэтому он легко растворяется в воде. Но масло, являющееся органическим соединением, нерастворимо в воде, так как представляет собой неполярное вещество с длинной цепью жирных кислот. Жирные кислоты не имеют полярности в своих связях.
Свойства, зависящие от полярности
Поверхностное натяжение и сцепление в воде
Как известно, в воде есть водородные связи. Кроме того, полярность воды также играет роль в склеивании молекул воды, что называется когезионным свойством воды. Поверхностное натяжение — это свойство, благодаря которому вода притягивает вещество на своей поверхности к остальной жидкости вниз, это результирующий эффект полярности воды.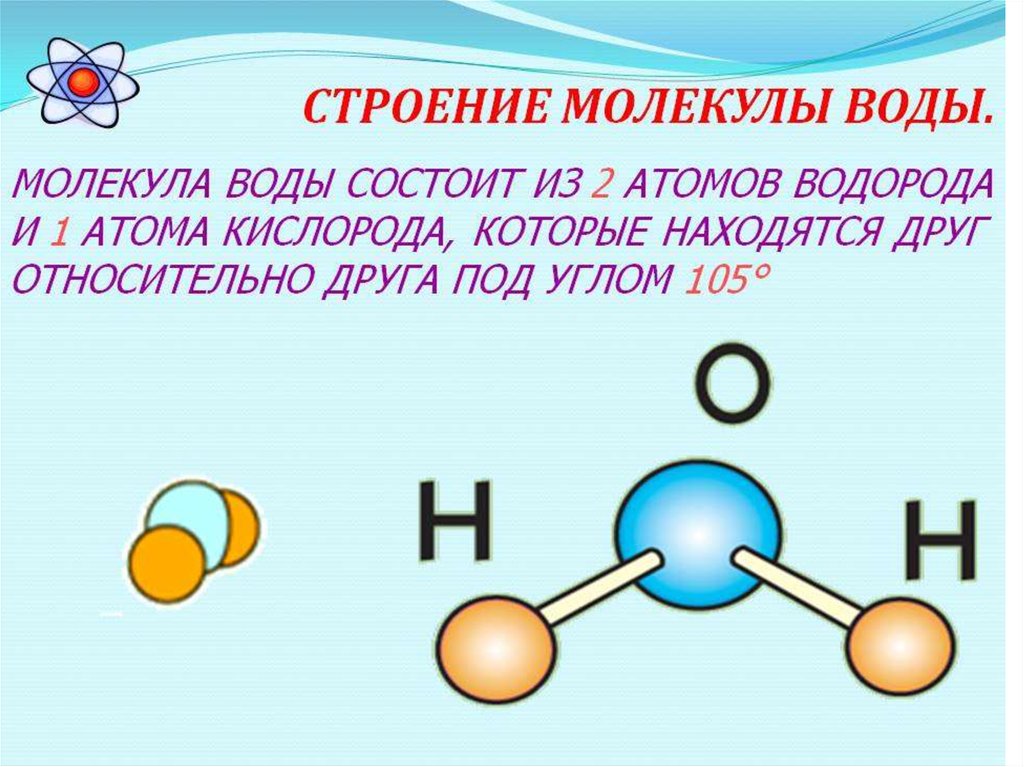 Из-за разделения зарядов в молекуле воды на молекулы на поверхности воды действуют электростатические силы, которые немедленно втягивают ее внутрь или в объем. Как отрицательно, так и положительно заряженные вещества могут притягиваться из-за наличия диполярной природы воды. Вот почему известно, что вода имеет высокое поверхностное натяжение и уменьшает площадь поверхности. Высокое поверхностное натяжение в воде заставляет воду образовывать капли, а не растекаться в виде слоя, как в масле.
Из-за разделения зарядов в молекуле воды на молекулы на поверхности воды действуют электростатические силы, которые немедленно втягивают ее внутрь или в объем. Как отрицательно, так и положительно заряженные вещества могут притягиваться из-за наличия диполярной природы воды. Вот почему известно, что вода имеет высокое поверхностное натяжение и уменьшает площадь поверхности. Высокое поверхностное натяжение в воде заставляет воду образовывать капли, а не растекаться в виде слоя, как в масле.
Жидкое состояние воды
Мы знаем, что молекулы могут существовать в трех фазах: твердом, жидком и газообразном. Но известно, что вода при комнатной температуре существует в жидком состоянии из-за сильных межмолекулярных сил в воде, таких как водородные связи. Образование водородной связи связано с полярностью воды. Электрически отрицательный кислород имеет тенденцию притягивать электрически положительный водород другой молекулы воды, что приводит к образованию водородной связи. Четыре таких водородных связи могут образовываться на молекулу воды, усиливая ее межмолекулярные силы притяжения. Когда между молекулами больше такого притяжения, молекула имеет тенденцию слипаться и существовать в жидком состоянии.
Когда между молекулами больше такого притяжения, молекула имеет тенденцию слипаться и существовать в жидком состоянии.
Другие физические свойства
Как упоминалось выше, полярность воды является причиной образования в них водородных связей. Водородная связь, в свою очередь, приводит к более высокой удельной теплоемкости, более высокому давлению пара, более высокой адгезии, более высокой температуре плавления и кипения и более высокой плотности воды. Плотность воды представляет особый интерес, поскольку вода, замерзая в лед, имеет меньшую плотность, чем жидкая вода. Это связано с тем, что при замерзании вода расширяется, что приводит к увеличению объема с тем же количеством молекул в ней, что приводит к снижению плотности. Именно по этой причине лед плавает на воде, а водная жизнь существует в холоде.
Распространенные ошибки
- Хотя мы говорим, что вода полярна и в ней есть разделение зарядов, молекула воды в целом является нейтральной молекулой, она не заряжена.
 Разделение зарядов в связях не обязательно означает, что молекулы должны существовать в виде ионов, эти разделенные заряды не являются полностью положительными или полностью отрицательными по своей природе, поэтому они не могут существовать в виде стабильных ионов. Более того, находясь в ковалентно связанной системе, они не могут существовать в виде ионов, и поэтому вода всегда является нейтральной молекулой.
Разделение зарядов в связях не обязательно означает, что молекулы должны существовать в виде ионов, эти разделенные заряды не являются полностью положительными или полностью отрицательными по своей природе, поэтому они не могут существовать в виде стабильных ионов. Более того, находясь в ковалентно связанной системе, они не могут существовать в виде ионов, и поэтому вода всегда является нейтральной молекулой.
- Не путайте геометрию воды с тетраэдром, поскольку она имеет геометрию sp3. Наличие двух неподеленных пар у центрального атома кислорода уменьшает тетраэдрический угол со 109,50 до 104,50. Следовательно, форма воды V-образная или изогнутая.
Контекст и приложения
Эта тема важна для профессиональных экзаменов как для бакалавров, так и для выпускников, особенно для бакалавров и магистров в области химии, биохимии, химической инженерии.
Практическая задача
Q1. Учитывая, что дипольный момент воды равен 1,85D. Найдите дипольный момент воды в см?
Q2. Назовите факторы, влияющие на полярность воды?
Назовите факторы, влияющие на полярность воды?
Q3. Объясните, почему вода имеет высокую температуру кипения?
Решение
Ответ1. Мы знаем, что 1 D = 3,33564 × 10−30 см.
Таким образом, если полярность воды равна 1,85 Д, то ее значением в см будет 1,85×3,33564×10−30.
Полученное значение равно 6,1709× 10−30 см.
Ответ2. Полярность воды зависит от разницы электроотрицательностей между атомами и молекулярной формы воды.
Ответ3. Вода полярна по своей природе. Полярные соединения имеют тенденцию располагать их таким образом, чтобы положительный и отрицательный заряды разделялись. Из-за разделения зарядов на сцену выходят слабые силы, такие как дисперсионные силы, и они усиливают межмолекулярные силы притяжения по сравнению с силами неполярного соединения. Вода в дополнение к этому имеет водородные связи в результате своей полярности, тем самым обладая действительно сильными межмолекулярными силами. Это заставляет молекулу удерживаться вместе и существовать в жидком состоянии.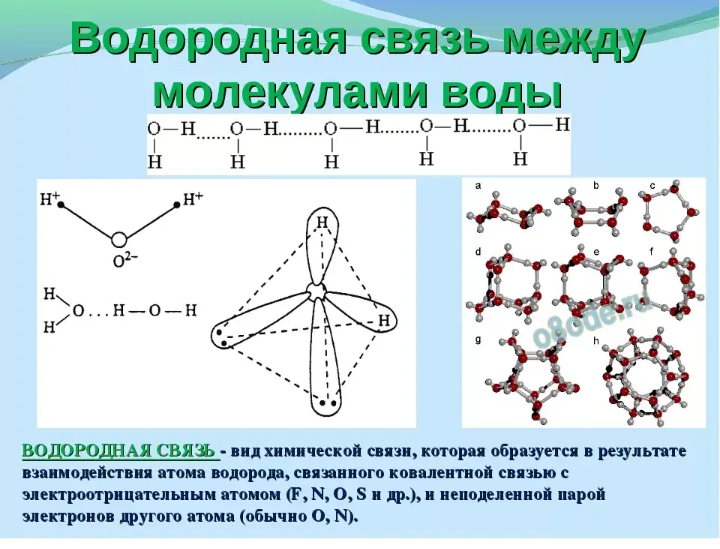 Следовательно, чтобы разрушить эти межмолекулярные силы и перейти в газообразное состояние, требуется высокая энергия. Только более высокие температуры могут обеспечить такую высокую энергию в виде тепла, чтобы разрушить эти межмолекулярные силы и привести к испарению воды.
Следовательно, чтобы разрушить эти межмолекулярные силы и перейти в газообразное состояние, требуется высокая энергия. Только более высокие температуры могут обеспечить такую высокую энергию в виде тепла, чтобы разрушить эти межмолекулярные силы и привести к испарению воды.
Мы обеспечим вас пошаговыми решениями миллионов задач из учебников, экспертами в любой области наготове 24 часа в сутки, 7 дней в неделю, когда вы запутались, и многое другое.
Ознакомьтесь с образцом решения вопросов и ответов по химии здесь!
*Время ответа зависит от темы и сложности вопроса. Среднее время отклика составляет 34 минуты для платных подписчиков и может быть больше для рекламных предложений.
Влияние полярности воды на живые существа
Обновлено 10 апреля 2018 г.
Автор Chris Deziel
Молекула воды электрически нейтральна, но асимметричное расположение атомов водорода на атоме кислорода придает ей чистый положительный заряд с одной стороны и отрицательный заряд с другой. Среди важных последствий для живых организмов — способность воды растворять множество веществ больше, чем любая другая жидкость, и ее сильное поверхностное натяжение, которое позволяет ей образовывать капли и проходить через крошечные корни, стебли и капилляры. Вода — единственное вещество, которое существует в виде газа, жидкости и твердого тела при температурах, характерных для Земли, и из-за полярности молекулы воды твердое состояние менее плотное, чем жидкое. В результате лед плавает, и это имеет серьезные последствия для жизни повсюду на планете.
Среди важных последствий для живых организмов — способность воды растворять множество веществ больше, чем любая другая жидкость, и ее сильное поверхностное натяжение, которое позволяет ей образовывать капли и проходить через крошечные корни, стебли и капилляры. Вода — единственное вещество, которое существует в виде газа, жидкости и твердого тела при температурах, характерных для Земли, и из-за полярности молекулы воды твердое состояние менее плотное, чем жидкое. В результате лед плавает, и это имеет серьезные последствия для жизни повсюду на планете.
Водородная связь
Простой способ оценить полярную природу молекулы воды — представить ее в виде головы Микки Мауса. Атомы водорода сидят на молекуле кислорода почти так же, как уши сидят на голове Микки. Это искаженное тетраэдрическое расположение возникает из-за того, как электроны распределяются между атомами. Атомы водорода образуют угол 104,5 градуса, что придает каждой молекуле характеристики электрического диполя или магнита.
Положительная (водородная) сторона каждой молекулы воды притягивается к отрицательной (кислородной) стороне окружающих молекул в процессе, называемом водородной связью. Каждая водородная связь длится всего долю секунды и недостаточно сильна, чтобы разорвать ковалентные связи между атомами, но придает воде аномальную природу по сравнению с другими жидкостями, такими как спирт. Три аномалии особенно важны для живых организмов.
Растворитель жизни
Из-за своей полярной природы вода способна растворять так много веществ, что ученые иногда называют ее универсальным растворителем. Организмы поглощают многие необходимые питательные вещества, включая углерод, азот, фосфор, калий, кальций, магний и серу из воды. Более того, когда вода растворяет ионное твердое вещество, такое как хлорид натрия, ионы свободно плавают в растворе и превращают его в электролит. Электролиты проводят электрические сигналы, необходимые для передачи нейронных сигналов, а также те, которые регулируют другие биофизические процессы. Вода также является средой, через которую организмы выводят продукты метаболизма.
Вода также является средой, через которую организмы выводят продукты метаболизма.
Связующая сила питания
Электростатическое притяжение молекул воды друг к другу создает явление поверхностного натяжения, при котором поверхность жидкой воды образует барьер, по которому могут ходить некоторые насекомые. Поверхностное натяжение заставляет воду собираться в капли, и когда одна капля приближается к другой, они притягиваются друг к другу, образуя единую каплю.
Из-за этого притяжения вода может втягиваться в маленькие капилляры в виде постоянного потока. Это позволяет растениям вытягивать влагу из почвы через свои корни, а высоким деревьям — получать питание, втягивая сок через свои поры. Притяжение молекул воды друг к другу также помогает жидкости циркулировать в телах животных.
Аномалия плавучего льда
Если бы лед не плавал, мир был бы другим местом и, вероятно, не смог бы поддерживать жизнь.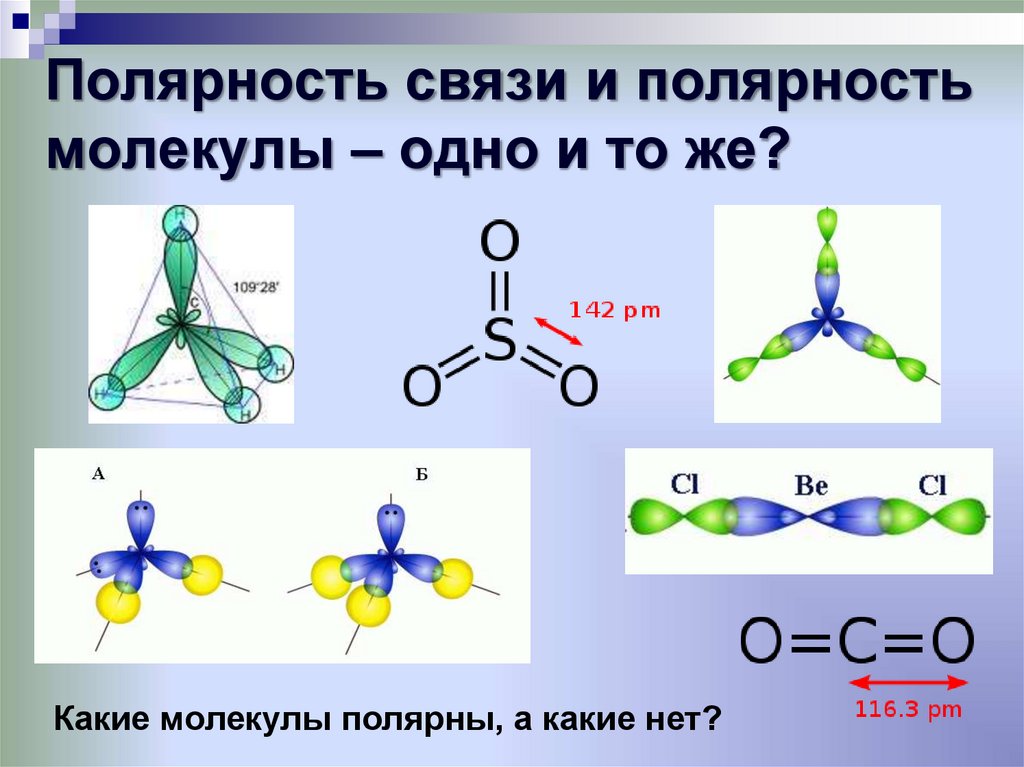


 РФ
РФ Разделение зарядов в связях не обязательно означает, что молекулы должны существовать в виде ионов, эти разделенные заряды не являются полностью положительными или полностью отрицательными по своей природе, поэтому они не могут существовать в виде стабильных ионов. Более того, находясь в ковалентно связанной системе, они не могут существовать в виде ионов, и поэтому вода всегда является нейтральной молекулой.
Разделение зарядов в связях не обязательно означает, что молекулы должны существовать в виде ионов, эти разделенные заряды не являются полностью положительными или полностью отрицательными по своей природе, поэтому они не могут существовать в виде стабильных ионов. Более того, находясь в ковалентно связанной системе, они не могут существовать в виде ионов, и поэтому вода всегда является нейтральной молекулой.