Содержание
Почему вода испаряется при комнатной температуре?
Общие знания
05.10.2021
2 301 2 минут чтения
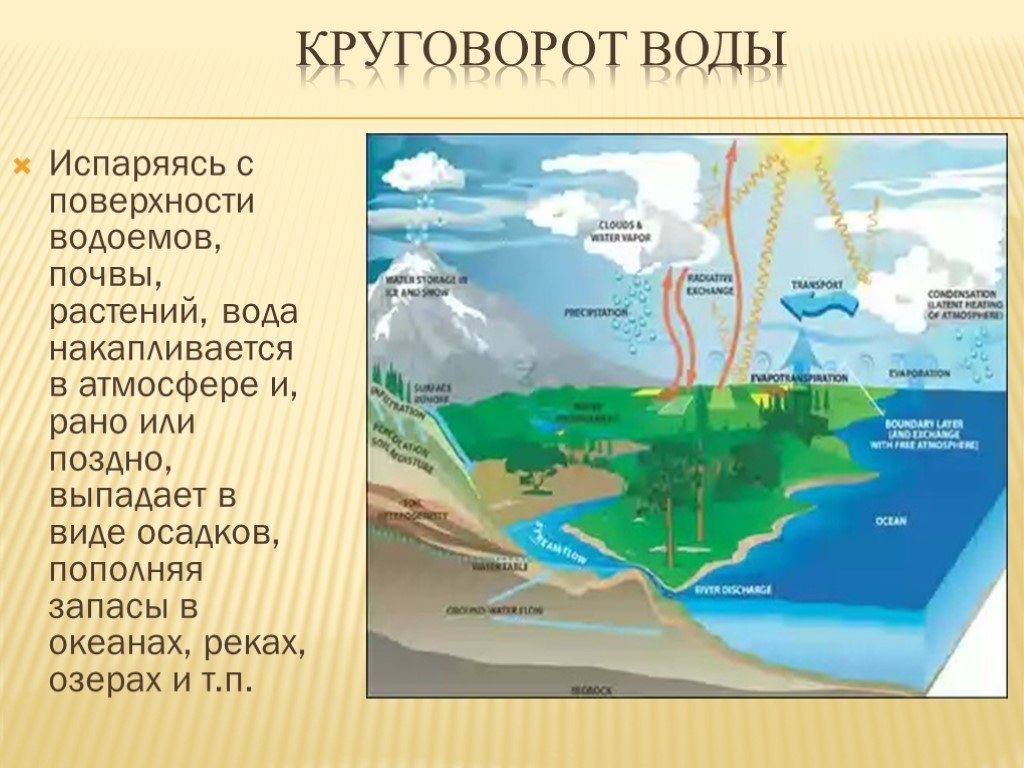
В школе нас учили, что когда вода закипает, она меняет фазу с жидкости на пар. Чтобы вызвать это изменение, требуется высокая температура, называемая точкой кипения. Для воды эта точка составляет 100 °C. Однако вспомните, что во время дождя лужи испаряются после прояснения неба, особенно когда выходит солнце. При испарении фаза воды также переходит из жидкой в парообразную, и это происходит при температурах, далеко не равных 100 °C.
Итак … почему это происходит?
Ответ кроется в физических и химических свойствах молекул воды и связей, образующихся между этими молекулами (межмолекулярных связей).
Химические свойства молекул воды
Молекула воды состоит из двух атомов водорода, соединенных с одним атомом кислорода. Связи между атомами O и H образуются за счет обмена электронами. Эти связи называются ковалентными. Каждый элемент стремится достичь энергетически наименьшего состояния (т.е. наиболее стабильного состояния), теряя или приобретая электроны, чтобы достичь ближайшей конфигурации благородного газа.
Эти связи называются ковалентными. Каждый элемент стремится достичь энергетически наименьшего состояния (т.е. наиболее стабильного состояния), теряя или приобретая электроны, чтобы достичь ближайшей конфигурации благородного газа.
Кислород содержит шесть электронов во внешней оболочке и нуждается в двух электронах, чтобы завершить октет и войти в конфигурацию благородного газа — неона. Водород имеет один электрон в своей внешней оболочке и, получив один электрон, может достичь конфигурации благородного газа гелия. Таким образом, один атом кислорода делится двумя электронами, а два атома водорода — одним электроном, образуя одну молекулу воды, т.е. h3O.
Молекула воды имеет слегка изогнутую форму благодаря электронам на атоме кислорода. Это способствует образованию межмолекулярной водородной связи.
Кислород имеет высокую склонность притягивать к себе электроны. Это свойство называется электроотрицательностью. Из-за высокой электроотрицательности электроны проводят больше времени вблизи O, и на O образуется частичный отрицательный заряд. Аналогично, на H образуется частичный положительный заряд. Геометрия молекулы воды такова, что происходит разделение положительных (вблизи двух атомов H) и отрицательных зарядов (на O).
Аналогично, на H образуется частичный положительный заряд. Геометрия молекулы воды такова, что происходит разделение положительных (вблизи двух атомов H) и отрицательных зарядов (на O).
Когда две молекулы воды находятся рядом друг с другом, частично отрицательный O одной молекулы имеет тенденцию притягивать частично положительный атом H другой молекулы, что приводит к слабой связи, называемой водородной связью. Эта связь существует между двумя разными молекулами (межмолекулярная связь). Поскольку водородная связь слабая, для ее разрыва требуется меньше энергии, поэтому вода остается жидкостью при комнатной температуре.
Температура и молекулярная энергия
Температура — это мера средней кинетической энергии, которой обладает молекула. Чем выше температура, тем больше средняя энергия, и тем легче молекулам преодолеть межмолекулярное притяжение и двигаться более свободно. Для того чтобы жидкость перешла в парообразное состояние, необходимо преодолеть две силы.
Первая — это межмолекулярное притяжение близлежащих молекул, называемое когезионными силами.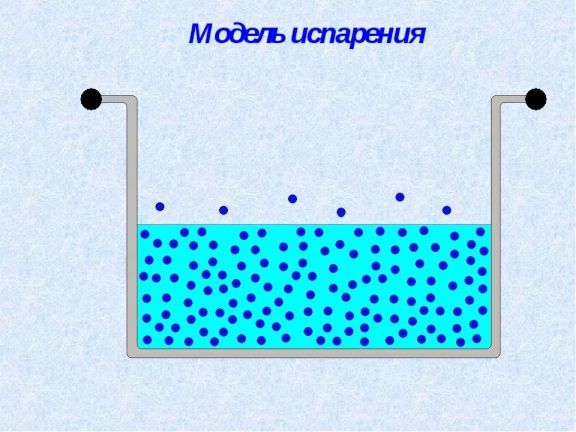 Вторая — нисходящее давление, оказываемое атмосферой. Когда жидкость меняет фазу на пар, ее молекулы приобретают достаточную кинетическую энергию, чтобы преодолеть все межмолекулярные силы, а также преодолеть нисходящее давление, оказываемое окружающей атмосферой.
Вторая — нисходящее давление, оказываемое атмосферой. Когда жидкость меняет фазу на пар, ее молекулы приобретают достаточную кинетическую энергию, чтобы преодолеть все межмолекулярные силы, а также преодолеть нисходящее давление, оказываемое окружающей атмосферой.
Влажность
Количество водяного пара, присутствующего в атмосфере, называется влажностью. При любой заданной температуре атмосфера может удерживать только фиксированное количество водяного пара. Чем выше температура, тем большее количество водяного пара присутствует в атмосфере. Концентрация водяного пара в атмосфере имеет верхний предел, за которым водяной пар не может удерживаться.
При испарении, в отличие от кипения, только некоторые молекулы на поверхности обладают достаточной энергией для перехода в парообразную фазу.
Испарение при комнатной температуре
Предположим, что вода налита на стол тонким слоем. Молекулы расположены слоями. Молекулы в самом верхнем слое испытывают межмолекулярные силы притяжения только снизу и с боков, тогда как молекулы в объеме жидкости испытывают межмолекулярное притяжение со всех сторон.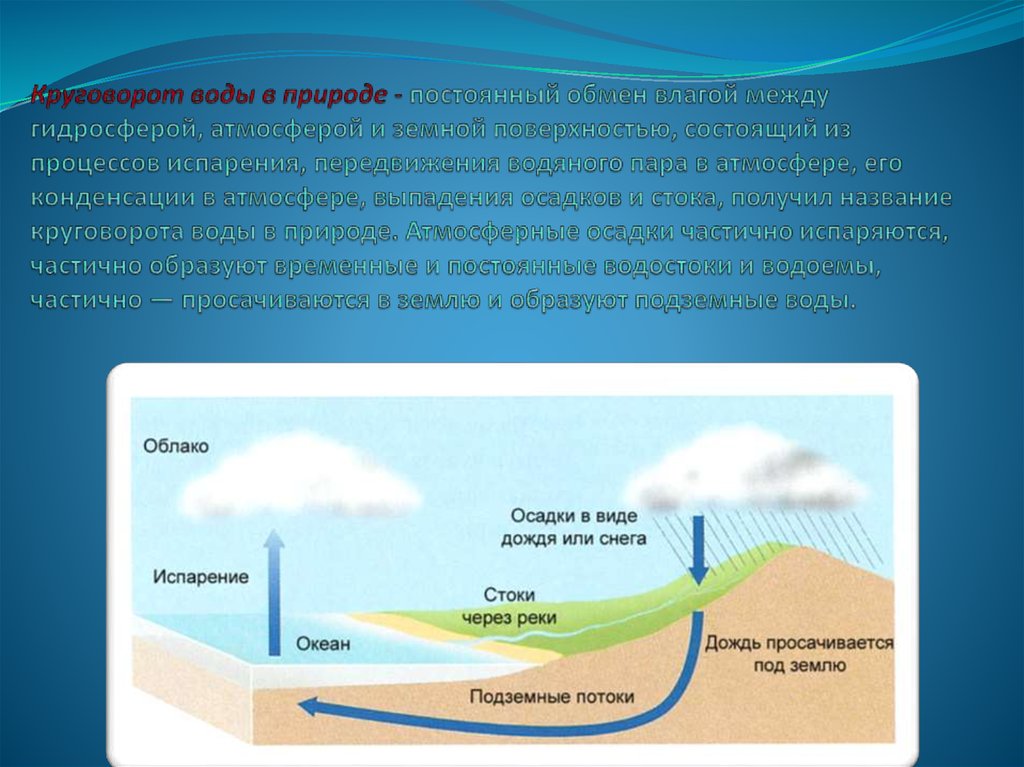 Таким образом, молекулы наверху испытывают меньшие суммарные межмолекулярные силы, чем молекулы внутри объема. Поскольку эти межмолекулярные силы (водородные связи) слабы, когда верхний слой подвергается воздействию солнечного света, некоторые молекулы получают достаточно кинетической энергии, чтобы уйти в атмосферу при комнатной температуре.
Таким образом, молекулы наверху испытывают меньшие суммарные межмолекулярные силы, чем молекулы внутри объема. Поскольку эти межмолекулярные силы (водородные связи) слабы, когда верхний слой подвергается воздействию солнечного света, некоторые молекулы получают достаточно кинетической энергии, чтобы уйти в атмосферу при комнатной температуре.
Более того, чем ниже влажность, тем легче испаряется жидкость. По мере испарения концентрация водяного пара в атмосфере увеличивается. За критическим порогом атмосфера больше не может удерживать водяной пар. Это называется состоянием насыщения. Если состояние насыщения не достигнуто, испарение продолжается.
Таким образом, сочетание влажности и высокой молекулярной энергии делает возможным испарение некоторых молекул на поверхности даже при низких температурах!
Подпишитесь на нас:Дзен.Новости / Вконтакте / Telegram
Back to top button
Экологи РУДН сравнили три модели испарения воды растениями в 251 точке Земли
Cookie-файлы
Этот сайт использует файлы cookie.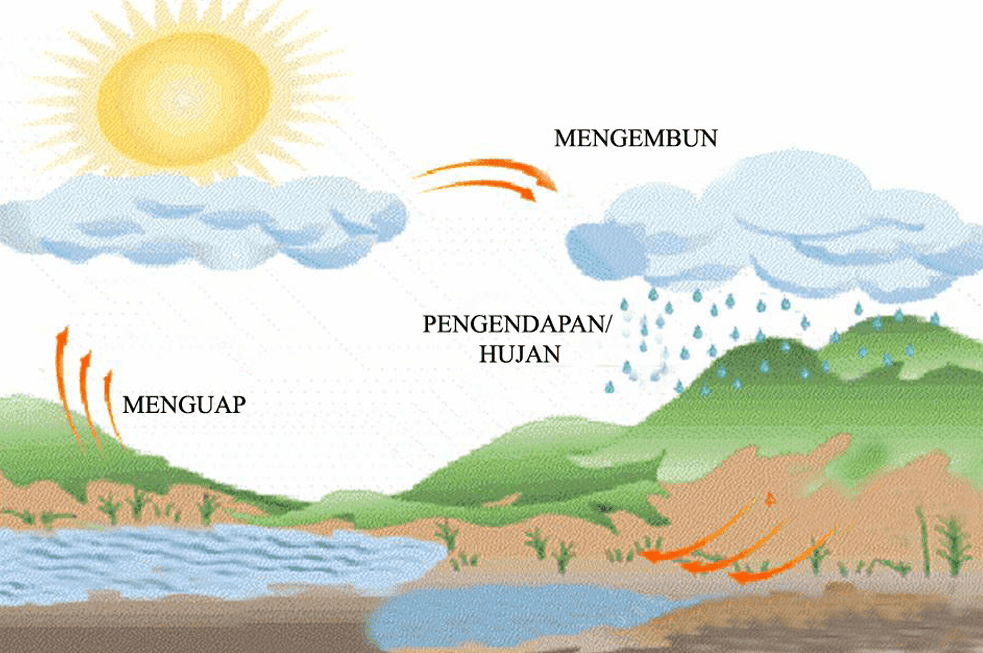 Собранная при помощи cookie информация не может идентифицировать вас, однако может помочь нам улучшить работу нашего сайта. Продолжая использовать сайт, вы даете согласие на обработку файлов cookie.
Собранная при помощи cookie информация не может идентифицировать вас, однако может помочь нам улучшить работу нашего сайта. Продолжая использовать сайт, вы даете согласие на обработку файлов cookie.
Хорошо
Подробнее
Медиа-центр
Новости
Наука
Экологи РУДН сравнили три модели испарения воды растениями в 251 точке Земли
Наука
07 июня 2021
Эколог РУДН с коллегами из 14 стран сравнил три модели испарения воды растениями. Это первое исследование такого масштаба — работа проведена на основе данных о количестве водяного пара в атмосфере в 251 точке планеты, от Австралии до Гренландии. Результаты помогут понять роль растений в глобальном круговороте воды и углерода в условиях глобального изменения климата.
Корни всасывают воду из почвы и доставляют к верхним листкам и веткам растений с помощью корневого давления. После листьев вода не возвращается вниз к корням — вместо этого она испаряется через отверстия для дыхания — устьица — и попадает в атмосферу. Этот процесс, при котором вода впитывается растениями и становится частью органического вещества, называется транспирацией. На нем пересекаются циклы углерода, воды и энергии в наземных экосистемах, поэтому изучение транспирации помогает оценивать вклад растений в изменение климата. Эколог РУДН в составе международной группы ученых сравнил три метода оценки транспирации, опираясь на данные глобальной сети микрометеорологических станций FLUXNET.
Этот процесс, при котором вода впитывается растениями и становится частью органического вещества, называется транспирацией. На нем пересекаются циклы углерода, воды и энергии в наземных экосистемах, поэтому изучение транспирации помогает оценивать вклад растений в изменение климата. Эколог РУДН в составе международной группы ученых сравнил три метода оценки транспирации, опираясь на данные глобальной сети микрометеорологических станций FLUXNET.
Экологи использовали данные 251 станции сети FLUXNET. На станциях измеряется, в том числе, количество водяного пара и углекислого газа в атмосфере методом турбулентной ковариации — по скорости движения воздуха приборы отслеживают вихревые потоки и перемещения различных газов в трех измерениях. Данные от станций экологи обработали тремя способами. В первой модели, uWUE, транспирацию и суммарное испарение воды с поверхности растений — эвапотранспирацию — рассчитали по сочетанию ежегодных данных и информации, полученной с шагом в восемь дней. Второй вариант, метод Перез-Приего, включает расчет с периодом пять дней четырех разных параметров — температуры, количества углекислого газа, насыщенности воздуха водяным паром и поглощения растениями солнечного света. Третий метод «TEA» основан на алгоритме машинного обучения — расчеты проводятся на основе «сырых» данных со станций, без каких-либо дополнительных предположений.
Второй вариант, метод Перез-Приего, включает расчет с периодом пять дней четырех разных параметров — температуры, количества углекислого газа, насыщенности воздуха водяным паром и поглощения растениями солнечного света. Третий метод «TEA» основан на алгоритме машинного обучения — расчеты проводятся на основе «сырых» данных со станций, без каких-либо дополнительных предположений.
«Все три метода основаны в конечном итоге на соотношении воды и углерода, но различаются по своим исходным предположениям и использованию параметров. Для трех методов измерения транспирации результаты хорошо совпали — с корреляцией от 89% до 94%. Однако соотношение транспирации к эвапотранспирации различается для трех методов — от 45% до 77%», — профессор Лука Беллели-Марчезини из Аграрно-технологического института РУДН.
Сравнив результаты трех подходов, экологи пришли к выводу, что соотношение транспирации и эвапотранспирации (T/ET) практически не зависит от климата — различия объясняются только характеристиками растительности и почвы.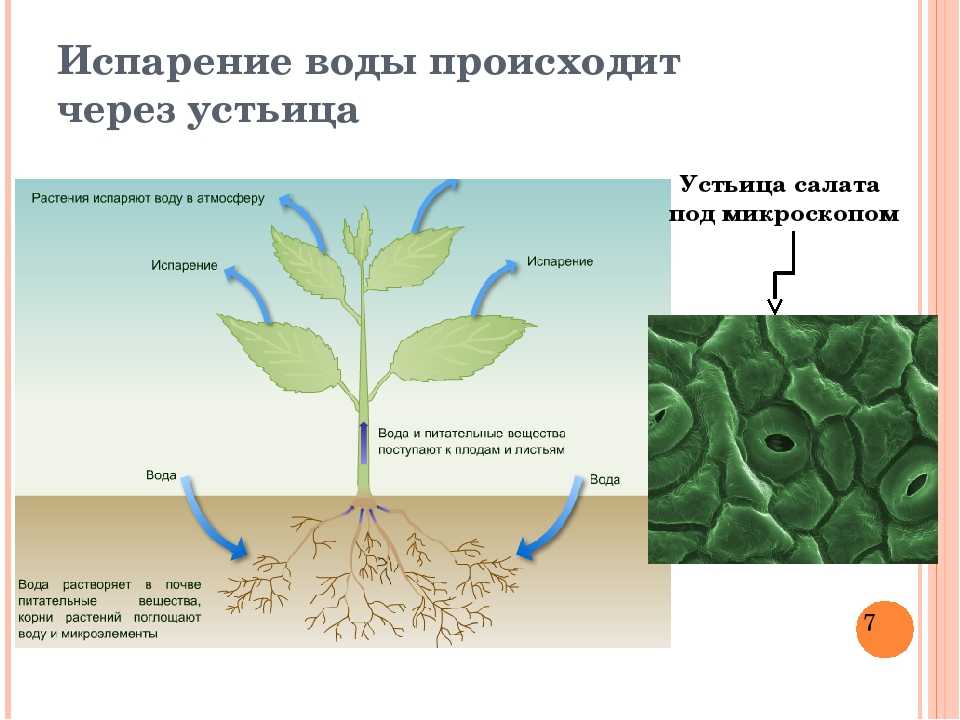 Для объяснения этой стабильности T/ET экологи предложили две гипотезы. Согласно первой, чем больше растительности, тем больше влаги удерживается растениями в экосистеме, но и тем больше воды испаряется с поверхности растений — эти два эффекта друг друга нейтрализуют. По второй гипотезе экосистемы адаптируются к тому количеству влаги, которое есть в доступе — в засушливом климате растения «берегут» воду и экономнее расходуют осадки.
Для объяснения этой стабильности T/ET экологи предложили две гипотезы. Согласно первой, чем больше растительности, тем больше влаги удерживается растениями в экосистеме, но и тем больше воды испаряется с поверхности растений — эти два эффекта друг друга нейтрализуют. По второй гипотезе экосистемы адаптируются к тому количеству влаги, которое есть в доступе — в засушливом климате растения «берегут» воду и экономнее расходуют осадки.
«Сочетание этих двух гипотез объясняет относительную неизменность соотношения T/ET в разных экосистемах. Это позволяет по-новому взглянуть на использование воды растениями и круговорот углерода по всему земному шару в изменяющемся климате», — заявил Лука Беллели-Марчезини, профессор РУДН.
Результаты опубликованы в журнале Global Change Biology.
Предыдущая новость
05 июня 2021
Стратегии привлечения иностранных студентов в российские вузы обсудили на научно-практической конференции
Следующая новость
07 июня 2021
«Хороший таможенник — тот, кто умеет быстро находить информацию» —Александр Чеботарев, выпускник юридического института РУДН
Эксперты из 15 стран дали ответы на вопросы о психическом здоровье
5–7 октября в РУДН состоялась конференция «Приверженность вопросам психического здоровья». В течение трех дней приглашенные участники мероприятия поднимали и обсуждали вопросы посвященные социальным, психологическим и медицинским аспектам жизни современного человека.
В течение трех дней приглашенные участники мероприятия поднимали и обсуждали вопросы посвященные социальным, психологическим и медицинским аспектам жизни современного человека.
Химик РУДН создал многоразовые ванадиевые катализаторы на углеродном каркасе
Химик РУДН совместно с коллегами из Португалии создал катализаторы на основе ванадия, закрепленные на углеродном каркасе. Их можно использовать, например, для получения адипиновой кислоты. Использование каркаса повысило эффективность катализаторов, сделала их многоразовыми и позволило проводить реакцию с микроволновым излучением вместо более энергозатратного обычного нагревания.
Директор НИИ нейрохирургии РУДН объединил 30 нейрохирургов из 8 стран на одной конференции
20 октября стартовала конференция «Хирургия основания черепа», в котором приняли участие 30 ведущих нейрохирургов из 8 стран. Организатор — Альберт Суфианов, директор Научно-исследовательского института нейрохирургии РУДН, главный врач Федерального центра нейрохирургии в Тюмени, доктор медицинских наук, профессор, член-корреспондент РАН, заслуженный врач РФ.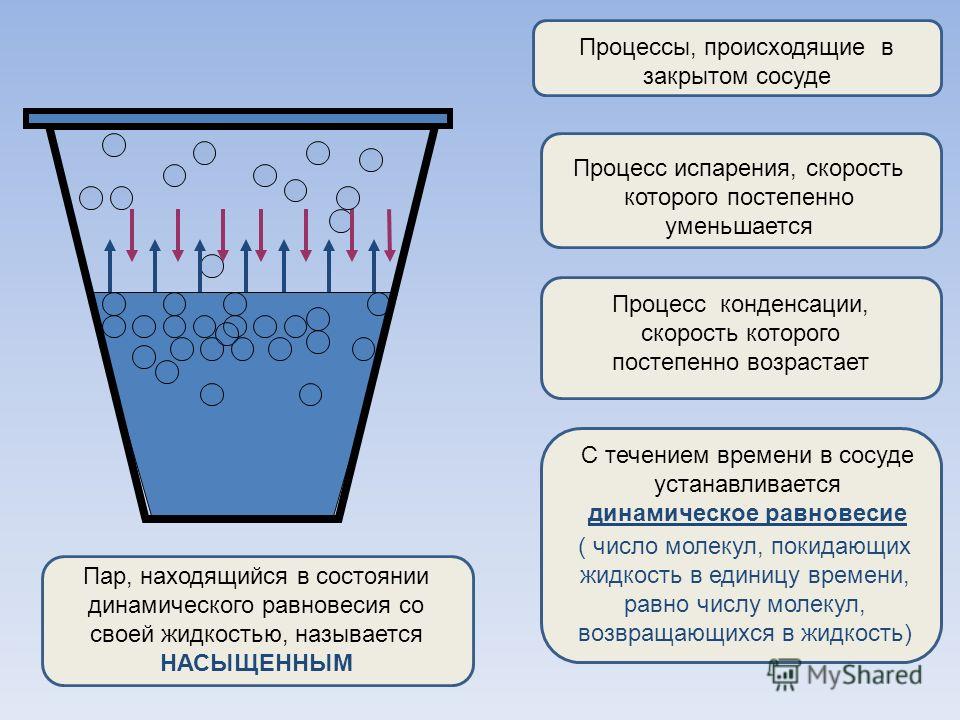
физическая химия — Почему вода самопроизвольно испаряется при комнатной температуре, несмотря на ΔG > 0?
спросил
Изменено
4 года, 1 месяц назад
Просмотрено
19 тысяч раз
$\begingroup$
Стандартная свободная энергия Гиббса образования жидкой воды при $\pu{298 K}$ составляет $\pu{−237,17 кДж моль-1}$, а водяного пара составляет $\pu{−228,57 кДж моль-1}$, поэтому
$$\ce{h3O (l) -> h3O (г)}\qquad\Delta G =\pu{8,43{кДж моль-1}}$$
Так как $\Delta G>0$, это не должен быть самопроизвольный процесс, но по общему наблюдению вода делает превращаются в пар из жидкости с течением времени без каких-либо видимых помех. Почему это происходит?
- физико-химия
- термодинамика
- свободная энергия
$\endgroup$
6
$\begingroup$
Стандартная свободная энергия Гиббса образования жидкой воды при 298 К составляет -237,17 кДж/моль, а водяного пара -228,57 кДж/моль.
\circ}}$ было бы отрицательной бесконечностью. Это будет означать бесконечное число 9.0017 отрицательный — т.е. очень спонтанный — $\Delta G$ для реакции испарения воды.
Небольшая, но не совсем нулевая сухость в атмосфере все же привела бы к $\Delta G$ водяного пара, более отрицательному, чем жидкая вода. Так что испарение воды по-прежнему происходит самопроизвольно.
Дополнительный балл: зная стандартную энергию образования, которую вы нашли, и предполагая, что вода является идеальным газом, вы можете рассчитать парциальное давление водяного пара, при котором $\Delta G = 0$ для испарения воды. И ответом лучше быть давление паров воды, иначе в вашем наборе данных есть термодинамическая несогласованность!
$\endgroup$
0
$\begingroup$
Есть два соображения по поводу того, почему вода испаряется, но только одно из них связано со свободной энергией испарения Гиббса.
Как правильно сказано в первом ответе, существует равновесие (сильно смещенное в пользу жидкости, а не пара) при комнатной температуре. В равновесии (которое измеряет $\Delta G$) тепловой энергии достаточно, чтобы перевести небольшое количество воды в паровую фазу, но большая часть воды останется жидкой. Это правильный анализ в закрытом сосуде. Вода не продолжает испаряться после достижения равновесия.
Но, в основном, в закрытых сосудах воды не наблюдаешь . Это объясняет, почему вода продолжает испаряться. Дело в том, что, когда пар можно удалить из сосуда с жидкостью, нормальное равновесие не устанавливается и вода может медленно испаряться (по крайней мере до тех пор, пока влажность окружающей среды ниже равновесного давления пара). ).
В открытых системах простые термодинамические числа неправильно описывают долгосрочное поведение, потому что равновесие не происходит.
$\endgroup$
1
$\begingroup$
$\Delta G = -RT \ln K$
Это означает, что для любого данного процесса можно вывести константу равновесия.
Поскольку продукты являются «газообразными», они ускользают из системы и еще больше приводят к равновесию.
В этом случае
$K = 0,05$
С практической точки зрения мы определяем систему как «рядом с лужей». Когда вода испаряется, она может либо снова сконденсироваться, либо уйти «далеко от лужи» и, следовательно, покинуть систему. Со временем «удаление» части этого процесса приводит к тому, что мы гуманистически наблюдаем как исчезновение лужи.
$\endgroup$
2
$\begingroup$
Энергия Гиббса определяется для систем при заданной температуре и давлении. Подумайте о контейнере, закрытом для любого переноса материала, погруженном в ванну с подогревом при определенной температуре, но с регулируемым объемом, подобно цилиндру с подвижным поршнем. Налейте в нее ничего, кроме воды, установите температуру нагревательной бани на 25°С и отрегулируйте объем так, чтобы давление составляло 1 атмосферу.
Так как давление пара воды при 25 С равно 0,0313 атмосферы, пара не будет, поршень будет соприкасаться с жидкой водой, придавливая ее давлением в одну атмосферу. Ваше уравнение и выводы верны.
Если вы понизите давление до 0,0313 атм, увеличив объем, то вы можете установить объем между объемом воды и объемом пара, когда последняя часть воды только что испарилась, и при этом поддерживать 0,0313 атм. Если вы увеличите объем еще больше, вы установите давление ниже давления пара, и вся вода испарится.
Когда вы замечаете, что вода испаряется при 25 °C, вы указываете огромный объем воздуха при 1 атм и немного воды, поэтому вы фактически устанавливаете парциальное давление пара на что-то очень маленькое, и, конечно, он испарится.
$\endgroup$
Зарегистрируйтесь или войдите в систему
Зарегистрируйтесь с помощью Google
Зарегистрироваться через Facebook
Зарегистрируйтесь, используя электронную почту и пароль
Опубликовать как гость
Электронная почта
Требуется, но никогда не отображается
Опубликовать как гость
Электронная почта
Требуется, но не отображается
Нажимая «Опубликовать свой ответ», вы соглашаетесь с нашими условиями обслуживания, политикой конфиденциальности и политикой использования файлов cookie
.
В: В чем разница между испарением и кипением?
Наука 101
Наука и дети — февраль 2020 г.
(Том 57, Выпуск 6)
Мэтт Бобровски
A: В дополнение к статье о конденсации, опубликованной в прошлом месяце, мы обсудим испарение (противоположное конденсации) и тесно связанное с ним явление кипения. И испарение, и кипение связаны с превращением жидкости в газ, но между ними есть ряд различий.
РАЗЛИЧИЯ ИСПАРЕНИЯ И КИПЕНИЯ
Скорость: Испарение — более медленный процесс, а кипение — более быстрое. Попробуйте следующее: за несколько недель до урока о круговороте воды (включая испарение и конденсацию) поставьте на полку высокий стакан с водой и предложите учащимся измерять высоту воды каждые несколько дней и ведите таблицу, показывающую изменение уровня (рис.
1). Если студенты еще не знают, что произойдет, не говорите им; пусть обнаружат. Они также могут отображать высоту воды с течением времени. Затем, когда вы будете готовы говорить об испарении, спросите: «Что случилось с водой, которая была в стакане? Куда оно делось? (Это исследование также можно провести, когда учащиеся считывают количество воды, оставшейся в градуированном цилиндре, но вы можете предпочесть, чтобы учащиеся попрактиковались в измерении с помощью линейки.) Напротив, вы можете вскипятить воду на плите и наблюдать, как уровень ниже за считанные минуты, а не дни и недели, которые требуются для испарения воды.
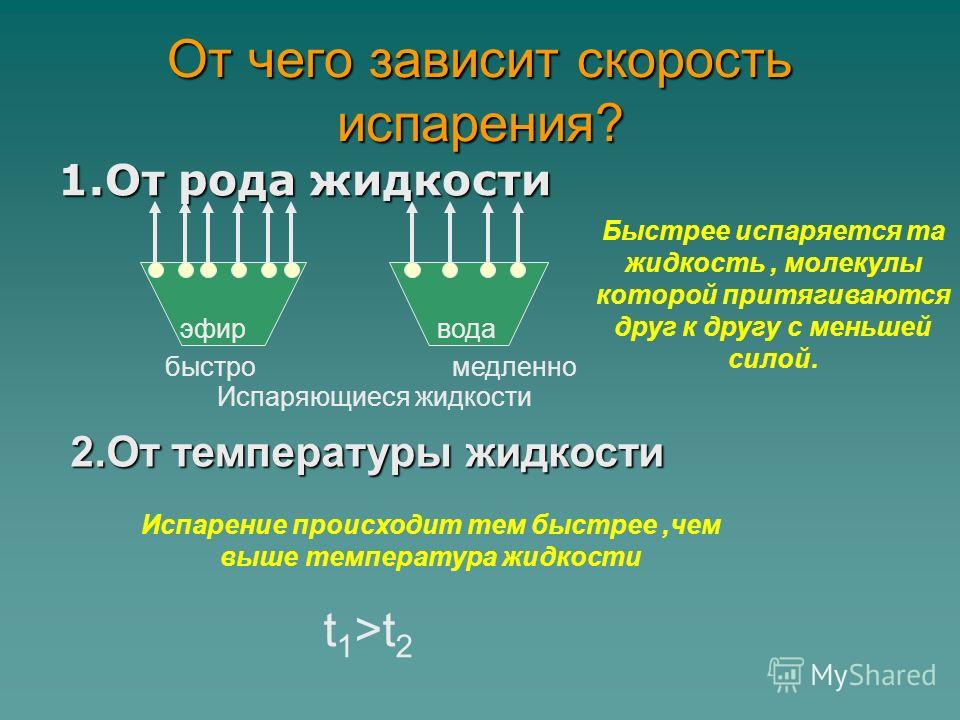
Требуемая температура: Жидкость испаряется при температуре выше точки замерзания. В предыдущем примере вода была комнатной температуры и медленно испарялась. Если бы вода была теплее, она испарялась бы быстрее. Напротив, кипение происходит только тогда, когда жидкость достигает определенной температуры, которую мы называем точкой кипения. Температура кипения воды на уровне моря составляет 100°C (212°F).
Пузырьки: При испарении не образуются пузырьки. Когда жидкость испаряется, отдельные молекулы покидают жидкость и становятся частью воздуха. На рисунке 2 точки представляют молекулы. Те, что покидают жидкость и становятся частью газа (воздуха), испаряются. Те, которые переходят из газа в жидкость, конденсируются. Когда вода в вашем стакане испарялась, молекулы должны были перемещаться из воды в воздух чаще, чем молекулы из воздуха в воду. Таким образом, имел место чистый перенос молекул воды из жидкости в стакане в воздух. Как видно из рисунка 2, в этом процессе пузырьков нет. Напротив, когда вы кипятите воду, жидкость превращается в газ так быстро, что образуются пузырьки водяного пара. Вот вопрос для учащихся: когда вы кипятите воду и видите пузырьки, есть ли что-нибудь в пузырьках? Если да, то из чего сделаны пузыри? Некоторые ученики могут подумать, что это пузырьки воздуха. Но теперь вы понимаете, что это не пузырьки воздуха; это пузырьки водяного пара — вода, которая превратилась из жидкости в газ.
Есть ли простой способ продемонстрировать, что пузырьки содержат молекулы воды? Да! Доведите кастрюлю с водой до кипения. Накройте его крышкой примерно на 20 секунд, а затем снимите крышку и осмотрите ее изнутри. Он покрыт каплями воды из тех пузырьков, которые сконденсировались на крышке кулера (рис. 3).
РИСУНОК 1. Измерьте изменение количества воды. РИСУНОК 2. Молекулы воды, движущиеся между жидкостью и газом.
Место перехода на газ: Вы, наверное, замечали, что когда вы нагреваете воду, чтобы довести ее до кипения, пузырьки сначала образуются на дне кастрюли. (Студенты в защитных очках могут наблюдать это крупным планом.) Это потому, что дно кастрюли — единственное место, где вода достаточно горячая, чтобы нагреть воду до точки кипения и превратить ее в газ. Но как только у вас закипит, вся кастрюля с водой достигает точки кипения (100°C), и по всей массе воды образуются пузырьки. Испарение, с другой стороны, происходит только на поверхности воды. (Вспомните рисунок 2, на котором показаны испаряющиеся молекулы, покидающие поверхность воды.
)
Источник энергии: Для варки обычно требуется внешний источник энергии, например, горелка под кастрюлей с водой, в которой вы варите яйца. Однако испарение использует энергию, уже содержащуюся в жидкости. Если у вас есть лужа с водой, в ней есть некоторое количество тепловой энергии, которая обычно поступает из окружающей среды. Тепло в этой воде приводит к тому, что некоторые молекулы движутся достаточно быстро, чтобы уйти в воздух, то есть испариться. Для испарения не требуется дополнительного источника энергии, и воде не нужно достигать точки кипения, чтобы испариться. Как мы видели, вода испаряется при комнатной температуре. То, что вы только что прочитали, подразумевает, что испарение, а не кипение, является естественным процессом. Ваша лужа воды или вода на ваших волосах, которые вы только что вымыли, испарится, и вы ничего особенного не сделаете. Просто подождите, и он высохнет. Но кипячение обычно не происходит естественным путем. Мы должны намеренно нагревать жидкость, чтобы она закипела.
РИСУНОК 3Водяной пар из пузырьков Водяной пар из пузырьков конденсируется на крышке холодильника. конденсируется на крышке холодильника.
Изменение температуры жидкости: Пока вода кипит, ее температура остается постоянной на уровне 100°C. Быстрое кипение не делает воду горячее, чем среднее кипячение. Ваши яйца приготовятся так же быстро в любом случае. С другой стороны, испарение воды охлаждает воду и любую поверхность, с которой вода испаряется. Вот почему, если вы ждете, пока высохнете после того, как выйдете из душа, вы почувствуете холод. Испаряющиеся молекулы воды уносят тепло с вашей кожи. Вот почему вы потеете в жаркий летний день. Дополнительная влага на вашей коже приводит к большему испарению, которое охлаждает вашу кожу. Так что не вытирай пот со лба; дайте ему испариться, и вам станет прохладнее!
ВЫСОТЫ И ДАВЛЕНИЕ
Почему я сказал «на уровне моря»? Потому что на больших высотах атмосферное давление ниже. При более низком давлении воздуха у воды меньше «крышки», и она может перейти в газообразное состояние при более низкой температуре.
Есть тут повара? Я только что взял свою старую книгу «Радость кулинарии», в которой авторы рассказывают о том, как следует изменять инструкции по приготовлению пищи на больших высотах. Например, в разделе супов они говорят: «На высоте более 2500 футов супы требуют более длительного времени приготовления, чем требуется в обычных рецептах, поскольку жидкости кипят при более низкой температуре». В кулинарии столько крутой науки! Напомните мне сделать статью об этом.
ФАКТОРЫ, ВЛИЯЮЩИЕ НА СКОРОСТЬ ИСПАРЕНИЯ
Спросите учащихся: «Что мы можем сделать, чтобы вода испарялась быстрее?» Вот некоторые факторы, влияющие на скорость испарения жидкости:
Тепло. Одежда, сушащаяся на бельевой веревке, в летний день сохнет быстрее, чем зимой.
Ветер. Если вы выходите из открытого бассейна, когда дует ветер, вы чувствуете себя холоднее, потому что ветер заставляет воду быстрее испаряться с вашей кожи, быстрее унося тепловую энергию от вашей кожи, оставляя вашу кожу более холодной (рис.
4). Этот эффект также является причиной «фактора охлаждения ветром», о котором мы слышим в прогнозах погоды в холодные зимние дни. Вы не были в бассейне, но на вашей коже всегда есть немного влаги. Ветер заставляет эту влагу быстрее испаряться, унося больше тепла с вашей кожи. Вот почему так важно оставаться укрытым в холодные и ветреные дни.
РИСУНОК 4Ветер заставляет воду с вашей кожи испаряться быстрее, что быстрее отводит тепло от вашей кожи, делая вас холоднее.
Влажность. Вода испаряется быстрее, когда воздух сухой. Когда воздух сухой, в нем меньше молекул воды, возвращающихся в жидкость, поэтому вода испаряется быстрее. Когда в воздухе много молекул воды (то есть он влажный), например, в дождливый день, испарение происходит медленнее, потому что больше молекул воды возвращается в жидкость. Попробуйте провести такое исследование: налейте равное количество воды в три одинаковые банки. Одну банку оставьте открытой, накройте другую алюминиевой фольгой и накройте последнюю банку плотно прилегающей крышкой (рис.
5). Основываясь на том, что мы узнали, что вы ожидаете увидеть через несколько дней или неделю? Чем плотнее крышка, тем меньше испарения. Но почему именно? Студенты могут предположить, что с крышкой на банке молекулам воды некуда деться. Вы можете ответить: «Да, но разве молекулы воды не могут по-прежнему подниматься в воздух над водой в банке?» Могут, но это приведет к тому, что в воздухе в банке будет намного больше молекул воды (более высокая влажность), и гораздо больше молекул воды вернется в жидкость (как на рис. 2). Он быстро достигает точки, когда количество молекул воды, возвращающихся в жидкость, равно количеству молекул, покидающих жидкость, поэтому чистого изменения количества жидкой воды не происходит (то есть испарения нет). Это гораздо более сложное объяснение, чем крышка, просто удерживающая воду. Вам, вероятно, не нужно будет вдаваться в такие подробности со своими учениками, но вы будете гораздо более уверены в своих знаниях контента, если глубоко поймете процесс.
РИСУНОК 5Вода в трех банках: без крышки, с крышкой из фольги и с плотно закрытой крышкой.
Площадь поверхности. Увеличение площади поверхности обеспечит большую поверхность, с которой может испаряться вода. Таким образом, влажное полотенце высохнет быстрее, если его разложить, а не свернуть или свернуть в кучу.
Подводя итог, можно сказать, что испарение происходит медленнее, происходит только с поверхности жидкости, не образует пузырьков и приводит к охлаждению. Кипение происходит быстрее, может происходить во всей жидкости, образует много пузырьков и не приводит к охлаждению.
Между статьей прошлого месяца и этой вы готовы обсудить круговорот воды. В своей простейшей форме круговорот воды представляет собой превращение воды из водяного пара (газа) в жидкую воду (конденсация), а затем обратно в газ (испарение). Боже мой, меня просто поразило, сколько реальных применений мы нашли для этой простой темы. В нашей повседневной деятельности так много открытий. Вот почему я всегда говорю: «Никогда не прекращайте учиться!»
Мэтт Бобровски — ведущий автор серии книг NSTA Press, Обучение на основе явлений: использование гаджетов и приспособлений для физических наук .
Вы можете сообщить ему, если есть научная концепция, о которой вы хотели бы услышать больше. Свяжитесь с ним по адресу: [email protected]
Лаборатории
Физическая наукаэлементарный
Лаборатории-Физические науки-Элементарный
Вам также может понравиться
Отчеты Статья
Бесплатные подарки и возможности для учителей естественных наук и STEM, 8 ноября 2022 г.
Веб-семинар
Веб-семинар: WI23: Вопросы безопасности в лаборатории для будущих учителей элементарных наук/STEM, 13 февраля 2023 г.

 \circ}}$ было бы отрицательной бесконечностью. Это будет означать бесконечное число 9.0017 отрицательный — т.е. очень спонтанный — $\Delta G$ для реакции испарения воды.
\circ}}$ было бы отрицательной бесконечностью. Это будет означать бесконечное число 9.0017 отрицательный — т.е. очень спонтанный — $\Delta G$ для реакции испарения воды.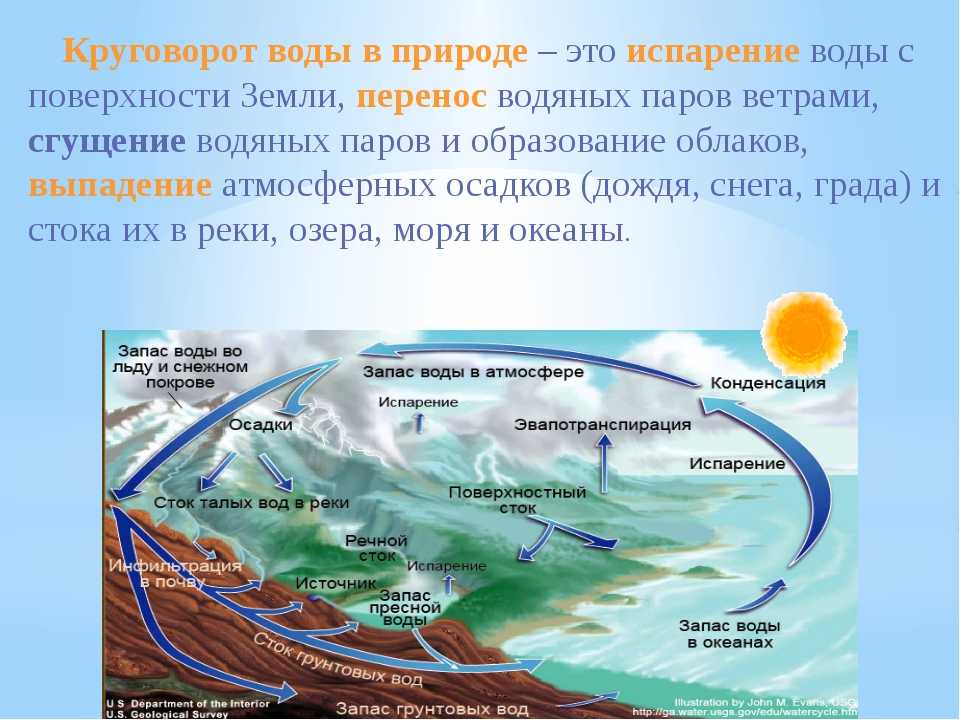
 Поскольку продукты являются «газообразными», они ускользают из системы и еще больше приводят к равновесию.
Поскольку продукты являются «газообразными», они ускользают из системы и еще больше приводят к равновесию.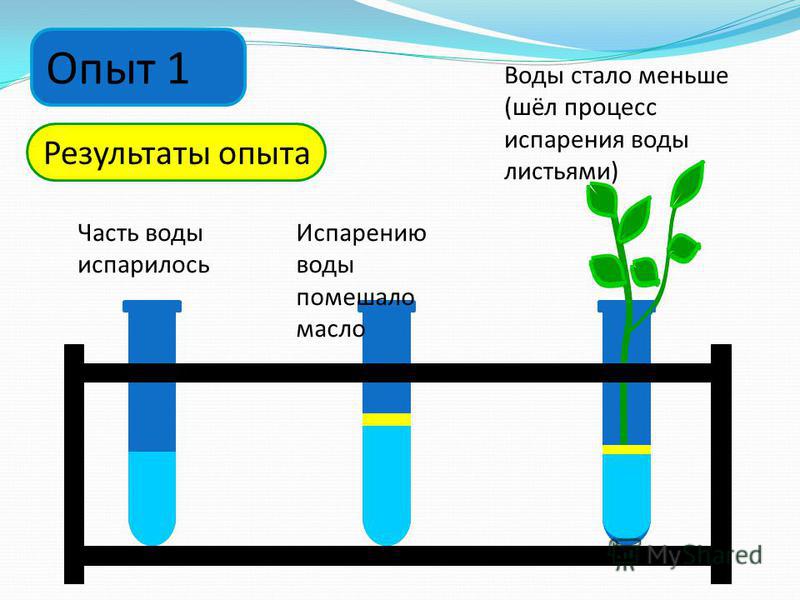 Так как давление пара воды при 25 С равно 0,0313 атмосферы, пара не будет, поршень будет соприкасаться с жидкой водой, придавливая ее давлением в одну атмосферу. Ваше уравнение и выводы верны.
Так как давление пара воды при 25 С равно 0,0313 атмосферы, пара не будет, поршень будет соприкасаться с жидкой водой, придавливая ее давлением в одну атмосферу. Ваше уравнение и выводы верны.
 1). Если студенты еще не знают, что произойдет, не говорите им; пусть обнаружат. Они также могут отображать высоту воды с течением времени. Затем, когда вы будете готовы говорить об испарении, спросите: «Что случилось с водой, которая была в стакане? Куда оно делось? (Это исследование также можно провести, когда учащиеся считывают количество воды, оставшейся в градуированном цилиндре, но вы можете предпочесть, чтобы учащиеся попрактиковались в измерении с помощью линейки.) Напротив, вы можете вскипятить воду на плите и наблюдать, как уровень ниже за считанные минуты, а не дни и недели, которые требуются для испарения воды.
1). Если студенты еще не знают, что произойдет, не говорите им; пусть обнаружат. Они также могут отображать высоту воды с течением времени. Затем, когда вы будете готовы говорить об испарении, спросите: «Что случилось с водой, которая была в стакане? Куда оно делось? (Это исследование также можно провести, когда учащиеся считывают количество воды, оставшейся в градуированном цилиндре, но вы можете предпочесть, чтобы учащиеся попрактиковались в измерении с помощью линейки.) Напротив, вы можете вскипятить воду на плите и наблюдать, как уровень ниже за считанные минуты, а не дни и недели, которые требуются для испарения воды.
 Есть ли простой способ продемонстрировать, что пузырьки содержат молекулы воды? Да! Доведите кастрюлю с водой до кипения. Накройте его крышкой примерно на 20 секунд, а затем снимите крышку и осмотрите ее изнутри. Он покрыт каплями воды из тех пузырьков, которые сконденсировались на крышке кулера (рис. 3).
Есть ли простой способ продемонстрировать, что пузырьки содержат молекулы воды? Да! Доведите кастрюлю с водой до кипения. Накройте его крышкой примерно на 20 секунд, а затем снимите крышку и осмотрите ее изнутри. Он покрыт каплями воды из тех пузырьков, которые сконденсировались на крышке кулера (рис. 3). )
)
 Есть тут повара? Я только что взял свою старую книгу «Радость кулинарии», в которой авторы рассказывают о том, как следует изменять инструкции по приготовлению пищи на больших высотах. Например, в разделе супов они говорят: «На высоте более 2500 футов супы требуют более длительного времени приготовления, чем требуется в обычных рецептах, поскольку жидкости кипят при более низкой температуре». В кулинарии столько крутой науки! Напомните мне сделать статью об этом.
Есть тут повара? Я только что взял свою старую книгу «Радость кулинарии», в которой авторы рассказывают о том, как следует изменять инструкции по приготовлению пищи на больших высотах. Например, в разделе супов они говорят: «На высоте более 2500 футов супы требуют более длительного времени приготовления, чем требуется в обычных рецептах, поскольку жидкости кипят при более низкой температуре». В кулинарии столько крутой науки! Напомните мне сделать статью об этом. 4). Этот эффект также является причиной «фактора охлаждения ветром», о котором мы слышим в прогнозах погоды в холодные зимние дни. Вы не были в бассейне, но на вашей коже всегда есть немного влаги. Ветер заставляет эту влагу быстрее испаряться, унося больше тепла с вашей кожи. Вот почему так важно оставаться укрытым в холодные и ветреные дни.
4). Этот эффект также является причиной «фактора охлаждения ветром», о котором мы слышим в прогнозах погоды в холодные зимние дни. Вы не были в бассейне, но на вашей коже всегда есть немного влаги. Ветер заставляет эту влагу быстрее испаряться, унося больше тепла с вашей кожи. Вот почему так важно оставаться укрытым в холодные и ветреные дни. 5). Основываясь на том, что мы узнали, что вы ожидаете увидеть через несколько дней или неделю? Чем плотнее крышка, тем меньше испарения. Но почему именно? Студенты могут предположить, что с крышкой на банке молекулам воды некуда деться. Вы можете ответить: «Да, но разве молекулы воды не могут по-прежнему подниматься в воздух над водой в банке?» Могут, но это приведет к тому, что в воздухе в банке будет намного больше молекул воды (более высокая влажность), и гораздо больше молекул воды вернется в жидкость (как на рис. 2). Он быстро достигает точки, когда количество молекул воды, возвращающихся в жидкость, равно количеству молекул, покидающих жидкость, поэтому чистого изменения количества жидкой воды не происходит (то есть испарения нет). Это гораздо более сложное объяснение, чем крышка, просто удерживающая воду. Вам, вероятно, не нужно будет вдаваться в такие подробности со своими учениками, но вы будете гораздо более уверены в своих знаниях контента, если глубоко поймете процесс.
5). Основываясь на том, что мы узнали, что вы ожидаете увидеть через несколько дней или неделю? Чем плотнее крышка, тем меньше испарения. Но почему именно? Студенты могут предположить, что с крышкой на банке молекулам воды некуда деться. Вы можете ответить: «Да, но разве молекулы воды не могут по-прежнему подниматься в воздух над водой в банке?» Могут, но это приведет к тому, что в воздухе в банке будет намного больше молекул воды (более высокая влажность), и гораздо больше молекул воды вернется в жидкость (как на рис. 2). Он быстро достигает точки, когда количество молекул воды, возвращающихся в жидкость, равно количеству молекул, покидающих жидкость, поэтому чистого изменения количества жидкой воды не происходит (то есть испарения нет). Это гораздо более сложное объяснение, чем крышка, просто удерживающая воду. Вам, вероятно, не нужно будет вдаваться в такие подробности со своими учениками, но вы будете гораздо более уверены в своих знаниях контента, если глубоко поймете процесс.
 Вы можете сообщить ему, если есть научная концепция, о которой вы хотели бы услышать больше. Свяжитесь с ним по адресу:
Вы можете сообщить ему, если есть научная концепция, о которой вы хотели бы услышать больше. Свяжитесь с ним по адресу: 