Содержание
Физические свойства и особенности воды.
Физические свойства и особенности воды.
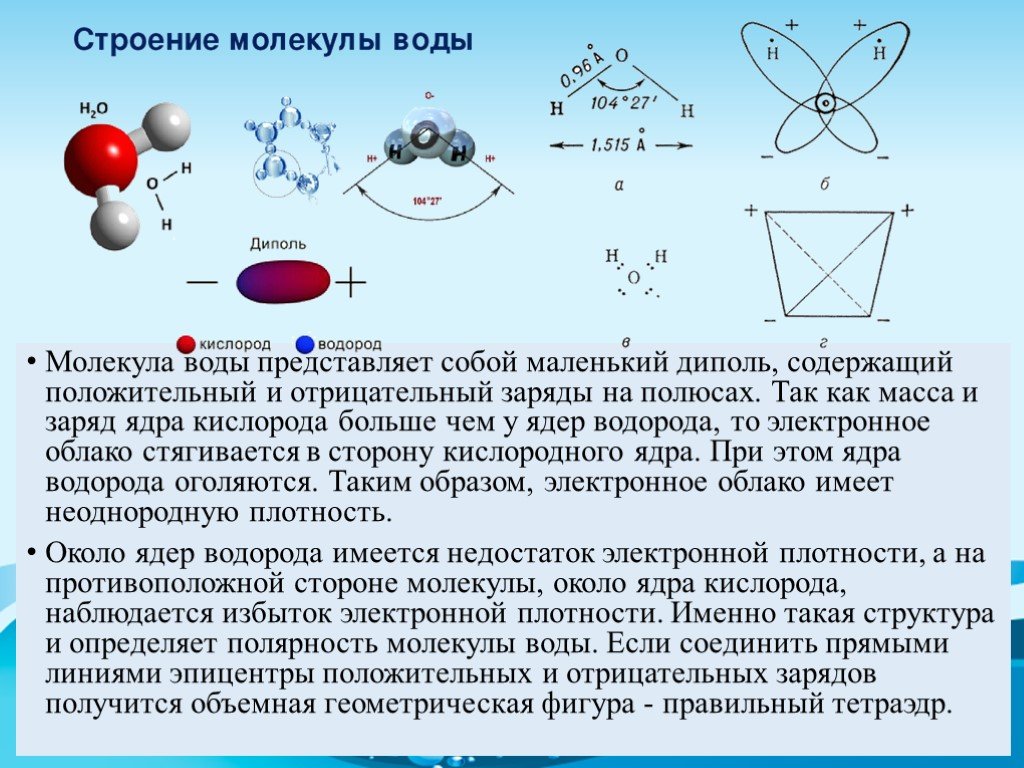
Если представить молекулу воды в форме какой-либо фигуры, это будет равнобедренный треугольник, в углах которого расположены два атома водорода и один – кислорода. Каждая такая молекула образует до четырех водородных связей, именно это определяет точки кипения и газообразования жидкости. Если бы не эта способность, Н2О кипела бы при -80 °С, а замерзала при -100 °С.
Для этого соединения характерны три агрегатных состояния: жидкое, твердое (лед) и газообразное (пар). При превращении в лед молекулы принимают упорядоченную структуру, между ними увеличиваются пустоты. При этом плотность вещества падает, это объясняет то, что в твердом виде вода занимает больший объем. При переходе в газообразное состояние водородные связи рвутся, для чего требуется значительное количество энергии. За счет этого вода имеет большую удельную теплоемкость.
Н2О может принимать и метастабильные состояния. Это:
Это:
• пересыщенный пар,
• перегретая жидкость,
• переохлажденная жидкость.
Они могут существовать в течение длительного времени, но как только соприкасаются с более стабильным состоянием – переходят в него. Например, переохлажденная жидкость при контакте с кристаллом очень быстро превращается в лед.
Свойства и особенности
Вода характеризуется высоким поверхностным натяжением, больший показатель только у ртути. Свойство Н2О быть хорошим растворителем используется всеми живыми организмами: в клетках и в межклеточном пространстве растворы взаимодействуют именно в воде. Без нее невозможна жизнь вообще.
Чистая вода без примесей является отличным изолятором. Но так как она все же растворитель, в ней всегда содержатся различные соли, + и – ионы. За счет этого вода обладает способностью проводника. Именно по способности проводить ток определяется степень чистоты Н2О. Вкус воды зависит от растворенных в ней примесей.
Цвет воды зависит от света.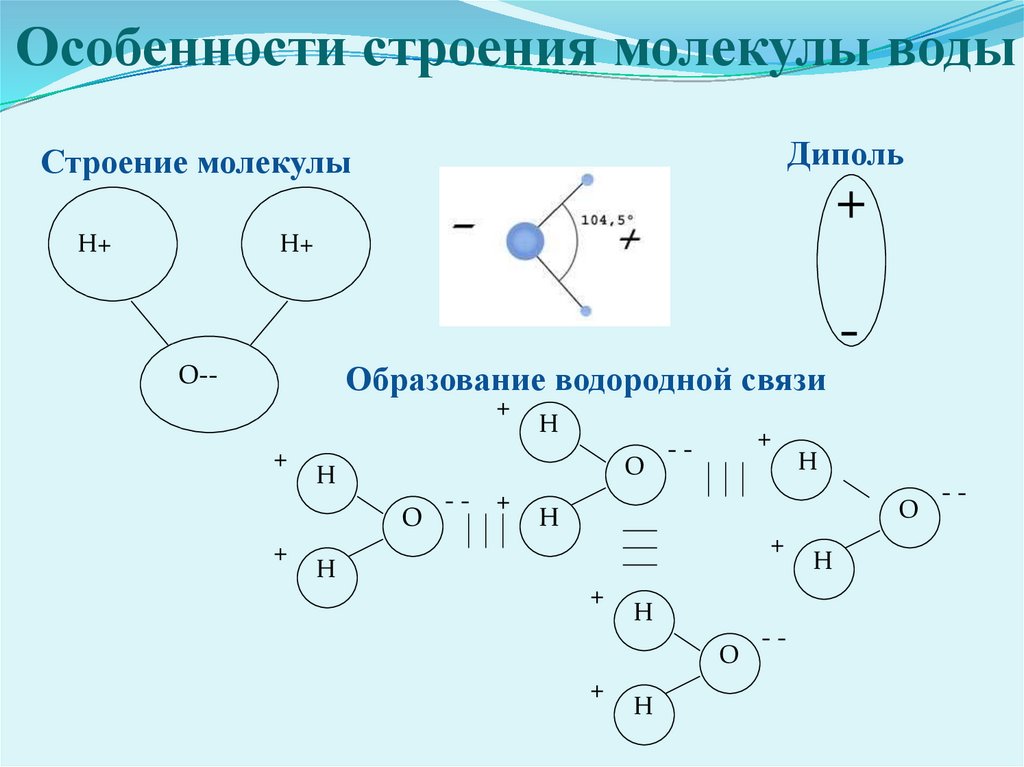 При прохождении волны излечения, поглощается оранжевый и красный компоненты спектра, поэтому вода имеет голубоватый оттенок. УФ лучи проходят через Н2О, поэтому подводой могут существовать растения. Интересно, что в жидком состоянии вода отражает всего 5 % лучей, а вот лед пропускает через себя всего 2 %.
При прохождении волны излечения, поглощается оранжевый и красный компоненты спектра, поэтому вода имеет голубоватый оттенок. УФ лучи проходят через Н2О, поэтому подводой могут существовать растения. Интересно, что в жидком состоянии вода отражает всего 5 % лучей, а вот лед пропускает через себя всего 2 %.
При трансформации воды из твердого в жидкое состояние плотность уменьшается, примечательно, что почти у всех других веществ происходит наоборот. При нагревании от 0 до 3,98 °C Н2О сжимается. Этим объясняется возможность жизни рыб в водоемах: более холодная вода остается на поверхности и замерзает, а остальная имеет плюсовую температуру. Жидкая вода имеет высокую теплоемкость, это свойство используется в промышленности.
Доставка воды в офис
Вода – это благо, удовлетворяющее базовую потребность. Очень важно обеспечить себя качественными продуктами питания и чистой водой. В нашей компании вы можете заказать воду в офис по невысокой цене. Привозится вода в 19 литровых бутылях, этот объем оптимален для установки в кулер или использования с помпой.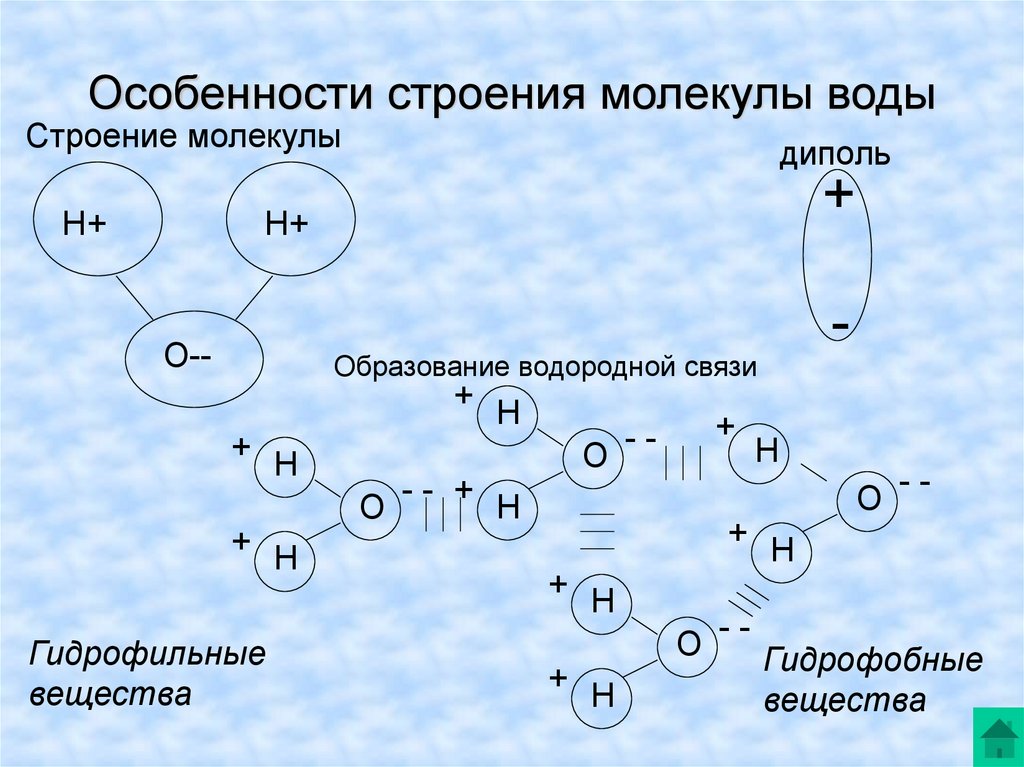 Вы можете заказать воду в офис, написав нам на электронную почту, позвонив или оставив заявку на сайте. Кроме того, мы предоставляем услуги аренды и санации кулеров. Доставка воды в офис осуществляется в рабочее время в будние дни.
Вы можете заказать воду в офис, написав нам на электронную почту, позвонив или оставив заявку на сайте. Кроме того, мы предоставляем услуги аренды и санации кулеров. Доставка воды в офис осуществляется в рабочее время в будние дни.
Ученые нашли новые формы воды: Наука и техника: Lenta.ru
Ученые из Индии и Италии утверждают, что им удалось обнаружить две формы жидкой воды. Существование этих форм было предсказано теоретически, однако обнаружить их экспериментально пока никому не удавалось. Опубликованы ли результаты в каком-либо научном журнале, не сообщается. Коротко о работе пишет портал Nature News.
У воды наблюдается целый ряд необычных физических свойств. Так, в отличие от большинства других жидкостей, плотность воды при замерзании уменьшается, а не увеличивается. Максимальную плотность жидкая вода имеет при четырех градусах Цельсия. Если бы вода была «стандартной» жидкостью, то ее плотность была бы максимальной при нуле градусов Цельсия, непосредственно перед переходом в твердую фазу.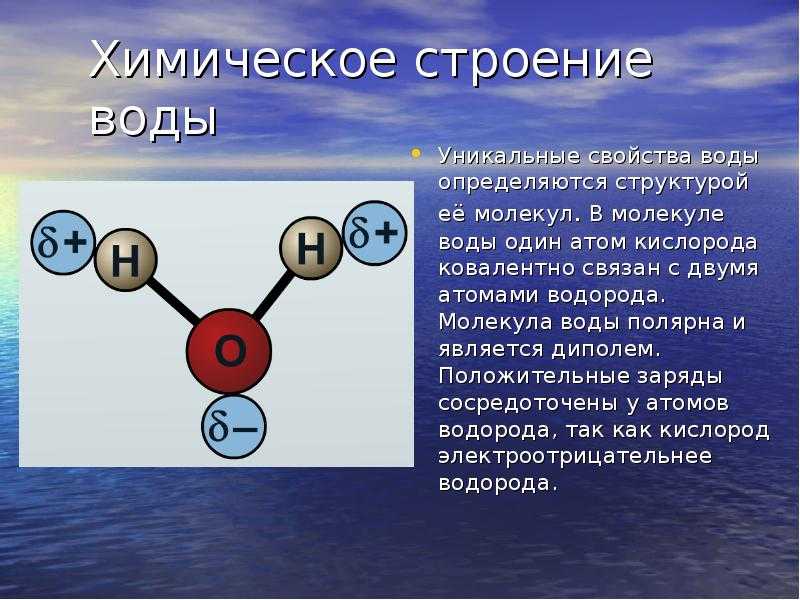 Особенности воды объясняются наличием между ее молекулами водородных связей. Они являются относительно слабыми, но когда речь идет о большом (точнее, огромном) количестве молекул, они начинают играть существенную роль.
Особенности воды объясняются наличием между ее молекулами водородных связей. Они являются относительно слабыми, но когда речь идет о большом (точнее, огромном) количестве молекул, они начинают играть существенную роль.
В 1992 году группа ученых под руководством Джина Стэнли (Gene Stanley) из Бостонского университета в Массачусетсе высказала предположение, что при низких температурах и высоком давлении водородные связи могут обеспечить существование двух форм воды. Первая форма получила название жидкости низкой плотности («сеть» связанных водородными связями молекул рыхлая), а вторая — жидкости высокой плотности (часть водородных связей разрывается, и молекулы воды «сжимаются» плотнее). Между двумя формами воды возможны фазовые переходы, подобные переходам между твердой и жидкой фазами. Теория Стэнли и коллег объясняла особенности воды именно конкуренцией между двумя формами.
Свои выводы группа сделала только на основании компьютерной модели, без экспериментального подтверждения.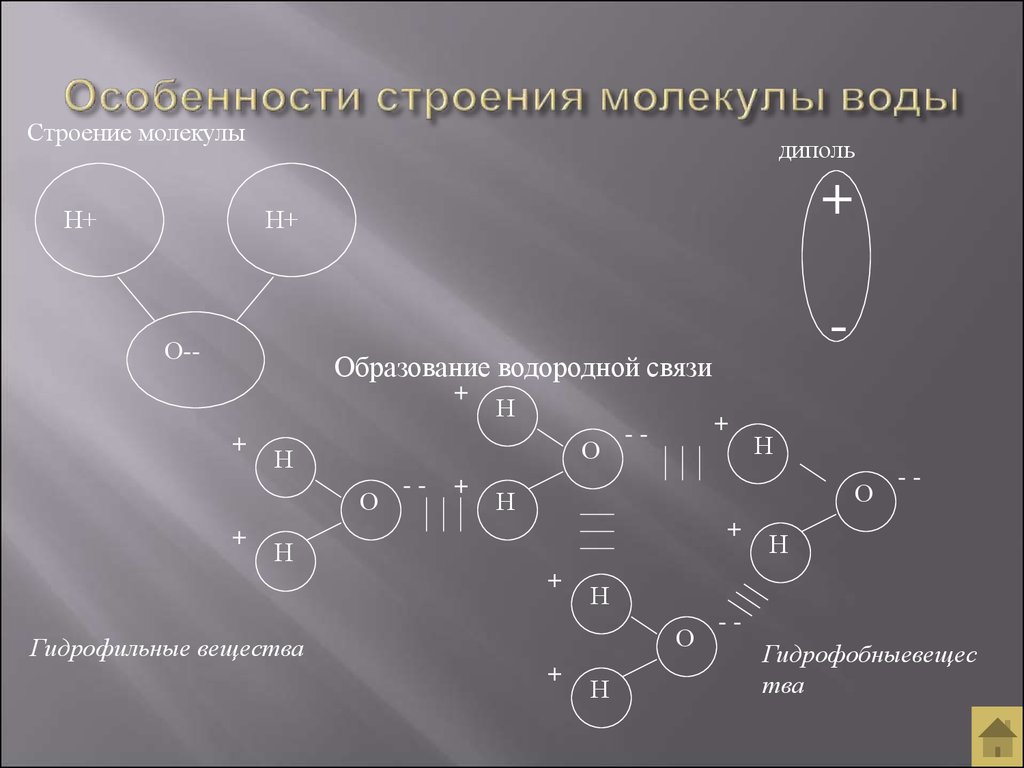 Одной из трудностей, препятствующих проведению опытов, была невозможность сохранить воду в жидком состоянии при нужной температуре — ниже -75 градусов Цельсия. Авторы новой работы решили «запереть» жидкую воду в ячейки из льда.
Одной из трудностей, препятствующих проведению опытов, была невозможность сохранить воду в жидком состоянии при нужной температуре — ниже -75 градусов Цельсия. Авторы новой работы решили «запереть» жидкую воду в ячейки из льда.
При помощи технологии электронного парамагнитного резонанса ученые изучали подвижность молекул воды в крошечных ледяных ячейках при температуре около -183 градусов Цельсия. Исследователи наблюдали за перемещениями специального зонда, помещенного в ячейки и не способного проникать в ледяные стенки. «Плотная» фаза воды является более вязкой, соответственно движение зонда в ней должно замедляться. В «рыхлой» фазе он должен перемещаться быстрее.
По результатам экспериментов ученые заключили, что при температурах от -140 до 0 градусов Цельсия в ячейках присутствуют обе фазы воды. При изменении температуры соотношение «плотной» и «рыхлой» воды изменяется.
С выводами новой работы согласны не все специалисты. По мнению некоторых из них, приведенных экспериментальных данных недостаточно для однозначного утверждения, что в ячейках присутствуют именно вода в разных фазах.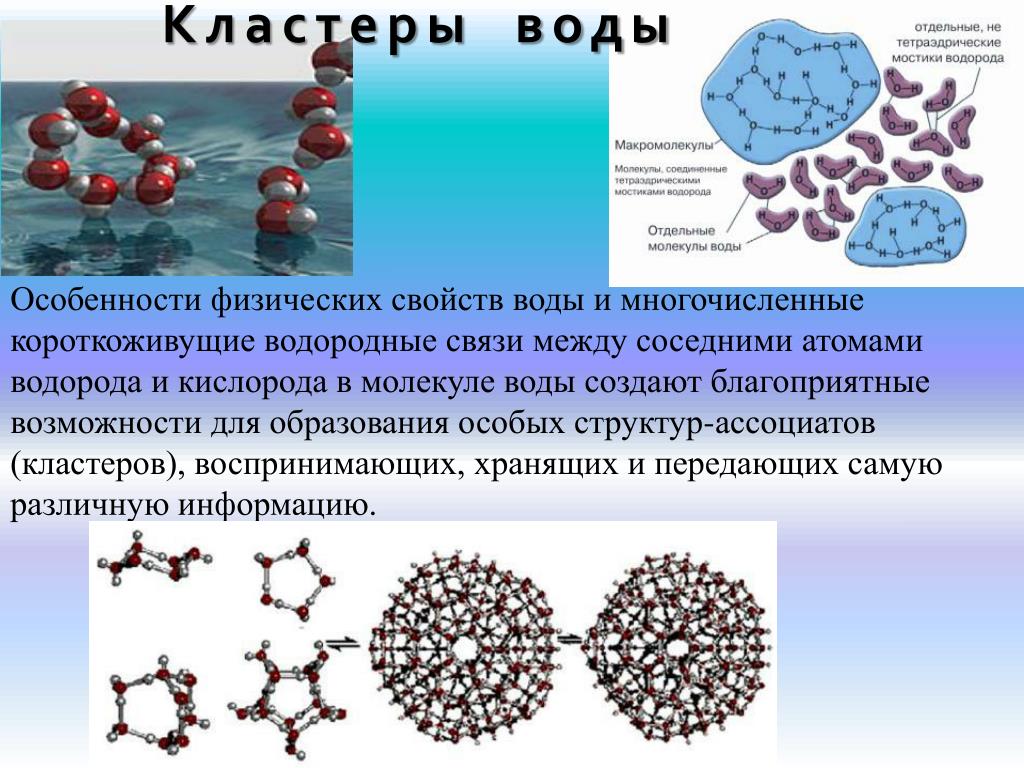 Также существует мнение, что замеченные авторами изменения в движении зонда объясняются тем, что при замерзании вода высвобождает в ячейки содержавшиеся в ней примеси (аналогично тому, как при испарении морской воды остается соль).
Также существует мнение, что замеченные авторами изменения в движении зонда объясняются тем, что при замерзании вода высвобождает в ячейки содержавшиеся в ней примеси (аналогично тому, как при испарении морской воды остается соль).
Совсем недавно появилась работа, авторы которой изучали новые формы твердой воды — льда. Они смогли получить его новый тип, который называется XV (пятнадцатый из уже известных).
4.1: Уникальные свойства воды
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 788
[Эта страница может использовать изображение]
[Вода «биполярна»? Возможно, имелось в виду, что вода считается полярной молекулой]
[физическое свойство – почему вода является хорошим растворителем?]
[что делает воду уникальной по отношению к другим веществам? Это называется «уникальные свойства»? Возможно, упомянуть, что если бы вода не образовалась так, как она есть, жизнь на Земле не была бы такой, какая она есть, или даже была бы возможной.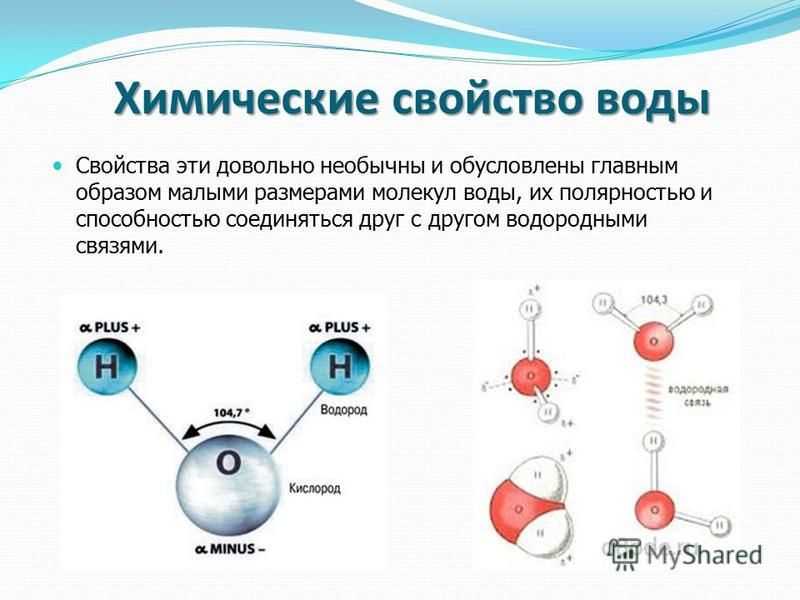 ]
]
[поверхностное натяжение — следует упомянуть капиллярное действие]
Физические свойства воды
Вода — единственное встречающееся в природе вещество на Земле, которое может находиться в трех физических состояниях: твердом, жидком и газообразном. В твердом состоянии (лед) он менее плотный, чем в жидком (вот почему лед плавает в стакане с водой).
Молекула обладает когезивным свойством, позволяющим ей «прилипать» к другим молекулам воды (образуя «капли» воды, когда молекулы прилипают друг к другу под действием гравитации). Он также клейкий, что означает, что он «прилипает» к другим окружающим молекулам при контакте (примером этого является капля воды на травинке).
На уровне моря вода замерзает при 32°F (0°C) до твердого состояния и кипит при 212°F (100°C) и становится водяным паром.
Плотность: 1 грамм/кубический сантиметр (г/см) при 390,2°F (4°C) и 0,95865 г/куб.см при 212°F (100°C)
Вес: 1000 кг/куб.м (кг/м³) при 32°F (0°C) и 993 кг/м³ при 212°F (100°C)
В чистом виде вода не проводит электричество.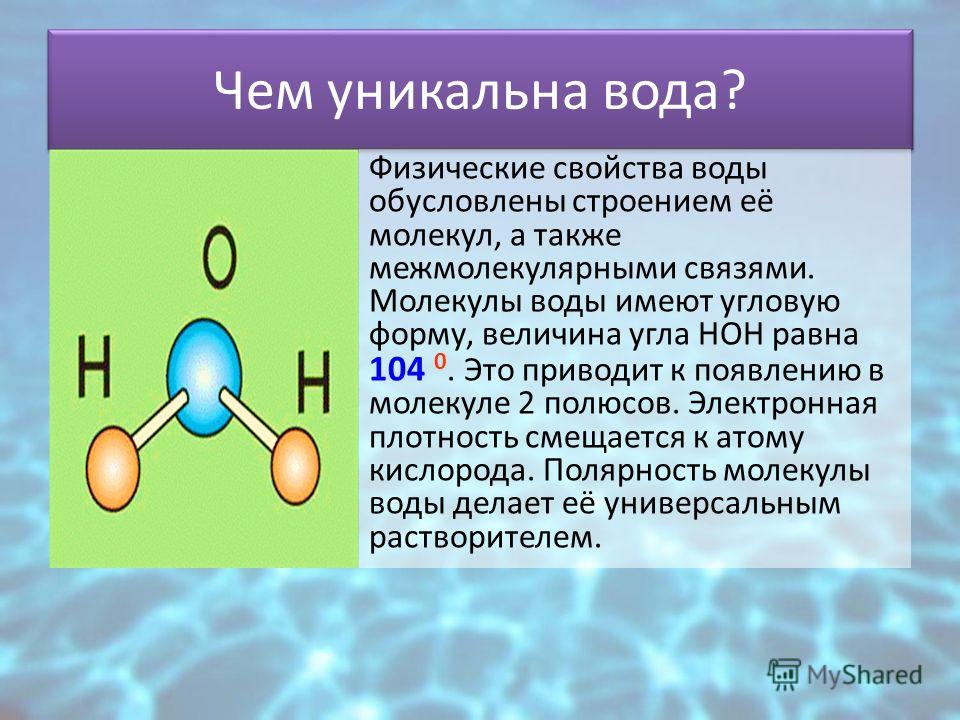 Однако он может проводить воду, когда начинает растворять окружающие его вещества. Вода — лучший растворитель из всех жидкостей — она может растворять больше веществ, чем остальные.
Однако он может проводить воду, когда начинает растворять окружающие его вещества. Вода — лучший растворитель из всех жидкостей — она может растворять больше веществ, чем остальные.
Химические свойства воды
Вода состоит из двух атомов водорода (H) и атома кислорода (O). Он уникален тем, что является биполярным, где молекула имеет слегка положительный заряд с одной стороны (там, где присоединены атомы водорода), а с другой — слегка отрицательный (только кислород).
Поскольку электроны распределены в воде неравномерно, она считается полярной молекулой, несмотря на то, что имеет одинаковое количество протонов и электронов. Кроме того, из-за тетраэдрического расположения вокруг атома кислорода и наличия у атома кислорода неподеленной пары электронов считается, что вода имеет изогнутую форму.
Одна молекула воды может соединиться с другой молекулой через водородную связь (около 1/20 силы ковалентной связи) между атомом водорода одной и атомом кислорода другой. Эта водородная связь создает поверхностное натяжение в группе молекул воды.
Эта водородная связь создает поверхностное натяжение в группе молекул воды.
pH чистой воды составляет около 7 при комнатной температуре (25°C или 77°F).
http://water.usgs.gov/edu/waterproperties.html
www.ozh3o.com/h3chem.html
Каждый атом водорода в воде ковалентно связан с кислородом через общую пару электронов. Кислород также имеет две неподеленные пары электронов, таким образом, есть четыре пары электронов, окружающих атом кислорода, две пары, участвующие в ковалентных связях с водородом, и две неподеленные пары на противоположной стороне атома кислорода.
Вода является полярной молекулой, что означает неравномерное распределение электронной плотности. Вода имеет частичный отрицательный заряд вблизи атома кислорода из-за неподеленных пар электронов и частичный положительный заряд вблизи атомов водорода. Электростатическое притяжение между частичным положительным зарядом вблизи атомов водорода и частичным отрицательным зарядом вблизи кислорода приводит к образованию водородной связи. А способность ионов и других молекул растворяться в воде обусловлена полярностью.
А способность ионов и других молекул растворяться в воде обусловлена полярностью.
Интернет-ресурс: watereducation.utah.gov/water…es/default.asp
4.1: Уникальные свойства воды распространяются по лицензии CC BY-NC-SA 4.0, автором, ремиксом и/или куратором является LibreTexts.
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Лицензия
- CC BY-NC-SA
- Версия лицензии
- 4,0
- Показать оглавление
- нет
- Теги

Ученые обнаружили новые свойства h3O
Группа ученых обнаружила новые молекулярные свойства воды — открытие явления, которое ранее оставалось незамеченным.
Известно, что жидкая вода является отличным переносчиком продуктов собственной автоионизации; то есть заряженные частицы, полученные при расщеплении молекулы воды (H 2 O) на протоны (H + ) и ионы гидроксида (OH — ). Это замечательное свойство воды делает ее важнейшим компонентом новых электрохимических технологий производства и хранения энергии, таких как топливные элементы; действительно, сама жизнь была бы невозможна, если бы вода не обладала этой характеристикой.
Известно, что вода состоит из сложной сети слабых направленных взаимодействий, известных как водородные связи. В течение почти века считалось, что механизмы, с помощью которых вода переносит ионы H + и OH − , являются зеркальным отражением друг друга — идентичными во всех отношениях, за исключением направлений водородных связей, участвующих в этом процессе.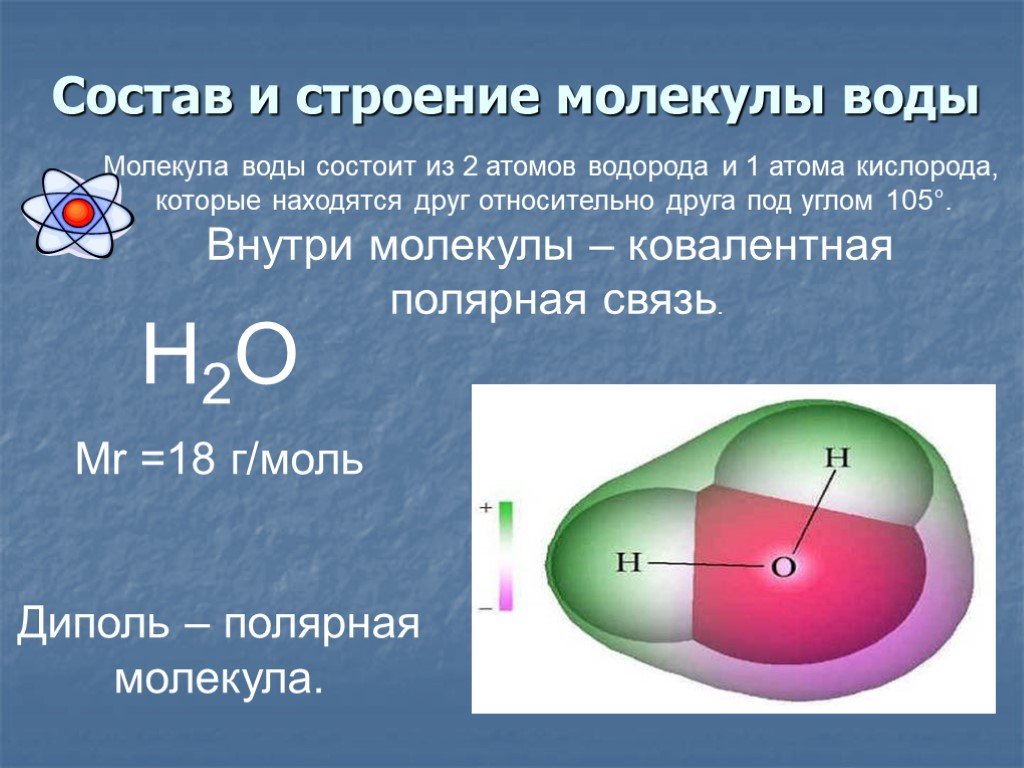
Современные современные теоретические модели и компьютерное моделирование, однако, предсказывают фундаментальную асимметрию в этих механизмах. Если это так, то эту асимметрию можно использовать в различных приложениях, адаптируя систему так, чтобы один ион отдавал предпочтение другому.
Экспериментальное подтверждение теоретического предсказания остается труднодостижимым из-за сложности непосредственного наблюдения двух ионных разновидностей. Различные эксперименты дали лишь проблески предсказанной асимметрии.
Группа ученых Нью-Йоркского университета под руководством профессора Алексея Ершоу, в которую вошли Эмилия Силлетта, научный сотрудник Нью-Йоркского университета, и Марк Такерман, профессор химии и математики Нью-Йоркского университета, разработала новый эксперимент для выявления этой асимметрии. Экспериментальный подход заключался в охлаждении воды до ее так называемой температуры максимальной плотности, при которой асимметрия, как ожидается, будет наиболее сильно проявляться, что позволило ее тщательно обнаружить.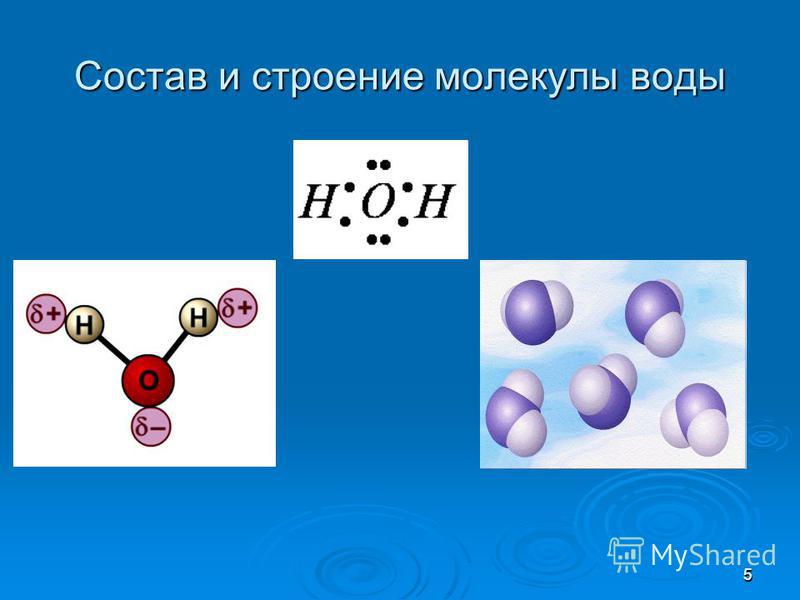
Общеизвестно, что лед плавает по воде, а озера замерзают сверху. Это связано с тем, что молекулы воды упаковываются в структуру с меньшей плотностью, чем плотность жидкой воды, что является проявлением необычных свойств воды: плотность жидкой воды увеличивается сразу после точки замерзания и достигает максимума при четырех градусах Цельсия (39 градусов по Фаренгейту). ), так называемая температура максимальной плотности; эта разница в плотности диктует, что жидкость всегда находится подо льдом.
Охлаждая воду до этой температуры, группа применила методы ядерного магнитного резонанса (тот же подход используется в медицине при магнитно-резонансной томографии), чтобы показать, что разница во времени жизни двух ионов достигает максимального значения (чем больше срок службы, тем медленнее транспорт). Подчеркнув разницу в продолжительности жизни, асимметрия стала очевидной.
Как отмечалось ранее, вода состоит из одного атома кислорода и двух атомов водорода, но атомы водорода относительно подвижны и могут перескакивать с одной молекулы на другую, и именно этот прыжок делает две ионные разновидности столь подвижными в воде.
В поисках объяснений характеристик, зависящих от температуры, исследователи сосредоточились на скорости, с которой могут происходить такие прыжки.
Предыдущие исследования показали, что два основных геометрических расположения водородных связей (по одной связанной с каждым ионом) облегчают прыжки. Исследователи обнаружили, что одна из схем приводит к значительно более медленным скачкам для OH — , чем для H + при четырех градусах Цельсия. Поскольку это также температура максимальной плотности, исследователи сочли, что эти два явления должны быть связаны. Кроме того, их результаты показали, что прыжковое поведение молекул резко изменилось при этой температуре.
«Изучение молекулярных свойств воды представляет большой интерес из-за ее центральной роли в обеспечении физиологических процессов и ее повсеместного характера», — говорит Джершоу, соответствующий автор этого исследования. «Новое открытие весьма неожиданно и может способствовать более глубокому пониманию свойств воды, а также ее роли в качестве жидкости во многих явлениях природы».