Содержание
Удивительные и странные свойства воды
| «Вода, у тебя нет ни вкуса, ни цвета, ни запаха, тебя невозможно описать, тобою наслаждаются, не ведая, что ты такое. Нельзя сказать, что ты необходима для жизни: ты сама жизнь. Ты восполняешь нас радостью, которую не объяснишь нашими чувствами. С тобою возвращаются к нам силы, с которыми мы уже простились. По твоей милости в нас вновь начинают бурлить высохшие родники нашего сердца.» (Антуан де Сент Экзюпери). |
«Нет ничего мягче и слабее воды, и нет ничего, что бы превосходило ее в разрушительной атаке на все жесткое и сильное». Китайский мудрец Лао-Цзы именно так ее охарактеризовал в одном из своих древних текстов Также парадоксально, что вода хорошо знакома нам (из нее на две трети состоит наше тело и на три четверти наша планета) и в то же время чрезвычайно загадочна. Несмотря на то, что вы много о ней знаете, многие из ее свойств могут вас удивить. Другие же являются настолько странными, что до сих пор ускользают от научного понимания. Дефицит воды в человеческом и любом другом живом организме вызовет весьма скоротечное обезвоживание. В таком случае страдает прежде всего нервная система, больше всего состоящая из воды, а затем и другие системы жизнеобеспечения. Поэтому главное полезное свойство воды — это обеспечение жизнедеятельности всех живых существ.
Несмотря на то, что вы много о ней знаете, многие из ее свойств могут вас удивить. Другие же являются настолько странными, что до сих пор ускользают от научного понимания. Дефицит воды в человеческом и любом другом живом организме вызовет весьма скоротечное обезвоживание. В таком случае страдает прежде всего нервная система, больше всего состоящая из воды, а затем и другие системы жизнеобеспечения. Поэтому главное полезное свойство воды — это обеспечение жизнедеятельности всех живых существ.
Прежде всего главной составляющей крови является именно вода. Кровь разносит по всем системам органов полезные вещества, минералы и соли, поэтому чем больше в нее поступает чистой воды, тем лучше. Органом, наиболее подверженным заболеваниям из-за нехватки жидкости, являются почти. Из-за этого они сильно нагружаются, а затем перестают выводить токсины в достаточном объеме Высококвалифицированные специалисты утверждают, что талую воду применяют при лечении атеросклероза; холодную воду эффективно использовать при рвоте, головокружении, перегревании; токсическом и пищевом отравлении, обмороках и повышенной температуре тела; горячая вода снижает спазмы при менструальном цикле, обильно выводя кровь, а также помогает в улучшении пищеварения. Противореча школьным урокам физики, вода имеет вовсе не три агрегатных состояния — жидкое, твердое (лед и снег) и газообразное (пар). Сейчас известно, что вода как вещество способна существовать в пяти, а не трех, агрегатных состояниях, и это только в жидком виде. А в твердом — в целых четырнадцати! Ни одно вещество на Земле не может поглощать тепло так, как вода. Теплоемкость воды намного больше теплоемкости стали и даже ртути Вода обладает способностью отдавать и поглощать тепло, климат Земли в один миг стал бы совершенно непригодным для существования любых разумных форм жизни: высокие широты подверглись бы влиянию ужасного холода, а в низких широтах царствовало бы испепеляющее солнце.. Подземный океан обеспечивает нашу планету теплом благодаря внутренним источникам Земли. Ученые выделяют, как минимум, 5 различных состояний воды в жидком виде и 14 состояний в замерзшем виде. Физики обнаружили, что нейтроны, направленные на молекулы воды, «видят» на 25% меньше протонов водорода, чем ожидалось.
Противореча школьным урокам физики, вода имеет вовсе не три агрегатных состояния — жидкое, твердое (лед и снег) и газообразное (пар). Сейчас известно, что вода как вещество способна существовать в пяти, а не трех, агрегатных состояниях, и это только в жидком виде. А в твердом — в целых четырнадцати! Ни одно вещество на Земле не может поглощать тепло так, как вода. Теплоемкость воды намного больше теплоемкости стали и даже ртути Вода обладает способностью отдавать и поглощать тепло, климат Земли в один миг стал бы совершенно непригодным для существования любых разумных форм жизни: высокие широты подверглись бы влиянию ужасного холода, а в низких широтах царствовало бы испепеляющее солнце.. Подземный океан обеспечивает нашу планету теплом благодаря внутренним источникам Земли. Ученые выделяют, как минимум, 5 различных состояний воды в жидком виде и 14 состояний в замерзшем виде. Физики обнаружили, что нейтроны, направленные на молекулы воды, «видят» на 25% меньше протонов водорода, чем ожидалось. Вода хранит любую информацию.
Вода хранит любую информацию.
Альтернативная официальной медицине гомеопатия утверждает, что разбавленный раствор лекарственного препарата может оказывать лечебный эффект на организм, даже если коэффициент разбавления настолько велик, что в растворе уже не осталось ничего, кроме молекул воды. Японский ученый Масару Емото более двадцати лет изучает кристаллы воды. Оказалось, что кристаллы воды, к которой до начала кристаллизации «обратились» с такими словами, как «доброта», «любовь», «ангел», «благодарность», имели правильную структуру, симметричную форму и были украшены сложным, красивым орнаментом.
Но если воде были сообщены слова типа «зло», «ненависть», «злоба», «то кристаллы получались мелкими, деформированными, уродливыми на вид. Воде не важно, на каком языке с ней общаются, она понимает любую речь. Вода способна воспринимать и отображать такие человеческие эмоции, как страх, боль, страдание. «Прослушав» сочинения Бетховена, «Аве Марию» Шуберта или «Свадебный марш» Мендельсона, она образует кристаллы фантастической красоты. А когда воде сообщили названия пяти основных мировых религий — христианство, буддизм, индуизм, ислам, и иудаизм, из нее образовался пятиугольный кристалл, и в нем просматривались контуры человеческого лица! Вода в нашей жизни — самое обычное и самое распространенное вещество. Однако с научной точки зрения это самая необычная, самая загадочная жидкость. Нет предела человеческому разуму, нет предела его возможностям; и то, что мы теперь так много знаем о природе и свойствах поистине самого необыкновенного в мире вещества — о воде, открывает еще большие возможности. Кто может сказать, что еще будет узнано, что открыто нового, еще более необычайного? Надо только уметь видеть и удивляться. Вода, как и все в мире, неисчерпаема. Эти свойства- подарок всему живому на Земле.
А когда воде сообщили названия пяти основных мировых религий — христианство, буддизм, индуизм, ислам, и иудаизм, из нее образовался пятиугольный кристалл, и в нем просматривались контуры человеческого лица! Вода в нашей жизни — самое обычное и самое распространенное вещество. Однако с научной точки зрения это самая необычная, самая загадочная жидкость. Нет предела человеческому разуму, нет предела его возможностям; и то, что мы теперь так много знаем о природе и свойствах поистине самого необыкновенного в мире вещества — о воде, открывает еще большие возможности. Кто может сказать, что еще будет узнано, что открыто нового, еще более необычайного? Надо только уметь видеть и удивляться. Вода, как и все в мире, неисчерпаема. Эти свойства- подарок всему живому на Земле.
Материал подготовила врач ОМП ГУЗ «ЕГБ №2» И.С.Бурлакова
26. Охарактеризуйте физические и химические свойства воды, её роль в природе.
Под
свойствами воды понимают совокупность
биохимических, органолептических,
физико-химических, физических, химических
и других свойств воды. Многие свойства
Многие свойства
воды аномальны, это вызвано особенностями
строения молекулы воды. Молекула воды
обладает угловым строением, ядра которого
образуют равнобедренный треугольник.
В основании этого треугольника находятся
два протона, а вершиной является ядро
атома кислорода.
Вода
(Н2О)
– это окись водорода, она является
наиболее важным и распространенным
веществом, в природе не существует
чистой воды, в ней обязательно содержатся
какие-либо примеси, чистая вода не имеет
вкуса и запаха, прозрачна, ее получают
в процессе перегонки, после этого она
называется дистиллированной.
При
переходе воды из твердого состояния в
жидкое ее плотность не уменьшается, а
возрастает, также плотность воды
увеличивается при ее нагреве от 0 до
+4°С, максимальную плотность вода имеет
при +4°С, и только при последующем ее
нагревании плотность уменьшается.
При
+4°С градусах плотность воды превышает
плотность льда, благодаря чему охлаждаясь
сверху вода опускается на дно лишь до
тех пор, пока ее температура не достигнет
+4°С, вследствие чего лед остается на
поверхности водоемов, что делает
возможным жизнь под слоем льда водной
флоры и фауны.
Данные
свойства воды связаны с существующими
в ней водородными связями, связывающими
между собой молекулы, как в жидком, так
и в твердом состоянии.
Еще
одним свойством воды является то, что
она обладает высокой теплоемкостью
(4,1868 кДж/кг), это объясняет, почему в
ночное время и при переходе от лета к
зиме вода остывает медленно, а днем или
во время перехода от зимы к лету также
медленно нагревается. Благодаря этому
свойству вода является регулятором
температуры на Земле.
Вода
обладает большой удельной теплоемкостью
и является хорошим теплоносителем.
Среди
всех жидкостей вода имеет самое высокое
поверхностное натяжение, исключение
составляет только ртуть. Дистиллированная
вода не проводит электрический ток, так
как она слабый электролит и диссоциирует
в малой степени.
Однако
вода способна стать хорошим проводником
при условии растворения в ней даже
малого количества ионных веществ.
По
массе в состав воды входит 88,81% кислорода
и 11,19% водорода, вода кипит при температуре
+100°С, а замерзает при 0°С, она плохой
проводник для электричества и теплоты,
но хороший растворитель.
Вода
является растворителем необходимым
для протекания биохимических реакций,
она хорошо растворяет ионные и многие
ковалентные соединения. Своими
способностями к растворению многих
веществ вода обязана полярности своих
молекул (при растворении ионных веществ
молекулы воды ориентируются вокруг
ионов).
Тяжелой
водой (D2О)
называется та вода, в состав которой
входит изотоп водорода дейтерий,
химические реакции с такой водой
протекают медленнее, чем с обычной.
Физические | Н2О | D2О |
Температура | 100 | 101,4 |
Температура | 0 | 3,8 |
Плотность | 0,9982 | 1,1050 |
Молекулярная | 18 | 20 |
Физические
свойства воды аномальны, вода является
единственным веществом на Земле,
существующим в жидком, твердом и
газообразном состояниях.
Многие
столетия люди не знали, что представляет
собой вода, и как появилась она на
планете. До XIX века люди не знали, что
вода — химическое соединение. Ее считали
обычным химическим элементом. После
этого свыше ста лет все и всюду считали,
что вода — соединение, описываемое
единственно возможной формулой H2O.
В 1932 году мир облетела сенсация:
кроме обычной воды, в природе существует
еще и тяжелая вода. Сегодня известно,
что изотопных разновидностей воды может
быть 135. Состав воды, даже полностью
освобожденной от минеральных и
органических примесей, сложен и
многообразен. Такое непростое это
«простейшее соединение» — вода.
Всё многообразие свойств воды и
необычность их проявления определяется,
в конечном счете, физической природой
этих атомов, способом их объединения в
молекулу и группировкой образовавшихся
молекул. Постоянно соприкасаясь со
всевозможными веществами, вода фактически
всегда представляет собой раствор
различного, зачастую очень сложного
состава. Она проявляет себя, как
универсальный растворитель. Ее
Ее
растворяющему действию, в той или иной
мере, подвластны и твердые тела, и
жидкости, и газы.
Около семидесяти
элементов Периодической системы
содержатся в ней в обнаруживаемых
количествах. Даже редкие и радиоактивные
элементы находятся в водах морей и
океанов. В наибольшем количестве
содержатся хлор, натрий, магний, сера,
кальций, калий, бром, углерод, стронций,
бор. Одного только золота растворено в
водах океана по 3 кг на душу населения
Земли.
По содержанию растворенных в
ней веществ вода делится на 3 класса:
пресная, соленая и рассолы. Наибольшее
значение в быту имеет пресная вода. Хотя
вода покрывает три четверти поверхности
Земли и запасы ее огромны и постоянно
поддерживаются кругооборотом воды в
природе, проблема обеспечения пресной
водой во многих районах земного шара
не решена и с развитием научно-технического
прогресса обостряется.
Природная
вода не бывает совершенно чистой.
Наиболее чистой является дождевая вода,
но и она содержит незначительные
количества различных примесей, которые
захватывает из воздуха.
Наличие в
воде различных веществ свидетельствует
о ее высокой растворяющей способности.
Это основное свойство воды. Вся
практическая деятельность человека, с
самой глубокой древности, связана с
использованием воды и водных растворов
и для приготовления пищи и для других
житейских надобностей.
Роль воды в
жизни нашей планеты удивительна и, как
ни странно, раскрыта еще не до конца.
Океаны, покрывающие Землю, являются
единым огромным своеобразным термостатом,
который летом не дает Земле перегреваться,
а зимой постоянно снабжает континенты
теплом. Водная поверхность планеты
поглощает избыток углекислого газа в
атмосфере, иначе Земля бы перегрелась
из-за «парникового эффекта».
Интересно и, оказывается, очень важно,
что, в отличие от других веществ, вода
при замерзании не уплотняется, а
расширяется. Молекулы льдоподобной
воды расположены таким образом, что
между ними возникают большие пустоты,
а поэтому лед рыхлообразный, то есть
легче, чем жидкая вода, и поэтому не
тонет.
Температура
замерзания и таяния воды 0° С, а кипения
— 100° С. Толстый слой воды имеет голубой
Толстый слой воды имеет голубой
цвет, что обусловливается не только ее
физическими свойствами, но и присутствием
взвешенных частиц примесей. Вода горных
рек зеленоватая из-за содержащихся в
ней взвешенных частиц карбоната кальция.
Чистая вода — плохой проводник
электричества.
Сжимаемость воды очень
мала. Плотность воды максимальна при
4° С. Это объясняется свойствами водородных
связей ее молекул. Если оставить воду
в открытой емкости, то она постепенно
испарится — все ее молекулы перейдут в
воздух. В то же время вода, находящаяся
в плотно закупоренном сосуде испаряется
лишь частично, т.е. при определенном
давлении водяных паров между водой и
воздухом, находящимся над ней,
устанавливается равновесие. Давление
паров в равновесии зависит от температуры
и называется давлением насыщенного
пара (или его упругостью). При обычном
давлении 760 мм рт.ст. вода кипит при 100°
С, а на высоте 2900 м над уровнем моря
атмосферное давление падает до 525 мм
рт.ст. и температура кипения оказывается
равной 90° С. Испарение происходит даже
Испарение происходит даже
с поверхности снега и льда, именно
поэтому высыхает на морозе мокрое белье.
Вязкость воды с ростом температуры
быстро уменьшается и при 100° С оказывается
в 8 раз меньше, чем при 0° С.
Структура и свойства воды | Введение в химию |
Цель обучения
- Описать структуру и свойства воды.
Ключевые моменты
- Вода представляет собой жидкость при стандартной температуре и давлении (25 градусов Цельсия и 1 атм для жидкостей).
- Вода без вкуса и запаха.
- Вода прозрачна в видимой части электромагнитного спектра.
- Вода может выступать как в роли кислоты, так и в качестве основания.
- Вода является универсальным растворителем, растворяющим многие вещества, встречающиеся в природе.
Термины
- фазовая диаграммаГрафик, показывающий фазовое состояние образца вещества при различных условиях температуры и давления.

- равновесие Состояние реакции, при котором скорости прямой и обратной реакции равны.
- диполь Любая молекула или радикал, который имеет делокализованные положительные и отрицательные заряды.
- амфотерная молекула, которая может действовать как кислота или основание в зависимости от химического окружения. Например, вода (H 2 O) амфотерна.
Свойства воды
Вода является самым распространенным соединением на поверхности Земли. В природе вода существует в жидком, твердом и газообразном состояниях. Он находится в динамическом равновесии между жидким и газообразным состояниями при температуре 0 градусов Цельсия и давлении 1 атм. При комнатной температуре (приблизительно 25 градусов Цельсия) это жидкость без вкуса, запаха и цвета. В воде растворяются многие вещества, и ее принято называть универсальным растворителем.
Свойства воды Таблица некоторых химических и физических свойств воды.
Фазы воды
Подобно многим другим веществам, вода может принимать различные формы. Ее жидкая фаза, наиболее распространенная фаза воды на Земле, представляет собой форму, которую обычно подразумевают под словом «вода».
Твердая фаза (лед)
Твердая фаза воды известна как лед и обычно имеет структуру твердых амальгамированных кристаллов, таких как кубики льда, или свободно скопившихся зернистых кристаллов, таких как снег. В отличие от большинства других веществ, твердая форма воды (лед) равна менее плотный, чем его жидкая форма, из-за характера его гексагональной упаковки внутри его кристаллической структуры. Эта решетка содержит больше места, чем когда молекулы находятся в жидком состоянии.
Шестиугольная структура льда Как природное кристаллическое неорганическое твердое вещество с упорядоченной структурой лед считается минералом. Он обладает правильной кристаллической структурой, основанной на молекулярной структуре воды, которая состоит из одного атома кислорода, ковалентно связанного с двумя атомами водорода: Н-О-Н.
Тот факт, что плотность льда меньше, чем у жидкой воды, имеет важное следствие, заключающееся в том, что лед плавает.
Плотность льда и воды в зависимости от температуры Твердая форма большинства веществ более плотная, чем жидкая фаза; поэтому блок данного твердого вещества обычно тонет в соответствующей жидкости. Однако глыба льда плавает в жидкой воде, потому что лед менее плотный, чем жидкая вода. На вставке более подробно показана кривая в диапазоне 0-10 градусов Цельсия. Жидкая вода имеет наибольшую плотность при температуре 4 градуса по Цельсию.
Жидкая фаза (вода)
Вода в основном является жидкостью при стандартных условиях (25 градусов Цельсия и давление 1 атм). Эту характеристику нельзя было предсказать по его связи с другими газообразными гидридами семейства кислорода в периодической таблице, такими как сероводород. Элементы, окружающие кислород в периодической таблице — азот, фтор, фосфор, сера и хлор — все в сочетании с водородом образуют газы при стандартных условиях. Вода образует жидкость, а не газ, потому что кислород более электроотрицательный, чем окружающие элементы, за исключением фтора. Кислород притягивает электроны гораздо сильнее, чем водород, что приводит к частичному положительному заряду атомов водорода и частичному отрицательному заряду атома кислорода. Наличие такого заряда на каждом из этих атомов придает молекуле воды результирующий дипольный момент.
Вода образует жидкость, а не газ, потому что кислород более электроотрицательный, чем окружающие элементы, за исключением фтора. Кислород притягивает электроны гораздо сильнее, чем водород, что приводит к частичному положительному заряду атомов водорода и частичному отрицательному заряду атома кислорода. Наличие такого заряда на каждом из этих атомов придает молекуле воды результирующий дипольный момент.
Электрическое притяжение между молекулами воды, вызванное этим диполем, сближает отдельные молекулы, что затрудняет разделение молекул и, следовательно, повышает температуру кипения. Этот тип притяжения известен как водородная связь. Молекулы воды постоянно движутся относительно друг друга, а водородные связи постоянно разрываются и восстанавливаются с интервалами короче 200 фемтосекунд (200 x 10 -15 секунд).
Расположение молекул воды в жидкой фазе Молекулы воды выстраиваются в соответствии с их полярностью, образуя водородные связи (обозначаются цифрой «1»).
Многие физические и химические свойства воды (включая ее способность растворителя) частично связаны с кислотно-щелочными реакциями, частью которых она может быть. Воду можно описать как амфотерную молекулу, что означает, что она может реагировать как с кислотой Бренстеда-Лоури, так и с основанием. Это можно показать на примере реакции между двумя молекулами воды, в результате которой образуется ион гидроксония (H 9- (aq)h3O(l)+h3O(l)⇌h4O+(aq)+OH−(aq)
Газовая фаза (водяной пар)
Газообразная фаза воды известна как водяной пар (или пар) и характеризуется прозрачным облаком. Вода также существует в редком четвертом состоянии, называемом сверхкритическим флюидом, которое встречается только в крайне непригодных для жизни условиях. Когда вода достигает определенной критической температуры и определенного критического давления (647 К и 22,064 МПа), жидкая и газовая фазы сливаются в одну гомогенную флюидную фазу, обладающую свойствами газа и жидкости.
Фазовая диаграмма воды
Вода замерзает, образуя лед, лед тает, образуя жидкую воду, и вода, и лед могут переходить в состояние пара. Фазовые диаграммы помогают описать, как вода меняет свое состояние в зависимости от давления и температуры.
Фазовая диаграмма воды Три фазы воды – жидкая, твердая и парообразная – показаны в пространстве температура-давление.
Обратите внимание на следующие ключевые точки на фазовой диаграмме:
- Критическая точка (КТ), выше которой существуют только сверхкритические флюиды.
- Тройная точка (ТР), четко определенная координата пересечения кривых, в которой три состояния вещества (твердое, жидкое, газообразное) существуют в равновесии друг с другом.
- Четко определенные границы между твердым телом и жидкостью, твердым телом и газом, жидкостью и газом. При фазовом переходе между двумя фазами (т. е. вдоль этих границ) фазы находятся в равновесии друг с другом.

Полярность воды
Полярная природа воды является особенно важной особенностью, которая способствует уникальности этого вещества. Молекула воды образует угол с атомом кислорода в вершине и атомами водорода на концах. Поскольку кислород имеет более высокую электроотрицательность, чем водород, сторона молекулы с атомом кислорода имеет частичный отрицательный заряд. Объект с такой разницей зарядов называется диполем (что означает «два полюса»). Кислородный конец частично отрицательный, а водородный конец частично положительный; из-за этого направление дипольного момента указывает от кислорода к центральному положению между двумя атомами водорода. Эта разница зарядов заставляет молекулы воды притягиваться друг к другу (относительно положительные области притягиваются к относительно отрицательным областям), а также к другим полярным молекулам. Это притяжение способствует образованию водородных связей и объясняет многие свойства воды (в том числе ее способность действовать как растворитель для многих веществ).
Полярность молекулы воды Из-за разницы в электроотрицательности атомов водорода (H) и кислорода (O) и изогнутой формы молекулы H 2 O существует результирующий дипольный момент. На рисунке показаны парциальные заряды, которыми обладают атомы.
Молекула воды может образовать максимум четыре водородные связи, приняв два атома водорода и отдав два атома водорода. Хотя водородная связь представляет собой относительно слабое притяжение по сравнению с ковалентными связями внутри самой молекулы воды (внутримолекулярные связи), она отвечает за ряд физических свойств воды. Одним из таких свойств является относительно высокая температура плавления и кипения; требуется больше энергии, чтобы разорвать водородные связи между молекулами, чтобы перейти в фазу с более высокой энергией.
Show Sources
Безграничный выбор и проверка высококачественного контента с открытой лицензией со всего Интернета. Данный конкретный ресурс использовал следующие источники:
«Безграничный».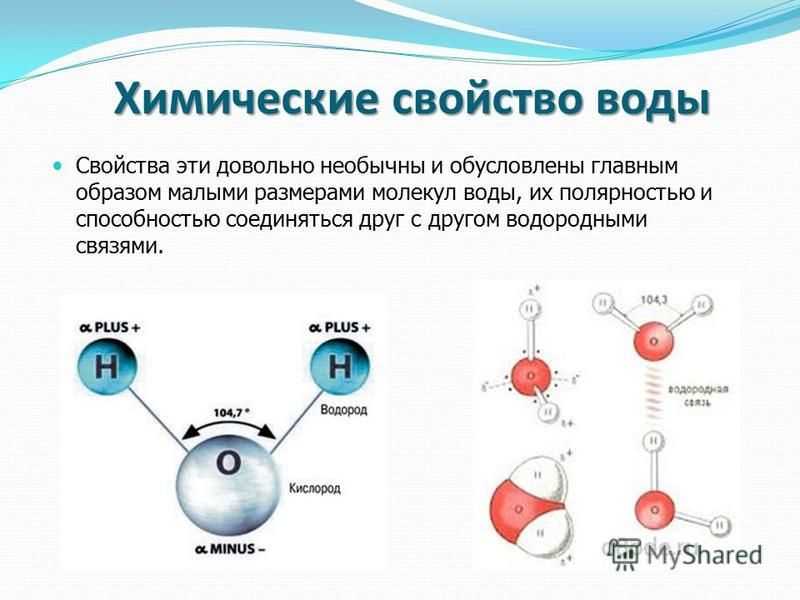
http://www.boundless.com/
Безграничное обучение
CC BY-SA 3.0.
«диполь».
http://en.wiktionary.org/wiki/dipole
Викисловарь
CC BY-SA 3.0.
«фазовая диаграмма».
http://en.wiktionary.org/wiki/phase_diagram
Викисловарь
CC BY-SA 3.0.
«равновесие».
http://en.wiktionary.org/wiki/равновесие
Викисловарь
CC BY-SA 3.0.
«Вода».
http://en.wikipedia.org/wiki/Вода
Википедия
CC BY-SA 3.0.
«Свойства воды».
http://en.wikipedia.org/wiki/Properties_of_water
Википедия
CC BY-SA 3.0.
«Лед».
http://en. wikipedia.org/wiki/Ice
wikipedia.org/wiki/Ice
Wikipedia
CC BY-SA 3.0.
«Водяной пар».
http://en.wikipedia.org/wiki/Water_vapor
Wikipedia
CC BY-SA 3.0.
«Диаграмма состояния воды».
http://en.wikipedia.org/wiki/File:Water_phase_diagram.svg
Wikipedia
CC BY-SA.
«209 полярных ковалентных связей в молекуле воды».
http://commons.wikimedia.org/wiki/File:209_Polar_Covalent_Bonds_in_a_Water_Molecule.jpg
Wikimedia Commons
CC BY 3.0.
«Лед».
http://en.wikipedia.org/wiki/Ice%23Phases
Википедия
GNU FDL.
Лицензии и ссылки
Контент с лицензией CC, ранее опубликованный
- Boundless Chemistry. Предоставлено : Безграничное обучение.
 Лицензия : CC BY-SA: Attribution-ShareAlike
Лицензия : CC BY-SA: Attribution-ShareAlike
Структура и свойства воды
Вода является ценным природным ресурсом. Вода необходима для выживания всех живых существ. Мы не можем представить мир без воды. Вода требуется животным и растениям для завершения их повседневной метаболической деятельности. Вода необходима растениям для синтеза пищи в процессе фотосинтеза. Мы все можем прожить дни без еды, но не можем представить дни без воды; без воды даже растения засыхают и сбрасывают листья.
Вода — бесцветное и прозрачное химическое вещество, которое является основным компонентом рек, океанов и озер земной коры. Это важная жидкость, которая играет важную роль в выживании жизни на Земле.
H 2 O — химическая формула воды. Он состоит из двух атомов водорода и одного атома кислорода, соединенных ковалентными связями. Эта жидкость составляет 71% земной поверхности.
Состояние воды
- Вода в твердом состоянии называется льдом. Вода замерзает, образуя лед, при 0 градусов по Цельсию (точка замерзания воды).
- Вода в жидком состоянии покрывает большую часть земной поверхности. Он используется в самых разных приложениях.
- Водяной пар представляет собой газообразное состояние воды. Вода достигает точки кипения при 100 градусах Цельсия и превращается в водяной пар.
Физические свойства воды
- Химическая формула: H 2 O — это химическая формула воды, как мы все знаем. Ковалентные связи существуют между атомами водорода и кислорода в молекуле воды. Один атом кислорода образует соединение с двумя атомами водорода.
- Внешний вид: В естественном состоянии вода представляет собой бесцветную жидкость без запаха и вкуса.
- Температура кипения: Вода имеет температуру кипения 100 градусов по Цельсию, как мы все знаем.
 Однако сравнительно высокая температура кипения воды нарушает тенденцию таблицы Менделеева. Водород (следующий гидрид) имеет относительно высокую температуру кипения по сравнению с теллуридом водорода и сероводородом, оба из которых имеют низкие температуры кипения. Это связано с чрезвычайно сильными водородными связями в молекуле воды. Для того, чтобы они сломались и начали кипеть, требуется много энергии.
Однако сравнительно высокая температура кипения воды нарушает тенденцию таблицы Менделеева. Водород (следующий гидрид) имеет относительно высокую температуру кипения по сравнению с теллуридом водорода и сероводородом, оба из которых имеют низкие температуры кипения. Это связано с чрезвычайно сильными водородными связями в молекуле воды. Для того, чтобы они сломались и начали кипеть, требуется много энергии. - Температура замерзания: То же самое относится к температуре замерзания воды. Вода имеет температуру замерзания 0 градусов по Цельсию. Тот факт, что воде требуется много времени, чтобы замерзнуть (или даже закипеть), имеет решающее значение для существования нашей экосистемы.
- Плотность: Одним из замечательных свойств воды является то, что она плотная в продаваемом состоянии. Плотность воды увеличивается по мере ее охлаждения до 4°С. Однако после этого вода становится менее плотной. Из-за этого лед плавает в воде.
- Вязкость: Из-за очень сильных межмолекулярных взаимодействий вода имеет высокую вязкость.

- Растворимость: Вода является высокоэффективным растворителем. Его даже называют универсальным растворителем.
Химические свойства воды
- Амфотерная природа: Вода амфотерна по своей природе, поскольку она может действовать как кислота и как основание. Следующие две реакции показывают, что вода имеет амфотерную природу.
Н 2 O (L) + HCl (AQ) ⇌ H 3 O + + CL —
H 2 O (L) + NH 3 (AQ) ⇌ O (L) + NH 3 (AQ) ⇌ O (L) + NH 3 (AQ). + + OH –
- Окислительно-восстановительные реакции: Вода восстанавливается до молекулы водорода с помощью электроположительных элементов. В результате вода является богатым источником водорода. Вода окисляется до O 2 в процессе фотосинтеза. Вода очень полезна в окислительно-восстановительных реакциях, потому что она может окисляться и восстанавливаться.

- Реакция гидролиза: Из-за своей диэлектрической проницаемости вода имеет очень сильную склонность к гидратации. Он растворяет широкий спектр ионных соединений. Вода может гидролизовать некоторые ковалентные и ионные соединения.
Структура воды
Жидкая вода
Молекула воды состоит из двух атомов водорода, соединенных одной химической связью с атомом кислорода. Ядра большинства атомов водорода полностью состоят из протонов. Вода содержит две изотопные формы, дейтерий и тритий, в которых атомные ядра также содержат один и два нейтрона соответственно. Оксид дейтерия (D 2 O), также известная как тяжелая вода, используется в химических исследованиях и в качестве замедлителя нейтронов в некоторых ядерных реакторах.
Атомы водорода в молекулах воды притягиваются к областям с высокой электронной плотностью и могут образовывать слабые связи, известные как водородные связи, с этими областями. Это означает, что атомы водорода в одной молекуле воды притягиваются к несвязывающим электронным парам атома кислорода соседней молекулы воды. Считается, что структура жидкой воды состоит из агрегатов молекул воды, которые постоянно образуются и переформируются. Другие необычные свойства воды, такие как ее высокая вязкость и поверхностное натяжение, объясняются этим ближним порядком.
Считается, что структура жидкой воды состоит из агрегатов молекул воды, которые постоянно образуются и переформируются. Другие необычные свойства воды, такие как ее высокая вязкость и поверхностное натяжение, объясняются этим ближним порядком.
Структуры льда
Межмолекулярные взаимодействия в твердом состоянии (лед) приводят к высокоупорядоченной, но рыхлой структуре, в которой каждый атом кислорода окружен четырьмя атомами водорода, два из которых ковалентно связаны с атомом кислорода и два других (на больших расстояниях) связаны водородной связью с неподеленными электронными парами атома кислорода.
Из-за своей открытой структуры лед имеет меньшую плотность, чем жидкая вода, в которой упорядоченная структура частично нарушена, а молекулы воды (в среднем) расположены ближе друг к другу. В зависимости от условий вода может замерзнуть в различные структуры.
Значение структуры жидкой воды
- Жидкое состояние воды имеет очень сложную структуру, которая, несомненно, включает значительную ассоциацию молекул.
 Из-за обширных водородных связей между молекулами в жидкой воде значения таких свойств, как вязкость, поверхностное натяжение и температура кипения, намного выше, чем можно было бы ожидать для типичной жидкости с небольшими молекулами. В отличие от конденсированных состояний воды (твердого и жидкого), которые имеют обширную связь между молекулами воды, газообразная (парообразная) фаза имеет относительно независимые молекулы воды, разделенные большими расстояниями.
Из-за обширных водородных связей между молекулами в жидкой воде значения таких свойств, как вязкость, поверхностное натяжение и температура кипения, намного выше, чем можно было бы ожидать для типичной жидкости с небольшими молекулами. В отличие от конденсированных состояний воды (твердого и жидкого), которые имеют обширную связь между молекулами воды, газообразная (парообразная) фаза имеет относительно независимые молекулы воды, разделенные большими расстояниями. - Полярность молекулы воды важна при растворении ионных соединений во время образования водного раствора. Океаны на Земле содержат огромное количество растворенных солей, которые являются ценными природными ресурсами. Кроме того, сотни химических реакций, которые происходят каждую секунду, чтобы поддерживать жизнь организмов, происходят в водных жидкостях. Кроме того, растворимость в воде таких веществ, как сахар и соль, позволяет придавать пищевым продуктам аромат во время их приготовления. Хотя растворимость растворенного вещества в воде является очень сложным процессом, решающее значение имеет взаимодействие между полярными молекулами воды и растворенным веществом.

- Когда ионное твердое вещество растворяется в воде, анионы притягивают положительные концы молекул воды, а катионы притягивают отрицательные концы. Это известно как гидратация. Гидратация ионов соли приводит к ее распаду (растворению) в воде. В процессе растворения сильные силы, существовавшие между положительными и отрицательными ионами твердого тела, заменяются сильными взаимодействиями ионов воды.
Значение воды
- Сельское хозяйство является наиболее важным видом использования воды. Орошение необходимо для сельского хозяйства, а вода является важнейшим компонентом в производстве продуктов питания.
- В зависимости от размера тела человеческое тело содержит от 50 до 78 % воды. Чтобы избежать обезвоживания, люди должны выпивать 7 литров воды в день.
- Необходим для пищеварения, а также других биологических процессов, происходящих в живых организмах. Это необходимо для поддержания рН тела. Он также помогает в движении антител иммунной системы.

- Помогает регулировать температуру тела. Вода обеспечивает организму необходимый охлаждающий эффект.
- Через пот и мочеиспускание вода вымывает вредные токсины из организма. Он предотвращает накопление отходов в живых организмах.
- Применяется для создания эмульсий и растворов, используемых в процессе стирки.
- Бытовое водопотребление составляет 15% от общего водопотребления. Вода используется для питья, купания, приготовления пищи и мытья посуды, одежды, фруктов и овощей, а также для чистки зубов.
- Используется либо при создании продукта, либо для охлаждения оборудования, используемого при создании продукта. Промышленная вода используется для мытья, охлаждения, обработки, транспортировки, разбавления или изготовления продукта. Большая часть воды используется в производстве химикатов, бумаги и продуктов питания.
- Он используется в транспорте, производстве, гидроэнергетике, удалении отходов тела, туризме и отдыхе.
Образец
Вопрос s
Вопрос 1: Каково наиболее важное использование воды?
Ответ:
Потребление воды в домашних условиях является наиболее значительным повседневным потреблением воды для большинства людей.
Бытовое использование относится к воде, используемой в доме ежедневно, например, для питья, приготовления пищи, купания, мытья одежды и посуды, смыва туалетов и орошения газонов и садов.
Вопрос 2. Дает ли вода энергию?
Ответ:
Вода содержит два типа электричества, а также множество других веществ. Кинетическая энергия считается первым видом энергии. Это электричество, такое как действие, которое используется во время выполнения процесса. Вода может течь в результате кинетической энергии, и могут образовываться волны.
Вопрос 3. Каков естественный источник воды?
Ответ:
Питьевую воду получают из природных источников, таких как подземные или морские воды. Подземные воды образуются, когда снег и дождь просачиваются сквозь землю. Вода собирается в открытых помещениях и порах, а также в песчано-гравийных отложениях, известных как водоносные горизонты.



 Лицензия : CC BY-SA: Attribution-ShareAlike
Лицензия : CC BY-SA: Attribution-ShareAlike  Однако сравнительно высокая температура кипения воды нарушает тенденцию таблицы Менделеева. Водород (следующий гидрид) имеет относительно высокую температуру кипения по сравнению с теллуридом водорода и сероводородом, оба из которых имеют низкие температуры кипения. Это связано с чрезвычайно сильными водородными связями в молекуле воды. Для того, чтобы они сломались и начали кипеть, требуется много энергии.
Однако сравнительно высокая температура кипения воды нарушает тенденцию таблицы Менделеева. Водород (следующий гидрид) имеет относительно высокую температуру кипения по сравнению с теллуридом водорода и сероводородом, оба из которых имеют низкие температуры кипения. Это связано с чрезвычайно сильными водородными связями в молекуле воды. Для того, чтобы они сломались и начали кипеть, требуется много энергии.

 Из-за обширных водородных связей между молекулами в жидкой воде значения таких свойств, как вязкость, поверхностное натяжение и температура кипения, намного выше, чем можно было бы ожидать для типичной жидкости с небольшими молекулами. В отличие от конденсированных состояний воды (твердого и жидкого), которые имеют обширную связь между молекулами воды, газообразная (парообразная) фаза имеет относительно независимые молекулы воды, разделенные большими расстояниями.
Из-за обширных водородных связей между молекулами в жидкой воде значения таких свойств, как вязкость, поверхностное натяжение и температура кипения, намного выше, чем можно было бы ожидать для типичной жидкости с небольшими молекулами. В отличие от конденсированных состояний воды (твердого и жидкого), которые имеют обширную связь между молекулами воды, газообразная (парообразная) фаза имеет относительно независимые молекулы воды, разделенные большими расстояниями.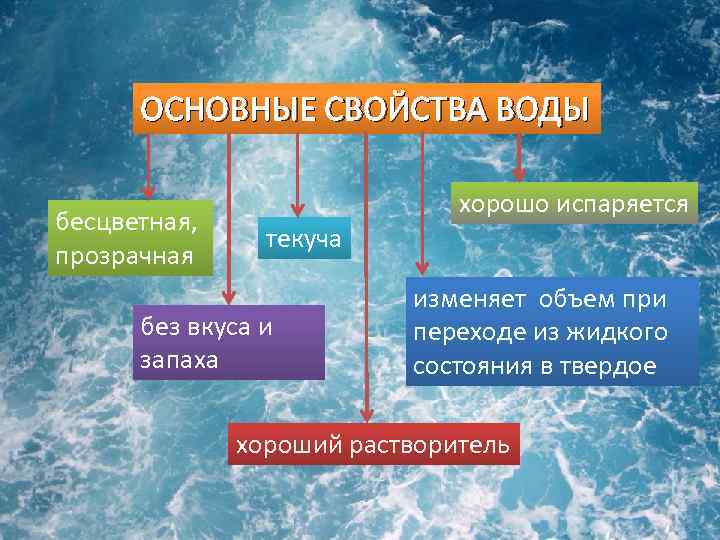

 Бытовое использование относится к воде, используемой в доме ежедневно, например, для питья, приготовления пищи, купания, мытья одежды и посуды, смыва туалетов и орошения газонов и садов.
Бытовое использование относится к воде, используемой в доме ежедневно, например, для питья, приготовления пищи, купания, мытья одежды и посуды, смыва туалетов и орошения газонов и садов.