Определение общей жесткости воды. Определение жесткости воды
15
82
8 Лабораторная работа №16
Жесткость воды, методы ее определения
Цель работы: познакомиться с понятием жесткости воды; овладеть методиками определения общей, временной (карбонатной) и постоянной (некарбонатной) жесткости воды методами потенциометрического и кислотно-основного титрования.
Оборудование и реактивы: 0,1н. соляная кислота; 0,1н. раствор трилона Б; индикаторы: эриохром черный кристаллический, фенолфталеин, метиловый оранжевый; аммиачный буфер; рН-метр; магнитная мешалка; бюретки; пипетки на 100 мл или мерные цилиндры; колбы на 250 мл и 500 мл; стаканы на 200 – 250 мл; мерные колбы на 200 мл; бумажные фильтры.
8.1 Теоретические пояснения
Природная вода в своем составе всегда содержит различные примеси: соли и газы, механические примеси, находящиеся во взвешенном состоянии, эмульсии, гидрозоли и другие образования. Некоторые соли, присутствующие в воде, вызывают ее жесткость.
Жесткость воды – это совокупность свойств воды, обусловленных присутствием в ней катионов Ca2+ и Mg2+, реже Fe2+.
Содержание в воде большого количества примесей растворимых солей кальция и магния делает ее непригодной для технических целей. Повышенная жесткость воды приводит к образованию накипи в паровых котлах и бытовой посуде. Это ухудшает теплообмен, а, следовательно, приводит к перерасходу топлива, электроэнергии, перегреву металлических поверхностей.
В жесткой воде ухудшается пенообразование и увеличивается расход мыла при стирке, так как часть содержащихся в нем растворимых солей жирных кислот переходит в нерастворимое состояние:
2C17h45COONa + CaSO4 = (C17h45COO)2Ca + Na2SO4.
При этом также ухудшается качество тканей вследствие осаждения на них нерастворимых кальциевых и магниевых солей высших жирных кислот.
В воде с повышенной жесткостью плохо развариваются овощи и мясо, так как катионы кальция образуют с белками нерастворимые соединения. Большая магниевая жесткость придает воде горький вкус.
Суммарное содержание Ca2+ и Mg2+ в воде называется общей жесткостью. Жесткость воды оценивается по-разному. В нашей стране ее чаще всего выражают количеством вещества эквивалентов кальция и магния (в ммоль) в одном литре воды.
Жесткость воды хозяйственно-питьевых водопроводов не должна превышать 7 ммоль экв./л. По величине жесткости воду условно подразделяют на мягкую (до 4 ммоль экв./л), средней жесткости (4 – 8 ммоль экв./л), жесткую (8 – 12 ммоль экв./л) и очень жесткую (более 12 ммоль экв./л).
Общая жесткость складывается из карбонатной (временной) и некарбонатной (постоянной). Карбонатная жесткость обусловлена присутствием в воде гидрокарбонатов кальция, магния, а иногда также и гидрокарбоната железа (II). Этот вид жесткости можно устранить кипячением:
Ca(HCO3)2 CaCO3 + h3O + CO2
CaCO3 + h3O + CO2
Mg(HCO3)2 MgCO3 + h3O + CO2;
MgCO3 + h3O + CO2;
2MgCO3 + h3O (MgOH)2CO3 + CO2
(MgOH)2CO3 + CO2
(MgOH)2CO3+h3O 2Mg(OH)2 +CO2
2Mg(OH)2 +CO2
Fe(HCO3)2 Fe(OH)2 + 2CO2;
Fe(OH)2 + 2CO2;
4Fe(OH)2 + O2 + 2 h3O 4Fe(OH)3.
При кипячении воды растворенные в ней гидрокарбонаты разлагаются, и карбонатная жесткость сильно снижается, однако полного устранения карбонатной жесткости не происходит вследствие того, что карбонаты кальция и магния несколько растворим в воде.
Наряду с понятием карбонатная жесткость, используется термин устранимая жесткость. Это та величина, на которую понижается жесткость при десятиминутном кипячении воды. Жесткость, оставшаяся после кипячения воды, называется постоянной жесткостью.
Для уменьшения карбонатной жесткости применяют также метод известкования:
Ca(HCO3)2 + Ca(OH)2 2CaCO3 + 2h3O
Mg(HCO3)2 + 2Ca(OH)2 Mg(OH)2 + 2CaCO3 + 2h3O.
Некарбонатная жесткость обусловлена присутствием в воде растворимых, устойчивых к нагреванию солей кальция и магния. Чаще всего это сульфаты и хлориды.
Некарбонатную жесткость можно устранить обработкой воды карбонатом или фосфатом натрия:
MeSO4 + Na2CO3 MeCO3 + Na2SO4.
Для устранения жесткости применяют также катиониты. Это ионообменные смолы и алюмосиликаты, содержащие в своем составе подвижные катионы, например, Na+, H+, способные обмениваться на катионы среды. Если пропускать воду через слои катионита, то его подвижные катионы будут обмениваться на катионы кальция и магния, при этом катионы жесткости остаются в катионите, а подвижные ионы катионита переходят в раствор. При помощи Н+-катионирования умягчают воду с преобладанием карбонатной жесткости, а при помощи Na+-катионирования – с преобладанием некарбонатной жесткости.
Для умягчения воды можно также использовать и физические методы: электродиализ, ультразвуковую, магнитную и магнитно-ионизационную обработку воды.
Жесткость воды определяется аналитически.
Карбонатную (устранимую или временную) жесткость воды определяют титрованием воды соляной кислотой:
Са(НСО3)2 + 2НС1 = CaCI2 + 2h3O + 2СO2
Mg(HCO3)2 + 2НС1 = MgCl2 + 2Н2О + 2СО2
Точку эквивалентности можно определить либо потенциометрическим титрованием с помощью рН-метра (определение объема раствора соляной кислоты в точке скачка рН), либо титрованием в присутствии кислотно-основных индикаторов (чаще всего метилового оранжевого).
Для выбора соответствующего кислотно-основного индикатора необходимо построить интегральную кривую титрования на основании данных потенциометрического титрования, а затем выбрать такой индикатор, интервал перехода окраски которого попадает в область скачка рН на кривой титрования. В таблице 8.1 приводятся интервалы перехода окраски для некоторых индикаторов.
Таблица 8.1 – Характеристики наиболее часто применяемых кислотно-основных индикаторов
| № | Индикатор | Интервал перехода окраски, единицы рН | Изменение окраски раствора при возрастании рН |
| 1 | О-крезоловый синий | 0,2 - 1,9 | красная ® желтая |
| 2 | Тимоловый синий | 1,2 – 2,8 | красная ® желтая |
| 3 | Метиловый оранжевый | 3,1 – 4,4 | красная ® оранжевая |
| 4 | Бромкрезоловый зеленый | 3,8 – 5,4 | желтая ® синяя |
| 5 | Бромметиловый зеленый | 5,0 – 8,0 | желтая ® синяя |
| 6 | Лакмус | 6,0 –8,0 | красна ® синяя |
| 7 | Бромтимоловый синий | 6,0 – 7,6 | желтая ® синяя |
| 8 | Феноловый красный | 6,8 – 8,4 | желтая ® красная |
| 9 | Фенолфталеин | 8,2 – 10 | бесцветная ® малиновая |
| 10 | Ализариновый желтый | 10,0 – 12,0 | бледно-лимонная ® желтая |
Некарбонатную (постоянную) жесткость воды определяют методом обратного титрования. К отмеренному объему исследуемой воды добавляют определенный объем раствора карбоната натрия известной концентрации и выпаривают раствор досуха. При этом образуются нерастворимые в воде карбонаты кальция и магния.
Са2+ + Mg2+ + 2Na2CO3 = CaCO3 + MgCO3 + 2Na+
Сухой остаток, представляющий из себя смесь карбонатов кальция, магния, натрия и других солей натрия, растворяют в не содержащей СО2 воде, отфильтровывают нерастворимые в воде карбонаты кальция и магния и титриметрическим способом определяют в растворе количество избыточного Na2CO3, не вошедшего в реакцию осаждения карбонатов. Специальными опытами показано, что при этом Na2CO3 не реагирует с гидрокарбонатами кальция и магния. Именно поэтому, рассмотренный метод позволяет определять постоянную жесткость воды.
Современным методом определения общей жесткости воды является титрование воды раствором трилона Б в присутствии специальных индикаторов-хромогенов, чаще всего эриохрома черного. Титрование проводится в аммиачной среде при значении рН раствора в пределах 9-10.
Трилон Б (комплексон III) – это динатриевая соль этилендиамминтетрауксусной кислоты (NaO2CCh3)2N(Ch3)2N(Ch3CO2H)2, сокращенно – Na2h3ЭДТА.
Na2h3ЭДТА + Са2+ (или Mg2+) ® Na2CaЭДТА + 2H+.
Хромоген образует с ионами магния и другими ионами относительно непрочные комплексные соединения, окрашенные в красно-фиолетовый цвет. При титровании трилоном Б содержащиеся в воде ионы Са2+ и Mg2+, а также ионы Cu2+, Zn2+, Mn2+, Cd2+, Ni2+, Al3+, Fе2+, Fe3+ реагируют с ним и образуют мало диссоциированные бесцветные прочные комплексные соединения. В конце титрования ионы магния, кальция и другие переходят от комплексного соединения с хромогеном к трилону Б, с образованием прочных бесцветных комплексов.
Поэтому в точке эквивалентности красно-фиолетовая окраска раствора исчезает. Однако раствор не обесцвечивается, а окрашивается в сине-фиолетовый цвет – цвет самого хромогена эриохрома черного при рН = 9-10 (аммиачный буфер). Это указывает на окончание титрования.
Так как трилон Б образует прочные комплексы со всеми катионами кальция и магния вне зависимости от характера аниона, то комплексонометрическим методом определяют именно общую жесткость воды.
Проба воды должна характеризовать действительный ее состав, поэтому при отборе пробы из водопровода воду спускают в течение 10-15 минут. Когда склянка наполнится, воду некоторое время переливают через край.
Из рек и ручьев отбирают пробы воды на глубине 0,75 м в нескольких местах, около берегов и в середине реки. Отдельные пробы смешивают вместе. Анализ воды проводят сразу же после взятия пробы или, в крайнем случае, при соответствующем хранении спустя несколько часов.
8.2 Методика проведения опытов
8.2.1 Опыт №1. Определение карбонатной жесткости воды
Мерным цилиндром отбирают в две конические колбы по 100 мл исследуемой воды из-под крана. Оттитровывают воду в первой колбе 0,1н. раствором НСl. Для этого с помощью рН-метра фиксируют значения рН воды после каждого прибавления очередной порции HCl из бюретки. Объем каждой порции HCl составляет 0,5 мл.
По полученным значениям рН и объема прилитой кислоты строят интегральную и дифференциальную кривые титрования. Из кривых титрования определяют точку эквивалентности. Пользуясь данными таблицы 8.1 выбирают индикатор для экспресс-анализа. Интервал перехода окраски выбранного индикатора должен находиться в пределах скачка рН на интегральной кривой титрования.
Карбонатную жесткость воды Жкарб., выраженную в ммоль экв./л, определяют по формуле (8.1):
 , (8.1)
, (8.1)
где V(HCl) – объем раствора 0,1н. НСl, израсходованного до достижения точки эквивалентности, мл;
С(HCl) – концентрация раствора HCl, моль экв./л;
V(Н2О) – объем исследуемой воды, мл;
1000 – коэффициент пересчета от моль к ммоль.
Затем проводят титрование воды во второй колбе 0,1н. раствором НСl. Только на этот раз за ходом титрования следят визуально, по изменению окраски выбранного индикатора. Вблизи точки эквивалентности последняя капля титранта вызывает резкое изменение окраски раствора, содержащего индикатор. Фиксируют объем прибавленной кислоты к моменту достижения точки эквивалентности. Проводят расчет карбонатной жесткости воды по формуле (8.1)
8.2.2 Опыт №2. Определение общей жесткости воды
В коническую колбу отмеряют пипеткой 100 – 150 мл исследуемой воды, добавляют 5 мл аммиачного буфера и несколько кристаллов эриохрома черного до образования заметной вишнево-красной окраски. При слабой окраске раствора проверяют его рН универсальной индикаторной бумагой. Значение рН должно находиться в интервале 8-11. При необходимости корректируют рН добавлением в раствор буферной смеси.
Раствор оттитровывают стандартным раствором трилона Б до точки резкого перехода вишнево-красной окраски в синюю. Окраска раствора от избытка трилона Б остается неизменной, поэтому в конце титрования рабочий раствор трилона Б прибавляют осторожно, по каплям, энергично перемешивая.
Титрование повторить два раза и взять среднее значение объема израсходованного раствора трилона Б.
Общую жесткость воды Жобщ., выраженную в ммоль экв./л, определяют по формуле (8.2):
 , (8.2)
, (8.2)
где V1 – объем рабочего раствора трилона Б, израсходованного на титрование пробы воды, мл;
N – молярная концентрация эквивалента рабочего раствора трилона Б, моль экв./л;
V2 – объем исследуемой воды, мл;
1000 – коэффициент пересчета от моль к ммоль.
По разности значений общей и карбонатной жёсткости определить постоянную жесткость. Сделать вывод о характере и степени жесткости исследуемой воды.
8.3 Примеры решения задач
Пример 1
Рассчитайте общую жесткость воды (ммоль экв./л), если в 0,15 л воды содержится 16,2 мг гидрокарбоната кальция, 2,92 мг гидрокарбоната магния, 11,10 мг хлорида кальция и 9,50 мг хлорида магния.
Решение
Выразим общую жесткость воды как сумму миллимолярных концентраций эквивалентов двухзарядных катионов металлов (или соответствующих им солей) в воде:
 ,
,
где m1, m2, mi – массы двухзарядных катионов металлов, либо массы соответствующих им солей, либо массы веществ, пошедших на устранение жесткости воды, мг;
M1, M2, Mi – молярные массы эквивалентов двухзарядных катионовметаллов, либо массы соответствующих им солей, либо массы веществ, пошедших на устранение жесткости воды, г/моль;
V – объем воды, л.
Молярные массы эквивалентов солей, перечисленных в условии задачи, рассчитываются по формуле:
 ,
,
где z – эквивалентное число, для солей жесткости оно равно 2;
 –молярная масса соли Х.
–молярная масса соли Х.
| Формула соли | Са(HCО3)2 | Mg(HCО3)2 | СаCl2 | MgCl2 |
|
| 81 | 73 | 55.5 | 48 |
Общая жесткость данного образца воды равна сумме временной и постоянной жесткости:
 =
=
=2,56 ммоль экв./л
Пример 2
Определите временную жесткость воды, если на титрование 0,1 л воды, содержащей гидрокарбонат магния, израсходовано 7,2∙10-3л 0,14н. раствора HCl.
Решение
При титровании воды соляной кислотой происходит реакция:
Mg(HCO3)2 + 2НС1 = MgCl2 + 2Н2О + 2СО2
Временную жесткость воды рассчитаем по формуле (8.1):

 =10,08 ммоль экв./л
=10,08 ммоль экв./л
Пример 3
Для устранения общей жесткости по известково-содовому методу добавлено 7,4 г Са(ОН)2 и 5,3 г Na2CO3. Рассчитать временную и постоянную жесткость воды.
Решение
Добавление к воде Са(ОН)2 может устранить временную жесткость, а добавление Na2CO3 – постоянную жесткость. При добавлении этих реагентов к воде происходят следующие реакции:
Ca(HCO3)2 + Ca(OH)2 2CaCO3 + 2h3O
Mg(HCO3)2 + 2Ca(OH)2 Mg(OH)2 + 2CaCO3 + 2h3O.
Ca(NО3)2 + Na2CO3 = MeCO3 + 2NaNO3
Mg(NО3)2 + Na2CO3 = MeCO3 + 2NaNO3
Временную жесткость воды Жвр измеряют количеством вещества эквивалентов гидроксида кальция, участвующего в реакции, а постоянную жесткость Жпост– количеством вещества эквивалентов карбоната натрия.
M(1/2Са(ОН)2) = 74/2=37 г/моль;
M(1/2Na2CO3) = 106/2=53 г/моль;
 7400/(37∙50) = 4 ммоль экв./л;
7400/(37∙50) = 4 ммоль экв./л;
 5300/(53∙50) = 2 ммоль экв./л
5300/(53∙50) = 2 ммоль экв./л
Общая жесткость воды равна:
Жобщ = Жвр + Жпост = 4 + 2 = 6 ммоль экв./л
8.4 Требования к уровню подготовки студентов
Знать понятия: общая, временная (карбонатная) и постоянная (некарбонатная) жесткость воды.
Понимать для чего необходимо умягчение воды.
Иметь представление о методах устранения временной и постоянной жесткости.
Уметь производить расчеты жесткости воды, а также количеств реактивов, необходимых для ее устранения.
8.5 Задания для самоконтроля
При определении карбонатной жесткости воды используют индикатор метиловый оранжевый. Почему нельзя использовать фенолфталеин?
Почему при кипячении воды ее временная (устранимая) жесткость уменьшается?
Почему комплексонометрическим методом определяют только общую жесткость?
Какие соли вызывают постоянную жесткость? Почему она так называется?
Что происходит при кипячении жесткой воды с гидроксидом натрия? Почему израсходованное количество NaOH эквивалентно суммарному количеству растворенных солей некарбонатного происхождения?
Что такое обратное титрование и как его осуществляют? Какие преимущества имеет этот метод?
Какой вид жесткости воды определяют при помощи титрования раствором кислоты? Какая реакция при этом происходит?
Какая характеристика раствора изменяется при кислотно-основном титровании? Какими методами можно фиксировать точку эквивалентности?
Благодаря каким свойствам трилон Б (комплексон III) можно использовать в качестве титранта при определении общей жесткости воды?
Для чего используется аммиачный буферный раствор при определении общей жесткости?
Почему при определении общей жесткости воды прибавление кристаллов эриохрома черного вызывает покраснение раствора, а в точке эквивалентности раствор синеет?
На титрование 100 мл воды пошло 2 мл 0,1н. раствора трилона Б. Рассчитайте жесткость воды.
Вода содержит в 10 л 0,95 г хлорида магния и 1,62 г гидрокарбоната кальция. Определить карбонатную, некарбонатную (постоянную) и общую жесткость этого образца воды.
Чему равна жесткость воды, выраженная в ммоль экв./л, если концентрация СаCl2 составляет 0,005 моль/л?
Растворимость СаSO4 в воде 0,202%. Вычислите жесткость насыщенного раствора этой соли, принимая его плотность за 1,0 г/мл.
Для умягчения 100 л воды потребовалось 12,72 г Na2CO3. Чему равна жесткость образца воды в ммоль экв./л?
На титрование 0,05 л образца воды израсходовано 4,8∙10-3 л 0,1н. раствора HCl. Чему равна карбонатная жесткость воды?
Какую массу гашеной извести надо прибавить к 2,5 л воды, чтобы устранить ее временную жесткость, равную 4,43 ммоль экв./л?
При определении временной жесткости на титрование 0,1 л воды израсходовано 5,25∙10-3 л 0,101н. раствора HCl. Какова величина жесткость этой воды?
Образец воды объемом 1 литр содержит 48,6 мг гидрокарбоната кальция и 29,6 мг сульфата магния. Какое количество Са2+ и Mg2+ содержится в литре этой воды? Чему равна общая, постоянная и карбонатная жесткость воды?
Некарбонатная жесткость воды равна 3,18 ммоль экв./л. Какую массу Na3РO4надо взять, чтобы умягчить 1м3 воды?
8.6 Список рекомендуемой литературы
8.6.1 Глинка Н.Л. Общая химия: Учебное пособие для вузов/ Под ред. А.И.Ермакова. – М.: Интеграл-Пресс, 2010. – 728 с.
8.6.2 Романцева Л.М. Сборник задач и упражнений по общей химии/ Л.М.Романцева, З.Л.Лещинская, В.А.Суханова. – М.: Высш. шк., 1991. – С.146 – 149.
studfiles.net
15
82
8 Лабораторная работа №16
Жесткость воды, методы ее определения
Цель работы: познакомиться с понятием жесткости воды; овладеть методиками определения общей, временной (карбонатной) и постоянной (некарбонатной) жесткости воды методами потенциометрического и кислотно-основного титрования.
Оборудование и реактивы: 0,1н. соляная кислота; 0,1н. раствор трилона Б; индикаторы: эриохром черный кристаллический, фенолфталеин, метиловый оранжевый; аммиачный буфер; рН-метр; магнитная мешалка; бюретки; пипетки на 100 мл или мерные цилиндры; колбы на 250 мл и 500 мл; стаканы на 200 – 250 мл; мерные колбы на 200 мл; бумажные фильтры.
8.1 Теоретические пояснения
Природная вода в своем составе всегда содержит различные примеси: соли и газы, механические примеси, находящиеся во взвешенном состоянии, эмульсии, гидрозоли и другие образования. Некоторые соли, присутствующие в воде, вызывают ее жесткость.
Жесткость воды – это совокупность свойств воды, обусловленных присутствием в ней катионов Ca2+ и Mg2+, реже Fe2+.
Содержание в воде большого количества примесей растворимых солей кальция и магния делает ее непригодной для технических целей. Повышенная жесткость воды приводит к образованию накипи в паровых котлах и бытовой посуде. Это ухудшает теплообмен, а, следовательно, приводит к перерасходу топлива, электроэнергии, перегреву металлических поверхностей.
В жесткой воде ухудшается пенообразование и увеличивается расход мыла при стирке, так как часть содержащихся в нем растворимых солей жирных кислот переходит в нерастворимое состояние:
2C17h45COONa + CaSO4 = (C17h45COO)2Ca + Na2SO4.
При этом также ухудшается качество тканей вследствие осаждения на них нерастворимых кальциевых и магниевых солей высших жирных кислот.
В воде с повышенной жесткостью плохо развариваются овощи и мясо, так как катионы кальция образуют с белками нерастворимые соединения. Большая магниевая жесткость придает воде горький вкус.
Суммарное содержание Ca2+ и Mg2+ в воде называется общей жесткостью. Жесткость воды оценивается по-разному. В нашей стране ее чаще всего выражают количеством вещества эквивалентов кальция и магния (в ммоль) в одном литре воды.
Жесткость воды хозяйственно-питьевых водопроводов не должна превышать 7 ммоль экв./л. По величине жесткости воду условно подразделяют на мягкую (до 4 ммоль экв./л), средней жесткости (4 – 8 ммоль экв./л), жесткую (8 – 12 ммоль экв./л) и очень жесткую (более 12 ммоль экв./л).
Общая жесткость складывается из карбонатной (временной) и некарбонатной (постоянной). Карбонатная жесткость обусловлена присутствием в воде гидрокарбонатов кальция, магния, а иногда также и гидрокарбоната железа (II). Этот вид жесткости можно устранить кипячением:
Ca(HCO3)2 CaCO3 + h3O + CO2
CaCO3 + h3O + CO2
Mg(HCO3)2 MgCO3 + h3O + CO2;
MgCO3 + h3O + CO2;
2MgCO3 + h3O (MgOH)2CO3 + CO2
(MgOH)2CO3 + CO2
(MgOH)2CO3+h3O 2Mg(OH)2 +CO2
2Mg(OH)2 +CO2
Fe(HCO3)2 Fe(OH)2 + 2CO2;
Fe(OH)2 + 2CO2;
4Fe(OH)2 + O2 + 2 h3O 4Fe(OH)3.
При кипячении воды растворенные в ней гидрокарбонаты разлагаются, и карбонатная жесткость сильно снижается, однако полного устранения карбонатной жесткости не происходит вследствие того, что карбонаты кальция и магния несколько растворим в воде.
Наряду с понятием карбонатная жесткость, используется термин устранимая жесткость. Это та величина, на которую понижается жесткость при десятиминутном кипячении воды. Жесткость, оставшаяся после кипячения воды, называется постоянной жесткостью.
Для уменьшения карбонатной жесткости применяют также метод известкования:
Ca(HCO3)2 + Ca(OH)2 2CaCO3 + 2h3O
Mg(HCO3)2 + 2Ca(OH)2 Mg(OH)2 + 2CaCO3 + 2h3O.
Некарбонатная жесткость обусловлена присутствием в воде растворимых, устойчивых к нагреванию солей кальция и магния. Чаще всего это сульфаты и хлориды.
Некарбонатную жесткость можно устранить обработкой воды карбонатом или фосфатом натрия:
MeSO4 + Na2CO3 MeCO3 + Na2SO4.
Для устранения жесткости применяют также катиониты. Это ионообменные смолы и алюмосиликаты, содержащие в своем составе подвижные катионы, например, Na+, H+, способные обмениваться на катионы среды. Если пропускать воду через слои катионита, то его подвижные катионы будут обмениваться на катионы кальция и магния, при этом катионы жесткости остаются в катионите, а подвижные ионы катионита переходят в раствор. При помощи Н+-катионирования умягчают воду с преобладанием карбонатной жесткости, а при помощи Na+-катионирования – с преобладанием некарбонатной жесткости.
Для умягчения воды можно также использовать и физические методы: электродиализ, ультразвуковую, магнитную и магнитно-ионизационную обработку воды.
Жесткость воды определяется аналитически.
Карбонатную (устранимую или временную) жесткость воды определяют титрованием воды соляной кислотой:
Са(НСО3)2 + 2НС1 = CaCI2 + 2h3O + 2СO2
Mg(HCO3)2 + 2НС1 = MgCl2 + 2Н2О + 2СО2
Точку эквивалентности можно определить либо потенциометрическим титрованием с помощью рН-метра (определение объема раствора соляной кислоты в точке скачка рН), либо титрованием в присутствии кислотно-основных индикаторов (чаще всего метилового оранжевого).
Для выбора соответствующего кислотно-основного индикатора необходимо построить интегральную кривую титрования на основании данных потенциометрического титрования, а затем выбрать такой индикатор, интервал перехода окраски которого попадает в область скачка рН на кривой титрования. В таблице 8.1 приводятся интервалы перехода окраски для некоторых индикаторов.
Таблица 8.1 – Характеристики наиболее часто применяемых кислотно-основных индикаторов
| № | Индикатор | Интервал перехода окраски, единицы рН | Изменение окраски раствора при возрастании рН |
| 1 | О-крезоловый синий | 0,2 - 1,9 | красная ® желтая |
| 2 | Тимоловый синий | 1,2 – 2,8 | красная ® желтая |
| 3 | Метиловый оранжевый | 3,1 – 4,4 | красная ® оранжевая |
| 4 | Бромкрезоловый зеленый | 3,8 – 5,4 | желтая ® синяя |
| 5 | Бромметиловый зеленый | 5,0 – 8,0 | желтая ® синяя |
| 6 | Лакмус | 6,0 –8,0 | красна ® синяя |
| 7 | Бромтимоловый синий | 6,0 – 7,6 | желтая ® синяя |
| 8 | Феноловый красный | 6,8 – 8,4 | желтая ® красная |
| 9 | Фенолфталеин | 8,2 – 10 | бесцветная ® малиновая |
| 10 | Ализариновый желтый | 10,0 – 12,0 | бледно-лимонная ® желтая |
Некарбонатную (постоянную) жесткость воды определяют методом обратного титрования. К отмеренному объему исследуемой воды добавляют определенный объем раствора карбоната натрия известной концентрации и выпаривают раствор досуха. При этом образуются нерастворимые в воде карбонаты кальция и магния.
Са2+ + Mg2+ + 2Na2CO3 = CaCO3 + MgCO3 + 2Na+
Сухой остаток, представляющий из себя смесь карбонатов кальция, магния, натрия и других солей натрия, растворяют в не содержащей СО2 воде, отфильтровывают нерастворимые в воде карбонаты кальция и магния и титриметрическим способом определяют в растворе количество избыточного Na2CO3, не вошедшего в реакцию осаждения карбонатов. Специальными опытами показано, что при этом Na2CO3 не реагирует с гидрокарбонатами кальция и магния. Именно поэтому, рассмотренный метод позволяет определять постоянную жесткость воды.
Современным методом определения общей жесткости воды является титрование воды раствором трилона Б в присутствии специальных индикаторов-хромогенов, чаще всего эриохрома черного. Титрование проводится в аммиачной среде при значении рН раствора в пределах 9-10.
Трилон Б (комплексон III) – это динатриевая соль этилендиамминтетрауксусной кислоты (NaO2CCh3)2N(Ch3)2N(Ch3CO2H)2, сокращенно – Na2h3ЭДТА.
Na2h3ЭДТА + Са2+ (или Mg2+) ® Na2CaЭДТА + 2H+.
Хромоген образует с ионами магния и другими ионами относительно непрочные комплексные соединения, окрашенные в красно-фиолетовый цвет. При титровании трилоном Б содержащиеся в воде ионы Са2+ и Mg2+, а также ионы Cu2+, Zn2+, Mn2+, Cd2+, Ni2+, Al3+, Fе2+, Fe3+ реагируют с ним и образуют мало диссоциированные бесцветные прочные комплексные соединения. В конце титрования ионы магния, кальция и другие переходят от комплексного соединения с хромогеном к трилону Б, с образованием прочных бесцветных комплексов.
Поэтому в точке эквивалентности красно-фиолетовая окраска раствора исчезает. Однако раствор не обесцвечивается, а окрашивается в сине-фиолетовый цвет – цвет самого хромогена эриохрома черного при рН = 9-10 (аммиачный буфер). Это указывает на окончание титрования.
Так как трилон Б образует прочные комплексы со всеми катионами кальция и магния вне зависимости от характера аниона, то комплексонометрическим методом определяют именно общую жесткость воды.
Проба воды должна характеризовать действительный ее состав, поэтому при отборе пробы из водопровода воду спускают в течение 10-15 минут. Когда склянка наполнится, воду некоторое время переливают через край.
Из рек и ручьев отбирают пробы воды на глубине 0,75 м в нескольких местах, около берегов и в середине реки. Отдельные пробы смешивают вместе. Анализ воды проводят сразу же после взятия пробы или, в крайнем случае, при соответствующем хранении спустя несколько часов.
8.2 Методика проведения опытов
8.2.1 Опыт №1. Определение карбонатной жесткости воды
Мерным цилиндром отбирают в две конические колбы по 100 мл исследуемой воды из-под крана. Оттитровывают воду в первой колбе 0,1н. раствором НСl. Для этого с помощью рН-метра фиксируют значения рН воды после каждого прибавления очередной порции HCl из бюретки. Объем каждой порции HCl составляет 0,5 мл.
По полученным значениям рН и объема прилитой кислоты строят интегральную и дифференциальную кривые титрования. Из кривых титрования определяют точку эквивалентности. Пользуясь данными таблицы 8.1 выбирают индикатор для экспресс-анализа. Интервал перехода окраски выбранного индикатора должен находиться в пределах скачка рН на интегральной кривой титрования.
Карбонатную жесткость воды Жкарб., выраженную в ммоль экв./л, определяют по формуле (8.1):
 , (8.1)
, (8.1)
где V(HCl) – объем раствора 0,1н. НСl, израсходованного до достижения точки эквивалентности, мл;
С(HCl) – концентрация раствора HCl, моль экв./л;
V(Н2О) – объем исследуемой воды, мл;
1000 – коэффициент пересчета от моль к ммоль.
Затем проводят титрование воды во второй колбе 0,1н. раствором НСl. Только на этот раз за ходом титрования следят визуально, по изменению окраски выбранного индикатора. Вблизи точки эквивалентности последняя капля титранта вызывает резкое изменение окраски раствора, содержащего индикатор. Фиксируют объем прибавленной кислоты к моменту достижения точки эквивалентности. Проводят расчет карбонатной жесткости воды по формуле (8.1)
8.2.2 Опыт №2. Определение общей жесткости воды
В коническую колбу отмеряют пипеткой 100 – 150 мл исследуемой воды, добавляют 5 мл аммиачного буфера и несколько кристаллов эриохрома черного до образования заметной вишнево-красной окраски. При слабой окраске раствора проверяют его рН универсальной индикаторной бумагой. Значение рН должно находиться в интервале 8-11. При необходимости корректируют рН добавлением в раствор буферной смеси.
Раствор оттитровывают стандартным раствором трилона Б до точки резкого перехода вишнево-красной окраски в синюю. Окраска раствора от избытка трилона Б остается неизменной, поэтому в конце титрования рабочий раствор трилона Б прибавляют осторожно, по каплям, энергично перемешивая.
Титрование повторить два раза и взять среднее значение объема израсходованного раствора трилона Б.
Общую жесткость воды Жобщ., выраженную в ммоль экв./л, определяют по формуле (8.2):
 , (8.2)
, (8.2)
где V1 – объем рабочего раствора трилона Б, израсходованного на титрование пробы воды, мл;
N – молярная концентрация эквивалента рабочего раствора трилона Б, моль экв./л;
V2 – объем исследуемой воды, мл;
1000 – коэффициент пересчета от моль к ммоль.
По разности значений общей и карбонатной жёсткости определить постоянную жесткость. Сделать вывод о характере и степени жесткости исследуемой воды.
8.3 Примеры решения задач
Пример 1
Рассчитайте общую жесткость воды (ммоль экв./л), если в 0,15 л воды содержится 16,2 мг гидрокарбоната кальция, 2,92 мг гидрокарбоната магния, 11,10 мг хлорида кальция и 9,50 мг хлорида магния.
Решение
Выразим общую жесткость воды как сумму миллимолярных концентраций эквивалентов двухзарядных катионов металлов (или соответствующих им солей) в воде:
 ,
,
где m1, m2, mi – массы двухзарядных катионов металлов, либо массы соответствующих им солей, либо массы веществ, пошедших на устранение жесткости воды, мг;
M1, M2, Mi – молярные массы эквивалентов двухзарядных катионовметаллов, либо массы соответствующих им солей, либо массы веществ, пошедших на устранение жесткости воды, г/моль;
V – объем воды, л.
Молярные массы эквивалентов солей, перечисленных в условии задачи, рассчитываются по формуле:
 ,
,
где z – эквивалентное число, для солей жесткости оно равно 2;
 –молярная масса соли Х.
–молярная масса соли Х.
| Формула соли | Са(HCО3)2 | Mg(HCО3)2 | СаCl2 | MgCl2 |
|
| 81 | 73 | 55.5 | 48 |
Общая жесткость данного образца воды равна сумме временной и постоянной жесткости:
 =
=
=2,56 ммоль экв./л
Пример 2
Определите временную жесткость воды, если на титрование 0,1 л воды, содержащей гидрокарбонат магния, израсходовано 7,2∙10-3л 0,14н. раствора HCl.
Решение
При титровании воды соляной кислотой происходит реакция:
Mg(HCO3)2 + 2НС1 = MgCl2 + 2Н2О + 2СО2
Временную жесткость воды рассчитаем по формуле (8.1):

 =10,08 ммоль экв./л
=10,08 ммоль экв./л
Пример 3
Для устранения общей жесткости по известково-содовому методу добавлено 7,4 г Са(ОН)2 и 5,3 г Na2CO3. Рассчитать временную и постоянную жесткость воды.
Решение
Добавление к воде Са(ОН)2 может устранить временную жесткость, а добавление Na2CO3 – постоянную жесткость. При добавлении этих реагентов к воде происходят следующие реакции:
Ca(HCO3)2 + Ca(OH)2 2CaCO3 + 2h3O
Mg(HCO3)2 + 2Ca(OH)2 Mg(OH)2 + 2CaCO3 + 2h3O.
Ca(NО3)2 + Na2CO3 = MeCO3 + 2NaNO3
Mg(NО3)2 + Na2CO3 = MeCO3 + 2NaNO3
Временную жесткость воды Жвр измеряют количеством вещества эквивалентов гидроксида кальция, участвующего в реакции, а постоянную жесткость Жпост– количеством вещества эквивалентов карбоната натрия.
M(1/2Са(ОН)2) = 74/2=37 г/моль;
M(1/2Na2CO3) = 106/2=53 г/моль;
 7400/(37∙50) = 4 ммоль экв./л;
7400/(37∙50) = 4 ммоль экв./л;
 5300/(53∙50) = 2 ммоль экв./л
5300/(53∙50) = 2 ммоль экв./л
Общая жесткость воды равна:
Жобщ = Жвр + Жпост = 4 + 2 = 6 ммоль экв./л
8.4 Требования к уровню подготовки студентов
Знать понятия: общая, временная (карбонатная) и постоянная (некарбонатная) жесткость воды.
Понимать для чего необходимо умягчение воды.
Иметь представление о методах устранения временной и постоянной жесткости.
Уметь производить расчеты жесткости воды, а также количеств реактивов, необходимых для ее устранения.
8.5 Задания для самоконтроля
При определении карбонатной жесткости воды используют индикатор метиловый оранжевый. Почему нельзя использовать фенолфталеин?
Почему при кипячении воды ее временная (устранимая) жесткость уменьшается?
Почему комплексонометрическим методом определяют только общую жесткость?
Какие соли вызывают постоянную жесткость? Почему она так называется?
Что происходит при кипячении жесткой воды с гидроксидом натрия? Почему израсходованное количество NaOH эквивалентно суммарному количеству растворенных солей некарбонатного происхождения?
Что такое обратное титрование и как его осуществляют? Какие преимущества имеет этот метод?
Какой вид жесткости воды определяют при помощи титрования раствором кислоты? Какая реакция при этом происходит?
Какая характеристика раствора изменяется при кислотно-основном титровании? Какими методами можно фиксировать точку эквивалентности?
Благодаря каким свойствам трилон Б (комплексон III) можно использовать в качестве титранта при определении общей жесткости воды?
Для чего используется аммиачный буферный раствор при определении общей жесткости?
Почему при определении общей жесткости воды прибавление кристаллов эриохрома черного вызывает покраснение раствора, а в точке эквивалентности раствор синеет?
На титрование 100 мл воды пошло 2 мл 0,1н. раствора трилона Б. Рассчитайте жесткость воды.
Вода содержит в 10 л 0,95 г хлорида магния и 1,62 г гидрокарбоната кальция. Определить карбонатную, некарбонатную (постоянную) и общую жесткость этого образца воды.
Чему равна жесткость воды, выраженная в ммоль экв./л, если концентрация СаCl2 составляет 0,005 моль/л?
Растворимость СаSO4 в воде 0,202%. Вычислите жесткость насыщенного раствора этой соли, принимая его плотность за 1,0 г/мл.
Для умягчения 100 л воды потребовалось 12,72 г Na2CO3. Чему равна жесткость образца воды в ммоль экв./л?
На титрование 0,05 л образца воды израсходовано 4,8∙10-3 л 0,1н. раствора HCl. Чему равна карбонатная жесткость воды?
Какую массу гашеной извести надо прибавить к 2,5 л воды, чтобы устранить ее временную жесткость, равную 4,43 ммоль экв./л?
При определении временной жесткости на титрование 0,1 л воды израсходовано 5,25∙10-3 л 0,101н. раствора HCl. Какова величина жесткость этой воды?
Образец воды объемом 1 литр содержит 48,6 мг гидрокарбоната кальция и 29,6 мг сульфата магния. Какое количество Са2+ и Mg2+ содержится в литре этой воды? Чему равна общая, постоянная и карбонатная жесткость воды?
Некарбонатная жесткость воды равна 3,18 ммоль экв./л. Какую массу Na3РO4надо взять, чтобы умягчить 1м3 воды?
8.6 Список рекомендуемой литературы
8.6.1 Глинка Н.Л. Общая химия: Учебное пособие для вузов/ Под ред. А.И.Ермакова. – М.: Интеграл-Пресс, 2010. – 728 с.
8.6.2 Романцева Л.М. Сборник задач и упражнений по общей химии/ Л.М.Романцева, З.Л.Лещинская, В.А.Суханова. – М.: Высш. шк., 1991. – С.146 – 149.
studfiles.net
Определение жесткости воды
Под жесткостью воды понимают общее количество содержащихся в ней солей кальция и магния. Различают жесткость воды общую, устранимую и постоянную.
Общаяжесткость представляет сумму солей кальция и магния в сырой воде (сумма устранимой и постоянной жесткости).
Устранимаяжесткость представляет сумму бикарбонатных и карбонатных солей кальция и магния, выпадающих в осадок после 1-часового кипячения.
Постояннаяжесткость представляет сумму сульфатных азотисто-азотнокислых и хлористых солей Са иMg, остающихся в воде после 1-часового кипячения.
Жесткость воды выражается в градусах: 1° жесткости соответствует 10 мг СаО на 1 л воды. Мягкая вода имеет жесткость до 10°, умеренно жесткая от 10 до 20°, жесткая – свыше 20°. По инструкции не допускается для хозяйственно-питьевого водоснабжения вода с общей жесткостью свыше 40°.
Определение общего количества солей кальция и магния в воде делается с помощью реактивов трилона и хромогена черного.
Приборы:
бюретка
пипетка
колбочки.
Реактивы:
0,1 Nраствор трилона Б (двунатриевая соль этилендиэминотетрауксусной кислоты) – 18,613 г на 1 л дистиллированной воды.
Щелочная смесь – аммиачный буферный раствор (100 мл 20% раствора хлористого аммония и 100 мл 20% раствора аммиака, доведенного до 1 л дистиллированной воды).
0,01 Nсмешанный раствор хлористого кальция и сернокислого магния (75 мл 0,1 N раствораCaCl2и 25 мл 0,1 N раствораMgSO4, доведенные до 1 л дистиллированной водой).
Индикатор – хромоген черный (0,5 г хромогена черного ЕТ–00 растворяется в 10 мл щелочной смеси и доводится до 100 мл этиловым спиртом).
Установление титра трилона.
В колбочку наливается 50 мл смешанного раствора и 5 мл буферного раствора. К смеси добавляется 5-7 капель хромогена черного. Жидкость титруется 0,1 Nраствором трилона до перехода винно-красного цвета в голубой. Расчет делается по формуле:
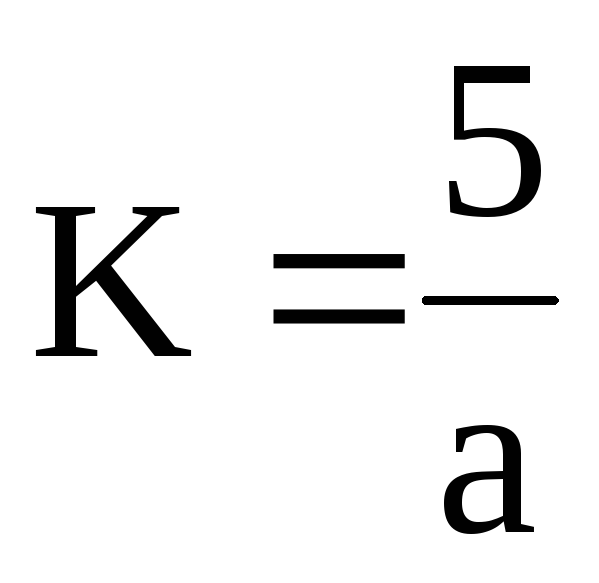 ,
,
где: К – коэффициент децинормальности трилона Б;
а – количество трилона Б, пошедшее на титрование;
5 – уменьшение в 10 раз взятой смеси.
Определение общей жесткости воды
К 50 мл исследуемой воды добавляется 5 мл щелочной смеси и 8 капель индикатора. Жидкость титруют 0,1 N раствором трилона Б до перехода цвета винно-красного в голубой.
Жесткость воды в миллиграмм-эквивалентах в 1 л рассчитывается по формуле:
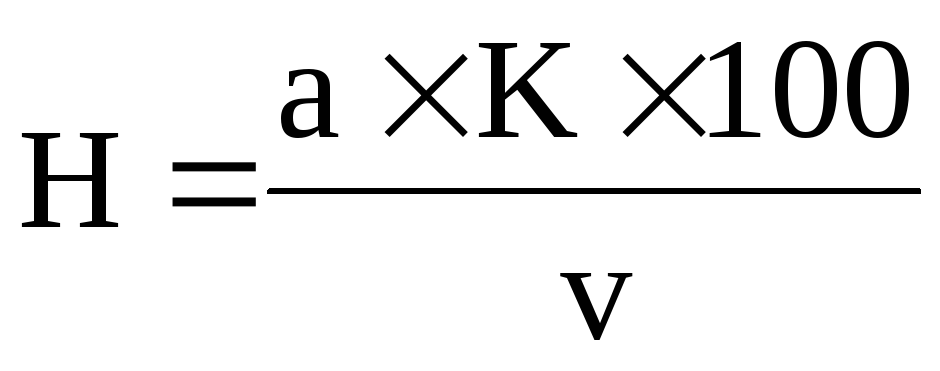 ,
,
где: Н – искомая жесткость в мгэкв/л;
а – количество мл 0,1 N раствора трилона Б;
К – коэффициент децинормальности трилона Б;
v– количество мл взятой для анализа воды.
Для перевода жесткости воды из мгэкв/л в градусы нужно полученное количество мгэкв/л умножить на 2,8. Один мгэкв/л соответствует 2,8°.
Определение устранимой жесткости
Приборы и реактивы:
Колбочки.
Пипетка.
Бюретка.
0.1 N раствор НCl.
0.1 N раствор метилоранжа- индикатор.
Ход анализа:
К 100 мл исследуемой воды добавляется 2-3 капли индикатора. Жидкость титруют 0,1 N раствором НС1 до первого изменения окраски (золотистый цвет переходит в розовый). Жесткость в 1 л исследуемой воды вычисляется по формуле:
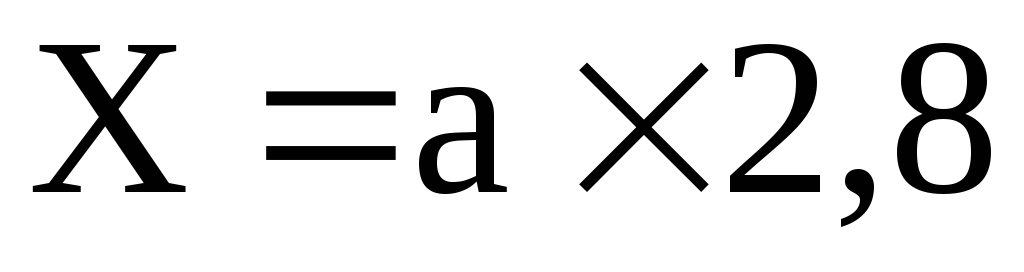 ,
,
где: Х – искомая устранимая жесткость в градусах;
а – количество мл в 0,1 Nраствора НС1, пошедшее на титрование;
2,8 – количество мг СаО, соответствующее 1 мл 0,1 Nраствора НС1.
studfiles.net
Определение жесткости воды
Жесткость воды измеряется градусами. Градусы различают немецкие, французские и английские.
В СССР все расчеты жесткости почти всегда ведутся по СаО.
В настоящий момент существует несколько методов определения жесткости воды.
Способ Варта-Пфейфера является несложным, по требует внимательного отношения при титровании, так как при вычислении результатов может получиться, что устранимая жесткость на несколько градусов больше общей. Этот способ рекомендуется для исследования вод на жесткость в условиях сельского хозяйства, где они почти всегда достаточно минерализованы и кроме карбонатных, содержат иногда значительное количество сернокислых, хлористых или азотнокислых солей.
Принцип определения жесткости воды по Варта-Пфейферу состоит в титровании определенного объема исследуемой воды с индикатором метилоранж (или метилрот) 0,1 N раствором соляной кислоты до нейтрализации бикарбонатов воды. По количеству израсходованной соляной кислоты вычисляют устранимую жесткость, зависящую от присутствия щелочно реагирующих бикарбонатов Са и Mg.
Общая жесткость узнается после определения устранимой, для чего к той же порции воды доливают определенный объем щелочной смеси Пфейфера (состоящей из равных частей 0,1 и раствора NaOH и 0,1 N раствора Na2CO3). Далее воду кипятят, охлаждают, разбавляют дестиллированной водой и отфильтровывают, после чего титруют 0,1 N раствором соляной кислоты, с добавлением того же индикатора, до слаборозового окрашивания. По разности между количеством смеси Пфейфера, прилитой к воде, и числом кубических сантиметров НСl, израсходованной на титрование,, определяют общую жесткость воды. Эта разность указывает, какое количество смеси Пфейфера пошло на соединение с солями Са и Mg. Постоянная жесткость получается вычитанием из общей устранимой жесткости.
Что касается нормативов но жесткости воды, то таковые всецело зависят от многих обстоятельств, вследствие чего многими авторами даются самые разноречивые нормы. Некоторые районы СССР имеют воду свыше 100° жесткости (исследование Онисимова), и эта вода является зачастую единственным источником водопоя. Во всяком случае, общее состояние доброкачественности воды и привыкание к жестким водам повышает иногда средние нормы допустимой жесткости питьевой воды.
Приведенные ниже данные являются придержкой для практической оценки вод по жесткости и не являются большим расхождением со многими авторитетными данными: 1) вода до немецких 10°— мягкая, 2) от 10 до 20° — среднежесткая, 3) свыше 20° — жесткая.
Жесткость воды говорит о присутствии Са и Mg в различных соединениях, поэтому если устанавливается, что жесткость не является результатом органического загрязнения, то отдельное исследование (кроме жесткости) на присутствие Са и Mg обычно редко, производится. Желательно, чтобы количество Mg было меньше Са: примерно на 1 л воды Са не больше 15 мг, a Mg небольше 4 мг.
В питьевой воде может содержаться небольшое количество железа в виде двууглекислых солей. Эти воды при стоянии на воздухе мутнеют под воздействием кислорода воздуха, так как двууглекислые соли железа разлагаются, углекислота улетучивается и из воды выпадает гидрат окиси железа, который оседает на дно водоема (посуды) в форме рыхлых хлопьев.
При содержании железа более 0,5 мг на 1 л вода принимает терпкий вкус. Питьевая же вода с содержанием более 1,5 мг Fe на 1 л всегда требует очищения от последнего или не применяется для питья.
Когда вода содержит много железа, то она после подкисления соляной кислотой с 10% раствором роданистого калия или аммония дает красное окрашивание вследствие образования роданистого железа. Количество железа определяется колориметрическим методом тем же роданистым аммонием, что и при качественной реакции. Раствор железных квасцов (1 см3 содержит 0,1 мг Fе) наливается последовательно по 0,5, 1, 1,6, 2, 2,6 см3 и т. д. в цилиндры, а затем подкисляют НСl и добавляют по нескольку капель роданистого аммония. В пробу воды добавляют также все реактивы, кроме квасцов. По совпадению ее цвета с определенным цилиндром вычисляют наличие Fe на литр.
Если вы нашли ошибку, пожалуйста, выделите фрагмент текста и нажмите Ctrl+Enter.
www.activestudy.info
3. Определение жесткости воды
Под жесткостью понимают свойство воды, обусловленное присутствием в ней солей кальция и магния. Выражается жесткость в мг-экв/л. Различают следующие виды жесткости: общая, устранимая (временная), неустранимая (постоянная), карбонатная и некарбонатная.
Природные воды по общей жесткости О.А. Алекин подразделяет на следующие группы:
| Группы | Жесткость, мг-экв/л |
| Очень мягкая Мягкая Умеренно жесткая Жесткая Очень жесткая | до 1,5 1 – 3 3 – 6 6 – 9 > 9 |
Устранимая (временная) и карбонатная жесткости обусловлены одними и теми же гидрокарбонатными и карбонатными солями кальция и магния. Устранимая жесткость – величина экспериментальная. Она показывает, на сколько уменьшается общая жесткость воды после кипячения. Карбонатная жесткость – величина расчетная, численно равна количеству миллиграмм-эквивалентов гидрокарбонатных и карбонатных ионов, содержащихся в воде. Если это количество больше, чем общая жесткость, карбонатную жесткость считают равной общей жесткости.
Неустранимая жесткость обусловлена хлоридами, сульфатами и другими некарбонатными солями кальция и магния. Определяется по разности между общей и карбонатной жесткостью.
Пример. Вычислить все виды жесткости по данным табл. 3.
1
(4)
. Общая жесткость: 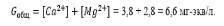
По степени жесткости (по классификации О.А. Алекина) вода относится к жесткой.
2. Карбонатная жесткость равна 4,7 мг-экв/л.
3. Некарбонатная жесткость равна 6,6 – 4,7 = 1,9 мг-экв/л.
4. Агрессивность воды
Подземные воды обладают в той или иной степени свойством агрессивности по отношению к бетону, железобетону и металлам. Агрессивность вод обусловлена присутствием ионов водорода, свободной углекислоты, сульфатов и магния. Различают следующие виды агрессивности: агрессивность выщелачивания, общекислотная, углекислая, сульфатная.
Агрессивность выщелачивания определяется по величине карбонатной жесткости воды. Вода считается агрессивной по отношению к бетону при карбонатной жесткости свыше 0,54–2,14 мг-экв/л в зависимости от типа цемента в составе бетона.
Агрессивность общекислотная определяется по количеству водородных ионов (по рН). Вода считается агрессивной для всех видов цементов в пластах высокой проводимости: а) при рН < 7 и карбонатной жесткости меньше 8,6 мг-экв/л; б) при рН < 6,7 и карбонатной жесткости больше 8,6 мг-экв/л. Для слабопроницаемых пластов вода считается агрессивной при рН ≤ 5.
Углекислая агрессивность устанавливается в воде по содержанию свободной углекислоты. Для большинства цементов в пластах высокой водопроводимости воды считаются агрессивными, если выражение  , будет больше содержания свободной углекислоты, гдеa и b – коэффициенты, определяемые в зависимости от величины карбонатной жесткости и количества ионов Cl- и SO42- в мг/л. Значения коэффициентов приведены в таблице 6.
, будет больше содержания свободной углекислоты, гдеa и b – коэффициенты, определяемые в зависимости от величины карбонатной жесткости и количества ионов Cl- и SO42- в мг/л. Значения коэффициентов приведены в таблице 6.
Таблица 6
Значения коэффициентов a и b для определения углекислой агрессивности воды
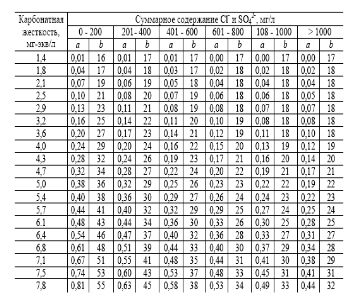
Агрессивность сульфатная оценивается по содержанию в воде ионов SO42- и Cl-, мг/л. В породах высокой водопроводимости для бетона на портландцементе вода считается агрессивной при следующих содержаниях SO42- и Cl-, мг/л:
| Cl- 0–3000 3001–5000 > 5000 | SO42- 250–500 501–1000 > 1000 |
В породах слабой проводимости вода считается агрессивной при содержании иона SО42- до 1000 мг/л, для бетонов на пуццолановом, шлаковом и песчано-пуццолановом портландцементе – при содержании иона Сl- - 400 мг/л независимо от содержания иона SО42-.
studfiles.net
Определение общей жесткости воды - Кустарь
Определение общей жесткости воды проводят несколькими методами: комплексометрический, как наиболее быстрый и удобный, спирто-мыльный, олеатный или пальмитатный методы.
Комплексометрический метод определения общей жесткости воды
Определение общей жесткости воды комплексометрическим методом проводят путем титрования пробы исследуемой воды раствором трилона Б — двунатриевой соли этилендиаминотетрауксусной кислоты, связывающей в слабощелочной среде катионы кальция и магния в комплексные соединения:

При этом в комплекс сначала связываются катионы кальция, а затем уже катионы магния.
Титрование проводят в присутствии хромовых красителей как индикаторов, из которых обычно применяют хромовый черный специальный (кислотный хром черный специальный, хромоген черный ЕТ-00) или хромовый темно-синий (кислотный хром темно-синий). Эти индикаторы образуют с катионами кальция и магния комплексные соли, придающие раствору окраску, резко отличающуюся (особенно у комплексов магния) от окраски в присутствии обычных солей этих индикаторов. Устойчивость комплексов катионов жесткости с индикаторами меньше, чем с трилоном Б. Эти индикаторы обладают также свойствами кислотно-основных индикаторов, изменяя окраску растворов в зависимости от pH среды, а поэтому титрование трилоном Б ведут при значении pH = 9-10, обеспечивая это введением аммиачного или боратного буферных растворов.
Индикаторы хром черный или хром темно-синий, введенные в исследуемую воду перед титрованием, образуют с катионами жесткости комплексные соединения, окрашивающие соответственно раствор в винно-красный или в розовато-красный цвет. Трилон Б в конце титрования извлекает катионы жесткости из их соединений с индикаторами, и раствор приобретает голубой или синевато-сиреневый цвет.
Концентрация катионов жесткости в исследуемой пробе должна быть до 5 мг-экв/л, что обеспечит хорошо заметный переход окраски. Воду, имеющую более высокую жесткость, разбавляют дистиллированной водой.
Для титрования воды с жесткостью больше 20 мг-экв/л можно применять 0,1 н. растворы трилона Б: для воды с жесткостью 0,5—20 мг-экв/л применяют 0,05 н. растворы, а для воды с жесткостью меньше 0,5 мг-экв/л — 0,01 н. растворы трилона Б. При анализе воды с жесткостью до 0,5 г-экв/л в качестве индикатора используют хром темно-синий, переход окраски у которого в этих условиях более заметен, чем у хром черного.
Комплексометрический метод применяют для анализа воды с жесткостью более 0,015 мг-экв/л, ошибка в анализе по этому методу обычно не превышает 1%. Определению жесткости комплексометрическим методом может мешать присутствие в воде катионов железа, алюминия, марганца, меди, цинка, а также высокое содержание гидрокарбонат- и карбонат-ионов.
Ионы железа, которые чаще других ионов, мешающих определению катионов жесткости, могут присутствовать в воде, при концентрациях выше 1 мг/л придают индикатору грязно-серый цвет и снижают четкость перехода его окраски. Для устранения влияния ионов железа и алюминия следует разбавлять испытуемую пробу дистиллированной водой, что снижает концентрацию этих ионов.
Подобное влияние небольших количеств катионов марганца может быть устранено добавлением к пробе раствора гидроксиламина. При большом содержании железа и марганца их выделяют из воды окислением и осаждением в щелочной среде.
Влияние катионов меди и цинка можно исключить, вводя в исследуемую пробу воды перед титрованием небольшое количество раствора сульфида натрия, вызывающего осаждение меди и цинка в виде сульфидов.
Чтобы устранить влияние карбонат- и гидрокарбонат-ионов, которые в щелочной среде вызывают образование малорастворимых карбонатов кальция и магния, медленно реагирующих с трилоном Б, пробу воды предварительно нейтрализуют соляной кислотой для разложения карбонатов, а затем кипятят 5 минут для удаления углекислого газа.
При анализе применяют следующие реактивы:
трилон Б, 0,05 н. или 0,01 н. раствор;
аммиачный буферный раствор, приготовляемый смешиванием 100 мл 20%-ного раствора хлорида аммония со 100 мл 20%-ного раствора аммиака и доведением объема смеси до 1 л, или борат-ный буферный раствор, приготовляемый смешиванием 800 мл 5%-ного раствора буры со 100 мл 10%-ного раствора едкого натра с доведением объема смеси до 1 л дистиллированной водой;
кислотный хром темно-синий или кислотный хром черный специальный, 0,5%-ные аммиачно-спиртовые растворы или 0,5%-ные сухие смеси с хлоридом натрия или нитратом калия;
дистиллированную воду.
При отсутствии ионов, мешающих анализу, объем воды, взятый для этого определения, должен быть не менее 500 мл. Если анализ на определение общей жесткости будет проведен позднее чем через 2 ч, то воду следует подкислить 0,1 н. раствором соляной кислоты до слабокислой реакции по лакмусовой бумажке. Мутную воду предварительно отстаивают в течение 2 ч, переливают в чистую склянку, а затем подкисляют.
В коническую колбу емкостью 250 мл пипеткой отбирают при температуре не ниже 15°С определенный объем исследуемой воды, в котором суммарное содержание катионов кальция и магния не превышает 0,5 мг-экв.
Рекомендуемые объемы пробы воды
Жесткость воды, мг-экв/л | Объем пробы воды, мл |
До 5 | 100 |
5 — 10 | 50 |
10 — 20 | 25 |
Свыше 20 | 15 |
Затем, если нужно, добавляют дистиллированную воду до общего объема 100 мл, вносят 5 мл аммиачного буферного раствора (при жесткости воды ниже 0,5 мг-экв/л можно вместо аммиачного внести 1 мл боратного буферного раствора), вводят 5—6 капель раствора индикатора или 0,1 г сухой смеси индикатора с солью и медленно титруют 0,05 н. раствором трилона Б при интенсивном перемешивании до перехода винно-красной окраски раствора в голубовато-синюю.
www.sdelaysam.info
Определение жесткости воды комплексонометрическим методом
Определение жесткости воды комплексонометрическим методом
Содержание
Введение
1. Технологическая часть
1.1 Вода в промышленности
1.. Показатели качества воды. Водоподготовка
1.3 Жесткость воды
1.4 Методы определения жесткости
1.4.1 Обзор возможных методов
1.4.2 Обоснование комплексонометрического метода
1.5 Теоретические основы комплексонометрического метода
1.6 Методика определения жесткости воды комплексонометрическим методом
1.6.1 Сущность метода
1.6.2 Отбор проб
1.6.3 Реактивы и оборудование
1.6.4 Выполнение определения
1.6.5 Обработка результатов
1.7 Экспериментальные данные
2. Экономическая часть
3. Охрана труда и техника безопасности
Заключение
Литература
ВВЕДЕНИЕ
В природных водах находится очень большое количество различных химических соединений. В процессе естественного кругооборота природные воды, находясь в контакте с воздухом и породами земной коры, обогащаются содержащимися в них веществами. Кроме того, в такие воды попадают продукты жизнедеятельности животных и растений. В ряде водоисточников вода дополнительно загрязняется отходами производственной деятельности людей. Непосредственное использование природных вод для промышленных и бытовых нужд является в большинстве случаев неприемлемым. Предъявляемые в промышленности требования к качеству потребляемой воды определяются специфическими условиями тех или иных технологических процессов. Так, например, многие производства (текстильное, кожевенное) не могут использовать жесткую воду, т.е. содержащую соли кальция и магния. Название жесткость воды возникло вследствии того, что промывание тканей в воде с высокой концентрацией ионов Ca и Mg делает волокна ломкими, неэластичными, словно жесткими. Это обусловлено образованием на волокнах кальциевых и магниевых солей жирных кислот, входящих в состав мыла, а также углекислых солей.
Особенно высокие требования к потребляемой воде предъявляет теплоэнергетическое производство.
Присутствие в воде значительного количества солей жесткости, делает воду непригодной для многих технических целей. При продолжительном питании паровых котлов жесткой водой их стенки постепенно покрываются плотной коркой накипи. Такая корка может служить причиной образования вздутий и трещин, как в кипятильных трубах, так и на стенках самого котла.
Поэтому химический контроль ионов Са2+ и Mg2+ очень важен для ведения водно-химического режима работы теплоэнергетического оборудования.
1. Технологическая часть
1.1 Вода в промышленности
Вода обладает универсальными свойствами, благодаря чему применяется в качестве сырья, химического реагента, растворителя, тепло - и хладоносителя, в некоторых случаях как катализатор. Например, из воды получают водород, применяемый в производстве спиртов, анилина, моющих средств и т.п. Вода служит реагентом для получения кислот, щелочей и оснований, различных органических продуктов – спиртов, уксусного альдегида, фенола, в реакциях гидратации и гидролиза. Воду применяют в качестве растворителя твердых, жидких и газообразных веществ. Как теплоноситель и хладоагент вода используется для проведения экзо - и эндотермических процессов. Горячая вода и водяной пар имеют значительные преимущества перед другими теплоносителями: высокую теплоемкость и термическую стойкость, простоту регулирования температуры в зависимости от давления и пр.
В целях экономии воды применяют так называемую оборотную воду, т.е. многократно использованную и возвращенную в производственный цикл. Для экономии воды как тепло- и хладоносителя ее заменяют воздухом.
Природные воды подразделяют на атмосферные, поверхностные и подземные.
Атмосферная вода – дождевые и снеговые осадки – характеризуется небольшим содержанием примесей в виде растворенных газов. В этой воде почти полностью отсутствуют растворенные соли.
Поверхностные воды – реки, озера и моря – отличаются разнообразным составом примесей, содержат газы, соли, основания, кислоты. Наибольшее содержание минеральных примесей в морской воде (солесодержание более 10 г/кг).
Подземные воды – колодезные, ключевые, артезианские – характеризуются различным составом растворенных солей, который зависит от состава и (коагуляции) отдельных частиц и образованию осадка.
Умягчение и обессоливание воды – это основные процессы водоподготовки, которые состоят в удалении солей кальция, магния и других металлов. Различают физические, физико-химические и химические способы умягчения воды.
Физические способы – термический (кипячение), дистилляция и вымораживание. Термическим способом удаляют соли временной жесткости. Дистиллированную воду, не содержащую солей, получают перегонкой на специальных дистилляционных установках. Она необходима для приготовления химически чистых реактивов, лекарственных препаратов, в лабораторной практике и т.п. Вымораживание основано на различии температур кристаллизации воды и примеси.
Физико-химические способы – электрохимические, основанные на применении электродиализа, электроосмоса, электрокоагуляции, и ионитовые (ионообменные), получившие широкое распространение.
Ионообменные способы основаны на удалении из воды ионов кальция и магния при помощи ионитов (труднорастворимых твердых веществ), способных обменивать свои ионы на ионы, содержащиеся в воде. Различают процессы катионного и анионного обмена, соответственно иониты называют катионитами и анионитами.
В основе катионного процесса умягчения лежат реакции обмена ионов натрия и водорода катионитов на ионы Са2+ и Mg2+ . Обмен ионов натрия называется Nа-катионированием, а ионов водорода – Н-катионированием:
2Na+ + Са(НСО3 )2→← Са2+ + 2NаНСО3
2Nа+ + MgSO4 →← Mg2+ + Nа2 SО4
2Н+ + MgCl2→← Mg2+ + 2HCl
H+ + NaCl→← Na+ + HCl
Приведенные реакции показывают, что ионообменным способом достигается полное обессоливание воды (умягчение и обессоливание).
Реакции ионообмена обратимы, и для восстановления обменной способности ионитов проводят процесс регенерации. При помощи растворов поваренной соли осуществляют регенерацию Nа – катионитов, при помощи минеральных кислот – Н-катионитов.
Са2+ + 2NaCl→← 2Na+ + СаCl2
Na+ + HCl→← H+ + NaCl
Примером анионного обмена может служить реакция обмена анионов ОН— по уравнению:
ОН¯ + HCl→← Cl¯ + Н2 О
Регенерацию анионита проводят при помощи растворов щелочей:
Cl¯ + NaОН →← ОН¯ + NaCl
Из электрохимических способов значительный интерес представляет электрокоагуляция. Сущность ее состоит в получении электрохимическим путем гидроксида алюминия, обладающего высокой сорбционной способностью по отношению к вредным примесям. Процесс осуществляют в электролизерах. К достоинствам способа электрокоагуляции относят: высокую сорбционную способность электрохимического Аl(ОН)3 , возможность механизации и автоматизации процесса, малые габариты очистных сооружений.
Химический способ умягчения воды заключается в обработке ее растворами некоторых химических соединений с целью связывания ионов Са2+ , Mg2+ и других в нерастворимые и легко удаляемые соединения.
Дегазация– это удаление из воды растворенных газов СО2 , О2 . Газы, содержащиеся в воде, представляют опасность из-за образования воздушных пробок, которые могут привести к нарушению технологического процесса. Растворенные газы могут вызывать коррозию аппаратов и трубопроводов. Дегазацию проводят химическим и физическим способами. Например, для удаления СО2 воду пропускают через фильтр, заполненный гашеной известью, или добавляют к воде известковое молоко: СО2 + Са(ОН)2 = СаСО3 ↓ + Н2 О. Для удаления О2 применяют фильтр, заполненный железными опилками, стружками.
Физические способы дегазации сводят к частичному удалению газов из воды при ее нагревании паром или нагревании воды в вакууме.
Обеззараживание воды, используемых для бытовых нужд, производят с целью уничтожения болезнетворных бактерий и окисления органических примесей.
Обеззараживание осуществляют хлорированием (газообразным хлором), а также хлорной известью и гипохлоритом кальция.
1.3 Жесткость воды
Ввиду широкой распространенности кальция, соли его почти всегда содержатся в природной воде. Из природных солей кальция только гипс несколько растворим в воде, однако, если вода содержит диоксид углерода, то карбонат кальция тоже может переходить в раствор в виде гидрокарбоната Са(НСО3 )2 .
Природная вода, содержащая в растворе большое количество солей кальция и магния, называется жесткой водой в противоположность мягкой воде, содержащей мало солей кальция и магния или совсем не содержащей их.
Суммарное содержание этих солей в воде называется ее общей жесткостью. Она подразделяется на карбонатную и некарбонатнуюжесткость. Первая из них обусловлена присутствием гидрокарбонатов кальция и магния, вторая – присутствием солей сильных кислот – сульфатов или хлоридов кальция и магния. При длительном кипячении воды, обладающей карбонатной жесткостью, в ней появляется осадок, состоящий главным образом из СаСО3 , и одновременно выделяется СО2 . Оба эти вещества появляются вследствие разложения гидрокарбоната кальция:
Са(НСО3 )2 = СаСО3 ↓ + СО2 ↑ + Н2 О
Поэтому карбонатную жесткость называют также временной жесткостью. Количественно временную жесткость характеризуют содержанием гидрокарбонатов, удаляющихся из воды при ее кипячении в течение часа. Жесткость, остающаяся после такого кипячения, называется постоянной жесткостью.
mirznanii.com

 , г/моль
, г/моль , г/моль
, г/моль


















