Содержание
НАБОР № 11 Экспресс-определение жесткости воды
КупитьЗадать вопрос
Сущность метода состоит в образовании при определенном значении рН прочного комплекса соединения трилона Б с ионами кальция и магния, сопровождающегося изменением окраски соответствующего индикатора.
Сущность метода состоит в образовании при определенном значении рН прочного комплекса соединения трилона Б с ионами кальция и магния, сопровождающегося изменением окраски соответствующего индикатора.
Нижний порог определения — 1 мг-экв./л.
Точность определения («шаг» набора) при указанном в описании объеме анализируемой воды — 1 мг-экв./л. (Для более точного определения величины жесткости можно использовать больший объем анализируемой пробы.)
Комплектация рассчитана на проведение 100 определений.
Состав набора
Буферно-индикаторная смесь. Общее количество 25 г.
Трилон Б, раствор концентрации точно 0,714 г-экв./л. Общий объем 25 мл.
Маскирующие агенты № 1 и № 2 для определения жесткости в присутствии ионов марганца, меди и цинка.
Ампула для титрования с отметкой на 25 мл.
Стандартная пипетка для раствора трилона Б.
Шпатели для маскирующих агентов
Ложечка для буферно-индикаторной смеси.
Необходимые для проведения анализа приборы и материалы:
Для проведения анализа дополнительного оборудования не требуется.
Подготовка к проведению анализа.
1. Кислые воды необходимо предварительно нейтрализовать раствором щелочи по индикатору метиловому оранжевому до рН около 7 по индикаторной бумаге.
2. Метод не пригоден для определения жесткости воды после известкования. При определении общей жесткости воды после известкования необходимо предварительно разрушить карбонат кальция. Для этого к пробе прибавляют небольшой количество соляной кислоты и кипятят ее до растворения осадка. Затем избыток кислоты нейтрализуют щелочью до рН около 7 по индикаторной бумаге и проводят определение как описано выше.
Для этого к пробе прибавляют небольшой количество соляной кислоты и кипятят ее до растворения осадка. Затем избыток кислоты нейтрализуют щелочью до рН около 7 по индикаторной бумаге и проводят определение как описано выше.
3. Воду, загрязненную нефтепродуктами, следует титровать при нагревании.
4. Холодную воду (с температурой ниже 100С) перед проведением анализа следует подогреть.
Проведение анализа.
В ампулу для титрования помещают 25 см3 анализируемой воды (до метки), добавляют ½ ложечки буферно-индикаторной смеси и перемешивают. Раствор приобретает малиново-фиолетовый цвет.
В пипетку набирают раствор трилона Б из упаковки №2 и аккуратно, по каплям дозируют в анализируемую воду с добавленной буферно-индикаторной смесью, перемешивая раствор после прибавления каждой капли и внимательно следя за изменением окраски раствора. Конечной считается точка, в которой раствор приобретает чистый синий цвет, не изменяющийся при добавлении следующей капли раствора трилона Б.
Жесткость анализируемой воды в мг-экв./л Ж = N,
где N — количество капель раствора трилона Б, пошедших на титрование.
После проведения анализа мерную ампулу и пипетку желательно промыть дистиллированной водой.
Определение жесткости воды в присутствии катионов меди, цинка и марганца
Присутствие в пробе ионов меди устанавливается по отсутствию отчетливой точки перехода цвета раствора.
Для установления присутствия в воде меди проводят параллельное титрование пробы воды в присутствии нескольких кристалликов маскирующего агента № 2. Нормальный индикаторный переход свидетельствует о наличии в пробе ионов меди. Результат титрования в присутствии маскирующего агента № 2 дает величину общей жесткости воды.
Присутствие в пробе ионов марганца распознается по изменению цвета раствора в среде буфера до начала титрования: цвет пробы быстро изменяется на серый.
Для устранения мешающего влияния ионов марганца к пробе воды, взятой для определения жесткости, следует прибавить несколько кристалликов маскирующего агента №1 и далее проводить титрование, как описано для меди.
Если величина жесткости воды, установленная в этом титровании, совпадает с величиной жесткости воды, определенной без добавления маскирующего агента, поправку на содержание ионов марганца можно не вводить. Если результат, полученный в титровании с маскирующим агентом, оказался ниже, в дальнейшем определение жесткости воды следует проводить с использованием маскирующего агента.
При наличии в воде ионов цинка результаты определения жесткости завышаются на величину, эквивалентную содержанию цинка.
Набор пригоден для определения
- жесткости сырой и осветленной воды в отсутствии катионов меди, цинка и марганца;
- жесткости воды в присутствии катионов меди и цинка;
- жесткости воды в присутствии катионов марганца;
- жесткости воды, загрязненной нефтепродуктами.

Как определить общую жесткость воды хозяйственно-бытового назначения?
7 июля 2020
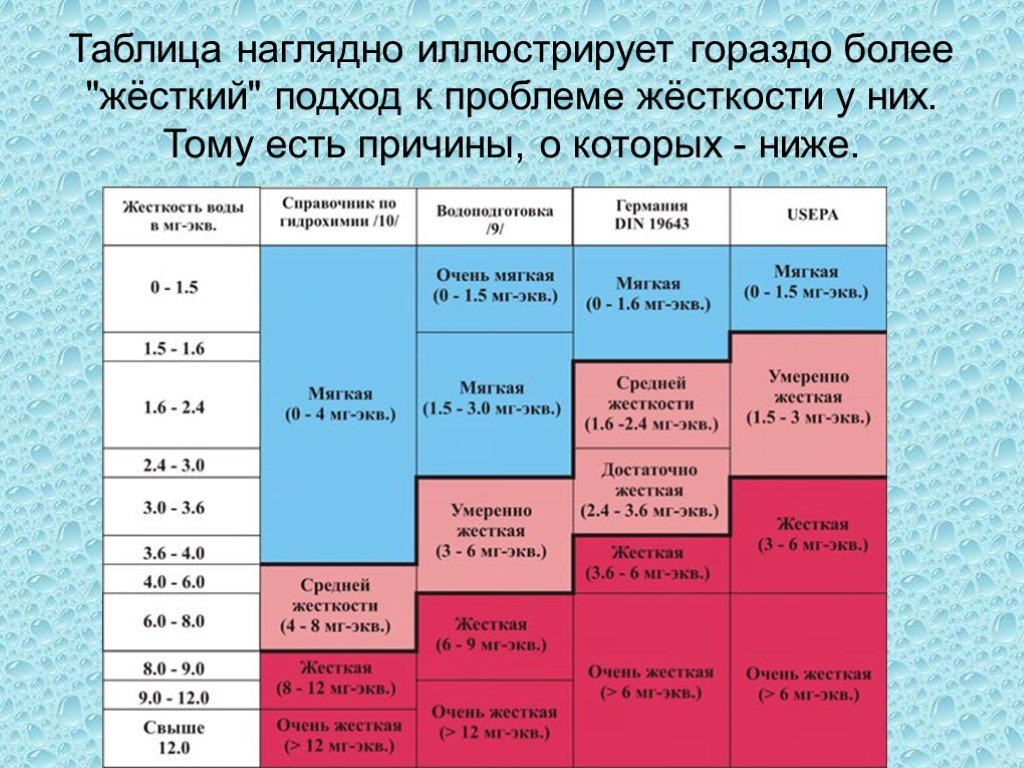
Классификация воды по жесткости
Общая жесткость – показатель, характеризующий свойство воды, обусловленное наличием в ней растворенных солей кальция и магния (сульфатов, хлоридов, карбонатов, гидрокарбонатов и т. п.).
По твердости воду классифицируют согласно табл. 1.
Таблица 1
Классификация воды по жесткости
|
Группа воды
|
Общая жесткость воды, ммоль/л
|
|
Очень мягкая
|
до 1,5
|
|
Мягкая
|
1,5–4,0
|
|
Средней жесткости
|
4,0–8,0
|
|
Жесткая
|
8,0–12,0
|
|
Очень жесткая
|
более 12,0
|
Нормативы общей жесткости воды
Международные нормативные документы, устанавливающие нормы качества воды, не нормируют жесткость воды, только отдельное содержание в воде ионов кальция (Ca2+) и магния (Mg2+).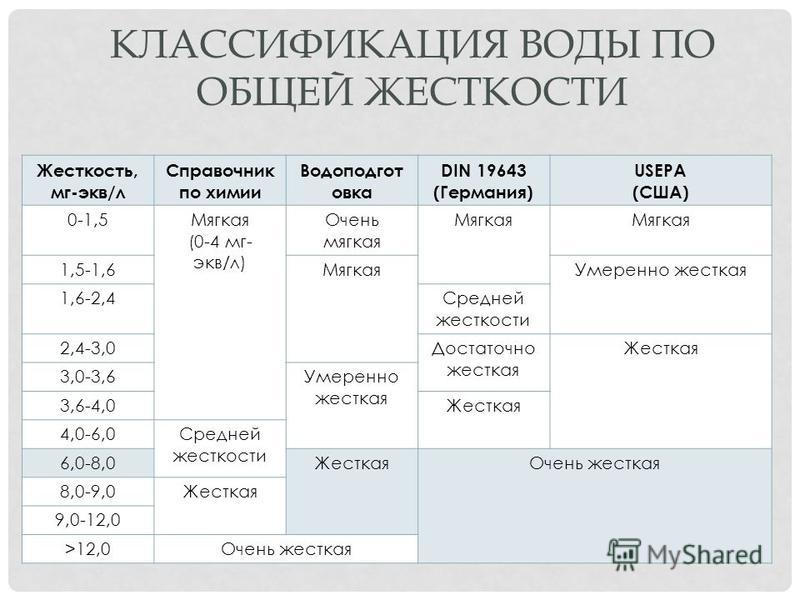 В Украине нормы общей жесткости для питьевой воды определены в ДСанПиН 2.2.4-171-10 «Гигиенические требования к воде питьевой, предназначенной для потребления человеком» (табл. 2).
В Украине нормы общей жесткости для питьевой воды определены в ДСанПиН 2.2.4-171-10 «Гигиенические требования к воде питьевой, предназначенной для потребления человеком» (табл. 2).
Таблица 2
Нормы общей жесткости воды
|
Вид воды
|
Нормы общей жесткости, ммоль/л
|
Нормативный документ
|
|
Водопроводная вода
|
до 7,0
|
ДСанПиН 2.2.4-171-10
|
|
Вода из колодцев и каптажей источников
|
до 10,0
|
ДСанПиН 2.2.4-171-10
|
|
Фасованная вода из пунктов разлива и бюветов
|
до 7,0
|
ДСанПиН 2.
|
|
По физиологической полноценности минерального состава питьевой воды
|
1,5–7,0
|
ДСанПиН 2.2.4-171-10
|
|
Вода предприятий банно-оздоровительного назначения (для бассейнов)
|
до 7,2
|
ДБН В.2.2-11:2002
|
Норма общей жесткости воды в аквариумах зависит от разновидностей рыб, которые будут в нем жить. Большинство рыб могут жить в широком диапазоне твердости – от очень мягкой до средней. Так, например, для некоторых рыб изменение уровня жесткости воды является сигналом к нересту.
Жесткость воды в бассейнах должна соответствовать нормам ДБН В.2.2-11: 2002 «Здания и сооружения. Предприятия бытового обслуживания» (табл. 1).
Достоверно жесткость воды определяют путем химического анализа (титрованием раствором трилона Б). Однако в бытовых условиях и при недостаточных знаниях химических процессов это сделать довольно сложно, да и не нужно.
Однако в бытовых условиях и при недостаточных знаниях химических процессов это сделать довольно сложно, да и не нужно.
Жесткость воды определяют измерением ее удельной электропроводности
Приблизительную жесткость воды можно определить путем измерения удельной электропроводности воды. Электропроводность воды определяет общее содержание растворенных солей в воде, в том числе солей кальция и магния. Метод является приблизительным, поскольку в воде могут присутствовать множество других солей. По значению удельной электропроводности λ мкСм/см по экспериментальному графику (рис. 1) [Хомченко И.Г. Современный аквариум и химия / И.Г. Хомченко, А.В. Трифонов, Б.Н. Разуваев. – Новая волна, 1997. – 115 с.] можно определить жесткость воды в так называемых немецких градусах dGH (иногда обозначают также dH, GH, dGH). Жесткость воды также могут определять в английских, французских и американских градусах, а также в мг-экв/л (табл. 3).
Рис. 1. График зависимости удельной электропроводности воды от ее жесткости
1. График зависимости удельной электропроводности воды от ее жесткости
Таблица 3
Соотношение между разными единицами измерения жесткости воды
|
Единицы
|
ммоль/л
|
мг-экв/л
|
|
Немецкий градус
|
0,1783
|
0,3566
|
|
Английский градус
|
0,1424
|
0,2848
|
|
Французский градус
|
0,0999
|
0,1998
|
|
Американский градус
|
0,01
|
0,02
|
Кондуктометр – прибор для определения удельной электропроводности воды
Удельную электропроводность воды определяют с помощью кондуктометра (табл. 4). Особое внимание следует уделить тому факту, что нужно определить именно удельную электропроводность, которая обозначается в мкСм/см. Кондуктометр, определяющий обычную электропроводность, в данном случае не подходит.
4). Особое внимание следует уделить тому факту, что нужно определить именно удельную электропроводность, которая обозначается в мкСм/см. Кондуктометр, определяющий обычную электропроводность, в данном случае не подходит.
Таблица 4
Приборы для измерения электропроводности воды
|
Измерительный прибор
|
Электропроводность
|
Точность
|
|
Ezodo CTS-406
|
0–2000 мкСм/см (µS/cm)
|
[±2 % + 1 деление]
|
|
Ezodo COND 6022
(кондуктометр)
|
0–1999 мкСм/см (µS/cm)
|
[±1 %]
|
Елена Можаровская,
кандидат технических наук
Поделиться
Поделится
Поделится
Новый комментарий
Войти с помощью
Отправить
| Природная вода всегда содержит различные растворенные ионы, в том числе Na +, K + , Ca 2+ , Mg 2+ , Cl — , HCO 3 — и некоторые другие. 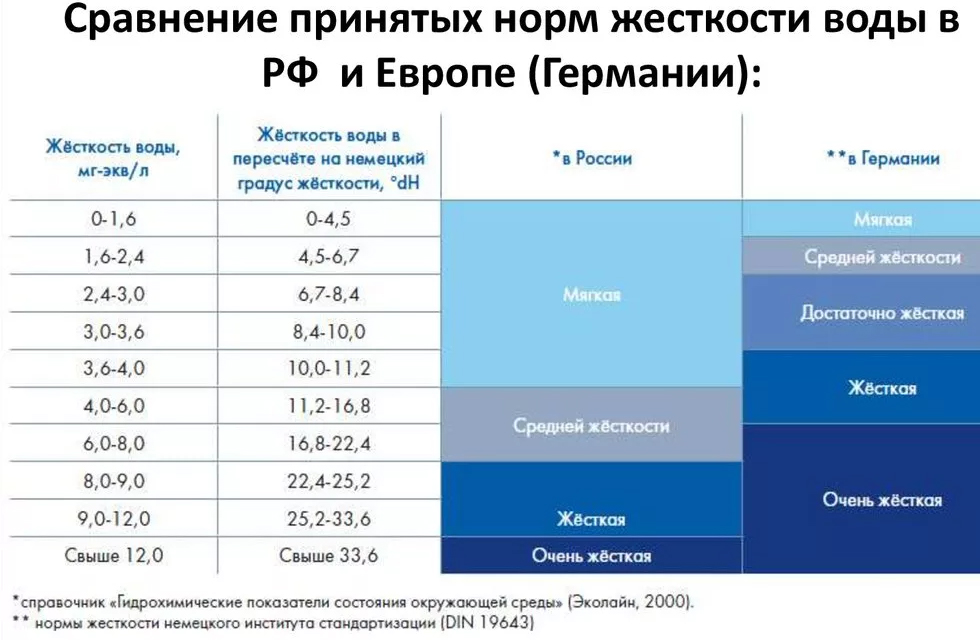 Если концентрации Ca и Если концентрации Ca иИоны Mg относительно велики, вода называется жесткой . Жесткая вода может стать причиной многих проблем. Поэтому важно иметь простой метод определения твердости. Такой метод основан на титровании пробы воды раствором комплексообразователя e тилен d иамин t etra a цетат (ЭДТА). Распространенной формой агента является динатриевая соль Na 2 H 2 ЭДТА. Он бесцветный. Его можно взвесить и растворить в воде для образования стабильного решение. При высоком pH (> 10) оставшиеся протоны покидают ЭДТА, образуя ЭДТА 4- анион: Этот ион легко реагирует с Mg 2+ (и Ca 2+ ), образуя бесцветный комплекс: Мг 2+ + ЭДТА 4- ® МгЭДТА 2- Все реагенты также бесцветны. Таким образом, для обнаружения конечной точки этой реакции нам нужен индикатор. Для этой цели мы будем использовать органический краситель Eriochrome Black T .  Это соединение образует комплексы розового цвета. Это соединение образует комплексы розового цвета.с ионами Mg 2+ и с ионами Ca 2+ . Водные растворы индикатора при рН 10 окрашены в синий цвет. Таким образом, когда розовый комплекс MgInd реагирует с ЭДТА дает синий раствор индикатора: MgInd + ЭДТА 4- ® MgEDTA 2- + Ind (стоимость не сбалансирован!) Реакция происходит потому, что ЭДТА образует гораздо более устойчивый комплекс чем индикатор. Аналогичное уравнение можно написать для кальция. Реагенты: Процедура Вычисления: Эксперимент 4 Имя __________________________ Дата _________________ Концентрация ЭДТА Объем пробы Mg Объем ЭДТА Титрование № 1: Титрование № 2 Титрование № 3: Среднее Концентрация Mg (ммоль/л): |
Определение общей жесткости воды по химическому составу.
 Учебное пособие
Учебное пособие
Определение общей жесткости в учебном пособии по химическому составу воды
Ключевые понятия
- Соли кальция и магния, растворенные в воде, вызывают жесткость воды.
- Жесткость воды можно измерить с помощью титрования этилендиаминтетрауксусной кислотой (ЭДТА).
Ионизированная форма ЭДТА показана справа.
ЭДТА, растворенный в воде, образует бесцветный раствор. - При рН 10 ионы кальция и магния образуют бесцветные водорастворимые комплексы с ЭДТА:
ион кальция в комплексе с ЭДТА: CaEDTA 2-
ион магния в комплексе с ЭДТА: MgEDTA 2- - Для титрования требуется индикатор, известный как индикатор ионов металлов.
Эриохромшварц-Т (Эрио Т) — подходящий индикатор.
Эриохромшварц-Т винно-красный в жесткой воде, но становится небесно-голубым в присутствии свободных ионов ЭДТА в растворе.
- Конечная точка титрования наступает, когда все ионы Ca 2+ и Mg 2+ образуют комплексы с ЭДТА.
Перед конечной точкой Ca 2+ и Mg 2+ в избытке, свободной ЭДТА в растворе нет.
Сразу после конечной точки наблюдается избыток ЭДТА. - Очень важно, чтобы при приготовлении всех растворов и промывании конической колбы использовалась деионизированная вода (вода, из которой были удалены ионы).
ИоныCa 2+ и Mg 2+ НЕ ДОЛЖНЫ присутствовать в воде, используемой для приготовления растворов, или при ополаскивании.
Пожалуйста, не блокируйте рекламу на этом сайте.
Нет рекламы = нет денег для нас = нет бесплатных вещей для вас!
Экспериментальное определение Ca
2+ и Mg 2+ в жесткой воде
Существует 3 этапа определения концентрации ионов кальция и магния в жесткой воде методом комплексонометрического титрования с ЭДТА:
- Приготовьте стандартный раствор ЭДТА.

- Используйте стандартный раствор ЭДТА для титрования жесткой воды.
- Выполнение расчетов для определения концентрации ионов кальция и магния в жесткой воде.
Приготовление стандартного раствора ЭДТА
Доступен ЭДТА с чистотой аналитического реагента, поэтому его можно использовать в качестве первичного стандарта.
Для приготовления стандартного раствора ЭДТА:
- Высушите немного ЭДТА при 80 o C, чтобы удалить всю влагу.
ЭДТА, приготовленный таким образом, будет иметь формулу Na 2 H 2 C 10 H 12 O 8 N 2 .2H 2 О
Молярная масса этого ЭДТА = (2 х 22,99) + (2 х 1,008) + (10 х 12,01) + (12 х 1,008) + (8 х 16,00) + (2 х 14,01) + 2(2 х 1,008 + 16,00) )
Молярная масса ЭДТА = 45,98 + 2,016 + 120,1 + 12,096 + 128 + 28,02 + 36,032 = 372,244 г моль -1 - Аккуратно отвесьте необходимое количество ЭДТА на часовом стекле.

Например, чтобы приготовить 250 мл 0,010 моль L -1 раствора ЭДТА:
(i) Определите необходимое количество молей ЭДТА:
концентрация раствора ЭДТА = 0,010 моль л -1
объем раствора ЭДТА = 250,0 мл = 250,0 x 10 -3 = 0,2500 л
моль ЭДТА = концентрация (моль л -1 ) x объем (л) = 0,010 x 0,2500 = 2,500 x 10 -3 моль(ii) Рассчитайте массу ЭДТА, необходимую для приготовления 250,0 мл раствора с концентрацией 0,010 моль л -1 .
молярная масса ЭДТА = 372,244 г моль -1
требуемая масса ЭДТА = моли x молярная масса = 2,500 x 10 -3 x 372,244 = 0,9306 г - Осторожно перенесите ЭДТА в мерную колбу
Поместите чистую сухую стеклянную воронку в горлышко мерной колбы.
С помощью чистого, сухого шпателя перенесите немного ЭДТА из часового стекла в воронку.
Используйте небольшое количество воды из бутыли для промывки, наполненной деионизированной водой, чтобы вымыть ЭДТА из воронки в колбу.
Продолжайте этот процесс до тех пор, пока на часовом стекле не останется ЭДТА.
Используйте промывочную бутыль, чтобы промыть шпатель над воронкой, чтобы перенести остатки ЭДТА в колбу.
Используйте бутыль для промывки, чтобы смыть остатки ЭДТА с часового стекла и смыть их с воронки.
Используйте бутыль для промывки, чтобы окончательно промыть саму воронку, чтобы убедиться, что весь оставшийся ЭДТА смыт в колбу. - Наполните мерную колбу деионизированной водой до метки.
Деионизированную воду можно наливать в колбу с помощью воронки до тех пор, пока объем раствора в колбе не станет немного ниже метки на колбе.
С помощью пастеровской пипетки добавляйте по каплям деионизированную воду до тех пор, пока нижняя часть мениска не окажется точно на отметке на колбе, если смотреть на уровне глаз.
Использование стандартного раствора ЭДТА для титрования жесткой воды
- Заполните бюретку на 50 мл стандартным раствором ЭДТА.

Сначала промойте чистую сухую бюретку небольшим количеством раствора ЭДТА.
Убедитесь, что кран на бюретке закрыт!
Наполните бюретку раствором ЭДТА до отметки 0,00 мл.
Поместите химический стакан под бюретку и медленно и осторожно пропускайте раствор ЭДТА через бюретку, пока дно мениска не совпадет точно с отметкой 0,00 мл на бюретке, если смотреть на уровне глаз.
Убедитесь в отсутствии пузырьков воздуха в растворе в бюретке и в отсутствии «воздушного кармана» на кончике бюретки.
Извлеките химический стакан и утилизируйте его содержимое надлежащим образом. - Промойте пипетку на 10,0 мл небольшим количеством образца жесткой воды, затем пипеткой перелейте 10,0 мл жесткой воды в чистую коническую колбу.
Используйте чистую коническую колбу, промытую деионизированной водой.
- Добавьте 5 мл буфера на основе аммиака с pH 10 с помощью пипетки 1 .
- Добавьте 2 капли индикатора, такого как Eriochromschwartz-T, который сделает винно-красным в аммиачной воде.

- Пропустите немного ЭДТА через бюретку в колбу, пока индикатор не станет небесно-голубым.
Продолжайте вращать коническую колбу во время титрования, чтобы перемешать содержимое.
Отметьте приблизительную конечную точку титрования. - При необходимости снова наполните бюретку и повторите титрование.
Используйте приведенное выше грубое титрование в качестве ориентира для определения конечной точки.
Быстро пропустите ЭДТА через бюретку примерно на 10 мл до ожидаемой конечной точки.
Медленно добавляйте ЭДТА по 1 мл за раз, пока не начнете видеть признаки изменения цвета в растворе, то есть пятно синий появляется перед исчезновением. В этот момент конечная точка близка.
Медленно по каплям добавляйте ЭДТА до первого стойкого изменения цвета (т. е. раствор становится синим и остается синим).
Запишите этот объем ЭДТА.
Используйте этот объем ЭДТА в качестве ориентира при повторении титрования.
Повторяйте титрование до тех пор, пока не получите 3 результата (объемы ЭДТА), которые согласуются с 0,05 мл (эти результаты считаются согласованными).
Расчеты
- Сбалансированное химическое уравнение реакции между ионами кальция и магния и ЭДТА:
CA 2+ + H 2 EDTA 2- → CAEDTA 2- + 2H +
MG 2+ + H 2 EDTA 2- → Mgedta 2- + + + + + + + + + + 2 . 2ч +
Итак, если мы допустим M 2+ — сумма ионов Ca 2+ и Mg 2+ в растворе, тогда:
M 2+ + H 2 ЭДТА 2- → МЭДТА 2- + 2H +
Обратите внимание, что 1 моль М 2+ реагирует с 1 молем Н 2 ЭДТА 2- .

В точке эквивалентности титрования:моль M 2+ = (моль Ca 2+ + моль Mg 2+ )
= моли H 2 ЭДТА 2- - Моль ЭДТА необходимо рассчитать, используя результаты титрования:
Титрование № Объем ЭДТА в бюрете Том EDTA Используемый (ML) Начальный объем (ML) Окончательный объем (ML) 3 9043. ) В (и) V f V (rough) = V f — V i Titration 1 V (i) V f V (1) = V F — V I 2 V (I) v F .  — В и
— В и Titration 3 V (i) V f V (3) = V f — V i average titre = (V (1) + V (2) + V (3) ) ÷ 3 = V (ср) моль ЭДТА = концентрация (моль л -1 ) x объем (л)
концентрация ЭДТА = концентрация стандартного раствора ЭДТА = c(ЭДТА)
объем ЭДТА = средний титр ÷ 1000 = V (av) x 10 -3 в литрах
моль ЭДТА = c(ЭДТА) x V (ср) x 10 -3 моль - Моль ионов кальция и магния в пробе жесткой воды (в конической колбе):
Из сбалансированного химического уравнения
моль M 2+ = моль ЭДТА, использованный при титровании
моль M 2+ = c(EDTA) x V (ср. ) x 10 -3 моль
) x 10 -3 моль - Концентрация М 2+ в жесткой воде:
концентрация M 2+ = моли M 2+ ÷ объем пробы воды (л)
моль M 2+ = c(EDTA) x V (av) x 10 -3 моль
объем жесткой воды = V (w) мл = V w x 10 -3 л
концентрация М 2+ = моли ÷ объем (л)
= c(EDTA) x V (av) x 10 -3 ÷ V (w) x 10 -3 моль л -1
Концентрация ионов кальция и магния в воде
= c(EDTA) x V (av) x 10 -3 ÷ V (w) x 10 -3 моль л -1
Рабочий пример
Студенту дали 1 л воды и попросили определить концентрацию растворенных в воде ионов кальция и магния.
Используя 0,010 моль л -1 стандартного раствора ЭДТА, студент оттитровал пробы воды объемом 100,0 мл, используя в качестве индикатора Эриохромшварц-Т.
Результаты титрования студента показаны ниже:
| Titration No. | volume EDTA (mL) |
|---|---|
| 1 | 10.14 |
| 2 | 10.10 |
| 3 | 10.12 |
Определите общую концентрацию ионов кальция и магния в пробе воды.
- Рассчитайте количество молей ЭДТА, необходимое для образования комплекса с ионами Ca 2+ и Mg 2+ в воде.
концентрация ЭДТА = 0,010 моль л -1
объем раствора ЭДТА = средний титр = (10,14 + 10,10 + 10,12) ÷ 3 = 10,12 мл = 10,12 x 10 -3 л
моль ЭДТА = концентрация (моль л -1 ) x объем (л) = 0,010 x 10,12 x 10 -3 = 1,012 x 10 -4 моль - Напишите уравнение реакции между ЭДТА и Ca 2+ и Mg 2+ :
CA 2+ + H 2 EDTA 2- → CAEDTA 2- + 2H +
MG 2+ + H 2 EDTA 2- → MGEDTA 2- + + + + + + + + 2 . 2H +
2H +
Пусть М 2+ = Са 2+ + Mg 2+ , то
M 2+ + H 2 ЭДТА 2- → МЕДТА 2- + 2H + - Рассчитайте количество молей M 2+ (= Ca 2+ + Mg 2+ ), присутствующего в пробе воды объемом 100,0 мл.
Из сбалансированного химического уравнения: 1 моль М 2+ реагирует с 1 молем ЭДТА.
Так 1,012 x 10 -4 молей ЭДТА реагируют с 1,012 x 10 -4 моль М 2+ - Рассчитайте концентрацию M 2+ (= Ca 2+ + Mg 2+ ) в воде
концентрация (M 2+ ) = моли M 2+ ÷ объем (л)
моль M 2+ = 1,012 x 10 -4 моль
объем = 100,0 мл = 100,0 x 10 -3 л
Концентрация
(М 2+ ) = 1,012 х 10 -4 ÷ 100,0 х 10 -3 = 1,012 х 10 -3 моль л -1 - Общая концентрация растворенных ионов кальция и магния в воде составляет 1,012 x 10 -3 моль л -1
1.

 2.4-171-10
2.4-171-10








 — В и
— В и  ) x 10 -3 моль
) x 10 -3 моль 2H +
2H +