Содержание
описание, особенности, рецепты и полезные свойства
Водá — прозрачная жидкость без цвета, вкуса и запаха, которая состоит из двух атомов водорода и одного кислорода. Меняет состояние в зависимости от температуры:замерзает или испаряется. Имеет ключевое значение для жизни человека. Потеря организмом более 10% жидкости приводит к летальному исходу.
История появления
Происхождение воды на Земле постоянно находится в центре внимания ученых, но точного ответа никто дать так и не может. Основной версией является такая: спустя один миллиард лет после Большого Взрыва в космосе образовался кислород, при взрыве сверхновых он попал в космическое пространство, соединился с водородом и образовал молекулы воды. А кометы и метеориты из пояса астероидов во время столкновения с Землей оставили молекулы воды на планете. У этой теории есть научное подтверждение: в кометах пояса Койпера обнаружена вода, идентичная по изотопному составу земной воде.
Польза и вред
Около 70% массы человека — это вода. А мозг вообще состоит из воды на 90%. Так что неудивительна потребность организма в постоянной водной поддержке. Взрослому человеку в сутки необходимо выпивать 35 мл воды на каждый килограмм веса. То есть, к примеру, норма для человека с массой тела 60 кг будет 2,1 л питьевой воды в день. Однако злоупотребление водой ни к чему хорошему не приведет. От гипергидратации развиваются отеки, страдают почки. Лучше до такого не доводить и придерживаться рекомендованного объема.
А мозг вообще состоит из воды на 90%. Так что неудивительна потребность организма в постоянной водной поддержке. Взрослому человеку в сутки необходимо выпивать 35 мл воды на каждый килограмм веса. То есть, к примеру, норма для человека с массой тела 60 кг будет 2,1 л питьевой воды в день. Однако злоупотребление водой ни к чему хорошему не приведет. От гипергидратации развиваются отеки, страдают почки. Лучше до такого не доводить и придерживаться рекомендованного объема.
Какая вода на вкус
Вкус воды зависит от солей и минералов, которые в ней растворены. В норме он очень слабо выражен. Если у воды есть какой-то яркий привкус, особенно химический, пить ее не стоит.
Как это пить
Специалисты настаивают, что норма жидкости должна обеспечиваться именно чистой питьевой водой. Чай, кофе, супы и газировка не восполняют водный баланс организма. Рекомендуется пить воду комнатной температуры или немного холоднее — она хорошо усваивается и избавляет от жажды.
Как и сколько хранить
Сама по себе чистая вода не портится и сроков хранения не имеет. Но если на воду воздействует высокая температура или материал посуды, в которой она содержится, есть свои нюансы. Пластиковая бутылка под прямыми солнечными лучами, например, начнется плавиться и выделять в воду токсины. Поэтому держать воду лучше в чистой посуде в прохладном месте. Открытую бутилированную воду рекомендуется выпить за неделю.
Но если на воду воздействует высокая температура или материал посуды, в которой она содержится, есть свои нюансы. Пластиковая бутылка под прямыми солнечными лучами, например, начнется плавиться и выделять в воду токсины. Поэтому держать воду лучше в чистой посуде в прохладном месте. Открытую бутилированную воду рекомендуется выпить за неделю.
Любопытные факты
В середине ХХ века появилась идея буксировать айсберги из Антарктиды в Африку, чтобы помочь победить засуху и жажду на континенте. Проект не оправдал себя из-за высоких затрат: слишком много пресной воды терялось в процессе перевозки.
Запасы подземных вод рассматриваются как полезное ископаемое.
В прошлом люди собирали для питья дождевую воду, но повышение кислотности дождей в наши дни сделало употребление такой воды небезопасным для здоровья.
Дистиллированная, то есть полностью очищенная от минералов и солей, вода вполне безопасна, но не для регулярного приема. Считается, что она вымывает из организма полезные вещества, а ничего хорошего не привносит — она же сверхчистая.
 Основное применение дистиллированной воды: опыты в химических лабораториях, фармакология, заправка кондиционеров. Можно еще добавлять ее вместо водопроводной в утюг для глажки в режиме отпаривания — нагревательные элементы прослужат дольше.
Основное применение дистиллированной воды: опыты в химических лабораториях, фармакология, заправка кондиционеров. Можно еще добавлять ее вместо водопроводной в утюг для глажки в режиме отпаривания — нагревательные элементы прослужат дольше.
Вкус воды — показатель ее качества — Каталог статей
Что такое «вкус воды»?
Немного лирики…
Один паломник прошел не одну тысячу шагов, чтобы встретить Учителя и, наконец, предстал перед ним, прося поделиться высшей мудростью.
— Тогда сделай глоток из этого ручья и опиши мне вкус воды. — сказал ему учитель.
— Это я уже слышал и понимаю эту Истину, – немного разочарованно произнес Искатель.
— Расскажи мне, что ты понимаешь? – попросил Учитель.
— Вкус воды нельзя описать словами, воду нужно пить, о ней не нужно разговаривать, так же и истина…
— А теперь представь себе – я сижу возле ручья, а толпа таких, как ты стоит в очереди для того, чтоб я описал им вкус воды, хотя многие из них уже слышали это описание от других Учителей.(Восточная притча)
Вкус воды — это органолептическое свойство воды, зависящее от растворенных в ней солей и газов.
Оценивают вкус по такой же пятибалльной шкале, как и запах, с градациями:
- очень слабый,
- слабый,
- заметный,
- отчетливый,
- очень сильный.
Согласно СанПиН запах и вкус очищенной воды, предназначенной для питьевых и хозяйственных целей, при температуре 20 °С не должны превышать 2 баллов; запах и вкус воды для промышленно-технических целей не имеют значения и свидетельствуют лишь о ее загрязнении.
Чтобы оценить вкус воды, ее набирают в рот малыми порциями, не проглатывая, задерживают 3-5 секунд.
Вода, прошедшая обработку, должна быть приятной на вкус и не иметь запаха. Если поступающая к потребителю вода достаточно часто имеет неприятный привкус, запах или цвет, то потребитель должен усомниться в том, что она безвредна для потребления.
Что влияет на вкус воды?
На вкусовые качества воды влияют неорганические соли или ионы металлов, разнообразные органические соединения, как природные, так и попадающие в воду вместе с производственными стоками, а также продукты жизнедеятельности флоры и фауны водоема. Наиболее часто появление привкусов и запахов в поверхностных водах обусловлено присутствием водорослей. В процессе матаболизма водорослей выделяются пахучие соединения, придающие воде привкус рыбы, травы, плесени или зловонных отбросов.
Наиболее часто появление привкусов и запахов в поверхностных водах обусловлено присутствием водорослей. В процессе матаболизма водорослей выделяются пахучие соединения, придающие воде привкус рыбы, травы, плесени или зловонных отбросов.
По вкусу различают четыре типа воды:
- сладкая
- с горчинкой
- кислая
- соленая.
Промежуточные ощущения характеризуют как привкус.
Насколько приятно пить воду, зависит от нескольких моментов: минерального состава – содержащиеся в воде соли могут придавать ей горчинку или иной характерный привкус; вода с температурой менее 11°С приятнее на вкус, чем теплая; наличия органических веществ. Так, присутствие в воде сероводорода придает ей характерный запах и привкус.
Основные соединения, влияющие на вкус воды
- сульфаты – придают питью некоторую горечь;
- соли железа — ярко выраженный привкус, довольно неприятный, аналогичным образом на свойства влияют соли марганца;
Пить сильно железистую воду и не полезно – она раздражающе действует на слизистые оболочки и кожу, вызывает аллергию, и противно – от нагревания такая вода становится бурой, дает сильный желтый осадок, неприятна на запах и на вкус.
 При централизованном водоснабжении ее от железа очищают. В домашних условиях, когда такая вода идет из вашей собственной скважины, ее надо отстаивать, кипятить и фильтровать.
При централизованном водоснабжении ее от железа очищают. В домашних условиях, когда такая вода идет из вашей собственной скважины, ее надо отстаивать, кипятить и фильтровать. - при повышенном содержании углекислоты вода становится кислой;
- хлориды делают воду соленой;
- органические вещества – придают легкую сладковатость.
В одном и том же источнике вода, взятая в разные сезоны, будет отличаться по вкусу. Меняется ее состав, концентрация активных веществ и микроорганизмов. Влияют на воду и биологические элементы: грибки, водоросли, бактерии. Некоторые из них могут придавать болотный или травяной привкус. Примесь фенола или хлорфенола придает настолько неприятный привкус, что воду практически невозможно пить. Подобная проблема возникает при попадании в источник сточных отходов.
Вкус воды в разных регионах
На севере вода ультрапресная, мягкая, в ней мало солей – от силы 0,1–0,2 г на литр. Зато много железа, кремния, природных органических кислот. А если двигаться на юг, то видно, что кислотность воды снижается, зато растет общая минерализация. В Астраханской области, в Калмыкии даже поверхностные воды солоноватые. Солей в них – 1,5–2 г на литр, больше, чем в норме должно быть в питьевой воде. Тип воды меняется как при продвижении с севера на юг, так и при восхождении от равнины к вершинам гор. Высоко в горах вода ультрапресная, по составу приближается к дистиллированной. Если ее пить, то в первое время она даже принесет организму пользу – очистит его, но постоянно употреблять такую воду нельзя – организм будет испытывать недостаток многих минеральных веществ.
Зато много железа, кремния, природных органических кислот. А если двигаться на юг, то видно, что кислотность воды снижается, зато растет общая минерализация. В Астраханской области, в Калмыкии даже поверхностные воды солоноватые. Солей в них – 1,5–2 г на литр, больше, чем в норме должно быть в питьевой воде. Тип воды меняется как при продвижении с севера на юг, так и при восхождении от равнины к вершинам гор. Высоко в горах вода ультрапресная, по составу приближается к дистиллированной. Если ее пить, то в первое время она даже принесет организму пользу – очистит его, но постоянно употреблять такую воду нельзя – организм будет испытывать недостаток многих минеральных веществ.
Как улучшить вкус воды?
Распространенный способ улучшения вкуса воды – использование фильтра с активированным углем. Благодаря его свойству абсорбции происходит удаление органических веществ и биологических организмов – именно они часто становятся источниками специфических привкусов.
Другой метод – фильтрация с помощью установки обратного осмоса. Помогает убрать привкус железа и солей. При этом нужно учитывать, что обратноосмотическая мембрана удаляет из воды и вещества полезные, такие как соли кальция, магния и пр. Обратноосмотическая очистка необходима только тогда, когда есть опасность микробиологического заражения воды. При этом нужно помнить, что недостаток минеральных соединений в воде должен полностью компенсироваться разнообразием рациона питания. Ведь основную часть минеральных веществ человек получает не из воды, а из пищи. Подробнее о минералах в воде в нашей статье «Вся правда о минералах»
Установив умягчающий фильтр, вы сразу заметите, что вкус воды стал слегка сладковатый. Удаление солей жесткости из воды помогает изменить вкус воды.
Минерализация воды — в настоящий момент производители оснащают бытовые фильтры для очистки воды минерализаторами, способными обогатить состав воды минеральными веществами и улучшить ее вкус. Например, проточный фильтр Фильтр BWT AQA vita Magnesium предназначен для очистки водопроводной воды от механических примесей, хлора, хлорорганических соединений и ионов тяжелых металлов с последующим обогащением ионами магния.
Например, проточный фильтр Фильтр BWT AQA vita Magnesium предназначен для очистки водопроводной воды от механических примесей, хлора, хлорорганических соединений и ионов тяжелых металлов с последующим обогащением ионами магния.
Выберите оптимальную систему очистки воды для вашего дома!
Готовы ответить на все вопросы, касающиеся фильтров для очистки воды, по тел. +7 (499) 398-02-35, через форму обратной связи или в комментариях к статье.
Что такое химическое вещество?
Версия для печати
Химическое вещество — это любое вещество, имеющее определенный состав. Другими словами, химическое вещество всегда состоит из одного и того же «вещества». Некоторые химические вещества встречаются в природе, например, вода. Производятся и другие химические вещества, такие как хлор (используемый для отбеливания тканей или в плавательных бассейнах). Химические вещества окружают вас повсюду: пища, которую вы едите, одежда, которую вы носите. Вы, на самом деле, состоите из самых разных химических веществ.
Вы, на самом деле, состоите из самых разных химических веществ.
Химическая реакция относится к изменению химического вещества. В более общем смысле под химической реакцией можно понимать процесс, при котором одно или несколько веществ изменяются с образованием одного или нескольких различных веществ. Химические изменения отличаются от физических изменений, которые не приводят к изменению веществ. Одним из примеров физического изменения является замерзание воды в лед. Хотя лед может иметь разные физические свойства, это все же вода. Другой пример, когда вы растворяете соль в чашке воды. Хотя может показаться, что соль исчезает в воде, у вас все еще есть вода и соль — никакое вещество не превратилось в совершенно новое вещество.
Вот один из примеров химической реакции: железо + кислород → оксид железа
Оксид железа, также известный как ржавчина, не может снова стать железом или кислородом. Это совершенно новое вещество. В уравнении вещества в левой части стрелки считаются реагентами (веществами, участвующими в химической реакции). Вещество справа от стрелки считается продуктом (веществом, полученным в результате химической реакции). В этом примере важно отметить, что в реакции не «теряется» никакой материал. С одной стороны уравнения у вас есть железо и кислород; с другой стороны, у вас все еще есть железо и кислород (теперь просто объединенные в одно химическое вещество).
Вещество справа от стрелки считается продуктом (веществом, полученным в результате химической реакции). В этом примере важно отметить, что в реакции не «теряется» никакой материал. С одной стороны уравнения у вас есть железо и кислород; с другой стороны, у вас все еще есть железо и кислород (теперь просто объединенные в одно химическое вещество).
В этом смысле этот пример иллюстрирует так называемый закон сохранения массы. Под «законом» мы подразумеваем общее правило того, как что-то работает или как что-то происходит. Это описание считается чрезвычайно надежным из-за большого количества подтверждающих экспериментальных проверок и наблюдений. В приведенном примере закон гласит, что продукты химической реакции имеют ту же массу («вещество»), что и реагенты. Другими словами, пока вещи перестраиваются, ничего не создается и не уничтожается.
Вот несколько способов узнать, происходит ли химическое изменение:
Вы можете заметить появление пузырьков или изменение запаха, что указывает на выделение газа.
 Так бывает, когда пищевая сода смешивается с уксусом.
Так бывает, когда пищевая сода смешивается с уксусом.Когда два прозрачных раствора смешиваются вместе, и полученная смесь становится мутной (из-за присутствия твердого вещества в жидкостях). Это известно как образование осадка.
Изменение цвета (как в нашем примере со ржавчиной).
- Изменение температуры или появление света, например, огня.
Хотя любое из вышеперечисленных может свидетельствовать о химическом изменении, физические изменения могут иметь некоторые из тех же последствий. Один из способов определить разницу между ними состоит в том, чтобы подумать о том, можно ли физически разделить новое вещество обратно на его исходные части, другими словами, может ли материя «вернуться» к тому состоянию, в котором она была изначально. Если не может, то это химическое изменение.
Комиссия по ядерному регулированию США — это независимое федеральное правительственное агентство, ответственное за регулирование коммерческого использования ядерных материалов. Этот документ не защищен авторскими правами и может быть воспроизведен в образовательных целях.
Этот документ не защищен авторскими правами и может быть воспроизведен в образовательных целях.
Последнее изменение страницы 19 марта 2020 г.
Кислоты и щелочи
Термины кислота и основание описывают химические характеристики многих веществ, которые мы используем ежедневно. Кислые вещи имеют кислый вкус. Основные или щелочные вещи имеют мыльный вкус. Сильные кислоты вызывают коррозию, а сильные основания едкие; оба могут вызвать серьезное повреждение кожи, похожее на ожог. Однако слабые кислоты и основания обычны и относительно безвредны для нас. Что делает вещество кислотным или основным? Следующее уравнение является хорошим местом для начала:
Мы начинаем с двух молекул воды и перемещаем несколько атомов водорода. Одна молекула воды получает водород и поэтому приобретает положительный заряд, а другая молекула воды теряет атом водорода и поэтому становится отрицательно заряженной. H 3 O + называется ионом гидроксония, и он делает вещества кислыми. OH – называется гидроксильным ионом, и он делает вещи основными. Однако в воде существует баланс между гидроксониями и гидроксилами, поэтому они нейтрализуют заряды друг друга. Чистая вода не является ни кислой, ни щелочной; это нейтрально.
H 3 O + называется ионом гидроксония, и он делает вещества кислыми. OH – называется гидроксильным ионом, и он делает вещи основными. Однако в воде существует баланс между гидроксониями и гидроксилами, поэтому они нейтрализуют заряды друг друга. Чистая вода не является ни кислой, ни щелочной; это нейтрально.
Так как же что-то становится кислым или щелочным? Это происходит, когда гидроксония и гидроксилы не сбалансированы. Если положительно заряженных гидроксоний больше, чем отрицательно заряженных гидроксилов, то вещество кислое. Если отрицательно заряженных гидроксилов больше, чем положительно заряженных гидроксоний, то вещество становится основным. На самом деле pH означает «потенциал (или мощность) водорода».
Примечание : Иногда люди пишут H + в качестве сокращения для H 3 O + и это может вызвать путаницу, потому что иногда, когда люди пишут H + , они на самом деле имеют в виду только H + , а не H 3 O + . Обратите на это внимание и попросите разъяснений!
Обратите на это внимание и попросите разъяснений!
Когда мы растворяем кислоты в воде, мы создаем избыток гидроксония. Когда мы растворяем основания в воде, мы создаем избыток гидроксилов. Вот два примера. Уксус, слабая кислота, имеет химическую формулу CH 3 СООН. При растворении в воде он становится CH 3 COO — и H + . Ионы H + объединяются с молекулами воды с образованием H 3 O + , поэтому раствор становится кислым. Теперь давайте посмотрим на щелочь, сильное основание с химической формулой NaOH (гидроксид натрия). Если мы добавим NaOH в воду, она диссоциирует на Na + и OH — . Натрий не делает ничего важного, но гидроксилы делают раствор более щелочным.
Последний вопрос: почему сильные кислоты и сильные основания так вредны? Это потому, что они не сбалансированы. У них либо слишком много положительных зарядов, и они ищут отрицательные, чтобы вернуться в равновесие, либо у них слишком много отрицательных зарядов, и они ищут положительные, чтобы вернуться к равновесию.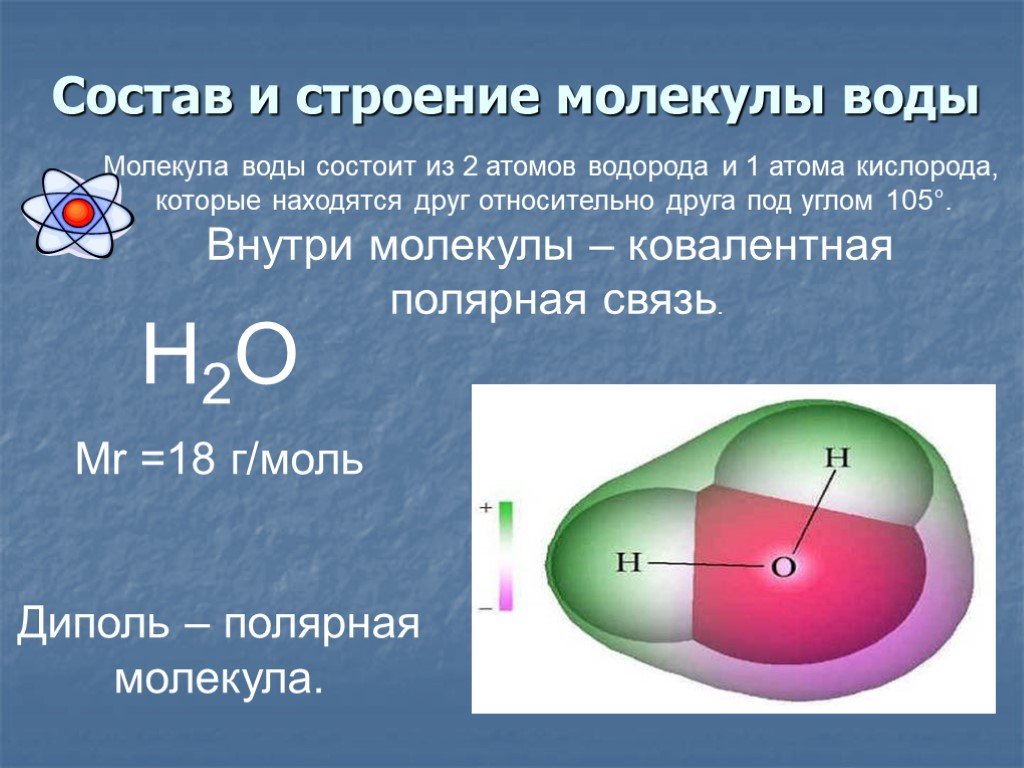 Это делает их очень реактивными со всем, с чем они контактируют. Когда положительные и отрицательные стороны находятся в равном количестве, они нейтрализуют друг друга.
Это делает их очень реактивными со всем, с чем они контактируют. Когда положительные и отрицательные стороны находятся в равном количестве, они нейтрализуют друг друга.
Что такое pH?: pH – это шкала, по которой мы измеряем силу кислот и оснований. pH обозначает потенциал водорода и примерно равен логарифму 10 по основанию молярной концентрации ионов водорода, поэтому pH = -log 10 [H + ]
Шкала pH — это мера кислотности по 14-бальной шкале, где 7 — нейтральная середина. pH представляет собой логарифмическую шкалу (как шкала Рихтера для землетрясений), поэтому pH 4 в 10 раз более кислый, чем pH 5, и в 100 раз более кислый, чем pH 6. Вы можете купить электронные pH-метры или pH-индикаторы. бумага от любой компании-поставщика биологических или лабораторных материалов, которую можно использовать для точного измерения кислотного или основного качества веществ, которые вы хотите протестировать. Попробуйте эту симуляцию, чтобы определить рН некоторых распространенных веществ.

 Основное применение дистиллированной воды: опыты в химических лабораториях, фармакология, заправка кондиционеров. Можно еще добавлять ее вместо водопроводной в утюг для глажки в режиме отпаривания — нагревательные элементы прослужат дольше.
Основное применение дистиллированной воды: опыты в химических лабораториях, фармакология, заправка кондиционеров. Можно еще добавлять ее вместо водопроводной в утюг для глажки в режиме отпаривания — нагревательные элементы прослужат дольше. (Восточная притча)
(Восточная притча) При централизованном водоснабжении ее от железа очищают. В домашних условиях, когда такая вода идет из вашей собственной скважины, ее надо отстаивать, кипятить и фильтровать.
При централизованном водоснабжении ее от железа очищают. В домашних условиях, когда такая вода идет из вашей собственной скважины, ее надо отстаивать, кипятить и фильтровать. Так бывает, когда пищевая сода смешивается с уксусом.
Так бывает, когда пищевая сода смешивается с уксусом.