Содержание
ICSC 0769 — ОКСИД КАЛИЯ
ICSC 0769 — ОКСИД КАЛИЯ
« back to the search result list(ru)
Chinese — ZHEnglish — ENFinnish — FIFrench — FRHebrew — HEHungarian — HUItalian — ITJapanese — JAKorean — KOPersian — FAPolish — PLPortuguese — PTRussian — RUSpanish — ES
| ОКСИД КАЛИЯ | ICSC: 0769 (Октябрь 2006) |
| CAS #: 12136-45-7 |
| UN #: 2033 |
| EINECS #: 235-227-6 |
| ОСОБЫЕ ОПАСНОСТИ | ПРОФИЛАКТИЧЕСКИЕ МЕРЫ | ТУШЕНИЕ ПОЖАРА | |
|---|---|---|---|
| ПОЖАР И ВЗРЫВ | Не горючее. | Использовать порошок, двуокись углерода. НЕ использовать водные агенты. |
| НЕ ДОПУСКАТЬ ОБРАЗОВАНИЕ ПЫЛИ! ИЗБЕГАТЬ ЛЮБЫХ КОНТАКТОВ! ВО ВСЕХ СЛУЧАЯХ ОБРАТИТЬСЯ К ВРАЧУ! | |||
|---|---|---|---|
| СИМПТОМЫ | ПРОФИЛАКТИЧЕСКИЕ МЕРЫ | ПЕРВАЯ ПОМОЩЬ | |
| Вдыхание | Боли в горле. Кашель. Ощущения жжения. Затрудненное дыхание. Сбивчивое дыхание. | Применять местную вытяжку. Применять средства защиты органов дыхания. | Свежий воздух, покой. Полусидячее положение. Может потребоваться искусственное дыхание. Немедленно обратиться за медицинской помощью. |
| Кожа | Покраснение. Боль. Серьезные ожоги кожи. | Защитные перчатки. Защитная одежда. | Снять загрязненную одежду. Промыть кожу большим количеством воды или принять душ. Обратиться за медицинской помощью. Промыть кожу большим количеством воды или принять душ. Обратиться за медицинской помощью. |
| Глаза | Покраснение. Боль. Ожоги. | Использовать маску для лица или средства защиты глаз в комбинации со средствами защиты органов дыхания.. | Промыть большим количеством воды в течение нескольких минут (снять контактные линзы, если это возможно сделать без затруднений). Немедленно обратиться за медицинской помощью. |
| Проглатывание | Боль в горле. Ощущение жжения в горле и груди. Шок или сильная слабость. | Не принимать пищу, напитки и не курить во время работы. | Прополоскать рот. НЕ вызывать рвоту. Обратиться за медицинской помощью. |
| ЛИКВИДАЦИЯ УТЕЧЕК | КЛАССИФИКАЦИЯ И МАРКИРОВКА |
|---|---|
Индивидуальная защита: костюм химической защиты, включая автономный дыхательный аппарат. Сухие пластиковыеСмести просыпанное вещество в закрытые контейнеры. Смыть остаток большим количеством воды. Сухие пластиковыеСмести просыпанное вещество в закрытые контейнеры. Смыть остаток большим количеством воды. |
Согласно критериям СГС ООН
ОПАСНО
Транспортировка |
| ХРАНЕНИЕ | |
| Отдельно от сильных кислот и пищевых продуктов и кормов. Хранить сухим. | |
| УПАКОВКА | |
| Герметичная. Не перевозить с продуктами питания и кормами для животных. |
| ОКСИД КАЛИЯ | ICSC: 0769 |
| ФИЗИЧЕСКИЕ И ХИМИЧЕСКИЕ СВОЙСТВА | |
|---|---|
|
Агрегатное Состояние; Внешний Вид
Физические опасности
Химические опасности
|
Формула: K2O |
| ВОЗДЕЙСТВИЕ НА ОРГАНИЗМ И ЭФФЕКТЫ ОТ ВОЗДЕЙСТВИЯ | |
|---|---|
|
Пути воздействия
Эффекты от кратковременного воздействия
|
Риск вдыхания
Эффекты от длительного или повторяющегося воздействия
|
| Предельно-допустимые концентрации |
|---|
|
|
| ОКРУЖАЮЩАЯ СРЕДА |
|---|
| ПРИМЕЧАНИЯ |
|---|
| Бурно реагирует с такими средствами пожаротушения, как вода. Симптомы отека легких часто не проявляются, пока не пройдет несколько часов, и они усугубляются физическими усилиями. 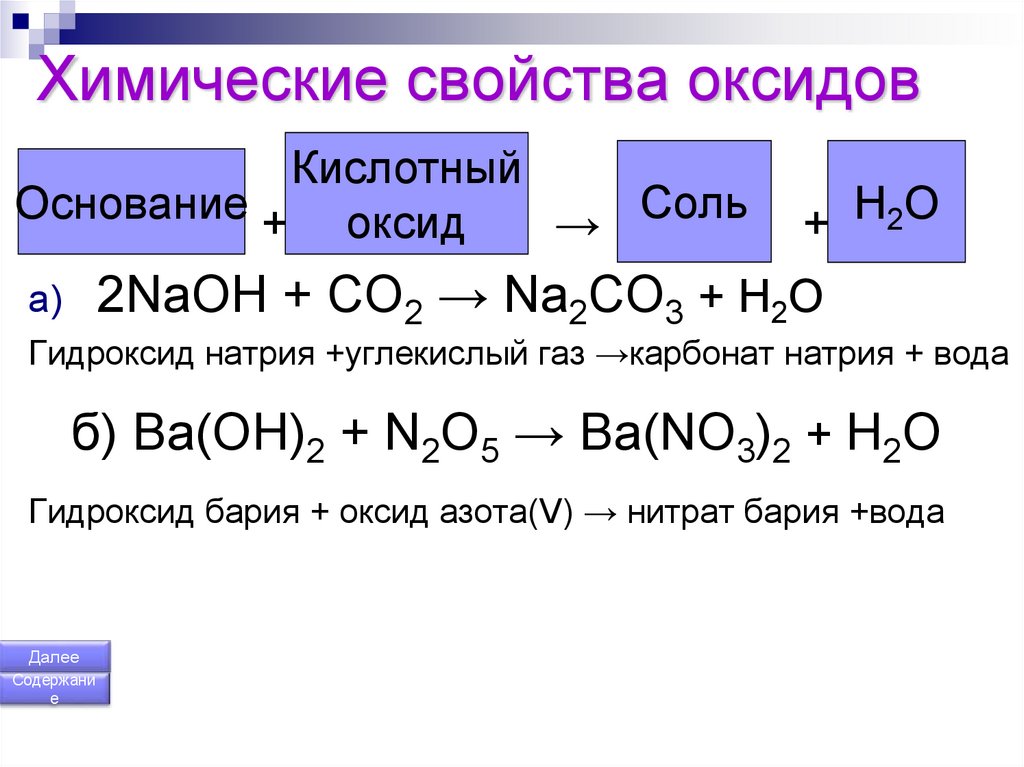 Поэтому крайне важны отдых и медицинское наблюдение. Поэтому крайне важны отдых и медицинское наблюдение.Следует рассмотреть возможность немедленного проведения соответствующей ингаляционной терапии врачом или уполномоченным на это лицом. См. карту ICSC 0357. |
| ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ |
|---|
|
Классификация ЕС |
| (ru) | Ни МОТ, ни ВОЗ, ни Европейский Союз не несут ответственности за качество и точность перевода или за возможное использование данной информации. © Версия на русском языке, 2018 |
Оксид калия, характеристика, свойства и получение, химические реакции
Оксид калия, характеристика, свойства и получение, химические реакции.
Оксид калия – неорганическое вещество, имеет химическую формулу K2O.
Краткая характеристика оксида калия
Физические свойства оксида калия
Получение оксида калия
Химические свойства оксида калия
Химические реакции оксида калия
Применение и использование оксида калия
Краткая характеристика оксида калия:
Оксид калия – неорганическое вещество бесцветного либо бледно-желтого цвета.
Так как валентность калия равна одному, то оксид калия содержит один атом кислорода и два атома калия.
Химическая формула оксида калия K2O.
В воде не растворяется, а вступает в реакцию с ней.
Растворим в органических растворителях.
Обладает высокой гигроскопичностью.
Физические свойства оксида калия:
| Наименование параметра: | Значение: |
| Химическая формула | K2O |
| Синонимы и названия иностранном языке | potassium oxide (англ. ) )калия окись (рус.) |
| Тип вещества | неорганическое |
| Внешний вид | бесцветные (иногда бледно-желтый) кубические кристаллы |
| Цвет | бесцветный, иногда – бледно-желтый |
| Вкус | —* |
| Запах | — |
| Агрегатное состояние (при 20 °C и атмосферном давлении 1 атм.) | твердое вещество |
| Плотность (состояние вещества – твердое вещество, при 20 °C), кг/м3 | 2320 |
| Плотность (состояние вещества – твердое вещество, при 20 °C), г/см3 | 2,32 |
| Температура кипения, °C | — |
| Температура плавления, °C | 740 |
| Температура разложения, °C | 300 |
| Гигроскопичность | высокая гигроскопичность |
| Молярная масса, г/моль | 94,196 |
* Примечание:
— нет данных.
Получение оксида калия:
Оксид калия получается в результате следующих химических реакций:
- 1.
 из пероксида калия:
из пероксида калия:
Вначале получают пероксид калия.
2К + О2 → К2О2.
Затем пероксид калия обогащают калием.
К2О2 + 2К → 2К2О.
Напрямую оксид калия путем окисления самого калия не получается.
Химические свойства оксида калия. Химические реакции оксида калия:
Химически активное вещество.
Химические свойства оксида калия аналогичны свойствам оксидов других щелочных металлов. Поэтому для него характерны следующие химические реакции:
1. реакция оксида калия с галогенами:
К2О + СІ2 → КСІ + КСІО;
К2О + Br2 → КBr + КBrО;
К2О + I2 → КI + КIО.
Оксид калия бурно реагирует с галогенами, образуя соответственно две соли:
– хлорид калия и гипохлорит калия,
– бромид калия и гипобромит калия,
– йодид калия и гипойодит калия.
2. реакция оксида калия с водой:
реакция оксида калия с водой:
К2О + Н2О → 2КОН.
Оксид калия бурно реагирует с водой, образуя гидроксид калия.
3. реакция оксида калия с оксидом углерода (углекислым газом):
К2О + СО2 → К2СО3.
Оксид калия на воздухе реагирует с углекислым газом (являющийся кислотным оксидом), образуя соль – карбонат калия.
4. реакция оксида калия с оксидом серы:
К2О + SО2 → К2SО3;
К2О + SО3 → К2SО4.
Оксид серы также является кислотным оксидом. В результате реакции образуется соответственно соль – в первом случае – сульфит калия, во втором случае – сульфат калия.
5. реакция оксида калия с оксидом кремния:
К2О + SiО2 → К2SiО3.
Оксид кремния также является кислотным оксидом. В результате реакции образуется соль – силикат калия.
В результате реакции образуется соль – силикат калия.
Аналогично проходят реакции оксида калия и с другими кислотными оксидами.
6. реакция оксида калия с оксидом цинка:
К2О + ZnО → К2ZnО2.
Оксид цинка является амфотерным оксидом. Это значит, что как амфотерный оксид оксид цинка проявляет свойства как кислотных, так и основных соединений. В результате реакции образуется соль – цинкат калия.
Аналогично проходят реакции оксида калия и с другими амфотерными оксидами.
7. реакция оксида калия с плавиковой кислотой:
K2O + 2HF → 2KF + H2O.
В результате химической реакции получается соль – фторид калия и вода.
Аналогично проходят реакции оксида калия и с другими кислотами.
8. реакция оксида калия с бромистым водородом (бромоводородом):
K2O + 2HBr → 2KBr + H2O.
В результате химической реакции получается соль – бромид калия и вода.
9. реакция оксида калия с йодоводородом:
K2O + 2HI → 2KI + H2O.
В результате химической реакции получается соль – йодид калия и вода.
10. реакция оксида калия с жидким аммиаком:
K2O + NH3 → КОН + KNH2 (t = -50 oC).
В результате химической реакции получается гидроксид калия и амид калия.
Применение и использование оксида калия:
Оксид калия используется в сельском хозяйстве в качестве компонента минеральных удобрений, в строительстве в составе цемента, а также в химической промышленности для получения других соединений калия.
Примечание: © Фото //www.pexels.com, //pixabay.com
оксид калия реагирует кислота 1 2 3 4 5 вода
уравнение реакций соединения масса взаимодействие оксида калия
реакции с оксидом калия
Коэффициент востребованности
9 211
{\text{ — }}}{\text{)}}\] имеет заряд -1. Таким образом, химическая формула гидроксида калия: \[{\text{KOH}}\].
Таким образом, химическая формула гидроксида калия: \[{\text{KOH}}\].
Неуравновешенная химическая реакция оксида калия с водой выглядит следующим образом:
\[{{\text{K}}_{\text{2}}}{\text{O + }}{{\text{H}} _{\text{2}}}{\text{O}} \to {\text{KOH}}\]
Сбалансированная химическая реакция выглядит следующим образом:
\[{{\text{K}}_{\ text{2}}}{\text{O +}}{{\text{H}}_{\text{2}}}{\text{O}} \to 2{\text{KOH}}\]
Таким образом, при взаимодействии оксида калия с водой образуется гидроксид калия (\[{\text{KOH}}\]).
Дополнительная информация: Калий реагирует с кислородом воздуха с образованием оксида калия. Оксид калия представляет собой бледно-желтое твердое вещество без запаха. Это основной оксид. Используется как удобрение. Он также используется для приготовления мыла и стекла. Он также имеет множество медицинских применений. Он очень эффективен при грибковых заболеваниях.
Общая химическая реакция оксида щелочного металла с водой выглядит следующим образом:
\[{{\text{M}}_{\text{2}}}{\text{O + }}{{\text{H} }_{\text{2}}}{\text{O}} \to {\text{2MOH}}\]
Примечание: Оксид калия является ионным соединением. Все оксиды металлов при взаимодействии с водой дают в качестве продукта гидроксид металла. 1 моль всего оксида щелочного металла реагирует с 1 молем воды и дает 2 моля гидроксида щелочного металла в качестве продукта.
Все оксиды металлов при взаимодействии с водой дают в качестве продукта гидроксид металла. 1 моль всего оксида щелочного металла реагирует с 1 молем воды и дает 2 моля гидроксида щелочного металла в качестве продукта.
Недавно обновленные страницы
В Индии по случаю бракосочетания фейерверк 12 класса химии JEE_Main
Щелочноземельные металлы Ba Sr Ca и Mg могут быть организованы 12 класса химии JEE_Main
Что из следующего имеет самый высокий электродный потенциал 12 класса химии JEE_Main
Что из следующего является истинным пероксидом A rmSrmOrm2 класса 12 химии JEE_Main
Какой элемент обладает наибольшим радиусом атомов А класса 11 химии JEE_Main
Получен фосфин из следующей руды Кальций класса 12 химии JEE_Main
В Индии по случаю бракосочетания фейерверк класса 12 химии JEE_Main
Щелочноземельные металлы Ba Sr Ca и Mg могут быть организованы класс 12 химии JEE_Main
Что из следующего имеет самый высокий электродный потенциал 12 класса химии JEE_Main
Что из следующего является истинным пероксидом A rmSrmOrm2 класса 12 химии JEE_Main
Какой элемент обладает наибольшим радиусом атомов А класса 11 химии JEE_Main
Получен фосфин из следующей руды Кальций класс 12 химия JEE_Main
Актуальные сомнения
Структура, формула, свойства и использование
Знаете ли вы, какой металл после натрия является наиболее реакционноспособным? Нет? Это калий! Калий подобен натрию, т. е. очень реактивен, мягок и энергичен. Из-за своей реакционной способности его держат в керосине. Подобно натрию, калий также реагирует с кислородом и образует оксид калия. Но можете ли вы ответить, является ли оксид калия ионным или ковалентным? Является ли это соединение кислотным или основным? Каковы применения оксида калия?
е. очень реактивен, мягок и энергичен. Из-за своей реакционной способности его держат в керосине. Подобно натрию, калий также реагирует с кислородом и образует оксид калия. Но можете ли вы ответить, является ли оксид калия ионным или ковалентным? Является ли это соединение кислотным или основным? Каковы применения оксида калия?
Этот раздел позволит вам ответить на все подобные вопросы об оксиде калия.
Что такое оксид калия?
Оксид калия представляет собой соединение, образованное связью между кислородом и калием. Он также известен как дикалийоксид или монооксид калия. Это неорганическое соединение. Как и оксид натрия, оксид калия также является очень реакционноспособным и редко встречающимся соединением.
Легко догадаться, является ли оксид калия ионным или ковалентным. Во-первых, калий — это металл, а металлы электроположительны, а кислород — один из сильно электроотрицательных элементов. Итак, происходит поляризация, и образующееся соединение является ионным.
Во-вторых, это объясняется структурой Льюиса оксида калия, которая объясняется далее.
Структура и формула оксида калия
Молекулярная формула оксида калия – K₂O. В общих чертах оксид калия называют оксидом щелочного металла. Это простейшее соединение калия, обладающее высокой реакционной способностью.
Это соединение является ионным соединением. Это связано с тем, что калий имеет только один электрон на внешней оболочке, а кислороду не хватает двух электронов, чтобы получить заполненный октет. Следовательно, два атома калия будут отдавать свои электроны атому кислорода и образовывать ионные связи. В результате форма соединения также является ионной.
Структура Льюиса оксида калия представлена ниже:
Ион калия имеет заряд +1, тогда как ион кислорода имеет заряд -2. Для электрически нейтрального соединения заряды должны уравновешивать друг друга. Следовательно, два атома К необходимы, чтобы уравновесить заряд -2 на атоме О. В результате формула оксида калия — K₂O.
Получение оксида калия
Некоторые методы получения оксида калия:
1. С помощью пероксида калия:
- Полученный продукт представляет собой оксид калия при взаимодействии пероксида калия, т.е. K2O2, с металлическим калием.
K₂O₂ + 2K → 2K₂O
- При нагревании пероксида калия при 500°C он разлагается на чистый оксид калия и молекулы кислорода.
2K₂O₂ → 2K₂O + O₂ ↑
2. С помощью нитрата калия:
При обработке нитрата калия металлическим калием образуется оксид калия с выделением газообразного азота. Этот способ более выгоден, чем первый.
2KNO₃ + 10K → 6K₂O + N₂ ↑
3. С помощью гидроксида калия:
Гидроксид калия невозможно дегидратировать до оксида. Но он может реагировать с расплавленным калием с образованием оксида калия и выделением водорода в качестве побочного продукта.
2KOH + 2K ⇌ 2K₂O + H₂ ↑
4. С помощью металлического калия:
При взаимодействии металлического калия с кислородом образуется оксид калия. Эта реакция представлена как
Эта реакция представлена как
4K + O₂ → 2K₂O
Физические свойства оксида калия
Калий является членом семейства натрия, т. е. группы I периодической таблицы. Он имеет тенденцию завершать свой октет, высвобождая электроны. Поэтому он очень реактивен в свободной форме. Когда он обрабатывается кислородом, он легко образует связь с атомом О и образует оксид калия. Некоторые физические свойства оксида калия:
- Это бледно-желтое или белое кристаллическое и твердое соединение.
- Молярная масса оксида калия составляет 9.4,2 г/моль.
- Широко используется в качестве удобрения.
- Плотнее воды. А плотность оксида калия составляет 2,35 г/см³.
- Это соединение без запаха.
- Разлагается при 740°C.
- Растворим в этаноле и диэтиловом эфире.
- Теплоемкость оксида калия 83,62 Дж/моль·К.
- Молекулы оксида калия образуют антифлюоритную структуру.
Химические свойства оксида калия
Химические свойства соединения – это свойства, которые изменяют химический состав соединения. Поскольку калий является высокореактивным металлом, оксид калия является реакционноспособным соединением и может бурно реагировать.
Поскольку калий является высокореактивным металлом, оксид калия является реакционноспособным соединением и может бурно реагировать.
- Реакция оксида калия с избытком воды становится сильно коррозионной, и соединение образует гидроксид калия.
K₂O + H₂O → KOH
- Это оксид металла, и обычно оксиды металлов являются основными. Следовательно, он является основным или щелочным и очень агрессивным.
- При взаимодействии оксида калия с сильными кислотами образуется соль и вода. Эта реакция показывает, что оксид калия является основным соединением.
K2O + HCl → KCl + H2O
K2O + H2SO4 → K2SO4 + H2O
K2O + HNO3 → 2KNO3 + H2O
Эти реакции являются примерами реакций нейтрализации.
- При нагревании выше 300°C оксид калия превращается в пероксид калия и металлический калий.
2K₂O → K₂O₂ + 2K
Использование и применение оксида калия
Обладает высокой энергичностью и легко вступает в реакцию с влагой. Он используется для различных целей. Некоторые из них:
Он используется для различных целей. Некоторые из них:
- В сельском хозяйстве оксид калия широко используется в качестве удобрения.
- Он также используется в рецептурах для производства стекла и в цементной промышленности.
- Оксид калия нерастворим в воде и является очень стабильным соединением. Это свойство делает его удобным в керамической промышленности.
- Используется врачами-зоотехниками при лечении болезней животных.
- Как правило, он известен как чистый калий и используется для изготовления очков и мыла.
- В аэрокосмической промышленности оксид калия используется для изготовления конструкционных компаундов и облегченных чаш.
- Подобно зигомицетам и т. д., грибковым инфекциям, оксид калия используется для лечения таких инфекций.
- В небольших количествах оксид калия также используется в некоторых лекарствах.
Меры безопасности при использовании оксида калия
Оксид калия можно использовать для различных целей, но его высокая реакционная способность делает его опасным химическим веществом. Поэтому при работе с ним необходимо соблюдать меры предосторожности. Однако, если вы каким-либо образом соприкоснулись с оксидом калия, необходимо немедленно принять меры по оказанию первой помощи. это
Поэтому при работе с ним необходимо соблюдать меры предосторожности. Однако, если вы каким-либо образом соприкоснулись с оксидом калия, необходимо немедленно принять меры по оказанию первой помощи. это
1. При попадании в глаза оксида калия:
- Немедленно промыть глаза большим количеством воды в течение не менее 30 минут.
- Промойте глаза, поднимая и опуская веки.
- Во время промывания глаз, если вы носили контактные линзы, снимите их.
- Немедленно обратитесь за медицинской помощью.
2. При попадании на кожу оксида калия:
- Как можно быстрее снимите всю загрязненную одежду.
- Немедленно промойте зараженный участок большим количеством воды.
- Немедленно обратитесь за медицинской помощью.
3. Если вы вдохнули оксид калия:
- Удалите человека, подвергшегося воздействию оксида калия, с его места.
- Начните оказание первой помощи, обеспечив ему искусственное дыхание, если его дыхание остановилось.

- Если его сердце перестало работать, сделайте ему сердечно-легочную реанимацию.
- Срочно доставить в медицинское учреждение.
Заключение
Прочитав вышеприведенную статью, вы теперь хорошо осведомлены об оксиде калия. Оксид калия представляет собой неорганическую кислоту с высокой реакционной способностью. Формула оксида калия K₂O. Он имеет основную или щелочную природу. Дает реакции нейтрализации при обработке сильными кислотами. Из-за своих различных свойств он используется в основном в качестве удобрения в сельском хозяйстве. Это полезно в стекольной, керамической и оптической промышленности. Он становится токсичным при проглатывании и вдыхании. Из-за его токсичности необходимо соблюдать меры предосторожности при работе с ним.
Часто задаваемые вопросы
1. Сколько типов оксидов образует калий на воздухе?
A. Когда калий подвергается воздействию воздуха (то есть кислорода), он образует три типа оксидов. Образование оксида зависит от наличия кислорода во время реакции.
Образование оксида зависит от наличия кислорода во время реакции.
- Оксид калия, K₂O
- Пероксид калия, K₂O₂
- Супероксид калия, KO₂
Реакция протекает как
8K + 4O₂ → 2K2O+ 2KO₂ + K₂O₂
2. Что такое супероксид калия?
A. Супероксид калия представляет собой неорганическое соединение с химической формулой KO₂. Степень окисления кислорода в KO₂, супероксиде калия, равна -1. Это парамагнитное твердое вещество желтого цвета, разлагающееся во влажном воздухе. Он имеет другие химические и физические свойства, чем оксид калия или пероксид калия.
3. Опасен ли оксид калия для здоровья?
A. Оксид калия представляет собой неорганическое соединение с химической формулой K₂O. Он очень коррозионно-активен во влаге и воздухе. Таким образом, во время химических реакций или при работе с ним необходимо обращаться с ним осторожно и безопасно. Некоторые опасности для здоровья, вызванные оксидом калия,
- При попадании на кожу может вызвать раздражение кожи.



 Едкое вещество при приеме внутрь. Вдыхание аэрозоля может вызвать отек легких. См Примечания Необходимо медицинское обследование.
Едкое вещество при приеме внутрь. Вдыхание аэрозоля может вызвать отек легких. См Примечания Необходимо медицинское обследование.
 из пероксида калия:
из пероксида калия:
