Содержание
Неорганические вещества: вода, соли
Вопрос 1. Какие вещества называют неорганическими?
Неорганические вещества — простые вещества и соединения, не являющиеся органическими, т. е. не содержащие углерода, а также некоторые углеродосодержащие соединения (карбиды, цианиды, карбонаты, оксиды углерода и некоторые другие вещества, которые традиционно относят к неорганическим).
Вопрос 2. Какие известные вам организмы содержат много воды?
Алоэ, кактусы, водоросли, медуза, в плодах огурцов и др.
Вопрос 3. Какие неорганические вещества мы употребляем в пищу? Почему?
Воду, минеральные вещества (кальций, магний, йод, фосфор, медь и др.). Они способствуют проникновению веществ в клетки организма, протекание ферментативных и пластических процессов, участвуют в формировании и построении тканей, поддерживают осмотическое давление крови, активируют проведение возбуждения и импульсов, способствуют свертыванию крови и т. д.
д.
Вопрос 4. Какие неорганические вещества содержатся в живых организмах?
Вода, соли минеральных кислот и соответствующие катионы и анионы.
Вопрос 5. Что определяет уникальные физические и химические свойства воды, столь важные для существования живой материи?
Уникальные физические и химические свойства воды определяются особенностями структуры её молекулы, которые возникают в результате специфического расположения электронов в атомах кислорода и водорода.
Вопрос 6. Какие химические связи называют водородными?
Водородные связи — это такие связи, которые возникают между положительно заряженным атомом водорода одной молекулы и отрицательно заряженным атомом другой молекулы.
Вопрос 7. Какие физико — химические свойства воды наиболее важны для обеспечения жизнедеятельности клеток и многоклеточных организмов в разных условиях?
Высокая теплоёмкость (способность поглощать тепло при незначительном изменении собственной температуры) воды предохраняет клетку от резких температурных колебаний, а высокая теплопроводность обеспечивает возможность равномерного распределения теплоты между отдельными частями организма. Высокая теплота испарения используется живыми организмами для предохранения от перегрева: испарение жидкости растениями и животными охлаждает организм и является защитной реакцией на повышение температуры. Вода практически несжимаема, благодаря чему клетки поддерживают свою форму и обладают упругостью. Очень важно, что лёд легче воды, так как вода имеет максимальную плотность при +4°С, поэтому пресные водоёмы не промерзают до дна.
Высокая теплота испарения используется живыми организмами для предохранения от перегрева: испарение жидкости растениями и животными охлаждает организм и является защитной реакцией на повышение температуры. Вода практически несжимаема, благодаря чему клетки поддерживают свою форму и обладают упругостью. Очень важно, что лёд легче воды, так как вода имеет максимальную плотность при +4°С, поэтому пресные водоёмы не промерзают до дна.
Для живых организмов весьма важно ещё и то, что молекулы воды являются диполями. Дипольный характер молекулы воды определяет её способность ориентироваться в электрическом поле. Именно это свойство воды определяет её уникальность как растворителя.
Вопрос 8. В каких растворителях могут растворяться гидрофобные вещества, а в каких — гидрофильные? Какие растворители вам известны?
Гидрофильные вещества легко разрушается в воде, гидрофобные — в бензине или в бензоле.
Вопрос 9.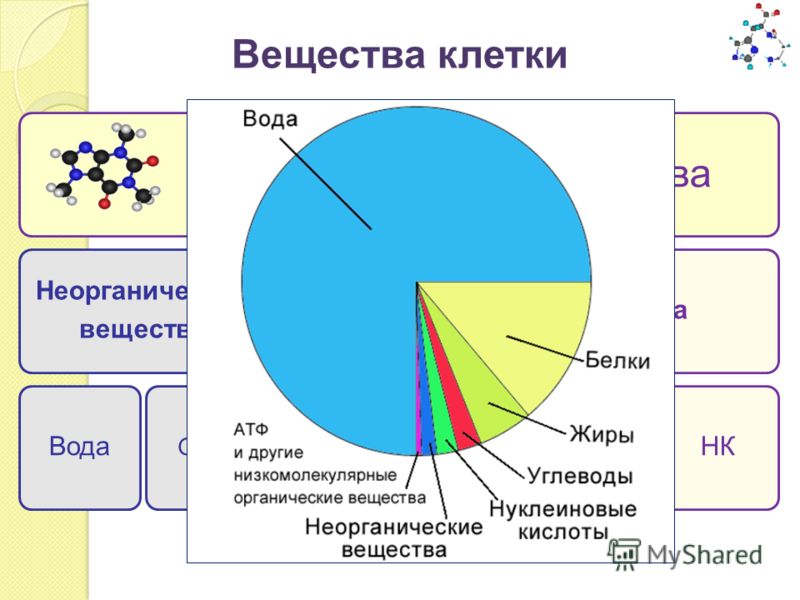 Используя интернет — ресурсы и другие источники информации, найдите сведения о значении для организма следующих элементов: В, Р, S, Са, Мn, Fe, Со, Zn, Сu. Ответ оформите в виде таблицы.
Используя интернет — ресурсы и другие источники информации, найдите сведения о значении для организма следующих элементов: В, Р, S, Са, Мn, Fe, Со, Zn, Сu. Ответ оформите в виде таблицы.
Вопрос 10. Прочитайте статью «Сахар против льда» и на основе анализа полученной информации предложите свои способы борьбы с гололёдом на дорогах.
При повышении безопасности дорожного движения в снежное время года, мы не должны забывать об экологической обстановке.
Сахар — это интересно, экологично, но скорее всего дорого.
Учитывая все недостатки при использовании соли и солевых растворов, связанных с их негативным воздействием на окружающую среду, наиболее целесообразным является способ предупреждения образования гололеда за счет создания покрытий автомобильных дорог, обладающих противо — гололедными свойствами, что делает возможным механическое удаление снежно — ледяных отложений снегоуборочной техникой и исключения отрицательного воздействия химических реагентов на окружающую среду.
1. К одному из способов образования антигололедных покрытий, разработанному в Словакии, относится «Соленый бетон». Антигололедная добавка с рабочим названием «Соленый бетон» представляет собой обработанные кристаллы против гололедного вещества (NaCl), введенные в минеральную часть асфальтобетона. Минеральная оболочка соли (NaCl) формируется из цемента, мелкозернистого известнякового порошка и дробленого песка. Введение добавки в количестве около 10 % по массе минерального материала является достаточным для достижения желаемого эффекта. При температуре около — 4°С небольшое количество соли (приблизительно 1 %) расплавляет тонкие слои снега. При температуре более низкой (ниже — 4°С) плотность льда нарушается; лед ломается и удаляется с поверхности дороги под действием колес транспортных средств. Если температура особенно низкая ( — 10°С), эффект «Соленого бетона» снижается, но сохраняется возможность достаточно простой очистки поверхности дороги с использованием дорожной щетки и отвала.
2. В Уральском государственном лесотехническом университете (УГЛТУ) для повышения противогололедных свойств асфальтобетона разработан кремнийорганический модификатор МПА — 130, не содержащий хлоридов. Устройство верхнего антигололедного слоя дорожного покрытия на основе гидрофобизирующего модификатора, не содержащего хлоридов, на автомобильных дорогах позволит вести активную борьбу с гололедом, благодаря чему повысится коэффициент сцепления колес автомобилей с дорожным покрытием и будет обеспечена нормальная работа транспорта. Кроме того, применение таких покрытий позволит улучшить экологическую обстановку придорожной полосы за счет отказа от применения хлоридов.
Вопрос 11. Уникальные свойства воды определяются в том числе существованием между её молекулами водородных связей. Возможно ли существование таких связей между молекулами других веществ?
Механизм возникновения водородной связи — частично электростатический и частично донорно — акцепторный.
Характерной чертой водородной связи является расстояние между атомом водорода и другим атомом, её образующим. Оно должно быть меньше, чем сумма радиусов этих атомов.
Межмолекулярная водородная связь образуется между молекулами веществ, в состав которых входят водород и сильно электроотрицательный элемент — фтор, кислород, азот, хлор, сера. Сильно смещенная общая электронная пара от водорода к атому отрицательно заряженного элемента, при этом положительный заряд водорода сконцентрирован в малом объеме, приводит взаимодействие протона с неподеленной электронной парой другого атома или иона, обобществляя её.
Водородную связь обозначают точками, указывая, что она намного слабее ковалентной связи (примерно в 15 — 20 раз).
Межмолекулярная водородная связь: две молекулы воды и две молекулы уксусной кислоты с образованием циклической структуры
Вопрос 12. Что произойдёт с клеткой, если концентрации ионов К+, Na+ и Са2+ выровняются и будут одинаковыми как вне, так и внутри её?
От концентрации солей внутри и снаружи клетки зависят буферные свойства цитоплазмы клетки.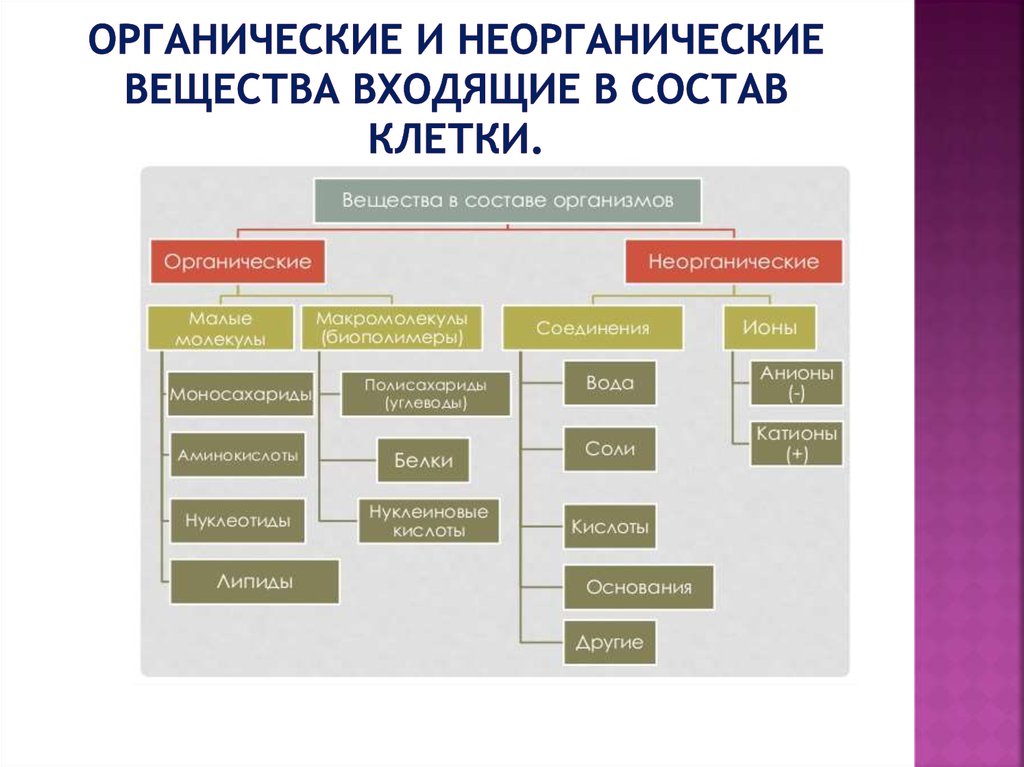 Буферностью называют способность клетки сохранять определенную концентрацию водородных ионов (рН). В клетке поддерживается слабощелочная реакция (рН 7,2). Пока клетка жива, эти различия в концентрации К+ и Na+ между клеткой и межклеточной средой стойко удерживаются. Если концентрации ионов К+, Na+ и Са2+ выровняются и будут одинаковыми как вне, так и внутри её, клетка просто умрет.
Буферностью называют способность клетки сохранять определенную концентрацию водородных ионов (рН). В клетке поддерживается слабощелочная реакция (рН 7,2). Пока клетка жива, эти различия в концентрации К+ и Na+ между клеткой и межклеточной средой стойко удерживаются. Если концентрации ионов К+, Na+ и Са2+ выровняются и будут одинаковыми как вне, так и внутри её, клетка просто умрет.
Вопрос 13. Используя доступные информационные источники, уточните, какие условия проведения эксперимента в естественных науках (давление, температура и др.) считаются нормальными. Обсудите с учителем и одноклассниками, почему при нормальных условиях вода (Н20) — это жидкость, а сероводород (h3S) — газ.
Нормальные условия — стандартные физические условия, с которыми обычно соотносят свойства веществ (при нормальных условиях, при н. у., англ. Standard temperature and pressure, STP). Нормальные условия определены IUPAC (Международным союзом чистой и прикладной химии) следующим образом:
Атмосферное давление 101325 Па = 760 мм рт. ст.
ст.
Температура воздуха 273,15 K = 0° C.
При нормальных условиях объём 1 моля идеального газа составляет 22,413 996(39) дм³ (молярный объём идеального газа), а количество молекул в 1 см³ составляет 2,686 7774(47)×1019 (постоянная Лошмидта).
Также в справочниках в качестве стандартных условий может указываться температура 298 K, либо +25 °С (298,15 К). Однако такая температура не установлена IUPAC в качестве стандартной, поэтому при использовании справочных данных всякий раз необходимо уточнять, при каких значениях приводятся величины.
Например, Национальный институт стандартов и технологий США (англ. National Institute of Standards and Technology, NIST) использует температуру +20 °C (293,15 K) и давление 101 325 Па (1 атм).
Вода (Н20) — это жидкость, а сероводород (h3S) — газ. Электроотрицательность кислорода выше, чем серы, электронная плотность в молекуле воды более смещена от водорода к кислороду, чем от водорода к сере, в молекуле сероводорода.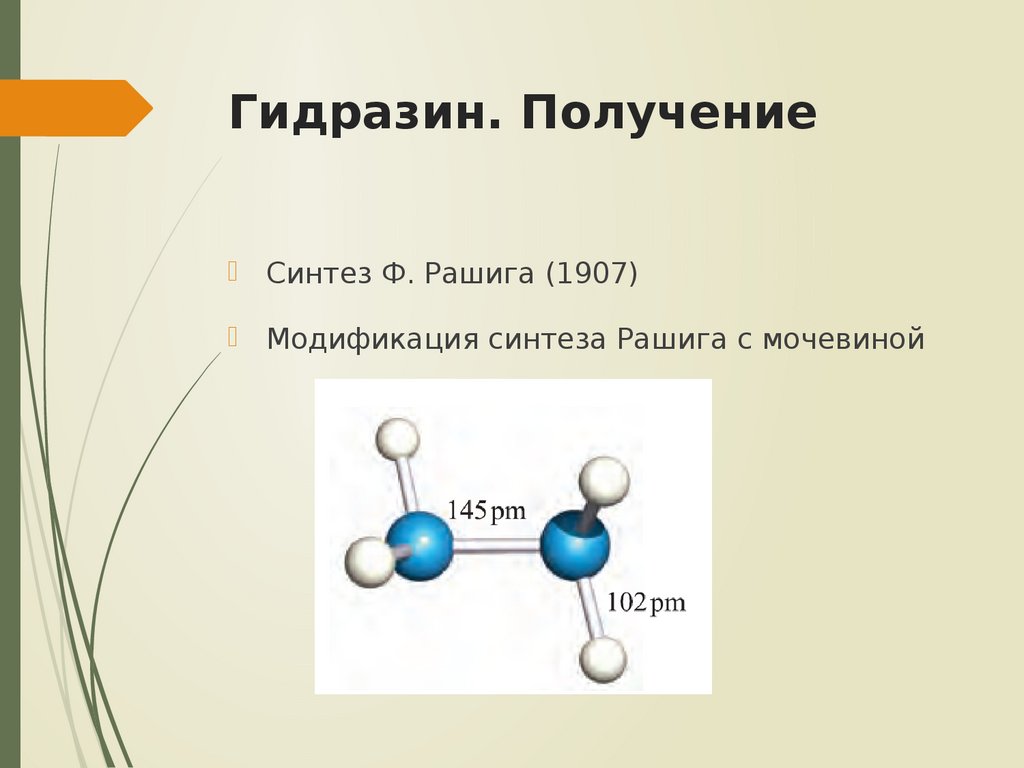 Молекулы воды образуют между собой прочные водородные связи. В сероводороде водородные связи очень слабые. Поэтому вода при комнатной температуре жидкость, а сероводород — газ.
Молекулы воды образуют между собой прочные водородные связи. В сероводороде водородные связи очень слабые. Поэтому вода при комнатной температуре жидкость, а сероводород — газ.
Или такой ответ, сформулированный иначе: кислород более электроотрицательный элемент, чем сера. Поэтому между молекулами воды возникают более прочные водородные связи, чем между молекулами сероводорода, разрыв этих связей, необходимый для перехода воды в газообразное состояние, требует значительной затраты энергии, что и приводит к аномальному повышению температуры кипения воды.
6. Неорганические вещества клетки. Биология. Общая биология. 10 класс. Базовый уровень
6. Неорганические вещества клетки
Вспомните!
Что такое неорганические вещества?
Какими физическими и химическими свойствами обладает вода?
Что называют ионами, анионами и катионами?
Значительная часть соединений, входящих в состав клетки, встречается в больших количествах только в живой природе. Это органические вещества. Однако есть соединение, которое одинаково характерно как для живой, так и для неживой природы. Это вода (рис. 9).
Это органические вещества. Однако есть соединение, которое одинаково характерно как для живой, так и для неживой природы. Это вода (рис. 9).
Вода. Считается, что миллиарды лет тому назад в первичном океане на нашей планете зародилась жизнь и вся дальнейшая эволюция природы была неразрывно связана с водой. Уникальные свойства этой относительно небольшой молекулы позволили нашей планете стать такой, какая она есть сейчас. Все жители Земли, растения и животные, грибы и бактерии, обязаны воде жизнью. В чём же заключается особенность этого вещества?
Молекула воды – это диполь, т. е. на одной стороне молекулы сосредоточен частичный положительный заряд, а на другом конце – частичный отрицательный (рис. 10). Именно эта особенность строения молекулы воды определяет её свойство универсального растворителя. Любые вещества, имеющие заряженные группы, растворяются в воде (рис. 11). Такие соединения называют гидрофильными (от греч. hydros – вода и phileo – люблю). Большинство веществ, присутствующих в клетке, относится к этой группе, например соли, аминокислоты, сахара, белки, простые спирты. Когда вещество переходит в раст вор, его реакционная способность увеличивается. Однако есть соединения, которые в воде растворяются очень плохо или вовсе не растворяются. Такие вещества называют гидрофобными (от греч. hydros – вода и phobos – страх), к ним относятся, в частности, жиры (липиды), жироподобные вещества (липоиды), полисахариды и некоторые белки.
hydros – вода и phileo – люблю). Большинство веществ, присутствующих в клетке, относится к этой группе, например соли, аминокислоты, сахара, белки, простые спирты. Когда вещество переходит в раст вор, его реакционная способность увеличивается. Однако есть соединения, которые в воде растворяются очень плохо или вовсе не растворяются. Такие вещества называют гидрофобными (от греч. hydros – вода и phobos – страх), к ним относятся, в частности, жиры (липиды), жироподобные вещества (липоиды), полисахариды и некоторые белки.
Рис. 9. Вещества, входящие в состав живых организмов
Рис. 10. Диполь. Схематичное изображение молекулы воды
Рис. 11. Растворение в воде хлорида натрия
Большинство процессов, которые протекают внутри клетки, могут осуществляться только в водной среде. Но вода не только обеспечивает условия химических реакций, она сама участвует во многих метаболических процессах. В реакциях гидролиза[1] белки расщепляются до аминокислот, а крахмал – до глюкозы. Высвобождение энергии в организме происходит при взаимодействии с водой главной энергетической молекулы – АТФ. Вода участвует в реакциях фотосинтеза и в синтезе АТФ в митохондриях.
В реакциях гидролиза[1] белки расщепляются до аминокислот, а крахмал – до глюкозы. Высвобождение энергии в организме происходит при взаимодействии с водой главной энергетической молекулы – АТФ. Вода участвует в реакциях фотосинтеза и в синтезе АТФ в митохондриях.
Отрицательные и положительные полюсы разных молекул воды притягиваются друг к другу, что приводит к образованию водородных связей. Наличие этих связей придаёт воде структурированность, что объясняет многие её необычные свойства: высокую температуру кипения, плавления, высокую теплоёмкость.
Сочетание высокой теплоёмкости и теплопроводности делает воду идеальной жидкостью для поддержания теплового равновесия. Тепло быстро и равномерно распределяется между всеми частями организма.
Рис. 12. Уменьшение количества воды в клетках приводит к увяданию растений
Высокая интенсивность испарения приводит к быстрой потере тепла и предохраняет от перегрева: испарение у растений и потоотделение у животных являются защитными реакциями и позволяют при минимальной потере воды существенно снизить температуру тела.
Практически полная несжимаемость воды обеспечивает поддержание формы клетки (рис. 12), а вязкость придаёт воде свойства смазки.
Высокая сила поверхностного натяжения воды обеспечивает восходящий и нисходящий транспорт веществ в растениях и движение крови в капиллярах. Многие мелкие организмы легко удерживаются и передвигаются по поверхности воды благодаря наличию плёнки поверхностного натяжения.
Полость тела круглых червей заполнена жидкостью, находящейся под давлением и образующей гидроскелет, что придаёт этим организмам постоянную форму. Свойство несжимаемости воды используется медузами, чьё тело на 95 % состоит из этого вещества.
Жидкость в подчерепном пространстве предохраняет от сотрясения головной мозг, а околоплодные воды в матке защищают и поддерживают плод у млекопитающих.
Жидкость в околосердечной сумке – перикарде – облегчает движения сердца при его сокращениях, а в плевральной полости снижает трение при дыхании.
Благодаря высокому тургорному давлению растительные ткани обладают упругостью, а стебли травянистых растений поддерживают вертикальное положение.
Соли. Важную роль в жизнедеятельности клетки играют минеральные соли, представленные в основном катионами калия (K+), натрия (Na+), кальция (Ca2+), магния (Mg2+) и анионами соляной (Сl–), угольной (HCO3–), фосфорной (HPO42–, H2PO4–) и некоторых других кислот. Многие ионы неравномерно распределены между клеткой и окружающей средой, так, например, в цитоплазме концентрация ионов калия в 20–30 раз выше, чем снаружи, а концентрация ионов натрия внутри клетки, наоборот, в 10 раз ниже. Именно благодаря существованию подобных градиентов концентраций осуществляются многие важные процессы жизнедеятельности, такие как возбуждение нервных клеток, сокращение мышечных волокон. После гибели клетки концентрация катионов снаружи и внутри быстро выравнивается.
Анионы слабых кислот (HCO3–, HPO42–) участвуют в поддержании кислотно-щелочного баланса (рН) клетки. Анионы фосфорной кислоты необходимы для синтеза нуклеотидов и нуклеиновых кислот.
Минеральные соли в живых организмах находятся не только в виде ионов, но и в твёрдом состоянии. Кости нашего скелета в основном состоят из фосфатов кальция и магния. Раковины моллюсков формируются из карбоната кальция.
Вопросы для повторения и задания
1. Каковы особенности пространственной организации молекул воды, обусловливающие её биологическое значение?
2. В чём заключается биологическая роль воды?
3. Какие вещества называют гидрофильными; гидрофобными? Приведите примеры.
4. Какие вещества поддерживают pH клетки на постоянном уровне? Объясните, почему жизнедеятельность клетки возможна только при определённом значении pH.
5. Расскажите о роли минеральных солей в жизнедеятельности клетки.
Расскажите о роли минеральных солей в жизнедеятельности клетки.
Подумайте! Выполните!
1. Почему при работе в горячих цехах для утоления жажды рекомендуют пить минеральную или подсоленную воду?
2. Известно, что ионный состав внутреннего содержимого клетки имеет большое сходство с ионным составом морской воды. Какой вывод можно из этого сделать?
3. Как изменяется количество воды в теле человека с возрастом?
4. Вспомните из курса биологии растений, какие структуры покровной ткани растений обеспечивают испарение воды. Каков принцип их работы?
5. Выполните исследовательскую работу «Изучение процесса осмоса в растительных клетках». Исследуйте влияние гипо– и гипертонических растворов на мембрану типичной вакуолизированной растительной клетки.
Работа с компьютером
Обратитесь к электронному приложению. Изучите материал и выполните задания.
Повторите и вспомните!
Растения
Поглощение корнями воды и минеральных веществ. Большая часть воды с растворёнными в ней минеральными веществами поглощается корнем с помощью корневых волосков в зоне всасывания. Всасывание воды происходит пассивно, посредством осмоса, так как концентрация осмотически активных веществ (минеральных солей и органических веществ) в клетках корня больше, чем в почвенном растворе. Интенсивность поглощения воды корневыми волосками называют сосущей силой (S). Она равна разнице между осмотическим (P) и тургорным (T) давлением: S = P – T. Когда осмотическое давление равно тургорному (P = T), то S = 0 и вода перестаёт поступать в корневой волосок. Если же концентрация веществ в почвенном растворе будет выше, чем внутри клеток корня, то вода будет выходить из клеток и растение завянет (см. рис. 12). Такое явление наблюдается при засухе или при неумеренном внесении удобрения в почву.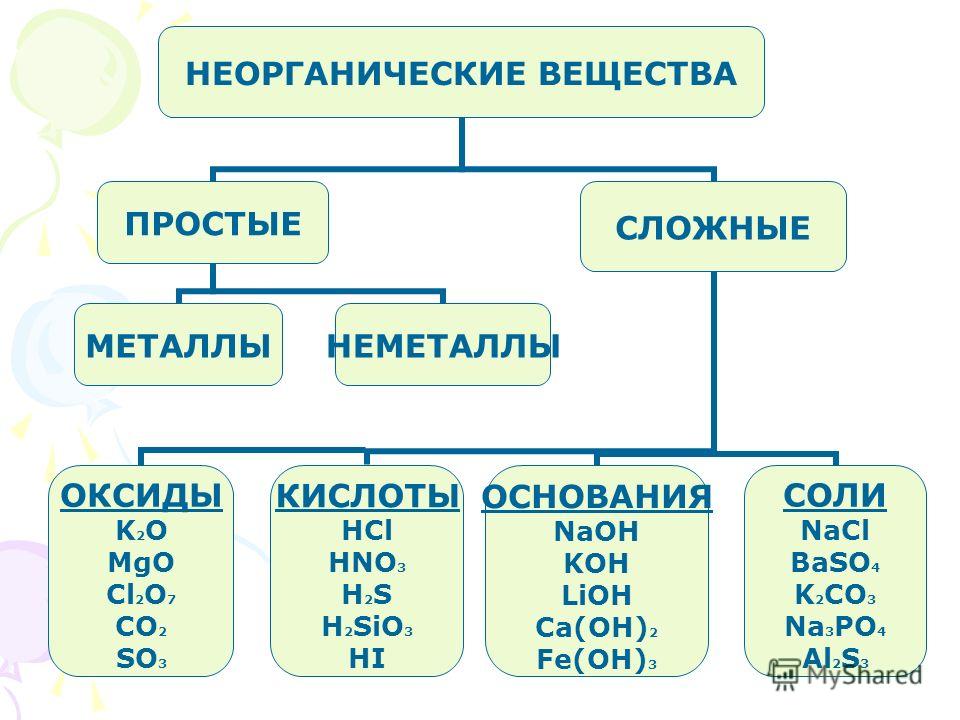
Животные
Первично– и вторичноводные животные. Кроме систематического деления на классы, подтип Позвоночные обычно условно подразделяют ещё на две группы, не имеющие таксономического значения: первичноводные (анамнии) и первичноназемные (амниоты). Жизнь и размножение животных, относящихся к анамниям, неразрывно связаны с водой. В качестве органов дыхания у них в течение всей жизни или на личиночной стадии функционируют жабры. При развитии оплодотворённой яйцеклетки не образуются защитные зародышевые оболочки. К этой группе относят классы Круглоротые, Хрящевые рыбы, Костные рыбы, Земноводные.
Размножение первичноназемных животных не связано с водой. Жаберного дыхания нет ни на одной из жизненных стадий. При развитии зародыша формируются зародышевые оболочки. К группе амниот относят классы Пресмыкающиеся, Птицы, Млекопитающие.
Вторичноводными называют амниот, которые вернулись к обитанию в воде. Такими животными, например, являются китообразные, которые полностью перешли к водному образу жизни.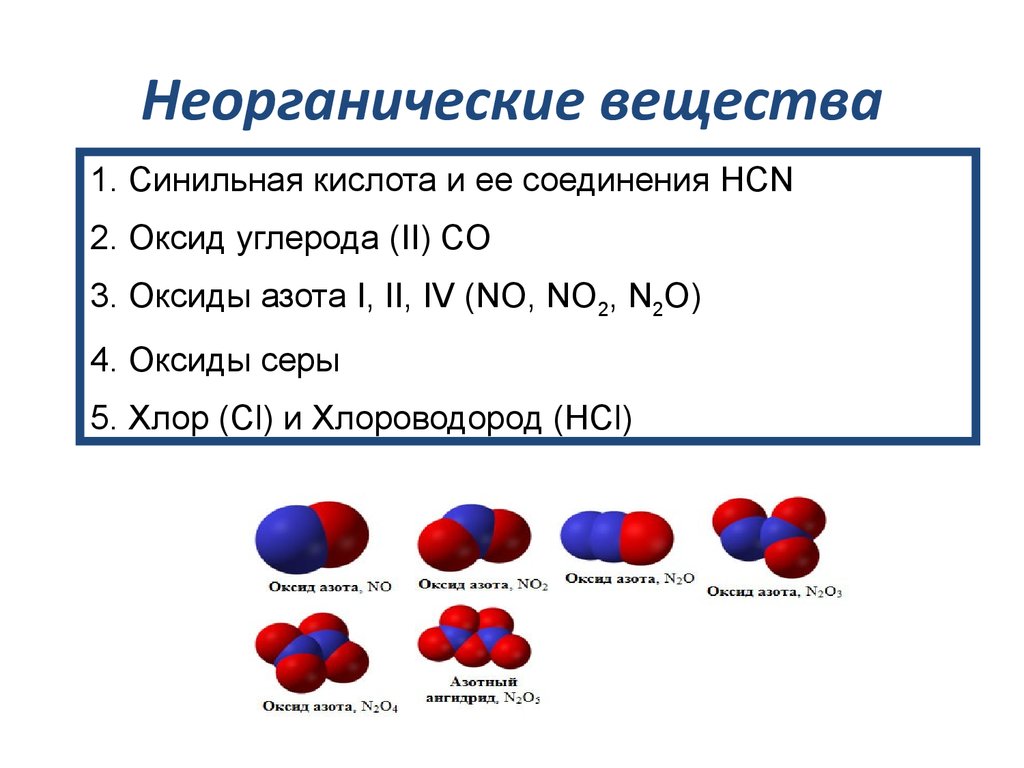 Их передние конечности превратились в ласты, задние – редуцированы.
Их передние конечности превратились в ласты, задние – редуцированы.
Человек
Водный и минеральный обмены. Ткани взрослого человека содержат в среднем до 60 % воды. В сутки организм человека теряет около 2,0–2,5 л воды. В составе мочи выводится 1,2–1,5 л, с потом – около 0,5–0,7 л, с парами воздуха через лёгкие – 0,3–0,5 л, через кишечник с калом – около 0,1 л. Столько же воды в сумме организм получает с питьём (1,0 л) и пищей (1,0 л), а часть воды образуется при обмене белков, жиров, углеводов (0,3–0,4 л). Для нормальной жизнедеятельности важно, чтобы поступление воды полностью покрывало её расход. Отношение количества потреблённой воды к количеству выделенной называют водным балансом. Обезвоживание организма приводит к быстрой гибели, без воды человек может прожить не более 5–6 дней. Однако обильное избыточное питьё тоже вредно, оно повышает нагрузку на организм и нарушает работу сердца и почек.
Минеральные соли поступают в организм человека с пищей и водой.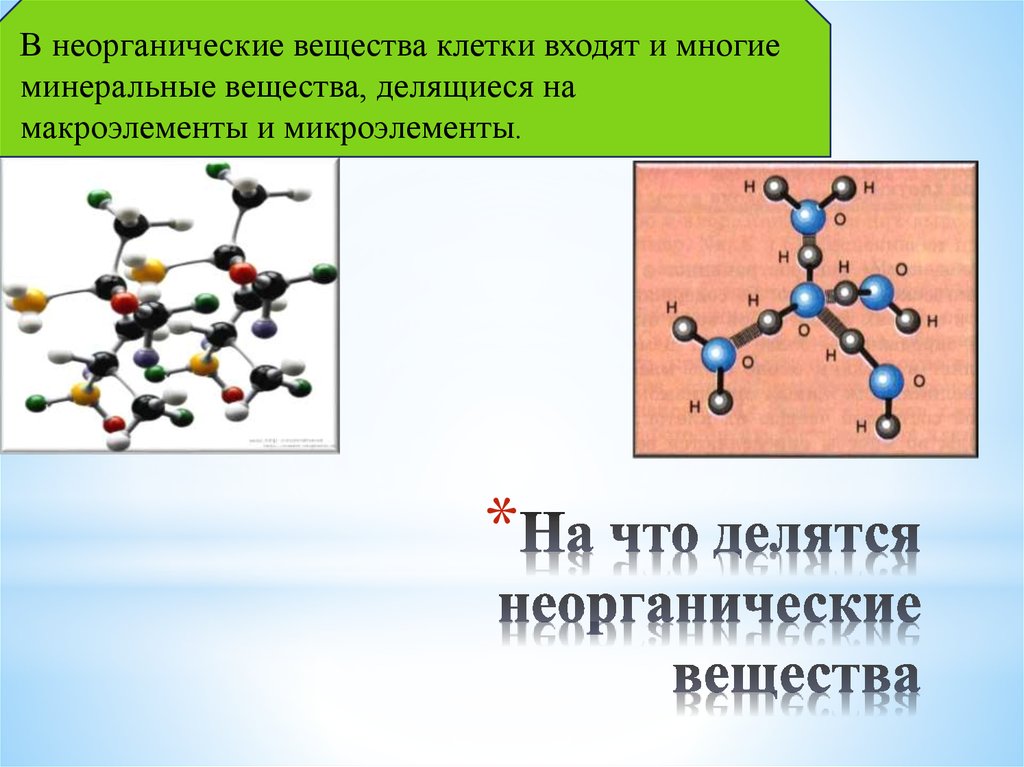 И хотя они составляют не более 4 % от массы тела, набор их очень разнообразен. В сутки в организм человека должно поступать не менее 4,4 г натрия, 5 г хлора, 2 г калия, 1 г кальция, 1 г фосфора, 0,2 г железа. Из различных минеральных солей специально в пищу мы добавляем только поваренную соль (NaCl), около 10 г в сутки. Все остальные минеральные соли содержатся в натуральных продуктах. Вода и растворённые в ней минеральные соли всасываются по всему желудочно-кишечному тракту, но больше всего в тонком кишечнике.
И хотя они составляют не более 4 % от массы тела, набор их очень разнообразен. В сутки в организм человека должно поступать не менее 4,4 г натрия, 5 г хлора, 2 г калия, 1 г кальция, 1 г фосфора, 0,2 г железа. Из различных минеральных солей специально в пищу мы добавляем только поваренную соль (NaCl), около 10 г в сутки. Все остальные минеральные соли содержатся в натуральных продуктах. Вода и растворённые в ней минеральные соли всасываются по всему желудочно-кишечному тракту, но больше всего в тонком кишечнике.
Данный текст является ознакомительным фрагментом.
5.2. Биологический взрыв и нехватка вещества
5.2. Биологический взрыв и нехватка вещества
Одной из важных черт жизни является способность к рождению себе подобных, которые также могут размножаться, давая новые единицы, способные к размножению, и т.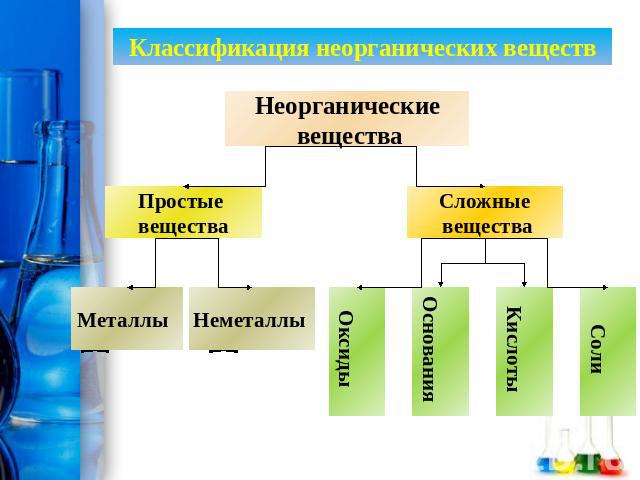 д. Это и есть известное явление автокатализа в физике, химии, при
д. Это и есть известное явление автокатализа в физике, химии, при
Микробы вырабатывают красящие вещества
Микробы вырабатывают красящие вещества
Интересно наблюдать колонии микроорганизмов в чашке Петри. Пытливый глаз человека различит здесь множество разнообразных цветовых оттенков. Колонии грибов, например, могли бы быть поставщиками красящих веществ, как самая
Клетки-коллективисты и клетки-одиночки
Клетки-коллективисты и клетки-одиночки
В основе тесной кооперации клеток, входящих в состав многоклеточного организма, лежат по меньшей мере две важнейшие причины. Во-первых, каждая отдельно взятая клетка, будучи сама по себе на редкость умелым и исполнительным
КЛЕТОЧНОЕ СТРОЕНИЕ ОРГАНИЗМОВ СТРОЕНИЕ КЛЕТКИ. ПРИБОРЫ ДЛЯ ИССЛЕДОВАНИЯ СТРОЕНИЯ КЛЕТКИ
КЛЕТОЧНОЕ СТРОЕНИЕ ОРГАНИЗМОВ СТРОЕНИЕ КЛЕТКИ. ПРИБОРЫ ДЛЯ ИССЛЕДОВАНИЯ СТРОЕНИЯ КЛЕТКИ
ПРИБОРЫ ДЛЯ ИССЛЕДОВАНИЯ СТРОЕНИЯ КЛЕТКИ
1. Выберите один наиболее правильный ответ.Клетка – это:A. Мельчайшая частица всего живогоБ. Мельчайшая частица живого растенияB. Часть растенияГ. Искусственно созданная единица для
Минеральные вещества и витамины
Минеральные вещества и витамины
Для нашего питания необходимы и некоторые другие вещества. Кости и зубы человека состоят в основном из фосфата кальция, поэтому в пище должны содержаться и фосфор и кальций. Больше всего их в молоке и сыре. В последнее время в
Оборонные вещества — аминоны
Оборонные вещества — аминоны
Жук-бомбардир — настоящий артиллерист. Он стреляет едкой жидкостью, которая, словно снаряд из миниатюрной пушки, вылетает из заднего конца его брюшка и мгновенно превращается в небольшой клуб ядовитого «дыма» — точно шрапнель разорвалась!
Гормоны мозгового вещества надпочечников
Гормоны мозгового вещества надпочечников
В мозговом веществе надпочечников в хромаффинных клетках синтезируются катехоламины – дофамин, адреналин и норадреналин.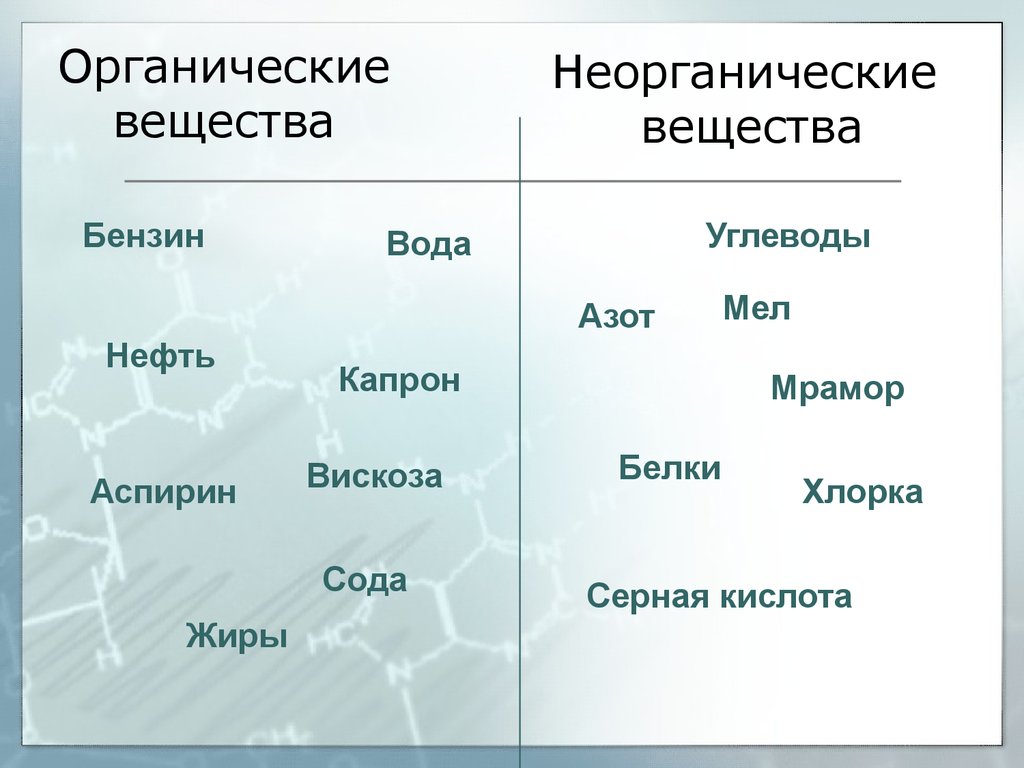 Непосредственным предшественником катехоламинов является тирозин. Норадреналин образуется также в
Непосредственным предшественником катехоламинов является тирозин. Норадреналин образуется также в
10.2. Геохимическая работа живого вещества
10.2. Геохимическая работа живого вещества
Более 99 % энергии, поступающей на поверхность Земли, составляет излучение Солнца. Эта энергия растрачивается в громадном большинстве физических и химических процессов в гидросфере, атмосфере и литосфере: перемешивании воздушных
ГЛАВА VIII. ТАИНСТВЕННЫЕ ВЕЩЕСТВА
ГЛАВА VIII. ТАИНСТВЕННЫЕ ВЕЩЕСТВА
«Пагуба моряков»
Среди бурунов.
Зноя и тумана
Скрипели и звенели паруса,
Раскатывался окрик капитана,
И таяли матросов голоса.
Был долог путь,
Вспененный и упорный.
Меж низких звезд
И оголенных вод…
Эд. Багрицкий
Многие морские
6. Неорганические вещества клетки
6. Неорганические вещества клетки
Неорганические вещества клетки
Вспомните!Что такое неорганические вещества?Какими физическими и химическими свойствами обладает вода?Что называют ионами, анионами и катионами?Значительная часть соединений, входящих в состав клетки, встречается в больших
8. Органические вещества. Углеводы. Белки
8. Органические вещества. Углеводы. Белки
Вспомните!Какие вещества называют биологическими полимерами?Каково значение углеводов в природе?Назовите известные вам белки. Какие функции они выполняют?Углеводы (сахара). Это обширная группа природных органических
ПСИХОТРОПНЫЕ ВЕЩЕСТВА
ПСИХОТРОПНЫЕ ВЕЩЕСТВА
Термин «психотропный» использовался в учебном курсе как синоним более строгого термина «психодислептический». Психотропные вещества способны изменять психологию человека и влиять на умственную деятельность. Их получают либо из определенных
Их получают либо из определенных
Химические загрязнители — Набор инструментов для питьевой воды
Химические вещества необходимы для повседневной жизни и выживания человека, но слово «химический» несет в себе некоторые негативные коннотации, выходящие за рамки науки.
ХИМИЧЕСКИЕ ЭЛЕМЕНТЫ
Химические вещества широко ассоциируются с гербицидами, пестицидами, фармацевтическими препаратами и другими химическими продуктами. Эти продукты часто связаны с ухудшением состояния окружающей среды и иногда оказывают неблагоприятное воздействие на здоровье человека. В результате у нас возникает социальная неприязнь или защитная реакция на слово «химический».
Важно понимать, что мы сталкиваемся с химическими веществами в каждый момент каждого дня и что некоторые из них могут оказывать полезное воздействие. Крайне важно анализировать нюансы химического загрязнения, например, какие химические вещества вредны, в каком объеме они вредны и как долго человек может подвергаться непосредственному воздействию химического вещества, прежде чем оно вызовет неблагоприятные последствия для здоровья.
Когда мы проверяем загрязнение воды, мы проверяем «вредные концентрации» химического вещества; не весь состав.
НЕОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ
Слово «неорганический» не означает, что химическое соединение является синтетическим или созданным человеком. Большая часть Земли неорганическая!
Неорганические соединения — это существующие в природе соединения, которые можно найти в земных слоях воды и горных пород. Мы называем эти соединения неорганическими просто потому, что они не содержат элементы, встречающиеся в живых организмах (например, углерод и водород).
Одно из наиболее часто встречающихся неорганических соединений хлорид натрия, или поваренная соль, добывается из-под земли и используется в повседневной кулинарии.
Большинство источников воды содержат следовые количества неорганических соединений. Тем не менее, неорганические соединения могут оказывать неблагоприятное воздействие на здоровье человека при превышении рекомендованного с пищей количества подземных вод.
Неблагоприятное воздействие чрезмерного потребления на здоровье может повлиять на печень, почки, нервную систему, систему кровообращения, кровь, желудочно-кишечный тракт, кости или кожу в зависимости от неорганического соединения и уровня воздействия. Повышенное содержание неорганических соединений может привести к опасному загрязнению питьевой воды.
ПОЛЕЗНО ЗНАТЬ
Самородная медь является одним из немногих металлических элементов, которые могут существовать в чистом, элементарном виде. Полуостров Кевино, расположенный на Верхнем полуострове Мичигана, является домом для самой большой концентрации месторождений самородной меди в мире!
ТАБЛИЦА ХИМИЧЕСКИХ ЗАГРЯЗНЕНИЙ
| Химикаты | Возникающий интерес | Возникающие проблемы |
|---|---|---|
| Мышьяк (As) Химический элемент | Пользователи частных колодцев наиболее уязвимы к загрязнению мышьяком, поскольку их источником являются подземные воды, поэтому они восприимчивы к мобилизации геохимического мышьяка. Исследователи должны изучить источник мышьяка и механизм его попадания в грунтовые воды, чтобы защитить пользователей частных колодцев. Исследователи должны изучить источник мышьяка и механизм его попадания в грунтовые воды, чтобы защитить пользователей частных колодцев. | Внесенные человеком изменения в местную гидрографию помогают растворить мышьяк в грунтовых водах, которые затем перекачиваются для получения питьевой воды. В результате уровни мышьяка в системе водоснабжения могут оказаться ядовитыми для человека. |
| Медь (Cu) Химический элемент | В медицинской литературе наблюдается растущий интерес к связи между потреблением неорганической меди и когнитивными заболеваниями и нарушениями. В научных исследованиях интоксикации медью у людей исследования показали, что дисбаланс меди в головном мозге прямо или косвенно связан с развитием болезни Паркинсона, болезни Альцгеймера, ацерулоплазминемии, болезни Менкеса, бокового амиотрофического склероза, болезни Хантингтона, синдрома затылочного рога и Прионовая болезнь. В настоящее время экспериментальные результаты хронического воздействия меди на крыс указывают на то, что необходимо провести дополнительные исследования, чтобы точно определить безопасные выравниватели меди для потребления человеком в питьевой воде. | Существует давняя озабоченность по поводу агрессивной воды и повышенного содержания меди в домашних водопроводных системах. Распространенным индикатором коррозионной активности воды является наличие сине-зеленых пятен на соединениях медных труб или на входе крана. |
| Фтор (F-) Неорганическое соединение | Растет объем научной литературы, в которой предполагается, что потребление фтора может быть связано с неблагоприятными последствиями для здоровья. Сообщается, что длительное и высокое воздействие фтора связано с осложнениями со стороны щитовидной железы, развивающимся мозгом, остеосаркомой и другими состояниями костей, такими как флюороз скелета. | Фтор был намеренно добавлен во многие источники питьевой воды из-за положительной связи между фтором и предотвращением кариеса. Однако многие считают, что практика преднамеренного фторирования объектов коммунального хозяйства имеет минимальную пользу, особенно учитывая возникающие риски для здоровья, связанные с высоким потреблением фтора. |
| Свинец (Pb) Химический элемент | После расследования причин водного кризиса во Флинте коррозия свинцовых трубопроводов подозревается в том, что они являются основным фактором загрязнения питьевой воды свинцом. В результате Агентство по охране окружающей среды рассматривает эффективность и правдоподобность национальной программы замены ведущей сервисной линии. | При употреблении воды, загрязненной свинцом, содержащийся в воде свинец попадает в кровоток и вызывает повышение уровня свинца в крови, что может привести к отравлению свинцом. Поскольку свинец является нейротоксином, он может оказывать пагубное влияние на многие процессы развития, такие как поведение, интеллект и общие жизненные достижения. |
| Радон (Rn) Химический элемент | Как правило, радон воздействует исключительно на частные колодцы, потому что общественные системы питьевой воды аэрируют воду во время процессов очистки, и растворенный радон выбрасывается в атмосферу. В настоящее время из-за дебатов, связанных с определением радона, методов измерения в питьевой воде и параметров здоровья, EPA еще не установило максимальный уровень загрязнения радоном. В настоящее время из-за дебатов, связанных с определением радона, методов измерения в питьевой воде и параметров здоровья, EPA еще не установило максимальный уровень загрязнения радоном. | Смягчение содержания радона в государственных и частных подземных водах различаются в зависимости от их соответствующей распределительной сети. Поскольку во время очистки системы водоснабжения общего пользования аэрируются, повторное попадание радона в питьевую воду маловероятно. Напротив, частные запасы подземных вод, используемые для частных колодцев, более уязвимы для радона, потому что вода очищается от радона только в точке входа (где вода поступает в дом из колодца), если вообще очищается. |
| Соль (NaCl) Неорганическое соединение | В настоящее время Закон о безопасной питьевой воде еще не установил максимальный уровень загрязнения для хлорида натрия (соли). В 1998 году EPA опубликовало первое издание своего Списка загрязнителей питьевой воды, для которого должны быть установлены максимальные уровни загрязнения, а натрий был назван загрязнителем питьевой воды.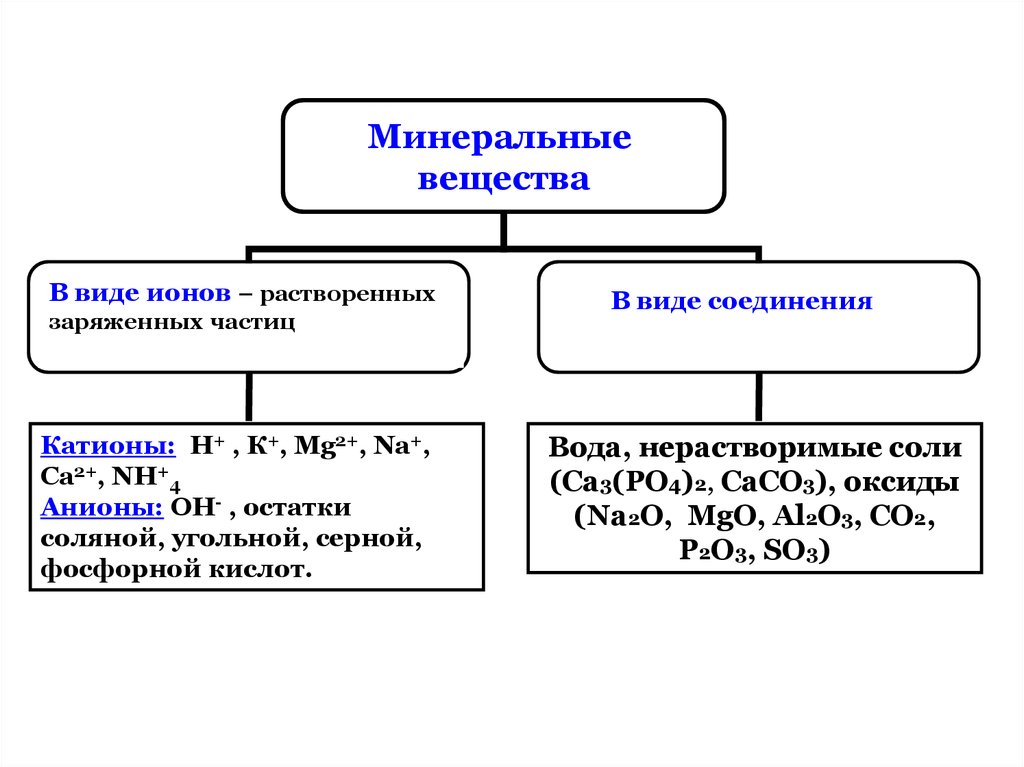 Однако в последующих изданиях (2005, 2009, 2016) натрий был полностью исключен из списка из-за предположения, что большая часть потребляемой человеком соли поступает с пищей. Однако в последующих изданиях (2005, 2009, 2016) натрий был полностью исключен из списка из-за предположения, что большая часть потребляемой человеком соли поступает с пищей. | В то время как в питьевой воде естественным образом содержится здоровое количество натрия и хлорида, такие источники, как дорожная соль, промышленные отходы, сточные воды, удобрения, умягчители воды и близость к соленой воде, обычно могут вызывать всплеск соли в питьевой воде. Хотя воздействие соли беспокоит не каждого человека, оно может быть весьма опасным для людей, придерживающихся диеты с низким содержанием натрия, особенно для людей с определенными заболеваниями сердца, сердечно-сосудистыми заболеваниями или заболеваниями почек или циррозом печени. |
| Селен (Se) Химический элемент | Селен играет важную роль в работе мозга как антиоксидант. При этом длительное воздействие высоких уровней неорганического селена широко упоминается как фактор развития неврологических заболеваний. В нескольких долгосрочных исследованиях была предпринята попытка установить связь между длительным потреблением неорганического селена в питьевой воде и БАС. Основываясь на эпидемиологических данных, эти исследования пришли к выводу, что длительное воздействие следовых количеств селена может оказывать токсическое действие на двигательные нейроны, способствуя тем самым развитию БАС. Однако, поскольку патогенез БАС остается предметом научных дискуссий, факторы окружающей среды и образа жизни, способствующие развитию заболевания, остаются спорными. В нескольких долгосрочных исследованиях была предпринята попытка установить связь между длительным потреблением неорганического селена в питьевой воде и БАС. Основываясь на эпидемиологических данных, эти исследования пришли к выводу, что длительное воздействие следовых количеств селена может оказывать токсическое действие на двигательные нейроны, способствуя тем самым развитию БАС. Однако, поскольку патогенез БАС остается предметом научных дискуссий, факторы окружающей среды и образа жизни, способствующие развитию заболевания, остаются спорными. | Как и в случае с солью, селен входит в наш повседневный рацион. В результате трудно провести различие между источниками дисбаланса селена. Токсичные концентрации селена обычно выбрасываются в окружающую среду из-за плохой дренажной практики при промышленной плавке на железных рудниках. Хвостохранилища и отвалы для хранения пустой породы являются необходимыми компонентами операций по добыче железа. При безответственном управлении методами дренажа неожиданные ливневые и талые воды могут удалять встречающиеся в природе вещества, в том числе селен, из хвостохранилищ и отвалов пустой породы, а растворенные материалы переносить в поверхностные стоки и грунтовые воды.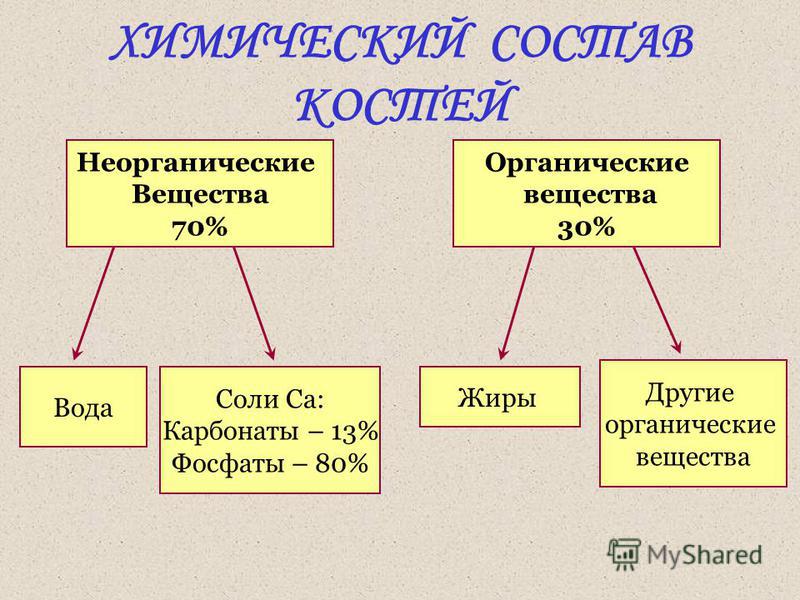 |
| Нитрат (NO3-) (Неорганический нитрат) Неорганическое соединение | В сфере общественного здравоохранения нитраты в питьевой воде, особенно в воде, используемой в детских смесях, уже давно ассоциируются с отравлением нитратами и синдромом голубого ребенка. Растениеводство и животноводство вносят значительный вклад в загрязнение нитратами из-за непреднамеренного попадания отходов и удобрений в водные пути. Помимо загрязнения азотом в результате сельского хозяйства, нитраты могут просачиваться в грунтовые воды из неправильно отрегулированных септических систем и сетей сточных вод. | Сток азота является важным фактором, способствующим цветению водорослей. Кроме того, азот обеспечивает богатую питательными веществами среду для процветания токсичных бактерий, таких как цветение цианобактерий. В прошлом считалось, что цветение цианобактерий вызывается исключительно фосфором, поэтому его можно было лечить сульфатом алюминия.  Однако сульфат алюминия нельзя использовать для обработки азота. В результате сток азота и выщелачивание старых септических систем необходимо сдерживать, чтобы защитить исходную воду от цианотоксинов. Однако сульфат алюминия нельзя использовать для обработки азота. В результате сток азота и выщелачивание старых септических систем необходимо сдерживать, чтобы защитить исходную воду от цианотоксинов. |
НАЗАД К ОБЗОРУ ЗАГРЯЗНИТЕЛЕЙ
ВНЕШНИЙ ВИД, ВКУС И ЗАПАХ
ПОЯВЛЯЮЩИЕСЯ ЗАГРЯЗНИТЕЛИ
2.4 Неорганические соединения, необходимые для жизнедеятельности человека – анатомия и физиология
Перейти к содержимому
Цели обучения
К концу этого раздела вы сможете:
- Сравнивать неорганические и органические соединения
- Определите свойства воды, которые делают ее необходимой для жизни
- Объясните роль солей в функционировании организма
- Различать кислоты и основания и объяснять их роль в рН
- Обсудите роль буферов в поддержании организмом гомеостаза pH
Понятия, которые вы уже изучили в этой главе, управляют всеми формами материи и могут служить основой как для геологии, так и для биологии. Этот раздел главы сужает фокус до химии человеческой жизни; то есть соединения, важные для структуры и функций организма. Как правило, эти соединения являются либо неорганическими, либо органическими.
Этот раздел главы сужает фокус до химии человеческой жизни; то есть соединения, важные для структуры и функций организма. Как правило, эти соединения являются либо неорганическими, либо органическими.
- Неорганическое соединение представляет собой вещество, которое не содержит ни углерода, ни водорода. Многие неорганические соединения содержат атомы водорода, такие как вода (H 2 O) и соляная кислота (HCl), вырабатываемая желудком. Напротив, только несколько неорганических соединений содержат атомы углерода. Углекислый газ (CO 2 ) является одним из немногих примеров.
- Органическое соединение представляет собой вещество, которое содержит как углерод, так и водород. Органические соединения синтезируются посредством ковалентных связей в живых организмах, в том числе в организме человека. Вспомните, что углерод и водород являются вторым и третьим по распространенности элементами в вашем теле. Вскоре вы обнаружите, как эти два элемента сочетаются в продуктах, которые вы едите, в соединениях, составляющих структуру вашего тела, и в химических веществах, питающих ваше функционирование.

В следующем разделе рассматриваются четыре группы неорганических соединений, необходимых для жизни: вода, соли, кислоты и основания. Органические соединения рассматриваются далее в этой главе.
Вода
До 70 процентов массы тела взрослого человека составляет вода. Эта вода содержится как внутри клеток, так и между клетками, из которых состоят ткани и органы. Несколько ее функций делают воду незаменимой для жизнедеятельности человека.
Вода в качестве смазки и прокладки
Вода является основным компонентом многих смазочных жидкостей организма. Подобно тому, как масло смазывает дверные петли, вода в синовиальной жидкости смазывает движения суставов тела, а вода в плевральной жидкости помогает легким расширяться и сжиматься при дыхании. Водянистые жидкости способствуют прохождению пищи по пищеварительному тракту и обеспечивают движение соседних органов брюшной полости без трения.
Вода также защищает клетки и органы от физических травм, например, амортизирует мозг внутри черепа и защищает нежную нервную ткань глаз. Вода смягчает развивающийся плод и в утробе матери.
Вода смягчает развивающийся плод и в утробе матери.
Вода в качестве теплоотвода
Радиатор — это вещество или объект, который поглощает и рассеивает тепло, но не испытывает соответствующего повышения температуры. В организме вода поглощает тепло, выделяемое химическими реакциями, без значительного повышения температуры. Более того, когда температура окружающей среды резко возрастает, вода, хранящаяся в организме, помогает охлаждать тело. Этот охлаждающий эффект возникает, когда теплая кровь из ядра тела течет к кровеносным сосудам прямо под кожей и переносится в окружающую среду. В то же время потовые железы выделяют теплую воду вместе с потом. Когда вода испаряется в воздух, она уносит тепло, а затем более холодная кровь с периферии циркулирует обратно к ядру тела.
Вода как компонент жидких смесей
Смесь представляет собой комбинацию двух или более веществ, каждое из которых сохраняет свою химическую идентичность. Другими словами, составляющие вещества не связаны химически в новое, более крупное химическое соединение. Эту концепцию легко представить, если подумать о порошкообразных веществах, таких как мука и сахар; когда вы перемешиваете их вместе в миске, они, очевидно, не связываются, образуя новое соединение. Комнатный воздух, которым вы дышите, представляет собой смесь газов, состоящую из трех отдельных элементов — азота, кислорода и аргона — и одного соединения — двуокиси углерода. Существует три типа жидких смесей, все из которых содержат воду в качестве ключевого компонента; это растворы, коллоиды и суспензии.
Другими словами, составляющие вещества не связаны химически в новое, более крупное химическое соединение. Эту концепцию легко представить, если подумать о порошкообразных веществах, таких как мука и сахар; когда вы перемешиваете их вместе в миске, они, очевидно, не связываются, образуя новое соединение. Комнатный воздух, которым вы дышите, представляет собой смесь газов, состоящую из трех отдельных элементов — азота, кислорода и аргона — и одного соединения — двуокиси углерода. Существует три типа жидких смесей, все из которых содержат воду в качестве ключевого компонента; это растворы, коллоиды и суспензии.
Чтобы клетки в организме выжили, их необходимо поддерживать во влажном состоянии в жидкости на водной основе, называемой раствором. В химии жидкий раствор состоит из растворителя, который растворяет вещество, называемое растворенным веществом. Важной характеристикой растворов является их однородность; то есть молекулы растворенного вещества равномерно распределены по всему раствору. Если бы вы размешали чайную ложку сахара в стакане воды, сахар растворился бы в молекулах сахара, разделенных молекулами воды. Отношение сахара к воде в левой части стакана будет таким же, как отношение сахара к воде в правой части стакана. Если бы вы добавили больше сахара, соотношение сахара и воды изменилось бы, но распределение — при условии, что вы хорошо перемешали — все равно было бы равномерным.
Если бы вы размешали чайную ложку сахара в стакане воды, сахар растворился бы в молекулах сахара, разделенных молекулами воды. Отношение сахара к воде в левой части стакана будет таким же, как отношение сахара к воде в правой части стакана. Если бы вы добавили больше сахара, соотношение сахара и воды изменилось бы, но распределение — при условии, что вы хорошо перемешали — все равно было бы равномерным.
Вода считается «универсальным растворителем» и считается, что жизнь не может существовать без воды из-за этого. Вода, безусловно, самый распространенный растворитель в организме; практически все химические реакции в организме происходят между соединениями, растворенными в воде. Поскольку молекулы воды полярны, с областями положительного и отрицательного электрического заряда, вода легко растворяет ионные соединения и полярные ковалентные соединения. Такие соединения называются гидрофильными или «водолюбивыми». Как было сказано выше, сахар хорошо растворяется в воде. Это связано с тем, что молекулы сахара содержат области полярных водородно-кислородных связей, что делает его гидрофильным. Неполярные молекулы, плохо растворяющиеся в воде, называются гидрофобными или «водобоязненными».
Неполярные молекулы, плохо растворяющиеся в воде, называются гидрофобными или «водобоязненными».
Концентрации растворенных веществ
В химии описаны различные смеси растворенных веществ и воды. Концентрация данного растворенного вещества — это количество частиц этого растворенного вещества в данном пространстве (кислород составляет около 21 процента атмосферного воздуха). В кровотоке человека концентрация глюкозы обычно измеряется в миллиграммах (мг) на децилитр (дл), а у здорового взрослого человека она составляет в среднем около 100 мг/дл. Другой метод измерения концентрации растворенного вещества — его молярность, то есть количество молей (М) молекул на литр (л). Моль элемента — это его атомный вес, а моль соединения — это сумма атомных весов его компонентов, называемая молекулярной массой. Часто используемым примером является расчет моля глюкозы с химической формулой C6h22O6. Используя периодическую таблицу, атомный вес углерода (С) составляет 12,011 грамма (г), а в глюкозе шесть атомов углерода, что дает общий атомный вес 72,066 г. Делая те же расчеты для водорода (H) и кислорода (O), молекулярная масса равна 180,156 г («молекулярная масса грамма» глюкозы). При добавлении воды для получения одного литра раствора получается один моль (1М) глюкозы. Это особенно полезно в химии из-за связи молей с «числом Авогадро». В моле любого раствора содержится одинаковое количество частиц: 6,02 × 10 23 . Многие вещества в кровотоке и других тканях тела измеряются тысячными долями моля или миллимолями (мМ).
Делая те же расчеты для водорода (H) и кислорода (O), молекулярная масса равна 180,156 г («молекулярная масса грамма» глюкозы). При добавлении воды для получения одного литра раствора получается один моль (1М) глюкозы. Это особенно полезно в химии из-за связи молей с «числом Авогадро». В моле любого раствора содержится одинаковое количество частиц: 6,02 × 10 23 . Многие вещества в кровотоке и других тканях тела измеряются тысячными долями моля или миллимолями (мМ).
Коллоид представляет собой смесь, похожую на тяжелый раствор. Частицы растворенного вещества состоят из крошечных сгустков молекул, достаточно больших, чтобы сделать жидкую смесь непрозрачной (поскольку частицы достаточно велики, чтобы рассеивать свет). Знакомыми примерами коллоидов являются молоко и сливки. В щитовидной железе гормон щитовидной железы хранится в виде густой белковой смеси, также называемой коллоидом.
Суспензия представляет собой жидкую смесь, в которой более тяжелое вещество временно взвешено в жидкости, но со временем оседает.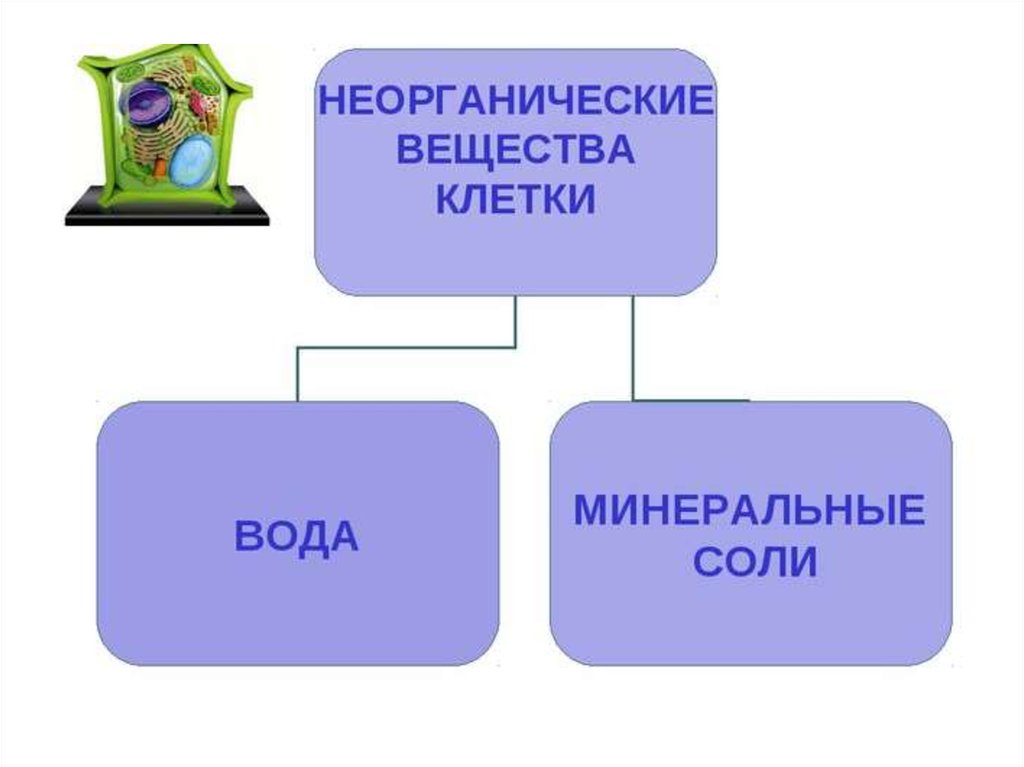 Такое отделение частиц от суспензии называется седиментацией. Пример оседания происходит в анализе крови, который устанавливает скорость оседания или скорость седации. Тест измеряет, как быстро эритроциты в пробирке оседают из водянистой части крови (известной как плазма) в течение установленного периода времени. Быстрое осаждение клеток крови обычно не происходит в здоровом организме, но аспекты некоторых заболеваний могут вызывать слипание клеток крови, и эти тяжелые скопления клеток крови оседают на дно пробирки быстрее, чем нормальные клетки крови.
Такое отделение частиц от суспензии называется седиментацией. Пример оседания происходит в анализе крови, который устанавливает скорость оседания или скорость седации. Тест измеряет, как быстро эритроциты в пробирке оседают из водянистой части крови (известной как плазма) в течение установленного периода времени. Быстрое осаждение клеток крови обычно не происходит в здоровом организме, но аспекты некоторых заболеваний могут вызывать слипание клеток крови, и эти тяжелые скопления клеток крови оседают на дно пробирки быстрее, чем нормальные клетки крови.
Роль воды в химических реакциях
Два типа химических реакций связаны с созданием или потреблением воды: синтез дегидратации и гидролиз.
- В синтезе дегидратации один реагент отдает атом водорода, а другой реагент отдает гидроксильную группу (ОН) при синтезе нового продукта. При образовании их ковалентной связи в качестве побочного продукта выделяется молекула воды (рис. 2.4.1). Это также иногда называют реакцией конденсации.

- При гидролизе молекула воды разрушает соединение, разрывая его связи. Вода сама расщепляется на Н и ОН. Затем одна часть разорванного соединения связывается с атомом водорода, а другая часть связывается с гидроксильной группой.
Эти реакции являются обратимыми и играют важную роль в химии органических соединений (которая будет обсуждаться в ближайшее время).
Рисунок 2.4.1 – Дегидратационный синтез и гидролиз: Мономеры, основные единицы для построения более крупных молекул, образуют полимеры (два или более химически связанных мономера). (а) При дегидратационном синтезе два мономера ковалентно связываются в результате реакции, в которой один отдает гидроксильную группу, а другой — атом водорода. Молекула воды высвобождается как побочный продукт при реакциях дегидратации. (б) При гидролизе ковалентная связь между двумя мономерами расщепляется за счет присоединения атома водорода к одному и гидроксильной группы к другому, что требует вклада одной молекулы воды.
Соли
Напомним, что соли образуются, когда ионы образуют ионные связи. В этих реакциях один атом отдает один или несколько электронов и, таким образом, становится положительно заряженным, тогда как другой принимает один или несколько электронов и становится отрицательно заряженным. Теперь вы можете определить соль как вещество, которое при растворении в воде диссоциирует на ионы, отличные от H + или OH – . Этот факт важен для отличия солей от кислот и оснований, о чем пойдет речь далее.
Типичная соль NaCl полностью диссоциирует в воде (рис. 2.4.2). Положительные и отрицательные участки молекулы воды (концы водорода и кислорода соответственно) притягивают отрицательные ионы хлорида и положительные ионы натрия, отталкивая их друг от друга. Опять же, в то время как неполярные и полярные ковалентно связанные соединения распадаются на молекулы в растворе, соли диссоциируют на ионы. Эти ионы являются электролитами; они способны проводить электрический ток в растворе. Это свойство имеет решающее значение для функции ионов в передаче нервных импульсов и стимулировании сокращения мышц.
Это свойство имеет решающее значение для функции ионов в передаче нервных импульсов и стимулировании сокращения мышц.
Рисунок 2.4.2 – Диссоциация хлорида натрия в воде: Обратите внимание, что кристаллы хлорида натрия диссоциируют не на молекулы NaCl, а на катионы Na + и анионы Cl – , каждый из которых полностью окружен молекулами воды.
Многие другие соли важны для организма. Например, соли желчных кислот, вырабатываемые печенью, помогают расщеплять пищевые жиры, а соли фосфата кальция образуют минеральную часть зубов и костей.
Кислоты и основания
Кислоты и основания, как и соли, диссоциируют в воде на электролиты. Кислоты и основания могут очень сильно изменять свойства растворов, в которых они растворены.
Кислоты
Кислота представляет собой вещество, выделяющее ионы водорода (H + ) в растворе (рис. 2. 4.3 a ). Поскольку атом водорода имеет только один протон и один электрон, положительно заряженный ион водорода — это просто протон. Этот уединенный протон с большой долей вероятности может участвовать в химических реакциях. Сильные кислоты — это соединения, которые выделяют весь свой H+ в раствор; то есть они полностью ионизируются. Соляная кислота (HCl), которая высвобождается клетками слизистой оболочки желудка, является сильной кислотой, потому что она высвобождает весь свой H9.0216 + в водянистой среде желудка. Эта сильная кислота способствует пищеварению и убивает проглоченные микробы. Слабые кислоты полностью не ионизируются; то есть некоторые из их ионов водорода остаются связанными внутри соединения в растворе. Примером слабой кислоты является уксус или уксусная кислота; его называют ацетатом после того, как он отдает протон.
4.3 a ). Поскольку атом водорода имеет только один протон и один электрон, положительно заряженный ион водорода — это просто протон. Этот уединенный протон с большой долей вероятности может участвовать в химических реакциях. Сильные кислоты — это соединения, которые выделяют весь свой H+ в раствор; то есть они полностью ионизируются. Соляная кислота (HCl), которая высвобождается клетками слизистой оболочки желудка, является сильной кислотой, потому что она высвобождает весь свой H9.0216 + в водянистой среде желудка. Эта сильная кислота способствует пищеварению и убивает проглоченные микробы. Слабые кислоты полностью не ионизируются; то есть некоторые из их ионов водорода остаются связанными внутри соединения в растворе. Примером слабой кислоты является уксус или уксусная кислота; его называют ацетатом после того, как он отдает протон.
Рисунок 2.4.3 – Кислоты и основания: (a) В водном растворе кислота диссоциирует на ионы водорода (H + ) и анионы. Почти каждая молекула сильной кислоты диссоциирует, образуя высокую концентрацию H + . (б) В водном растворе основание диссоциирует на гидроксильные ионы (ОН – ) и катионы. Почти каждая молекула сильного основания диссоциирует, образуя высокую концентрацию ОН – .
Почти каждая молекула сильной кислоты диссоциирует, образуя высокую концентрацию H + . (б) В водном растворе основание диссоциирует на гидроксильные ионы (ОН – ) и катионы. Почти каждая молекула сильного основания диссоциирует, образуя высокую концентрацию ОН – .
Основания
Основание представляет собой вещество, которое высвобождает гидроксильные ионы (ОН – ) в растворе или принимает H+, уже присутствующий в растворе (см. рис. 2.4.3 b ). Ионы гидроксила (также известные как ионы гидроксида) или другие основные вещества соединяются с H + образуют молекулу воды, тем самым удаляя H+ и снижая кислотность раствора. Сильные основания высвобождают большую часть или все свои гидроксильные ионы; слабые основания выделяют только некоторые гидроксильные ионы или поглощают только несколько H + . Пища, смешанная с соляной кислотой из желудка, обожгла бы тонкий кишечник (следующий отдел пищеварительного тракта после желудка), если бы не выделение бикарбоната (HCO 3 – ), слабого основания, притягивающего Н + . Бикарбонат принимает часть протонов Н+, тем самым снижая кислотность раствора.
Бикарбонат принимает часть протонов Н+, тем самым снижая кислотность раствора.
Концепция pH
Относительную кислотность или щелочность раствора можно определить по его рН. pH раствора — это отрицательный логарифм по основанию 10 концентрации ионов водорода (H + ) в растворе. Например, раствор с pH 4 имеет концентрацию H + , которая в десять раз больше, чем у раствора с pH 5. То есть раствор с рН 4 в десять раз более кислый, чем раствор с рН 5. Понятие рН станет более понятным, когда вы изучите шкалу рН, как показано на рис. 2.4.4. Шкала состоит из ряда приращений от 0 до 14. Раствор с рН 7 считается нейтральным — ни кислым, ни щелочным. Чистая вода имеет рН 7. Чем меньше число ниже 7, тем более кислый раствор или тем выше концентрация Н + . Концентрация ионов водорода при каждом значении рН в 10 раз отличается от следующего значения рН. Например, значение рН 4 соответствует концентрации протонов 10 90 216 -4 90 217 М, или 0,0001 М, а значение рН 5 соответствует концентрации протонов 10 90 216 -5 90 217 М, или 0,00001 М. Чем выше число выше 7, тем более основным (щелочным) является раствор, или тем ниже концентрация H + . Человеческая моча, например, в десять раз более кислая, чем чистая вода, а HCl в 10 000 000 раз более кислая, чем вода.
Чем выше число выше 7, тем более основным (щелочным) является раствор, или тем ниже концентрация H + . Человеческая моча, например, в десять раз более кислая, чем чистая вода, а HCl в 10 000 000 раз более кислая, чем вода.
Рисунок 2.4.4 Шкала рН
Буферы
pH крови человека обычно колеблется от 7,35 до 7,45, хотя обычно определяется как pH 7,4. При этом слегка щелочном pH кровь может снизить кислотность, возникающую из-за того, что углекислый газ (CO 2 ) постоянно выделяется в кровоток триллионами клеток тела. Гомеостатические механизмы (наряду с выдыханием СО 2 при дыхании) обычно удерживают рН крови в этом узком диапазоне. Это очень важно, потому что колебания — слишком кислые или слишком щелочные — могут привести к опасным для жизни расстройствам.
Все клетки организма зависят от гомеостатической регуляции кислотно-щелочного баланса при рН примерно 7,4. Таким образом, в организме есть несколько механизмов для этой регуляции, включая дыхание, выделение химических веществ с мочой и внутреннее высвобождение химических веществ, которые в совокупности называются буферами, в жидкости организма. Буфер представляет собой раствор слабой кислоты и сопряженного с ней основания. Буфер может нейтрализовать небольшое количество кислот или оснований в жидкостях организма. Например, если есть даже незначительное снижение рН жидкости организма ниже 7,35, буфер в жидкости — в данном случае действующий как слабое основание — будет связывать избыток ионов водорода. Напротив, если pH поднимается выше 7,45, буфер будет действовать как слабая кислота и вносить ионы водорода.
Буфер представляет собой раствор слабой кислоты и сопряженного с ней основания. Буфер может нейтрализовать небольшое количество кислот или оснований в жидкостях организма. Например, если есть даже незначительное снижение рН жидкости организма ниже 7,35, буфер в жидкости — в данном случае действующий как слабое основание — будет связывать избыток ионов водорода. Напротив, если pH поднимается выше 7,45, буфер будет действовать как слабая кислота и вносить ионы водорода.
Гомеостатический дисбаланс
Избыточная кислотность кислот и оснований, крови и других жидкостей организма известна как ацидоз. Распространенными причинами ацидоза являются ситуации и расстройства, которые снижают эффективность дыхания, особенно способность человека к полному выдоху, что вызывает накопление CO 2 (и H + ) в кровотоке. Ацидоз также может быть вызван метаболическими проблемами, которые снижают уровень или функцию буферов, действующих как основания, или которые способствуют выработке кислот. Например, при тяжелой диарее организм может терять слишком много бикарбоната, что приводит к накоплению кислот в жидкостях организма. У людей с плохо управляемым диабетом (неэффективное регулирование уровня сахара в крови) кислоты, называемые кетонами, вырабатываются в качестве топлива для организма. Они могут накапливаться в крови, вызывая серьезное состояние, называемое диабетическим кетоацидозом. Почечная недостаточность, печеночная недостаточность, сердечная недостаточность, рак и другие заболевания также могут вызывать метаболический ацидоз.
Например, при тяжелой диарее организм может терять слишком много бикарбоната, что приводит к накоплению кислот в жидкостях организма. У людей с плохо управляемым диабетом (неэффективное регулирование уровня сахара в крови) кислоты, называемые кетонами, вырабатываются в качестве топлива для организма. Они могут накапливаться в крови, вызывая серьезное состояние, называемое диабетическим кетоацидозом. Почечная недостаточность, печеночная недостаточность, сердечная недостаточность, рак и другие заболевания также могут вызывать метаболический ацидоз.
Напротив, алкалоз — это состояние, при котором кровь и другие жидкости организма являются слишком щелочными (щелочными). Как и в случае с ацидозом, респираторные расстройства являются основной причиной; однако при респираторном алкалозе уровень углекислого газа падает слишком низко. Заболевания легких, передозировка аспирина, шок и обычное беспокойство могут вызвать респираторный алкалоз, который снижает нормальную концентрацию H + .
Метаболический алкалоз часто возникает в результате длительной сильной рвоты, которая вызывает потерю ионов водорода и хлора (как компонентов HCl). Лекарства также могут вызвать алкалоз. К ним относятся мочегонные средства, которые заставляют организм терять ионы калия, а также антациды, принимаемые в чрезмерных количествах, например, при постоянной изжоге или язве.
Обзор главы
Неорганические соединения, необходимые для жизнедеятельности человека, включают воду, соли, кислоты и основания. Эти соединения неорганические; то есть они не содержат ни водорода, ни углерода. Вода является смазкой и подушкой, теплоотводом, компонентом жидких смесей, побочным продуктом реакций дегидратационного синтеза, реагентом в реакциях гидролиза. Соли – это соединения, которые при растворении в воде диссоциируют на ионы, отличные от H + или OH – . Напротив, кислоты выделяют H + в растворе, делая его более кислым. Основания принимают H + , тем самым делая раствор более щелочным (едким).
Основания принимают H + , тем самым делая раствор более щелочным (едким).
pH любого раствора – это его относительная концентрация H + . Раствор с рН 7 нейтрален. Растворы с рН ниже 7 являются кислотами, а растворы с рН выше 7 — щелочами. Изменение на одну цифру шкалы pH (например, с 7 до 8) соответствует десятикратному увеличению или уменьшению концентрации H + . У здорового взрослого человека рН крови колеблется от 7,35 до 7,45. Механизмы гомеостатического контроля, которые важны для поддержания крови в здоровом диапазоне pH, включают химические вещества, называемые буферами, слабыми кислотами и слабыми основаниями, высвобождаемыми, когда pH крови или других жидкостей организма колеблется в любом направлении за пределами этого нормального диапазона.
Лицензия
Анатомия и физиология Линдси М. Бига, Сьерра Доусон, Эми Харвелл, Робин Хопкинс, Джоэл Кауфманн, Майк ЛеМастер, Филип Матерн, Кэти Моррисон-Грэм, Девон Квик и Джон Руньон лицензирована Creative Commons Attribution -ShareAlike 4.


