Содержание
Эксперимент «Натрий на воде» — MEL Chemistry
Почему металл не тонет, а бегает по воде?
Твитнуть
Отправить
Можно ли заставить металл бегать по воде? Давайте проверим!
Меры предосторожности
Проводите опыт в защитных перчатках, очках и маске. Соблюдайте технику безопасности при работе с огнем и горючими предметами, а также активными металлами (литий, натрий, калий, рубидий, цезий).
Внимание! Не проводите этот опыт самостоятельно — только в присутствии профессионала!
Реагенты и оборудование:
- металлический натрий;
- 1%-й р-р фенолфталеина;
- 1%-й р-р индигокармина;
- 1%-й р-р тимолового синего;
- вода;
- кристаллизатор (3 шт.).
Пошаговая инструкция
В кристаллизаторы наливаем воду и добавляем растворы индикаторов: в первый кристаллизатор капаем фенолфталеин, во второй — индигокармин, а в третий — тимоловый синий. Добавляем по кусочку металлического натрия. Наблюдаем изменение окраски во всех трех кристаллизаторах.
Добавляем по кусочку металлического натрия. Наблюдаем изменение окраски во всех трех кристаллизаторах.
Пояснение процессов
Натрий — очень активный металл, он способен вытеснять водород из воды. Реакция натрия и воды нередко сопровождается взрывом. Если маленький кусочек натрия бросить в кристаллизатор с водой и кислотно-основным индикатором, натрий будет быстро бегать по поверхности жидкости. При этом он будет плавиться, превращаясь в красивую «бусину», которая может даже загореться!
Почему натрий бегает
При взаимодействии с водой выделяется водород, который подталкивает натрий к «бегству».
Почему натрий плавится и загорается
Реакция натрия с водой сопровождается выделением огромного количества тепла — из-за этого металл плавится. Этой энергии реакции достаточно, чтобы поджечь выделяющейся водород!
Почему изменяется цвет растворов
Фенолфталеин, индигокармин и тимоловый синий являются кислотно-основными индикаторами, то есть веществами, которые изменяют свой цвет в зависимости от водородного показателя среды. При взаимодействии натрия с водой образуется гидроксид натрия, который является очень сильным основанием — так среда становится щелочной. Фенолфталеин меняет цвет от бесцветного к малиновому, индигокармин — от синего к зеленому, а тимоловый синий — от желтого к синему.
При взаимодействии натрия с водой образуется гидроксид натрия, который является очень сильным основанием — так среда становится щелочной. Фенолфталеин меняет цвет от бесцветного к малиновому, индигокармин — от синего к зеленому, а тимоловый синий — от желтого к синему.
2Na + 2H₂O = 2NaOH + H₂
Твитнуть
Отправить
Больше статей о химии:
- Горение стальной ваты
Как поджечь железо батарейкой - Эксперимент «Цветной дождь в стакане»
Понадобится только растительное масло и пищевые красители
Делайте эксперименты дома!
Трансмутация
Узнать больше
Кинетика и термодинамика химического взаимодействия натрия с водой
Страница 5 из 24
Глава 2
ОБЩИЕ СВЕДЕНИЯ О ВЗАИМОДЕЙСТВИИ НАТРИЯ С ВОДОЙ
Кинетика и термодинамика химического взаимодействия натрия с водой
Химическое взаимодействие натрия и воды протекает в два этапа. На первом этапе реакция протекает с большой скоростью с выделением газообразного водорода и тепла:
На первом этапе реакция протекает с большой скоростью с выделением газообразного водорода и тепла:
(2.1)
Обратить эту реакцию практически невозможно, так как равновесное давление водорода очень велико. На втором этапе происходит химическое взаимодействие продуктов первого этапа реакции с избыточным натрием (избыток натрия характерен при течах воды в условиях парогенератора с натриевым теплоносителем):
(2.2)
(2.3)
(2.4)
Таким образом, взаимодействие натрия с водой — довольно сложный, многоэтапный процесс, в котором протекают последовательные реакции образования гидроксида натрия и водорода и их последующее взаимодействие с натрием. Конечная концентрация продуктов взаимодействия воды с натрием определяется условиями термодинамического равновесия, а время достижения равновесного состояния — кинетикой протекающих реакций.
Реакция натрия с водой в конденсированном состоянии протекает с очень высокой скоростью (практически мгновенно) . Однако весьма важно, что образующийся газообразный водород разъединяет реагирующие компоненты, в результате чего реальная скорость взаимодействия натрия с водой определяется перемешиванием реагентов и не носит взрывного характера. Бытующее мнение о взрывном характере взаимодействия воды с натрием связано с возможностью взрывного взаимодействия смеси водорода с газообразным кислородом, образование которой происходит при выделении образующегося водорода в среду, содержащую газообразный кислород. Инициатором взрыва такой смеси могут служить высокие температуры, которые развиваются в зоне реакции.
Однако весьма важно, что образующийся газообразный водород разъединяет реагирующие компоненты, в результате чего реальная скорость взаимодействия натрия с водой определяется перемешиванием реагентов и не носит взрывного характера. Бытующее мнение о взрывном характере взаимодействия воды с натрием связано с возможностью взрывного взаимодействия смеси водорода с газообразным кислородом, образование которой происходит при выделении образующегося водорода в среду, содержащую газообразный кислород. Инициатором взрыва такой смеси могут служить высокие температуры, которые развиваются в зоне реакции.
Многочисленными исследованиями показано, что изоляция системы натрий—вода от кислорода созданием над уровнем воды или натрия газовой полости с бескислородной атмосферой (аргон, гелий, азот) полностью исключает взрывные эффекты. Одновременно такая газовая полость служит эффективным демпфером для расширения образующегося водорода. Это исключает быстрое и значительное нагружение конструкции.
Состояние продуктов взаимодействия натрия с водой при термодинамическом равновесии. Данные по состоянию продуктов реакции натрия с водой получены как использованием расчетных методов, так и анализом проб, отобранных при проведении опытов по взаимодействию воды с натрием.
Методика термодинамических расчетов основана на решении системы уравнений, получающихся с использованием закона действующих масс для независимых реакций, протекающих в данной системе, и балансных уравнений по компонентам, участвующим в реакциях.
Основная сложность связана с выбором исходных термодинамических данных, в особенности данных по переходу от термодинамической активности к концентрациям.
При проведении расчетов считается, что реакция (2.1) идет до конца, количество натрия в системе превышает количество воды, попавшей в нее, т.е. n0Na>>nh3O, и все продукты взаимодействия находятся в натрии в растворенном состоянии, количеством водорода, находящимся в газовой фазе, можно пренебречь.
Тогда равновесные концентрации продуктов реакции находятся из системы уравнений:
первое из которых — следствие закона действующих масс, а три последних — балансные уравнения для кислорода, водорода и натрия, причем
К2.2=ехр(-ΔΖ°(2. 2)/RT).
Решение системы уравнений (2.5)-(2.8) дает:
где
Расчет по (2.9) — (2.11) показывает, что с ростом температуры с 300 до 500 суменьшается с 0,17 до 0,007, а с ростом
доля водорода в виде гидроксида также растет. Последнее должно приводить к тому, что равновесное давление водорода над натрием, содержащим кислород и водород, будет понижаться с ростомЭто
подтверждено специальными опытами [15].
При попадании значительного количества воды в натрий указанное выше условиене выполняется. При этом концентрация
образующихся соединений может превысить их растворимость в натрии. В этих условиях образуется каустическая фаза, состоящая из гидроксида и растворенных в нем оксида, гидрида натрия и натрия. Термодинамический анализ состава каустической фазы при допущении, что растворимость натрия в гидроксиде мала по сравнению с растворимостью гидрида и оксида [77, 76], т.е. в каустической фазе
Термодинамический анализ состава каустической фазы при допущении, что растворимость натрия в гидроксиде мала по сравнению с растворимостью гидрида и оксида [77, 76], т.е. в каустической фазе
NNa=0, показал, что основными продуктами реакции в присутствии жидкого натрия как самостоятельной фазы будут гидроксид, гидрид и оксид натрия, молярные доли которых при 450 °C и≈ 0,5 равны 0,46; 0,51;
0,03 соответственно. С ростом температуры и nдоля гидроксида растет. При этом важно, что температура плавления каустической фазы, формирующейся в таких условиях, будет превышать температуру плавления чистого гидроксида.
В реальных условиях формирования каустической фазы температура ее плавления не превышала 400 °C. В открытой системе, когда возможна потеря водорода, температура плавления каустической фазы по мере обеднения ее водородом будет расти.
Общие закономерности, описывающие равновесное давление водорода в газовой фазе над системой натрий-кислород-водород, в настоящее время неизвестны.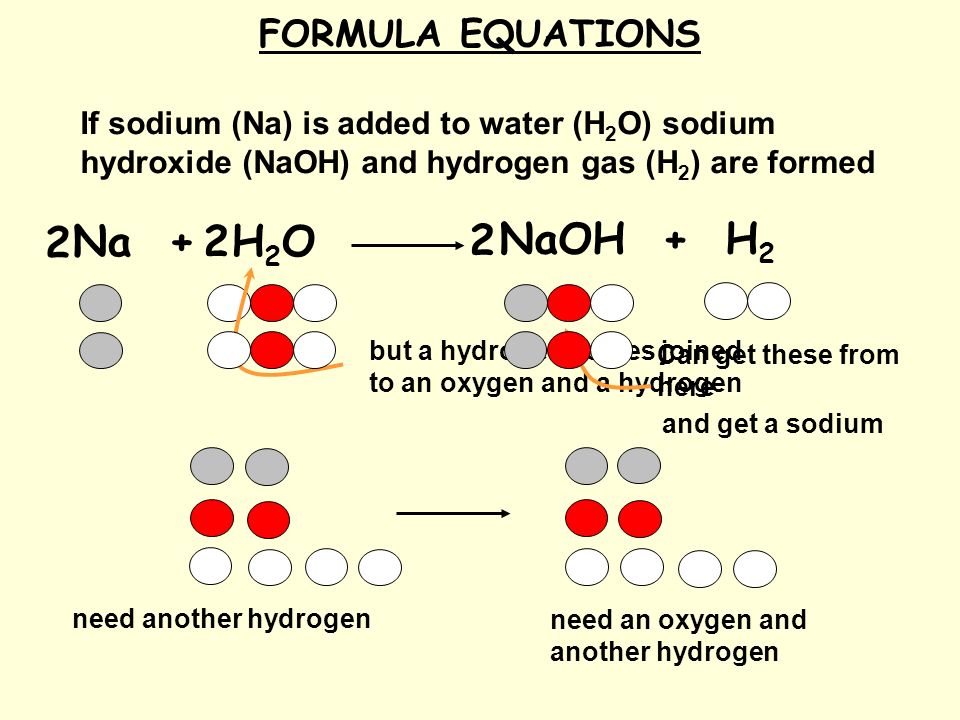
Растворимость в натрии, млн-1, кислорода, водорода, а также продуктов взаимодействия натрия с водой описывается уравнениями:
В (2.19) растворимость продуктов взаимодействия натрия с водой условно рассчитана на кислород, содержащийся в воде. Сопоставление (2.17) и (2.19) показывает, что растворимость кислорода в присутствии водорода увеличивается.
На рис. 2.1 представлена диаграмма равновесных состояний системы натрий-вода в зависимости от температуры и молярной доли воды в составе реагентов [19].
Конечными продуктами реакции натрия с водой могут быть гидрид и оксид натрия в жидких растворах на основе натрия и его гидроксида, гидрид и твердый раствор гидроксида, а также водный раствор щелочи и газообразный водород.
36 Изменение концентрации продуктов взаимодействия натрия с водой в натрии и защитном газе с учетом кинетики реакций. Будем считать, что течь воды в натрий постоянна во времени. Из полного количества газообразного водорода, образующегося при взаимодействии натрия с водой, доля его, равная (1-а), находится в натрии, а остальной водород поступает в защитный газ.
Тогда, принимая, что водород взаимодействует с натрием на поверхности раздела по реакции первого порядка, а выделение его из натрия за счет обратной реакции происходит по реакции второго порядка, а реакция гидроксида натрия с натрием гомогенна и первого порядка, и считая, что перемешивание в контуре и газовой фазе идеальное, получаем уравнения баланса:
для водорода в газе
Считая, что сферический пузырь, находящийся в движущемся вверх натрии, взаимодействует с натрием кинетически, причем скорость образования гидрида много выше скорости обратной реакции, а температура и давление водорода в пузыре равны соответствующим параметрам натрия, запишем уравнение, описывающее изменение диаметра пузыря:
(2.34) где х — расстояние до места течи; Т и р- температура и давление в точке х соответственно; f (х) определяется из (2.27) [с учетом вида функции T(х) ]. Решения уравнения (2.34) для случаев wn = const и
wn > wNa, когда d = d0 при х = 0, имеют вид:
в первом случае
Используя (2. 35) —(2.37), можно определить расстояние, пройдя которое пузырь с начальным диаметром d0 полностью растворится, т.е. а станет равным нулю.
35) —(2.37), можно определить расстояние, пройдя которое пузырь с начальным диаметром d0 полностью растворится, т.е. а станет равным нулю.
Из приведенных выражений видно, что доля водорода, выходящего в газовую полость, зависит от многих параметров: направления движения натрия в парогенераторе, температуры, давления, начального диаметра пузыря и др.
Водородные пузыри уносятся из парогенератора с потоком натрия. Сложность гидродинамики потока в парогенераторах и контурах не позволяет провести точную аналитическую оценку доли пузырей, выходящих в газовую полость. Однако очевидно, что чем ближе место течи к газовой полости, тем эта доля должна быть больше.
Полученные уравнения позволяют рассчитать изменение концентрации примесей в контуре во времени и оценить эффективность различных систем обнаружения течи воды в натрий.
- Назад
- Вперёд
Напишите сбалансированное уравнение для следующих химических уравнений: Натрий + Вода $ \to $ Гидроксид натрия + Водород (A) — ${\text{2Na}}\left( {\text{s}} \right){\text { + 2}}{{\text{H}}_{\text{2}}}{\text{O}}\left( {\text{l}} \right) \to {\text{2NaOH} }\left( {\text{aq}}} \right){\text{ + }}{{\text{H}}_{\text{2}}}\left( {\text{g}} \ right) $ (B) — $ {\ text {Na}} \ left ( {\ text {s}} \ right) {\ text { + }} {\ text {H}} _ {\ text {2 }}}{\text{O}}\left( {\text{l}} \right) \to {\text{NaOH}}\left({{\text{aq}}} \right){\text { + }}{{\text{H}}_{\text{2}}}\left( {\text{g}} \right)$(C) — ${\text{2Na}}\left( {\ text {s}} \ right) {\ text { + 2}} {{\ text {H}} _ {\ text {2}}} {\ text {O}} \ left ( {\ text {l }} \right) \to {\text{NaOH}}\left( {\text{aq}}} \right){\text{+}}{{\text{H}}_{\text{2 }}}\left( {\text{g}} \right)$(D) — ${\text{Na}}\left( {\text{s}} \right){\text{ +}}{ {\text{H}}_{\text{2}}}{\text{O}}\left( {\text{l}} \right) \to 2{\text{NaOH}}\left({ {\text{aq}}} \right){\text{+}}{{\text{H}}_{\text{2}}}\left( {\text{g}} \right т)$
Ответ
Проверено
203,7 тыс. + просмотров
+ просмотров
Подсказка: Чтобы сбалансировать любое химическое уравнение, мы должны поддерживать молекулярность каждого атома с обеих сторон химической реакции, то есть со стороны реагента, а также со стороны образования продукта. сторона.
Полный пошаговый ответ:
Для уравновешивания химической реакции сначала мы вычисляем количество каждого атома в левой и правой частях данного химического уравнения.
Известно, что натрий реагирует с водой с образованием гидроксида натрия и газообразного водорода, т.е. } \ влево ( {\ текст {s}} \ вправо) {\ текст { + }} {{\ текст {H}} _ {\ текст {2}}} {\ текст {O}} \ влево ( {\ text{l}} \right) \to {\text{NaOH}}\left( {\text{aq}}} \right){\text{+}}{{\text{H}}_{\ text{2}}}\left( {\text{g}} \right)$
Приведенное выше химическое уравнение не представлено в сбалансированной форме, потому что:
— В левой части, как и в правой, присутствует только один атом натрия (${\text{Na}}$) и атом кислорода (${\text{O}}$), что верно.
— Но с левой стороны или со стороны реагента присутствуют два атома водорода (${\text{H}}$), а с правой стороны или со стороны продукта — три атома водорода (${\text {H}}$) присутствуют, что неверно.
Итак, сбалансированное химическое уравнение для данной реакции выглядит следующим образом:
${\text{2Na}}\left( {\text{s}} \right){\text{ + 2}}{{\text{H }}_{\text{2}}}{\text{O}}\left( {\text{l}} \right) \to {\text{2NaOH}}\left({{\text{aq} }} \right){\text{ + }}{{\text{H}}_{\text{2}}}\left( {\text{g}} \right)$
Где каждый атом имеет одинаковую молекулярность как в левой, так и в правой части химической реакции. Правильный ответ — вариант «А».
Примечание: Здесь некоторые из вас могут запутаться в балансировке уравнения, где числа записываются в виде нижнего индекса или иногда перед молекулами. Таким образом, вы можете сбалансировать уравнение, учитывая оба числа.
Недавно обновленные страницы
В Индии по случаю бракосочетания фейерверк 12 класс химия JEE_Main
Щелочноземельные металлы Ba, Sr, Ca и Mg могут быть отнесены к 12 классу химии JEE_Main
Что из следующего имеет самый высокий электродный потенциал 12 класс химии JEE_Main
Что из следующего является истинным пероксидом A rmSrmOrm2 класс 12 химии JEE_Main
Какой элемент обладает наибольшим атомным радиусом А 11 класс химии JEE_Main
Фосфин получают из следующей руды Кальций 12 класса химии JEE_Main
В Индии по случаю бракосочетания фейерверк 12 класса химии JEE_Main
Щелочноземельные металлы Ba, Sr, Ca и Mg могут быть отнесены к 12 классу химии JEE_Main
Что из следующего имеет самый высокий электродный потенциал 12 класс химии JEE_Main
Что из следующего является истинным пероксидом A rmSrmOrm2 класс 12 химии JEE_Main
Какой элемент обладает наибольшим атомным радиусом А Химический класс 11 JEE_Main
Фосфин получают из следующей руды А Кальций 12 химического класса JEE_Main
Актуальные сомнения
Написать сбалансированное уравнение — натрий + вода → гидроксид натрия + водород
Последнее обновление: 30 июня 2021 г. , Teachoo
, Teachoo
Напишите сбалансированное уравнение для следующих химических реакций.
(iii) Натрий + вода → гидроксид натрия + водород
Отвечать
(iii) Натрий + вода → гидроксид натрия + водород
Скелетное химическое уравнение вышеуказанной реакции имеет вид
Na + H
2
O → NaOH + H
2
| | |
натрий | 1 | 1 |
Водород | 2 | 3 |
Кислород | 1 | 1 |
-
Количество атомов водорода в реагентах
≠
количество атомов водорода в продуктах
Чтобы сбалансировать количество Водорода,
Мы
умножить NaOH в продукте на 2
(Если умножить h3, общее количество H в продукте будет нечетным, а в реагенте четным.

