Содержание
Реакция натрия с водой (со взрывом)
Химия элементов и их соединения.
1)
Начинать с щелочных металлов, там сначала
описываешь Na и К, а потом пишешь все
возможные реакции на их примере.
2)
То же с Са и Мg.
3)Al-
обратить внимание на его амфотерность.
4)
Mn, Fe, Cu, Cr,Zn, так же описываешь.
5)
Неметаллы H, C, Si, N, P, O, S.
6)Галогены
F, Cl.
1) К
щелочным металлам относятся литий,
натрий, калий, рубидий, цезий и франций.
В периодической системе они расположены
в главной подгруппе I группы. Все щелочные
металлы имеют один s-электрон на внешнем
электронном слое, который при химических
реакциях легко теряют, проявляя степень
окисления +1. Поэтому щелочные металлы
являются сильными восстановителями.
Радиусы их атомов возрастают от лития
к францию. Электрон внешнего слоя с
возрастанием радиуса атома находится
все дальше от ядра, силы притяжения
ослабевают и, следовательно, увеличивается
способность к отдаче этого электрона,
т.е. химическая активность. В
В
электрохимическом ряду напряжений
металлов все щелочные металлы стоят
левее водорода.
Это
типичные металлы, в твердом состоянии
хорошо проводят электрический ток. Они
легкоплавки, быстро окисляются на
воздухе, поэтому их хранят без доступа
воздуха и влаги, чаще всего под керосином.
Щелочные металлы образуют соединения
с преимущественно ионной связью.
Оксиды
щелочных металлов — твердые гигроскопичные
вещества, легко взаимодействующие с
водой. При этом образуются гидроксиды
— твердые вещества, хорошо растворимые
в воде. Соли щелочных металлов, как
правило, тоже хорошо растворяются в
воде.
11 | Натрий |
Na 22,989 | |
[Nе]3s1 | |
На́трий — элемент главной
подгруппы первой группы, третьего
периода периодической
системы химических элементовД. И. Менделеева,
И. Менделеева,
с атомным
номером 11.
Обозначается символом Na (лат. Natrium). Простое
вещество натрий (CAS-номер:
7440-23-5) — мягкий щелочной
металл серебристо-белого
цвета.
История
и происхождение названия
Натрий
(а точнее, его соединения) использовался
с давних времён. Например, сода (натрон),
встречается в природе в водахнатронных
озёр в Египте.
Природную соду древние египтяне
использовали для бальзамирования,
отбеливания холста, при варке пищи,
изготовлении красок и глазурей. Плиний
Старший пишет,
что в дельте Нила соду
(в ней была достаточная доля примесей)
выделяли из речной воды. Она поступала
в продажу в виде крупных кусков, из-за
примеси угля окрашенных
в серый или даже чёрный цвет.
Название
«натрий» происходит от латинского
слова natrium (ср. др.-греч. νίτρον),
которое было заимствовано изсреднеегипетского
языка (nṯr),
где оно означало среди прочего: «сода»,
«едкий натр»[2].
Аббревиатура
«Na» и слово natrium были
впервые использованы академиком,
основателем шведского общества врачей
Йенсом Якобсом Берцелиусом (Jöns Jakob
Berzelius, 1779—1848) для обозначения природных
минеральных солей, в состав которых
входила сода[3].
Ранее элемент именовался содием (лат. sodium).
Название sodium,
возможно, восходит к арабскому слову suda,
означающему «головная боль», так как
сода применялась в то время в качестве
лекарства от головной боли[4].
Натрий
впервые был получен английским
химиком Хемфри
Дэви в
1807 году электролизом твердого NaOH.
[править]Нахождение
в природе
Кларк натрия
в земной коре 25 кг/т. Содержание в морской
воде в
виде соединений — 10,5 г/л[5].
Металлический натрий встречается как
примесь, окрашивающая каменную соль в
синий цвет. Данную окраску соль приобретает
под действием радиации.
[править]Получение
Промышленное
получение натрия по способу Девилля,
распространённое в 19 веке. AC —
железная трубка со смесью соды, угля и
мела; B —
холодильник Донни и Мареска; R —
приёмник с нефтью.
Первым
промышленным способом получения натрия
стала карботермическая реакция
восстановления карбоната
натрия углем
при нагревании тесной смеси этих веществ
в железной ёмкости до 1000 °C
(способ Девилля) [6]:
Аналогично,
могут быть использованы карбид
кальция, алюминий, кремний, ферросилиций, силикоалюминий. [7] [8]
[7] [8]
С
появлением электроэнергетики стал
более практичен другой способ получения
натрия — электролиз расплава едкого
натра или хлорида
натрия.
В настоящее время электролиз —
основной способ получения натрия.
Натрий
также можно получить циркониетермическим
методом, а также термическим разложением
азида натрия.
[править]Физические
свойства
Металлический
натрий, сохраняемый вкеросине
Качественное
определение натрия
с помощью пламени — ярко-жёлтый
цветэмиссионного
спектра «D-линии натрия», дублет 588,9950 и
589,5924 нм.
Натрий —
серебристо-белый металл[9],
в тонких слоях с фиолетовым оттенком,
пластичен, даже мягок (легко режется
ножом), свежий срез натрия блестит.
Величины электропроводности и
теплопроводности натрия достаточно
высоки, плотность равна 0,96842 г/см³ (при
19,7 °C), температура плавления 97,86 °C,
температура кипения 883,15 °C.
Под
давлением становится прозрачным и
красным, как рубин[9].
При
комнатной температуре натрий образует
кристаллы в кубической
сингонии, пространственная
группа I m3m,
параметры ячейки a =
0,42820 нм, Z = 2. При температуре -268°С (5 К)
натрий переходит в гексагональную
фазу,
пространственная группа P 63/mmc,
параметры ячейки a =
0,3767 нм, c =
0,6154 нм, Z =
2.
[править]Химические
свойства
Щелочной
металл, на воздухе легко окисляется.
Для защиты от кислорода воздуха
металлический натрий хранят под
слоем керосина.
При
горении на воздухе или в кислороде
образуется пероксид натрия:
С
водой натрий реагирует очень бурно,
реакция идёт с выделением водорода,
который может самовоспламениться или
взорваться, куски металла всплывают на
поверхность и могут расплавиться:
Как
и все щелочные металлы, натрий является
сильным восстановителем и энергично
взаимодействуют со многими неметаллами
(за исключением азота, иода, углерода,
благородных газов):
Натрий
более активный чем литий.
С азотом реагирует
крайне плохо в тлеющем разряде, образуя
очень неустойчивое вещество — нитрид
натрия (в противоположность нитриду
лития):
С
разбавленными кислотами взаимодействует
как обычный металл:
С
концентрированными окисляющими кислотами
выделяются продукты восстановления:
Растворяется
в жидком аммиаке,
образуя синий раствор:
С
газообразным аммиаком взаимодействует
при нагревании
С
ртутью образует амальгаму натрия,
которая используется как более мягкий
восстановитель вместо чистого металла.
При сплавлении с калием даёт жидкий
сплав.
Алкилгалогениды
с избытком металла могут давать
натрийорганические соединения —
высокоактивные соединения, которые
обычно самовоспламеняются на воздухе
и взрываются с водой.
Изотопы
натрия
В
настоящее время известно 15 изотопов и
2 ядерных
изомера натрия.
Единственный стабильный изотоп 23Na.
У большинства изотопов период
полураспада меньше
одной минуты. Имеются также 2 радиоактивных
Имеются также 2 радиоактивных
изотопа с большим периодом полураспада.
Это излучающий позитроны 22Na
с периодом полураспада 2.6027 года, его
используют в качестве источника
позитронов и в научных исследованиях. 24Na
с периодом полураспада 15 часов используется
в медицине для диагностики и для лечения
некоторых форм лейкемии.
Применение
Металлический
натрий широко используется в препаративной
химии и промышленности как сильный
восстановитель, в том числе в металлургии.
Используется для осушения органических
растворителей, например, эфира.
Натрий используется в производстве
весьма энергоёмких натриево-серных
аккумуляторов.
Его также применяют в выпускных клапанах
грузовиков как теплоотвод. Изредка
металлический натрий применяется в
качестве материала для электрических
проводов, предназначенных для очень
больших токов.
В
сплаве с калием, а также
с рубидием и цезием используется
в качестве высокоэффективного
теплоносителя. В частности, сплав состава
натрий 12 %, калий 47 %, цезий 41 %
имеет рекордно низкую температуру
плавления −78 °C и был предложен в
качестве рабочего тела ионных ракетных
двигателей и теплоносителя для атомных
энергоустановок.
Натрий
также используется в газоразрядных
лампах высокого и низкого давления
(НЛВД и НЛНД). Лампы НЛВД типа ДНаТ
(Дуговая Натриевая Трубчатая) очень
широко применяются в уличном освещении.
Они дают ярко-жёлтый свет. Срок службы
ламп ДНаТ составляет 12-24 тысяч часов.
Поэтому газоразрядные лампы типа ДНаТ
незаменимы для городского, архитектурного
и промышленного освещения. Также
существуют лампы ДНаС, ДНаМТ (Дуговая
Натриевая Матовая), ДНаЗ (Дуговая
Натриевая Зеркальная) и ДНаТБР (Дуговая
Натриевая Трубчатая Без Ртути).
Металлический
натрий применяется в качественном
анализе органического вещества. Сплав
натрия и исследуемого вещества
нейтрализуют этанолом,
добавляют несколько миллилитров
дистиллированной воды и делят на 3 части,
проба Ж. Лассеня (1843), направлена на
определение азота, серы и галогенов (проба
Бейльштейна)
Хлорид
натрия (поваренная
соль) —
древнейшее применяемое вкусовое и
консервирующее средство.
Азид
натрия (NaN3)
применяется в качестве азотирующего
средства в металлургии и при получении
азида свинца.
Цианид
натрия (NaCN)
применяется при гидрометаллургическом
способе выщелачивания золота из горных
пород, а также при нитроцементации стали
и в гальванотехнике (серебрение,
золочение).
Хлорат
натрия (NaClO3)
применяется для уничтожения нежелательной
растительности на железнодорожном
полотне.
Биологическая
роль
В
организме натрий находится большей
частью снаружи клеток (примерно
в 15 раз больше чем в цитоплазме).
Эту разницу поддерживает натрий-калиевый
насос,
который откачивает попавший внутрь
клетки натрий.
Совместно
с калием натрий
выполняет следующие функции:
Создание
условий для возникновения мембранного
потенциала и
мышечных сокращений.Поддержание
осмотической концентрации крови.Поддержание кислотно-щелочного
баланса.Нормализация
водного баланса.Обеспечение
мембранного транспорта.Активация
многих энзимов.
Как работать с натрием
Натрий
является очень активным металлом,
который реагирует со многими веществами.
Реакции с участием натрия могут протекать
бурно со значительным выделением тепла.
При этом часто происходит воспламенение,
и даже взрыв. Для безопасной работы с
натрием необходимо иметь четкое
представление о его физических и
химических свойствах.
Натрий
легкий (плотность 0.97 г/см3),
мягкий и легкоплавкий (Тпл 97,86° С) металл.
По твердости он напоминает парафин или
мыло. На воздухе натрий очень быстро
окисляется, покрываясь серой пленкой,
что состоит из перекиси Na2O2 и
карбоната, поэтому натрий хранят в
хорошо закрытых банках под слоем
безводного керосина или масла.
Кусочек
натрия нужного размера отрезают, не
вынимая металл из керосина, с помощью
ножа или скальпеля. Из банки натрий
достают пинцетом. Все инструменты должны
быть сухими! После
этого натрий освобождают от остатков
керосина с помощью фильтровальной
бумажки. В некоторых случаях металл
очищают скальпелем от слоя перекиси,
поскольку контакт перекиси со свежей
поверхностью натрия может привести к
взрыву. Натрий нельзя брать руками.
Натрий нельзя брать руками.
Обрезки натрия сплавляют при слабом
нагревании под слоем керосина.
Посуду,
в которой был натрий, ни в коем случае
не допускается мыть водой — это может
привести к взрыву с трагическими
последствиями. Остатки натрия устраняют
добавлением спирта, только после этого
можно применять воду.
Работать
с натрием необходимо в защитных очках.
Никогда не забывайте, с чем вы имеете
дело — взрыв может произойти в самый
неожиданный и неподходящий момент, и к
этому нужно быть готовым.
Реакция натрия с водой
В
кристаллизатор налейте на 3/4 воду и
добавьте в нее несколько капель
фенолфталеина. Бросьте в кристаллизатор
кусочек натрия размером с половину
горошины. Натрий останется на поверхности,
поскольку он легче воды. Кусочек начнет
активно реагировать с водой с выделением
водорода. От тепла реакции металл
расплавится и превратится в серебристую
капельку, которая будет активно бегать
по поверхности воды. При этом слышится
шипение. Иногда водород, который
выделяется, загорается желтым пламенем.
Такой цвет придают ему пары натрия. Если
воспламенения не произошло, водород
можно поджечь. Однако кусочки натрия
размером меньше пшеничного зернышка
гаснут.
2Na
+ 2H2O
= 2NaOH + H2
В
результате реакции образуется щелочь,
которая действует на фенолфталеин,
поэтому кусочек натрия оставляет за
собой малиновый след. Под конец опыта
практически вся вода в кристаллизаторе
окрасится в малиновый цвет.
Не
следует брать натрия слишком много,
иначе возможен взрыв. Когда автор взял
кусочек натрия размером с фасолину, то
реакция началась спокойно, но через
несколько секунд последовал взрыв. В
результате брызги расплавленного натрия
разлетелись во все стороны, часть их
попала на фотоаппарат, в том числе — на
стекло объектива. Многоразовое протирание
объектива ваткой со спиртом спасло
положение — снимки из других разделов
выполнены уже после взрыва с помощью
этого же фотоаппарата.
| | ||
| | ||
| Под |
Стенки
кристаллизатора должны быть свободны
от жира и других загрязнений. В случае
необходимости их промывают раствором
щелочи, иначе натрий прилипает к стенкам,
и кристаллизатор может треснуть.
Опыт
следует проводить в защитной маске или
защитных очках. Во время реакции держитесь
на некотором расстоянии и ни в коем
случае не наклоняйтесь над кристаллизатором.
Попадание расплавленного натрия или
брызг щелочи в глаза грозит практически
гарантированной слепотой.
19 | Калий |
K 39,098 | |
[Ar]4s1 | |
Ка́лий — элемент главной
подгруппы первой группы, четвёртого
периода периодической
системы химических элементовД. И. Менделеева,
И. Менделеева,
с атомным
номером 19.
Обозначается символом K (лат. Kalium). Простое
вещество калий (CAS-номер:
7440-09-7) — мягкий щелочной
металл серебристо-белого
цвета.
В
природе калий встречается только в
соединениях с другими элементами,
например, в морской
воде,
а также во многихминералах.
Очень быстро окисляется на воздухе и
очень легко вступает в химические
реакции, особенно с водой,
образуящёлочь.
Во многих отношениях химические свойства
калия очень близки к натрию,
но с точки зрения биологической функции
и использования их клетками живых
организмов они всё же отличаются.
Нахождение
в природе
В
свободном состоянии не встречается.
Калий входит в
состав сильвина KCl, сильвинита KCl·NaCl, карналлитаKCl·MgCl2·6H2O, каинита KCl·MgSO4·6H2O,
а также присутствует в золе некоторых
растений в виде карбоната K2CO3 (поташ).
Калий входит в состав всех клеток (см.
ниже разделБиологическая
роль). Кларк калия
в земной коре составляет 2,4 % (5-й по
распространённости металл, 7-й по
содержанию в коре элемент). Концентрация
в морской
воде 380
мг/л[3].
[править]Месторождения
Крупнейшие
месторождения калия находятся на
территории Канады (производитель PotashCorp), России (ОАО
«Уралкалий»,
г. Березники,
ОАО «Сильвинит»,
г. Соликамск, Пермский
край, Верхнекамское
месторождение калийных руд[4]), Белоруссии (ПО
«Беларуськалий»,
г. Солигорск, Старобинское
месторождение калийных руд[5]).
[править]Получение
Калий,
как и другие щелочные металлы,
получают электролизом расплавленных хлоридов или
щелочей. Так как хлориды имеют более
высокую температуру плавления
(600—650 °C),
то чаще проводят электролиз расплавленных
щелочей с добавкой к ним соды или поташа
(до 12 %). При электролизе расплавленных
При электролизе расплавленных
хлоридов на катоде выделяется
расплавленный калий, а на аноде — хлор:
При
электролизе щелочей на катоде также
выделяется расплавленный калий, а на
аноде — кислород:
Вода
из расплава быстро испаряется. Чтобы
калий не взаимодействовал с хлором или
кислородом, катод изготовляют из меди и
над ним помещают медный цилиндр.
Образовавшийся калий в расплавленном
виде собирается в цилиндре. Анод
изготовляют также в виде цилиндра
из никеля (при
электролизе щелочей) либо из графита (при
электролизе хлоридов).
Важное
промышленное значение имеют и методы
термохимического восстановления:
и
восстановление из расплава хлорида
калия карбидом
кальция, алюминием или кремнием.[6][7]
[править]Физические
свойства
Калий
под слоем ТГФ
Калий —
серебристое вещество с характерным
блеском на свежеобразованной поверхности.
Очень лёгок и легкоплавок. Относительно
хорошо растворяется в ртути,
образуя амальгамы. Будучи внесённым в
пламя горелки, калий (а также его
соединения) окрашивает пламя в характерный
розово-фиолетовый цвет[8].
Калий
активно взаимодействует с водой.
Выделяющийся водородвоспламеняется,
а ионы калия придают пламени фиолетовый
цвет.
Растворфенолфталеина в
воде становится малиновым, демонстрируя
щелочную реакцию образующегося KOH.
Калий
образует кристаллы кубической
сингонии, пространственная
группа I m3m,
параметры ячейки a =
0,5247 нм, Z = 2.
[править]Химические
свойства
Элементарный
калий, как и другие щелочные
металлы,
проявляет типичные металлические
свойства и очень химически активен,
является сильным восстановителем. На
воздухе свежий срез быстро тускнеет
из-за образования плёнок соединений
(оксиды и карбонат). При длительном
контакте с атмосферой способен полностью
разрушиться. С водой реагирует со
С водой реагирует со
взрывом. Хранить его необходимо под
слоембензина, керосина или силикона,
дабы исключить контакт воздуха и воды
с его поверхностью. С Tl, Sn, Pb, Bi калий
образует интерметаллиды.
[править]Взаимодействие
с простыми веществами
Калий
при комнатной температуре реагирует с
кислородом воздуха, галогенами;
практически не реагирует с азотом (в
отличие от лития и
натрия). При умеренном нагревании
реагирует с водородом с
образованием гидрида (200—350 °C):
,
с халькогенами (100—200 °C,
E = S, Se, Te):
.
При
сгорании калия на воздухе
образуется надпероксид
калия KO2 (с
примесью K2O2):
В
реакции с фосфором в
инертной атмосфере образуется фосфид зелёного
цвета (200 °C):
[править]Взаимодействие
со сложными веществами
Калий
при комнатной температуре активно
реагирует с водой, кислотами, растворяется
в жидком аммиаке (−50 °C) с образованием
тёмно-синего раствора.
Калий
глубоко восстанавливает разбавленные серную и азотную кислоты:
При
сплавлении металлического калия со
щелочами он восстанавливает водород
гидроксогруппы:
При
умеренном нагревании реагирует с
газообразным аммиаком с
образованием амида (65—105 °C):
Металлический
калий реагирует со спиртами с
образованием алкоголятов:
Алкоголяты
щелочных металлов (в данном случае,
этаноат калия) являются очень
сильными основаниями и
широко используются в органическом
синтезе.
[править]Соединения
с кислородом
При
взаимодействии калия
с кислородом воздуха образуется
не оксид, а пероксид и супероксид:
Оксид
калия может
быть получен при нагревании металла до
температуры не выше 180 °C в среде,
содержащей очень мало кислорода,
или при нагревании смеси супероксида
калия с металлическим калием:
Оксиды
калия обладают ярко выраженными основными
свойствами, бурно реагируют с водой,
кислотами и кислотными оксидами.
Практического значения они не имеют.
Пероксиды представляют собой
желтовато-белые порошки, которые, хорошо
растворяясь в воде, образуют щёлочи
и пероксид
водорода:
Советский
изолирующий противогазИП-5
Свойство
обменивать углекислый газ на кислород
используется в изолирующих противогазах и
на подводных лодках. В качестве поглотителя
используют эквимолярную смесь супероксида
калия и пероксида натрия. Если смесь не
эквимолярна, то в случае избытка пероксида
натрия поглотится больше газа, чем
выделится (при поглощении двух объёмов
CO2 выделяется
один объём O2),
и давление в замкнутом пространстве
упадёт, а в случае избытка супероксида
калия (при поглощении двух объёмов
CO2 выделяется
три объёма O2)
выделяется больше газа, чем поглотится,
и давление повысится.
В
случае эквимолярной смеси (Na2O2:K2O4 =
1:1) объёмы поглощаемого и выделяемого
газов будут равны (при поглощении четырёх
объёмов CO2 выделяется
четыре объёма O2).
Пероксиды
являются сильными окислителями, поэтому
их применяют для отбеливания тканей
в текстильной промышленности.
Получают
пероксиды прокаливанием металлов на
воздухе, освобождённом от углекислого
газа.
Также
известен озонид калия KO3,
оранжево-красного цвета. Получить его
можно взаимодействием гидроксида калия
с озоном при
температуре не выше 20 °C:
Озонид
калия является очень сильным окислителем,
например, окисляет элементарную
серу до
сульфата и дисульфата уже
при 50 °C:
[править]Гидроксид
Основная
статья: Гидроксид
калия
Гидроксид
калия (или едкое
кали)
представляет собой твёрдые белые
непрозрачные, очень гигроскопичные кристаллы,
плавящиеся при температуре 360 °C.
Гидроксид калия относится к щелочам.
Он хорошо растворяется в воде с выделением
большого количества тепла. Растворимость
едкого кали при 20 °C в 100 г воды
составляет 112 г.
Натрий в воде — методы исследования и воздействие на человека
В разделе: Вода
22.01.2019
Бузин Игорь
Кандидат биологических наук
Химическое обозначение: Na
Синонимы: сода, едкий натр, содий.
Описание: элемент 1 группы 3 периода с атомным номером 11. Мягкий металл серебристого цвета с повышенной способностью вступать в реакции.
Методы определения: потенциометрия, титрование, масс-спектрометрия, атомная абсорбция и эмиссия.
Методики, используемые в Испытательном центре МГУ для определения концентрации натрия в природных средах
|
Нормативный документ на методику |
Метод определения |
Оборудование |
|---|---|---|
|
Вода | ||
|
ЦВ 3. 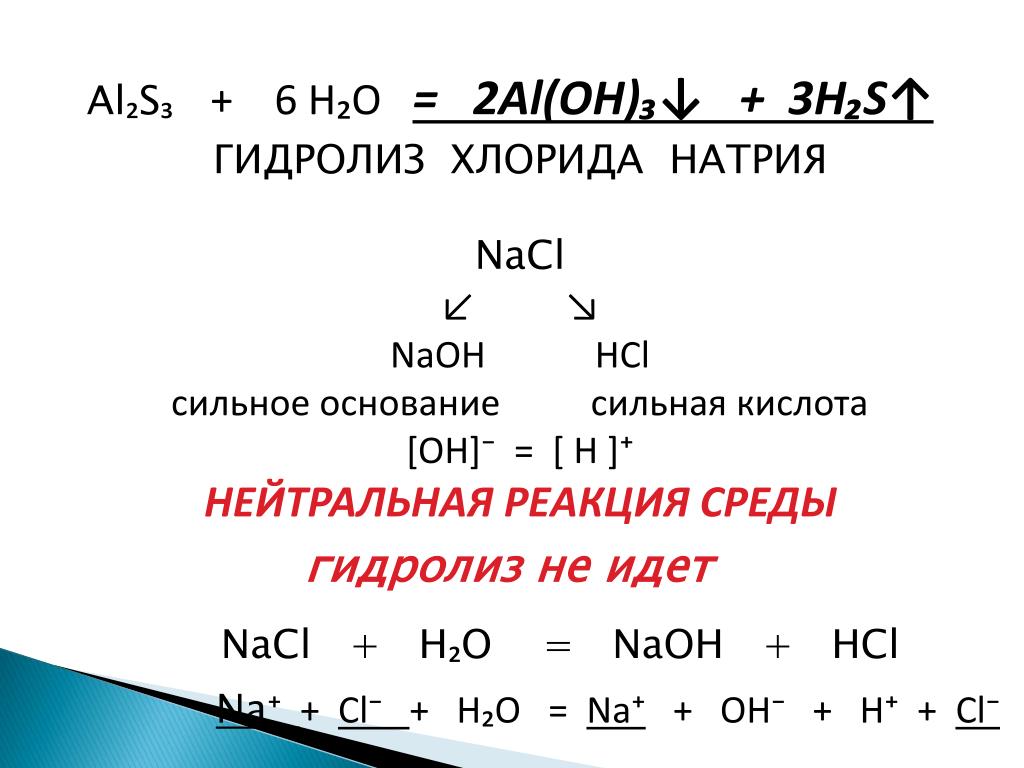 18.05-2005 18.05-2005 (ФР.1.31.2005.01714) |
масс-спектрометрия |
AGILENT 7500A ICP-MS |
|
РД 52.24.391-2008 |
пламенно-фотометрический |
ANALYTIK JENA CONTRAA 300 |
|
Почва | ||
|
ФР.1.31.2009.06787 |
масс-спектрометрия |
AGILENT 7500A ICP-MS |
|
ФР.1.29.2006.02149 |
масс-спектрометрия |
AGILENT 7500A ICP-MS |
Контроль измерений проводят на оборудовании: AGILENT 5110 ICP-OES и BRUKER S2 PICOFOX.
Распространённость: в свободном виде натрий не встречается в природе, однако распространён в составе соединений. В земной коре на тонну породы приходится до 25 кг натрия, а в литре морской воды содержание этого элемента превышает 10,6 г. Самая распространённый форма натрия, с которой сталкивается человек — поваренная соль NaСl. Наряду с другими макроэлементами концентрация натрия в воде обуславливает минерализацию воды.
Самая распространённый форма натрия, с которой сталкивается человек — поваренная соль NaСl. Наряду с другими макроэлементами концентрация натрия в воде обуславливает минерализацию воды.
Нормирование
В воде систем централизованного водоснабжения, как и в бутилированной воде, содержание натрия нормируется напрямую. Для бутилированной воды высшей категории концентрация натрия находится в жёстких рамках. Несмотря на наличие положительной роли натрия в работе организма, допускается его полное отсутствие в питьевой воде: это связано с тем, что значительное количество натрия мы получаем с пищей.
Предельно допустимая концентрация (ПДК) натрия в различных водных объектах
|
Нормирование |
ПДК, мг/л |
|---|---|
|
Бутилированная вода первой категории СанПиН 2.1.4.1116-02 |
0–200 |
|
Бутилированная вода высшей категории СанПиН 2.  1.4.1116-02 1.4.1116-02
|
0–20 |
|
Вода систем централизованного водоснабжения СанПиН 2.1.4.1074-01 |
0-200 |
|
Водные объекты рыбохозяйственного значения Приказ Минсельхоза РФ № 552 |
0–120 |
|
Объекты рекреационного водопользования СанПиН 2.1.5.980-00 |
— |
|
Вода плавательных бассейнов СанПиН 2.1.2.1188-03 |
— |
|
Хозяйственно-бытовые стоки Постановление Правительства РФ № 644 |
— |
|
Ливневые стоки Постановление Правительства РФ № 644 |
— |
Польза и вред
Норма потребления натрия составляет 5 г в сутки.
Натрий участвует в:
- поддержании постоянного осмотического давления в клетках и тканях;
- перераспределении воды в организме;
- регуляции кислотно-щелочного равновесия;
- проводимости нервных импульсов;
- сокращении мышц;
- пищеварении и всасывании.
При недостатке элемента наблюдаются:
- сокращение содержания воды в жидкой части крови;
- повышение содержания в крови азотсодержащих продуктов метаболизма;
- сокращение объема жидкости, находящейся вне клеток организма.
При избытке натрия наблюдается:
- аккумуляция избытка жидкости в организме;
- рост возбудимости миокарда;
- повышение артериального давления;
- головная боль.
Методы очистки воды
Натрий сам по себе является побочным продуктом фильтрования воды от солей жесткости посредством ионообменных смол. Очень часто излишнее умягчение приводит к повышению содержания натрия и выходу за рамки предельно допустимых концентраций.
Очень часто излишнее умягчение приводит к повышению содержания натрия и выходу за рамки предельно допустимых концентраций.
Обратите внимание: если одновременно
- в Вашей воде превышено содержание натрия;
- Вы используете водоподготовительную (фильтрационную) систему;
- жёсткость Вашей воды (согласно результатам испытаний) не превышает 0,5 мг-экв/л.
Вам обязательно нужно настроить умягчитель таким образом, чтобы интенсивность умягчения снизилась, а показатель жёсткости находился в оптимальном диапазоне 1,5–2,5 мг-экв/л. Такая жёсткость воды после умягчения не только позволит сохранить полезные для организма уровни содержания кальция и магния, но и снизить дозу натрия, поступающего в воду при умягчении.
Обратный осмос. Вместе с другими веществами обратный осмос убирает из воды натрий. Поскольку метода избирательного удаления натрия из воды нет или он не распространен, удалить излишки натрия из воды можно с помощью обратного осмоса.
Натрий относится к элементам, которые характеризуются как отрицательным, так и положительным влиянием на организм человека. Поэтому необходимо контролировать содержания натрия в питьевой воде и регулировать его содержание таким образом, чтобы концентрация находилась в оптимальном диапазоне.
Натрий (Na) и вода
- Дом
- Таблица Менделеева
- Элементы и вода
- Натрий в воде (Na + h3O)
| Миллиардами лет и натрий вымывается из почвы, перегибается почва в океанах, где он может оставаться около 50 900 15 . 10 6 лет. Морская вода содержит примерно 11 000 частей на миллион натрия. Реки содержат только около 9 частей на миллион. Питьевая вода обычно содержит около 50 мг/л натрия. Это значение явно выше для минеральной воды. В растворимой форме натрий всегда присутствует в виде Na + ионов. Каким образом и в какой форме натрий реагирует с водой? Элементарный натрий сильно реагирует с водой по следующему механизму реакции: 2Na(s) + 2H 2 O → 2NaOH(aq) + H состоящий из сильно щелочного гидроксида натрия (едкого натра) и газообразного водорода. Растворимость натрия и соединений натрия Имеется ряд примеров растворимости натрия в воде. Наиболее известным соединением натрия является хлорид натрия (NaCl), также известный как поваренная соль. При 20 o C растворимость составляет 359 г/л, т. е. достаточно растворима в воде. Растворимость почти не зависит от температуры. Карбонат натрия (Na 2 CO 3 ) также хорошо растворяется в воде. Растворимость 220 г/л при 20 o C. Почему в воде присутствует натрий? Соединения натрия естественным образом попадают в воду. Как упоминалось ранее, натрий происходит из горных пород и почв. Натрий относится ко 2 классу опасности для воды, другими словами, представляет опасность при наличии в воде. Однако хлорид натрия не представляет опасности и относится к классу опасности для воды 1. Каково влияние натрия в воде на здоровье? Натрий присутствует в организме человека в количестве около 100 г. Это диетический минерал, частично отвечающий за нервные функции. Сыворотка крови содержит 3,3 г/л натрия. Он регулирует внеклеточную жидкость, кислотно-щелочной баланс и мембранный потенциал, частично вместе с калием. Какие технологии очистки воды можно применить для удаления натрия из воды? Для удаления хлорида натрия из воды можно применять методы обратного осмоса, электродиализа, дистилляции или ионного обмена. Обратный осмос наиболее экономичен с точки зрения затрат энергии и денежных средств. Литература и другие элементы и их взаимодействие с водой |
Еще из «Элементы и вода»
Алюминий в воде (AL + h3O)
Аргон в воде (Ar + h3O)
6 вода (As + h3O)
Бор в воде (B + h3O)
Кальций в воде (Ca + h3O)
Хром в воде (Cr + h3O)
Гелий в воде (He + h3O)
Йод в воде (I + h3O)
Железо в воде (Fe + h3O)
Свинец в воде (Pb + h3O)
Литий в воде (Li + h3O)
Магний в воде (Mg + h3O)
Никель в воде (Ni + h3O)
Азот в воде (N + h3O)
Кислород в воде (O2 + h3O)
Калий в воде (K + h3O)
Кремний в воде (Si + h3O)
Серебро в воде (Ag + h3O)
Стронций в воде (Sr + h3O)
Олово в воде (SN + h3O)
Титан в воде (Ti + h3O)
Цинк в воде (Zn + h3O)
Мышьяк в воде
Реакция Натрий в воде
Учебные пособия
- Сообщение от
Мелисса Валки
19
Aug
Основные понятия
В этом уроке вы узнаете о реакции между натрием и водой , что вызывает это и как это работает.
Темы, охватываемые в других статьях
- натрия
- Сгорание
- ГВodens
- Энергия ионизации
- кипящий и температура плавления водой
Над взрывается в воде
22222. горячий и шипит; иногда реакция может быть достаточно экстремальной, чтобы вызвать пламя и взрывы. Однако при контакте с водой хлорид натрия просто растворяется; а когда хлор попадает в воду, он действует как дезинфицирующее средство, убивая бактерии и микроорганизмы. Так что же сам по себе натрий вызывает такую бурную реакцию? Ответ связан с квантовыми взаимодействиями между металлом и молекулами воды.
Стабильность натрия и воды
Эту реакцию может быть немного легче понять, если сравнить натрий с благородным газом; он похож на неон, который имеет десять протонов и десять электронов. Благородные газы известны своей стабильностью из-за их полных атомных орбиталей, которым не нужно приобретать или терять электроны; у неона 1s, 2s и 2p орбитали заполнены. Эта стабильность нарушается, когда вы отклоняетесь от благородных газов, таких как натрий. Этот элемент имеет 11 протонов, и «лишний» электрон очень слабо удерживается следующей атомной орбиталью. Вот почему натрий так легко отдает электрон в таких соединениях, как хлорид натрия, который образует стабильную связь.
Благородные газы известны своей стабильностью из-за их полных атомных орбиталей, которым не нужно приобретать или терять электроны; у неона 1s, 2s и 2p орбитали заполнены. Эта стабильность нарушается, когда вы отклоняетесь от благородных газов, таких как натрий. Этот элемент имеет 11 протонов, и «лишний» электрон очень слабо удерживается следующей атомной орбиталью. Вот почему натрий так легко отдает электрон в таких соединениях, как хлорид натрия, который образует стабильную связь.
С другой стороны, вода может выглядеть как стабильная молекула, но она является высокополярной молекулой. Из-за его изогнутой формы одна сторона кислорода имеет предпочтительный отрицательный заряд (сторона с неподеленными парами), а другая — предпочтительный положительный заряд (сторона с двумя атомами водорода). Когда вместе много жидкой воды, молекулы располагаются так, что отрицательные концы «нейтрализуют» положительные концы, и электрическая потенциальная энергия минимизируется. Некоторые молекулы воды, одна из миллионов, диссоциируют на соответствующие им ионы – протон (H + ) и гидроксильных (ОН – ) ионов.
Смешивание натрия и воды
Что происходит, когда вы смешиваете натрий с полярной водой, протонами и ионами гидроксила? Свободно удерживаемый электрон натрия захочет вступить в реакцию с единственным найденным протоном. Электроны натрия соединяются с ионами водорода, что происходит, когда более нейтральные молекулы воды диссоциируют, образуя свободные протоны; на это уходит около 13,6 эВ энергии. Нейтральные атомы водорода движутся к энергетически выгодному состоянию, нейтральному двухатомному газу H 2 , который содержит 13,6 эВ энергии, поступающей в систему.
Уравнение реакции металлического натрия и воды
В этой экзотермической реакции твердый натрий смешивается с водой с образованием бесцветного щелочного раствора, состоящего из крепкого щелочного гидроксида натрия и газообразного водорода. Во время взаимодействия натрий может нагреться настолько, что горит оранжевым пламенем. Ниже представлена реакция:
2Na (т) + 2H 2 O → 2NaOH (водн. ) + H 2(г)
) + H 2(г)
Теперь у вас есть энергия в виде тепла и газообразного водорода, который стремится уйти в атмосферу, содержащую газообразный кислород (O 2 ). Это вызывает горение водорода/кислорода! Эти два в присутствии тепловой энергии производят водяной пар и больше энергии, что объясняет интенсивную и взрывную реакцию. Эта реакция продолжается до тех пор, пока натрий полностью не растворится в своей ионизированной и растворимой форме Na + .
Может ли металлический натрий быть опасным для здоровья?
Хотя мы только что узнали, что металлический натрий может быть взрывоопасным при воздействии воды, натрий на самом деле необходим организму, так как это диетический минерал, необходимый для нервных функций. (Дополнительную информацию см. в нашем руководстве по нейротрансмиттерам). Сыворотка крови используется в регуляции внутреннего кислотно-щелочного баланса, мембранного потенциала и внеклеточной жидкости. Мы потребляем натрий в его нейтрализованной форме хлорида натрия или поваренной соли.

 10
10 Это экзотермическая реакция. Металлический натрий нагревается и может загореться и гореть характерным оранжевым пламенем. Газообразный водород, выделяющийся в процессе горения, сильно реагирует с кислородом воздуха.
Это экзотермическая реакция. Металлический натрий нагревается и может загореться и гореть характерным оранжевым пламенем. Газообразный водород, выделяющийся в процессе горения, сильно реагирует с кислородом воздуха.  Не только моря, но и реки и озера содержат значительное количество натрия. Однако концентрации намного ниже, в зависимости от геологических условий и загрязнения сточных вод.
Не только моря, но и реки и озера содержат значительное количество натрия. Однако концентрации намного ниже, в зависимости от геологических условий и загрязнения сточных вод.  В гигиенических моющих средствах элемент присутствует в виде гипохлорита натрия.
В гигиенических моющих средствах элемент присутствует в виде гипохлорита натрия. 
 Людям с диареей или другими последствиями для здоровья, которые увеличивают потребность в соли, требуется большее количество натрия в рационе, чем обычно. Потребление взрослой поваренной соли составляет в среднем 9 г в день, что соответствует примерно 4 г натрия. Людям с заболеваниями сердца и почек рекомендуется диета с низким содержанием натрия.
Людям с диареей или другими последствиями для здоровья, которые увеличивают потребность в соли, требуется большее количество натрия в рационе, чем обычно. Потребление взрослой поваренной соли составляет в среднем 9 г в день, что соответствует примерно 4 г натрия. Людям с заболеваниями сердца и почек рекомендуется диета с низким содержанием натрия. 