ЖИЗНЬ, МОЛЕКУЛА ВОДЫ И ЗОЛОТАЯ ПРОПОРЦИЯ. Молекула воды
ЖИЗНЬ, МОЛЕКУЛА ВОДЫ И ЗОЛОТАЯ ПРОПОРЦИЯ
Соотношения золотой пропорции исследователи находят в морфологической структуре растений, птиц, животных, человека. Закономерности золотой пропорции обнаруживаются и в организации неживой природы. В данной статье на основании анализа молекулы воды в различных агрегатных состояниях высказана гипотеза, что ее структура в состоянии талой воды практически соответствует треугольнику золотой пропорции.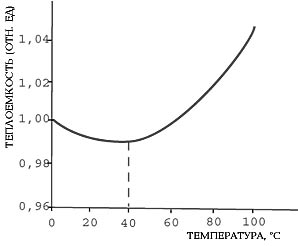
Теплоемкость воды достигает минимального значения при температуре около 37<SUP>о</SUP>С.
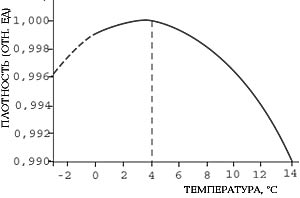
Илл. 1. Плотность воды при понижении температуры сначала возрастает, достигает максимума при 4<SUP>о</SUP>С и начинает уменьшаться.
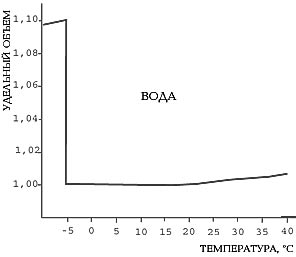
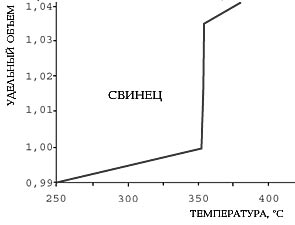
В момент плавления объем свинца мгновенно увеличивается от 1 до 1,003, а объем воды скачком уменьшается от 1,1 до 1,0.
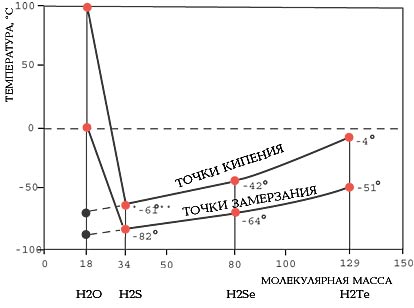
Вода имеет аномально высокие температуры кипения и замерзания по сравнению с другими трехатомными соединениями водорода.
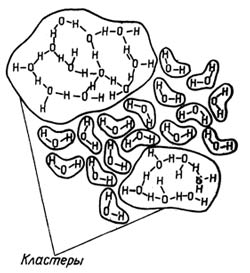
В жидкой воде молекулы H<SUB>2</SUB>O могут объединяться в сложные образования - кластеры, по структуре напоминающие лед.
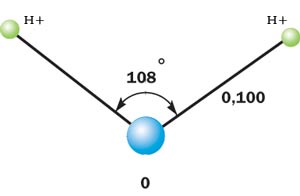
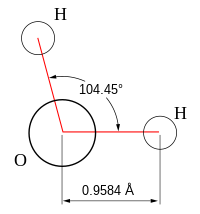
Схематичное изображение молекулы воды на плоскости.
Деление отрезка в крайнем и среднем отношении, или золотая пропорция. Отрезок разделен на две части так, что CB:AC = AC:AB.
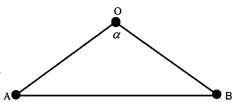
"Золотой треугольник". Соотношение его сторон OA:AB = OB:AB ≈ 0,618,
‹
›
Воде была дана волшебная власть стать соком жизни на Земле. Леонардо да Винчи
Вода - одно из самых уникальных и загадочных веществ на Земле. Природа этого вещества до конца еще не понята. Внешне вода кажется достаточно простой, в связи с чем долгое время считалась неделимым элементом. Лишь в 1766 году Г. Кавендиш (Англия) и затем в 1783 году А. Лавуазье (Франция) показали, что вода не простой химический элемент, а соединение водорода и кислорода в определенной пропорции. После этого открытия химический элемент, обозначаемый как Н, получил название "водород" (Hydrogen - от греч. hydro genes), которое можно истолковать как "порождающий воду".

Дальнейшие исследования показали, что за незатейливой химической формулой Н2О скрывается вещество, обладающее уникальной структурой и не менее уникальными свойствами. Исследователи, пытавшиеся на протяжении двух с лишним столетий раскрыть секреты воды, часто заходили в тупик. Да и сейчас ученые понимают, что вода остается трудным объектом для исследований, ее свойства до сих пор не всегда до конца прогнозируемы.
Загадочная магия воды. Почему жидкая вода имеет необычные свойства? Традиционный ответ может быть следующим: из-за свойств атомов кислорода и водорода, из-за их структурного расположения в молекуле, из-за определенного поведения электронов в молекуле и т.п.
Так в чем же заключаются загадочные, необычные свойства привычной всем жидкой воды? Прежде всего, в том, что практически все свойства воды аномальны, а многие из них не подчиняются логике тех законов физики, которые управляют другими веществами. Кратко упомянем те из них, которые обуславливают существование жизни на Земле.
Вначале о трех особенностях тепловых свойств воды.
Первая особенность: вода - единственное вещество на Земле (кроме ртути), для которого зависимость удельной теплоемкости от температуры имеет минимум.
Из-за того, что удельная теплоемкость воды имеет минимум около 37оС, нормальная температура человеческого тела, состоящего на две трети из воды, находится в диапазоне температур 36-38оС (внутренние органы имеют более высокую температуру, чем наружные).
Вторая особенность: теплоемкость воды аномально высока. Чтобы нагреть определенное ее количество на один градус, необходимо затратить больше энергии, чем при нагреве других жидкостей, - по крайней мере вдвое по отношению к простым веществам. Из этого вытекает уникальная способность воды сохранять тепло. Подавляющее большинство других веществ таким свойством не обладают. Эта исключительная особенность воды способствует тому, что у человека нормальная температура тела поддерживается на одном уровне и жарким днем, и прохладной ночью.
Таким образом, вода играет главенствующую роль в процессах регулирования теплообмена человека и позволяет ему поддерживать комфортное состояние при минимуме энергетических затрат. При нормальной температуре тела человек находится в наиболее выгодном энергетическом состоянии.
Температура других теплокровных млекопитающих (32-39оС) также хорошо соотносится с температурой минимума удельной теплоемкости воды.
Третья особенность: вода обладает высокой удельной теплотой плавления, то есть воду очень трудно заморозить, а лед - растопить. Благодаря этому климат на Земле в целом достаточно стабилен и мягок.
Все три особенности тепловых свойств воды позволяют человеку оптимальным образом существовать в условиях благоприятной среды.
Имеются особенности и в поведении объема воды. Плотность большинства веществ - жидкостей, кристаллов и газов - при нагревании уменьшается и при охлаждении увеличивается, вплоть до процесса кристаллизации или конденсации. Плотность воды при охлаждении от 100 до 4оС (точнее, до 3,98оС) возрастает, как и у подавляющего большинства жидкостей. Однако, достигнув максимального значения при температуре 4оС, плотность при дальнейшем охлаждении воды начинает уменьшаться. Другими словами, максимальная плотность воды наблюдается при температуре 4оС (одна из уникальных аномалий воды), а не при температуре замерзания 0оС.
Замерзание воды сопровождается скачкообразным(!) уменьшением плотности более чем на 8%, тогда как у большинства других веществ процесс кристаллизации сопровождается увеличением плотности. В связи с этим лед (твердая вода) занимает больший объем, чем жидкая вода, и держится на ее поверхности.
Столь необычное поведение плотности воды крайне важно для поддержания жизни на Земле.
Покрывая воду сверху, лед играет в природе роль своего рода плавучего одеяла, защищающего реки и водоемы от дальнейшего замерзания и сохраняющего жизнь подводному миру. Если бы плотность воды увеличивалась при замерзании, лед оказался бы тяжелее воды и начал тонуть, что привело бы к гибели всех живых существ в реках, озерах и океанах, которые замерзли бы целиком, превратившись в глыбы льда, а Земля стала ледяной пустыней, что неизбежно привело бы к гибели всего живого.
Отметим еще некоторые особенности воды.
Внешне вода подвижна и податлива, и ее можно заключить в любой сосуд. Однако, проникая в трещины горных пород и расширяясь при замерзании, вода раскалывает скальные породы любой твердости, которые постепенно распадаются на все более мелкие частицы. Так начинается возврат окаменевших пород в жизненный цикл: на полях промерзание поверхностных слоев земли с ее органическими компонентами помогает образованию плодородной почвы.
Процесс включения твердых веществ в большой круговорот живой природы ускоряется чудесным свойством воды их растворять. Вода с растворенными компонентами твердых веществ становится средой питания и поставщиком микроэлементов, необходимых для жизни растений, животных и человека.
Вода сильнее других жидкостей проявляет свойства универсального растворителя. Если ей дать достаточно времени, она может растворить практически любое твердое вещество. Именно из-за уникальной растворяющей способности воды никому до сих пор не удалось получить химически чистую воду - она всегда содержит растворенный материал сосуда. Вода абсолютно необходима для всех ключевых систем жизнеобеспечения человека. Она содержится в человеческой крови (79%) и способствует переносу по кровеносной системе в растворенном состоянии тысяч необходимых для жизни веществ. Вода содержится в лимфе (96%), которая разносит из кишечника питательные вещества по тканям живого организма (см. таблицу 1).
Перечисленные свойства и особая роль воды в обеспечении жизни на Земле не могут оставить равнодушным ни один пытливый ум, даже если он верит в счастливые случайности. "Начало всего есть вода", - справедливо отмечал Фалес из Милета в VI веке до н.э.
Жидкое чудо. Прекратим перечисление странных, но жизненно необходимых свойств воды, которых можно набрать еще с десяток, и переключим внимание на секреты необычного строения ее молекулы. Именно анализ строения молекулы воды позволяет понять ее исключительность в живой и неживой природе. Так что дорога к истине проходит через строение одиночной молекулы воды.
Прежде всего отметим, что молекула воды самая маленькая среди подобных трехатомных молекул (по отношению к гомологам, то есть водородным соединениям типа Н2S, Н2Se, Н2Те, со свойствами которых традиционно сравнивают свойства воды). Такие молекулы при нормальных условиях образуют газы, а молекулы воды - жидкость. Почему?
Хаотичное сообщество газообразных молекул воды при конденсации, то есть при образовании жидкой фазы, формирует жидкое вещество удивительной сложности. В первую очередь это связано с тем, что молекулы воды обладают уникальным свойством объединяться в кластеры (группы) (Н2О)x. Под кластером обычно понимают группу атомов или молекул, объединенных физическим взаимодействием в единый ансамбль, но сохраняющих внутри него индивидуальное поведение. Возможности прямого наблюдения кластеров ограничены, и поэтому экспериментаторы компенсируют аппаратурные недостатки интуицией и теоретическими построениями.
При комнатной температуре степень ассоциации X для воды составляет, по современным данным, от 3 до 6. Это означает, что формула воды не просто Н2О, а среднее между Н6О3 и Н12О6. Другими словами, вода - сложная жидкость, "составленная" из повторяющихся групп, содержащих от трех до шести одиночных молекул. Вследствие этого вода имеет аномальные значения температуры замерзания и кипения по сравнению с гомологами. Если бы вода подчинялась общим правилам, она должна была замерзать при температуре порядка -100оС и закипать при температуре около +10оС.
Если бы вода при испарении оставалась в виде Н6О3, Н8О4 или Н12О6, то водяной пар был бы намного тяжелее воздуха, в котором доминируют молекулы азота и кислорода. В этом случае поверхность всей Земли была бы покрыта вечным слоем тумана. Представить себе жизнь на такой планете практически невозможно.
Людям крупно повезло: кластеры воды при испарении распадаются, и вода превращается практически в простой газ с химической формулой Н2О (обнаруженное в последнее время в паре незначительное количество димеров Н4О2 погоды не делает). Плотность газообразной воды меньше плотности воздуха, и поэтому вода способна насыщать своими молекулами земную атмосферу, создавая комфортные для человека погодные условия.
На Земле нет других веществ, наделенных способностью быть жидкостью при температурах существования человека и при этом образовывать газ не только легче воздуха, но и способный возвращаться к ее поверхности в виде осадков.
Восхитительная геометрия. Итак, какова же самая маленькая среди трехатомных молекул? Молекула воды имеет симметричную V-образную форму, так как два небольших атома водорода располагаются с одной стороны от сравнительно крупного атома кислорода. Это сильно отличает молекулу воды от линейных молекул, например Н2Ве, в которой все атомы располагаются цепочкой. Именно такое странное расположение атомов в молекуле воды и позволяет ей иметь множество необычных свойств.
Если внимательно рассмотреть геометрические параметры молекулы воды, то в ней обнаруживается определенная гармония. Чтобы увидеть ее, построим равнобедренный треугольник Н-О-Н с протонами в основании и кислородом в вершине. Такой треугольник схематично копирует структуру молекулы воды, проекция которой на плоскость условно изображена на рисунке.
Длины сторон этого треугольника и валентный угол между двумя связями О-Н изменяются при изменении агрегатного состояния воды. Приведем эти параметры (см. таблицу 2).
Прокомментируем данные, характеризующие различные состояния воды.
Параметры молекулы воды в парообразном состоянии получены на основе обработки спектров ее поглощения. Результаты неоднократно уточнялись, но по существу правильно оценивают длины связей и валентный угол в молекуле воды в состоянии пара.
Кристаллическая структура льда при нормальном давлении довольно рыхлая с причудливой паутиной связей между молекулами воды. Схематично кристаллическую решетку обычного льда можно построить из атомов кислорода, каждый из которых участвует с соседними атомами в четырех водородных связях, направленных приблизительно к вершинам правильного тетраэдра.
Напомним, что водородной называется связь между атомами в одной молекуле или между соседними молекулами, которая осуществляется через атом водорода. Водородная связь играет чрезвычайно важную роль в структуре не только воды, но и большинства биологических молекул - углеводов, белков, нуклеиновых кислот и т. п.
Если кристаллический лед хорошо упорядочен по кислороду, то этого нельзя сказать про водород: в расположении ионов водорода (протонов) наблюдается сильный беспорядок. Их положение четко не определено, и поэтому лед можно считать разупорядоченным по водороду.
Лед обладает многими удивительными особенностями, из которых отметим две.
Во-первых, он всегда очень чист химически. В структуре льда практически не бывает примесей: при замерзании они вытесняются в жидкость. Именно поэтому снежинки всегда белые, а льдинки на поверхности грязной лужи практически прозрачные. Вообще говоря, любой растущий кристалл стремится создать идеальную кристаллическую решетку и вытесняет посторонние вещества. Но в планетарном масштабе именно замечательный феномен замерзания и таяния воды играет роль гигантского очистительного процесса - вода на Земле постоянно очищает сама себя.
Во-вторых, лед и особенно снег обладают очень высокой отражательной способностью. Благодаря этому солнечное излучение не вызывает заметного нагрева полярных областей, и, как следствие этого, наша планета избавлена от сезонных наводнений и повышений уровня Мирового океана.
Экспериментальное определение параметров одиночной молекулы воды в жидкой фазе до сих пор встречает непреодолимые трудности, поскольку жидкая вода - это смесь структурных элементов, то есть различных кластеров, находящихся в динамическом равновесии между собой. Полной ясности в отношении их взаимодействий до сих пор нет, а разделить такую смесь на отдельные компоненты невозможно: "простая" жидкость Н2О не торопится раскрывать свои внутренние секреты.
Вернемся к рисунку, на котором в общих чертах представлена структура молекулы воды. В ней есть симметрия, которая играет основную роль в попытках всестороннего объяснения физического мира, и асимметрия, наделяющая эту молекулу возможностью движения и связью с золотой пропорцией. Поэтому кратко напомним о том, что в математике называют золотой пропорцией.
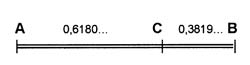
Золотая пропорция . Это понятие возникает при решении геометрической задачи о нахождении на отрезке АВ такой точки С, чтобы выполнялось соотношение СВ:АС = АС:АВ.
Решение этой задачи приводит к отношению СВ:АС = (-1+√5)/2, которое называют золотой пропорцией, а соответствующее геометрическое деление отрезка АВ точкой С называют золотым сечением. Если принять весь отрезок за единицу, то АС = 0,618033… и СВ = 0,381966....
Время показало, что золотая пропорция воплощает совершенные и гармоничные отношения двух величин. В геометрической интерпретации она приводит к соразмерному и привлекательному соотношению между двумя неравными отрезками.
Исследователи золотой пропорции с античных времен до наших дней всегда восхищались и продолжают восхищаться ее свойствами, которые проявляются в строении различных элементов физического и биологического мира. Золотая пропорция обнаруживается везде, где соблюдены принципы гармонии.
Что же объединяет золотую пропорцию с молекулой воды? Чтобы ответить на этот вопрос, рассмотрим двумерный образ золотой пропорции в виде треугольника.
В золотом треугольнике отношение ОА:АВ = ОВ:АВ приблизительно равно 0,618, угол α = 108,0о. Для льда отношение длин связей О-Н к Н-Н равно 0,100:0,163 = 0,613 и угол α = 109,5о, для пара - соответственно 0,631 и 104,5о. Не распознать в золотом треугольнике прообраз структуры молекулы воды просто невозможно! Удивительно, что до сих пор так мало внимания обращали на возможность подобной интерпретации ее строения.
И действительно, поместив в треугольнике АОВ в точки А и В атомы водорода, а в точку О - атом кислорода, получим в первом приближении молекулу жидкой воды, сконструированную на основе золотой пропорции. Подобная элегантность молекулы очаровывает и восхищает. Так что роль молекулы воды в природе и жизни не может быть правильно оценена без учета красоты ее формы.
Исключительная гармония. Убедимся, что молекула жидкой воды - единственное трехатомное вещество, имеющее соразмерности, свойственные золотой пропорции.
В трехатомных молекулах-гомологах, близких по химическому составу к молекуле воды (Н2S, h3Se и Н2Те), валентный угол приблизительно равен 90о. Например, молекула Н2S имеет следующие геометрические параметры:
длина связи S-Н, нм ......................... 0,1345
длина связи Н-Н, нм ........................... 0,1938
валентный угол Н-S-Н, град .............. 92,2
Отношение длин связей S-Н к Н-Н равно 0,694, что далеко от золотой пропорции. Квантово-химические расчеты показывают, что если бы вода была подобна родственным ей веществам, то валентный угол у ее молекулы должен был быть приблизительно таким же, как у Н2S, или больше максимум на 5о.
Но вода, как выясняется, не любит подобия, она всегда герой другого романа. Если бы валентный угол у воды был порядка 90-95о, о золотой пропорции пришлось бы забыть и вода оказалась бы в одном содружестве с другими водородными соединениями.
Но вода уникальна, ее молекула обладает практически выверенными эстетическими качествами, и поэтому ее свойства необходимо иногда интерпретировать, выходя за рамки традиционной научной парадигмы. И тогда некоторые загадки воды смогут быть объяснены таким "ненаучным" понятием, как гармония.
На приведенные рассуждения можно возразить: экспериментальные измерения геометрических параметров молекулы воды имеют определенную погрешность, и поэтому соотношение золотой пропорции может строго не выполняться. Но даже если в экспериментальные измерения внести еще большую погрешность, молекула воды все равно останется единственным из трехатомных веществ, имеющим практически "золотые" гармоничные пропорции.
В связи с этим обратим внимание на загадку талой воды, которая, по широко распространенному мнению, обладает отличным от обычной воды физиологическим воздействием.
Удивительная талая вода. Она рождается при таянии льда и сохраняет температуру 0оС, пока весь лед не растает. Специфика межмолекулярных взаимодействий, характерная для структуры льда, сохраняется и в талой воде, так как при плавлении кристалла разрушается только 15% всех водородных связей. Поэтому присущая льду связь каждой молекулы воды с четырьмя соседними ("ближний порядок") в значительной степени не нарушается, хотя и наблюдается бoльшая размытость кислородной каркасной решетки.
Таким образом, талая вода отличается от обычной изобилием многомолекулярных кластеров, в которых в течение некоторого времени сохраняются рыхлые льдоподобные структуры. После таяния всего льда температура воды повышается и водородные связи внутри кластеров перестают противостоять возрастающим тепловым колебаниям атомов. Размеры кластеров изменяются, и поэтому начинают меняться свойства талой воды: диэлектрическая проницаемость приходит к своему равновесному состоянию через 15-20 минут, вязкость - через 3-6 суток. Биологическая активность талой воды спадает, по одним данным, приблизительно за 12-16 часов, по другим - за сутки.
Итак, физико-химические свойства талой воды самопроизвольно меняются во времени, приближаясь к свойствам обычной воды: она постепенно как бы "забывает" о том, что еще недавно была льдом.
Лед и пар - различные агрегатные состояния воды, и поэтому логично предположить, что в жидкой промежуточной фазе валентный угол отдельной молекулы воды лежит в диапазоне между значениями в твердой фазе и в паре. В кристалле льда валентный угол молекулы воды близок к 109,5о. При таянии льда межмолекулярные водородные связи ослабевают, расстояние Н-Н несколько сокращается, валентный угол уменьшается. При нагревании жидкой воды происходит разупорядочение кластерной структуры, и этот угол продолжает уменьшаться. В парообразном состоянии валентный угол молекулы воды составляет уже 104,5о.
Значит, для обычной жидкой воды валентный угол вполне может иметь некоторое среднее значение между 109,5и 104,5о, то есть примерно 107,0о. Но так как талая вода по своей внутренней структуре близка ко льду, то и валентный угол ее молекулы должен быть ближе к 109,5о, скорее всего, около 108,0о.
Сказанное выше можно сформулировать в виде гипотезы: в силу того, что талая вода значительно более структурирована, чем обычная вода, ее молекула с большой долей вероятности имеет структуру, максимально приближенную к гармоничному треугольнику золотой пропорции с валентным углом, близким к 108о, и с отношением длин связей примерно 0,618-0,619.
Экспериментального подтверждения этой гипотезы у авторов нет, как нет и какой-либо теории ее обоснования. Есть только догадка, высказанная на этих страницах, которая может, естественно, оспариваться.
Таинственная сила талой воды. Человеку с незапамятных времен известны удивительные свойства талой воды. Давно замечено, что вблизи тающих родников растительность альпийских лугов всегда пышнее, а у кромки тающего льда в арктических морях бурно цветет жизнь. Полив талой водой повышает урожайность сельскохозяйственных культур, ускоряет прорастание семян. При употреблении талой воды устойчиво повышаются привесы в животноводстве, ускоряется развитие цыплят. Известно, с какой жадностью животные пьют весной талую воду, а птицы буквально купаются в первых лужицах подтаявшего снега.
Талая вода, в отличие от обычной, по своей структуре очень похожа на жидкость, содержащуюся в клетках растительных и живых организмов. Именно поэтому для человека более подходит "ледяная" структура талой воды, в которой молекулы объединены в ажурные кластеры. Это уникальное свойство талой воды способствует ее легкому усвоению организмом, она биологически активна. Вот почему так полезны овощи и фрукты - они доставляют в организм воду, имеющую аналогичную структуру.
При питье талой воды происходит подпитка организма самым гармоничным из всех веществ на Земле. Она улучшает обмен веществ и усиливает кровообращение, снижает количество холестерина в крови и успокаивает боли в сердце, повышает адаптационные возможности организма и способствует продлению жизни. Глоток чистейшей талой воды тонизирует лучше пастеризованного сока, в ней есть заряд энергии, бодрости и легкости.
Один из авторов этой работы постоянно пьет талую с плавающими льдинками воду и считает, что именно поэтому за три года ни разу не простудился. Талая вода освежает и молодит кожу, которая перестает нуждаться в кремах и лосьонах.
Теоретическое изучение свойств талой воды находится пока на уровне гипотез. Нет общепринятого мнения о причинах, вызывающих необычные эффекты при ее применении. Есть определенные проблемы и с доказательной стороной биологической активности талой воды. Исследования в этом направлении вызывают порой жаркие дискуссии. Сложность проблемы, отсутствие ясности - все это должно не отпугивать, а притягивать и способствовать появлению новых идей, гипотез, теорий. Таков зачастую тернистый путь развития науки.
Подчеркнем: приведенная гипотеза не претендует на расшифровку загадки талой воды. Она лишь позволяет выйти за рамки традиционного мышления и посмотреть на взаимную любовь жизни и воды с необычной стороны - со стороны гармонии и красоты, со стороны особых свойств талой воды, добавляющих ее изящной молекуле черты, которыми не обладают другие молекулы.
ЛИТЕРАТУРА
Ауэрбах Ф. Семь аномалий воды. - СПб., 1919.
Габуда С. П. Связанная вода. Факты и гипотезы. - Новосибирск: Наука, 1982.
Зацепина Г. Н. Физические свойства и структура воды. - М.: МГУ, 1998.
Синюков В. В. Вода известная и неизвестная. - М.: Знание, 1987.
Белянин В. С., Романова Е. Золотая пропорция. Новый взгляд // Наука и жизнь, 2003, № 6.
Вода: структура, состояние, сольватизация. Достижения последних лет. - М.: Наука, 2003.
Подписи к иллюстрациям
Илл. 1. Плотность льда почти на 10% меньше, чем у воды, а удельный объем на столько же больше. Поэтому лед плавает, а вода, замерзая в трещинах горных пород, раскалывает их.
www.nkj.ru
Чем отличаются молекулы воды от молекул пара
Для того, чтобы правильно судить о составе воды, нужно изучить, что же такое вода в принципе. Как известно из уроков физики и химии, вода – это вещество (жидкое), состоящее из таких химических элементов, как водород и кислород. Вода встречается в природе в нескольких состояниях, а точнее – трех. При низких температурах она кристаллизируется в лед, при высоких из воды образуется пар, а при обычных условиях жидкость является водой. Вода входит в состав всего живого на планете, в частности содержится и в нас (около 80%). Мы не можем существовать без воды в нашем организме, употребляя в пищу продукты, содержащие эту жидкость, восполняем потери для нормальной жизнедеятельности. Она не имеет ни запаха, ни вкуса, но все равно человек и все живое пьют воду, так как нуждаются в ее живительной силе.
Вода входит в состав всего живого на планете, в частности содержится и в нас (около 80%). Мы не можем существовать без воды в нашем организме, употребляя в пищу продукты, содержащие эту жидкость, восполняем потери для нормальной жизнедеятельности. Она не имеет ни запаха, ни вкуса, но все равно человек и все живое пьют воду, так как нуждаются в ее живительной силе.
Вода помогает всем живым организмам расти и процветать, в любом агрегатном состоянии она нужна и важна. Так ледники, оттаивая, отдают почве самые полезные микроэлементы, ведь в твердом состоянии молекулы воды насыщаются кислородом, взамен почва дает растения, а они в свою очередь вырабатывают кислород, необходимый для всех. А еще продукты с огорода становятся намного вкусней именно после дождя или обильного полива водой.
Что касается молекулы воды, то она состоит из атомов водорода и кислорода, которые находятся очень близко к друг другу. При этом они активно движутся и взаимодействуют. Поэтому ни для кого не секрет, что молекула воды тяжелее молекулы пара, например. В молекуле газообразного вещества все обстоит совсем по-другому. Давайте рассмотрим конкретнее состав молекул пара.

Молекулы воды
Молекулы газообразного вещества – пара
Исходя из того, что вода сама по себе бывает как тяжелая, так и легкая, молекулы пара такой воды тоже меняются. Но в любом случае, молекула пара будет легче молекулы воды. Связано это с тем, что атомы, движущиеся в молекуле пара, расположены очень далеко, и между собой. Вот почему воздух с повышенным сочетанием влажности при высокой температуре приносит больше вреда, чем пользы. Человек не сможет дышать таким разряженным воздухом длительное время. Это касается сауны, где возможно пробыть всего лишь несколько часов. Пар – это агрегатное, то есть связывающее молекулы, состояние жидкости, в данном случае воды. Расстояние между атомами и молекулами в паре гораздо больше размера самих молекул. Движутся атомы пара беспорядочно и очень быстро, если рассматривать большое помещение, то в краткие сроки пар способен заполнить его. Кроме того, пар способен сжиматься в отличие от воды. На маленьком пространстве, газ способен расширяться и создавать давление, поэтому если накрыть крышкой банку с паром, он сможет вытолкнуть ее наверх под давлением.
Пар – это агрегатное, то есть связывающее молекулы, состояние жидкости, в данном случае воды. Расстояние между атомами и молекулами в паре гораздо больше размера самих молекул. Движутся атомы пара беспорядочно и очень быстро, если рассматривать большое помещение, то в краткие сроки пар способен заполнить его. Кроме того, пар способен сжиматься в отличие от воды. На маленьком пространстве, газ способен расширяться и создавать давление, поэтому если накрыть крышкой банку с паром, он сможет вытолкнуть ее наверх под давлением. Вот такие интересные свойства пара можно узнать, изучая теорию. На практике же все гораздо интереснее, проводя различные опыты, можно сделать гораздо больше открытий на эту тему. А теперь давайте сопоставим два агрегатных состояния воды – жидкости и пара. Чем они все же конкретно отличаются, что их объединяет?
Вот такие интересные свойства пара можно узнать, изучая теорию. На практике же все гораздо интереснее, проводя различные опыты, можно сделать гораздо больше открытий на эту тему. А теперь давайте сопоставим два агрегатных состояния воды – жидкости и пара. Чем они все же конкретно отличаются, что их объединяет?
В чем разница пара и воды, что объединяет эти два состояния
Молекула воды как таковая, это и есть молекула пара, исходя из их состава. То есть общее между ними то, что кислород и водород в одинаковых количествах находятся в обеих молекулах. Можно отметить, что они отталкиваются друг от друга постоянно и быстро, это свойство тоже объединяет их между собой.
Основные отличия молекулы пара от молекулы воды:
- Пар состоит из молекул, где атомы находятся на расстоянии большем, чем сама молекула, а в воде же все наоборот — очень близко.
- Газы не имеют формы, и могут, как сжиматься, так и расширяться в разные стороны, благодаря силе, с которой атомы и молекулы отталкиваются.
- Вода обладает текучестью, в отличие от пара, она принимает форму сосуда, в котором находится, ведь молекулы друг от друга слишком близко.
- Газ может создавать давление, когда молекулы отталкиваются друг от друга, они могут вытолкнуть пробку из шампанского, например.
- А вода не может оказывать давление на предметы, так как молекулы внутри воды двигаются беспорядочно, а не сталкиваясь непосредственно друг с другом.
- Вода – это химический элемент (вещество), а пар – физическое состояние воды.
Надеемся, вы получили достаточно информации, посетив наш сайт, и мы ответили на ваш вопрос достаточно подробно.
vchemraznica.ru
Молекула воды
Вода (оксид водорода) Н2О – простейшее устойчивое соединение водорода с кислородом. Молекулярная масса воды 18,0160, на водород приходится 11,19% по массе, а на кислород – 88,81%.
Как ранее говорилось, в природе существует три изотопа водорода – легкий водород Н1, дейтерий D (Н2) и тритий (Н3) и три изотопа кислорода – О16, О17 и О18. Искусственно получены в ускорителях сверхтяжелые изотопы водорода Н4 и Н5 и шесть изотопов кислорода: три легких – О13, О14, О15, два тяжелых – О19, О20 и один сверхтяжелый – О24. Теоретически пять изотопов водорода и девять изотопов кислорода могут образовать 135 разновидностей молекулы воды, из которых устойчивыми являются девять, включающих стабильные изотопы. В природной воде на долю 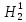 О16 приходится 99,75% по массе, на долю
О16 приходится 99,75% по массе, на долю 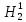 О18 – 0,2%, на
О18 – 0,2%, на 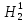 О17 – 0,04% и на Н1Н2О16 – примерно 0,093%; остальные пять разновидностей присутствуют в ничтожных количествах [4].
О17 – 0,04% и на Н1Н2О16 – примерно 0,093%; остальные пять разновидностей присутствуют в ничтожных количествах [4].
Строение воды
Молекула воды имеет угловое строение: входящие в её состав ядра образуют равнобедренный треугольник, в основании которого находятся два водорода, а в вершине – атом кислорода. Межъядерные расстояния О – Н близки к 0,1 нм, расстояние между ядрами атомов водорода равно 0,15 нм. Из шести электронов, составляющих внешний электронный слой атома кислорода в молекуле воды, две электронные пары образуют ковалентные связи О-Н, а остальные четыре электрона представляют собой две неподелённые электронные пары (рисунок 1).
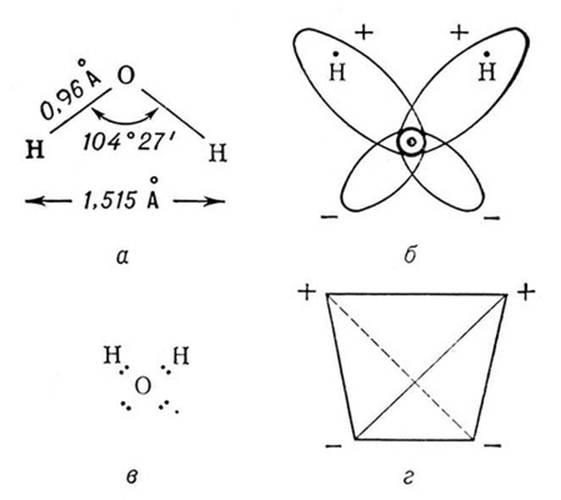
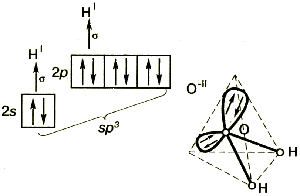
Рисунок 1 – Модели строения молекулы воды [3]
Молекула воды представляет собой маленький диполь, содержащий положительный и отрицательный заряды на полюсах. Около ядер водорода имеется недостаток электронной плотности, а на противоположной стороне молекулы, около ядра кислорода, наблюдается избыток электронной плотности. Именно такая структура и определяет полярность молекулы воды. Если соединить прямыми линиями эпицентры положительных и отрицательных зарядов, получится объемная геометрическая фигура – правильный тетраэдр (рисунок 1) [19,20].
С позиций метода валентных связей образование химических связей в молекуле воды можно объяснить за счёт перекрывания двух одноэлектронных p-облаков атома кислорода и одноэлектронных s-облаков двух атомов водорода. Ввиду того что участвующие в образовании химических связей p-облака кислорода расположены относительно друг друга под углом в 90 , валентный угол НОН должен был также соответствовать этому значению. Однако в действительности он состовляет 104,5
, валентный угол НОН должен был также соответствовать этому значению. Однако в действительности он состовляет 104,5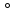 . Отклонение валентного угла от ожидаемого можно объяснить с двух позиций.
. Отклонение валентного угла от ожидаемого можно объяснить с двух позиций.
Согласно одной из них увеличение валентного угла с 90 до 104,5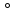 можно объяснить отталкиванием атомов водорода, который вследствие большой разности в электроотрицательности с кислородом (разность составляет 1,4 по шкале Полинга) приобретают в молекуле воды частичный положительный заряд (плюс 0,33 на каждом атоме). Эффективный заряд атома кислорода составляет минус 0,66.
можно объяснить отталкиванием атомов водорода, который вследствие большой разности в электроотрицательности с кислородом (разность составляет 1,4 по шкале Полинга) приобретают в молекуле воды частичный положительный заряд (плюс 0,33 на каждом атоме). Эффективный заряд атома кислорода составляет минус 0,66.
С точки зрения концепции гибридизации атом кислорода должен находится в состоянии sp3-гибридизации, в которой принимают участие две орбитали с неподелёнными электронными парами и две орбитали, осуществляющие связи с водородом. В соответствии с этим валентный угол между тетраэдрически расположенными в пространстве орбиталями кислорода должен составить порядка 109,5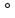 . Отклонение валентного угла НОН от тетраэдрического можно объяснить тем, что электронные пары связи О – Н занимают в пространстве меньший объём, чем неподелённые пары кислорода [3].
. Отклонение валентного угла НОН от тетраэдрического можно объяснить тем, что электронные пары связи О – Н занимают в пространстве меньший объём, чем неподелённые пары кислорода [3].
Особенности строения молекулы воды имеют важные следствия.
Во-первых, из-за неравномерности распределения электронной плотности валентных электронов молекула Н2О представляет собой диполь с отрицательным полюсом на кислороде и положительным со стороны атома водорода. Дипольный момент воды составляет 6,17 10-30 Кл
10-30 Кл м. Это достаточно большая величина. Для сравнения, дипольный момент метана равен 0, аммиака – 4,44
м. Это достаточно большая величина. Для сравнения, дипольный момент метана равен 0, аммиака – 4,44 10-30 Кл
10-30 Кл м.
м.
Во-вторых, большой дипольный момент воды является причиной возникновения диполь-дипольных и ион-дипольных взаимодействий в водных растворах.
В-третьих, молекула воды образует водородные связи.
В-четвёртых, неподелённые электронные пары кислорода позволяют Н2О выступать в качестве лиганда с образованием комплексных соединений [3].
Вода имеет очень высокие температуры замерзания (0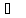 ) и кипения (100
) и кипения (100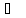 ) (рисунок 2). Это позволяет ей существовать во всех агрегатных состояниях: твердом (лед), жидком (вода) и газообразном (пар) (рисунок 3).
) (рисунок 2). Это позволяет ей существовать во всех агрегатных состояниях: твердом (лед), жидком (вода) и газообразном (пар) (рисунок 3).
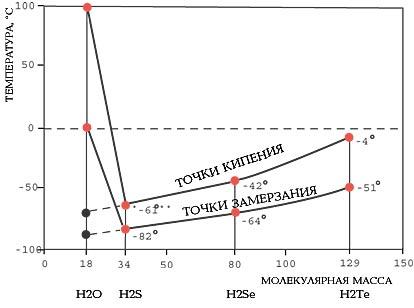
Рисунок 2 – Аномалии точек кипения и замерзания воды

Рисунок 3 – Агрегаты состояния воды: а – лед, б – вода, в – пар [2]
Из одиночных молекул вода состоит в парообразном состоянии. При температуре ниже температуры кипения, когда кинетическая энергия молекул становится ниже их потенциальной энергии взаимодействия, вода, как и любое вещество в этом случае, переходит в жидкое состояние. Но температура этого фазового перехода для воды почти на 200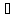 выше, чем это следовало бы ожидать из характера того межмолекулярного взаимодействия, которое должно осуществлять между подобными ей по составу молекулами, например сероводорода.
выше, чем это следовало бы ожидать из характера того межмолекулярного взаимодействия, которое должно осуществлять между подобными ей по составу молекулами, например сероводорода.
Высокая полярность воды является лишь одной из причин ассоциации молекул воды, которые могут комбинироваться по две, три и более вследствие взаимного притяжения противоположно заряженных концов диполя [3].
Главной причиной образования ассоциатов (Н2О)х являются водородные связи [3]. В твердом состоянии атом кислорода каждой молекулы воды образует две водородные связи (показаны пунктиром) с соседними молекулами по схеме (рисунок 4) [4]. Благодаря им жидкая вода – это не разупорядоченное движение молекул, а состояние, близкое к аморфному. В нём молекулы воды ассоциированы в агрегаты (Н2О)х – кластеры со степенью ассоциации (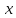 ) до 130 молекул воды при 0
) до 130 молекул воды при 0 , до 90 – при 20
, до 90 – при 20 , до 60 – при 72
, до 60 – при 72 (рисунок 5) [3].
(рисунок 5) [3].
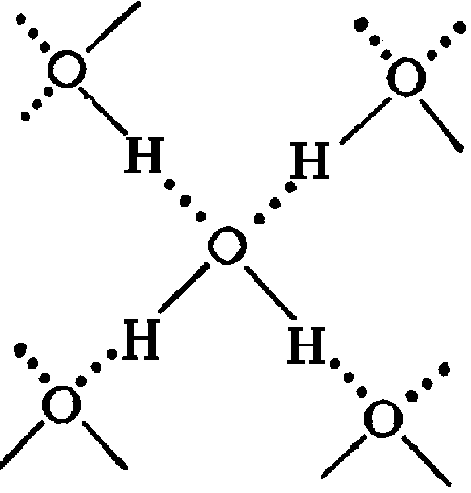
Рисунок 4 – Схема образования водородных связей [4]
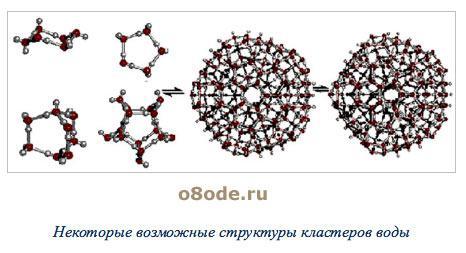
Рисунок 5 – Некоторые возможные структуры кластеров воды
Время жизни таких кластеров небольшое (10-11 – 10-10 с). В их образовании участвуют не все молекулы, иначе бы их плотность в жидком состоянии должна была бы составить не  1 г/см3, а 1,84 г/см3. Последняя величина рассчитана из предположения плотной упаковки молекул Н2О с радиусом, равным 1,38
1 г/см3, а 1,84 г/см3. Последняя величина рассчитана из предположения плотной упаковки молекул Н2О с радиусом, равным 1,38  , который определен из размеров кристаллической решетки льда [3].
, который определен из размеров кристаллической решетки льда [3].
Схема кристаллической решетки льда представлена на рисунке 6. Каждая молекула Н2О (черные шарики) окружена тетраэдрически четырьмя другими молекулами – тремя из того же слоя и одной из соседнего слоя молекул. Структура льда является наименее плотной структурой. Ее особенность заключается в наличии пустот, размеры которых превышают размеры молекул Н2О. При плавлении льда часть водородных связей разрушается, и в пустотах оставшихся агрегатов могут разместиться отдельные молекулы воды, вследствие чего достигается более плотная упаковка молекул. Поэтому при плавлении льда объем воды уменьшается, а плотность возрастает.
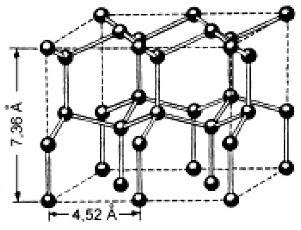
Рисунок 6 – Кристаллическая решетка льда [4]
studfiles.net
Молекула воды Википедия
| Вода | |
 | |
 | |
 | |
| Оксид водорода Вода[1] | |
| вода | |
| h3O | |
| жидкость | |
| 18,01528 г/моль | |
| 0,9982 г/см³ | |
| 1,5[3] | |
| 0,00101 Па·с | |
| 0,01012 см²/с (при 20 °C) | |
| (дистиллированная вода) 1348 м/с | |
| 273,1 K (0 ° C) | |
| 373,1 K (99,974 ° C) °C | |
| 273,2 K (0,01 ° C), 611,72 Па | |
| 647,1 K (374 ° C), 22,064 МПа | |
| 75,37 Дж/(моль·К) | |
| 0,56 Вт/(м·K) | |
| 2256,2 кДж/кг[2] | |
| 332,4 кДж/кг[2] | |
| 1,3945, 1,33432, 1,32612, 1,39336, 1,33298 и 1,32524 | |
| 7732-18-5 | |
| 962 | |
| 231-791-2 | |
| ZC0110000 | |
| 15377 | |
| 937 | |
 | |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. | |
 71 % поверхности Земли покрывает вода
71 % поверхности Земли покрывает вода Вода́ (оксид водорода) — бинарное неорганическое соединение с химической формулой Н2O. Молекула воды состоит из двух атомов водорода и одного — кислорода, которые соединены между собой ковалентной связью. При нормальных условиях представляет собой прозрачную жидкость, не имеющую цвета (при малой толщине слоя), запаха и вкуса. В твёрдом состоянии называется льдом (кристаллы льда могут образовывать снег или иней), а в газообразном — водяным паром. Вода также может существовать в виде жидких кристаллов (на гидрофильных поверхностях)[4][5].
Около 71 % поверхности Земли покрыто водой (океаны, моря, озёра, реки, льды) — 361,13 млн км2[6][7]. На Земле примерно 96,5 % воды приходится на океаны, 1,7 % мировых запасов составляют грунтовые воды, ещё 1,7 % — ледники и ледяные шапки Антарктиды и Гренландии, небольшая часть находится в реках, озёрах и болотах, и 0,001 % в облаках (образуются из взвешенных в воздухе частиц льда и жидкой воды)[8][9]. Бо́льшая часть земной воды — солёная, непригодная для сельского хозяйства и питья. Доля пресной составляет около 2,5 %, причём 98,8 % этой воды находится в ледниках и грунтовых водах. Менее 0,3 % всей пресной воды содержится в реках, озёрах и атмосфере, и ещё меньшее количество (0,003 %) находится в живых организмах[8].
Является хорошим сильнополярным растворителем. В природных условиях всегда содержит растворённые вещества (соли, газы).
Исключительно важна роль воды в глобальном кругообороте вещества и энергии[10], возникновении и поддержании жизни на Земле, в химическом строении живых организмов, в формировании климата и погоды. Вода является важнейшим веществом для всех живых существ на Земле[11].
Химические названия
С формальной точки зрения вода имеет несколько различных корректных химических названий:
- Оксид водорода: бинарное соединение водорода с атомом кислорода в степени окисления −2, встречается также устаревшее название окись водорода.
- Гидроксид водорода: соединение гидроксильной группы OH- и катиона (H+)
- Гидроксильная кислота: воду можно рассматривать как соединение катиона H+, который может быть замещён металлом, и «гидроксильного остатка» OH-
- Монооксид дигидрогена
- Дигидромонооксид
Образование воды
Известно, что 2 объема водорода взаимодействуют с 1 объемом кислорода с образованием воды. При реакции выделяется большое количество тепла, как и при горении свечи. Продукт реакции — вода не похожа на исходные вещества — водород и кислород. Следовательно, превращение, происходящее при взаимодействии водорода и кислорода, должно быть отнесено к химическим реакциям.
В соответствии с атомно-молекулярной теорией мы начинаем рассуждение, предполагая, что в реакции участвуют молекулы Н2 и О2. В результате реакции образуются молекулы воды. Связи между атомами в реагирующих веществах разрываются и атомы перегруппировываются. При этом возникают новые связи в молекулах продукта реакции. Эти превращения легко представить с помощью молекулярных моделей. Молекулярную модель можно представить как две молекулы Н2 (четыре атома) и одна молекула О2 (два атома). Если эти молекулы будут реагировать с образованием воды, то связи между атомами в молекулах водорода и кислорода должны разорваться. Затем «завязываются» новые связи и образуются две молекулы воды. Отметим, что в результате реакции происходит перегруппировка атомов, но общее число атомов при этом не изменяется.
Пример образования молекул воды
Один миллион молекул кислорода реагирует с достаточно большим количеством молекул водорода с образованием воды. Сколько молекул воды образуется? Сколько молекул водорода требуется для этой реакции?
Для получения 100 молекул воды расходуется 100 молекул водорода и 50 молекул кислорода. Таким образом, для получения 1 моля воды (6,02 · 1023 молекул) нам потребуется 1 моль водорода (6,02 · 1023 молекул) и 0,5 моля кислорода (3,01 · 1023 молекул). Результаты приведены в таблице:
| Водород | Кислород | Вода | |
| Число молекул | 2 | 1 | 2 |
| 4 | 2 | 4 | |
| 100 | 50 | 100 | |
| 6,02 · 1023 | 3,01 · 1023 | 6,02 · 1023 | |
| Число молей | 1 | 0,5 | 1 |
| 2 | 1 | 2 | |
| 10 | 5 | 10 |
Реакция между водородом и кислородом протекает намного быстрее, если эти газы смешать и затем поджечь смесь искрой. Происходит сильный взрыв. Тем не менее, на 1 моль реагирующего водорода образуется такое же количество продукта реакции — воды — и выделяется столько же тепла, как и при обычном горении.
Если реагируют 1 моль чистого водорода и 0,5 моля чистого кислорода, образуется 1 моль воды. Количество тепла, выделяющееся при образовании 1 моля воды, равно 68000 кал. Если же мы возьмем только 0,025 моля чистого водорода, то потребуется 0,5 · 0,025 моля кислорода. При этом образуется 0,025 моля воды. Если получено только 0,025 моля воды, то выделяется лишь 0,025 · 68 000 = 1700 кал тепла.
Источником этой тепловой энергии должны быть сами реагирующие вещества (водород и кислород), так как к системе извне подводится только тепло, необходимое для поджигания смеси. Отсюда можно сделать вывод, что вода содержит меньше энергии, чем реагирующие вещества, используемые для ее получения. Реакция, при которой выделяется тепло, называется экзотермической. Количество тепла, выделяющееся при сгорании 1 моля водорода (68 000 кал, или 68 ккал), называется молярной теплотой сгорания водорода.
Свойства
Физические свойства
Вода при нормальных условиях находится в жидком состоянии, тогда как аналогичные водородные соединения других элементов являются газами (h3S, Ch5, HF). Атомы водорода присоединены к атому кислорода, образуя угол 104,45° (104°27′). Из-за большой разности электроотрицательностей атомов водорода и кислорода электронные облака сильно смещены в сторону кислорода. По этой причине молекула воды обладает большим дипольным моментом (p = 1,84 Д, уступает только синильной кислоте). Каждая молекула воды образует до четырёх водородных связей — две из них образует атом кислорода и две — атомы водорода[12]. Количество водородных связей и их разветвлённая структура определяют высокую температуру кипения воды и её удельную теплоту парообразования[12]. Если бы не было водородных связей, вода, на основании места кислорода в таблице Менделеева и температур кипения гидридов аналогичных кислороду элементов (серы, селена, теллура), кипела бы при −80 °С, а замерзала при −100 °С[13].
При переходе в твёрдое состояние молекулы воды упорядочиваются, при этом объёмы пустот между молекулами увеличиваются, и общая плотность воды падает, что и объясняет меньшую плотность (больший объём) воды в фазе льда. При испарении, напротив, все водородные связи рвутся. Разрыв связей требует много энергии, отчего у воды самая большая удельная теплоёмкость среди прочих жидкостей и твёрдых веществ. Для того чтобы нагреть один литр воды на один градус, требуется затратить 4,1868 кДж энергии. Благодаря этому свойству вода нередко используется как теплоноситель. Помимо большой удельной теплоёмкости, вода также имеет большие значения удельной теплоты плавления (333,55 кДж/кг при 0 °C) и парообразования (2250 кДж/кг).
| -60 (лёд) | 1,64 |
| -20 (лёд) | 2,01 |
| -10 (лёд) | 2,22 |
| 0 (лёд) | 2,11 |
| 0 (чистая вода) | 4,218 |
| 10 | 4,192 |
| 20 | 4,182 |
| 40 | 4,178 |
| 60 | 4,184 |
| 80 | 4,196 |
| 100 | 4,216 |
Физические свойства разных изотопных модификаций воды при различных температурах[14]:
| Н2O | 3,9834 | 0,01 |
| D2O | 11,2 | 3,82 |
| T2O | 13,4 | 4,49 |
| Н218O | 4,3 | 0,31 |
Вода обладает также высоким поверхностным натяжением, уступая в этом только ртути[15][16][17]. Относительно высокая вязкость воды обусловлена тем, что водородные связи мешают молекулам воды двигаться с разными скоростями.
Вода является хорошим растворителем полярных веществ. Каждая молекула растворяемого вещества окружается молекулами воды, причём положительно заряженные участки молекулы растворяемого вещества притягивают атомы кислорода, а отрицательно заряженные — атомы водорода. Поскольку молекула воды мала по размерам, много молекул воды могут окружить каждую молекулу растворяемого вещества.
Это свойство воды используется живыми существами. В живой клетке и в межклеточном пространстве вступают во взаимодействие растворы различных веществ в воде[18]. Вода необходима для жизни всех без исключения одноклеточных и многоклеточных живых существ на Земле.
Вода обладает отрицательным электрическим потенциалом поверхности.
 Капля, ударяющаяся о поверхность воды
Капля, ударяющаяся о поверхность воды Чистая вода — хороший изолятор. При нормальных условиях вода слабо диссоциирована и концентрация протонов (точнее, ионов гидроксония h4O+) и гидроксильных ионов OH− составляет 10-7 моль/л. Но поскольку вода — хороший растворитель, в ней практически всегда растворены те или иные соли, то есть присутствуют другие положительные и отрицательные ионы. Благодаря этому вода проводит электричество. По электропроводности воды можно определить её чистоту.
Вода имеет показатель преломления n=1,33 в оптическом диапазоне. Однако она сильно поглощает инфракрасное излучение, и поэтому водяной пар является основным естественным парниковым газом, отвечающим более чем за 60 % парникового эффекта. Благодаря большому дипольному моменту молекул, вода также поглощает микроволновое излучение, на чём основан принцип действия микроволновой печи.
Агрегатные состояния
По состоянию различают:

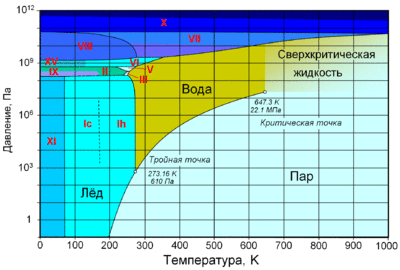
При нормальном атмосферном давлении (760 мм рт. ст., 101 325 Па) вода переходит в твёрдое состояние при температуре в 0 °C и кипит (превращается в водяной пар) при температуре 100 °C (значения 0 °C и 100 °C были выбраны как соответствующие температурам таяния льда и кипения воды при создании температурной шкалы «по Цельсию»). При снижении давления температура таяния (плавления) льда медленно растёт, а температура кипения воды — падает. При давлении в 611,73 Па (около 0,006 атм) температура кипения и плавления совпадает и становится равной 0,01 °C. Такие давление и температура называются тройной точкой воды. При более низком давлении вода не может находиться в жидком состоянии, и лёд превращается непосредственно в пар. Температура возгонки (сублимации) льда падает со снижением давления. При высоком давлении существуют модификации льда с температурами плавления выше комнатной.
С ростом давления температура кипения воды растёт[19]:
| 0,987 (105 Па — нормальные условия) | 99.63 |
| 1 | 100 |
| 2 | 120 |
| 6 | 158 |
| 218,5 | 374,1 |
При росте давления плотность насыщенного водяного пара в точке кипения тоже растёт, а жидкой воды — падает. При температуре 374 °C (647 K) и давлении 22,064 МПа (218 атм) вода проходит критическую точку. В этой точке плотность и другие свойства жидкой и газообразной воды совпадают. При более высоком давлении и/или температуре исчезает разница между жидкой водой и водяным паром. Такое агрегатное состояние называют «сверхкритическая жидкость».
Вода может находиться в метастабильных состояниях — пересыщенный пар, перегретая жидкость, переохлаждённая жидкость. Эти состояния могут существовать длительное время, однако они неустойчивы и при соприкосновении с более устойчивой фазой происходит переход. Например, можно получить переохлаждённую жидкость, охладив чистую воду в чистом сосуде ниже 0 °C, однако при появлении центра кристаллизации жидкая вода быстро превращается в лёд.
Оптические свойства
Они оцениваются по прозрачности воды, которая, в свою очередь, зависит от длины волны излучения, проходящего через воду. Вследствие поглощения оранжевых и красных компонентов света вода приобретает голубоватую окраску. Вода прозрачна только для видимого света и сильно поглощает инфракрасное излучение, поэтому на инфракрасных фотографиях водная поверхность всегда получается чёрной. Ультрафиолетовые лучи легко проходят через воду, поэтому растительные организмы способны развиваться в толще воды и на дне водоёмов, инфракрасные лучи проникают только в поверхностный слой. Вода отражает 5 % солнечных лучей, в то время как снег — около 85 %. Под лёд океана проникает только 2 % солнечного света.
Изотопные модификации
И кислород, и водород имеют природные и искусственные изотопы. В зависимости от типа изотопов водорода, входящих в молекулу, выделяют следующие виды воды:
Последние три вида возможны, так как молекула воды содержит два атома водорода. Протий — самый лёгкий изотоп водорода, дейтерий имеет атомную массу 2,0141017778 а. е. м., тритий — самый тяжёлый, атомная масса 3,0160492777 а. е. м. В воде из-под крана тяжелокислородной воды (h3O17 и h3O18) содержится больше, чем воды D2O16: их содержание, соответственно, 1,8 кг и 0,15 кг на тонну[13].
Хотя тяжёлая вода часто считается мёртвой водой, так как живые организмы в ней жить не могут, некоторые микроорганизмы могут быть приучены к существованию в ней[13].
По стабильным изотопам кислорода 16O, 17O и 18O существуют три разновидности молекул воды. Таким образом, по изотопному составу существуют 18 различных молекул воды. В действительности любая вода содержит все разновидности молекул.
Химические свойства
Вода является наиболее распространённым растворителем на планете Земля, во многом определяющим характер земной химии, как науки. Большая часть химии, при её зарождении как науки, начиналась именно как химия водных растворов веществ.
Её иногда рассматривают, как амфолит — и кислоту и основание одновременно (катион H+анион OH−). В отсутствие посторонних веществ в воде одинакова концентрация гидроксид-ионов и ионов водорода (или ионов гидроксония), pKa ≈ 16.
Вода — химически активное вещество. Сильно полярные молекулы воды сольватируют ионы и молекулы, образуют гидраты и кристаллогидраты. Сольволиз, и в частности гидролиз, происходит в живой и неживой природе, и широко используется в химической промышленности.Воду можно получать:
- в ходе реакций —
- Восстановлением водородом оксидов металлов —
Под воздействием очень высоких температур или электрического тока (при электролизе)[20], а также под воздействием ионизирующего излучения, как установил в 1902 году[21]Фридрих Гизель[en] при исследовании водного раствора бромида радия[22], вода разлагается на молекулярный кислород и молекулярный водород:
2h3O→2h3↑+O2↑{\displaystyle {\mathsf {2H_{2}O\rightarrow 2H_{2}\uparrow +O_{2}\uparrow }}}Вода реагирует при комнатной температуре:
2h3O+2Na→2NaOH+h3↑{\displaystyle {\mathsf {2H_{2}O+2Na\rightarrow 2NaOH+H_{2}\uparrow }}}- со фтором и межгалоидными соединениями
- с солями, образованными слабой кислотой и слабым основанием, вызывая их полный гидролиз
- с ангидридами и галогенангидридами карбоновых и неорганических кислот
- с активными металлорганическими соединениями (диэтилцинк, реактивы Гриньяра, метилнатрий и т. д.)
- с карбидами, нитридами, фосфидами, силицидами, гидридами активных металлов (кальция, натрия, лития и др.)
- со многими солями, образуя гидраты
- с боранами, силанами
- с кетенами, недоокисью углерода
- с фторидами благородных газов
Вода реагирует при нагревании:
4h3O+3Fe→Fe3O4+4h3{\displaystyle {\mathsf {4H_{2}O+3Fe\rightarrow Fe_{3}O_{4}+4H_{2}}}}h3O+C⇄ CO+h3{\displaystyle {\mathsf {H_{2}O+C\rightleftarrows \ CO+H_{2}}}}- с некоторыми алкилгалогенидами
Вода реагирует в присутствии катализатора:
- с амидами, эфирами карбоновых кислот;
- с ацетиленом и другими алкинами;
- с алкенами;
- с нитрилами.
Волновая функция основного состояния воды
В валентном приближении электронная конфигурация молекулы h3O{\displaystyle {\ce {h3O}}} в основном состоянии: (1a1)1(1b2)2(1b1)2(2b2)0(3a1)0.{\displaystyle (1a_{1})^{1}(1b_{2})^{2}(1b_{1})^{2}(2b_{2})^{0}(3a_{1})^{0}.} Молекула имеет замкнутую оболочку, неспаренных электронов нет. Заняты электронами четыре молекулярные орбитали (МО) — по два электрона на каждой МО ϕi{\displaystyle \phi _{i}}, один со спином α{\displaystyle \alpha }, другой со спином β{\displaystyle \beta }, или 8 спин-орбиталей ψ{\displaystyle \psi }. Волновая функция молекулы, Ψ{\displaystyle \Psi }, представленная единственным детерминантом Слэтера Ф, имеет вид
|ϕ1a1(1)α(1)ϕ1a1(1)β(1)ϕ1b2(1)α(1)...ϕ1b1(1)β(1)ϕ1a1(2)α(2)ϕ1a1(2)β(2)ϕ1b2(2)α(2)...ϕ1b1(2)β(2)ϕ1a1(3)α(3)ϕ1a1(3)β(3)ϕ1b2(3)α(3)...ϕ1b1(3)β(3)...............ϕ1a1(8)α(8)ϕ1a1(8)β(8)ϕb2(8)α(8)...ϕ1b1(8)β(8)|{\displaystyle {\begin{vmatrix}\phi _{1a_{1}}(1)\alpha (1)&\phi _{1a_{1}}(1)\beta (1)&\phi _{1b_{2}}(1)\alpha (1)&...&\phi _{1b_{1}}(1)\beta (1)\\\phi _{1a_{1}}(2)\alpha (2)&\phi _{1a_{1}}(2)\beta (2)&\phi _{1b_{2}}(2)\alpha (2)&...&\phi _{1b_{1}}(2)\beta (2)\\\phi _{1a_{1}}(3)\alpha (3)&\phi _{1a_{1}}(3)\beta (3)&\phi _{1b_{2}}(3)\alpha (3)&...&\phi _{1b_{1}}(3)\beta (3)\\...&...&...&...&...\\\phi _{1a_{1}}(8)\alpha (8)&\phi _{1a_{1}}(8)\beta (8)&\phi _{b_{2}}(8)\alpha (8)&...&\phi _{1b_{1}}(8)\beta (8)\end{vmatrix}}}
Симметрия этой волновой функции определяется прямым произведением НП, по которым преобразуются все занятые спин-орбитали
(a1)⊗(a1)⊗(b2)⊗(b2)⊗(a1)⊗(a1)⊗(b1)⊗(b1).{\displaystyle (a_{1})\otimes (a_{1})\otimes (b_{2})\otimes (b_{2})\otimes (a_{1})\otimes (a_{1})\otimes (b_{1})\otimes (b_{1}).}
Принимая во внимание, что:
- прямое произведение невырожденного НП самого на себя является полносимметричным НП.
- прямое произведение любого невырожденного представления Г на полносимметричное есть Г, получаем:
a1⊗a1⊗⏟A1b2⊗b2⏟A1⊗a1⊗a1⏟A1⊗b1⊗b1⏟A1⏟A1{\displaystyle \underbrace {\underbrace {a_{1}\otimes a_{1}\otimes } _{A_{1}}\underbrace {b_{2}\otimes b_{2}} _{A_{1}}\otimes \underbrace {a_{1}\otimes a_{1}} _{A_{1}}\otimes \underbrace {b_{1}\otimes b_{1}} _{A_{1}}} _{A_{1}}}
Виды
Вода на Земле может существовать в трёх основных состояниях:
- жидком,
- газообразном
- твёрдом.
Вода может приобретать различные формы, которые могут одновременно соседствовать и взаимодействовать друг с другом:
Вода способна растворять в себе множество органических и неорганических веществ. Из-за важности воды, «как источника жизни», её нередко подразделяют на типы по различным принципам.
Виды воды по особенностям происхождения, состава или применения:
по содержанию катионов кальция и магнияпо изотопам водорода в молекуледругие виды- Пресная вода,
- Дождевая вода,
- Морская вода,
- Подземные воды,
- Минеральная вода,
- Солоноватая вода,
- Питьевая вода и Водопроводная вода,
- Дистиллированная вода и деионизированная вода,
- Сточные воды,
- Ливневая вода или поверхностные воды,
- Апирогенная вода,
- Поливода,
- Структурированная вода — термин, применяемый в различных неакадемических теориях,
- Талая вода,
- Мёртвая вода и Живая вода — виды воды со сказочными свойствами,
- Святая вода — особый вид воды с мистическими свойствами (согласно религиозным учениям). По христианским представлениям святая вода — это вода, посвященная Богу. Никакие свойства воды как таковой при этом не меняются.
В природе
В атмосфере нашей планеты вода находится в виде капель малого размера, в облаках и тумане, а также в виде пара. При конденсации выводится из атмосферы в виде атмосферных осадков (дождь, снег, град, роса). В совокупности жидкая водная оболочка Земли называется гидросферой, а твёрдая — криосферой. Вода является важнейшим веществом всех живых организмов на Земле. Предположительно, зарождение жизни на Земле произошло в водной среде.
Мировой океан содержит более 97,54 % земной воды, подземные воды — около 0,63 %, ледники — 1,81 %, реки и озера — 0,009 %, материковые солёные воды — 0,007 %, атмосфера — 0,001 %[7].
Атмосферные осадки
Вода за пределами Земли
Вода — чрезвычайно распространённое вещество в космосе, однако из-за высокого внутрижидкостного давления вода не может существовать в жидком состоянии в условиях вакуума космоса, отчего она представлена только в виде пара или льда.
Одним из наиболее важных вопросов, связанных с освоением космоса человеком и возможности возникновения жизни на других планетах, является вопрос о наличии воды за пределами Земли в достаточно большой концентрации. Известно, что некоторые кометы более, чем на 50 % состоят из водяного льда. Не стоит, впрочем, забывать, что не любая водная среда пригодна для жизни.
В результате бомбардировки лунного кратера, проведённой 9 октября 2009 года НАСА с использованием космического аппарата LCROSS, впервые были получены достоверные свидетельства наличия на спутнике Земли водяного льда в больших объёмах[23].
Вода широко распространена в Солнечной системе. Наличие воды (в основном в виде льда) подтверждено на многих спутниках Юпитера и Сатурна: Энцеладе[24][25], Тефии, Европе, Ганимеде и др. Вода присутствует в составе всех комет и многих астероидов. Учёными предполагается, что многие транснептуновые объекты имеют в своём составе воду.
Вода в виде паров содержится в атмосфере Солнца (следы)[26], атмосферах Меркурия (3,4 %, также большие количества воды обнаружены в экзосфере Меркурия)[27], Венеры (0,002 %)[28], Луны[29], Марса (0,03 %)[30], Юпитера (0,0004 %)[31], Европы[32], Сатурна, Урана (следы)[33] и Нептуна[34] (найден в нижних слоях атмосферы).
Содержание водяного пара в атмосфере Земли у поверхности колеблется от 3—4 % в тропиках до 2·10−5% в Антарктиде[35].
Кроме того, вода обнаружена на экзопланетах, например HD 189733 A b[36], HD 209458 b[37] и GJ 1214 b[38].
Жидкая вода, предположительно, имеется под поверхностью некоторых спутников планет — наиболее вероятно, на Европе — спутнике Юпитера.
Биологическая роль
 Полный стакан с водой
Полный стакан с водойВода играет уникальную роль как вещество, определяющее возможность существования и саму жизнь всех существ на Земле. Она выполняет роль универсального растворителя, в котором происходят основные биохимические процессы живых организмов. Уникальность воды состоит в том, что она достаточно хорошо растворяет как органические, так и неорганические вещества, обеспечивая высокую скорость протекания химических реакций и в то же время — достаточную сложность образующихся комплексных соединений.
Благодаря водородной связи, вода остаётся жидкой в широком диапазоне температур, причём именно в том, который широко представлен на планете Земля в настоящее время.
Поскольку у льда плотность меньше, чем у жидкой воды, вода в водоёмах замерзает сверху, а не снизу. Образовавшийся слой льда препятствует дальнейшему промерзанию водоёма, это позволяет его обитателям выжить. Существует и другая точка зрения: если бы вода не расширялась при замерзании, то не разрушались бы клеточные структуры, соответственно замораживание не наносило бы ущерба живым организмам. Некоторые существа (тритоны) переносят замораживание/оттаивание — считается что этому способствует особый состав клеточной плазмы, не расширяющейся при замораживании.
Применение
В земледелииВыращивание достаточного количества сельскохозяйственных культур на открытых засушливых землях требует значительных расходов воды на ирригацию, доходящих до 90 % в некоторых странах.
Для питья и приготовления пищи
Живое человеческое тело содержит от 50 % до 75 % воды[39], в зависимости от веса и возраста. Потеря организмом человека более 10 % воды может привести к смерти. В зависимости от температуры и влажности окружающей среды, физической активности и т. д. человеку нужно выпивать разное количество воды. Ведётся много споров о том, сколько воды нужно потреблять для оптимального функционирования организма.
Питьевая вода представляет собой воду из какого-либо источника, очищенную от микроорганизмов и вредных примесей. Пригодность воды для питья при её обеззараживании перед подачей в водопровод оценивается по количеству кишечных палочек на литр воды, поскольку кишечные палочки распространены и достаточно устойчивы к антибактериальным средствам, и если кишечных палочек будет мало, то будет мало и других микробов. Если кишечных палочек не больше, чем 3 на литр, вода считается пригодной для питья[40][41].
Как растворительВода является растворителем для многих веществ. Она используется для очистки как самого человека, так и различных объектов человеческой деятельности. Вода используется как растворитель в промышленности.
В качестве теплоносителя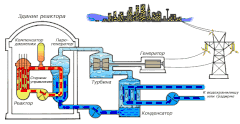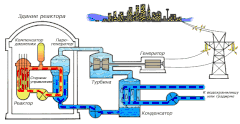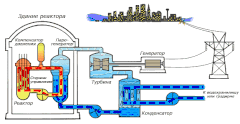 Схема работы атомной электростанции на двухконтурном водо-водяном энергетическом реакторе (ВВЭР)
Схема работы атомной электростанции на двухконтурном водо-водяном энергетическом реакторе (ВВЭР) Среди существующих в природе жидкостей вода обладает наибольшей теплоёмкостью. Теплота её испарения выше теплоты испарения любых других жидкостей, а теплота кристаллизации уступает лишь аммиаку. В качестве теплоносителя воду используют в тепловых сетях, для передачи тепла по теплотрассам от производителей тепла к потребителям. Воду в виде льда используют для охлаждения в системах общественного питания, в медицине. Большинство атомных электростанций используют воду в качестве теплоносителя.
Как замедлительВо многих ядерных реакторах вода используется не только в качестве теплоносителя, но и замедлителя нейтронов для эффективного протекания цепной ядерной реакции. Также существуют тяжеловодные реакторы, в которых в качестве замедлителя используется тяжёлая вода.
Для ПожаротушенияВ пожаротушении вода зачастую используется не только как охлаждающая жидкость, но и для изоляции огня от воздуха в составе пены, так как горение поддерживается только при достаточном поступлении кислорода.
В спортеМногими видами спорта занимаются на водных поверхностях, на льду, на снегу и даже под водой. Это подводное плавание, хоккей, лодочные виды спорта, биатлон, шорт-трек и др.
В качестве Инструмента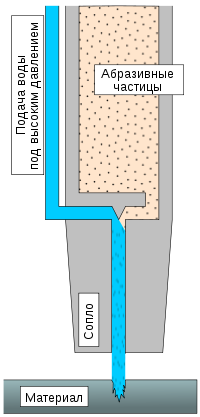
Вода используется как инструмент для разрыхления, раскалывания и даже резки пород и материалов. Она используется в добывающей промышленности, горном деле и в производстве. Достаточно распространены установки по резке водой различных материалов: от резины до стали. Вода, выходящая под давлением несколько тысяч атмосфер способна разрезать стальную пластину толщиной несколько миллиметров, или более при добавлении абразивных частиц.
Для смазкиВода применяется как смазочный материал для смазки подшипников из древесины, пластиков, текстолита, подшипников с резиновыми обкладками и др. Воду также используют в эмульсионных смазках[42].
Исследования
Происхождение воды на планете
Происхождение воды на Земле является предметом научных споров. Некоторые учёные считают, что вода была занесена астероидами или кометами на ранней стадии образования Земли, около четырёх миллиардов лет назад, когда планета уже сформировалась в виде шара. В настоящее время установлено, что вода появилась в мантии Земли не позже 2,7 миллиардов лет назад[43].
Гидрология
Гидроло́гия — наука, изучающая природные воды, их взаимодействие с атмосферой и литосферой, а также явления и процессы, в них протекающие (испарение, замерзание и т. п.).
Предметом изучения гидрологии являются все виды вод гидросферы в океанах, морях, реках, озёрах, водохранилищах, болотах, почвенных и подземных вод.
Гидрология исследует круговорот воды в природе, влияние на него деятельности человека и управление режимом водных объектов и водным режимом отдельных территорий; проводит анализ гидрологических элементов для отдельных территорий и Земли в целом; даёт оценку и прогноз состояния и рационального использования водных ресурсов; пользуется методами, применяемыми в географии, физике и других науках. Данные гидрологии моря используются при плавании и ведении боевых действий надводными кораблями и подводными лодками.
Гидрология подразделяется на океанологию, гидрологию суши и гидрогеологию.
Океанология подразделяется на биологию океана, химию океана, геологию океана, физическую океанологию, и взаимодействие океана и атмосферы.
Гидрология суши подразделяется на гидрологию рек (речную гидрологию, потамологию), озероведение (лимнологию), болотоведение, гляциологию.
Гидрогеология
Гидрогеоло́гия (от др.-греч. ὕδωρ «водность» + геология) — наука, изучающая происхождение, условия залегания, состав и закономерности движений подземных вод. Также изучается взаимодействие подземных вод с горными породами, поверхностными водами и атмосферой. В сферу этой науки входят такие вопросы, как динамика подземных вод, гидрогеохимия, поиск и разведка подземных вод, а также мелиоративная и региональная гидрогеология. Гидрогеология тесно связана с гидрологией и геологией, в том числе и с инженерной геологией, метеорологией, геохимией, геофизикой и другими науками о Земле. Она опирается на данные математики, физики, химии и широко использует их методы исследования. Данные гидрогеологии используются, в частности, для решения вопросов водоснабжения, мелиорации и эксплуатации месторождений.
Факты
 | Данный раздел имеет чрезмерный объём или содержит маловажные подробности. Если вы не согласны с этим, пожалуйста, покажите в тексте существенность излагаемого материала. В противном случае раздел может быть удалён. Подробности могут быть на странице обсуждения. |
- В среднем в организме растений и животных содержится более 50 % воды[44].
- В составе мантии Земли воды содержится в 10-12 раз больше, чем в Мировом океане[45].
- При средней глубине в 3,6 км Мировой океан покрывает около 71 % поверхности планеты и содержит 97,6 % известных мировых запасов свободной воды.[источник не указан 116 дней]
- Если бы на Земле не было впадин и выпуклостей, вода покрыла бы всю Землю слоем толщиной 3 км[46].
- При определённых условиях (внутри нанотрубок) молекулы воды образуют новое состояние, при котором они сохраняют способность течь даже при температурах, близких к абсолютному нулю[47].
- Вода отражает 5 % солнечных лучей, в то время как снег — около 85 %. Под лёд океана проникает только 2 % солнечного света.[источник не указан 116 дней]
- Синий цвет чистой океанской воды в толстом слое объясняется избирательным поглощением и рассеянием света в воде.[источник не указан 116 дней]
- С помощью капель воды из кранов можно создать напряжение до 10 киловольт, опыт называется «Капельница Кельвина».[источник не указан 116 дней]
- Вода — это одно из немногих веществ в природе, которые расширяются при переходе из жидкой фазы в твёрдую (кроме воды, таким свойством обладают сурьма[48], висмут, галлий, германий и некоторые соединения и смеси).
- Вода и водяной пар горят в атмосфере фтора фиолетовым пламенем. Смеси водяного пара со фтором в пределах взрывчатых концентраций взрывоопасны. В результате этой реакции образуются фтороводород и элементарный кислород.[источник не указан 116 дней]
См. также
Примечания
- ↑ англ. International Union of Pure and Applied Chemistry. Nomenclature of Inorganic Chemistry. IUPAC RECOMMENDATIONS 2005. RSC Publishing, 2005. — p. 306.
- ↑ 1 2 Маленков Г. Г. Вода // Физическая энциклопедия. — М.: Советская энциклопедия, 1988. — Т. I. Ааронова — Бома эффект — Длинные линии. — С. 294—297.
- ↑ Петрушевский Ф. Ф., Гершун А. Л. Лед, в физике // Энциклопедический словарь — СПб.: Брокгауз—Ефрон, 1896. — Т. XVII. — С. 471–473.
- ↑ Henniker, J. C. (1949). «The Depth of the Surface Zone of a Liquid». Reviews of Modern Physics (Reviews of Modern Physics) 21 (2): 322–341. DOI:10.1103/RevModPhys.21.322.
- ↑ Pollack, Gerald. Water Science. University of Washington, Pollack Laboratory. — «Water has three phases – gas, liquid, and solid; but recent findings from our laboratory imply the presence of a surprisingly extensive fourth phase that occurs at interfaces.». Проверено 5 февраля 2011. Архивировано 15 февраля 2013 года.
- ↑ CIA- The world fact book. Central Intelligence Agency. Проверено 20 декабря 2008.
- ↑ 1 2 Marine Science: An Illustrated Guide to Science
- ↑ 1 2 Gleick, P.H. Water in Crisis: A Guide to the World's Freshwater Resources. — Oxford University Press, 1993.
- ↑ Water Vapor in the Climate System (англ.). American Geophysical Union. Проверено 13 февраля 2013. Архивировано 15 февраля 2013 года.
- ↑ Криволуцкий А. Е. Голубая планета. Земля среди планет. Географический аспект. — М.: Мысль, 1985. — С. 212.
- ↑ United Nations. Un.org (22 марта 2005). Проверено 25 июля 2010. Архивировано 15 февраля 2013 года.
- ↑ 1 2 Ларионов А. К. Занимательная гидрогеология. — Москва: Недра, 1979. — С. 5—12. — 157 с.
- ↑ 1 2 3 Петрянов И.В. Самое необыкновенное вещество // Химия и жизнь. — 1965. — № 3. — С. 2—14.
- ↑ Physics of Ice (15 страница)
- ↑ Свойства воды. Физические свойства воды
- ↑ Основные физические свойства воды, водяного пара, льда, снега
- ↑ Коэффициенты поверхностного натяжения жидкостей
- ↑ Молекулярные преобразователи энергии в живой клетке (Тихонов А. Н., 1997)
- ↑ П. И. Воскресенский Техника лабораторных работ. 9-е изд. Л.: «Химия», 1970. С. 696—697
- ↑ Ходаков Ю.В., Эпштейн Д.А., Глориозов П.А. § 7. Атомы // Неорганическая химия: Учебник для 7—8 классов средней школы. — 18-е изд. — М.: Просвещение, 1987. — С. 15—18. — 240 с. — 1 630 000 экз.
- ↑ Радиационная химия // Энциклопедический словарь юного химика. 2-е изд. / Сост. В. А. Крицман, В. В. Станцо. — М.: Педагогика, 1990. — С. 200. — ISBN 5-7155-0292-6.
- ↑ Le Caër S. (2011). «Water Radiolysis: Influence of Oxide Surfaces on h3 Production under Ionizing Radiation». Water 3: 236.
- ↑ Вода на Луне: но откуда?
- ↑ NASA Space Assets Detect Ocean inside Saturn Moon. NASA (3 April 2014). Проверено 3 апреля 2014.
- ↑ (4 April 2014) «The Gravity Field and Interior Structure of Enceladus». Science (journal) 344: 78—80. DOI:10.1126/science.1250551. Проверено 3 April 2014.
- ↑ Solanki, S. K. (1994). «New Light on the Heart of Darkness of the Solar Chromosphere». Science 263 (5143): 64–66. DOI:10.1126/science.263.5143.64. PMID 17748350. Bibcode: 1994Sci...263...64S.
- ↑ MESSENGER Scientists 'Astonished' to Find Water in Mercury's Thin Atmosphere. Planetary Society (3 июля 2008). Проверено 5 июля 2008. Архивировано 17 января 2010 года.
- ↑ Bertaux, Jean-Loup (2007). «A warm layer in Venus' cryosphere and high-altitude measurements of HF, HCl, h3O and HDO». Nature 450 (7170): 646–649. DOI:10.1038/nature05974. PMID 18046397. Bibcode: 2007Natur.450..646B.
- ↑ Sridharan, R.; S.M. Ahmed, Tirtha Pratim Dasa, P. Sreelathaa, P. Pradeepkumara, Neha Naika, and Gogulapati Supriya (2010). «'Direct' evidence for water in the sunlit lunar ambience from CHACE on MIP of Chandrayaan I». Planetary and Space Science 58 (6). DOI:10.1016/j.pss.2010.02.013. Bibcode: 2010P&SS...58..947S.
- ↑ Donald Rapp. Use of Extraterrestrial Resources for Human Space Missions to Moon or Mars. — Springer, 28 November 2012. — P. 78–. — ISBN 978-3-642-32762-9.
- ↑ (2005) «Coupled Clouds and Chemistry of the Giant Planets — A Case for Multiprobes» (PDF). Space Science Reviews 116: 121–136. DOI:10.1007/s11214-005-1951-5. ISSN 0032-0633. Bibcode: 2005SSRv..116..121A.
- ↑ Hubble Sees Evidence of Water Vapor at Jupiter Moon. NASA (December 12, 2013). Проверено 12 декабря 2013.
- ↑ Encrenaz, 2003, p. 92.
- ↑ Hubbard, W. B. (1997). «Neptune's Deep Chemistry». Science 275 (5304): 1279–1280. DOI:10.1126/science.275.5304.1279. PMID 9064785.
- ↑ Земля (планета) — статья из Большой советской энциклопедии.
- ↑ Water Found on Distant Planet 12 July 2007 By Laura Blue, Time
- ↑ Water Found in Extrasolar Planet’s Atmosphere
- ↑ Атмосфера экзопланеты GJ 1214b переполнена водой. Компьюлента (24 февраля 2012). — «Новые наблюдения транзитов GJ 1214 b, удалённой от Земли на 40 световых лет, показали, что вода должна составлять не менее половины от всей массы атмосферы этой «суперземли»». Проверено 21 июля 2013. Архивировано 29 августа 2013 года.
- ↑ Watson, P. E. et al. (1980) Total body water volumes for adult males and females estimated from simple anthropometric measurements, The American Journal for Clinical Nutrition, Vol. 33, No 1, pp.27-39.
- ↑ Моргунова Г.С. Вода, которую мы пьём // Химия и жизнь. — 1965. — № 3. — С. 15—17.
- ↑ Sharma B.K. Water Pollution. — 1994. — P. 408—409.
- ↑ Воскресенский В. А., Дьяков В. И. Глава 2. Смазочные вещества и их физико-химические свойства // Расчет и проектирование опор скольжения (жидкостная смазка): Справочник. — М.: Машиностроение, 1980. — С. 15. — (Библиотека конструктора). — ISBN ББК 34.42, УДК 621.81.001.2 (031).
- ↑ Ученые: вода появилась в мантии Земли 2,7 млрд лет назад. ТАСС. Проверено 26 апреля 2016.
- ↑ Наука и техника. Книги. Загадки простой воды.
- ↑ Состав и природа мантии Земли
- ↑ Биосфера Земли
- ↑ Science Daily (англ.)
- ↑ Сурьма // Энциклопедический словарь юного химика. 2-е изд. / Сост. В. А. Крицман, В. В. Станцо. — М.: Педагогика, 1990. — С. 235. — ISBN 5-7155-0292-6.
Литература
Ссылки
Справочные материалыwikiredia.ru
3. Молекула воды. «Вода» | Суслов Б. Н.
В жизни человека, как и в жизни всякого другого существа, вода играет громадную роль. Вода нужна для питья и для приготовления пищи, вода нужна для мытья. Давно человек понял и то, что вода необходима для его полей. Поэтому нет ничего удивительного, что ещё древние народы, жившие тысячелетия до нас, смотрели на воду как на особое вещество, первооснову всего существующего.
«Вода как жидкое, подвижное, всепроникающее, явилась началом всего» — учил около двух с половиной тысяч лет назад «греческий мудрец Фалес Милетский. Лет двести спустя крупнейший философ древнего мира Аристотель насчитывал уже несколько таких первооснов, „основных элементов“ мира, но среди них была и вода.
В высказываниях древних греков, какими бы эти высказывания ни казались нам сейчас по-детски наивными, уже отражалось глубокое понимание значения воды во всех явлениях природы и в жизни человека.
Прошло около 20 веков. Само понятие „элемент“ существенно изменилось. Химическим элементом стали считать простое вещество, которое уже не может быть разложено далее на более простые вещества. Число элементов всё увеличивалось и увеличивалось. В списке этих элементов опять значилась вода.
И этому были причины. Ведь учёные того времени, наблюдая различные явления, в которых участвует вода, никогда не замечали, чтобы она изменялась химически. На глазах их она затвердевала в лёд, но лёд при таянии давал ту же воду. Вода нагревалась до кипения и испарялась, но, охлаждаясь, пары снова собирались в капли воды. Вода как вещество оставалась во всех процессах „самой собой“ и её считали неразложимым, простым веществом.
Только в конце восемнадцатого столетия было сделано важное открытие, что вода есть сложное вещество: вода была получена искусственным путём, при сжигании газа водорода в кислороде. Этим было доказано, что вода состоит из водорода и кислорода.
Приблизительно в это же время сложный состав воды удалось доказать и обратным путём — разложением воды на составные части. Это сделал французский учёный Лавуазье. Через раскалённый ружейный ствол он пропускал пары воды. От действия высокой температуры вода разлагалась. Кислород соединялся с железом, и на внутренней поверхности ствола появлялась окалина (соединение железа с кислородом), а из ствола выходил газ водород.
А несколькими годами позже вода впервые была разложена на её составные части электрическим током. Этим путём было точно установлено, что в воде по весу находится 11,11 процента водорода и 88,89 процента кислорода, причём водорода выделяется из воды по объёму в два раза больше, чем кислорода.
Если оба эти выделившиеся газа смешать, то при комнатной температуре эта смесь может оставаться без изменения очень долго. Чтобы только одна шестая часть этой смеси превратилась в воду, нам пришлось бы ждать 54 миллиарда лет. Но стоит только поднести к этой смеси горящую спичку или пропустить через неё электрическую искру, как между кислородом и водородом моментально произойдёт химическая реакция: водород сгорит в кислороде, и в результате получится вода. Такой опыт надо проводить с большой осторожностью, так как горение всегда сопровождается взрывом большой силы. Поэтому смесь из двух объёмов водорода и одного объёма кислорода и названа гремучей смесью.
Чтобы вызвать реакцию между кислородом и водородом, вовсе не обязательно нагревать всю смесь. Достаточно нагреть самый незначительный её объём. В этом объёме начнётся процесс горения водорода — соединения его с кислородом. При этом выделяется очень много тепла (десять граммов гремучей смеси при горении дают такое количество тепла, которого достаточно, чтобы вскипятить почти пол-литра воды). Выделяющееся тепло передаётся соседним участкам смеси, и процесс горения с чрезвычайной быстротой распространяется по всему объёму.
Температура в пламени гремучего газа превышает 3000 градусов. Поэтому гремучий газ и применяют для автогенной сварки.
Итак, вода — это сложное вещество, состоящее из кислорода и водорода. Как же построена молекула воды? Как располагаются в ней атомы кислорода и водорода?
Современная наука располагает очень точными методами исследования, которые позволяют проникнуть в строение вещества так глубоко, что уже теперь с полной уверенностью можно говорить не только о том, из каких атомов составлены молекулы того или другого вещества, но и о том, как располагаются атомы в молекулах. Каждая молекула воды состоит из трёх атомов: одного атома кислорода и двух атомов водорода. Все три атома расположены в молекуле таким образом, что если мысленно соединить их линиями, то образуется равнобедренный треугольник, то есть треугольник, у которого две стороны равны (рис. 3). В вершине находится атом кислорода, а в двух углах при основании — по атому водорода. Расстояния между атомом кислорода и водородными атомами одинаковы и равны 97 десятимиллиардным долям сантиметра. Расстояние между атомами водорода равно 154 десятимиллиардным долям сантиметра, а угол при вершине, в которой находится атом кислорода, составляет около 105 градусов. Если размер молекулы увеличить в десять миллиардов раз, этот треугольник поместился бы на столе среднего размера.
Рис. 3. Расположение атомов в молекуле воды.
Читатель может спросить: почему атомы в молекуле воды расположены в виде треугольника, а не по прямой линии — в середине атом кислорода, а по краям атомы водорода?
Объяснить это можно так. Всякое тело в природе стремится занять наиболее устойчивое положение. Мяч, брошенный на гладкую крышу, не останется лежать на её покатой поверхности и под действием силы тяжести обязательно скатится вниз. Если мы привяжем к нитке какой-нибудь грузик и будем держать нитку за свободный конец, грузик натянет нить и расположится точно по отвесной линии. Отведём грузик немного в сторону и отпустим, — грузик не останется в новом неустойчивом состоянии и под действием силы тяжести быстро вернётся к своему первоначальному положению. Так и в молекуле воды. Атомы соединены в ней друг с другом силами, которые называют силами химического сродства. Величина и направление действия этих сил таковы, что молекула воды является устойчивой именно тогда, когда атомы образуют треугольник. Всякая другая „постройка“ из атомов оказывается менее устойчивой. И если по каким-либо причинам расположение „атомов“ изменится, то по устранении этой причины атомы вновь образуют такой же треугольник.
Нужно сказать, что силы, удерживающие атомы водорода и кислорода в молекуле воды, весьма велики. Необходима очень большая энергия, чтобы связь между атомами „разорвалась“. Мы можем нагреть воду до 1400 градусов, и из миллиона молекул воды при этой температуре только около ста молекул окажутся разложенными на водород и кислород. Даже при 3092 градусах разрушается только 13 процентов всех молекул воды.
Любая вода, откуда бы она ни была взята, — из Северного Ледовитого океана, из глубокой шахты Донбасса, была заключена в снежинке или сверкала ранним утром в капельке росы на цветке, — любая вода состоят из одинаково построенных молекул. Однако взаимное расположение отдельных молекул друг относительно друга в жидкой воде, снежинке или в паре из парового котла оказывается неодинаковым.
Пары воды, нагретые градусов до трёхсот, при атмосферном давлении подобны обычным газам: в них расстояния между молекулами достаточно велики, так что каждая отдельная молекула может существовать более или менее самостоятельно, не испытывая существенного взаимодействия со стороны своих соседей, за исключением, конечно, тех случаев, когда молекулы в результате беспорядочного теплового движения сталкиваются друг с другом.
В снежинке или кусочке льда молекулы сближены и закреплены в определённых местах кристаллической решётки; движения молекул в большинстве своём ограничиваются колебанием около некоторых средних положений.
А как располагаются молекулы в жидкой воде?
В науке до сих пор ещё нет строгой, твёрдо установленной теории, касающейся строения жидкостей, в частности воды. Предполагается, что жидкая вода по своему строению представляет нечто среднее между кристаллами льда и паром. Изучение строения воды с помощью инфракрасных и рентгеновых лучей дало возможность считать, что при температурах, близких к точке замерзания, молекулы жидкой воды собираются в небольшие группы и „упаковываются“ в пространство приблизительно так, как в кристаллах, а при температурах, близких к точке кипения воды, при нормальном давлении, они располагаются более свободно, беспорядочно. Однако „каркас“, составленный в жидкой воде из отдельных молекул, должен быть очень гибким. Иначе трудно было бы объяснить подвижность воды, способность её быть „рабочим телом“, приводящим в движение тяжёлое колесо турбины, и переносчиком различных питательных веществ по тончайшим сосудам живых организмов.
По-видимому, и в водяном паре при невысоких температурах часть молекул воды объединена или, как говорят, ассоциирована.
Вода — самая распространённая в природе жидкость. Мы так привыкли к воде, к её разнообразным проявлениям, что она нам кажется самой обыкновенной жидкостью. Многие свойства воды положены в основу нашей измерительной системы. Температуру таяния льда мы считаем за нуль градусов, а температуру кипения за сто градусов (по принятой теперь почти всюду шкале Цельсия). Массу воды в объёме одного кубического сантиметра мы принимаем за меру массы — один грамм. Количество тепла, которое поглощает один грамм воды при нагревании на один градус, мы называем единицей теплоты — калорией. Многие измерительные приборы физиков и химиков градуируются по воде, и величины, измеренные для других веществ, обычно сравниваются с числами, полученными для воды. Но если мы внимательно присмотримся к поведению воды в различных условиях и сравним его с поведением большинства других жидкостей, то обнаружим, что наша „обыкновенная“ жидкость ведёт себя очень странно, если этими словами можно выразить своеобразный характер воды, резко отличающий её от всех других жидкостей.
Теперь мы и расскажем о некоторых самых важных и интересных свойствах воды и её отступлениях от общих „правил“ поведения жидкостей.
litresp.ru
Жизнь, молекула воды и золотая пропорция
Соотношения золотой пропорции исследователи находят в морфологической структуре растений, птиц, животных, человека. Закономерности золотой пропорции обнаруживаются и в организации неживой природы. В данной статье на основании анализа молекулы воды в различных агрегатных состояниях высказана гипотеза, что ее структура в состоянии талой воды практически соответствует треугольнику золотой пропорции.
Воде была дана волшебная власть стать соком жизни на Земле.Леонардо да Винчи
Вода - одно из самых уникальных и загадочных веществ на Земле. Природа этого вещества до конца еще не понята. Внешне вода кажется достаточно простой, в связи с чем долгое время считалась неделимым элементом. Лишь в 1766 году Г. Кавендиш (Англия) и затем в 1783 году А. Лавуазье (Франция) показали, что вода не простой химический элемент, а соединение водорода и кислорода в определенной пропорции. После этого открытия химический элемент, обозначаемый как Н, получил название "водород" (Hydrogen - от греч. hydro genes), которое можно истолковать как "порождающий воду".


Теплоемкость воды достигает минимального значения при температуре около 37оС.
Дальнейшие исследования показали, что за незатейливой химической формулой Н2О скрывается вещество, обладающее уникальной структурой и не менее уникальными свойствами. Исследователи, пытавшиеся на протяжении двух с лишним столетий раскрыть секреты воды, часто заходили в тупик. Да и сейчас ученые понимают, что вода остается трудным объектом для исследований, ее свойства до сих пор не всегда до конца прогнозируемы.
Загадочная магия воды. Почему жидкая вода имеет необычные свойства? Традиционный ответ может быть следующим: из-за свойств атомов кислорода и водорода, из-за их структурного расположения в молекуле, из-за определенного поведения электронов в молекуле и т.п.


Плотность воды при понижении температуры сначала возрастает, достигает максимума при 4оС и начинает уменьшаться. Плотность льда почти на 10% меньше, чем у воды, а удельный объем на столько же больше. Поэтому лед плавает, а вода, замерзая в трещинах горных пород, раскалывает их.
Так в чем же заключаются загадочные, необычные свойства привычной всем жидкой воды? Прежде всего, в том, что практически все свойства воды аномальны, а многие из них не подчиняются логике тех законов физики, которые управляют другими веществами. Кратко упомянем те из них, которые обуславливают существование жизни на Земле.
Вначале о трех особенностях тепловых свойств воды.
Первая особенность: вода - единственное вещество на Земле (кроме ртути), для которого зависимость удельной теплоемкости от температуры имеет минимум.
Из-за того, что удельная теплоемкость воды имеет минимум около 37оС, нормальная температура человеческого тела, состоящего на две трети из воды, находится в диапазоне температур 36-38оС (внутренние органы имеют более высокую температуру, чем наружные).


В момент плавления объем свинца мгновенно увеличивается от 1 до 1,003, а объем воды скачком уменьшается от 1,1 до 1,0.
Вторая особенность: теплоемкость воды аномально высока. Чтобы нагреть определенное ее количество на один градус, необходимо затратить больше энергии, чем при нагреве других жидкостей, - по крайней мере вдвое по отношению к простым веществам. Из этого вытекает уникальная способность воды сохранять тепло. Подавляющее большинство других веществ таким свойством не обладают. Эта исключительная особенность воды способствует тому, что у человека нормальная температура тела поддерживается на одном уровне и жарким днем, и прохладной ночью.
Таким образом, вода играет главенствующую роль в процессах регулирования теплообмена человека и позволяет ему поддерживать комфортное состояние при минимуме энергетических затрат. При нормальной температуре тела человек находится в наиболее выгодном энергетическом состоянии.


Вода имеет аномально высокие температуры кипения и замерзания по сравнению с другими трехатомными соединениями водорода.
Температура других теплокровных млекопитающих (32-39оС) также хорошо соотносится с температурой минимума удельной теплоемкости воды.
Третья особенность: вода обладает высокой удельной теплотой плавления, то есть воду очень трудно заморозить, а лед - растопить. Благодаря этому климат на Земле в целом достаточно стабилен и мягок.
Все три особенности тепловых свойств воды позволяют человеку оптимальным образом существовать в условиях благоприятной среды.
Имеются особенности и в поведении объема воды. Плотность большинства веществ - жидкостей, кристаллов и газов - при нагревании уменьшается и при охлаждении увеличивается, вплоть до процесса кристаллизации или конденсации. Плотность воды при охлаждении от 100 до 4оС (точнее, до 3,98оС) возрастает, как и у подавляющего большинства жидкостей. Однако, достигнув максимального значения при температуре 4оС, плотность при дальнейшем охлаждении воды начинает уменьшаться. Другими словами, максимальная плотность воды наблюдается при температуре 4оС (одна из уникальных аномалий воды), а не при температуре замерзания 0оС.


В жидкой воде молекулы h3O могут объединяться в сложные образования - кластеры, по структуре напоминающие лед.
Замерзание воды сопровождается скачкообразным(!) уменьшением плотности более чем на 8%, тогда как у большинства других веществ процесс кристаллизации сопровождается увеличением плотности. В связи с этим лед (твердая вода) занимает больший объем, чем жидкая вода, и держится на ее поверхности.
Столь необычное поведение плотности воды крайне важно для поддержания жизни на Земле.

Схематичное изображение молекулы воды на плоскости.
Покрывая воду сверху, лед играет в природе роль своего рода плавучего одеяла, защищающего реки и водоемы от дальнейшего замерзания и сохраняющего жизнь подводному миру. Если бы плотность воды увеличивалась при замерзании, лед оказался бы тяжелее воды и начал тонуть, что привело бы к гибели всех живых существ в реках, озерах и океанах, которые замерзли бы целиком, превратившись в глыбы льда, а Земля стала ледяной пустыней, что неизбежно привело бы к гибели всего живого.
Отметим еще некоторые особенности воды.
Внешне вода подвижна и податлива, и ее можно заключить в любой сосуд. Однако, проникая в трещины горных пород и расширяясь при замерзании, вода раскалывает скальные породы любой твердости, которые постепенно распадаются на все более мелкие частицы. Так начинается возврат окаменевших пород в жизненный цикл: на полях промерзание поверхностных слоев земли с ее органическими компонентами помогает образованию плодородной почвы.


Деление отрезка в крайнем и среднем отношении, или золотая пропорция. Отрезок разделен на две части так, что CB:AC = AC:AB.
"Золотой треугольник". Соотношение его сторон OA:AB = OB:AB
 0,618,
угол при вершине α = 108°.
0,618,
угол при вершине α = 108°.
Процесс включения твердых веществ в большой круговорот живой природы ускоряется чудесным свойством воды их растворять. Вода с растворенными компонентами твердых веществ становится средой питания и поставщиком микроэлементов, необходимых для жизни растений, животных и человека.
Вода сильнее других жидкостей проявляет свойства универсального растворителя. Если ей дать достаточно времени, она может растворить практически любое твердое вещество. Именно из-за уникальной растворяющей способности воды никому до сих пор не удалось получить химически чистую воду - она всегда содержит растворенный материал сосуда. Вода абсолютно необходима для всех ключевых систем жизнеобеспечения человека. Она содержится в человеческой крови (79%) и способствует переносу по кровеносной системе в растворенном состоянии тысяч необходимых для жизни веществ. Вода содержится в лимфе (96%), которая разносит из кишечника питательные вещества по тканям живого организма (см. таблицу).

Перечисленные свойства и особая роль воды в обеспечении жизни на Земле не могут оставить равнодушным ни один пытливый ум, даже если он верит в счастливые случайности. "Начало всего есть вода", - справедливо отмечал Фалес из Милета в VI веке до н.э.
Жидкое чудо. Прекратим перечисление странных, но жизненно необходимых свойств воды, которых можно набрать еще с десяток, и переключим внимание на секреты необычного строения ее молекулы. Именно анализ строения молекулы воды позволяет понять ее исключительность в живой и неживой природе. Так что дорога к истине проходит через строение одиночной молекулы воды.
Прежде всего отметим, что молекула воды самая маленькая среди подобных трехатомных молекул (по отношению к гомологам, то есть водородным соединениям типа Н2S, Н2Se, Н2Те, со свойствами которых традиционно сравнивают свойства воды). Такие молекулы при нормальных условиях образуют газы, а молекулы воды - жидкость. Почему?


Хаотичное сообщество газообразных молекул воды при конденсации, то есть при образовании жидкой фазы, формирует жидкое вещество удивительной сложности. В первую очередь это связано с тем, что молекулы воды обладают уникальным свойством объединяться в кластеры (группы) (Н2О)x. Под кластером обычно понимают группу атомов или молекул, объединенных физическим взаимодействием в единый ансамбль, но сохраняющих внутри него индивидуальное поведение. Возможности прямого наблюдения кластеров ограничены, и поэтому экспериментаторы компенсируют аппаратурные недостатки интуицией и теоретическими построениями.
При комнатной температуре степень ассоциации X для воды составляет, по современным данным, от 3 до 6. Это означает, что формула воды не просто Н2О, а среднее между Н6О3 и Н12О6. Другими словами, вода - сложная жидкость, "составленная" из повторяющихся групп, содержащих от трех до шести одиночных молекул. Вследствие этого вода имеет аномальные значения температуры замерзания и кипения по сравнению с гомологами. Если бы вода подчинялась общим правилам, она должна была замерзать при температуре порядка -100оС и закипать при температуре около +10оС.
Если бы вода при испарении оставалась в виде Н6О3, Н8О4 или Н12О6, то водяной пар был бы намного тяжелее воздуха, в котором доминируют молекулы азота и кислорода. В этом случае поверхность всей Земли была бы покрыта вечным слоем тумана. Представить себе жизнь на такой планете практически невозможно.
Людям крупно повезло: кластеры воды при испарении распадаются, и вода превращается практически в простой газ с химической формулой Н2О (обнаруженное в последнее время в паре незначительное количество димеров Н4О2 погоды не делает). Плотность газообразной воды меньше плотности воздуха, и поэтому вода способна насыщать своими молекулами земную атмосферу, создавая комфортные для человека погодные условия.
На Земле нет других веществ, наделенных способностью быть жидкостью при температурах существования человека и при этом образовывать газ не только легче воздуха, но и способный возвращаться к ее поверхности в виде осадков.
Восхитительная геометрия. Итак, какова же самая маленькая среди трехатомных молекул? Молекула воды имеет симметричную V-образную форму, так как два небольших атома водорода располагаются с одной стороны от сравнительно крупного атома кислорода. Это сильно отличает молекулу воды от линейных молекул, например Н2Ве, в которой все атомы располагаются цепочкой. Именно такое странное расположение атомов в молекуле воды и позволяет ей иметь множество необычных свойств.
Если внимательно рассмотреть геометрические параметры молекулы воды, то в ней обнаруживается определенная гармония. Чтобы увидеть ее, построим равнобедренный треугольник Н-О-Н с протонами в основании и кислородом в вершине. Такой треугольник схематично копирует структуру молекулы воды, проекция которой на плоскость условно изображена на рисунке.
Длины сторон этого треугольника и валентный угол между двумя связями О-Н изменяются при изменении агрегатного состояния воды. Приведем эти параметры.
Прокомментируем данные, характеризующие различные состояния воды.
Параметры молекулы воды в парообразном состоянии получены на основе обработки спектров ее поглощения. Результаты неоднократно уточнялись, но по существу правильно оценивают длины связей и валентный угол в молекуле воды в состоянии пара.
Кристаллическая структура льда при нормальном давлении довольно рыхлая с причудливой паутиной связей между молекулами воды. Схематично кристаллическую решетку обычного льда можно построить из атомов кислорода, каждый из которых участвует с соседними атомами в четырех водородных связях, направленных приблизительно к вершинам правильного тетраэдра.
Напомним, что водородной называется связь между атомами в одной молекуле или между соседними молекулами, которая осуществляется через атом водорода. Водородная связь играет чрезвычайно важную роль в структуре не только воды, но и большинства биологических молекул - углеводов, белков, нуклеиновых кислот и т. п.
Если кристаллический лед хорошо упорядочен по кислороду, то этого нельзя сказать про водород: в расположении ионов водорода (протонов) наблюдается сильный беспорядок. Их положение четко не определено, и поэтому лед можно считать разупорядоченным по водороду.
Лед обладает многими удивительными особенностями, из которых отметим две.
Во-первых, он всегда очень чист химически. В структуре льда практически не бывает примесей: при замерзании они вытесняются в жидкость. Именно поэтому снежинки всегда белые, а льдинки на поверхности грязной лужи практически прозрачные. Вообще говоря, любой растущий кристалл стремится создать идеальную кристаллическую решетку и вытесняет посторонние вещества. Но в планетарном масштабе именно замечательный феномен замерзания и таяния воды играет роль гигантского очистительного процесса - вода на Земле постоянно очищает сама себя.
Во-вторых, лед и особенно снег обладают очень высокой отражательной способностью. Благодаря этому солнечное излучение не вызывает заметного нагрева полярных областей, и, как следствие этого, наша планета избавлена от сезонных наводнений и повышений уровня Мирового океана.
Экспериментальное определение параметров одиночной молекулы воды в жидкой фазе до сих пор встречает непреодолимые трудности, поскольку жидкая вода - это смесь структурных элементов, то есть различных кластеров, находящихся в динамическом равновесии между собой. Полной ясности в отношении их взаимодействий до сих пор нет, а разделить такую смесь на отдельные компоненты невозможно: "простая" жидкость Н2О не торопится раскрывать свои внутренние секреты.
Вернемся к рисунку, на котором в общих чертах представлена структура молекулы воды. В ней есть симметрия, которая играет основную роль в попытках всестороннего объяснения физического мира, и асимметрия, наделяющая эту молекулу возможностью движения и связью с золотой пропорцией. Поэтому кратко напомним о том, что в математике называют золотой пропорцией.
Золотая пропорция . Это понятие возникает при решении геометрической задачи о нахождении на отрезке АВ такой точки С, чтобы выполнялось соотношение СВ:АС = АС:АВ.
Решение этой задачи приводит к отношению СВ:АС = (-1+√5)/2, которое называют золотой пропорцией, а соответствующее геометрическое деление отрезка АВ точкой С называют золотым сечением. Если принять весь отрезок за единицу, то АС = 0,618033… и СВ = 0,381966....
Время показало, что золотая пропорция воплощает совершенные и гармоничные отношения двух величин. В геометрической интерпретации она приводит к соразмерному и привлекательному соотношению между двумя неравными отрезками.
Исследователи золотой пропорции с античных времен до наших дней всегда восхищались и продолжают восхищаться ее свойствами, которые проявляются в строении различных элементов физического и биологического мира. Золотая пропорция обнаруживается везде, где соблюдены принципы гармонии.
Что же объединяет золотую пропорцию с молекулой воды? Чтобы ответить на этот вопрос, рассмотрим двумерный образ золотой пропорции в виде треугольника.
В золотом треугольнике отношение ОА:АВ = ОВ:АВ 0,618, угол α = 108,0о. Для льда отношение длин связей О-Н к Н-Н равно 0,100:0,163 = 0,613 и угол α = 109,5о, для пара - соответственно 0,631 и 104,5о. Не распознать в золотом треугольнике прообраз структуры молекулы воды просто невозможно! Удивительно, что до сих пор так мало внимания обращали на возможность подобной интерпретации ее строения.
И действительно, поместив в треугольнике АОВ в точки А и В атомы водорода, а в точку О - атом кислорода, получим в первом приближении молекулу жидкой воды, сконструированную на основе золотой пропорции. Подобная элегантность молекулы очаровывает и восхищает. Так что роль молекулы воды в природе и жизни не может быть правильно оценена без учета красоты ее формы.
Исключительная гармония. Убедимся, что молекула жидкой воды - единственное трехатомное вещество, имеющее соразмерности, свойственные золотой пропорции.
В трехатомных молекулах-гомологах, близких по химическому составу к молекуле воды (Н2S, h3Se и Н2Те), валентный угол приблизительно равен 90о. Например, молекула Н2S имеет следующие геометрические параметры:
длина связи S-Н, нм ......................... 0,1345
длина связи Н-Н, нм ........................... 0,1938
валентный угол Н-S-Н, град .............. 92,2
Отношение длин связей S-Н к Н-Н равно 0,694, что далеко от золотой пропорции. Квантово-химические расчеты показывают, что если бы вода была подобна родственным ей веществам, то валентный угол у ее молекулы должен был быть приблизительно таким же, как у Н2S, или больше максимум на 5о.
Но вода, как выясняется, не любит подобия, она всегда герой другого романа. Если бы валентный угол у воды был порядка 90-95о, о золотой пропорции пришлось бы забыть и вода оказалась бы в одном содружестве с другими водородными соединениями.
Но вода уникальна, ее молекула обладает практически выверенными эстетическими качествами, и поэтому ее свойства необходимо иногда интерпретировать, выходя за рамки традиционной научной парадигмы. И тогда некоторые загадки воды смогут быть объяснены таким "ненаучным" понятием, как гармония.
На приведенные рассуждения можно возразить: экспериментальные измерения геометрических параметров молекулы воды имеют определенную погрешность, и поэтому соотношение золотой пропорции может строго не выполняться. Но даже если в экспериментальные измерения внести еще большую погрешность, молекула воды все равно останется единственным из трехатомных веществ, имеющим практически "золотые" гармоничные пропорции.
В связи с этим обратим внимание на загадку талой воды, которая, по широко распространенному мнению, обладает отличным от обычной воды физиологическим воздействием.
Удивительная талая вода. Она рождается при таянии льда и сохраняет температуру 0оС, пока весь лед не растает. Специфика межмолекулярных взаимодействий, характерная для структуры льда, сохраняется и в талой воде, так как при плавлении кристалла разрушается только 15% всех водородных связей. Поэтому присущая льду связь каждой молекулы воды с четырьмя соседними ("ближний порядок") в значительной степени не нарушается, хотя и наблюдается бoльшая размытость кислородной каркасной решетки.
Таким образом, талая вода отличается от обычной изобилием многомолекулярных кластеров, в которых в течение некоторого времени сохраняются рыхлые льдоподобные структуры. После таяния всего льда температура воды повышается и водородные связи внутри кластеров перестают противостоять возрастающим тепловым колебаниям атомов. Размеры кластеров изменяются, и поэтому начинают меняться свойства талой воды: диэлектрическая проницаемость приходит к своему равновесному состоянию через 15-20 минут, вязкость - через 3-6 суток. Биологическая активность талой воды спадает, по одним данным, приблизительно за 12-16 часов, по другим - за сутки.
Итак, физико-химические свойства талой воды самопроизвольно меняются во времени, приближаясь к свойствам обычной воды: она постепенно как бы "забывает" о том, что еще недавно была льдом.
Лед и пар - различные агрегатные состояния воды, и поэтому логично предположить, что в жидкой промежуточной фазе валентный угол отдельной молекулы воды лежит в диапазоне между значениями в твердой фазе и в паре. В кристалле льда валентный угол молекулы воды близок к 109,5о. При таянии льда межмолекулярные водородные связи ослабевают, расстояние Н-Н несколько сокращается, валентный угол уменьшается. При нагревании жидкой воды происходит разупорядочение кластерной структуры, и этот угол продолжает уменьшаться. В парообразном состоянии валентный угол молекулы воды составляет уже 104,5о.
Значит, для обычной жидкой воды валентный угол вполне может иметь некоторое среднее значение между 109,5 и 104,5о, то есть примерно 107,0о. Но так как талая вода по своей внутренней структуре близка ко льду, то и валентный угол ее молекулы должен быть ближе к 109,5о, скорее всего, около 108,0о.
Сказанное выше можно сформулировать в виде гипотезы: в силу того, что талая вода значительно более структурирована, чем обычная вода, ее молекула с большой долей вероятности имеет структуру, максимально приближенную к гармоничному треугольнику золотой пропорции с валентным углом, близким к 108о, и с отношением длин связей примерно 0,618-0,619.
Экспериментального подтверждения этой гипотезы у авторов нет, как нет и какой-либо теории ее обоснования. Есть только догадка, высказанная на этих страницах, которая может, естественно, оспариваться.
Таинственная сила талой воды. Человеку с незапамятных времен известны удивительные свойства талой воды. Давно замечено, что вблизи тающих родников растительность альпийских лугов всегда пышнее, а у кромки тающего льда в арктических морях бурно цветет жизнь. Полив талой водой повышает урожайность сельскохозяйственных культур, ускоряет прорастание семян. При употреблении талой воды устойчиво повышаются привесы в животноводстве, ускоряется развитие цыплят. Известно, с какой жадностью животные пьют весной талую воду, а птицы буквально купаются в первых лужицах подтаявшего снега.
Талая вода, в отличие от обычной, по своей структуре очень похожа на жидкость, содержащуюся в клетках растительных и живых организмов. Именно поэтому для человека более подходит "ледяная" структура талой воды, в которой молекулы объединены в ажурные кластеры. Это уникальное свойство талой воды способствует ее легкому усвоению организмом, она биологически активна. Вот почему так полезны овощи и фрукты - они доставляют в организм воду, имеющую аналогичную структуру.
При питье талой воды происходит подпитка организма самым гармоничным из всех веществ на Земле. Она улучшает обмен веществ и усиливает кровообращение, снижает количество холестерина в крови и успокаивает боли в сердце, повышает адаптационные возможности организма и способствует продлению жизни. Глоток чистейшей талой воды тонизирует лучше пастеризованного сока, в ней есть заряд энергии, бодрости и легкости.
Один из авторов этой работы постоянно пьет талую с плавающими льдинками воду и считает, что именно поэтому за три года ни разу не простудился. Талая вода освежает и молодит кожу, которая перестает нуждаться в кремах и лосьонах.
Теоретическое изучение свойств талой воды находится пока на уровне гипотез. Нет общепринятого мнения о причинах, вызывающих необычные эффекты при ее применении. Есть определенные проблемы и с доказательной стороной биологической активности талой воды. Исследования в этом направлении вызывают порой жаркие дискуссии. Сложность проблемы, отсутствие ясности - все это должно не отпугивать, а притягивать и способствовать появлению новых идей, гипотез, теорий. Таков зачастую тернистый путь развития науки.
Подчеркнем: приведенная гипотеза не претендует на расшифровку загадки талой воды. Она лишь позволяет выйти за рамки традиционного мышления и посмотреть на взаимную любовь жизни и воды с необычной стороны - со стороны гармонии и красоты, со стороны особых свойств талой воды, добавляющих ее изящной молекуле черты, которыми не обладают другие молекулы.Кандидат технических наук В. БЕЛЯНИН, ведущий научный сотрудник РНЦ "Курчатовский институт", Е. РОМАНОВА, студентка МАДИ (ГТУ).
ЛИТЕРАТУРА
Ауэрбах Ф. Семь аномалий воды. - СПб., 1919.
Габуда С. П. Связанная вода. Факты и гипотезы. - Новосибирск: Наука, 1982.
Зацепина Г. Н. Физические свойства и структура воды. - М.: МГУ, 1998.
Синюков В. В. Вода известная и неизвестная. - М.: Знание, 1987.
Белянин В. С., Романова Е. Золотая пропорция. Новый взгляд // Наука и жизнь, 2003, № 6.
Вода: структура, состояние, сольватизация. Достижения последних лет. - М.: Наука, 2003.
nauka.relis.ru
МОЛЕКУЛА ВОДЫ
разное
жизни человека, как и в жизни всякого другого существа, вода играет громадную роль. Вода нужна для питья, приготовления пищи, для мытья. Давно человек понял и то, что вода необходима для его полей. Поэтому нет ничего удивительного, что ещё древние народы, жившие тысячелетия до нас, смотрели на воду как на особое вещество, первооснову всего существующего.
«Вода как жидкое, подвижное, всепроникающее, явилась началом всего» — учил около двух с половиной тысяч лет назад греческий учёный Фалес Милетский. Лет двести спустя крупнейший философ древнего мира Аристотель насчитывал уже несколько таких первооснов, «основных элементов» мира, среди которых была и вода.
В высказываниях древних греков, какими бы эти высказывания ни казались нам сейчас по-детски наивными, уже отражалось глубокое понимание значения воды во всех явлениях природы и в жизни человека.
С тех пор прошло около 20 веков. Само понятие «элемент» существенно изменилось. Химическим элементом стали считать такое вещество, которое уже не может быть разложено далее на более простые вещества. Число элементов всё увеличивалось и увеличивалось. В списке их оставалась вода.
И этому были причины. Ведь учёные того времени, наблюдая различные явления, в которых участвует вода, никогда не замечали, чтобы она изменялась химически. На их глазах она затвердевала в лёд, но лёд при таянии давал ту же воду. Вода нагревалась до кипения и испарялась, но, охлаждаясь, пары снова собирались в капли воды. Вода как вещество оставалась во всех процессах «самой собой» и её считали неразложимым, простым веществом.
Только в конце восемнадцатого столетия было сделано важное открытие, что вода есть сложное вещество: вода впервые была получена искусственным путём, при сжигании газа водорода в кислороде. Так было доказано, что вода состоит из водорода и кислорода.
Приблизительно в это же время сложный состав воды удалось доказать и обратным путём — разложением воды на составные части. Это сделал французский учёный Лавуазье. Через раскалённый ружейный ствол он пропускал пары воды. От действия высокой температуры вода разлагалась. Кислород соединялся с железом, и на внутренней поверхности ствола появлялась окалина (соединение железа с кислородом), а из ствола выходил газ водород.
А несколькими годами позже вода впервые была разложена на её составные части электрическим током. Этим путём было точно установлено, что в воде по весу находится 11,11 процента водорода и 88,89 процента кислорода, по объёму же водорода выделяется из воды в два раза больше, чем кислорода.
Если оба эти выделившиеся газа смешать, то при комнатной температуре такая смесь может оставаться без изменения очень долго. Чтобы только одна шестая часть смеси превратилась в воду, нам пришлось бы ждать 54 миллиарда лет! Но стоит только поднести к этой смеси горящую спичку или пропустить через неё электрическую искру, как между кислородом и водородом моментально произойдёт химическая реакция: водород сгорит в кислороде, и в результате получится вода. Такой опыт надо проводить с большой осторожностью, так как горение всегда сопровождается взрывом большой силы. Поэтому смесь из двух объёмов водорода и одного объёма кислорода и названа гремучей смесью.
Чтобы вызвать реакцию между кислородом и водородом, вовсе не обязательно нагревать всю смесь. Достаточно нагреть самый незначительный её объём. В этом объёме начнётся процесс горения водорода — соединение его с кислородом. При этом выделяется очень много тепла (десять граммов гремучей смеси при горении дают такое количество тепла, которого достаточно, чтобы вскипятить почти пол-литра воды). Выделяющееся тепло передаётся соседним участкам смеси, и процесс горения с чрезвычайной быстротой распространяется по всему
Объёму. Температура в пламени гремучего газа превышает 3000 градусов.
Итак, вода — сложное вещество, состоящее из кислорода и водорода. Как же построена молекула воды? Как располагаются в ней атомы кислорода и водорода?
Современная наука вооружена очень точными методами исследования, которые позволяют проникнуть в строение вещества так глубоко, что уже теперь с полной уверенностью можно говорить не только о том, из каких атомов составлены молекулы того или другого вещества, но и о том, как располагаются атомы в молекулах. Каждая молекула воды состоит из трёх атомов: одного атома
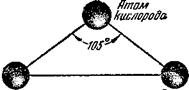 Кислорода и двух атомов водорода. Все три атома расположены в молекуле таким образом, что если мысленно соединить их линиями, то образуется равнобедренный треуголь - Лтом Лтом ник, то-есть треугольник,
Кислорода и двух атомов водорода. Все три атома расположены в молекуле таким образом, что если мысленно соединить их линиями, то образуется равнобедренный треуголь - Лтом Лтом ник, то-есть треугольник,
Водорода еодорода у которого две стороны
Рис. 3. Схема расположения ато - равны (рис. 3). В верши- мов в молекуле воды. не находится атом кисло
Рода, а в двух углах при основании — по атому водорода. Расстояния между центром атома кислорода и центрами водородных атомов одинаковы и равны 97 десятимиллиардным долям сантиметра. Расстояние между центрами атомов водорода равно 154 десятимиллиардным долям сантиметра, а угол при вершине, в которой находится атом кислорода, составляет около 105 градусов. Если размер молекулы увеличить в десять миллиардов раз, этот треугольник поместится на небольшом столе.
Читатель может спросить: почему атомы в молекуле воды расположены в виде треугольника, а не по прямой линии — в середине атом кислорода, а по краям атомы водорода?
Объяснить это можно так. Всякое тело в природе стремится занять наиболее устойчивое положение. Мяч, брошенный на гладкую покатую крышу, не останется лежать на её поверхности, а под действием силы тяжести обязательно скатится вниз. Если мы привяжем к нитке какой-нибудь грузик и будем держать нитку за свободный конец,, грузик натянет нить и расположится, точно по отвесной линии. Отведём грузик немного в сторону и отпустим,. — грузик не останется в новом неустойчивом состоянии, а под действием силы тяжести быстро вернётся к своему первоначальному положению. Так и в молекуле воды. Атомы соединены в ней друг с другом силами, которые называют силами химического сродства. Величина и направление действия этих сил таковы, что молекула воды является устойчивой именно тогда, когда атомы образуют треугольник. Всякая другая «постройка» из атомов оказывается менее устойчивой. И если по каким-либо причинам расположение атомов изменится, то по устранении этой причины атомы вновь образуют такой же треугольник.
Нужно сказать, что силы, удерживающие атомы водорода и. кислорода в молекуле воды, весьма велики. Необходима очень большая энергия, чтобы связь между атомами «разорвалась». Мы можем нагреть воду до 1400 градусов, и из миллиона молекул воды при этой температуре только около ста молекул окажутся разложенными на водород и кислород. Даже при 3092 градусах разрушается только 13 процентов всех молекул воды.
Любая вода, откуда бы она ни была взята, — из; Северного Ледовитого океана или из глубокой шахты Донбасса, была заключена в снежинке или: сверкала ранним утром - в капельке росы на цветке, — любая вода состоит из одинаково построенных молекул. Однако взаимное расположение отдельных молекул друг относительно друга в жидкой воде, снежинке или в паре из парового котла оказывается неодинаковым.
Пары воды, нагретые градусов до трёхсот, при атмосферном давлении подобны обычным газам: в них расстояния между молекулами достаточно велики, так что каждая отдельная молекула может существовать более или менее самостоятельно, не испытывая существенного воздействия со стороны своих соседей, за исключением, конечно, тех случаев, когда молекулы в результате*, беспорядочного теплового движения сталкиваются: друг с другом.
В снежинке или кусочке льда молекулы сближены и закреплены в определённых местах кристаллической решётки; движения молекул в большинстве своём ограничиваются колебанием около некоторых средних положений.
А как располагаются молекулы в жидкой воде?
В науке до сих пор ещё нет строгой, твёрдо установленной теории строения жидкостей, в частности воды. Предполагается, что жидкая вода по своему строению представляет нечто среднее между кристаллами льда и паром. Изучение строения воды с помощью инфракрасных и рентгеновых лучей дало возможность считать, что при температурах, близких к точке замерзания, молекулы жидкой воды собираются в небольшие группы и «упаковываются» в пространстве приблизительно так, как в кристаллах, а при температурах, близких к точке кипения воды, при нормальном давлении, они располагаются более свободно. Однако «каркас», составленный в жидкой воде из отдельных молекул, должен быть очень гибким. Иначе трудно было бы объяснить подвижность воды, способность её участвовать в самых различных процессах, начиная от процессов растворения и кончая переносом питательных веществ по тончайшим сосудам живых организмов.
Повидимому, и в водяном паре при невысоких температурах часть молекул воды объединена или, как говорят, ассоциирована.
Вода — самая распространённая в природе и как будто самая обыкновенная жидкость. Многие свойства воды положены в основу нашей измерительной системы. Температуру таяния льда мы считаем за нуль градусов, а температуру кипения за сто градусов (по принятой теперь почти всюду шкале Цельсия). Массу воды в объёме одного кубического сантиметра при 4 градусах Цельсия мы принимаем за меру массы — один грамм. Количество тепла, которое поглощает один грамм воды при нагревании на один градус, мы называем единицей теплоты — калорией. Многие измерительные приборы физиков и химиков градуируются по воде, и величины, измеренные для других веществ, в этом случае сравниваются с числами, полученными для воды. Но если мы внимательно присмотримся к поведению воды в различных условиях и сравним его с поведением большинства других жидкостей, то обнаружим, что наша «обыкновенная» жидкость ведёт себя очень странно, если этими словами можно выразить своеобразный характер воды, резко отличающий её от всех других жидкостей.
Теперь мы и расскажем о некоторых самых важных и интересных свойствах воды и её отступлениях от общих «правил поведения» жидкостей.
Как идентифицировать оригинальную батарею на iPhone Батарея iPhone 5 – один из ключевых элементов культового гаджета, позволяющий пользователям долгое время оставаться на связи. Речь ищет о литий-ионном аккумуляторе емкостью1440 mAh. …
Сегодня многие владельцы домашних животных не утруждают себя приготовлением классической вареной еды для любимцев, а просто наполняют мисочки пушистиков сухими кормами, которые стали так популярны.
Квалифицированные инженеры, работающие в компании «Дом Экологии», советуют владельцам частных домов либо коттеджей заказать услугу по установке автономной канализации, которая требует минимального обслуживания. Уже многие клиенты, посетившие раздел http://www.osk-ekoline.com.ua/avtonomnaja-kanalizacija-polijetilen.html, смогли …
msd.com.ua

 NaHCO3+Ch4COOH→Ch4COONa+h3O+CO2↑{\displaystyle {\mathsf {NaHCO_{3}+CH_{3}COOH\rightarrow CH_{3}COONa+H_{2}O+CO_{2}\uparrow }}}
NaHCO3+Ch4COOH→Ch4COONa+h3O+CO2↑{\displaystyle {\mathsf {NaHCO_{3}+CH_{3}COOH\rightarrow CH_{3}COONa+H_{2}O+CO_{2}\uparrow }}} 2Ch4COOH+CaCO3→Ca(Ch4COO)2+h3O+CO2↑{\displaystyle {\mathsf {2CH_{3}COOH+CaCO_{3}\rightarrow Ca(CH_{3}COO)_{2}+H_{2}O+CO_{2}\uparrow }}}
2Ch4COOH+CaCO3→Ca(Ch4COO)2+h3O+CO2↑{\displaystyle {\mathsf {2CH_{3}COOH+CaCO_{3}\rightarrow Ca(CH_{3}COO)_{2}+H_{2}O+CO_{2}\uparrow }}} h3SO4+2KOH→K2SO4+2h3O{\displaystyle {\mathsf {H_{2}SO_{4}+2KOH\rightarrow K_{2}SO_{4}+2H_{2}O}}}
h3SO4+2KOH→K2SO4+2h3O{\displaystyle {\mathsf {H_{2}SO_{4}+2KOH\rightarrow K_{2}SO_{4}+2H_{2}O}}} HNO3+Nh5OH→Nh5NO3+h3O{\displaystyle {\mathsf {HNO_{3}+NH_{4}OH\rightarrow NH_{4}NO_{3}+H_{2}O}}}
HNO3+Nh5OH→Nh5NO3+h3O{\displaystyle {\mathsf {HNO_{3}+NH_{4}OH\rightarrow NH_{4}NO_{3}+H_{2}O}}} 2Ch4COOH+Ba(OH)2→Ba(Ch4COO)2+2h3O{\displaystyle {\mathsf {2CH_{3}COOH+Ba(OH)_{2}\rightarrow Ba(CH_{3}COO)_{2}+2H_{2}O}}}
2Ch4COOH+Ba(OH)2→Ba(Ch4COO)2+2h3O{\displaystyle {\mathsf {2CH_{3}COOH+Ba(OH)_{2}\rightarrow Ba(CH_{3}COO)_{2}+2H_{2}O}}}



 h3O+F2→HF+HOF{\displaystyle {\mathsf {H_{2}O+F_{2}\rightarrow HF+HOF}}}
h3O+F2→HF+HOF{\displaystyle {\mathsf {H_{2}O+F_{2}\rightarrow HF+HOF}}} (при низких температурах) 3h3O+2IF5→5HF+HIO3{\displaystyle {\mathsf {3H_{2}O+2IF_{5}\rightarrow 5HF+HIO_{3}}}}
(при низких температурах) 3h3O+2IF5→5HF+HIO3{\displaystyle {\mathsf {3H_{2}O+2IF_{5}\rightarrow 5HF+HIO_{3}}}} 9h3O+5BrF3→15HF+Br2+3HBrO3{\displaystyle {\mathsf {9H_{2}O+5BrF_{3}\rightarrow 15HF+Br_{2}+3HBrO_{3}}}}
9h3O+5BrF3→15HF+Br2+3HBrO3{\displaystyle {\mathsf {9H_{2}O+5BrF_{3}\rightarrow 15HF+Br_{2}+3HBrO_{3}}}}

 h3O+C⇄ CO+h3{\displaystyle {\mathsf {H_{2}O+C\rightleftarrows \ CO+H_{2}}}}
h3O+C⇄ CO+h3{\displaystyle {\mathsf {H_{2}O+C\rightleftarrows \ CO+H_{2}}}}
 в основном состоянии: (1a1)1(1b2)2(1b1)2(2b2)0(3a1)0.{\displaystyle (1a_{1})^{1}(1b_{2})^{2}(1b_{1})^{2}(2b_{2})^{0}(3a_{1})^{0}.}
в основном состоянии: (1a1)1(1b2)2(1b1)2(2b2)0(3a1)0.{\displaystyle (1a_{1})^{1}(1b_{2})^{2}(1b_{1})^{2}(2b_{2})^{0}(3a_{1})^{0}.} Молекула имеет замкнутую оболочку, неспаренных электронов нет. Заняты электронами четыре молекулярные орбитали (МО) — по два электрона на каждой МО ϕi{\displaystyle \phi _{i}}
Молекула имеет замкнутую оболочку, неспаренных электронов нет. Заняты электронами четыре молекулярные орбитали (МО) — по два электрона на каждой МО ϕi{\displaystyle \phi _{i}} , один со спином α{\displaystyle \alpha }
, один со спином α{\displaystyle \alpha } , другой со спином β{\displaystyle \beta }
, другой со спином β{\displaystyle \beta } , или 8 спин-орбиталей ψ{\displaystyle \psi }
, или 8 спин-орбиталей ψ{\displaystyle \psi } . Волновая функция молекулы, Ψ{\displaystyle \Psi }
. Волновая функция молекулы, Ψ{\displaystyle \Psi } , представленная единственным детерминантом Слэтера Ф, имеет вид
, представленная единственным детерминантом Слэтера Ф, имеет вид 




















