Содержание
Самая крутая молекула — MEL Chemistry
[Deposit Photos]
В XVIII веке Антуан Лавуазье пропустил через воду электрический ток и обнаружил в ее составе два газа: водород и кислород.
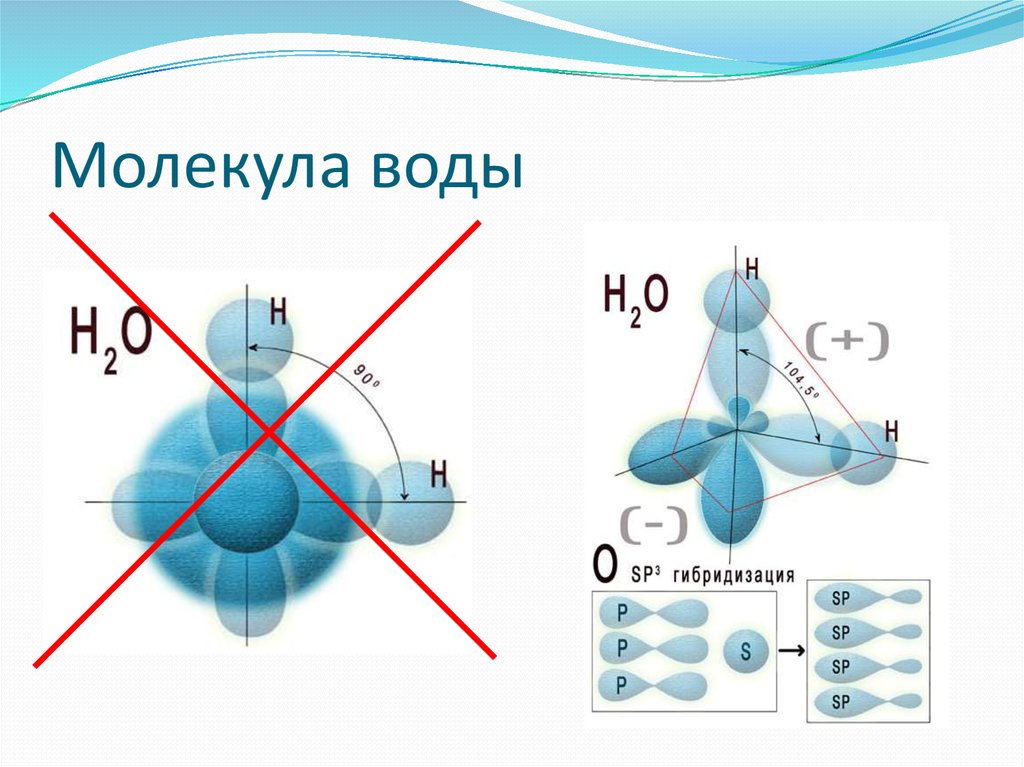
Формула молекулы воды — H₂O — два атома водорода и один атом кислорода. Помимо того, что эти атомы связаны в одну молекулу, их электрические заряды способствуют тому, что молекулы воды могут соединяться друг с другом, образуя водородные связи. Именно маленький размер атома водорода позволяет сильнополярным молекулам, в которых он присутствует, сближаться достаточно тесно для образования этих связей. Они не так сильны, как связи атомов внутри молекулы (ковалентные связи), но именно из-за них молекулы воды притягиваются друг к другу сильнее, чем молекулы многих прочих веществ.
Из-за водородных связей у воды очень высокая удельная теплоемкость. Это означает, что нужно довольно много энергии, чтобы нагреть воду. Судя по расположению кислорода в таблице Менделеева и температурам кипения гидридов (соединений с водородом) аналогичных кислороду элементов (серы, селена, теллура), вода без водородных связей кипела бы при −80 °С, а замерзала при −100 °С.
Это означает, что нужно довольно много энергии, чтобы нагреть воду. Судя по расположению кислорода в таблице Менделеева и температурам кипения гидридов (соединений с водородом) аналогичных кислороду элементов (серы, селена, теллура), вода без водородных связей кипела бы при −80 °С, а замерзала при −100 °С.
via GIPHY
Кипящая вода
Водородными связями объясняются капиллярные явления. Их можно наблюдать, например, когда краска поднимается между ворсинками кисточки. Молекулы воды притягивают друг друга настолько сильно, что преодолевают силу гравитации. Когда с листьев на деревьях испаряются молекулы воды, они по капиллярам внутри ствола подтягивают воду вверх от самых корней.
via GIPHY
Капля воды
Водородные же связи обеспечивают воде высокое поверхностное натяжение. Благодаря ему вода может собираться в капли, её можно налить в чашку «с горкой», а некоторые насекомые могут ходить по ней, как по суше. Незадолго до рождения в легких человека вырабатывается так называемое поверхностно-активное вещество (ПАВ). Это сложная субстанция из 6 липидов и 4 протеинов. Она помогает новорожденным начать дышать. Сила поверхностного натяжения настолько велика, что недоношенным младенцам с дефицитом ПАВ просто не хватает сил, чтобы раздуть легкие. К счастью, в наши дни поверхностно-активные вещества доступны в виде лекарств.
Незадолго до рождения в легких человека вырабатывается так называемое поверхностно-активное вещество (ПАВ). Это сложная субстанция из 6 липидов и 4 протеинов. Она помогает новорожденным начать дышать. Сила поверхностного натяжения настолько велика, что недоношенным младенцам с дефицитом ПАВ просто не хватает сил, чтобы раздуть легкие. К счастью, в наши дни поверхностно-активные вещества доступны в виде лекарств.
Универсальный растворитель
Наличие водородных связей делает воду универсальным растворителем. Она растворяет соли, сахара, кислоты, щелочи и даже некоторые газы (например, диоксид углерода, который шипит в газировке). Подобные вещества называются гидрофильными (любящими воду), именно потому что они легко растворяются в воде.
И наоборот, жиры и масла являются гидрофобными. Это означает, что их молекулы не способны образовывать водородные связи. Поэтому вода отталкивает такие молекулы, предпочитая образовывать связи внутри себя. Чтобы отмыть руки от жира, мы используем мыло, в молекулах которого есть и гидрофобные и гидрофильные части.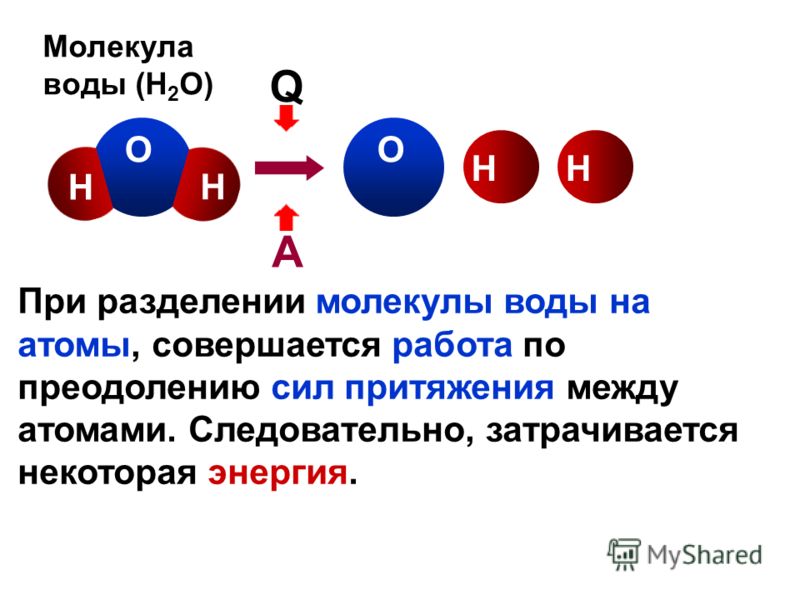 Гидрофобные цепляются к жиру, разбивая его на мелкие капельки. Гидрофильными же частями эта конструкция цепляется за поток воды и отправляется вместе с ним в канализацию.
Гидрофобные цепляются к жиру, разбивая его на мелкие капельки. Гидрофильными же частями эта конструкция цепляется за поток воды и отправляется вместе с ним в канализацию.
Масло не растворяется в воде
[Deposit Photos]
Двух одинаковых снежинок не бывает
Во-первых, на то, в какую форму заморозятся молекулы воды, влияют малейшие изменения температуры и влажности. А во-вторых, одна среднестатистическая снежинка содержит 10 квинтиллионов (10 и еще 18 нулей) молекул воды. И это дает некоторый простор для творчества.
Вода — одна из немногих субстанций, которые расширяются, когда переходят в твёрдое состояние. Обычно, замерзая, вещества уплотняются и становятся тяжелее жидких форм. Но ведь кубики водяного льда плавают в верхних слоях наших напитков! И, что более ценно для живых организмов, лед в водоемах образуется тоже сверху, не позволяя промерзнуть остальной воде.
Выстраиваясь при замерзании в упорядоченную решетку, молекулы воды занимают больше пространства, чем им требовалось в жидком состоянии. В результате лед на 9% менее плотный, чем жидкая вода.
Японский макак в воде
[Deposit Photos]
Вода невероятно подвижна. Она постоянно перемещается по всей Земле в цикле испарения, конденсации и осадков. Ее подвижность касается и живых организмов, в которых ее водородные и кислородные составляющие непрерывно объединяются и перестраиваются в ходе биохимических процессов.
Мы не только потребляем воду, но и производим ее. Каждый раз, когда в организме расщепляется молекула глюкозы, образуется 6 молекул воды. Эта реакция происходит в теле обычного человека 6 септиллионов (6 с 24 нолями) раз в сутки. Тем не менее, мы не можем таким способом покрыть свои потребности в воде.
com/embed/Z3NVDAamiuT4Y» frameborder=»0″ allowfullscreen=»»/>
via GIPHY
Разрушение ледника
Сколько у нас есть?
Вообще, воды во вселенной довольно много, и это вполне закономерно. Три самых распространённых элемента во вселенной — водород, гелий и кислород. Но поскольку гелий, в силу своей инертности, в химические реакции не вступает, соединение водорода и кислорода (то есть вода) встречается нередко. При этом, из всей воды на Земле получился бы шар диаметром около 1400 км. Это почти в 10 раз меньше диаметра самой Земли. Из этого объема только 3% — пресная вода. То есть на каждый стакан морской воды приходится чуть больше чайной ложки пресной. При этом 85% пресной воды на планете заключены в ледниках и полярных льдах. Рост населения, загрязнение водоемов и ряд других факторов делают всё более реальными опасения, что уже в XXI веке пресная вода может повсеместно стать дефицитом и стоить больше, чем бензин.
К счастью, сегодня у нас еще есть возможность поднять стаканы с водой за самую крутую молекулу.
via GIPHY
Стакан воды
Источник
Мембраны. Немного физики — «BASK»
Высокие технологии, изначально работающие в космосе или на сложном производстве, со временем становятся повседневными. Так мембранные материалы, несколько десятилетий назад родившиеся в научных лабораториях, теперь служат нам в одежде и обуви.
Мембрана – это барьер, который пропускает через себя одни вещества и останавливает другие. Впервые применить это свойство мембран в одежде догадались в фирме Gore в 70-годах прошлого века. Именно в это время стало технологически возможным создать прочную поровую мембрану на основе полимеров. Радиус пор подбирался так, чтобы они не пропускали капли воды из внешней среды и не создавали препятствия для выхода пара наружу.
Капля тумана – 0,1 мм (100000 нм)
Крупная капля дождя – 6,5 мм (6500000 нм)
Молекула воды – 0,2 нм
d пор в мембране = 140 — 200 нм
Зачем это нужно?
Простой полиэтиленовый плащ отлично защитит от дождя и ветра, но не спасёт от намокания. А всё потому, что одной из важнейших постоянных человеческого тела является температура. Она может колебаться в узких пределах. При любой активности мы вырабатываем тепло, излишки которого незамедлительно сбрасываются в окружающую среду. Одним из механизмов отвода тепла является потоотделение: ежесуточно человек выделяет не менее полулитра пота в нормальных условиях, при высоких нагрузках и температурах это значение достигает 12 литров.
А всё потому, что одной из важнейших постоянных человеческого тела является температура. Она может колебаться в узких пределах. При любой активности мы вырабатываем тепло, излишки которого незамедлительно сбрасываются в окружающую среду. Одним из механизмов отвода тепла является потоотделение: ежесуточно человек выделяет не менее полулитра пота в нормальных условиях, при высоких нагрузках и температурах это значение достигает 12 литров.
Но полиэтилен препятствует отводу паров воды и она конденсируется на его поверхности, опять превращаясь в воду – порочный круг замыкается, под плащом пасмурно и сыро, особенно если снаружи тепло и солнечно.
Как работают поровые мембраны?
Поровая мембрана позволяет избежать «застоя» паров воды под одеждой.
Водяной пар – газообразное состояние той же воды, что падает на нас снаружи в жидком состоянии в виде капель.
Расстояние между молекулами воды в паре так велико, что каждая молекула выступает как отдельный «игрок»: поровая мембрана для неё не является серьёзным препятствием и молекула свободно выходит наружу. Движение пара в поровой мембране можно описать как поток через отверстия.
Движение пара в поровой мембране можно описать как поток через отверстия.
В капле те же молекулы воды связаны силой поверхностного натяжения, они живут плотными сообществами. Такой конгломерат не может разом пройти сквозь пору пока не растечётся по поверхности монослоем в размер молекулы. В этот момент мембрана начинает пропускать воду. Чтобы предотвратить такой ход событий на поверхность мембраны наносят специальное гидрофобное покрытие с плохой смачиваемостью – DWR. С этим покрытием молекулы воды не могут прореагировать и капля не растекаясь скатывается с поверхности. Да и сама пористая мембрана производится из гидрофобных полимеров, например, политетрафторэтилена, чтобы у молекул пара не было возможности остаться на стенке поры по пути наружу.
Политетрафторэтилен (ПТФЭ) – превосходит по химической стойкости все полимеры: не смачивается водой и не растворяется в обычных растворителях. Полимер с самой большой молекулярной массой.
Почему молекулы пара начинают целенаправленно двигаться наружу? Кто их подталкивает?
Всё мире стремится к равновесию, по крайне мере, так говорит физика. Любое движение обусловлено избытком энергии/вещества в одном месте и недостатком в другом. Когда парциальное давление водяного пара под мембраной (под курткой) превышает его парциальное давление во внешней среде, молекулы воды начинают двигаться сквозь мембрану наружу. Процесс останавливается когда давление пара внутри и снаружи выравнивается.
Любое движение обусловлено избытком энергии/вещества в одном месте и недостатком в другом. Когда парциальное давление водяного пара под мембраной (под курткой) превышает его парциальное давление во внешней среде, молекулы воды начинают двигаться сквозь мембрану наружу. Процесс останавливается когда давление пара внутри и снаружи выравнивается.
Значит, если снаружи влажно, то отвод водяного пара прекращается и мы промокаем? Да, но только в случае, когда температуры под курткой и снаружи близки по значениям. Если стоит холодная влажная погода, то отвод водяного пара будет продолжаться даже в таких условиях, так как парциальное давление зависит от температуры и разница в давлениях сохранится.
Особенности поровых мембран
Рабочие характеристики поровой мембраны в первую очередь определяются количеством пор, их размером, распределением по поверхности и толщиной мембраны, а не химическими свойствами материала из которого она изготовлена. Со временем на поверхности мембраны появляются грязевые отложения, они сильно снижают её качество, закупоривая поры и меняя свойства. Неправильно подобранное моющее средство, например порошок, так же забивает поры. Поэтому уход за поровыми мембранами требует особого внимания и осторожности. А поддержание гидрофобности внешней ткани – пропитка, основой правильной работы этого сложного механизма.
Неправильно подобранное моющее средство, например порошок, так же забивает поры. Поэтому уход за поровыми мембранами требует особого внимания и осторожности. А поддержание гидрофобности внешней ткани – пропитка, основой правильной работы этого сложного механизма.
Непоровые мембраны. Зачем нужны они?
Непоровые мембраны – отдельный класс мембран, работа которых основана на совершенно иных физических процессах. Как следует из названия, в них нет пор, однако материал мембраны имеет неравномерную структуру, причина которой свободный объём между большими молекулами полимера. Этот объём достаточен для движения небольших молекул воды по мембране – диффузии. Молекулярный размер этих полостей не сравним с размерами пор.
Водяной пар химически связывается с гидрофильной внутренней поверхностью мембраны. В случае интенсивной работы с повышенным потоотделением влага конденсируется на ней. Материал мембраны, обычно полиуретан, начинает набухать, впитывая в себя молекулы воды. Все молекулы под действием температуры начинают двигаться быстрее: гибкий, за счёт влаги, полимер расширяется, пространство между цепочками увеличивается и диффузия молекул воды ускоряется. Она происходит до тех пор, пока концентрация молекул воды в мембране не станет одинаковой по всей толщине мембраны. Основными движущими силами процессов в непоровой мембране являются: разница концентрации молекул воды в ней и разница температур с двух сторон от мембраны. Движение направлено из области с высокой концентрацией воды в область с низкой концентрацией воды. Молекулы, проходящие через свободные полости в мембране, достигают наружней поверхности и уходят в окружающую среду.
Она происходит до тех пор, пока концентрация молекул воды в мембране не станет одинаковой по всей толщине мембраны. Основными движущими силами процессов в непоровой мембране являются: разница концентрации молекул воды в ней и разница температур с двух сторон от мембраны. Движение направлено из области с высокой концентрацией воды в область с низкой концентрацией воды. Молекулы, проходящие через свободные полости в мембране, достигают наружней поверхности и уходят в окружающую среду.
Внешняя поверхность непоровой мембраны всегда защищена гидрофобной тканью с плотным плетением, которая не пропускает капли воды снаружи и не препятствует отводу пара.
Полиуретан – прочный, устойчивый к старению, эластичный материал. Гидрофилен. Плёнки из полиуретана легко наносятся на поверхности любой конфигурации. Обладает относительно низкой молекулярной массой.
Непоровая мембрана меньше загрязняется, так как в ней нет пор и нечему забиваться. Эластичность этого полимера даёт возможность производить тянущиеся ткани на его основе
И здесь не обошлось без слабых мест
Тесты показывают, что поровые мембраны более устойчивы к образованию конденсата на внутренней поверхности и лучше работают в условиях повышенной влажности – JIS L 1099 A1.
Проблемным местом непоровой мембраны нужно назвать ограничение её работы при низких температурах. Влага на внутренней поверхности мембраны превращается в изморозь, это затрудняет отведение пара и причиняет дискомфорт. В случае с поровой мембраной изморозь не во всех случаях образуется на внутренней стороне мембраны, так как точка росы может оказаться в другом месте за счёт интенсивного потока пара через мембрану.
Непоровая мембрана начинает работать с небольшой задержкой: ей требуется время на набухание (намокание), чтобы выйти на максимальные рабочие показатели. Тесты показывают, что эффективность непоровой мембраны возрастает с ростом абсолютной влажности под одеждой, поровые мембраны мало зависят от этого параметра. В условиях активной работы при невысокой влажности окружающего воздуха, хорошие непоровые мембраны обходят поровые по паропроницаемости – JIS L 1099 B1.
Из-за гидрофильности самой мембраны её водостойкость ниже, чем у полностью гидрофобной пористой. Когда верхний защитный слой ткани с непоровой мембраной начинает пропускать влагу, она мгновенно проникает внутрь.
Комбинированные мембраны
Хорошие результаты часто получают на стыке методов. В последнее время всё больше интереса вызывают комбинированные мембраны, которые включают поровую мембрану у наружнего слоя и тонкую непориовую со стороны тела. Таким образом производители защищают пористую мембрану от загрязнений тела и увеличивают показатели паропроницаемости.
Так же интересен опыт создания поровой мембраны из волокон полиуретана, реализованный в тканях Polartec® NeoShell®.
Характеристики мембран
Влагостойкость
Паропроницаемость (A1, B1)
Ret
Подробнее читайте в статье
Поровые мембраны в снаряжении Баск:
Polartec® Neoshell
Advance® Alaska
Advance® Perfomance
Advance® 2.5L
Непоровые мембраны в снаряжении Баск:
Gelanots®
Dermizax® 3L
Читать так же:
Разумно о мембранах
Из чего делают мембраны?
Мембраны: «Взгляд изнутри» – как это устроено и работает
Методы определения паропроницаемости и Ret мембраны
Информация для учителей
Молекула воды состоит из водорода и кислорода в соотношении два объема водорода на каждый объем кислорода, с молекулярной формулой H 2 O и молекулярным диаметром около 2,75 ангстрем.
Молекулы воды (H 2 O) симметричны (точечная группа C 2V ), с двумя зеркальными плоскостями симметрии и двойной осью вращения. Атомы водорода состоят из ядра с одним протоном и окружены одним электроном. Центральный атом молекулы, атом кислорода, имеет ядро с восемью протонами и восемью нейтронами, окруженное восемью электронами. Ядро водорода связано с центральным атомом кислорода одинарной полярной ковалентной связью, в которой пара электронов является общей. Каждая связь OH воды состоит из молекулярной орбитали (в соответствии с теорией молекулярной орбитали), образованной из одной из 2p орбитали атома кислорода и 1s орбитали атома водорода.
Изображение извлечено из:
http://www.lsbu.ac.uk/water/h3oorb.html
Водяной пар |
Вода в газовой фазе состоит из изолированных молекул H 2 O. Каждая молекула изогнута с валентным углом 105 град. Отрицательный заряд сосредоточен вокруг атома кислорода. Протоны имеют частичный положительный заряд. Карта электронной плотности (вверху справа) показывает, что плотность электронов вокруг кислорода примерно в 10 раз выше, чем вокруг атомов водорода.
Каждая молекула изогнута с валентным углом 105 град. Отрицательный заряд сосредоточен вокруг атома кислорода. Протоны имеют частичный положительный заряд. Карта электронной плотности (вверху справа) показывает, что плотность электронов вокруг кислорода примерно в 10 раз выше, чем вокруг атомов водорода.
| Водяной пар можно идентифицировать и количественно определить по его ИК-спектру и по его микроволновому спектру. Водяной пар концентрируется близко к поверхности Земли в тропосфере. На этом изображении водяной пар в верхних слоях тропосферы и стратосфере в течение летнего сезона 2004 года. Он был получен с помощью прибора Microwave Limb Sounder (MLS) на спутнике NASA Aura. MLS может одновременно измерять несколько газовых примесей и химических веществ, разрушающих озон, в верхних слоях атмосферы. |
Молекула воды может колебаться разными способами. В газообразном состоянии колебания включают комбинации симметричного растяжения (v 1 ), асимметричного растяжения (v 3 ) и изгиба (v 2 ) ковалентных связей с интенсивностью поглощения (H 2 16 О) v 1 = 0,07; v 2 = 1,47; v 3 = 1,00. Дипольные моменты изменяются в направлении движения атомов кислорода. Поскольку атомы водорода легкие, колебания имеют большие амплитуды.
Дипольные моменты изменяются в направлении движения атомов кислорода. Поскольку атомы водорода легкие, колебания имеют большие амплитуды.
Изображение взято из:
http://www.lsbu.ac.uk/water/vibrat.html
Лед
В отличие от водяного пара, в твердой фазе атомы кислорода в воде находятся в тетраэдре атомов водорода.
Справа представлена диаграмма, показывающая положение атомов кислорода воды в кубической плотноупакованной решетке.
В центре линий, соединяющих каждый атом кислорода с другим, находится атом водорода.
Связи внутри ледяной структуры жесткие.
Жидкая вода
Но, несмотря на свою распространенность и важность, жидкая вода не так хорошо изучена в других фазах.
В недавнем исследовании Нильссон и его коллеги исследовали структуру жидкой воды с помощью рентгеновской эмиссионной спектроскопии и рентгеновской абсорбционной спектроскопии. Эти методы используют рентгеновские лучи, генерируемые синхротронным источником света, для возбуждения электронов внутри единственного атома кислорода молекулы воды. Настройка рентгеновских лучей на определенный диапазон энергий может точно определить местоположение и расположение молекул воды.
Эти методы используют рентгеновские лучи, генерируемые синхротронным источником света, для возбуждения электронов внутри единственного атома кислорода молекулы воды. Настройка рентгеновских лучей на определенный диапазон энергий может точно определить местоположение и расположение молекул воды.
Исследователи обнаружили, что вода в основном состоит из тетраэдрических групп, как и лед, но есть и менее определенная структура, похожая на искаженную, связанную водородом форму водяного пара.
Атомы кислорода в искаженных молекулах воды имеют 2 сильные связи с водородом и 2 слабые. Кислород в тетраэдрической льдоподобной воде имеет 4 эквивалентные связи с водородом.
Даже в своей тетраэдрической форме жидкая вода отличается от льда тем, что связи постоянно разрываются, молекулы воды движутся и образуются новые связи.
Плотность воды выше, чем у льда из-за того, что молекулы воды удерживаются в отверстиях кубической плотноупакованной решетки.
Молекулярные орбитали H 2 O(g)
В этом разделе мы сравним связь в двух родственных газообразных молекулах: воде и озоне. Наш первый шаг — построить структуру Льюиса для каждой из этих молекул.
Наш первый шаг — построить структуру Льюиса для каждой из этих молекул.
ВСЕПР дает нам структуру.
Каждая молекула имеет ось C 2 и 2 вертикальные плоскости. Это помещает их в группу очков C 2v .
Сначала рассмотрим сигма-соединение.
- Для воды нам нужно сделать 2 групповые орбитали из 1s-орбиталей атома водорода.
- Для озона мы делаем 2-групповые орбитали из концевых кислородных 2s-орбиталей.
- В каждом случае одна орбиталь будет иметь 0 узлов, а другая, более высокая энергия, будет иметь 1 узел.
Обратите внимание, что орбиталь с более низкой энергией (группа 1) трансформируется как A 1 в группу C 2v , а орбиталь с более высокой энергией (группа 2) трансформируется как B 2 . С какими орбиталями кислорода это будет взаимодействовать? Посмотрим на симметрию.
Из симметрии мы видим, что
- и 2p z , и 2s-орбитали центрального кислорода будут взаимодействовать с группой 1 (A 1 )
- 2п y орбиталь будет взаимодействовать с группой 2 (B 2 )
- 2p x не имеет правильной симметрии для сигма-связи
Давайте объединим орбитали симметрии 2 A 1 на центральном кислороде (2s и 2p z ) с групповой орбиталью с такой симметрией.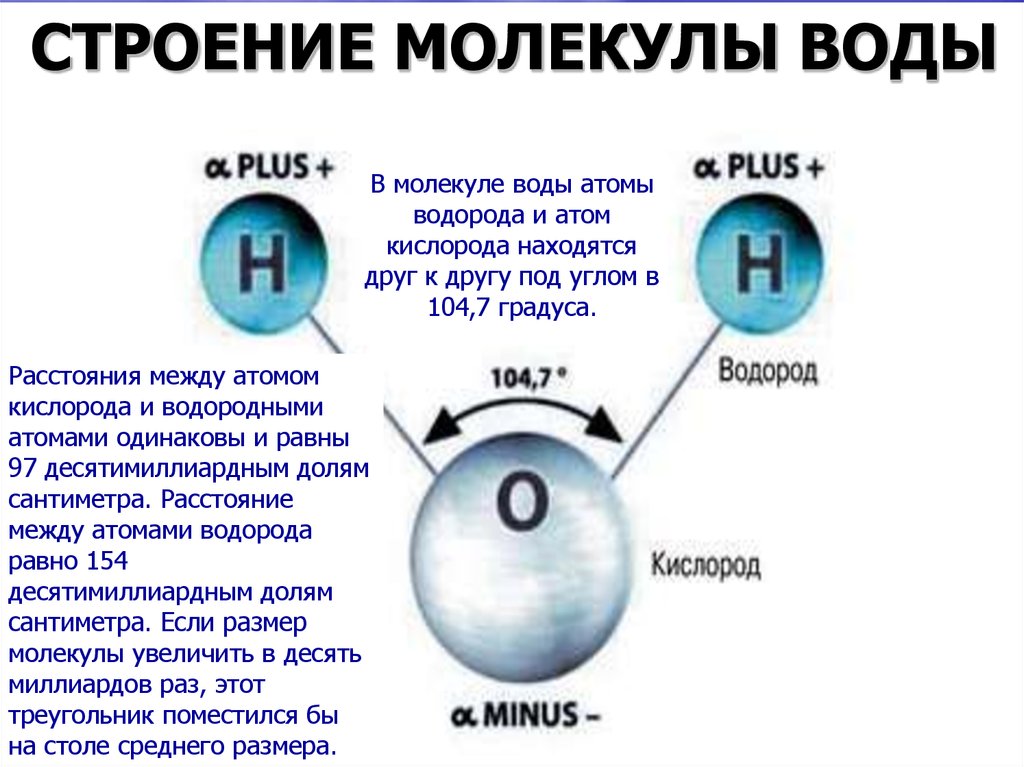 Объединение 3 орбиталей должно дать нам 3 молекулярные орбитали: 1, 2 и 3.
Объединение 3 орбиталей должно дать нам 3 молекулярные орбитали: 1, 2 и 3.
Теперь мы можем объединить орбитали с симметрией B 2 : 2p y на центральном кислороде с групповой орбиталью 2. Объединение 2 орбиталей даст нам 2 молекулярные орбитали.
В воде на кислороде остается 2p x орбиталь, которая не может соединяться ни с какой другой орбиталью. Это становится несвязывающей молекулярной орбиталью. Мы получаем в общей сложности 6 молекулярных орбиталей.
- Две нижние орбитали сильно связаны.
- Две верхние орбитали являются сильно разрыхляющими.
- Средние две орбитали почти не связаны. Они могут быть представлены неподеленными парами кислорода в структуре воды Льюиса.
Что насчет озона? Орбиталь 2p x на центральном кислороде имеет правильную симметрию для объединения с групповой орбиталью, состоящей из орбиталей 2p x на двух концевых атомах кислорода.
Эти две орбитали могут объединяться, образуя две молекулярные орбитали пи-симметрии. Остальные орбитали на концевых атомах кислорода (O 1 (2p y ), O 1 (2p z , O 3 (2p y )) и O 3 (2p z ) не склеиваются.
Алмазная решетка конденсированного H
2 O
Структуры как жидкой воды, так и твердой воды основаны на алмазной решетке. Сначала мы должны рассмотреть более простую структуру, кубическую замкнутую структуру.
В массиве ccp атомы кислорода воды упаковываются как можно плотнее, чтобы минимизировать пустое пространство. Плотноупакованные структуры начинаются с гексагонально упакованного слоя. Представьте, что каждый атом окружен 6 другими атомами кислорода.
В любом плотно упакованном массиве атомов или ионов есть как октаэдрические, так и тетраэдрические отверстия, в которых могут находиться более мелкие атомы или ионы.
На этом рисунке показаны три слоя атомов или ионов. Посмотрите на первый слой. Есть отверстия, окруженные 3 из этих анионов.
Добавляем второй слой (красный) так, чтобы каждый атом или ион помещался в углубление в слое под ним. Некоторые дырки в первом слое закрыты другим атомом или ионом во втором слое. Это четырехгранные отверстия. Другие отверстия не закрываются таким образом. Атом или ион большего размера мог бы поместиться в эти октаэдрические отверстия, окруженные тремя анионами из одного слоя и тремя из другого слоя.
Третий слой покрывает эти октаэдрические отверстия в слое ABC кубической плотноупакованной структуры (ccp).
Наименьшей повторяющейся единицей регулярной трехмерной структуры является элементарная ячейка. Справа внизу находится простой куб, разделенный на 8 меньших кубов. Если бы атомы кислорода занимали вершины большого куба и были центрированы на каждой грани, они были бы в элементарной ячейке кубического плотноупакованного массива.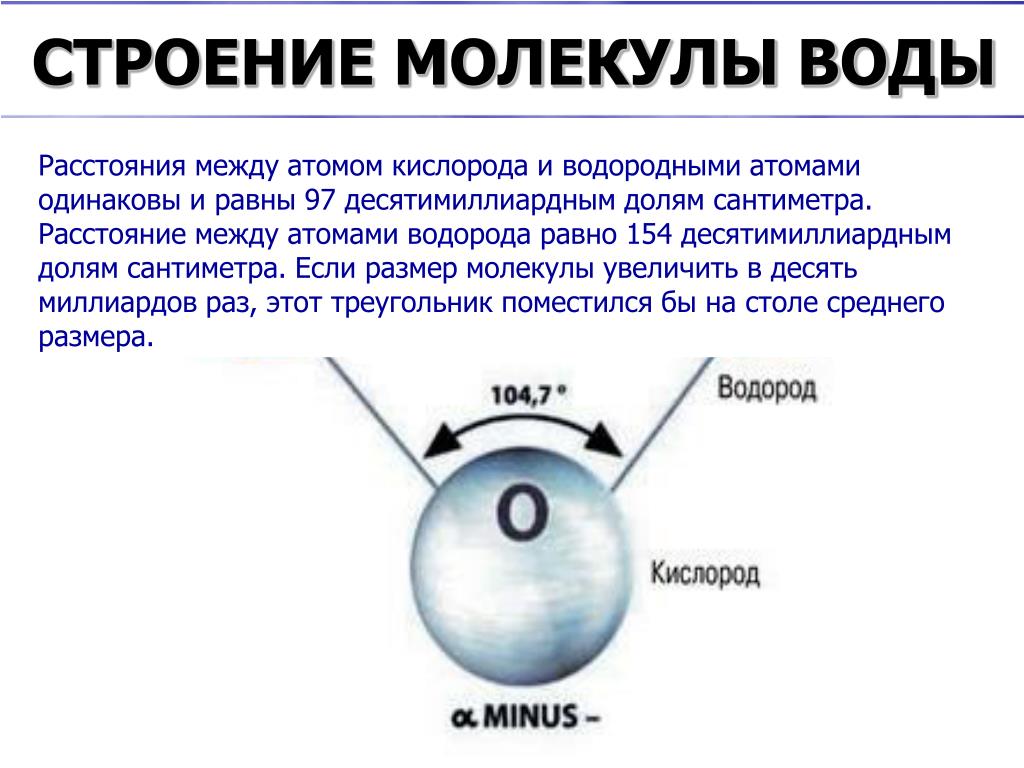 Этот тип упаковки также называют гранецентрированной кубической.
Этот тип упаковки также называют гранецентрированной кубической.
Во льду атомы кислорода также занимают центры 4 из 8 меньших кубов. Линии, которые соединяют каждый внутренний атом кислорода с вершинным кислородом и тремя атомами кислорода на гранях большого куба, на самом деле являются мостиками атомов водорода: единицами O-H-O.
Каждый атом кислорода находится в тетраэдре атомов водорода.
Насколько мала молекула воды?
от Mark
Молекула воды крупным планом
Итак, насколько велика одна молекула воды? Быстрый ответ:
Диаметр молекулы воды (H 2 O) точно рассчитан и составляет около 0,000282 мкм (микрометры – миллионные доли метра) в диаметре.
Вы можете произнести это число (0,000282 мкм) как: «Двести восемьдесят две миллионные доли микрометра».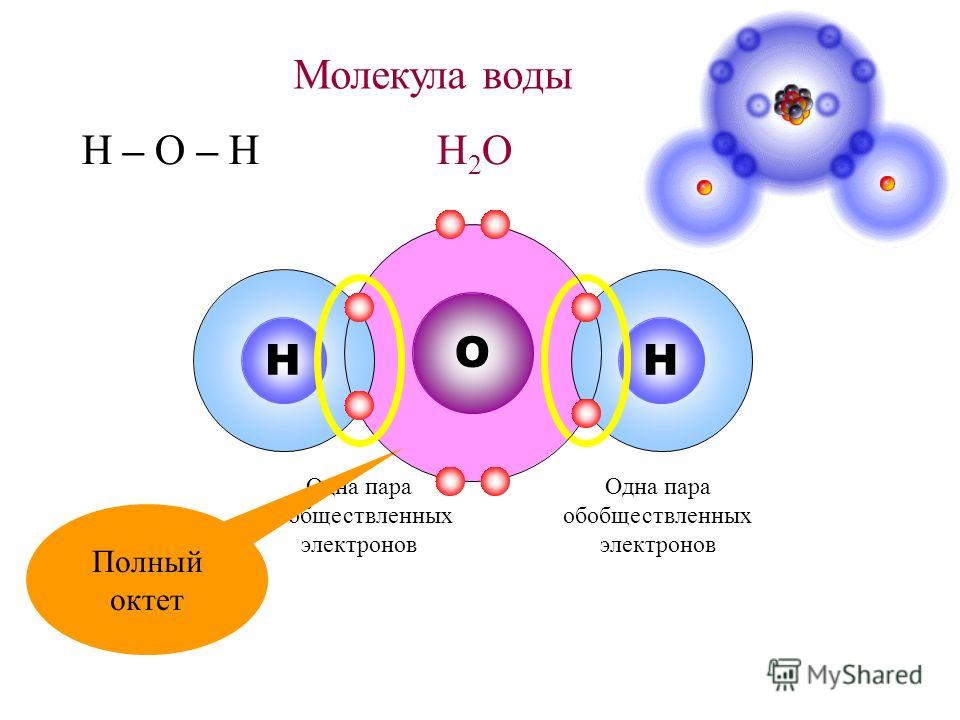
Или вы можете передвинуть запятую на три знака (0,282 нм) и сказать: «Двести, восемьдесят две тысячных нанометра ».
Или вы можете переместить десятичный знак еще на три знака, чтобы число стало целым (282,0 пм), и сказать:
«двести восемьдесят два пикометра » или (282 триллионных доли метра).
Let’s Recap
0,000282 мкм (микрометры — миллионы метра) ,
0,282 нм (Nanometers — миллиард. Из меттера) 929522. 292929. 2. 95292952. 2929292952. 2. 2. 2. 2. 2. 2. 2. 2. 2. 2. . метр).
Вот это мало!
Молекула воды странной формы
Модель заполнения пространства молекулой воды. Базовая геометрическая структура молекулы воды.
При описании размера молекулы воды имейте в виду, что форма отдельной молекулы воды не является идеальной сферой. Атом кислорода окружен с обеих сторон двумя атомами водорода под углом около 104,45 градусов.
Атом кислорода окружен с обеих сторон двумя атомами водорода под углом около 104,45 градусов.
Расстояние от центра атома кислорода до центра одного из атомов водорода составляет примерно 95,84 пм (пикометры – триллионные доли метра), что равно 0,0000958 мкм (микрометры – миллионные доли метра).
В 1967 году термин «микрон» был официально объявлен устаревшим и больше не использовался как синоним термина «микрометр». Международная система единиц (СИ) отменила этот термин, потому что он мог бы создать путаницу, если бы его сочетали с термином «микро», означающим миллионные доли единицы. Сегодня термин «микрометр» и символ μ приняты на международном уровне в качестве официального термина для миллионных долей метра. Источник: Википедия: Микрометр
Знакомство с метрическими префиксами для измерения мелких предметов
Все эти важные префиксы относятся к метру (метр — британское написание):
милли — миллиметр (мм) — одна тысячная доля метра — 0,001 метра (10 -3 )
микро – микрометр (мкм) одна миллионная часть метра – 0,000 001 метра (10 -6 )
нано – нанометр (нм) это одна миллиардная часть метра – 0,000 000 001 метр (10 -9 )
пико – пикометр (pm) одна триллионная метра – 0,000 000 000 001 метр (10 -12 )
Преобразование метрической системы в старую имперскую систему
Старая имперская система, в которой все измеряется в футах, дюймах и фунтах, к сожалению, все еще широко используется в Соединенных Штатах. Если вы не ученый, инженер или врач, вы, вероятно, лучше всего знакомы со старой имперской системой. Давайте поймем размер молекулы воды в дюймах.
Если вы не ученый, инженер или врач, вы, вероятно, лучше всего знакомы со старой имперской системой. Давайте поймем размер молекулы воды в дюймах.
1 метр равен 39,36996 дюйма (1,09361 ярда).
Размер одной молекулы воды в метрических единицах составляет 282 пм (двести восемьдесят два пикометра).
282 x 10 -12 => (0,000 000 000 282) умножить на 39,36996 дюйма = 11,102 -9 дюйма (0,000000011102 дюйма).
Вы можете произнести это число как «одиннадцать целых сто две миллиардные доли дюйма». Это размер одной молекулы воды (H 2 O) в дюймах.
Я уже говорил маленький!?
Примечание: См. таблицу ниже, где находится молекула воды ( H 2 O ). Молекулы CL 2 — это хлор , а C 6 H 6 — бензол , оба токсичные соединения. Как видите, эти молекулы немного больше молекулы воды.
Все больше и больше людей устанавливают домашние системы обратного осмоса для воды под кухонными раковинами, которые очищают питьевую воду от этих и других вредных химических веществ.