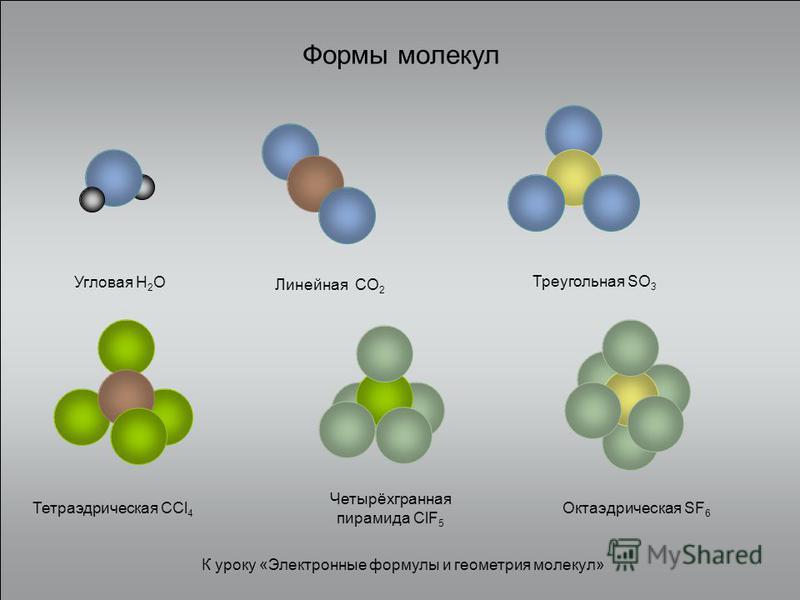
Содержание
Алканы, химические свойства, получение, номенклатура
1
H
ВодородВодород
1,008
1s1
2,2
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
ГелийГелий
4,0026
1s2
Бесцветный газ
t°кип=-269°C
3
Li
ЛитийЛитий
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
БериллийБериллий
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
БорБор
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
УглеродУглерод
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
t°кип=4830°C
7
N
АзотАзот
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
КислородКислород
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
ФторФтор
18,998
2s2 2p5
4,0
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
НеонНеон
20,180
2s2 2p6
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
НатрийНатрий
22,990
3s1
0,93
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
МагнийМагний
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
АлюминийАлюминий
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
КремнийКремний
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
ФосфорФосфор
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
СераСера
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
ХлорХлор
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
АргонАргон
39,948
3s2 3p6
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
19
K
КалийКалий
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
КальцийКальций
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
СкандийСкандий
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
ТитанТитан
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип=3260°C
23
V
ВанадийВанадий
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
ХромХром
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
МарганецМарганец
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
ЖелезоЖелезо
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
КобальтКобальт
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
НикельНикель
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
МедьМедь
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
ЦинкЦинк
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
t°кип=907°C
31
Ga
ГаллийГаллий
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
ГерманийГерманий
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
МышьякМышьяк
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
СеленСелен
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°пл=217°C
t°кип=685°C
35
Br
БромБром
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
КриптонКриптон
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
РубидийРубидий
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
СтронцийСтронций
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
ИттрийИттрий
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
ЦирконийЦирконий
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
НиобийНиобий
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
МолибденМолибден
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
ТехнецийТехнеций
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
РутенийРутений
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
РодийРодий
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
ПалладийПалладий
106,42
4d10
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
СереброСеребро
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
КадмийКадмий
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
ИндийИндий
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
ОловоОлово
118,71
5s2 5p2
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
СурьмаСурьма
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
ТеллурТеллур
127,60
5s2 5p4
2,1
Серебристый блестящий полуметалл
t°пл=450°C
t°кип=990°C
53
I
ИодИод
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
КсенонКсенон
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
ЦезийЦезий
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
БарийБарий
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
ЛантанЛантан
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
ЦерийЦерий
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
ПразеодимПразеодим
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
НеодимНеодим
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
ПрометийПрометий
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
СамарийСамарий
150,36
f-элемент
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
ЕвропийЕвропий
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
ГадолинийГадолиний
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
ТербийТербий
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
ДиспрозийДиспрозий
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
ГольмийГольмий
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
ЭрбийЭрбий
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
ТулийТулий
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
ИттербийИттербий
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
ЛютецийЛютеций
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
ГафнийГафний
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
ТанталТантал
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
ВольфрамВольфрам
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
РенийРений
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
ОсмийОсмий
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
ИридийИридий
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
ПлатинаПлатина
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
ЗолотоЗолото
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
РтутьРтуть
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
ТаллийТаллий
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
СвинецСвинец
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
ВисмутВисмут
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
ПолонийПолоний
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
АстатАстат
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
РадонРадон
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
ФранцийФранций
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
РадийРадий
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
АктинийАктиний
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
ТорийТорий
232,04
f-элемент
Серый мягкий металл
91
Pa
ПротактинийПротактиний
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
УранУран
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
НептунийНептуний
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
ПлутонийПлутоний
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
АмерицийАмериций
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
КюрийКюрий
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
БерклийБерклий
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
КалифорнийКалифорний
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
ЭйнштейнийЭйнштейний
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
ФермийФермий
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
МенделевийМенделевий
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
НобелийНобелий
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
ЛоуренсийЛоуренсий
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
РезерфордийРезерфордий
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
ДубнийДубний
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
СиборгийСиборгий
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
БорийБорий
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
ХассийХассий
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
МейтнерийМейтнерий
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
ДармштадтийДармштадтий
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
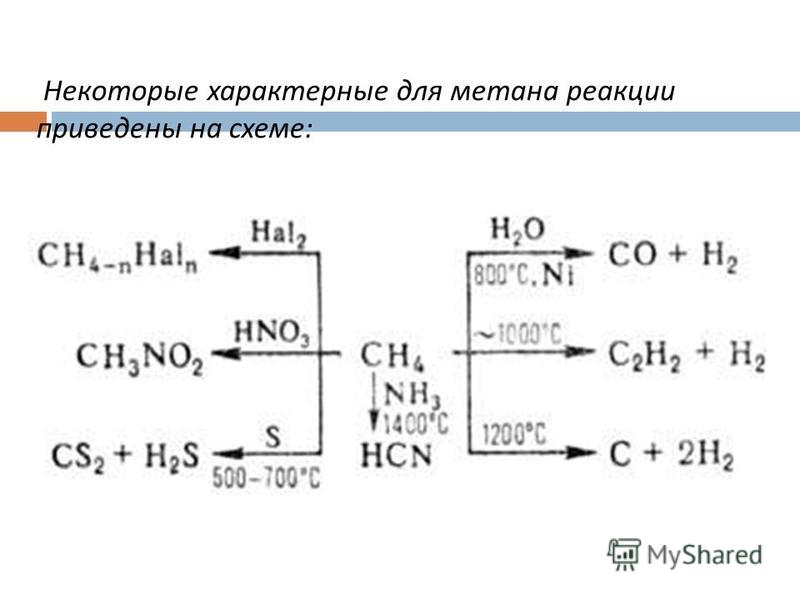
ICSC 0291 — МЕТАН
ICSC 0291 — МЕТАН
« back to the search result list(ru)
Chinese — ZHEnglish — ENFinnish — FIFrench — FRGerman — DEHebrew — HEHungarian — HUItalian — ITJapanese — JAKorean — KOPersian — FAPolish — PLPortuguese — PTRussian — RUSpanish — ES
| МЕТАН | ICSC: 0291 (Февраль 2000) |
| CAS #: 74-82-8 |
| UN #: 1971 |
| EINECS #: 200-812-7 |
| ОСОБЫЕ ОПАСНОСТИ | ПРОФИЛАКТИЧЕСКИЕ МЕРЫ | ТУШЕНИЕ ПОЖАРА | |
|---|---|---|---|
| ПОЖАР И ВЗРЫВ | Чрезвычайно легковоспламеняющееся. Смеси газа с воздухом взрывоопасны. Смеси газа с воздухом взрывоопасны. | НЕ использовать открытый огонь, НЕ допускать образование искр, НЕ КУРИТЬ. Замкнутая система, вентиляция, взрывозащищенное электрическое оборудование и освещение. Использовать ручной инструмент, не образующий искры. | Перекрыть поступление; если невозможно и нет риска для окружения, дать огню прогореть. В других случаях тушить распыленной водой, порошком, двуокисью углерода. В случае пожара: охлаждать баллон распыляя воду. Бороться с огнем из укрытия. |
| СИМПТОМЫ | ПРОФИЛАКТИЧЕСКИЕ МЕРЫ | ПЕРВАЯ ПОМОЩЬ | |
|---|---|---|---|
| Вдыхание | Удушье. См. примечания. | Применять вентиляцию. Применять средства защиты органов дыхания. | Свежий воздух, покой. Может потребоваться искусственное дыхание. Обратиться за медицинской помощью. Обратиться за медицинской помощью. |
| Кожа | ПРИ КОНТАКТЕ С ЖИДКОСТЬЮ: ОБМОРОЖЕНИЕ. | Перчатки для защиты от холода. | ПРИ ОБМОРОЖЕНИИ: промыть большим количеством воды, НЕ удалять одежду. обратиться за медицинской помощью . |
| Глаза | ПРИ КОНТАКТЕ С ЖИДКОСТЬЮ: ОБМОРОЖЕНИЕ. | Использовать защитные очки. | Прежде всего промыть большим количеством воды в течение нескольких минут (снять контактные линзы, если это возможно сделать без затруднений), затем обратится за медицинской помощью. |
| Проглатывание | |||
| ЛИКВИДАЦИЯ УТЕЧЕК | КЛАССИФИКАЦИЯ И МАРКИРОВКА |
|---|---|
Покинуть опасную зону! Индивидуальная защита: автономный дыхательный аппарат. Проконсультироваться со специалистом! Вентилировать. Удалить все источники воспламенения. НИКОГДА не направлять струю воды на жидкость. Проконсультироваться со специалистом! Вентилировать. Удалить все источники воспламенения. НИКОГДА не направлять струю воды на жидкость. |
Согласно критериям СГС ООН
Транспортировка |
| ХРАНЕНИЕ | |
| Обеспечить огнестойкость. Прохладное место. Вентиляция вдоль пола и потолка. | |
| УПАКОВКА | |
| МЕТАН | ICSC: 0291 |
| ФИЗИЧЕСКИЕ И ХИМИЧЕСКИЕ СВОЙСТВА | |
|---|---|
|
Агрегатное Состояние; Внешний Вид
Физические опасности
Химические опасности
|
Формула: CH4 |
| ВОЗДЕЙСТВИЕ НА ОРГАНИЗМ И ЭФФЕКТЫ ОТ ВОЗДЕЙСТВИЯ | |
|---|---|
|
Пути воздействия
Эффекты от кратковременного воздействия
|
Риск вдыхания
Эффекты от длительного или повторяющегося воздействия
|
| Предельно-допустимые концентрации |
|---|
|
|
| ОКРУЖАЮЩАЯ СРЕДА |
|---|
| ПРИМЕЧАНИЯ |
|---|
| Density of the liquid at boiling point: 0.42 kg/l. Высокие концентрации в воздухе вызывают дефицит кислорода с риском потери сознания или смерти. Проверьте содержание кислорода перед тем, как войти.  Поверните протекающий цилиндр местом протечки вверх, чтобы предотвратить утечку газа в жидком состоянии. After use for welding, turn valve off; regularly check tubing, etc., and test for leaks with soap and water. The measures mentioned in section PREVENTION are applicable to production, filling of cylinders, and storage of the gas. Other UN number: 1972 (refridgerated liquid), Hazard class: 2.1. |
| ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ |
|---|
|
Классификация ЕС Символ: F+; R: 12; S: (2)-9-16-33 |
| (ru) | Ни МОТ, ни ВОЗ, ни Европейский Союз не несут ответственности за качество и точность перевода или за возможное использование данной информации. © Версия на русском языке, 2018 |
Метан в подземных водах
Метан в подземных водах
Перейти к основному содержанию
Любой человек в возрасте 6 месяцев и старше имеет право на получение вакцины против COVID-19. Найдите ближайший пункт вакцинации на веб-сайте вакцин.
Найдите ближайший пункт вакцинации на веб-сайте вакцин.
Скачать PDF здесь
Метан (CH 4 ) представляет собой бесцветный легковоспламеняющийся газ без запаха, используемый в качестве топлива для отопления домов. Метан образуется в природе в результате распада органических веществ и в процессе пищеварения различных организмов. Повышенный уровень метана естественным образом можно обнаружить в подземных водах в некоторых районах штата Иллинойс. Метан в подземных водах также может быть результатом загрязнения, вызванного утечками из подземных хранилищ метана или свалок. Повышенный уровень метана, попадающего в здание, может снизить уровень кислорода и создать опасность пожара или взрыва.
Как я могу подвергнуться воздействию метана?
Метан, также называемый «природным газом», доставляется по трубопроводам по всему Иллинойсу в дома в качестве топлива для отопления и приготовления пищи. Поскольку он не имеет запаха, химическое вещество с запахом тухлых яиц добавляется в небольших количествах, чтобы жильцы могли обнаружить утечку. Если вы почувствуете этот запах и услышите шипящий звук выпускаемого газа, немедленно покиньте помещение и обратитесь в газовую компанию.
Если вы почувствуете этот запах и услышите шипящий звук выпускаемого газа, немедленно покиньте помещение и обратитесь в газовую компанию.
Природный метан и утечки из подземных хранилищ не имеют запаха тухлых яиц. Метан, который попал в грунтовые воды и попал в дом растворенным в колодезной воде, может быть заметен в виде пузырьков в воде. Растворенный метан легко покидает воду на открытом воздухе, поэтому самые высокие уровни газообразного метана обычно наблюдаются в закрытых помещениях, где используется большое количество воды, таких как душевые в ванных комнатах, посудомоечные машины и прачечные.
Как метан попадает в мою питьевую воду?
Метан может попасть в питьевую воду двумя способами. Метан может естественным образом производиться подповерхностными бактериями и разложением органического вещества. Метан также может просачиваться из глубоких подземных хранилищ или свалок. По мере продвижения метана вверх от источника к поверхности он может растворяться в грунтовых водах. Если эти подземные воды используются в качестве источника колодезной воды, то растворенный метан может попасть в ваш дом.
Если эти подземные воды используются в качестве источника колодезной воды, то растворенный метан может попасть в ваш дом.
Как метан может повлиять на мое здоровье?
Метан сам по себе не токсичен; однако выброс метана в помещении может снизить уровень кислорода и затруднить дыхание. Метан в подземных водах не взрывоопасен, но при контакте воды с растворенным метаном с воздухом метан выходит из воды. Если это происходит в помещении или в замкнутом пространстве и уровень метана в воздухе помещений достигает 5%, возникает опасность возгорания или взрыва. Хотя такие уровни редко возникают только из-за растворенного метана, риск реален. Рекомендуется проверять колодезную воду на наличие метана, если в воде наблюдаются сильные пузыри.
Как проверить воду из скважины на метан?
Для тестирования растворенного метана используется специальный метод сбора, при котором вода собирается в вакуумный мешок. Департамент общественного здравоохранения штата Иллинойс (IDPH) рекомендует использовать лабораторию, сертифицированную Агентством по охране окружающей среды штата Иллинойс.
Обязательно подтвердите, что лаборатория может провести анализ растворенного метана с использованием метода USEPA RSK-175. Обратитесь в местный отдел здравоохранения или в региональный офис IDPH для получения информации и помощи.
Приемлемый ли уровень метана в моей воде?
Стандарта питьевой воды для содержания метана в питьевой воде не существует. Министерство внутренних дел США установило предупредительный уровень 10 миллиграммов метана на литр (мг/л) воды. Уровни растворенного метана выше 28 мг/л могут привести к выделению потенциально воспламеняющихся количеств метана в замкнутом пространстве.
Как снизить уровень метана в воде?
Если в колодезной воде обнаруживается повышенный уровень метана, в соответствии с Кодексом строительства водяных колодцев штата Иллинойс требуется устье скважины. Метан легче воздуха, поэтому вентиляционное отверстие позволяет растворенному метану выбрасываться из скважины в атмосферу, не попадая в ваш дом. Если вы решите установить установку для очистки воды, предназначенную для удаления растворенного метана, правила водопроводно-канализационного хозяйства штата Иллинойс требуют, чтобы она была установлена лицензированным сантехником, соответствовала проектам, утвержденным IDPH до установки, и была изготовлена из утвержденных материалов. Фильтрация не является эффективным средством удаления метана. Системы удаления метана должны быть должным образом вентилированы для наружного воздуха независимо от канализации здания и вентиляционных отверстий. Эксплуатация любой утвержденной установки водоподготовки должна соответствовать рекомендациям и требованиям производителя.
Если вы решите установить установку для очистки воды, предназначенную для удаления растворенного метана, правила водопроводно-канализационного хозяйства штата Иллинойс требуют, чтобы она была установлена лицензированным сантехником, соответствовала проектам, утвержденным IDPH до установки, и была изготовлена из утвержденных материалов. Фильтрация не является эффективным средством удаления метана. Системы удаления метана должны быть должным образом вентилированы для наружного воздуха независимо от канализации здания и вентиляционных отверстий. Эксплуатация любой утвержденной установки водоподготовки должна соответствовать рекомендациям и требованиям производителя.
Вода и метан остаются вместе при экстремальных давлениях
Proc Natl Acad Sci U S A. 2019 Aug 13; 116 (33): 16164–16166.
Опубликовано в сети 1 августа 2019 г. doi: 10.1073/pnas.19113
Химия
Информация об авторе Информация об авторских правах и лицензии Отказ от ответственности (1, 2). Этот странный мир весьма драматично иллюстрирует, что изоэлектронный CH 9Молекулы 0010 4 и H 2 O демонстрируют совершенно разные физические свойства, включая разницу в температуре плавления на 182 ° C при атмосферном давлении. В отличие от метана, молекулы воды образуют прочные водородные связи с четырьмя соседями, что объясняет более высокую температуру плавления льда по сравнению с твердым метаном. Перестройки этих водородных связей, происходящие при изменении температуры и давления, приводят к возникновению большого семейства сложных сетчатых структур, выходящих за рамки «обычной» гексагональной формы льда, льда I 9.0068 ч (3). Однако структурное разнообразие H 2 O не исчерпывается чистыми фазами льда. Молекулы воды могут образовывать клетки вокруг гидрофобных частиц, таких как метан, с образованием клатратных гидратов (4, 5). Эти важные соединения включения были предложены в качестве модельных систем для изучения гидрофобных взаимодействий (4), и они также актуальны для широкого спектра промышленных, геологических, атмосферных и космологических условий (6, 7).
Этот странный мир весьма драматично иллюстрирует, что изоэлектронный CH 9Молекулы 0010 4 и H 2 O демонстрируют совершенно разные физические свойства, включая разницу в температуре плавления на 182 ° C при атмосферном давлении. В отличие от метана, молекулы воды образуют прочные водородные связи с четырьмя соседями, что объясняет более высокую температуру плавления льда по сравнению с твердым метаном. Перестройки этих водородных связей, происходящие при изменении температуры и давления, приводят к возникновению большого семейства сложных сетчатых структур, выходящих за рамки «обычной» гексагональной формы льда, льда I 9.0068 ч (3). Однако структурное разнообразие H 2 O не исчерпывается чистыми фазами льда. Молекулы воды могут образовывать клетки вокруг гидрофобных частиц, таких как метан, с образованием клатратных гидратов (4, 5). Эти важные соединения включения были предложены в качестве модельных систем для изучения гидрофобных взаимодействий (4), и они также актуальны для широкого спектра промышленных, геологических, атмосферных и космологических условий (6, 7). Гидрат клатрата метана (MH) является одним из наиболее тщательно изученных материалов в этом контексте с 3 различными структурными формами, идентифицированными до сих пор экспериментально при различных давлениях (5). Шаак и др. (8) теперь сообщают в PNAS о существовании четвертого гидрата метана (MH-IV), который образуется выше ~40 ГПа и остается стабильным по крайней мере до 150 ГПа. Интересно, что водная сеть MH-IV принимает очень знакомую форму — ледовую сеть I 9.0068 h , но плотно упакован молекулами метана в соотношении 2:1 H 2 O:CH 4 .
Гидрат клатрата метана (MH) является одним из наиболее тщательно изученных материалов в этом контексте с 3 различными структурными формами, идентифицированными до сих пор экспериментально при различных давлениях (5). Шаак и др. (8) теперь сообщают в PNAS о существовании четвертого гидрата метана (MH-IV), который образуется выше ~40 ГПа и остается стабильным по крайней мере до 150 ГПа. Интересно, что водная сеть MH-IV принимает очень знакомую форму — ледовую сеть I 9.0068 h , но плотно упакован молекулами метана в соотношении 2:1 H 2 O:CH 4 .
показывает современную последовательность фазовых переходов, наблюдаемых при сжатии смесей лед/метан, вместе с кристаллическими структурами различных МГ. Фаза низкого давления (MH-I) представляет собой хорошо известный клатратный гидрат кубической структуры I, который можно найти на морском дне Земли (6). Сжатие выше 0,9 ГПа приводит к образованию гексагонального клатратного гидрата MH-II (9) с его почти «барочной» кристаллической структурой, включающей большие бочкообразные клетки (10). Этот тип клетки, выделенный зеленым цветом на , является крупнейшим экспериментально идентифицированным в клатратных гидратах и может содержать несколько видов-гостей (4, 5, 9).
Этот тип клетки, выделенный зеленым цветом на , является крупнейшим экспериментально идентифицированным в клатратных гидратах и может содержать несколько видов-гостей (4, 5, 9).
Открыть в отдельном окне
Последовательность фазовых переходов гидратов метана (МГ) при сжатии при температуре окружающей среды. MH-IV образуется при давлении выше 40 ГПа и стабилен как минимум до 150 ГПа (8). Оранжевые линии указывают на сети воды, связанные водородными связями. Черные сферы нарисованы с использованием радиуса Ван-дер-Ваальса метана (2,08 Å) (20) и показывают центральные положения клеток в клатратных гидратах MH-I и MH-II, а также расположение молекул метана в MH-III и MH-II. MH-IV гидратирует. Различные клетки в MH-I и MH-II выделены разными цветами, включая 5 12 (оранжевый), 5 12 6 2 (синий), 5 12 6 8 (зеленый) и 4 3 5 0 6 8 3
При дальнейшем сжатии область клатратных гидратов заканчивается и встречается так называемая заполненная ледяная структура в виде MH-III (9). Следует подчеркнуть, что водная сеть МН-III не соответствует ни одной из известных фаз льда (3). Как видно на , MH-III содержит необычную комбинацию 4-, 6- и 8-членных колец молекул воды, связанных водородными связями, которые ограничивают гостевые молекулы метана. Интересным аспектом последовательности сжатия является то, что H 2 O:CH 4 молекулярное соотношение уменьшается с 5,75:1 для MH-I до 2:1 для MH-III, что означает, что чистые льды высокого давления образуются как побочные продукты по мере появления MH высокого давления (9 ).
Следует подчеркнуть, что водная сеть МН-III не соответствует ни одной из известных фаз льда (3). Как видно на , MH-III содержит необычную комбинацию 4-, 6- и 8-членных колец молекул воды, связанных водородными связями, которые ограничивают гостевые молекулы метана. Интересным аспектом последовательности сжатия является то, что H 2 O:CH 4 молекулярное соотношение уменьшается с 5,75:1 для MH-I до 2:1 для MH-III, что означает, что чистые льды высокого давления образуются как побочные продукты по мере появления MH высокого давления (9 ).
Сам MH-III претерпевает тонкие структурные изменения при увеличении давления: выше 30 ГПа водородные связи O–H···O становятся симметричными, процесс, который также наблюдался для чистого льда X (11). Однако на этом история не заканчивается. Стремясь к еще более высокому давлению, Schaack et al. (8) теперь сообщают, что еще одна ледяная структура, заполненная метаном, которую они называют MH-IV, существует выше 40 ГПа. В отличие от MH-III, водная сеть MH-IV проста, содержит только 6-членные кольца по строению, очень похожему на «обычный» лед I ч , как показано в .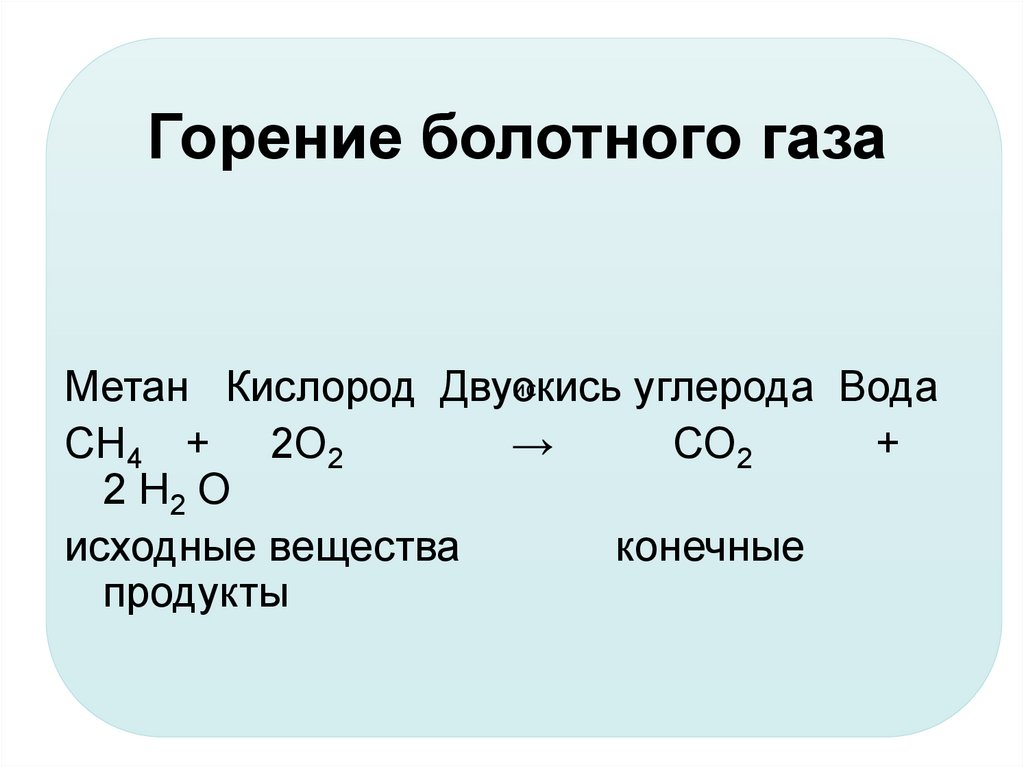 Очень интересно, что структура, стабильная только при очень низких давлениях в случае чистого льда, вновь появляется при экстремальных давлениях в присутствии метана.
Очень интересно, что структура, стабильная только при очень низких давлениях в случае чистого льда, вновь появляется при экстремальных давлениях в присутствии метана.
Доказательства этих открытий основаны на спектроскопии комбинационного рассеяния, проведенной в ячейке с алмазными наковальнями, и подтверждены высокоуровневыми вычислительными расчетами. Шаак и др. (8) также показывают, что предложенная ими структура MH-IV согласуется с ранее неразрешенными данными рентгеновской дифракции, представленными Tanaka et al. (12). Механизм фазового перехода MH-III в MH-IV довольно тонкий и требует реорганизации лишь нескольких водородных связей, что объясняет, почему H 2 O:CH 4 соотношение может оставаться постоянным на уровне 2:1 во время фазового перехода. Так же, как и для MH-III (11), Schaack et al. сообщают, что MH-IV в конечном итоге подвергается симметризации водородной связи при сжатии. В целом было обнаружено, что структура MH-IV стабильна как минимум до 150 ГПа, текущего предела их экспериментов (8).
MH-IV теперь устанавливает рекорд давления для существования газового гидрата. Это важно, поскольку изначально предполагалось, что MH разлагается на чистый лед и метан при давлении всего около 1 ГПа (13). Таким образом, замечательная стабильность давления MH-IV открывает прекрасную возможность для изучения взаимодействия между H 2 O и CH 4 в широком диапазоне давлений, и его существование, конечно, также очень важно для понимания планетарных процессов с участием воды и метана, например, внутри газовых гигантов, таких как Уран и Нептун (8).
Идентификация MH-IV теперь также поддерживает правило, что клатратно-гидратные структуры с клетками предпочтительнее при более низких давлениях, тогда как более плотные заполненные льдом структуры доминируют в области высокого давления (ср. ). При уменьшении размера гостевых видов этот структурный переход, по-видимому, смещается в сторону более низких давлений. Например, крошечный атом гелия входит в лед I ч и лед II при достаточно низких давлениях с образованием наполненных ледяных структур (14, 15). Все попытки получить гидрат клатрата гелия напрямую пока не увенчались успехом. Однако недавно было показано, что гидрат клатрата гелия может быть образован опосредованно, сначала высвобождая гидрат клатрата неона, чтобы получить лед XVI, а затем снова заполняя пустой гидрат клатрата гелием при низких температурах (15). Другими структурами заполненного льда являются хиральный гидрат водорода C 0 , который в пустой форме называется льдом XVII (16), и наполненный водородом кубический лед I в (17). Что теперь ясно, так это то, что все открытые фазы льда с низкой плотностью имеют соответствующие заполненные аналоги, если размер гостя и давление настроены соответствующим образом. В этом контексте стоит упомянуть, что полностью кубический лед I c , по-видимому, впервые был получен путем тщательного нагревания льда XVII (18).
Все попытки получить гидрат клатрата гелия напрямую пока не увенчались успехом. Однако недавно было показано, что гидрат клатрата гелия может быть образован опосредованно, сначала высвобождая гидрат клатрата неона, чтобы получить лед XVI, а затем снова заполняя пустой гидрат клатрата гелием при низких температурах (15). Другими структурами заполненного льда являются хиральный гидрат водорода C 0 , который в пустой форме называется льдом XVII (16), и наполненный водородом кубический лед I в (17). Что теперь ясно, так это то, что все открытые фазы льда с низкой плотностью имеют соответствующие заполненные аналоги, если размер гостя и давление настроены соответствующим образом. В этом контексте стоит упомянуть, что полностью кубический лед I c , по-видимому, впервые был получен путем тщательного нагревания льда XVII (18).
Возвращаясь к МГ, важно иметь в виду, что состав смеси H 2 O/CH 4 представляет 1 степень свободы на фазовой диаграмме. Таким образом, изоплетическая траектория, показанная на рис. , строго говоря, действительна только для состава исходного материала MH-I. Вполне возможно, что совершенно другой каскад фазовых переходов можно было бы наблюдать, если бы, например, содержание метана было увеличено в начале эксперимента по сжатию. В конечном счете, при приближении к чистому метану фазовые переходы при сжатии, конечно, должны быть связаны с фазовой диаграммой метана.
Таким образом, изоплетическая траектория, показанная на рис. , строго говоря, действительна только для состава исходного материала MH-I. Вполне возможно, что совершенно другой каскад фазовых переходов можно было бы наблюдать, если бы, например, содержание метана было увеличено в начале эксперимента по сжатию. В конечном счете, при приближении к чистому метану фазовые переходы при сжатии, конечно, должны быть связаны с фазовой диаграммой метана.
Остаются и другие вопросы. Что происходит с MH-IV за пределами 150 ГПа? Разлагается ли он в конечном счете на чистый лед и метан, или есть еще один, еще более плотный, гидрат, ожидающий своего обнаружения? Точно так же влияние температуры необходимо будет изучить в будущих исследованиях. Совсем недавно было высказано предположение, что чистый лед претерпевает фазовый переход в суперионную фазу, лед XVIII, при температуре выше 100 ГПа и 2000 К (19). В этой структуре атомы кислорода плотно упакованы, а атомы водорода свободно перемещаются между ними. В настоящее время мы можем только начать размышлять о том, какая экзотическая химия могла бы иметь место, если бы МН, включая МН-IV, подвергались таким экстремальным давлениям и температурам.
В настоящее время мы можем только начать размышлять о том, какая экзотическая химия могла бы иметь место, если бы МН, включая МН-IV, подвергались таким экстремальным давлениям и температурам.
Я благодарю Королевское общество (UF100144) и Европейский исследовательский совет в рамках исследовательской и инновационной программы Horizon 2020 Европейского Союза (соглашение о гранте 725271) за финансирование и А. Селла за полезные комментарии.
Автор заявляет об отсутствии конфликта интересов.
См. сопутствующую статью на стр. 16204.
1. Стофан Э. Р. и др. Озера Титана. Природа
445, 61–64 (2007). [PubMed] [Google Scholar]
2. Лопес Р. М. К. и др., Титан, обнаруженный радаром Кассини. Космические науки. преп.
215, 33 (2019). [Google Scholar]
3. Зальцманн К.Г. Успехи в экспериментальном исследовании фазовой диаграммы воды. Дж. Хим. физ.
150, 060901 (2019). [PubMed] [Google Scholar]
4. Рипмистер Дж. А., Рэтклифф С. И., Клуг Д. Д., Це Дж. С., Молекулярные перспективы структуры и динамики клатратных гидратов. Энн. Н. Я. акад. науч.
С., Молекулярные перспективы структуры и динамики клатратных гидратов. Энн. Н. Я. акад. науч.
715, 161–176 (2006). [Google Scholar]
5. Лавдей Дж. С., Нельмес Р. Дж., Газогидраты высокого давления. физ. хим. хим. физ.
10, 937–950 (2008). [PubMed] [Академия Google]
6. Сум А. К., Кох С. А., Слоан Э. Д. Клатратные гидраты: от лабораторных исследований к инженерной практике. Инд.Инж. хим. Рез.
48, 7457–7465 (2009). [Google Scholar]
7. Delsemme A.H., Swings P., Hydrates de gaz dans les noyaux cométaires et les grins interstellaires. Анналы астрофизики
15, 1–6 (1952). [Google Scholar]
8. Шаак С. и др. Наблюдение за наполненным метаном гексагональным льдом, устойчивым до 150 ГПа. проц. Натл. акад. науч. США.
116, 16204–16209(2019). [Бесплатная статья PMC] [PubMed] [Google Scholar]
9. Лавдей Дж. С. и др., Стабильный гидрат метана выше 2 ГПа и источник атмосферного метана Титана. Природа
410, 661–663 (2001). [PubMed] [Google Scholar]
10. Ripmeester J. A., Tse J. S., Ratcliffe C. I., Powell B. M., Новая структура гидрата клатрата. Природа
A., Tse J. S., Ratcliffe C. I., Powell B. M., Новая структура гидрата клатрата. Природа
325, 135–136 (1987). [Google Scholar]
11. Шаак С., Депондт П., Финокки Ф., Симметризация водородных связей в гидрате метана под высоким давлением. Дж. Физ. конф. сер.
1136, 012018 (2018). [Академия Google]
12. Танака Т. и др., Фазовые изменения заполненного льдом гидрата метана Ih при низкой температуре и высоком давлении. Дж. Хим. физ.
139, 104701 (2013). [PubMed] [Google Scholar]
13. Лунин Дж. И., Стивенсон Д. Дж. Термодинамика клатратного гидрата при низких и высоких давлениях применительно к внешней солнечной системе. Астрофиз. Дж. Доп. сер.
58, 493–531 (1985). [Google Scholar]
14. Лондоно Д., Кухс В. Ф., Финни Дж. Л., Инклатрация гелия во льду II: первый гидрат гелия. Природа
332, 141–142 (1988). [Google Scholar]
15. Kuhs W. F., Hansen T. C., Falenty A., Наполнение льдов гелием и образование гидрата клатрата гелия. Дж. Физ. хим. лат.
9, 3194–3198 (2018).