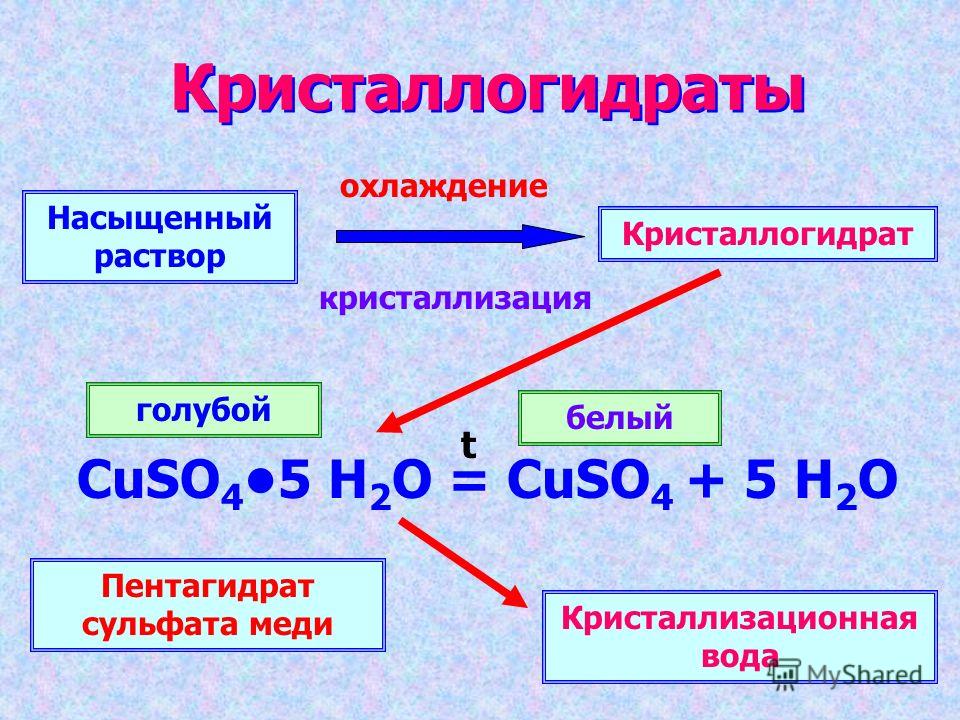
Содержание
Потеря — кристаллизационная вода — Большая Энциклопедия Нефти и Газа, статья, страница 2
Cтраница 2
В области температур 256 — 636 С наблюдается ряд эндоэффектов, связанных с потерей межрешеточной и кристаллизационной воды. Порошок, полученный в условиях плазмы, практически не содержит кристаллизационной влаги и дает незначительный эндоэффект.
[16]
Эндотермический эффект при 57 С связан с плавлением кристаллогидрата, а эффект при 256 С — с потерей кристаллизационной воды вследствие испарения. Это подтверждается тем, что оба эндотермических эффекта отсутствуют на термограмме безводного перхлората кальция. Это предположение подтверждается тем, что перхлорат кальция при 340 С остается твердым и не показывает еще никаких признаков плавления или разложения.
[17]
Кристаллы железо-аммонийных квасцов должны быть светло-фиолетового цвета, если же они обесцвечены, то это говорит о потере кристаллизационной воды.
[18]
Фазовые превращения гидратов мыл могут существенно отличаться от фазовых превращений безводных мыл и, в отдельных случаях, могут вызываться потерей кристаллизационной воды.
[19]
| Дериватограмма термического разложения Zn ( NO3 2 6Н2О. [ IMAGE ] Дериватограмма термического разложения Си ( NO3. 2 ЗН2О.
[20] |
Эрдей производства Венгерского оптического завода ( рис. 1, 2), показывают наличие нескольких эндотермических эффектов, связаннных с потерей кристаллизационной воды, образованием промежуточных и конечных продуктов. Первые эндотермические эффекты на обеих дериватограммах вызваны плавлением солей в кристаллизационной воде без изменения массы образцов.
[21]
| Термограмма препарата АФС, высушенного без нагревания. / — дифференциальная кривая нагревания. 2 — потери массы.
[22] |
Термограмма исходного препарата АФС ( рис. 8) имеет два эндотермических эффекта: первый — при 140 С, соответствующий потере кристаллизационной воды, и второй — при 240 С, соответствующий потере части конституционной воды. При наблюдении под микроскопом установлено, что при 140 — 150 С появляется новая фаза, которая при 170 С составляет основную массу продукта.
8) имеет два эндотермических эффекта: первый — при 140 С, соответствующий потере кристаллизационной воды, и второй — при 240 С, соответствующий потере части конституционной воды. При наблюдении под микроскопом установлено, что при 140 — 150 С появляется новая фаза, которая при 170 С составляет основную массу продукта.
[23]
При взаимодействии мочевины с дигмдратом дикаль-цийфосфата СаНРО4 — 2Н2О не получается комплекса, подобного CaSC4 4СО ( N1 2) 2 — Мочевина лишь ускоряет потерю кристаллизационной воды из дикальций-фосфата.
[24]
Кроме того, вопреки распространенному мнению, ткань из длинноволокнистого хризотилового асбеста при нагревании в течение продолжительного времени при 1093 ЭС, в результате которого происходит потеря кристаллизационной воды и изменение структуры ( превращение в кристаллический хризотил), сохраняет форму ( рис. 69) и относительно высокую долю полезной механической прочности.
[25]
При термическом разложении кристаллогидрата Na2SO3S — 5h3O в контролируемых условиях возможно образование сульфата натрия, сероводорода и воды, либо вначале ( до 100 С) происходит потеря кристаллизационной воды, а затем ( выше 220 С) превращение в сульфат натрия и пентасуль-фид ( 2 -) натрия, который неустойчив и при дальнейшем прокаливании разлагается до сульфида натрия и серы. Составьте уравнения всех параллельно идущих реакций, а также суммарное уравнение реакции термического разложения исходного кристаллогидрата. Предложите способы разделения и обнаружения всех продуктов.
Составьте уравнения всех параллельно идущих реакций, а также суммарное уравнение реакции термического разложения исходного кристаллогидрата. Предложите способы разделения и обнаружения всех продуктов.
[26]
Запасной стандартный раствор железа приготовляется из железокалиевых квасцов [ Fe2 ( SO4) 3 — K2SO4 — 24h3O ] или железо-аммонийных квасцов FeNh5 ( SO4) 2 — 12h3O ], которые должны быть светло-фиолетового цвета, но не бесцветные, так как последнее указывает на потерю кристаллизационной воды. Отвешивают точно 0 4505 г железокалиевых квасцов или 0 4317 железоаммо-нийных квасцов и растворяют в небольшом количестве дистиллированной воды в мерной колбе объемом в 500 мл. После растворения добавляют 3 мл концентрированного раствора НС1 и доводят объем до метки. Fe и является основным стандартным раствором.
[27]
Результаты термогравиметрического исследования оксиэти-лидендифосфонатов показывают, что все они являются кристаллогидратами. Потеря кристаллизационной воды для тетразамещенных комплексов начинается уже при 30 — 40 С. Одностадийное удаление воды характерно для кристаллогидратов дизамещенных оксиэтилидендифос-фонатов Mg и Са, причем для последнего характерна чрезвычайно высокая термическая устойчивость: его дегидратация начинается при 173 С.
Одностадийное удаление воды характерно для кристаллогидратов дизамещенных оксиэтилидендифос-фонатов Mg и Са, причем для последнего характерна чрезвычайно высокая термическая устойчивость: его дегидратация начинается при 173 С.
[28]
Результаты термогравиметрического исследования оксиэти-лидендифосфонатов показывают, что все они являются кристаллогидратами. Потеря кристаллизационной воды для тетразамещенных комплексов начинается уже при 30 — 40 С. Одностадийное удаление воды характерно для кристаллогидратов дизамещенных оксиэтилидендифос-фонатов Mg и Са, причем для последнего характерна чрезвычайно высокая термическая устойчивость: его дегидратация начинается при 173 С.
[29]
Помещают в сухую пробирку небольшое количество полученного продукта и осторожно нагревают. Происходит потеря кристаллизационной воды, сопровождающаяся изменением цвета.
[30]
Страницы:
1
2
3
4
Очистка солей, содержащих кристаллизационную воду — СУНЦ МГУ
♣ 1: Горелки
Горелка Теклю. В практикуме Вы будете использовать в основном горелки Теклю (рис. 1). В боковой отвод 1 через шланг 2 поступает газ из крана 3. Шланги зачастую бывают длинными. Если горелка долго не работает, они заполнены воздухом. Сначала откройте газовый кран, подождите 2-3 секунды (* зачем?), и поднесите спичку.
В практикуме Вы будете использовать в основном горелки Теклю (рис. 1). В боковой отвод 1 через шланг 2 поступает газ из крана 3. Шланги зачастую бывают длинными. Если горелка долго не работает, они заполнены воздухом. Сначала откройте газовый кран, подождите 2-3 секунды (* зачем?), и поднесите спичку.
Подачу газа кроме газового крана можно регулировать винтом 4. Подача воздуха происходит через щель между конусообразной трубкой 5 и диском 6 и регулируется вращением диска.
Рис. 1. Горелка Теклю
Пламя. Наибольшее количество тепла получается при полном сгорании газа, когда пламя почти не светится. При сокращенном доступе воздуха пламя становится светящимся и коптящим. * Почему?
Внутренний конус пламени 1 (рис. 2) содержит смесь воздуха и газа, горения в нем не происходит. В конусе 2 происходит горение при избытке газа и недостатке кислорода. Здесь находятся раскаленные продукты неполного сгорания газа; пламя этой зоны является восстановительным. * Почему? Во внешнем конусе 3 хорошие условия для притока воздуха, поэтому тут происходит полное сгорание продуктов, образовавшихся в конусе 2. Эта зона пламени является окислительной. * Почему?
* Почему? Во внешнем конусе 3 хорошие условия для притока воздуха, поэтому тут происходит полное сгорание продуктов, образовавшихся в конусе 2. Эта зона пламени является окислительной. * Почему?
* В какой зоне пламени надо вести нагрев пробирок или приборов?
Рис. 2. Строение пламени
Паяльная горелка. Паяльную горелку разрешается включать только в присутствии преподавателя!
Паяльная горелка (рис. 3) служит для получения высокотемпературного пламени. В ее нижней части имеются две трубки с кранами. По трубке 1 подводится воздух, по трубке 2 – газ.
Рис. 3. Паяльная горелка
Сначала открывают кран 2 газопровода. Спичку подносят к устью горелки сбоку (не наклоняясь!), газ вспыхивает широким коптящим пламенем (1). Уменьшают доступ газа. Затем плавным поворотом крана 1 воздуховода устанавливают нормальный ток воздуха (без отрыва пламени от сопла горелки). С помощью кранов 1 и 2 регулируют пламя до установления ровного голубоватого острого факела без признаков копоти (2).
С помощью кранов 1 и 2 регулируют пламя до установления ровного голубоватого острого факела без признаков копоти (2).
(1) (2)
Чтобы выключить горелку, сначала перекрывают кран воздуховода, затем газопровода.
♣ 2: Химическая посуда
* Вспомните, как выглядят и для чего применяются пробирки, стаканы, воронки, мерные цилиндры, круглодонные и плоскодонные колбы.
Слева направо на рисунке: стакан, воронка, мерный цилиндр, коническая колба.
Рис. 4. Стеклянная лабораторная посуда
Для получения газов применяют пробирки Вюрца 1 (малые количества) и колбы Вюрца 2 (большие количества) (рис. 4).
1 2
Эксикатор 3 служит для осушки гигроскопичных или неустойчивых на воздухе веществ. На дно ставится фарфоровая чашка с осушителем, а на фарфоровый поддон а – тигли и бюксы с веществами. Через кран б можно откачать воздух.
Через кран б можно откачать воздух.
3
U-образная трубка 4 предназначена для осушки газов (в нее помещают твердый осушитель) или для конденсации легколетучих веществ (тогда ее охлаждают).
4
Холодильники 5 и 6 нужны для конденсации жидкостей.
5
6
С помощью промывалок 7 очищают и осушают газы. Промывалки заполняют через воронки Мюнке 8.
7
8
Воронка с длинной трубкой 9 часто используется при приливании реагента в колбу для получения газа. Конец воронки должен доходить почти до дна колбы так, чтобы жидкость в колбе закрывала его, создавая водяной затвор.
9
Капельная воронка 10 предназначена для добавления жидких реагентов по каплям. Малые количества жидкостей прикапывают пипеткой.
10
Иногда для проведения реакций удобно использовать реторту 11. Отверстие а называется тубусом, б – горлом реторты.
Отверстие а называется тубусом, б – горлом реторты.
11
Рис. 5. Фарфоровая лабораторная посуда
Фарфоровая чашка 1 (рис. 5) служит в основном для выпаривания растворов. Растирать вещества в ней нельзя; для этого используют ступки 2, имеющие, в отличие от чашек, более толстое дно, плоское снаружи, и шершавую поверхность внутри. К ступкам прилагаются пестики 3.
1
2, 3
Для прокаливания используют тигли 4 и лодочки 6. Лодочки обычно помещают в кварцевую, фарфоровую или металлическую трубку, а тигель ставят на треугольник 5.
4
5 6
Шпатели для насыпания веществ бывают различной формы и изготавливаются из фарфора, стекла или металла.
♣ 3: Взвешивание
Вещества следует взвешивать не на бумажке, а в небольшом стаканчике, тигле или на часовом стекле (часовое стекло отличается от предметного тем, что первое выгнутое и тонкое, а второе плоское и толстое).
Обычно в практикуме используют одночашечные весы. Сначала на чашку весов кладут тару (стаканчик и т. п.). Если на весах есть кнопка «Т», нажмите ее, чтобы показания весов вернулись к нулю. Если же нет, запишите показания.
Не насыпайте вещество в тару, стоящую на весах! * Почему? Снимите тару, насыпьте шпателем вещество и поместите тару с веществом на весы. Если требуется отвесить 0,5 г вещества, нет необходимости добиваться, чтобы показания весов составляли 0,5000 г. Значение 0,45 г или 0,55 г вполне удовлетворительно. Но нужно обязательно записать точную массу навески – исходя из нее Вам предстоит рассчитывать выход.
♣ 4: Фильтрование
Раствор, прошедший через фильтр, в общем случае называют фильтратом. По отношению к осадку он является маточным раствором.
Фильтрование через обычную воронку. Воронку с бумажным фильтром помещают в кольцо штатива так, чтобы ее нижний конец соприкасался со стенкой стакана, в который фильтруют. * Зачем? Жидкость переносится на фильтр по стеклянной палочке (рис. 6). * Почему?
* Зачем? Жидкость переносится на фильтр по стеклянной палочке (рис. 6). * Почему?
Рис. 6. Фильтрование
Воронка для горячего фильтрования. При перекристаллизации обычно требуется фильтровать горячие растворы. Для этого используется специальная воронка с коротко обрезанной трубкой (* зачем ее обрезают?), помещенная в кожух с водяным обогревом (рис. 7). Кожух имеет двойные стенки, между которыми заливается вода через отверстие 1. Отросток 2 служит для нагревания воды, его нагревают горелкой перед фильтрованием.
Рис. 7. Воронка для горячего фильтрования
Воронка с короткой трубкой:
Не стоит забывать, что нижний конец воронки также должен соприкасаться со стенкой стакана! Вот что случается, если этого не обеспечить:
Фильтрование под уменьшенным давлением производят для более быстрого отделения осадка от жидкости (рис. 8). Фарфоровую воронку Бюхнера 1 вставляют при помощи резиновой пробки в толстостенную колбу Бунзена 2, подключенную к водоструйному насосу 3. * Для чего нужна пустая промывалка 4?
8). Фарфоровую воронку Бюхнера 1 вставляют при помощи резиновой пробки в толстостенную колбу Бунзена 2, подключенную к водоструйному насосу 3. * Для чего нужна пустая промывалка 4?
Воронка Бюхнера:
Рис. 8. Фильтрование под уменьшенным давлением
Не забудьте вымыть колбу Бунзена перед использованием и после! Размер воронки Бюхнера должен соответствовать количеству осадка.
Бумажный фильтр помещают на дно воронки, смачивают дистиллированной водой и плотно прижимают ко дну. Включают насос, закрывают зажим 5 (вместо зажима может использоваться стеклянный кран) и «присасывают» фильтр к воронке.
Затем зажим открывают. Раствор с осадком переносят по стеклянной палочке в воронку так, чтобы он покрывал всю поверхность фильтра (* зачем?), и закрывают зажим. Следите, чтобы при фильтровании в осадке не образовывалось трещин! Если они появятся, загладьте их стеклянной палочкой. * Зачем? При промывании осадка на фильтре наливайте столько жидкости, чтобы она закрыла всю поверхность фильтра. Жидкость наливают при открытом зажиме.
* Зачем? При промывании осадка на фильтре наливайте столько жидкости, чтобы она закрыла всю поверхность фильтра. Жидкость наливают при открытом зажиме.
Прежде чем выключить насос, откройте зажим. * Зачем?
Стеклянные фильтры (фильтры Шотта, воронки со стеклянным фильтрующим дном) устойчивы по отношению к кислотам, а также к щелочам на холоду (рис. 9). Их можно использовать для кристаллических осадков вместо воронки Бюхнера при фильтровании под уменьшенным давлением.
Рис. 9. Стеклянный фильтр
Бумажные фильтры. При фильтровании через обычную воронку применяют гладкий и складчатый фильтры. Гладкий фильтр готовят из квадратного кусочка фильтровальной бумаги. Его складывают пополам, еще раз пополам и обрезают внешние углы по дуге. Край фильтра должен быть ниже края воронки на 1-2 мм. * Почему? Необходимо, чтобы фильтр всей поверхностью плотно прилегал к воронке. Для этого смочите вставленный в воронку фильтр дистиллированной водой и прижмите.
Для этого смочите вставленный в воронку фильтр дистиллированной водой и прижмите.
Складчатый фильтр готовят из гладкого фильтра, разными способами продолжая складывание его гармошкой. Фильтрование через него происходит быстрее.
* Какой фильтр нужно применять при горячем фильтровании – гладкий или складчатый? Почему?
Фильтр для воронки Бюхнера (рис. 10) должен иметь такой же размер, как дно воронки, и два небольших «хвостика» на противоположных сторонах, предназначенные для извлечения фильтра из воронки.
Рис. 10. Фильтр для воронки Бюхнера
Декантация. Иногда удобнее не фильтровать осадок, а сливать жидкость с осадка. Этот прием называется декантацией. Осадку обязательно надо дать отстояться. Раствор следует выливать осторожно, по стеклянной палочке, не встряхивая.
Семинар по подготовке к перекристаллизации
Занятие 1. Перекристаллизация
Задания
1. В чем заключается сущность перекристаллизации?
В чем заключается сущность перекристаллизации?
2. Перечислите способы перекристаллизации. От чего зависит выбор способа?
3. Перечислите пути загрязнения осадка.
(Для ответа на вопросы 1 – 3 воспользуйтесь книгой Ю.М. Коренева «Общая и неорганическая химия. Часть IV. Растворы»).
4. Получите у преподавателя индивидуальное задание и рассчитайте, сколько технической соли (А г) надо взять для приготовления исходного раствора и сколько очищенной соли (В г) должно выделиться после перекристаллизации, а также выполните другие требуемые расчеты. (Даны содержание безводной соли в кристаллогидрате, растворимость при различных температурах, объем воды, добавляемый для растворения).
Пример расчета:
Пусть А г – масса навески CuSO4×dH2O (содержание безводной соли 63,9%), необходимая для приготовления насыщенного раствора CuSO4 при 80оС. Тогда 0,639А – масса безводного CuSO4, 0,361А – масса кристаллизационной воды.
Если мы растворяем соль в 50 мл воды, то, воспользовавшись данными о ее растворимости, получаем пропорцию:
В 100 г воды – растворяется 55,5 г CuSO4
В (50+0,361А) г воды – 0,639А г CuSO4
Решая пропорцию, находим: А = 63,1 г CuSO4×dH2O.
Масса воды в приготовленном растворе будет равна 50+0,361А = 72,8 г; масса растворенного CuSO4 составит 0,639А = 40,3 г.
Пусть при охлаждении до 20оС должно выпасть В г CuSO4×dH2O. Тогда в растворе остается 72,8-0,361В г воды и 40,3-0,639В г CuSO4.
Составим пропорцию:
В 100 г воды – растворяется 20,5 г CuSO4
В (72,8-0,361В) г воды – (40,3-0,639В) г CuSO4
Находим В = 45,0 г CuSO4×dH2O должно выпасть в осадок.
5. Составьте и проанализируйте графики температурной зависимости растворимости солей по данным, приведенным в конце пособия. Ответьте на вопросы:
— оптимально ли выбрана температура растворения Вашей соли?
— достаточна ли разница в растворимости Вашей соли при высоких и низких температурах для того, чтобы из раствора выделилось значительное количество соли?
— при каких температурах следует вести растворение и кристаллизацию соли, чтобы выход перекристаллизации был оптимален?
— есть ли возможность повысить выход перекристаллизации Вашей соли за счет образования менее растворимых форм – квасцов или шенитов? Если да, то рассчитайте массу сульфата калия или аммония, которую нужно добавить к Вашему раствору для образования квасцов или шенита. Рассчитайте объем воды, необходимый для растворения сульфата калия или аммония в горячей воде.
Рассчитайте объем воды, необходимый для растворения сульфата калия или аммония в горячей воде.
— как объяснить немонотонность температурной зависимости растворимости (если таковая наблюдается для Вашей соли)?
Обратите внимание, что растворимость дается в расчете на безводную соль, тогда как растворяемая и выделяемая из раствора формы – кристаллогидраты.
Пример графика:
Методика
1. Заполнить воронку для горячего фильтрования водой и начать нагревание.
2. Взвесить А г соли. Мерным цилиндром отмерить необходимое для растворения количество дистиллированной воды. Для веществ, растворы которых обладают высокой вязкостью (сульфаты хрома, алюминия), увеличить количество воды в 1,5 раза.
3. Налить воду в стакан, отметить уровень воды и поместить стакан на треножник (или на кольцо) с асбестовой сеткой.
4. Нагреть стакан пламенем горелки до указанной преподавателем температуры. В процессе нагревания добавлять соль мелкими порциями, помешивая стеклянной палочкой, до полного растворения. * Почему добавлять всю соль сразу не рекомендуется? Если уровень жидкости в стакане уменьшится (* почему это может случиться?), долить горячей дистиллированной воды.
* Почему добавлять всю соль сразу не рекомендуется? Если уровень жидкости в стакане уменьшится (* почему это может случиться?), долить горячей дистиллированной воды.
5. Горячий раствор отфильтровать на воронке для горячего фильтрования. * Зачем?
Внимание! Если носик воронки не касается стенок стакана, помимо разбрызгивания возможно застывание раствора в носике:
6. При получении двойных солей к прозрачному горячему фильтрату добавить горячий раствор сульфата калия или аммония и перемешать.
7. Фильтрат охладить в бане с холодной водой, перемешивая содержимое стакана стеклянной палочкой. * Зачем? Можно следить за динамикой роста кристаллов, периодически рассматривая их под микроскопом.
Кристаллы помещают под микроскоп на предметном стекле. Вот оно:
Если вы добавляли для растворения лишний объем воды или температурная зависимость растворимости вашего вещества пологая, перед кристаллизацией можно провести упаривание раствора (в 1. 5-2 раза). Это увеличит выход продукта. * За счет чего?
5-2 раза). Это увеличит выход продукта. * За счет чего?
Упаривание раствора сульфата кобальта на водяной бане:
Следует избегать охлаждения раствора в снегу или, если это необходимо, быстро проводить последующее фильтрование на охлажденном фильтре, промывая ледяной водой. Когда вы вынимаете раствор из снега, он начинает нагреваться, и выпавшие кристаллы, частично растворяясь, оплывают. Вместо кристаллов с четкими гранями (на фото слева) получаются «обсосанные леденцы» (справа):
8. Отфильтровать кристаллы на воронке Бюхнера (хорошо закристаллизованный осадок можно фильтровать на стеклянном фильтре), поместить в подписанную фарфоровую чашку и оставить сушиться на воздухе.
9. Определить массу перекристаллизованной соли С, рассчитать практический выход по формуле (С/В)×100%.
Фотографии кристаллов
CoSO4×7H2O и кобальтовый шенит Co(NH4)2(SO4)2×6Н2О
NiSO4×7H2O и никелевый шенит Ni(NH4)2(SO4)2×6Н2О
Медный купорос CuSO4×5H2O и медный шенит:
Алюмокалиевые квасцы KAl(SO4)2×12Н2О
Хромокалиевые квасцы KCr(SO4)2×12Н2О
Бура Na2B4O7×10Н2О
Занятие 2.
 Определение состава кристаллогидрата
Определение состава кристаллогидрата
Методика
Взвесить тигель. Положить в него 1-2 г растертой (* с помощью чего?) перекристаллизованной соли и взвесить вместе с веществом (записать точную массу навески!). На треножнике или кольце штатива установить фарфоровый треугольник и поставить на него тигель с веществом. Нагреть тигель пламенем горелки.
Через 2-3 минуты после начала нагревания отставить горелку и накрыть тигель сухим часовым стеклом. * Что при этом происходит? Убрать стекло и продолжить нагревание.
Вот это — часовое стекло:
Рекомендуется проводить прокаливание с датчиком температуры (термопарой). На основании характера кривой нагрева можно легко определить, когда заканчивается дегидратация, и даже (если повезет) заметить образование нескольких последовательных продуктов дегидратации.
Прокаливание с датчиком:
Когда соль обезводится, поставить тигель в эксикатор. Охлажденный до комнатной температуры тигель взвесить. Повторить прокаливание (5 мин), охлаждение и взвешивание несколько раз, доводя тигель с веществом до постоянной массы.
Повторить прокаливание (5 мин), охлаждение и взвешивание несколько раз, доводя тигель с веществом до постоянной массы.
Тигли в эксикаторе (фото Д.Андреевой):
Рассчитать количество кристаллизационной воды в исследуемой соли.
Задания
1. Для чего тигель после нагревания накрывают часовым стеклом?
2. Как установить, когда соль обезводится?
3. Почему тигель с веществом охлаждают в эксикаторе?
4. Как рассчитать количество кристаллизационной воды в соли по данным Вашего эксперимента?
Фотографии прокаленных солей
NiSO4
CuSO4
Результат неравномерного прокаливания медного купороса:
CoSO4
Результат неравномерного прокаливания сульфата кобальта:
Результат прокаливания кобальтового шенита:
Результат прокаливания хромокалиевых квасцов:
Кристаллизационная вода (альтерн. В классическом понимании «кристаллизационная вода» относится к воде, которая находится в кристаллическом каркасе металлического комплекса, но не связана напрямую с ионом металла. Очевидно, что «кристаллизационная вода» связана или взаимодействует с некоторыми другими атомами и ионами, иначе она не включалась бы в кристаллический каркас. По сравнению с неорганическими солями белки кристаллизуются с необычно большим количеством воды в кристаллической решетке. Содержание воды 50 % не редкость. Расширенная гидратная оболочка — это то, что позволяет кристаллографу белка утверждать, что конформация в кристалле не слишком далека от нативной конформации в растворе. Дополнительные рекомендуемые знания
Другие примеры Соль с попутной кристаллизационной водой известна как гидрат .
Со второй половины 20-го века структуры наиболее распространенных гидратов определялись с помощью кристаллографии, поэтому точечный формализм становится все более устаревшим. Другой причиной использования точечного формализма является простота. Для многих солей точное связывание воды не имеет значения, поскольку при растворении молекулы воды лабилизируются. Например, водный раствор, приготовленный из CuSO 4 •5H 2 O и безводный CuSO 4 ведут себя одинаково. Кристаллы вышеупомянутого гидратированного сульфата меди состоят из [Cu(H 2 O) 4 ] 2+ центров, связанных с ионами SO 4 2- . Медь окружена шестью атомами кислорода, образованными двумя разными сульфатными группами и четырьмя молекулами воды. Десикация
Некоторые безводные соединения так легко гидратируются, что о них говорят, что они гигроскопичны и используются в качестве осушителей или осушителей. АнализСодержание воды в большинстве соединений можно определить, зная их формулу. Неизвестный образец можно определить с помощью термогравиметрического анализа (ТГА), при котором образец сильно нагревается, а точный вес образца отображается в зависимости от температуры. Затем количество удаленной воды делится на молярную массу воды, чтобы получить количество молекул воды, связанных с солью. Серьезным осложнением термического анализа на присутствие воды гидратации является то, что соединения, содержащие водород и кислород, выделяют воду при нагревании, независимо от того, содержат ли они молекулы воды. Таким образом, выделение воды при нагреве, особенно до высоких температур, является недостаточным критерием наличия воды в образце до нагрева. Например, если нагревать карбоновую кислоту, RCO 2 H, получают H 2 O. В исходной карбоновой кислоте не было воды. Воды кристаллизации в неорганических галогенидахВ таблице ниже указано количество молекул воды на металл в различных солях. [1]
Прочие растворители кристаллизации Вода является особенно распространенным растворителем в кристаллах, потому что она мала и полярна. Но все растворители можно найти в некоторых кристаллах-хозяевах. Для других растворителей кристаллизации анализ удобно проводить путем растворения образца в дейтерированном растворителе и анализа образца на наличие сигналов растворителя с помощью ЯМР-спектроскопии. Рентгеновская кристаллография монокристалла также часто позволяет обнаружить присутствие этих растворителей кристаллизации. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Эта статья находится под лицензией GNU Free Documentation License. Он использует материал из статьи Википедии «Water_of_crystallization». Список авторов есть в Википедии. |
Урок Видео: Кристаллизационная вода
Видеозапись
На этом уроке мы научимся определять кристаллизационную воду и объяснять ее влияние на структуру и свойства кристаллов. Выращивание кристаллов химических соединений в лаборатории школы или колледжа может стать приятным развлечением. Этого легко добиться, приготовив раствор химической соли.
Соли часто получают нейтрализацией кислоты основанием. Образуется соль и вода. Если выбранная комбинация кислоты и основания представляет собой серную кислоту и оксид меди, то образующаяся соль представляет собой сульфат меди. Если раствор, содержащий растворенную соль, оставить в теплом месте, вода будет медленно испаряться. Через несколько дней от жидкости не остается и остается несколько сухих кристаллов однородной формы. Сухие кристаллы сульфата меди будут иметь синий цвет и правильную форму независимо от того, могут ли варьироваться их размеры.
Если выбранная комбинация кислоты и основания представляет собой серную кислоту и оксид меди, то образующаяся соль представляет собой сульфат меди. Если раствор, содержащий растворенную соль, оставить в теплом месте, вода будет медленно испаряться. Через несколько дней от жидкости не остается и остается несколько сухих кристаллов однородной формы. Сухие кристаллы сульфата меди будут иметь синий цвет и правильную форму независимо от того, могут ли варьироваться их размеры.
Действительно ли кристаллы сульфата меди сухие? Они не мокрые на ощупь, вокруг них нет следов жидкости. Однако если мы возьмем часть кристаллов, поместим их в большую сухую пробирку или кипящую пробирку и сильно нагреем, то можно будет сделать некоторые довольно интересные наблюдения. Голубые твердые кристаллы сульфата меди постепенно начинают приобретать белый цвет. Будет виден конденсирующийся пар, выходящий из пробирки. Водяной пар также конденсируется в верхней части пробирки, где он прохладный, и образует капли жидкой воды. После дальнейшего нагревания, чтобы удалить все следы этих конденсированных капель воды в пробирке, остается только белый порошок.
После дальнейшего нагревания, чтобы удалить все следы этих конденсированных капель воды в пробирке, остается только белый порошок.
Голубые кристаллы сульфата меди не расплавились и не разложились во время этого процесса нагревания, но, похоже, они изменили форму с синей на белую. Откуда взялась эта вода? По-видимому, в начале нагревания ни в кристаллах, ни в пробирке не было воды. Мы бы открыли то, что известно как вода кристаллизации или, реже, вода гидратации. Молекулы воды, выделившиеся из кристаллов при нагревании, представляют собой молекулы воды, являющиеся частью химической структуры соли. Они присутствуют внутри кристаллической решетки. Помните, что кристаллы или кристаллические твердые тела имеют составляющие атомы, молекулы или ионы, организованные в очень правильную микроскопическую структуру, называемую кристаллической решеткой.
Эта кристаллическая решетка содержит повторяющиеся формульные единицы, которые простираются во всех направлениях по всему кристаллу. Поскольку сульфат меди является ионным веществом, его кристаллическая решетка будет содержать положительно заряженные ионы меди и отрицательно заряженные сульфат-ионы. Голубые кристаллы сульфата меди, которые нагревали в эксперименте, были не просто влажными или влажными кристаллами. Они содержали молекулы воды, химически связанные в их кристаллическую решетку. Эти молекулы воды известны как кристаллизационная вода, и они включаются в кристаллы соли, поскольку они кристаллизуются из раствора, содержащего в основном воду.
Поскольку сульфат меди является ионным веществом, его кристаллическая решетка будет содержать положительно заряженные ионы меди и отрицательно заряженные сульфат-ионы. Голубые кристаллы сульфата меди, которые нагревали в эксперименте, были не просто влажными или влажными кристаллами. Они содержали молекулы воды, химически связанные в их кристаллическую решетку. Эти молекулы воды известны как кристаллизационная вода, и они включаются в кристаллы соли, поскольку они кристаллизуются из раствора, содержащего в основном воду.
Синяя версия кристаллов сульфата меди известна как гидратированная соль. Гидратированный просто означает, что кристаллы содержат кристаллизационную воду. Когда эти кристаллы нагревались, тепловой энергии было достаточно, чтобы вытеснить эти молекулы воды из их положений в кристаллической решетке. Некоторые химические связи между молекулами воды и ионами в кристаллической решетке были нарушены. Это оставило после себя белую версию сульфата меди. Эти кристаллы сульфата меди известны как безводные. Безводный означает без кристаллизационной воды. Помимо их цвета, можно определить, являются ли кристаллы гидратированными или безводными, внимательно изучив химическую формулу каждого соединения.
Безводный означает без кристаллизационной воды. Помимо их цвета, можно определить, являются ли кристаллы гидратированными или безводными, внимательно изучив химическую формулу каждого соединения.
Помните, что кристаллы гидратированного сульфата меди содержат кристаллизационную воду. Безводный сульфат меди не содержит кристаллизационной воды. Кристаллы гидратированного сульфата меди имеют формулу CuSO4.5h3O. Обратите внимание, что в этой формуле есть две очевидные части. Одной из них является ожидаемая формула сульфата меди, указывающая, что соединение содержит один атом меди, один атом серы и четыре атома кислорода. Поскольку это ионное соединение, медь присутствует в виде катионов меди с положительным зарядом. Атомы серы и кислорода химически связаны друг с другом в сульфат-анионы. CuSO4 — это простая единица или строительный блок, на котором построена кристаллическая структура сульфата меди. Тогда в формуле стоит точка. Это средняя точка или промежуточная точка, а не точка или точка, которые используются в конце предложения.
После точки ясно видно, что в формуле также присутствуют пять молекул воды. Таким образом, количество молекул воды, присутствующих в одной формульной единице сульфата меди, равно пяти. В безводной или белой версии медного купороса эта точка отсутствует. Формула безводного сульфата меди как раз и есть CuSO4. Поэтому, когда мы смотрим на формулу ионных солей, легко увидеть воду после точки. Это говорит нам о том, что мы имеем дело с гидратированной солью, где на самом деле присутствует кристаллизационная вода. Другим примером гидратированной соли, содержащей кристаллизационную воду, является сульфат железа (II), также известный как сульфат железа. Сульфат железа (II) содержит семь молекул воды на единицу сульфата железа (II).
В одном моле гидратированного сульфата железа(II) на каждые семь молей воды приходится один моль сульфата железа(II). Это стехиометрическое соотношение всегда будет наблюдаться во всей кристаллической решетке. Другим примером является карбонат натрия, который обычно называют стиральной содой. Декагидрат карбоната натрия, как известно, содержит 10 молей молекул воды на 1 моль карбоната натрия в своей кристаллической решетке. Более сложным примером является соль сульфата хрома-калия, также известная как хромовые квасцы. Гидратированная соль содержит ионы калия, ионы хрома, сульфат-ионы и кристаллизационную воду. На один моль сульфата хрома-калия приходится 12 моль кристаллизационной воды.
Декагидрат карбоната натрия, как известно, содержит 10 молей молекул воды на 1 моль карбоната натрия в своей кристаллической решетке. Более сложным примером является соль сульфата хрома-калия, также известная как хромовые квасцы. Гидратированная соль содержит ионы калия, ионы хрома, сульфат-ионы и кристаллизационную воду. На один моль сульфата хрома-калия приходится 12 моль кристаллизационной воды.
Гидратированная версия этой соли существует в виде довольно красивых темно-фиолетовых кубических кристаллов. Они могут быть выращены с высокой степенью успеха в лаборатории школы или колледжа. Это серовато-коричневый порошок без 12 молей кристаллизационной воды. Как ни странно, некоторые соли могут терять или приобретать кристаллизационную воду. Это может зависеть от того, как они хранятся, и от среды, в которой они хранятся. Если декагидрат карбоната натрия, гидратированная соль, хранится в сухом месте, он теряет кристаллизационную воду в атмосферу и становится моногидратом. Этот процесс известен как высолы и может привести к образованию солевых отложений на каменной и кирпичной кладке зданий.
Некоторые соли поглощают воду из атмосферы. Они известны как гигроскопичные соли. Обратите внимание на написание здесь, которое не содержит слова «гидро-», как в слове «гидроэлектроэнергия», основа слова, часто связанная с водой. Гидроксид натрия, широко известный как щелочь, является гигроскопичным веществом. При кристаллизации из воды образует моногидрат NaOH.h3O. Гидроксид натрия легко поглощает воду из воздуха и даже может образовывать раствор в этой поглощенной воде. Этот процесс известен как растекание. Можно определить, сколько кристаллизационной воды содержится в формуле соли, проведя эксперимент с некоторыми простыми измерениями массы. Массу навески гидратированной соли в тигле с крышкой определяли до начала процесса нагревания.
Нам также нужно заранее найти массу пустого тигля с крышкой. Мы вычли бы массу пустого тигля с крышкой из массы тигля, крышки и образца до начала процесса нагревания, чтобы найти массу образца. После этого процесса нагревания будет определена масса безводной соли, тигля и крышки. Нам нужно было бы убедиться, что вся кристаллизационная вода покинула образец. Мы могли бы повторить процесс и посмотреть, изменится ли масса. Повторение процессов нагрева и взвешивания до тех пор, пока не будет достигнута постоянная масса, называется нагревом до постоянной массы. Кажущаяся потеря массы эквивалентна массе кристаллизационной воды, удаленной из образца.
Нам нужно было бы убедиться, что вся кристаллизационная вода покинула образец. Мы могли бы повторить процесс и посмотреть, изменится ли масса. Повторение процессов нагрева и взвешивания до тех пор, пока не будет достигнута постоянная масса, называется нагревом до постоянной массы. Кажущаяся потеря массы эквивалентна массе кристаллизационной воды, удаленной из образца.
Это определяется простым вычитанием массы образца после нагревания из массы образца до нагревания. Нам нужно знать больше о точной формуле рассматриваемой соли, чтобы найти точное количество молей кристаллизационной воды, содержащейся в этой соли. Итак, давайте теперь рассмотрим вопрос, чтобы проверить наше понимание в количественном отношении. В этом вопросе были проведены измерения массы до и после нагревания гидратированной соли.
Учащийся пытается определить, сколько молекул воды содержится в гидрате CoSO4.𝑥h3O, где 𝑥 — целое число. Студент взвешивает образец соединения и нагревает его до тех пор, пока масса не станет постоянной. Используя приведенные ниже результаты эксперимента, определите значение 𝑥. Масса образца до нагревания, 4,9 г.7 грамм; масса образца после нагревания 2,74 грамма.
Используя приведенные ниже результаты эксперимента, определите значение 𝑥. Масса образца до нагревания, 4,9 г.7 грамм; масса образца после нагревания 2,74 грамма.
В этом вопросе мы начинаем с 4,97 г образца гидратированной соли. Образец гидратированной соли основан на сульфате кобальта. В нынешнем виде формула этого гидратированного сульфата кобальта предполагает, что он содержит один моль сульфата кобальта на каждые 𝑥 молей воды. Чтобы найти значение 𝑥 в этой формуле, нам нужно установить отношение молей сульфата кобальта к молям воды в единицах к 𝑥. В вопросе указано, что 𝑥 — целое число. Это означает, что он будет иметь целочисленное значение. Мы можем установить значение 𝑥, найдя количество молей сульфата кобальта в образце и количество молей воды в образце. Мы можем сделать это, используя массы, указанные в эксперименте.
Масса образца до нагревания включает массу сульфата кобальта плюс кристаллизационная вода. Масса образца после нагревания представляет собой безводный образец. В составе только сульфат кобальта. Таким образом, потеря массы, наблюдаемая в этом эксперименте, представляет собой кристаллизационную воду, содержащуюся в этом образце. Таким образом, масса воды, которую содержала эта гидратированная соль, составляет 4,97 грамма, вычесть 2,74 грамма, что равняется 2,23 граммам кристаллизационной воды. Молярная масса воды составляет 18 граммов на моль. Это определяется путем сложения атомных масс водорода и кислорода по формуле воды. Таким образом, количество молей воды, содержащихся в этом образце, равно 2,23 граммам воды, деленным на 18 граммов на моль. Таким образом, эта гидратированная соль содержит около 0,124 моля воды.
В составе только сульфат кобальта. Таким образом, потеря массы, наблюдаемая в этом эксперименте, представляет собой кристаллизационную воду, содержащуюся в этом образце. Таким образом, масса воды, которую содержала эта гидратированная соль, составляет 4,97 грамма, вычесть 2,74 грамма, что равняется 2,23 граммам кристаллизационной воды. Молярная масса воды составляет 18 граммов на моль. Это определяется путем сложения атомных масс водорода и кислорода по формуле воды. Таким образом, количество молей воды, содержащихся в этом образце, равно 2,23 граммам воды, деленным на 18 граммов на моль. Таким образом, эта гидратированная соль содержит около 0,124 моля воды.
Помните, что образец после нагревания содержит только сульфат кобальта. Таким образом, масса сульфата кобальта в гидратированной соли, то есть в гидрате, составляет 2,74 грамма. Молярная масса сульфата кобальта составляет 155 граммов на моль. Опять же, мы используем атомные массы для серы кобальта и кислорода и формулу для сульфата кобальта, чтобы выяснить это.

 Br.E. Кристаллизационная вода) – это вода, находящаяся в кристаллах, но не связанная ковалентно с молекулой или ионом-хозяином. Этот термин является архаичным и предшествует современной структурной неорганической химии, пришедшим из эпохи, когда взаимосвязь между стехиометрией и структурой была плохо изучена. Тем не менее, эта концепция широко распространена, и при точном применении этот термин может быть полезен. При кристаллизации из воды или влажных растворителей многие соединения включают молекулы воды в свои кристаллические каркасы. На самом деле часто интересующие виды не могут кристаллизоваться в отсутствие воды, даже если прочные связи с «гостевыми» молекулами воды могут не проявляться.
Br.E. Кристаллизационная вода) – это вода, находящаяся в кристаллах, но не связанная ковалентно с молекулой или ионом-хозяином. Этот термин является архаичным и предшествует современной структурной неорганической химии, пришедшим из эпохи, когда взаимосвязь между стехиометрией и структурой была плохо изучена. Тем не менее, эта концепция широко распространена, и при точном применении этот термин может быть полезен. При кристаллизации из воды или влажных растворителей многие соединения включают молекулы воды в свои кристаллические каркасы. На самом деле часто интересующие виды не могут кристаллизоваться в отсутствие воды, даже если прочные связи с «гостевыми» молекулами воды могут не проявляться. Рассмотрим случай гексагидрата хлорида никеля (II). Этот вид имеет формулу NiCl 2 (H 2 O) 6 . Изучение его молекулярной структуры показывает, что кристалл состоит из [ транс -NiCl 2 (H 2 O) 4 ] субъединицы, связанные водородной связью друг с другом и двумя изолированными молекулами H 2 O. Таким образом, 1/3 молекул воды в кристалле не связаны напрямую с Ni 2+ , и их можно назвать «кристаллизационной водой».
Рассмотрим случай гексагидрата хлорида никеля (II). Этот вид имеет формулу NiCl 2 (H 2 O) 6 . Изучение его молекулярной структуры показывает, что кристалл состоит из [ транс -NiCl 2 (H 2 O) 4 ] субъединицы, связанные водородной связью друг с другом и двумя изолированными молекулами H 2 O. Таким образом, 1/3 молекул воды в кристалле не связаны напрямую с Ni 2+ , и их можно назвать «кристаллизационной водой». Структура гидратов может быть весьма сложной из-за существования водородных связей, определяющих полимерные структуры. Исторически структура многих гидратов была неизвестна, и точка в формуле гидрата использовалась для указания состава без указания того, как вода связана. Примеры:
Структура гидратов может быть весьма сложной из-за существования водородных связей, определяющих полимерные структуры. Исторически структура многих гидратов была неизвестна, и точка в формуле гидрата использовалась для указания состава без указания того, как вода связана. Примеры: Поэтому знание степени гидратации важно только для определения эквивалентной массы: один моль CuSO 4 • 5H 2 O весит больше, чем один моль CuSO 4 . В некоторых случаях степень гидратации может иметь решающее значение для получаемых химических свойств. Например, безводный RhCl 3 не растворяется в воде и относительно бесполезен в металлоорганической химии, тогда как RhCl 3 •3H 2 O универсален. Точно так же гидратированный AlCl 3 является плохой кислотой Льюиса и, следовательно, неактивен в качестве катализатора реакций Фриделя-Крафтса. Поэтому образцы AlCl 3 должны быть защищены от атмосферной влаги, чтобы предотвратить образование гидратов.
Поэтому знание степени гидратации важно только для определения эквивалентной массы: один моль CuSO 4 • 5H 2 O весит больше, чем один моль CuSO 4 . В некоторых случаях степень гидратации может иметь решающее значение для получаемых химических свойств. Например, безводный RhCl 3 не растворяется в воде и относительно бесполезен в металлоорганической химии, тогда как RhCl 3 •3H 2 O универсален. Точно так же гидратированный AlCl 3 является плохой кислотой Льюиса и, следовательно, неактивен в качестве катализатора реакций Фриделя-Крафтса. Поэтому образцы AlCl 3 должны быть защищены от атмосферной влаги, чтобы предотвратить образование гидратов. Пятая вода находится в другом месте в каркасе, но не связывается напрямую с медью. Упомянутый выше йодид кобальта встречается в виде [Co(H 2 О) 6 ] 2+ и я — . В хлориде олова каждый центр Sn(II) имеет пирамидальную форму (средний угол O/Cl-Sn-O/Cl составляет 83°), связанный с двумя ионами хлора и одним ионом воды. Вторая вода в формульной единице связана водородной связью с хлоридом и координированной молекулой воды. Кристаллизационная вода стабилизируется электростатическим притяжением, поэтому гидраты характерны для солей, содержащих катионы +2 и +3, а также анионы -2. В некоторых случаях большая часть веса соединения может быть связана с водой. Глауберова соль, белое кристаллическое твердое вещество Na 2 SO 4 (H 2 O) 10 содержит >50% воды по весу.
Пятая вода находится в другом месте в каркасе, но не связывается напрямую с медью. Упомянутый выше йодид кобальта встречается в виде [Co(H 2 О) 6 ] 2+ и я — . В хлориде олова каждый центр Sn(II) имеет пирамидальную форму (средний угол O/Cl-Sn-O/Cl составляет 83°), связанный с двумя ионами хлора и одним ионом воды. Вторая вода в формульной единице связана водородной связью с хлоридом и координированной молекулой воды. Кристаллизационная вода стабилизируется электростатическим притяжением, поэтому гидраты характерны для солей, содержащих катионы +2 и +3, а также анионы -2. В некоторых случаях большая часть веса соединения может быть связана с водой. Глауберова соль, белое кристаллическое твердое вещество Na 2 SO 4 (H 2 O) 10 содержит >50% воды по весу. Обычные осушители включают CaCl 2 и Na 2 SO 4 .
Обычные осушители включают CaCl 2 и Na 2 SO 4 .




 с с с с с с с с с с с с с с с с с с с с с с .
с с с с с с с с с с с с с с с с с с с с с с . Вода заслуживает внимания, потому что она реакционноспособна, тогда как другие растворители, такие как бензол, считаются химически безвредными. Иногда в кристалле находится более одного растворителя, и часто стехиометрия варьируется, что отражается в кристаллографическом понятии «частичной занятости». Обычно химик «высушивает» образец с помощью комбинации вакуума и тепла «до постоянного веса».
Вода заслуживает внимания, потому что она реакционноспособна, тогда как другие растворители, такие как бензол, считаются химически безвредными. Иногда в кристалле находится более одного растворителя, и часто стехиометрия варьируется, что отражается в кристаллографическом понятии «частичной занятости». Обычно химик «высушивает» образец с помощью комбинации вакуума и тепла «до постоянного веса».